Method Article
Выделение, характеристика и выделение общей ДНК для идентификации эндофитных грибов в микогетеротрофных растениях
В этой статье
Erratum Notice
Резюме
Целью настоящей статьи является предоставление подробных и адекватных протоколов выделения растительно-ассоциированных эндофитных грибов, долговременной консервации изолятов, морфологической характеристики и экстракции общей ДНК для последующей молекулярной идентификации и метагеномного анализа.
Аннотация
Микогетеротрофные растения представляют собой одну из самых крайних форм микоризной зависимости, полностью утратив свою автотрофную способность. Так же важны, как и любой другой жизненно важный ресурс, грибы, с которыми эти растения тесно связаны, необходимы для них. Таким образом, некоторые из наиболее актуальных методов в изучении микогетеротрофных видов позволяют исследовать ассоциированные грибы, особенно те, которые обитают в корнях и подземных органах. В этом контексте обычно применяются методы идентификации культурально-зависимых и культурально-независимых эндофитных грибов. Изоляция эндофитов грибов обеспечивает средства для их морфологической идентификации, анализа их разнообразия и сохранения инокулатуры для применения в симбиотическом проращивании семян орхидей. Однако известно, что существует большое разнообразие некультивируемых грибов, населяющих ткани растений. Таким образом, методы молекулярной идентификации, не зависящие от культуры, обеспечивают более широкий охват видового разнообразия и численности. Целью данной статьи является методологическое сопровождение, необходимое для запуска двух процедур исследования: культурно-зависимой и независимой. Что касается культурально-зависимого протокола, то подробно описаны процессы сбора и хранения образцов растений от мест сбора до лабораторных помещений, а также выделение нитчатых грибов из подземных и надземных органов микогетеротрофных растений, ведение коллекции изолятов, морфологически охарактеризовать гифы методом культивирования на предметных стеклах и молекулярная идентификация грибов методом тотальной экстракции ДНК. Детальные процедуры, включающие в себя независимые от культуры методики, включают сбор образцов растений для метагеномного анализа и извлечение общей ДНК из органов ахлорофилловых растений с использованием коммерческого набора. Наконец, протоколы непрерывности (например, полимеразная цепная реакция [ПЦР], секвенирование) также предлагаются для анализа, и здесь представлены методы.
Введение
Эндофитные грибы – это, по определению, те, которые обитают внутри органов и тканей растений при незаметных инфекциях (т.е. не причиняя вреда своему хозяину)1,2. Эти грибы могут нейтрально или благотворно взаимодействовать с растениями-хозяевами, могут обеспечивать устойчивость к патогенам и неблагоприятным условиям окружающей среды, а также могут способствовать синтезу полезных для растения соединений (например, факторов роста и других фитогормонов)1,3. Микоризные эндофиты – это грибы, которые устанавливают микоризные ассоциации с растением, принимая участие в переносе питательных веществ4. У Orchidaceae взаимодействие с микоризными эндофитами имеет основополагающее значение для прорастания семян у подавляющего большинства видов и укоренения проростков у всех растений семейства5. В таких условиях микогетеротрофные орхидеи представляют собой случай полной зависимости от своих микоризных партнеров, поскольку они зависят от переноса минеральных питательных веществ и углеродных соединений этими грибами в течение всего своегожизненного цикла. Поэтому выделение и идентификация ассоциативных грибов является фундаментальной базой при исследовании микогетеротрофных жизненных стратегий. Более того, мало что известно о роли грибных эндофитов в микогетеротрофных растениях или даже о реальном разнообразии этих грибов 7,8.
Исследование эндофитных грибов может проводиться с помощью различных методов, традиционно описываемых как независимые от культуры или зависимые, например: (а) прямое наблюдение, (б) выделение грибов и морфологическая и/или молекулярная идентификация, и (в) полная экстракция ДНК растительных тканей и молекулярная идентификация9. При непосредственном наблюдении (а) эндофитные грибы могут быть исследованы еще в недрах растительных клеток и тканей с помощью световой или электронной микроскопии9, поскольку различные протоколы микроскопии подробно описаны Pena-Passos et al.10. С помощью методов выделения (b) эндофиты грибов могут быть охарактеризованы в соответствии с их колониями, гифами и морфологией репродуктивной структуры или структуры резистентности. Кроме того, с помощью методов выделения можно проводить молекулярную идентификацию изолятов путем экстракции ДНК, амплификации молекулярных идентификационных последовательностей (штрих-кодов или отпечатков пальцев) и секвенирования11. Последний метод (c) позволяет проводить молекулярную идентификацию эндофитных грибов с помощью экстракции ДНК во внутренней части растительных тканей (метабаркодирование) с последующей подготовкой библиотеки и секвенированием12.
Кроме того, грибные изоляты могут быть применены в симбиотических испытаниях проращивания с использованием семян автотрофных или микогетеротрофных орхидей. Примером такого применения является исследование, проведенное Sisti et al.13, описывающее прорастание и начальные стадии развития протокорма у микогетеротрофной орхидеи Pogoniopsis schenckii в ассоциации с некоторыми из ее изолятов, включающих немикоризные эндофитные грибы. Применяемый протокол проращивания симбиоза подробно описан и представлен в видео Pena-Passos et al.10. Выделение грибов в ассоциации с различными органами растений позволяет по-разному исследовать природу взаимодействия растений и грибов (например, понять экологические или физиологические аспекты ассоциации, а также исследовать перенос питательных веществ от грибов к растению)9.
Методики, представленные в разделе 1, основаны на сборе образцов подземных органов, поскольку эти органы представляют наибольшие трудности при сборе и представляют большой интерес, поскольку их колонизируют микоризные эндофиты. Тем не менее, оба включенных протокола (шаги 1.1 и 1.2) могут быть применены к другим микогетеротрофным органам растений (например, корневищам, цветочным стеблям и плодам). Методика сбора, описанная на шаге 1.1, предназначена для выделения эндофитных грибов (раздел 2) для морфологической характеристики (разделы 4 и 5) и/или выделения общей ДНК для идентификации изолятов (раздел 6). С другой стороны, методология сбора, описанная в шаге 1.2, предназначена исключительно для тотальной экстракции ДНК растительных тканей для методов метабаркодирования (раздел 7). В разделе 3 представлены четыре способа хранения и консервации нитчатых грибов: два для кратковременного хранения (3-6 месяцев) и два других для длительного хранения (>1 год). Морфологическая характеристика (разделы 4 и 5) может быть связана с молекулярной идентификацией для ее усиления и получения важной информации о макро- и микроморфологии грибов. На рисунке 1 обобщены коллективные методологии, описанные ниже.

Рисунок 1: Схематическое обобщение представленных методов. Сбор растений и выделение, консервация и молекулярная идентификация растений с помощью культурно-зависимых и независимых методологий. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
протокол
1. Отбор проб растений
- Отбор проб для методов, зависящих от языка и региональных параметров
- Осторожно выкопайте подземные органы; Это могут быть корни, стебли, корневища или органы хранения растения, подлежащего сбору. Помимо очень плотных почв, эти пробы собирают вручную.
ПРИМЕЧАНИЕ: Использование таких инструментов, как мастерки или совки, на этом этапе не рекомендуется, так как это может повредить хрупкие структуры микогетеротрофных растений и вызвать загрязнение тканей неэндофитными грибами. - Соберите как можно больше подземных органов. Храните образцы в бумажных пакетах внутри охлаждаемого контейнера (например, коробки из пенополистирола или термосумки со льдом). Если собираются и воздушные органы, транспортируйте их отдельно от подземных.
- Осторожно выкопайте подземные органы; Это могут быть корни, стебли, корневища или органы хранения растения, подлежащего сбору. Помимо очень плотных почв, эти пробы собирают вручную.
- Отбор образцов для методов, не зависящих от языка и региональных параметров
- Осторожно выкопайте корни растения, подлежащего сбору, в соответствии с теми же рекомендациями, указанными в ПРИМЕЧАНИИ к шагу 1.1.1.
- Соберите как можно больше подземных органов. Храните собранные образцы в криопробирках внутри жидкого азота (предпочтительный вариант) или используйте центрифужные пробирки, окруженные сухим льдом (альтернативный вариант). Поддерживайте воздушные органы отдельно, если они собраны.
2. Выделение эндофитных грибов, ассоциированных с органами растений14
ПРИМЕЧАНИЕ: Каждый материал, раствор и реагент, используемые в этом разделе, должны быть стерильными. Те, которые не могут быть куплены уже стерилизованными, должны быть автоклавированы при 121 °C в течение 20 минут.
- Поверхностное дезинсекция органов растений
- Промойте собранные образцы (шаг 1.1.2) в проточной воде и удалите как можно больше субстрата и другого мусора, который может быть в образцах.
- Внутри ламинарного колпака выдержите промытые образцы, погруженные в 70% этанол в течение 1 минуты (можно использовать стакан или стеклянную банку).
- Переложите образцы в другую емкость с гипохлоритом натрия с 2% активным хлором на 3 мин.
- Переложите образцы в контейнер с 70% этанолом и держите погруженным в воду в течение 1 минуты. После этого образцы последовательно промывают в двух емкостях с дистиллированной водой.
- Установка фрагментов растений в питательную среду
ПРИМЕЧАНИЕ: Каждый шаг, описанный в шаге 2.2, должен выполняться внутри ламинарного колпака.- Перед установкой подготовьте чашки Петри (8-10 см в диаметре) с питательной средой картофельного декстрозы (КПК) 19,5 г/л + 7 г/л бактериологического агара + 3 мл/л антибиотиков (например, стрептомицина, пенициллина, тетрациклина, ампициллина).
- Перед использованием выдержите чашки Петри с питательной средой при температуре 36 °C в течение 24 ч, чтобы убедиться в отсутствии загрязнения. Выбросьте посуду, зараженную колониями бактерий или грибков.
ПРИМЕЧАНИЕ: Добавление антибиотиков в среду имеет важное значение на этом этапе, так как органы сильно инфицированы бактериями, которые могут подавлять рост грибков. Проверьте, можно ли нагревать антибиотики во время автоклавирования; некоторые антибиотики необходимо добавлять после охлаждения среды примерно до 36 °C (перед тем, как поместить ее в посуду). - Сразу после поверхностной дезинсекции образцов и все еще внутри ламинарного колпака, в КПК, засейте несколько капель дистиллированной воды из последней емкости, используемой для промывки образцов. Этот этап важен для оценки эффективности поверхностной дезинсекции образцов.
- Поместите образцы в пустую автоклавную посуду и с помощью опламененного скальпеля и щипцов разрежьте образцы до толщины около 0,2 см.
- Разрез цилиндрических образцов продольно на две половины, при желании усиливают поверхность, контактирующую со средой. Чтобы лучше обнажить плоды и другие более шаровидные органы, тщательно измельчите или нарежьте структуры. Семена также могут быть важными источниками грибков, поэтому убедитесь, что разрезанные плоды подвергают их воздействию среды.
ПРИМЕЧАНИЕ: Только здоровые органы, без повреждений тканей или сигналов о возможных заболеваниях или патогенных инфекциях, должны использоваться для выделения эндофитов грибов. - Распределите пять фрагментов подземных органов в чашках Петри с КПК + антибиотик. Убедитесь, что фрагменты находятся как можно дальше друг от друга, а также не касаются краев блюда. Не массивируйте какие-либо фрагменты на носителе. Подготовьте копии каждого установленного органа в качестве меры предосторожности на случай загрязнения.
- Запечатайте чашки Петри пищевой пленкой и храните их в темноте при температуре 25-27 °C (лучше в инкубаторе) в течение 5 дней.
- Исчисление частоты изоляции (ПЧ)11
- Через 5 дней инкубации фрагментов органов рассчитайте IF, в соответствии с количеством инкубационных фрагментов, в которых растут колонии грибов, разделенным на общее количество инкубированных фрагментов, как представлено в следующем уравнении:

- Через 5 дней инкубации фрагментов органов рассчитайте IF, в соответствии с количеством инкубационных фрагментов, в которых растут колонии грибов, разделенным на общее количество инкубированных фрагментов, как представлено в следующем уравнении:
- Очистка грибковых изолятов путем бороздчатости и субкультивирования
ПРИМЕЧАНИЕ: Каждый шаг, описанный в шаге 2.4, должен выполняться внутри ламинарного колпака.- Приготовьте чашки Петри (5 см в диаметре) с 5-7 г/л агар-агара (АА; только бактериологический агар). Выдерживайте посуду в течение 24 часов при температуре 36 °C, чтобы исключить возможные загрязнения.
- Определите каждую выращенную грибковую колонию кодом и разграничите ее края на нижней стороне чашки (можно сделать перманентным маркером). Дифференциация колоний по цвету, характеру роста, текстуре и формату полей.
- С помощью автоклавной деревянной зубочистки, используя тонкий наконечник, восстановите небольшое количество мицелия из колонии грибов. Желательно сконцентрироваться на границах колонии и выбрать область как можно дальше от другой колонии, избегая одновременного восстановления более чем одного типа колонии.
- Используя ту же зубочистку с мицелием на кончике, расчешите АА, образуя три стрии (бороздки). Следите за тем, чтобы каждая полоска находилась на расстоянии 1 см от другой и краев посуды. Напишите соответствующий код (используя бумагу для стикеров и карандаш), запечатайте посуду и выдержите ее в инкубации в темноте при температуре 25-27 °C в течение 3 дней.
- Приготовьте чашки Петри (диаметром 8 см) с 39 г/л КПК. Добавлять антибиотики на этом этапе не нужно.
- После инкубации чашек с АА внимательно наблюдайте за ними на фоне света (от лампы или окна), стремясь выявить тонкие гифы, образующие отдельные колонии. Разграничьте площадь отдельной колонии в чашке, используя перманентный маркер на нижней стороне чашки Петри.
- В ламинарном вытяжном шкафу используйте автоклавную зубочистку, чтобы отрезать часть среды, содержащей колонию, и переместить срезанный объем в центр новой чашки с КПК.
- Определите чашки Петри с кодами изолятов, запечатайте чашки пищевой пленкой и выдержите в темноте при температуре 25-27 °C в течение 7-14 дней.
3. Консервация очищенных грибковых изолятов
ПРИМЕЧАНИЕ: Каждый материал, раствор и реагент, используемые в этом разделе, должны быть стерильными. Те, которые не могут быть куплены уже стерилизованными, должны быть автоклавированы при 121 °C в течение 20 минут.
- Консервирование по методу Кастеллани или в минеральном масле (3-6 месяцев)11,15
- Приготовьте пробирки для микроцентрифуг объемом 2 мл с 0,5 мл дистиллированной воды или содержащие 0,5 мл минерального масла (в зависимости от выбранного метода). Убедитесь, что пробирки автоклавированы пустыми, а автоклавная вода и масло добавляются в трубки внутри ламинарного колпака.
- В ламинарный колпак поместите чашки Петри с очищенными изолятами, уже выращенными в КПК (39 г/л) на 7-14 дней. Используя автоклавную зубочистку, вырежьте небольшие кубоиды (0,5 см х 0,5 см в верхней области) из среды, содержащей края мицелия.
- Поместите от четырех до шести кубоидов в пробирки микроцентрифуги с дистиллированной водой (метод Кастеллани) или минеральным маслом. Храните пробирки в темноте при температуре 25 °C столько, сколько необходимо, соблюдая временные ограничения метода.
ПРИМЕЧАНИЕ: Не добавляйте слишком много кубоидов в пробирки и не делайте их заполненными, так как это может увеличить вероятность загрязнения. Пробирки можно хранить в холодильнике, что может способствовать более длительному хранению некоторых изолятов. Currah et al.16 рекомендуют хранить реплики изолятов микоризных грибов из тропических орхидей как в холодильнике, так и при температуре 25 °C, так как они могут быть потеряны при хранении в холодильнике. - Восстановите кубоид и поместите его в центр новой чашки с КПК, чтобы вырастить хранимый изолят.
- Криоконсервация в неочищенных рисовых зернах (>1 год)17
- Неочищенные рисовые зерна промыть в проточной воде и варить до тех пор, пока рисовая шелуха не начнет открываться. Приготовленные зерна распределить по стеклянным пробиркам с завинчивающейся крышкой и автоклавировать дважды с интервалом 24 ч между ними.
- В ламинарный колпак поместите чашки Петри с очищенными изолятами, уже выращенными в КПК (39 г/л) на 7-14 дней. Используя автоклавную зубочистку, восстановите пять небольших фрагментов гиф с краев мицелия и поместите их в пробирку, содержащую автоклавные зерна риса.
ПРИМЕЧАНИЕ: Посев гиф в разных точках и на разной глубине трубки гарантирует, что изолят колонизирует неочищенные рисовые зерна за меньшее время. - Инкубируют пробирки в темноте при температуре 25-27 °C в течение 14 дней. Перемешивайте трубки, вихревая их каждые 3 дня, чтобы зерна оставались индивидуальными.
- Наблюдая за ростом грибков в рисовых зернах, распределите зерна в автоклавной чашке Петри, выстланной фильтровальной бумагой для впитывания влаги, поверх бумаги, чтобы зерна могли высохнуть. Хранить в темноте при температуре 25-27 °C в течение 2-3 дней.
- Подготовьте криопробирки с 1/3 силикагеля внизу и 1/3 стекловаты над кремнеземом. Наконец, распределите 1/3 рисовых зерен с выращенным грибным мицелием. Хранить при температуре -20 °C в течение 24 часов.
- Через 24 ч храните криопробирки при температуре -80 °C столько, сколько необходимо, соблюдая временные ограничения метода.
- Криоконсервация в вермикулите с использованием криопротектора (>1 год)18
- Готовят жидкую питательную среду, состоящую из 0,2% дрожжевого экстракта и 2% глюкозы в дистиллированной воде. Отрегулируйте pH до 5 и автоклавируйте его.
- Распределите 0,2 г вермикулита (используйте мелкую гранулометрию) в криопробирки с завинчивающейся крышкой и автоклавируйте их. В криопробирки, содержащие вермикулит, добавить 0,8 мл автоклавной жидкой среды.
- В ламинарный колпак поместите чашки Петри с очищенными изолятами, уже выращенными в КПК (39 г/л) на 7-14 дней. Используя автоклавную зубочистку, рекуперируют от трех до пяти фрагментов гиф с краев мицелия и высевают по пробирке, содержащую вермикулит + жидкая питательная среда. Не забудьте идентифицировать криопробирки с соответствующим кодом изолята.
ПРИМЕЧАНИЕ: Инокуляция гиф в разных точках и глубинах криопробирки гарантирует, что изолят колонизирует вермикулит за меньшее время. - Храните криопробирки в темноте при температуре 25-27 °C до тех пор, пока не будет наблюдаться колонизация большей части зерен вермикулита, что обычно занимает около 14 дней.
- Приготовьте раствор криопротектора, состоящий из 5% глицерина и 5% трегалозы, в дистиллированной воде и автоклавируйте его. Дайте раствору остыть перед использованием.
- После того, как вермикулит в криопробирках будет колонизирован соответствующим грибковым изолятом, распределите 0,4 мл криопротектора в каждой пробирке и храните криопробирки в холодильнике при температуре 4 °C в течение 48 часов. После этого поддерживайте криопробирки при температуре -80 °C столько, сколько необходимо, соблюдая временные ограничения метода.
4. Макроморфологическая характеристика нитчатых грибов (морфология колоний)
- Вести фотографический регистр мицелия, выращенного в каждой чашке Петри, с 39 г/л КПК в течение 7-14 дней. Не забудьте зарегистрировать обе стороны колонии, верхнюю и нижнюю (обратную). Если посуда будет легко использоваться в разделе 6 или за ней не ухаживать, откройте посуду при ее фотографировании, чтобы получить более качественные фотографии.
- Если вас интересуют количественные данные о морфологии колоний, субкультура реплицирует изоляты и поддерживает их в тех же условиях произрастания и в течение постоянного периода времени, чтобы зарегистрировать диаметр колонии и рассчитать скорость роста (обычно в мм/ч).
ПРИМЕЧАНИЕ: Более сложные количественные результаты могут быть достигнуты путем использования различных типов питательных сред для сравнения19 и рассмотрения статистических инструментов для обработки данных. - Понаблюдайте за колониями под стереомикроскопом, чтобы определить морфологические характеристики и сфотографировать в увеличении. Оцените колонии в соответствии с их макроморфологическими характеристиками, как подробно описано в разделе результатов. Обратитесь к различным библиографическим источникам, чтобы помочь классифицировать и связать макроморфологию с молекулярной и/или морфологической идентификацией.
5. Микроморфологическая характеристика нитчатых грибов (гифальная морфология)
ПРИМЕЧАНИЕ: Микроморфологические методы сравниваются в разделе обсуждения, учитывая их возможное использование и недостатки.
- Выращивайте изоляты на чашках Петри с 39 г/л КПК в течение 7-14 дней. Для оценки предполагаемых микоризных грибов орхидей выращивают изоляты на агаре кукурузной муки 17 г/л (КМА; или другой питательно-лимитирующей среде) в течение 3-7 дней19.
- Дразнящее крепление
- Работа внутри ламинарного колпака. Капните каплю выбранного пятна (шаг 5.5) на чистое предметное стекло.
- Используя автоклавную зубочистку или другой стерильный материал, аккуратно удалите несколько гиф из выращенного изолята и поместите их в каплю пятна. Поместите покровное стекло (желательно под начальным углом 45°, чтобы избежать пузырьков воздуха) и проанализируйте под световым микроскопом.
- Крепление на клейкую ленту
ПРИМЕЧАНИЕ: Этот метод обычно применяется в грибных культурах, которые легко используются в разделе 6 или не поддерживаются, так как клейкая лента не может быть автоклавирована, и после выполнения метода может произойти загрязнение.- Капните каплю выбранного пятна (шаг 5.5) на чистое предметное стекло. Отрежьте полоску прозрачной клейкой ленты по размеру, который подходит к предметному стеклу и центральному пятну хорошо капли.
- Направьте липкую поверхность полоски на поверхность мицелия. Не давите и постарайтесь собрать несколько гиф, не приклеивая их слишком много.
- Приклейте ленту к предметному стеклу, убедившись, что пятно находится в контакте с собранными гифами. Поместите каплю воды над лентой и положите покровный листок. Проанализируйте предметное стекло под световым микроскопом.
- Слайд-культура нитчатых грибов20
- Внутри большой чашки Петри (предпочтительно >9 см в диаметре) поместите: фильтровальную бумагу в нижней части, U-образный стеклянный стержень или приспособление (цель состоит в том, чтобы обеспечить возвышение предметного стекла), одно предметное стекло и два покровных стекла. Более высокие чашки Петри облегчают манипуляции. Автоклавируйте эти наборы чашек Петри, по одному на каждый изолят.
- Готовят небольшой объем 39 г/л КПК или 17 г/л КМА, добавляют 10 г/л бактериологического агара и автоклавируют (объема для одной чашки Петри хватает более чем на 30 изолятов). Питательная среда, используемая в культуре слайдов, должна быть более твердой, чем обычная среда. Автоклав 100 мл дистиллированной воды.
- Работа внутри ламинарного колпака. Поместите жидкую среду в чашку Петри, образуя слой высотой около 0,5 см. Дайте среде застыть. После затвердевания стерильным скальпелем вырежьте квадраты среды размером 1 см x 1 см.
- Откройте набор чашки Петри внутри колпака с ламинарным потоком и используйте пламенные щипцы, чтобы упорядочить материал, автоклавный внутри чашки. Расположите материал в пронумерованном порядке, как показано на рисунке 2A, поместив квадрат питательной среды на предметное стекло. Перед тем, как поместить покровный лист на носитель, перейдите к шагу 5.4.5.
- Используйте автоклавную зубочистку, чтобы извлечь гифы из изолята, и осторожно потрите четыре боковые грани среды, помещенной на предметное стекло. Поместите автоклавный покровный листок на средний квадрат с помощью пламенных щипцов.
- Используйте стерильный наконечник пипетки, чтобы поместить автоклавную воду в фильтровальную бумагу, чтобы создать влажную камеру. Используйте объем, чтобы пропитать бумагу, не добавляя лишнего количества воды. Запечатайте чашку Петри пищевой пленкой и определите ее соответствующим кодом изолята. Выдерживайте посуду в темноте при температуре 25-27 °C в течение 3-7 дней.
- Оцените рост гиф в предметном стекле и покровном стекле. Из каждого набора для культивирования слайдов изготавливаются два предметных стекла: один с использованием предметного стекла с гифами и автоклавным покровным стеклом, второй с использованием покровного стекла с гифами, а другой со стеклянным предметным стеклом.
- После наблюдения за ростом гифа осторожно отделите квадрат среды от предметного стекла (рис. 2Б), закрепите два предметных стекла с помощью выбранного красителя (шаг 5.5) и проанализируйте под световым микроскопом. Не забудьте идентифицировать изолированный код на слайде. Чтобы получить полуперманентные слайды, запечатайте покровное стекло прозрачным лаком для ногтей.
- Чтобы получить перманентные предметные стекла, тщательно смойте краситель с прилипших гиф после окрашивания и дайте предметному стеколу высохнуть. Монтаж с быстросъемным монтажным материалом (подробнее см. Pena-Passos et al.10).
ПРИМЕЧАНИЕ: Недостаток изготовления перманентного предметного стекла с помощью этой техники заключается в том, что споры и структуры, не прилипшие к стеклу, могут быть промыты.
- Методы окрашивания и наблюдение за гифами
- Лактофенол хлопковый синий (LPCB)21: добавьте 20 мл молочной кислоты, 40 мл глицерина и 20 мл дистиллированной воды. Растворите в этом растворе 20 г кристаллов фенола, слегка нагревая. Растворяют 0,05 г метилового синего (хлопкового синего, или 2 мл 1% водного раствора). LPCB также можно легко приобрести уже готовым.
ВНИМАНИЕ: Фенол очень токсичен и летуч; Манипулируйте им исключительно внутри вытяжного шкафа и надевайте перчатки. - Толуидиновый синий O10 (TBO): Приготовьте 0,05% TBO в 0,1 М фосфатном буфере (pH 6,8).
- Конголезское красное22,23,24: Приготовьте раствор 1% конголезского красного в дистиллированной воде и отфильтруйте его. Выдерживать 5-10 мин. Этот краситель также может быть применен для флуоресцентной микроскопии25.
- При наблюдении и фотографировании гиф грибов под световым микроскопом обращайтесь к различным библиографическим источникам, которые помогут идентифицировать структуры (см. обсуждение).
- Лактофенол хлопковый синий (LPCB)21: добавьте 20 мл молочной кислоты, 40 мл глицерина и 20 мл дистиллированной воды. Растворите в этом растворе 20 г кристаллов фенола, слегка нагревая. Растворяют 0,05 г метилового синего (хлопкового синего, или 2 мл 1% водного раствора). LPCB также можно легко приобрести уже готовым.

Рисунок 2: Процедуры культивирования предметных стекол нитчатых грибов . (A) Схематическая конфигурация набора для культивирования предметных стекол, где цифры обозначают порядок расположения элементов. (Б) В предметном стекле и покровном стекле наблюдается отслоение квадрата питательной среды после роста гифы. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
6. Выделение общей ДНК из грибных изолятов (самодельный протокол26 с модификациями 27)
ПРИМЕЧАНИЕ: Каждый материал, раствор и реагент, используемые в этом разделе, должны быть стерильными. Те, которые не могут быть куплены уже стерилизованными, должны быть автоклавированы при 121 °C в течение 20 минут. Надевайте перчатки в течение всего протокола и выполняйте некоторые этапы в вытяжном шкафу.
- Приготовьте буфер для экстракции: 1% додецилсульфат натрия (SDS), 250 мМ NaCl, 200 мМ Tris-HCl (pH 8,0) и 25 мМ этилендиаминтетрауксусной кислоты (ЭДТА). Выращивают очищенные изоляты в 39 г/л КПК в течение 7-14 дней.
- Аккуратно соскребают мицелий с изолята с помощью шпателя или ложки и переносят фрагменты в автоклавную ступку, избегая переноса питательной среды с агрегатом гиф. С помощью фарфорового пестика измельчите мицелий с жидким азотом до состояния мелкого порошка. Не позволяйте измельчаемому мицелию растаять, добавляя азот, чтобы избежать этого.
- Добавьте 1 мл экстракционного буфера в пробирку для микроцентрифуги объемом 2 мл и поместите измельченный образец до отметки 1,5 мл. Осторожно перемешайте содержимое пробирок для гомогенизации.
- Перемешайте пробирки в вихре в течение 5 с и поместите их в термоблок при температуре 65 °C на 20 минут. Тщательно гомогенизируйте содержимое путем инверсии каждые 7-10 минут.
- Центрифугируйте пробирки при 10 000 x g в течение 10 мин при 4 °C. Перелейте 800 мкл из верхней фазы в новую пробирку для микроцентрифуги объемом 2 мл, добавьте в пробирки 800 мкл фенола и перемешайте содержимое путем инверсии.
ВНИМАНИЕ: Фенол является высокотоксичным и летучим реагентом; Он может вызвать эритему, гангрену и некроз тканей. При вдыхании может вызвать одышку и кашель. Системная абсорбция может повредить печень, почки и центральную нервную систему. Манипулируйте фенолом исключительно в вытяжном шкафу и надевайте перчатки.
ПРИМЕЧАНИЕ: Начиная со следующего шага, используйте перчатки и проводите протокол в вытяжном шкафу. - Центрифужируют пробирки при 10 000 x g в течение 10 мин при 4 °C и переносят 800 мкл из верхней фазы в новую пробирку объемом 2 мл, осторожно избегая переноса содержимого нижней фазы.
- Добавьте в пробирки 400 мкл фенола и 400 мкл хлороформа и перемешайте содержимое методом инверсии. Центрифугируйте их при 10 000 x g в течение 10 минут при 4 °C.
ВНИМАНИЕ: Хлороформ является высокотоксичным и летучим реагентом; При контакте с кожей он может вызывать раздражение и травмы, а при вдыхании поражает центральную нервную и кардиореспираторную системы, печень и почки. Манипулируйте хлороформом исключительно в вытяжном шкафу и надевайте перчатки. - Рекуперация 800 мкл или менее из верхней фазы в новую пробирку объемом 2 мл. Добавьте 800 мкл хлороформа, перемешайте содержимое путем инверсии и центрифугируйте при 10 000 x g в течение 10 мин при 4 °C.
ПРИМЕЧАНИЕ: На этом этапе остатки нижней фазы не должны перекладываться в новые пробирки. Таким образом, будьте особенно осторожны при рекуперации верхней фазы. - Перенесите 600-800 мкл из верхней фазы в новую пробирку объемом 1,5 мл и добавьте 450 мкл изопропанола. Содержимое перемешивают инверсией и инкубируют при 25 °С в течение 5 мин.
- Центрифугируют пробирки при 10 000 x g в течение 5 мин при 4 °C и удаляют надосадочную жидкость с помощью микропипетки. Будьте осторожны, чтобы не выбросить гранулы, осевшие на дне тюбика.
- Добавьте 500 мкл 80% этанола и центрифугируйте в течение 5 минут. Повторите дважды, если гранула не осветлена.
- Удалите этанол с помощью микропипетки и высушите гранулу при температуре 37 °C в течение 30-60 минут. Добавьте 30-50 мкл деионизированной воды, элюируя гранулы с помощью микропипетки.
- Выдержите пробирки при температуре 4 °C в течение ночи для полного элюирования ДНК и заморозьте содержимое при -20 °C.
7. Выделение общей ДНК из органов растений для методики метабаркодирования (коммерческий набор)
ПРИМЕЧАНИЕ: Для следующей методики необходимо приобрести коммерческий набор, указанный в таблице материалов , как набор для экстракции почвенной ДНК. Каждый материал, раствор и реагент, используемые в этом разделе, должны быть стерильными. Те, которые не могут быть куплены уже стерилизованными, должны быть автоклавированы при 121 °C в течение 20 минут. Настоятельно рекомендуется носить перчатки в течение всего протокола, а шаги можно проводить внутри ламинарного колпака. Описанный протокол является модификацией De Souza et al.12 из протокола, подробно описанного производителем.
- Используя фарфоровые пестики и ступки, измельчите корни, собранные после шага 1.2, в жидком азоте, измельчив образцы до мелкого порошка. Добавьте 0,3 г измельченных образцов в пробирки PowerBead и осторожно перемешайте до гомогенизации.
- Добавьте 60 мкл раствора С1 (входит в комплект) в пробирки PowerBead и перемешайте содержимое методом инверсии. Используя тканевый гомогенизатор и лизер клеток (таблица материалов), прочно привяжите трубки к соответствующей опоре, соедините опору с вихрем и запустите оборудование на максимальной скорости в течение 10-20 минут.
ПРИМЕЧАНИЕ: Если раствор C1 выпадает в осадок, нагрейте его при 60 °C до полного растворения. - Центрифугируйте пробирки при 10 000 x g в течение 30 с при 25 °C. Переносят 500 мкл надосадочной жидкости в пробирки микроцентрифуги объемом 2 мл. Переносимое содержимое может быть твердыми частицами.
- Добавить в пробирки 250 мкл раствора С2 и перемешать в вихре в течение 5 с. Инкубируют при 4 °C в течение 5 минут, а затем центрифугируют при 10 000 x G в течение 1-2 минут при 25 °C.
- Перенесите более 600 мкл надосадочной жидкости в новые пробирки объемом 2 мл, избегая гранул. Добавляют 200 мкл раствора С3 и перемешивают на вихре в течение 5 с.
- Инкубируют при 4 °C в течение 5 мин, а затем центрифугируют при 10 000 x G в течение 1 мин при 25 °C. На этом этапе убедитесь, что надосадочная жидкость не содержит твердых частиц.
- Перенесите более 750 мкл надосадочной жидкости в новые пробирки объемом 2 мл, избегая гранул. Раствор С4 хорошо гомогенизируют, добавляют к надосадочной жидкости 1100 мкл раствора С4 и перемешивают в вихре в течение 5 с.
- Загрузите 675 мкл из содержимого пробирок в колонках MB Spin Columns, через фильтр и центрифугу при 10 000 x g в течение 1 мин при 25 °C. Выбросьте жидкое содержимое.
- Повторите предыдущий шаг дважды, пока не будет обработано все содержимое каждой пробирки. Затем добавьте 500 мкл раствора C5 в центр фильтра, находящегося в верхней колонне пробирки, и центрифугу при 10 000 x g в течение 30 с при 25 °C.
- Выбросьте жидкое содержимое и снова центрифугируйте в тех же условиях, что и на предыдущем этапе. Осторожно переложите верхнюю колонку колонки MB Spin Column в новые пробирки для микроцентрифуг объемом 2 мл, избегая попадания жидкости в колонку.
- Добавьте 85-100 мкл раствора С6 в центр фильтра и подождите 1 минуту. Центрифуга при 10 000 x g в течение 30 с при 25 °C и утилизируйте колонку MB Spin Column. Хранить пробирки при температуре -80 °C.
8. Количественное определение ДНК в спектрофотометре (см. Таблицу материалов)
- С помощью указанного спектрофотометра откройте программное обеспечение. Выберите опцию Нуклеиновая кислота, выберите опцию ДНК и установите концентрацию нг/мкл.
- Добавьте 1 мкл деионизированной воды в детектор спектрофотометра и выполните калибровку, выбрав опцию Пусто. После считывания аккуратно протрите датчик мягкой папиросной бумагой.
- Назовите полевой образец кодом изолята считываемой пробы и поместите 1 мкл его в детектор оборудования. Выберите опцию Измерить; Формируется график и таблица с результатами.
- Повторяйте шаг 8.3 до тех пор, пока не будут прочитаны все образцы. Таблицу со сформированными результатами рекомендуется сохранить для записи и анализа: выберите опцию Отчеты и место, куда будет сохранен .xml файл.
- Добавьте в детектор 5 мкл деионизированной воды, подождите несколько минут и аккуратно протрите мягкой папиросной бумагой.
Результаты
В протоколе изоляции, учитывая наличие загрязнения от воды, использованной при последней промывке, а также обнаружение загрязнения в чашках Петри с инокулированными фрагментами, могут быть предприняты различные действия в зависимости от типа загрязняющего вещества (Таблица 1). Эту процедуру необходимо повторить с самого начала в случае сильно спорулирующих грибковых загрязнителей, которые также демонстрируют ускоренный рост, и интенсивно размножающихся бактерий, устойчивых к выбранным антибиотикам. Вместо этого, если грибковый загрязнитель медленно растет или не спорулирует, можно просто избежать его изоляции на последующих этапах протокола. Наконец, контаминация штаммами бактерий, которые размножаются медленно, также может быть легко предотвращена на задних стадиях, особенно при очистке, при рекуперации гиф.
Во всех ранее представленных случаях идеальным сценарием является повторная процедура дезинсекции с использованием других образцов и установка фрагментов растений в питательную среду, сочетающую другие антибиотики с более широким спектром действия, в случаях заражения резистентных бактерий первой посуды. Однако, учитывая трудности, связанные со сбором новых образцов и получением органов из микогетеротрофных растений, некоторые случаи могут быть успешно решены на более поздних стадиях протокола, как показано в таблице 1.
| Загрязняющее вещество | Характеристика загрязняющих веществ | Возможные последствия загрязнения | Требуемое действие | |||
| Бактерии | Интенсивное умножение | Полное или частичное торможение роста интересующих эндофитов | Перезапуск изоляции с самого начала | |||
| Медленное умножение | Выделение бактерий вместе с интересующим эндофитом | Избегайте колоний бактерий во время очистки | ||||
| Грибов | Интенсивный рост и/или сильное спороношение | Делает невозможным выделение и/или очистку интересующих эндофитов | Перезапуск изоляции с самого начала | |||
| Медленный рост и/или отсутствие спороношения | Ошибочная изоляция загрязняющего вещества | Избегайте изоляции загрязняющего вещества | ||||
Таблица 1: Описание возможных контаминантов в процессе выделения эндофитных грибов, последствий контаминации и процедур смягчения.
Через 5 суток после установки фрагментов органов в среду ПИТ можно визуализировать рост небольших групп нитчатых грибов мицелия, выходящих из внутренней части фрагментов (рис. 3). Каждый мицелиальный морфотип должен привести к получению грибного изолята к концу протокола выделения, учитывая, что каждый из них должен быть исчерчен в новой чашке Петри со средой АА для очистки. Рекомендуется не выбрасывать оригинальную посуду из установки фрагментов до завершения всего протокола изоляции. Их можно хранить в холодильнике при температуре 4 °C до получения очищенных колоний. Кроме того, что касается этой части протокола, анализ IF может быть очень полезен для оценки процента образцов тканей, которые приводят к изолированным грибкам, среди общего количества установленных образцов.
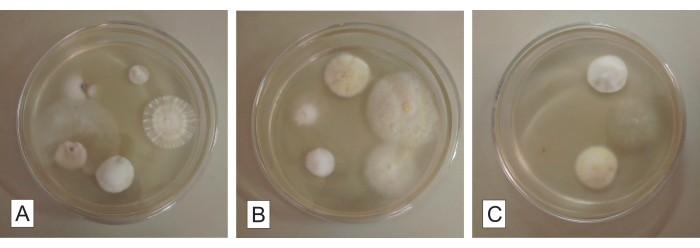
Рисунок 3: Фрагменты корней для выделения грибов в картофельном декстрозном агаре. Культивируемые эндофитные грибы, растущие из фрагментов корней микогетеротрофной орхидеи примерно через 5 дней инкубации. Каждая чашка Петри (А, В и С) содержит пять фрагментов корня. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Через 3 дня после инкубации чашек АК для очистки изолята из стрий в среде АА должны были вырасти крошечные гифальные колонии, почти незаметные. На этом этапе, в случае контаминации медленно растущими бактериями в изолирующих чашках, возможно, что эти бактерии также были перенесены в чашки АА с выбранными гифами эндофитов грибов. Если это так, бактерии будут ограничены областями растяжек, с небольшим ростом по сравнению с грибком, что позволит восстанавливать только грибок, представляющий интерес для новых блюд с КПК.
В течение 7-14 дней инокуляции очищенных грибковых изолятов в чашки КПК чистая колония должна расти центробежно (от центра чашки к ее периферии), образуя единственный круговой мицелий (рисунок 4). На этом этапе легко выявляются возможные загрязнения, так как они значительно нарушают однородность колонии в отношении ее роста, формы, внешнего вида, цвета, выработки пигмента в среде и т. д. (рис. 5). Предполагая, что конечные колонии не являются чистыми, грибы, первоначально выращенные из фрагментов органов, должны быть снова подвергнуты процедурам очистки, путем бороздирования и субкультивирования (шаг 2.4). Рекуперация изолятов возможна как из первоначально установленных органов, так и из конечных изолирующих чашек, содержащих гетерогенные культуры.
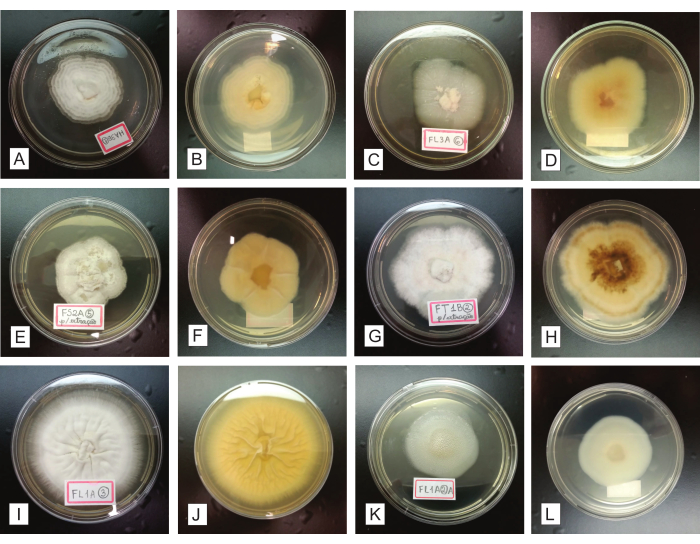
Рисунок 4: Представление очищенных грибковых изолятов, выращенных в течение 7-14 дней в питательной среде КПК. В первой и третьей колонках (A, C, E, G, I и K) с верхней стороны видны зарегистрированные колонии; вторая и четвертая колонки (B, D, F, H, J и L) представляют те же колонии, соответственно, видимые с нижней стороны. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 5: Представление нечистых грибковых изолятов, выращенных в течение 7-14 дней в питательной среде КПК. В первом столбце (A, D и G) виден общий вид колоний с верхней стороны; во втором столбце (B, E и F) подробно показаны колонии; в третьем столбце (C, F и I) показаны колонии с нижней стороны. Цифры представляют различные морфотипы грибов, присутствующие в каждой посуде, а линии представляют собой тонкое разграничение между различными грибковыми изолятами. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Консервирование изолятов не должно производиться с использованием одного единственного способа хранения, так как каждый грибок может представлять большую или меньшую чувствительность к каждому описанному способу. Крайне желательно выбирать для каждого грибкового изолята не менее двух видов хранения, гарантирующих больше шансов на успех в его сохранении. Подчеркнем, что нежизнеспособность грибов, сохранившихся в кастеллани или минеральном масле, ожидается через 6 месяцев или менее. Исследователям следует подумать о том, являются ли эти методы единственными выбранными методами сохранения, чтобы избежать возможных неожиданных потерь изолятов. Чтобы продлить этот ограниченный период, можно реактивировать грибковые изоляты, выращивая их в среде КПК (39 г/л) в течение 2-3 недель, а затем снова храня. Ожидается, что после определенного периода хранения изоляты будут демонстрировать более медленный рост по сравнению с наблюдаемой скоростью роста до его консервации, а также колонии с менее энергичными аспектами (т.е. менее плотными, отличающимися по цвету). Для восстановления этих характеристик достаточно несколько раз провести субкультурирование в питательной питательной среде.
При оценке макроморфологии колоний, полученных в процессе выделения, следует собирать качественные данные, учитывая как можно больше характеристик: (а) цвет колонии (верхняя и нижняя сторона), который может быть проанализирован с помощью печатных цветовых справочников (например, Rayner28, Kornerup & Wanscher29, Ridgway30); (b) непрозрачность колонии: прозрачная, непрозрачная, полупрозрачная; в) диффузные пигменты в среде31 (наличие/отсутствие и цвет); (d) экссудат31 (наличие/отсутствие, цвет, общий вид); (e) макроскопические структуры31 (наличие/отсутствие, тип и внешний вид; например, склероции, пикниды); (f) надземный и подводный мицелий 19,32,21 (наличие/отсутствие, внешний вид - скудный или обильный); g) внешний вид полей19 (цвет, форма, однородность – погруженные или воздушные); и (h) топография колонии (нагроможденная, морщинистая, кратеровидная, плоская и т.д.), общий вид и текстура - хлопчатобумажная, бархатистая, мучнистая, шерстистая, сальная (восковидная), голая, меловая, слизистая, кожистая, колючая и т.д.19,21.
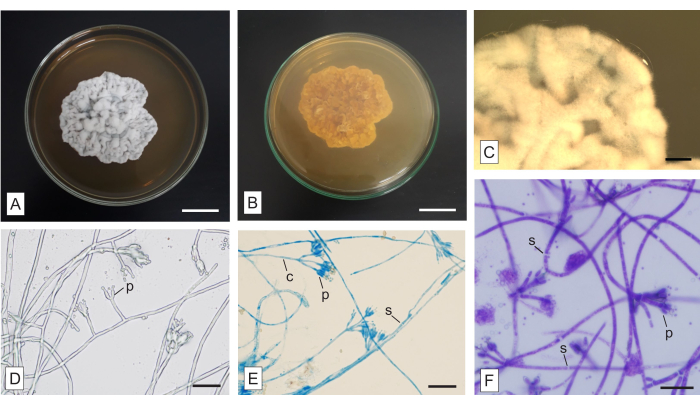
Рисунок 6: Макро- и микроморфология неидентифицированного гриба, выделенного из микогетеротрофной орхидеи Wullschlaegelia aphylla. (А) Верхние и (Б) нижние аспекты колонии, (В) усиленный вид воздушных гиф (как видно в стереомикроскоп). Микроморфология гиф (D) без окрашивания и окрашенных (E) LPCB и (F) TBO. Сокращения: c = конидиеносец, p = фиалид, s = перегородка. Масштабные линейки: A,B = 2 см; С = 2 мм; D-F = 20 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
На рисунке 6 показана колония, выделенная из веретенообразных корней микогетеротрофной орхидеи Wullschlaegelia aphylla, применяющая описанную методику. Колония от беловатой до серой на верхней стороне (Рисунок 6А) и коричневатая на нижней поверхности (Рисунок 6Б). Он непрозрачен, не содержит ни диффузных пигментов в среде, ни экссудата. Мицелий воздушный и обильный, края неровные и воздушные, колония имеет бархатистую текстуру и морщинистый рельеф (рис. 6А). Макроскопические структуры отсутствуют.
Метод культивирования предметных стекол является традиционным и выгодным, и, хотя он занимает много времени, может быть применен для получения постоянных предметных стекол, которые можно исследовать впоследствии. Различные красители, представленные здесь, могут быть использованы для выявления важных структур, и они требуют испытаний в образцах, чтобы определить наиболее адекватное время инкубации. Конголезский красный и TBO являются пятнами общего назначения. Конголезский красный цвет подходит для демонстрации некоторых тонких структур (дополнительная литература: Malloch22). TBO окрашивает клеточное содержимое более интенсивно, чем клеточную стенку гриба (рис. 6F). Несмотря на то, что ТБО является обычным красителем для растительных структур и не так часто встречается в микроскопии грибов, он обладает важным метахроматическим свойством33, которое благоприятствует другим приложениям, таким как анализ грибов в тканях растений10. LPCB является широко применяемым красителем в анализе грибов, хотя и требует осторожности из-за фенола. Хлопковый синий (синоним: метиловый синий) является красителем, молочная кислота - очистительным агентом, а фенол - убивающим агентом21. LPCB имеет сродство к хитину и обнаруживает споровые стены и украшения23,24. Грибковые перегородки не окрашиваются ни LPCB (рис. 6E), ни TBO (рис. 6F), что облегчает идентификацию таких структур. Применение красителей выгодно для выявления структур, которые трудно увидеть, когда гифы не окрашены (рис. 6D).
При выделении ДНК из образцов грибов и корней необходимо соблюдать количество измельченного образца в жидком азоте, добавляемого в буфер экстракции, не превышающее указанное в протоколе количество. Следует отметить, что большое количество обработанного образца не означает просто наличие высокой концентрации ДНК без существенных недостатков, так как может значительно ухудшить конечное качество ДНК. Это происходит при насыщении следующих этапов очистки ДНК. Кроме того, концентрирование предполагаемых соединений, продуцируемых растениями или грибами (например, пигменты, вторичные метаболиты), присутствующих в конечном растворе с ДНК, может снижать качество ДНК и/или ингибировать полимеразную цепную реакцию (ПЦР). Еще одна проблема, которая может значительно снизить качество ДНК, — это полное удаление питательной среды с грибным мицелием и его измельчение, чего следует категорически избегать. Некоторые реагенты, полученные в процессе экстракции (например, фенол, этиловый спирт, паспорт безопасности) и другие вещества (например, грибковые пигменты) могут быть ингибиторами, препятствующими проведению ПЦР.
На этапах очистки ДНК при использовании фенола и хлороформа надосадочная жидкость всегда должна представлять фазу с меньшим количеством примесей, обычно охватывающую наиболее чистую фазу. Во время такой стадии нижняя фаза не должна восстанавливаться при аспирации надосадочной жидкости, которая будет перенесена в новые пробирки. К концу протокола гранула (состоящая из ДНК) должна иметь полупрозрачный (крайне желательный) или беловатый цвет. На этапе сушки сушка ДНК в термоблоке имеет основополагающее значение для полного испарения этанола. Через 12 ч при 4 °C гранула должна полностью элюироваться в водном растворе, добавленном в пробирки, и после этого ее не должно быть видно. В случае, если элюирование не завершено, а концентрация ДНК значительно ниже идеальной концентрации, можно хранить раствор в холодильнике еще 12 ч, без существенных потерь в его качестве.
Анализы ДНК в программном обеспечении генерируют таблицу, представленную в таблице 2, где указаны данные, относящиеся к количеству и качеству ДНК. Количественная оценка ДНК определяется концентрацией нуклеиновых кислот в нанограммах на микролитр образца. Учитывая молекулярную идентификацию изолированных грибов, образцы ДНК должны иметь концентрацию около 200 нг/мкл, что идеально подходит для этапов ПЦР. В случае образцов с более высокими концентрациями нуклеиновых кислот аликвоту из пробы следует разбавлять, приближая концентрацию к ранее указанному значению. Образцы с чрезмерно высокими концентрациями, такие как образцы 1 и 2 в таблице 2, могут указывать на ложное обнаружение из-за загрязняющих веществ в растворе. Между тем, образцы с более низкими концентрациями нуклеиновых кислот, такие как No 7 (табл. 2), все еще могут быть использованы для ПЦР, что важно для применения большего объема образца в реакциях. Что касается параметров качества, то удовлетворительно то, что коэффициенты 260/280 и 260/230 находятся в диапазоне от 1,8 до 2,2, как указано в образцах 3, 5 и 8 (табл. 2). Образцы, которые имеют такие значения (намного ниже или выше), должны быть подвергнуты новому извлечению ДНК, как указано в образцах 9 и 10 из таблицы 2. В случае образцов с достаточным количеством ДНК и минимально превышающим идеальный диапазон качества, о чем свидетельствуют значения 260/280 и 260/230 в номерах 4 и 6 (таблица 2), разбавление является наиболее выгодной процедурой, позволяющей сделать концентрацию нуклеиновой кислоты адекватной для ПЦР и разбавить возможные ингибиторы, такие как рудиментарные реагенты из процедуры экстракции. в образцах.
| Образец | Нуклеиновая кислота Conc. | Единица | А260 | А280 | 260/280 | 260/230 | Тип образца |
| 1 | 14491.7 | нг/мкл | 289.833 | 141.175 | 2.05 | 1.8 | ДНК |
| 2 | 13359.3 | нг/мкл | 267.187 | 124.607 | 2.14 | 2.15 | ДНК |
| 3 | 1137.6 | нг/мкл | 22.751 | 10.574 | 2.15 | 2.13 | ДНК |
| 4 | 1472.6 | нг/мкл | 29.452 | 13.287 | 2.22 | 2.16 | ДНК |
| 5 | 3464.8 | нг/мкл | 69.295 | 33.329 | 2.08 | 1.88 | ДНК |
| 6 | 1884.2 | нг/мкл | 37.684 | 17.912 | 2.1 | 1.78 | ДНК |
| 7 | 187.6 | нг/мкл | 3.751 | 1.834 | 2.05 | 2.06 | ДНК |
| 8 | 1580.3 | нг/мкл | 31.607 | 15.281 | 2.07 | 1.98 | ДНК |
| 9 | 923.3 | нг/мкл | 18.466 | 9.196 | 2.01 | 1.37 | ДНК |
| 10 | 2414.4 | нг/мкл | 48.287 | 21.008 | 2.3 | 3.45 | ДНК |
Таблица 2: Результаты, полученные в программном обеспечении из образцов ДНК грибов, проанализированных в спектрофотометре.
В отличие от образцов ДНК изолированных эндофитных грибов, концентрация ДНК в образцах для анализа метабаркодирования должна представлять собой огромное количество извлеченных молекул ДНК с высоким качеством и молекулярной массой. Образцы должны быть оценены методом электрофореза в агарозном геле с получением максимально возможной целостности, с небольшим размазыванием в геле или без него.
Обсуждение
Поверхностная дезинсекция образцов растений является одним из наиболее ответственных этапов в представленном протоколе. Крайне желательно отсутствие загрязнений в посуде КПК каплями от последней стирки. Бактерии часто наблюдаются в качестве загрязняющих веществ в изоляционных чашках, обычно в большей степени, чем переносимые по воздуху спорулирующие грибы, учитывая, что эндофитные бактерии также распространены в тканях растений 3,11. Таким образом, добавление антибиотиков в питательную среду при установке фрагментов органов имеет существенное значение. Лучшие результаты достигаются при сочетании различных типов антибиотиков, что приводит к более широкому спектру действия. Еще одним важным соображением является внутренняя предвзятость в изоляции грибов, так как использование КПК и АА неизбежно приведет к отбору определенных видов и неблагоприятствованию других. Комбинация других питательных сред может свести к минимуму систематическую ошибку, хотя и не устранить такие ограничения9.
Как правило, грибы, которые продуцируют споры при выращивании в чашках Петри, демонстрируют более высокие показатели выживаемости в протоколах консервации, либо при более низких температурах, либо нет, а неспорулирующие изоляты могут не переносить консервацию Кастеллани или минеральное масло34,35,36, поэтому метод криоконсервации может иметь решающее значение в таких случаях. Кроме того, некоторые изоляты могут быть чувствительны к замораживанию, а добавление криопротекторов способствует консервации, как в представленном способе с использованием вермикулита18. Характеристики колонии и гифы могут быть полезны для группировки изолятов со сходными признаками, облегчая отбор для использования в симбиотических методах проращивания (как подробно описано Pena-Passos et al.10). Эти характеристики также влияют на выбор применяемых методов консервации, особенно с учетом спороношения или его отсутствия.
Морфологическая характеристика изолятов также улучшает и дополняет морфологические описания, имеющиеся в специализированной литературе, особенно когда они связаны с молекулярной характеристикой. Несмотря на то, что с большим количеством изолятов существует сложная задача, морфологически охарактеризовать грибы занимает много времени и зависит от опубликованных данных. Даже если планируется провести только молекулярную характеристику, рекомендуется вести фотографический регистр внешнего вида колонии (макроморфологию) и публиковать его, когда это возможно, чтобы внести свой вклад в будущие процедуры идентификации. Также важно сохранить фотографии посуды, в которой установлены фрагменты, чтобы можно было сравнить полученные окончательные изоляты с морфотипами, наблюдаемыми при росте в посуде. В этом случае сравниваемые грибы должны быть культивированы в среде одного типа. В работе Currah et al.16 были найдены дополнительные методики для оценки микоризных грибов орхидей, такие как культивирование на дубильной кислотной среде (TAM) для дифференциации родов Epulorhiza (телеоморф: Tulasnella) и Ceratorhiza (телеоморф: Ceratobasidium), а также культивирование на CMA для стимуляции монилиоидных клеток для характеристики грибов из комплекса Rhizoctonia .
Учитывая детальные методы наблюдения за гифами грибов под световым микроскопом, монтаж дразнилки и клейкой ленты происходит быстрее, чем культивирование предметных стеблей, хотя метод дразнящего крепления не подходит для анализа спор и измерения углов ветвления. Крепление клейкой лентой сохраняет организацию мицелия лучше, чем техника дразнящего крепления, хотя использование клейкой ленты не так надежно, как культивирование слайдов для измерения углов ветвей (наблюдение авторов). Культура слайдов, несмотря на то, что она занимает много времени, является наиболее подходящим методом для изготовления полуперманентных и постоянных слайдов. Макро- и микроморфология проанализированы с учетом литературы. Webster and Weber32 представляет собой обширный общий источник информации и дополнительных ссылок. Currah et al.16 и Zettler and Corey37 предоставляют полезную информацию о микоризных грибах орхидей. Несмотря на то, что Walsh et al.21 и McGinnis31 описывают грибы, имеющие медицинское значение, они также полезны в отношении общих характеристик колоний нитчатых грибов, визуальной/описательной информации и дополнительных ссылок по микроморфологии грибов.
По данным Yu et al.38, количественный анализ ДНК в спектрофотометре обеспечивает высокую точность и достоверность, согласуясь с количественным ПЦР-анализом в реальном времени. Важным наблюдением является то, что некоторые изоляты могут не предоставлять образцы ДНК достаточно чистой для последующих этапов молекулярной идентификации, поскольку грибные эндофиты микогетеротрофов чрезвычайно разнообразны, особенно те, которые связаны с тропическими растениями39, как и продуцируемые метаболиты. Для оценки таких случаев могут использоваться спектрофотометрические анализы и различные протоколы, а также коммерческие наборы, применяемые для очистки образцов ДНК. Предлагаемыми последующими этапами молекулярной идентификации изолятов являются амплификация области внутреннего транскрибируемого спейсера (ITS) и секвенирование. Область ITS представляет собой рибосомную РНК-спейсерную ДНК, широко используемую в специализированной литературе и официально принятую в качестве основного штрих-кода для идентификации грибов 9,40. Он может быть амплифицирован методом ПЦР с праймерами ITS1 и ITS441, а затем секвенирован на платформе Сэнгера42.
Анализ меташтрихкодирования, помимо того, что позволяет исследовать богатство, численность и таксономический состав микроорганизмов в образцах окружающей среды и растений, может дать результаты положительных или отрицательных взаимодействий между этими микроорганизмами12. Стадия мацерации с использованием жидкого азота, добавленного к стандартному протоколу DNeasy PowerSoil, направлена на разрушение как можно большего количества грибковых клеток по отношению к тканям растений, что позволяет лучше отбирать образцы грибкового сообщества в мацерированной ткани11. При выборе праймеров для последовательностей грибов (штрих-кодов) при молекулярной идентификации необходимо учитывать вмешательство в ДНК растений. Мы рекомендуем использовать праймеры, которые амплифицируют вариабельные участки гена гриба 18S, например, ITS1-5,8S-ITS243. После получения образцов ДНК последующими этапами являются подготовка метагеномных библиотек, которые зависят от выбранной платформы секвенирования, апостериорное секвенирование библиотек и анализ полученных данных с помощью биоинформатических инструментов. Мы рекомендуем использовать платформу Illumina MiSeq, которая представляет собой менее дорогой вариант с высокой производительностью, генерирующей последовательности 250.н. за короткие промежутки времени11,44.
Раскрытие информации
Авторам нечего раскрывать и нет конфликта интересов.
Благодарности
Мы благодарим FAPESP (2015/26479-6) и CNPq (447453/2014-9). JLSM благодарит CNPq за гранты на повышение производительности (303664/2020-7). MPP благодарит Capes (стипендия магистратуры, процесс 88887.600591/2021-00) и CNPq.
Материалы
| Name | Company | Catalog Number | Comments |
| Adhesive tape | (from any company, for adhesive tape mount in micromorphological analyses) | ||
| Ampicillin | Sigma-Aldrich | A5354 | (for installation of plant fragments; other antibiotics may be used - check step 2.2.1) |
| Autoclave | (from any company, for materials sterilization in many steps) | ||
| Bacteriological agar | Sigma-Aldrich | A1296 | (for many steps) |
| C1, C2, C3, C4, C5, and C6 solutions | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Centrifuge | Merck/Eppendorf | 5810 G | (for total DNA extraction from fungal isolates) |
| Centrifuge tubes | Merck | CLS430828 | (for samples collection) |
| Chloroform | Sigma-Aldrich | C2432 | (for total DNA extraction from fungal isolates) |
| Congo red | Supelco | 75768 | (for hyphae staining) |
| Cryotubes | Merck | BR114831 | (for many steps) |
| Ethanol | Supelco | 100983 | It will be necessary to carry out the appropriate dilutions (for many steps) |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | 3609 | (for total DNA extraction from fungal isolates) |
| Filter paper | Merck | WHA10010155 | (for many steps) |
| Glass test tubes | Merck | CLS7082516 | (for cryopreservation in unhulled rice grains) |
| Glass wool | Supelco | 20411 | (for cryopreservation in unhulled rice grains) |
| Glucose | Sigma-Aldrich | G8270 | Or dextrose (for cryopreservation in vermiculite) |
| Glycerol | Sigma-Aldrich | G5516 | Or glycerin (for cryopreservation in vermiculite, for preparing LPCB) |
| Isopropanol | Sigma-Aldrich | 563935 | (for total DNA extraction from fungal isolates) |
| Lactic acid | Sigma-Aldrich | 252476 | (for preparing LPCB - hyphae staining) |
| Lactophenol blue solution (LPCB) | Sigma-Aldrich | 61335 | (for hyphae staining) |
| Laminar flow hood | (class I, from any company, for many steps) | ||
| Light microscope | (from any company, for hyphae observation) | ||
| MB Spin Columns | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Methyl blue (cotton blue) | Sigma-Aldrich | M5528 | (for preparing LPCB - hyphae staining) |
| Microcentrifuge tube (1.5 mL) | Merck | HS4323 | (for total DNA extraction from fungal isolates) |
| Microcentrifuge tube (2 mL) | Merck | BR780546 | (for many steps) |
| Mineral oil | (for preservation of fungal isolates) | ||
| Paper bags | Average size 150 mm x 200 mm (for samples collection) | ||
| Petri dish (Glass, 120 mm x 20 mm) | Merck/Pyrex | SLW1480/10D | (autoclavable, for fungi slide culture, prefer higher ones) |
| Petri dish (Glass, 50 mm x 17 mm) | Merck/Aldrich | Z740618 | (for purification of fungal isolates); alternatively: polystyrene petri dishes (sterile, γ-irradiated, non-autoclavable) |
| Petri dish (Glass, 80 mm x 15 mm) | Merck/Brand | BR455732 | (for installation of plant fragments); alternatively: polystyrene petri dishes (sterile, γ-irradiated, non-autoclavable) |
| Phenol | Sigma-Aldrich | P1037 | (for total DNA extraction from fungal isolates, for preparing LPCB) |
| Porcelain mortar | Sigma-Aldrich | Z247464 | (for total DNA extraction from fungal isolates) |
| Porcelain pestle | Sigma-Aldrich | Z247502 | (for total DNA extraction from fungal isolates) |
| Potato dextrose agar (PDA) | Millipore | P2182 | (for many steps) |
| PowerBead tubes | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Rapid mounting medium (Entellan) | Sigma-Aldrich | 1.0796 | (for fungi slide culture) |
| Silica gel | Supelco | 717185 | (for cryopreservation in unhulled rice grains) |
| Sodium chloride (NaCl) | Sigma-Aldrich | S9888 | (for total DNA extraction from fungal isolates) |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771 | Lauryl sulfate sodium salt (for total DNA extraction from fungal isolates) |
| Sodium hypochlorite (w/ 2% active chlorine) | (commercial product, for superficial desinfestation) | ||
| Soil DNA extraction kit (DNeasy PowerSoil kit) | Qiagen | 12888-50 | (for total DNA extraction from plant organs) |
| Spectrophotometer - Nanodrop 2000/2000c | ThermoFisher Scientific | ND2000CLAPTOP | (for total DNA extraction from plant organs) |
| Stereomicroscope | (=dissecting microscope, from any company, for macromorphological analyses) | ||
| Tetracycline | Sigma-Aldrich | T7660 | (for installation of plant fragments) |
| Thermoblock | Merck/Eppendorf | EP5362000035 | (or from other companies) |
| Tissue homogenizer and cell lyzer | SPEX SamplePrep | 2010 Geno/Grinder - Automated Tissue Homogenizer and Cell Lyzer (for total DNA extraction from plant organs) | |
| Toluidine blue O | Sigma-Aldrich/Harleco | 364-M | (for hyphae staining) |
| Trehalose | Sigma-Aldrich | T9531 | (for cryopreservation in vermiculite) |
| Tris Base Solution (Tris) | Sigma-Aldrich | T1699 | (for total DNA extraction from fungal isolates) |
| Unhulled rice grains | (for cryopreservation) | ||
| U-shaped glass rod | (or an adaptation - check step 5.4.1, for fungi slide culture) | ||
| Vermiculite | Fine granulometry (for cryopreservation in vermiculite) | ||
| Vortexer | Sigma-Aldrich/BenchMixer | BMSBV1000 | (for total DNA extraction from fungal isolates) |
| Yeast extract | Sigma-Aldrich | Y1625 | (for cryopreservation in vermiculite) |
Ссылки
- de Azevedo, J. L. Endophytic microorganisms. Ecologia Microbiana. , 117-137 (1998).
- Stone, J. K., Bacon, C. W., White, J. F. An overview of endophytic microbes: endophytism defined. Microbial Endophytes. , 17-44 (2000).
- Schulz, B., Boyle, C. What are Endophytes. Microbial Root Endophytes. , Springer-Verlag. Berlin. 1-13 (2006).
- Smith, S. E., Read, D. J. Mycorrhizal Symbiosis. , Elsevier Science Academic Press. London. (2008).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Ma, X., Kang, J., Nontachaiyapoom, S., Wen, T., Hyde, K. D. Non-mycorrhizal endophytic fungi from orchids. Current Science. 109 (1), 72-87 (2015).
- Favre-Godal, Q., Gourguillon, L., Lordel-Madeleine, S., Gindro, K., Choisy, P. Orchids and their mycorrhizal fungi: an insufficiently explored relationship. Mycorrhiza. 30 (1), 5-22 (2020).
- Sun, X., Guo, L. -D. Endophytic fungal diversity: review of traditional and molecular techniques. Mycology. 3 (1), 65-76 (2012).
- Pena-Passos, M., Sisti, L. S., Mayer, J. L. S. Microscopy techniques for interpreting fungal colonization in mycoheterotrophic plants tissues and symbiotic germination of seeds. Journal of Visualized Experiments. (183), e63777(2022).
- Araújo, W. L., et al. Endophytic microorganisms: Theoretical and Practical Aspects of Isolation and Characterization. 1st ed. 1, Santarém: UFOPA. 257(2014).
- de Souza, R. S. C., et al. Unlocking the bacterial and fungal communities assemblages of sugarcane microbiome. Scientific Reports. 6, 28774(2016).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589(2019).
- Araújo, W. L., et al. Variability and interactions between endophytic bacteria and fungi isolated from leaf tissues of citrus rootstocks. Canadian Journal of Microbiology. 47 (3), 229-236 (2001).
- Castellani, A. Further researches on the long viability and growth of many pathogenic fungi and some bacteria in sterile distilled water. Mycopathologia. 20 (1-2), 1-6 (1963).
- Currah, R. S., Zelmer, C. D., Hambleton, S., Richardson, K. A. Fungi from orchid mycorrhizas. Orchid Biology: Reviews and Perspectives, VII. , 117-170 (1997).
- Freitas, E. F. S., et al. Diversity of mycorrhizal Tulasnella associated with epiphytic and rupicolous orchids from the Brazilian Atlantic Forest, including four new species. Scientific Reports. 10 (1), 7069(2020).
- Sato, M., Inaba, S., Noguchi, M., Nakagiri, A. Vermiculite as a culture substrate greatly improves the viability of frozen cultures of ectomycorrhizal basidiomycetes. Fungal Biology. 124 (8), 742-751 (2020).
- Pereira, O. L., Kasuya, M. C. M., Borges, A. C., Araújo, E. F. D. Morphological and molecular characterization of mycorrhizal fungi isolated from neotropical orchids in Brazil. Canadian Journal of Botany. 83 (1), 54-65 (2005).
- Riddell, R. W. Permanent stained mycological preparations obtained by slide culture. Mycologia. 42 (2), 265-270 (1950).
- Walsh, T. J., Hayden, R. T., Larone, D. H. Larone's Medically Important Fungi: A Guide to Identification. , ASM Press. (2018).
- Malloch, D. Moulds: Isolation, Cultivation, Identification. , Available from: http://website.nbm-mnb.ca/mycologywebpages/Moulds/Moulds.html (1997).
- Smith, P. Microscopy: Chemical Reagents. British Mycological Society. , Available from: https://www.britmycolsoc.org.uk/field_mycology/microscopy/reagents (2022).
- Senanayake, I. C., et al. Morphological approaches in studying fungi: Collection, examination, isolation, sporulation and preservation. Mycosphere. 11 (1), 2678-2754 (2020).
- Slifkin, M., Cumbie, R. Congo red as a fluorochrome for the rapid detection of fungi. Journal of Clinical Microbiology. 26 (5), 827-830 (1988).
- Raeder, U., Broda, P. Rapid preparation of DNA from filamentous fungi. Letters in Applied Microbiology. 1 (1), 17-20 (1985).
- Martins, M. K., et al. Molecular characterization of endophytic microorganisms. Endophytic microorganisms: theoretical and practical aspects of isolation and characterization. 1st edition. , Santarém: UFOPA. 189-211 (2014).
- Rayner, R. W. A Mycological Colour Chart. Commonwealth Mycological Institute. , (1970).
- Kornerup, A., Wanscher, J. H. Methuen Handbook of Colour. Methuen handbook of colour. , Methuen & Co. Ltd. London. (1967).
- Ridgway, R. Color Standards and Color Nomenclature. , Washington, DC. Published by the author (1912).
- McGinnis, M. R. Laboratory Handbook of Medical Mycology. , Elsevier Science. (2012).
- Webster, J., Weber, R. Introduction to Fungi. , Cambridge University Press. Cambridge, UK. (2007).
- Sridharan, G., Shankar, A. A. Toluidine blue: A review of its chemistry and clinical utility. Journal of Oral and Maxillofacial Pathology. 16 (2), 251-255 (2012).
- Smith, D., Onions, A. H. S. A comparison of some preservation techniques for fungi. Transactions of the British Mycological Society. 81 (3), 535-540 (1983).
- Ryan, M. J., Smith, D., Jeffries, P. A decision-based key to determine the most appropriate protocol for the preservation of fungi. World Journal of Microbiology and Biotechnology. 16 (2), 183-186 (2000).
- Lalaymia, I., Cranenbrouck, S., Declerck, S. Maintenance and preservation of ectomycorrhizal and arbuscular mycorrhizal fungi. Mycorrhiza. 24 (5), 323-337 (2014).
- Zettler, L. W., Corey, L. L. Orchid mycorrhizal fungi: isolation and identification techniques. Orchid Propagation: From Laboratories to Greenhouses-Methods and Protocols. , 27-59 (2018).
- Yu, S., Wang, Y., Li, X., Yu, F., Li, W. The factors affecting the reproducibility of micro-volume DNA mass quantification in Nanodrop 2000 spectrophotometer. Optik. 145, 555-560 (2017).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Schoch, C. L., et al. Nuclear ribosomal internal transcribed spacer (ITS) region as a universal DNA barcode marker for Fungi. Proceedings of the National Academy of Sciences. 109 (16), 6241-6246 (2012).
- White, T. J., Bruns, T., Lee, S., Taylor, J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR Protocols: A Guide to Methods and Applications. 18 (1), 315-322 (1990).
- Sanger, F., Nicklen, S., Coulson, A. R. DNA sequencing with chain-terminating inhibitors. Proceedings of the National Academy of Sciences. 74 (12), 5463-5467 (1977).
- Ranjard, L., et al. Characterization of bacterial and fungal soil communities by automated ribosomal intergenic spacer analysis fingerprints: biological and methodological variability. Applied and Environmental Microbiology. 67 (10), 4479-4487 (2001).
- Metzker, M. L. Sequencing technologies-the next generation. Nature Reviews Genetics. 11 (1), 31-46 (2010).
Erratum
Formal Correction: Erratum: Isolation, Characterization, and Total DNA Extraction to Identify Endophytic Fungi in Mycoheterotrophic Plants
Posted by JoVE Editors on 1/01/1970. Citeable Link.
An erratum was issued for: Isolation, Characterization, and Total DNA Extraction to Identify Endophytic Fungi in Mycoheterotrophic Plants. The Authors section was updated from:
Juliana Lishcka Sampaio Mayer
to:
Juliana Lischka Sampaio Mayer
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены