Method Article
عزل وتوصيف واستخلاص الحمض النووي الكلي لتحديد الفطريات الداخلية في النباتات الفطرية ذاتية التغذية
In This Article
Erratum Notice
Summary
تهدف المقالة الحالية إلى توفير بروتوكولات مفصلة وكافية لعزل الفطريات الداخلية المرتبطة بالنباتات ، والحفاظ على العزلات على المدى الطويل ، والتوصيف المورفولوجي ، واستخراج الحمض النووي الكلي لتحديد الجزيئات اللاحقة والتحليلات الميتاجينومية.
Abstract
تمثل النباتات الفطرية التغذية واحدة من أكثر أشكال الاعتماد على الفطريات تطرفا ، بعد أن فقدت قدرتها الذاتية التغذية تماما. لا تقل أهمية عن أي مورد حيوي آخر ، فإن الفطريات التي ترتبط بها هذه النباتات ارتباطا وثيقا ضرورية لها. ومن ثم ، فإن بعض التقنيات الأكثر صلة في دراسة الأنواع الفطرية غير المتجانسة هي تلك التي تمكن من التحقيق في الفطريات المرتبطة بها ، وخاصة تلك التي تعيش في الجذور والأعضاء الجوفية. في هذا السياق ، يتم تطبيق تقنيات لتحديد الفطريات الداخلية المعتمدة على الثقافة والمستقلة عن الثقافة. يوفر عزل النباتات الداخلية الفطرية وسيلة لتحديدها شكليا ، وتحليل تنوعها ، والحفاظ على اللقاح للتطبيقات في الإنبات التكافلي لبذور الأوركيد. ومع ذلك ، فمن المعروف أن هناك مجموعة كبيرة ومتنوعة من الفطريات غير القابلة للزراعة التي تعيش في الأنسجة النباتية. وبالتالي ، فإن تقنيات التحديد الجزيئي المستقلة عن الثقافة توفر غطاء أوسع لتنوع الأنواع ووفرتها. تهدف هذه المقالة إلى توفير الدعم المنهجي اللازم لبدء إجراءين للتحقيق: إجراء يعتمد على الثقافة والآخر مستقل. فيما يتعلق بالبروتوكول المعتمد على الاستزراع ، يتم تفصيل عمليات جمع العينات النباتية وصيانتها من مواقع التجميع إلى مرافق المختبر ، جنبا إلى جنب مع عزل الفطريات الخيطية من الأعضاء الجوفية والجوية للنباتات الفطرية ذاتية التغذية ، والحفاظ على مجموعة من العزلات ، وتوصيف الخيوط شكليا من خلال منهجية زراعة الشرائح ، والتحديد الجزيئي للفطريات عن طريق الاستخراج الكلي للحمض النووي. وتشمل الإجراءات التفصيلية، التي تشمل منهجيات مستقلة عن الاستزراع، جمع عينات نباتية للتحليلات الميتاجينومية واستخراج الحمض النووي الكلي من الأعضاء النباتية الأكلوروفيلية باستخدام مجموعة تجارية. وأخيرا، تقترح أيضا بروتوكولات الاستمرارية (مثل تفاعل البوليميراز المتسلسل [PCR]، والتسلسل) للتحليلات، وتعرض التقنيات هنا.
Introduction
الفطريات الداخلية هي ، بحكم تعريفها ، تلك التي تعيش داخل الأعضاء والأنسجة النباتية في حالات العدوى غير الواضحة (أي دون التسبب في ضرر لمضيفها)1,2. يمكن أن تتفاعل هذه الفطريات بشكل محايد أو مفيد مع النباتات المضيفة ، وقد تمنح مقاومة لمسببات الأمراض والظروف البيئية غير المواتية ، وقد تساهم في تخليق المركبات المفيدة للنبات (على سبيل المثال ، عوامل النمو والهرمونات النباتية الأخرى)1,3. النباتات الداخلية الفطرية هي الفطريات التي تنشئ ارتباطات جذرية مع النبات ، وتشارك في نقل المغذيات4. في Orchidaceae ، يعد التفاعل مع النباتات الداخلية الفطرية أمرا أساسيا لإنبات البذور في الغالبية العظمى من الأنواع ، وإنشاء الشتلات في جميع النباتات في العائلة5. في مثل هذه السياقات ، تمثل بساتين الفاكهة الفطرية حالة من الاعتماد الكلي فيما يتعلق بشركائها الفطريين ، لأنها تعتمد على المغذيات المعدنية ونقل مركبات الكربون بواسطة هذه الفطريات خلال دورة حياتها بأكملها6. لذلك ، فإن عزل وتحديد الفطريات المرتبطة هو قاعدة أساسية عند التحقيق في استراتيجيات الحياة الفطرية. علاوة على ذلك ، لا يعرف سوى القليل عن أدوار النباتات الداخلية الفطرية في النباتات الفطرية أو حتى التنوع الحقيقي لهذه الفطريات 7,8.
يمكن إجراء التحقيق في الفطريات الداخلية من خلال تقنيات مختلفة ، توصف تقليديا بأنها مستقلة عن الثقافة أو تعتمد ، على سبيل المثال: (أ) الملاحظة المباشرة ، (ب) العزل الفطري والتحديد المورفولوجي و / أو الجزيئي ، و (ج) استخراج الحمض النووي الكلي للأنسجة النباتية والتحديد الجزيئي9. في الملاحظة المباشرة (أ) ، يمكن فحص الفطريات الداخلية أثناء وجودها في داخل الخلايا والأنسجة النباتية بواسطة المجهر الضوئي أو الإلكتروني9 ، حيث تم تفصيل بروتوكولات الفحص المجهري المختلفة بواسطة Pena-Passos et al.10. من خلال طرق العزل (ب) ، يمكن وصف النباتات الداخلية الفطرية وفقا لمستعمراتها ، والخيوط ، ومورفولوجيا البنية الإنجابية أو المقاومة. أيضا ، من خلال تقنيات العزل ، من الممكن إجراء التحديد الجزيئي للعزلات من خلال استخراج الحمض النووي ، وتضخيم تسلسلات التعريف الجزيئي (الرموز الشريطية أو بصمات الأصابع) ، والتسلسل11. تتيح التقنية الأخيرة (ج) التحديد الجزيئي للفطريات الداخلية لكل استخراج الحمض النووي أثناء وجودها في داخل الأنسجة النباتية (metabarcoding) ، تليها إعداد المكتبة والتسلسل12.
علاوة على ذلك ، يمكن تطبيق العزلات الفطرية في تجارب الإنبات التكافلية ، باستخدام بذور من بساتين الفاكهة ذاتية التغذية أو الفطرية. مثال على هذا التطبيق هو التحقيق الذي أجراه Sisti et al.13 ، واصفا الإنبات والمراحل الأولية لتطور البروتوكورم في Pogoniopsis schenckii ، وهي سحلية فطرية التغذية ، بالاشتراك مع بعض عزلاتها ، والتي تضم الفطريات الداخلية غير الفطرية. تم تفصيل بروتوكول الإنبات التكافلي المطبق وتقديمه في مقطع فيديو بواسطة Pena-Passos et al.10. يسمح عزل الفطريات بالاشتراك مع أعضاء نباتية مختلفة بتركيز متنوع على طبيعة التفاعلات الفطرية النباتية (على سبيل المثال ، لفهم الجوانب البيئية أو الفسيولوجية للارتباط ، بالإضافة إلى التحقيقات في انتقال المغذيات من الفطريات إلى النبات)9.
تستند المنهجيات المعروضة في القسم 1 إلى مجموعة من عينات الأعضاء الجوفية ، حيث أن هذه الأعضاء تمثل أكبر الصعوبات في الجمع ، وهي ذات أهمية كبيرة لأن النباتات الداخلية الفطرية تستعمرها. ومع ذلك ، يمكن تطبيق كلا البروتوكولين المشمولين (الخطوتان 1.1 و 1.2) على أعضاء نباتية أخرى متغايرة التغذية (مثل الجذور والسيقان الزهرية والفواكه). تم تصميم منهجية الجمع الموصوفة في الخطوة 1.1 لعزل الفطريات الداخلية (القسم 2) للتوصيف المورفولوجي (القسمان 4 و 5) و / أو استخراج الحمض النووي الكلي لتحديد العزلة (القسم 6). من ناحية أخرى ، تم تعيين منهجية الجمع الموضحة في الخطوة 1.2 حصريا لاستخراج الحمض النووي الكلي للأنسجة النباتية لتقنيات metabarcoding (القسم 7). في القسم 3 ، يتم تقديم أربع طرق لتخزين الفطريات الخيطية وحفظها ، اثنتان للتخزين قصير الأجل (3-6 أشهر) والطريقتان الأخريان كافيتان للتخزين طويل الأجل (>1 سنة). قد يرتبط التوصيف المورفولوجي (القسمان 4 و 5) بالتحديد الجزيئي لتعزيزه وتوفير معلومات مهمة عن التشكل الكلي والدقيق الفطري. ويلخص الشكل 1 المنهجيات الجماعية الموصوفة بعد ذلك.

الشكل 1: تلخيص تخطيطي للطرق المقدمة. جمع النباتات وعزلها الفطري وحفظها وتحديدها الجزيئي من خلال منهجيات تعتمد على الثقافة ومستقلة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
1. جمع عينات النبات
- جمع العينات للطرق المعتمدة على الثقافة
- حفر بعناية الأعضاء الجوفية. يمكن أن تكون هذه الجذور أو السيقان أو الجذور أو أعضاء تخزين النبات المراد جمعها. بصرف النظر عن التربة المدمجة للغاية ، اجمع هذه العينات يدويا.
ملاحظة: استخدام أدوات مثل المسجات أو المجارف في هذه الخطوة غير حكيم ، لأنه يمكن أن يتلف الهياكل الهشة للنباتات الفطرية التغذية وقد يتسبب في تلوث الأنسجة بالفطريات غير الداخلية. - جمع أكبر عدد ممكن من الأعضاء الجوفية. احتفظ بالعينات في أكياس ورقية داخل حاوية مبردة (على سبيل المثال ، صندوق رغوة البوليسترين أو كيس حراري به ثلج). إذا تم جمع الأعضاء الهوائية أيضا ، فقم بنقلها بشكل منفصل عن الأعضاء الجوفية.
- حفر بعناية الأعضاء الجوفية. يمكن أن تكون هذه الجذور أو السيقان أو الجذور أو أعضاء تخزين النبات المراد جمعها. بصرف النظر عن التربة المدمجة للغاية ، اجمع هذه العينات يدويا.
- جمع العينات للطرق المستقلة عن الثقافة
- احفر بعناية جذور النبات المراد جمعها بموجب نفس التوصيات المشار إليها في الملاحظة من الخطوة 1.1.1.
- جمع أكبر عدد ممكن من الأعضاء الجوفية. الحفاظ على العينات التي تم جمعها في أنابيب التبريد داخل النيتروجين السائل (خيار مرغوب فيه) أو استخدام أنابيب الطرد المركزي المحاطة بالثلج الجاف (خيار بديل). الحفاظ على الأجهزة الهوائية بشكل منفصل ، إذا تم جمعها.
2. عزل الفطريات الداخلية المرتبطة بالأعضاء النباتية14
ملاحظة: يجب أن تكون كل مادة ومحلول وكاشف مستخدم في هذا القسم معقمة. تلك التي لا يمكن شراؤها معقمة بالفعل يجب تعقيمها عند 121 درجة مئوية لمدة 20 دقيقة.
- التطهير السطحي لأعضاء النبات
- اغسل العينات التي تم جمعها (الخطوة 1.1.2) في المياه الجارية وقم بإزالة أكبر قدر ممكن من الركيزة والحطام الآخر الذي يمكن أن تحتويه العينات.
- داخل غطاء التدفق الصفحي ، حافظ على العينات المغسولة المغمورة في 70٪ إيثانول لمدة 1 دقيقة (يمكن استخدام دورق أو وعاء زجاجي).
- نقل العينات إلى حاوية أخرى مع هيبوكلوريت الصوديوم مع 2 ٪ الكلور النشط لمدة 3 دقائق.
- تغيير العينات إلى حاوية مع الإيثانول 70 ٪ والحفاظ على مغمورة لمدة 1 دقيقة. بعد ذلك ، اغسل العينات بالتتابع في حاويتين بالماء المقطر.
- تركيب شظايا النبات في وسط الاستزراع
ملاحظة: يجب إجراء كل خطوة مفصلة في الخطوة 2.2 داخل غطاء التدفق الصفحي.- قبل التثبيت ، قم بإعداد أطباق بتري (قطرها 8-10 سم) مع وسط زراعة أجار سكر العنب للبطاطس 19.5 جم / لتر (PDA) + 7 جم / لتر أجار بكتريولوجي + 3 مل / لتر من المضادات الحيوية (مثل الستربتومايسين والبنسلين والتتراسيكلين والأمبيسلين).
- حافظ على أطباق بتري مع وسط الاستزراع عند 36 درجة مئوية لمدة 24 ساعة قبل استخدامها لضمان عدم وجود تلوث. تخلص من الأطباق الملوثة بالبكتيريا أو مستعمرات الفطريات.
ملاحظة: إضافة المضادات الحيوية في الوسط أمر ضروري في هذه الخطوة ، حيث أن الأعضاء مصابة بشدة بالبكتيريا التي قد تمنع نمو الفطريات. تحقق مما إذا كان يمكن تسخين المضادات الحيوية أثناء التعقيم. يجب إضافة بعض المضادات الحيوية بعد تبريد الوسط إلى حوالي 36 درجة مئوية (قبل وضعه في الأطباق). - مباشرة بعد التطهير السطحي للعينات ولا تزال داخل غطاء التدفق الصفحي ، في المساعد الرقمي الشخصي ، قم بتلقيح بعض قطرات الماء المقطر من الحاوية الأخيرة المستخدمة لغسل العينات. هذه الخطوة مهمة لتقييم فعالية التطهير السطحي للعينات.
- في طبق تعقيم فارغ ، ضع العينات واستخدم مشرطا ملتهبا وملقطا لتقسيم العينات إلى سمك حوالي 0.2 سم.
- قسم العينات الأسطوانية طوليا إلى نصفين إذا رغبت في تضخيم السطح الملامس للوسط. لفضح الفواكه والأعضاء الكروية الأخرى بشكل أفضل ، قم بتقطيع الهياكل أو تقطيعها جيدا. يمكن أن تكون البذور أيضا مصادر فطرية مهمة ، لذا تأكد من أن الفاكهة المقسمة تعرضها للوسط.
ملاحظة: يجب استخدام الأعضاء السليمة فقط ، دون تلف الأنسجة أو إشارات الأمراض المحتملة أو الالتهابات المسببة للأمراض ، في عزل النباتات الداخلية الفطرية. - توزيع خمس شظايا من الأعضاء الجوفية في أطباق بتري مع المساعد الرقمي الشخصي + المضادات الحيوية. تأكد من أن الشظايا بعيدة عن بعضها البعض قدر الإمكان ، كما أنها لا تلمس حواف الطبق. لا تقم بتجميع أي شظايا على الوسيط. إعداد النسخ المتماثلة لكل عضو مثبت ، كإجراء وقائي في حالة التلوث.
- ختم أطباق بتري مع فيلم تتشبث وتخزينها في الظلام في 25-27 درجة مئوية (يفضل في حاضنة) لمدة 5 أيام.
- تردد العزل (IF) حساب التفاضل والتكامل11
- بعد 5 أيام من حضانة شظايا الأعضاء ، احسب IF ، وفقا لعدد الأجزاء المحتضنة التي تظهر مستعمرات فطرية تنمو مقسومة على إجمالي الشظايا المحتضنة ، كما هو موضح في المعادلة التالية:

- بعد 5 أيام من حضانة شظايا الأعضاء ، احسب IF ، وفقا لعدد الأجزاء المحتضنة التي تظهر مستعمرات فطرية تنمو مقسومة على إجمالي الشظايا المحتضنة ، كما هو موضح في المعادلة التالية:
- تنقية العزلات الفطرية عن طريق التخطيط والاستزراع الفرعي
ملاحظة: يجب إجراء كل خطوة مفصلة في الخطوة 2.4 داخل غطاء التدفق الرقائقي.- تحضير أطباق بتري (قطرها 5 سم) مع 5-7 جم / لتر أجار أجار (AA ؛ أجار بكتريولوجي فقط). حافظ على الأطباق لمدة 24 ساعة عند 36 درجة مئوية للتخلص من الأطباق التي يحتمل أن تكون ملوثة.
- حدد كل مستعمرة فطرية نمت برمز وحدد هوامشها على الجانب السفلي من الطبق (يمكن القيام به بعلامة دائمة). قم بتمييز المستعمرات حسب اللون ونمط النمو والملمس وتنسيق الهامش.
- باستخدام عود أسنان خشبي معقم ، باستخدام الطرف الرفيع ، استرد كمية صغيرة من الفطريات من مستعمرة فطرية. ركز بشكل مفضل على هوامش المستعمرة واختر منطقة بعيدة قدر الإمكان عن مستعمرة أخرى ، وتجنب استعادة أكثر من نوع واحد من المستعمرات في وقت واحد.
- باستخدام نفس المسواك مع الفطريات عند الطرف ، قم بتخطيط AA لإنتاج ثلاثة خطوط (أخاديد). تأكد من أن كل سطور على مسافة 1 سم من أخرى وحواف الطبق. اكتب الرمز المناسب (باستخدام ورق لاصق وقلم رصاص) ، وأغلق الأطباق ، واحتفظ بها في الظلام عند 25-27 درجة مئوية لمدة 3 أيام.
- تحضير أطباق بتري (قطرها 8 سم) مع 39 جم / لتر PDA. ليس من الضروري إضافة المضادات الحيوية في هذه المرحلة.
- بعد احتضان أطباق AA ، راقبها بدقة ضد الضوء (من مصباح أو نافذة) ، بهدف تحديد خيوط دقيقة تشكل مستعمرات فردية. حدد مساحة مستعمرة فردية لكل طبق ، باستخدام علامة دائمة على الجانب السفلي من طبق بتري.
- في غطاء التدفق الصفحي ، استخدم عود أسنان معقم لقطع جزء من الوسط الذي يحتوي على المستعمرة ونقل حجم القطع إلى مركز طبق PDA جديد.
- حدد أطباق بتري برموز العزلات ، وأغلق الأطباق بغشاء ملتصق ، واحتفظ بها في الظلام عند 25-27 درجة مئوية لمدة 7-14 يوما.
3. الحفاظ على العزلات الفطرية النقية
ملاحظة: يجب أن تكون كل مادة ومحلول وكاشف مستخدم في هذا القسم معقمة. تلك التي لا يمكن شراؤها معقمة بالفعل يجب تعقيمها عند 121 درجة مئوية لمدة 20 دقيقة.
- الحفظ بطريقة كاستيلاني أو في الزيوت المعدنية (3-6 أشهر)11,15
- قم بإعداد أنابيب طرد مركزي دقيقة سعة 2 مل مع 0.5 مل من الماء المقطر أو تحتوي على 0.5 مل من الزيت المعدني (حسب الطريقة المختارة). تأكد من أن الأنابيب فارغة ، ويضاف الماء والزيت المعقم إلى الأنابيب داخل غطاء التدفق الصفحي.
- في غطاء التدفق الصفحي ، ضع أطباق بتري مع عزلات منقاة نمت بالفعل في القناة النقية السالكة (39 جم / لتر) لمدة 7-14 يوما. باستخدام عود أسنان معقم ، قم بقطع متوازي المستطيلات الصغيرة (0.5 سم × 0.5 سم في المنطقة العلوية) من الوسط الذي يحتوي على هوامش الفطريات.
- ضع أربعة إلى ستة متوازي المستطيلات في أنابيب الطرد المركزي الدقيقة بالماء المقطر (طريقة كاستيلاني) أو الزيت المعدني. قم بتخزين الأنابيب في الظلام ، عند 25 درجة مئوية طالما دعت الحاجة ، مع مراعاة القيود الزمنية للطريقة.
ملاحظة: تجنب إضافة الكثير من متوازي المستطيلات إلى الأنابيب وجعلها ممتلئة ، مما قد يزيد من فرص التلوث. من الممكن الحفاظ على الأنابيب مبردة ، مما قد يفضل الحفاظ على بعض العزلات لفترة أطول. يوصي Currah et al.16 بتخزين نسخ طبق الأصل من عزلات الفطريات الجذرية من بساتين الفاكهة الاستوائية المبردة وعند 25 درجة مئوية ، حيث يمكن أن تضيع عندما تكون في التخزين البارد. - استرد متوازي المستطيلات وضعه في وسط طبق PDA جديد لزراعة عزلة مخزنة.
- الحفظ بالتبريد في حبوب الأرز غير المقشورة (>1 سنة)17
- اغسل حبوب الأرز غير المقشورة بالماء الجاري واطهيها حتى يبدأ قشر الأرز في الفتح. قم بتوزيع الحبوب المطبوخة في أنابيب اختبار زجاجية بغطاء لولبي والأوتوكلاف مرتين بفاصل 24 ساعة بينهما.
- في غطاء التدفق الصفحي ، ضع أطباق بتري مع عزلات منقاة نمت بالفعل في القناة النقية السالكة (39 جم / لتر) لمدة 7-14 يوما. باستخدام عود أسنان معقم ، استرد خمس شظايا خيوط صغيرة من هوامش الفطريات وقم بتلقيحها في الأنبوب الذي يحتوي على حبوب الأرز المعقم.
ملاحظة: يضمن تلقيح الخيوط الفطرية في نقاط وأعماق مختلفة من الأنبوب أن العزلة تستعمر حبوب الأرز غير المقشورة في وقت أقل. - احتضان الأنابيب في الظلام عند 25-27 درجة مئوية لمدة 14 يوما. قم بتحريك الأنابيب عن طريق دوامها كل 3 أيام للحفاظ على الحبوب فردية.
- بعد مراقبة نمو الفطريات في حبوب الأرز ، قم بتوزيع الحبوب في طبق بتري معقم مبطن بورق ترشيح لامتصاص الرطوبة ، فوق الورق حتى تجف الحبوب. يحفظ في الظلام على حرارة 25-27 درجة مئوية لمدة 2-3 أيام.
- تحضير أنابيب التبريد مع 1/3 هلام السيليكا في الأسفل و 1/3 الصوف الزجاجي فوق السيليكا. أخيرا ، قم بتوزيع 1/3 من حبوب الأرز مع الفطريات الفطرية المزروعة. يحفظ في درجة حرارة -20 درجة مئوية لمدة 24 ساعة.
- بعد 24 ساعة ، قم بتخزين أنابيب التبريد في -80 درجة مئوية طالما دعت الحاجة ، مع مراعاة القيود الزمنية للطريقة.
- الحفظ بالتبريد في الفيرميكوليت باستخدام مادة واقية من البرودة (>1 سنة)18
- تحضير وسط ثقافة سائل يتكون من 0.2 ٪ مستخلص الخميرة و 2 ٪ الجلوكوز في الماء المقطر. اضبط الرقم الهيدروجيني على 5 وقم بتعقيمه.
- توزيع 0.2 غرام من الفيرميكوليت (استخدام قياس الحبيبات غرامة) في cryotubes مع غطاء المسمار والأوتوكلاف لهم. أضف 0.8 مل من الوسط السائل المعقم إلى أنابيب التبريد التي تحتوي على الفيرميكوليت.
- في غطاء التدفق الصفحي ، ضع أطباق بتري مع عزلات منقاة نمت بالفعل في القناة النقية السالكة (39 جم / لتر) لمدة 7-14 يوما. باستخدام عود أسنان معقم ، استرد ثلاث إلى خمس شظايا خيوط من هوامش الفطريات وقم بالتلقيح على طول الأنبوب الذي يحتوي على الفيرميكوليت + وسط الثقافة السائلة. تذكر أن تحدد أنابيب التبريد برمز العزل المعني.
ملاحظة: يضمن تلقيح الخيوط في نقاط وأعماق مختلفة من أنبوب التبريد أن العزلة تستعمر الفيرميكوليت في وقت أقل. - قم بتخزين أنابيب التبريد في الظلام عند 25-27 درجة مئوية حتى يمكن ملاحظة استعمار معظم حبيبات الفيرميكوليت ، والذي يستغرق عادة حوالي 14 يوما.
- تحضير محلول واقي بالتبريد يتكون من 5٪ جلسرين و 5٪ تريهالوز في الماء المقطر والأوتوكلاف. دع المحلول يبرد قبل استخدامه.
- بعد استعمار الفيرميكوليت في أنابيب التبريد بواسطة العزلة الفطرية المعنية ، قم بتوزيع 0.4 مل من مادة الحماية بالتبريد في كل أنبوب واحتفظ بأنابيب التبريد مبردة عند 4 درجات مئوية لمدة 48 ساعة. بعد ذلك ، حافظ على أنابيب التبريد عند -80 درجة مئوية طالما دعت الحاجة ، مع مراعاة القيود الزمنية للطريقة.
4. التوصيف الماكرومورفولوجي للفطريات الخيطية (مورفولوجيا المستعمرة)
- احتفظ بسجل فوتوغرافي للفطريات المزروعة في كل طبق بتري مع 39 جم / لتر PDA لمدة 7-14 يوما. تذكر أن تسجل جانبي المستعمرة ، الجانب العلوي والسفلي (العكسي). إذا كانت الأطباق ستستخدم بسهولة في القسم 6 أو لا تتم صيانتها ، فافتح الأطباق عند تصويرها للحصول على صور أفضل.
- إذا كانت مهتمة بالبيانات الكمية عن مورفولوجيا المستعمرة ، فإن الثقافة الفرعية تتكرر من العزلات وتحافظ عليها في نفس ظروف النمو ولفترة ثابتة لتسجيل قطر المستعمرة وحساب معدل النمو (عادة بالملليمتر / ساعة).
ملاحظة: يمكن تحقيق نتائج كمية أكثر تعقيدا باستخدام أنواع مختلفة من وسائط الثقافة للمقارنة19 والنظر في الأدوات الإحصائية لمعالجة البيانات. - مراقبة المستعمرات تحت المجهر المجسم وكذلك لتحديد الخصائص المورفولوجية والتصوير في التكبير. تقييم المستعمرات وفقا لخصائصها الكبيرة ، كما هو مفصل في قسم النتائج. استشر المصادر الببليوغرافية المتنوعة للمساعدة في تصنيف وربط التشكل الكلي بالتحديد الجزيئي و / أو المورفولوجي.
5. التوصيف المجهري للفطريات الخيطية (مورفولوجيا hyphal)
ملاحظة: تتم مقارنة التقنيات المجهرية في قسم المناقشة ، مع الأخذ في الاعتبار استخداماتها وعيوبها المحتملة.
- قم بزراعة العزلات على أطباق بتري مع 39 جم / لتر PDA لمدة 7-14 يوما. لتقييم الفطريات الفطرية السحلبية المفترضة ، قم بزراعة العزلات على أجار دقيق الذرة 17 جم / لتر (CMA ؛ أو وسط آخر محدد للمغذيات) لمدة 3-7 أيام19.
- ندف جبل
- العمل داخل غطاء التدفق الصفحي. ضع قطرة من البقعة المختارة (الخطوة 5.5) على شريحة زجاجية نظيفة.
- باستخدام عود أسنان معقم أو مادة معقمة أخرى ، قم بإزالة بعض الخيوط بعناية من العزلة المزروعة وضعها في قطرة البقعة. ضع غطاء (يفضل أن يكون بزاوية أولية 45 درجة لتجنب فقاعات الهواء) وقم بالتحليل تحت المجهر الضوئي.
- جبل الشريط اللاصق
ملاحظة: عادة ما يتم تطبيق هذه التقنية في المزارع الفطرية لاستخدامها بسهولة في القسم 6 أو عدم صيانتها ، حيث لا يمكن تعقيم الشريط اللاصق ، وقد تحدث الملوثات بعد تنفيذ الطريقة.- ضع قطرة من البقعة المختارة (الخطوة 5.5) على شريحة زجاجية نظيفة. قطع شريط من شريط لاصق شفاف في حجم يناسب الشريحة الزجاجية وبقعة بقعة مركزية جيدا.
- قم بتوجيه السطح اللاصق للشريط إلى سطح الفطريات. لا تضغط ، وحاول جمع بعض الخيوط دون لصق الكثير منها.
- قم بلصق الشريط على الشريحة الزجاجية ، مع التأكد من ملامسة البقعة للخيوط المجمعة. ضع قطرة ماء فوق الشريط وضع غطاء. تحليل الشريحة تحت المجهر الضوئي.
- ثقافة الشرائح للفطريات الخيطية20
- داخل طبق بتري كبير (قطره >9 سم ، يفضل) ، ضع: ورق ترشيح في الجزء السفلي ، قضيب زجاجي على شكل حرف U أو تكيف (الهدف هو توفير ارتفاع للشريحة الزجاجية) ، شريحة زجاجية واحدة ، واثنين من أغطية الغطاء. أطباق بتري أعلى تسهل التلاعب. الأوتوكلاف هذه المجموعات من أطباق بتري ، واحدة لكل عزل.
- قم بإعداد حجم صغير من 39 جم / لتر PDA أو 17 جم / لتر CMA ، أضف 10 جم / لتر أجار بكتريولوجي ، والأوتوكلاف (حجم طبق بتري واحد يكفي لأكثر من 30 عزلة). يجب أن تكون وسائط الثقافة المستخدمة في ثقافة الشرائح أصعب من الوسائط المعتادة. الأوتوكلاف 100 مل من الماء المقطر.
- العمل داخل غطاء التدفق الصفحي. ضع الوسط السائل في طبق بتري ، مما ينتج طبقة يبلغ ارتفاعها حوالي 0.5 سم. دع الوسط يصلب. بمجرد أن تصبح صلبة ، استخدم مشرطا معقما لقطع مربعات الوسط التي يبلغ حجمها 1 سم × 1 سم.
- افتح مجموعة أطباق بتري داخل غطاء التدفق الصفحي واستخدم ملقط ملتهب لتنظيم المواد المعقمة داخل الطبق. رتب المادة بالترتيب المرقم ، كما هو موضح في الشكل 2 أ ، مع وضع مربع من وسط الثقافة على الشريحة الزجاجية. قبل وضع غطاء الغطاء فوق الوسط ، انتقل إلى الخطوة 5.4.5.
- استخدم عود أسنان معقم لاستعادة بعض الخيوط من العزلة وافرك بعناية الوجوه الجانبية الأربعة للوسط الموضوعة على الشريحة الزجاجية. ضع غطاء معقم فوق المربع المتوسط باستخدام ملقط ملتهب.
- استخدم طرف ماصة معقم لوضع الماء المعقم في ورق الترشيح ، لإنشاء غرفة رطبة. استخدم وحدة تخزين لتشبع الورق دون وضع الماء الزائد. ختم طبق بتري مع فيلم تتشبث وتحديده مع رمز العزل المعني. الحفاظ على الأطباق في الظلام في 25-27 درجة مئوية لمدة 3-7 أيام.
- تقييم نمو الخيوط في الشريحة الزجاجية وغطاء الغطاء. يتم إنتاج شريحتين من كل مجموعة ثقافة شرائح ، واحدة باستخدام الشريحة الزجاجية مع خيوط وغطاء التعقيم ، والثانية باستخدام غطاء الغطاء مع خيوط وشريحة زجاجية أخرى.
- بعد ملاحظة نمو hyphal ، افصل مربع الوسط بعناية عن الشريحة الزجاجية (الشكل 2B) ، وقم بتركيب الشريحتين باستخدام بقعة مختارة (الخطوة 5.5) ، وقم بتحليلها تحت المجهر الضوئي. تذكر تحديد رمز العزل على الشريحة. لإنتاج شرائح شبه دائمة ، أغلق غطاء الغطاء بطلاء أظافر شفاف.
- لإنتاج شرائح دائمة ، اغسل الصبغة بعناية من خيوط ملتصقة بعد تلطيخها واترك الشريحة تجف. قم بالتركيب باستخدام وسيط تركيب سريع (لمزيد من التفاصيل ، اقرأ Pena-Passos et al.10).
ملاحظة: عيب إنتاج شريحة دائمة باستخدام هذه التقنية هو أنه يمكن غسل الجراثيم والهياكل غير الملتصقة بالزجاج.
- طرق تلطيخ ومراقبة خيوط
- اللاكتوفينول الأزرق القطني (LPCB) 21: أضف 20 مل من حمض اللاكتيك و 40 مل من الجلسرين و 20 مل من الماء المقطر. قم بإذابة 20 جم من بلورات الفينول في هذا المحلول عن طريق التسخين برفق. حل 0.05 غرام من الميثيل الأزرق (القطن الأزرق ، أو 2 مل من محلول مائي 1 ٪). يمكن أيضا شراء LPCB بسهولة معد بالفعل.
تنبيه: الفينول شديد السمية ومتقلب. التلاعب بها حصرا داخل غطاء الدخان وارتداء القفازات. - التولويدين الأزرق O10 (TBO): تحضير 0.05٪ TBO في محلول فوسفات 0.1 M (درجة الحموضة 6.8).
- الكونغوالأحمر 22،23،24: تحضير محلول من 1 ٪ الكونغو الأحمر في الماء المقطر وتصفيتها. احتضان لمدة 5-10 دقائق. يمكن تطبيق هذه الصبغة أيضا على الفحص المجهري الفلوري25.
- عند مراقبة وتصوير خيوط فطرية تحت المجهر الضوئي ، استشر مصادر ببليوغرافية متنوعة للمساعدة في تحديد الهياكل (تحقق من المناقشة).
- اللاكتوفينول الأزرق القطني (LPCB) 21: أضف 20 مل من حمض اللاكتيك و 40 مل من الجلسرين و 20 مل من الماء المقطر. قم بإذابة 20 جم من بلورات الفينول في هذا المحلول عن طريق التسخين برفق. حل 0.05 غرام من الميثيل الأزرق (القطن الأزرق ، أو 2 مل من محلول مائي 1 ٪). يمكن أيضا شراء LPCB بسهولة معد بالفعل.

الشكل 2: إجراءات زراعة شرائح الفطريات الخيطية . (أ) التكوين التخطيطي لمجموعة أدوات زراعة الشرائح، حيث تشير الأرقام إلى ترتيب ترتيب العناصر. (ب) فصل مربع وسط الاستزراع بعد ملاحظة نمو غشاء في الشريحة الزجاجية وانزلاق الغطاء. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
6. استخراج الحمض النووي الكلي من العزلات الفطرية (بروتوكول محلي الصنع26 مع تعديلات 27)
ملاحظة: يجب أن تكون كل مادة ومحلول وكاشف مستخدم في هذا القسم معقمة. تلك التي لا يمكن شراؤها معقمة بالفعل يجب تعقيمها عند 121 درجة مئوية لمدة 20 دقيقة. ارتد القفازات أثناء البروتوكول بأكمله وقم بإجراء بعض المراحل داخل غطاء الدخان.
- تحضير المخزن المؤقت للاستخراج: 1٪ كبريتات دوديسيل الصوديوم (SDS) ، 250 مللي مول كلوريد الصوديوم ، 200 مللي متر Tris-HCl (درجة الحموضة 8.0) ، و 25 مللي متر حمض الإيثيلين ديامينيترايتيك (EDTA). تنمو العزلات المنقاة في 39 جم / لتر PDA لمدة 7-14 يوما.
- كشط بعناية mycelium من عزل باستخدام ملعقة أو ملعقة ونقل شظايا إلى هاون معقم ، وتجنب نقل وسط الثقافة مع الركام خيوط. باستخدام مدقة الخزف ، قم بطحن الفطريات بالنيتروجين السائل إلى مسحوق ناعم. لا تدع النخلة تذوب ، مضيفا النيتروجين لتجنب ذلك.
- أضف 1 مل من المخزن المؤقت للاستخراج في أنبوب طرد مركزي صغير سعة 2 مل وضع العينة الأرضية حتى علامة 1.5 مل. حرك محتوى الأنابيب برفق للتجانس.
- حرك الأنابيب في دوامة لمدة 5 ثوان وضعها في كتلة حرارية عند 65 درجة مئوية لمدة 20 دقيقة. تجانس المحتوى بعناية عن طريق الانعكاس كل 7-10 دقائق.
- أجهزة الطرد المركزي الأنابيب عند 10000 × جم لمدة 10 دقائق عند 4 درجات مئوية. انقل 800 ميكرولتر من المرحلة العليا إلى أنبوب طرد مركزي دقيق جديد سعة 2 مل ، وأضف 800 ميكرولتر من الفينول إلى الأنابيب ، وامزج المحتوى عن طريق الانقلاب.
تنبيه: الفينول هو كاشف شديد السمية ومتقلبة. يمكن أن يسبب حمامي ، الغرغرينا ، ونخر الأنسجة. عند استنشاقه ، يمكن أن يسبب ضيق التنفس والسعال. يمكن أن يؤدي الامتصاص الجهازي إلى تلف الكبد والكلى والجهاز العصبي المركزي. تعامل مع الفينول حصريا داخل غطاء الدخان وارتد القفازات.
ملاحظة: من الخطوة التالية فصاعدا ، استخدم القفازات وقم بإجراء البروتوكول داخل غطاء الدخان. - أجهزة الطرد المركزي الأنابيب عند 10000 × جم لمدة 10 دقائق عند 4 درجات مئوية ونقل 800 ميكرولتر من المرحلة العليا إلى أنبوب جديد سعة 2 مل ، مع تجنب نقل محتوى الطور السفلي بعناية.
- أضف 400 ميكرولتر من الفينول و 400 ميكرولتر من الكلوروفورم إلى الأنابيب واخلط المحتوى عن طريق الانقلاب. أجهزة الطرد المركزي لهم في 10000 × غرام لمدة 10 دقائق في 4 درجة مئوية.
تنبيه: الكلوروفورم هو كاشف شديد السمية ومتطاير. يمكن أن يسبب تهيجا وإصابات عند ملامسته للجلد ، وإذا تم استنشاقه ، فإنه يؤثر على الجهاز العصبي المركزي والجهاز التنفسي القلبي والكبد والكلى. تعامل مع الكلوروفورم حصريا داخل غطاء الدخان وارتداء القفازات. - استرد 800 ميكرولتر أو أقل من المرحلة العليا إلى أنبوب جديد سعة 2 مل. أضف 800 ميكرولتر من الكلوروفورم ، وامزج المحتوى عن طريق الانقلاب ، وأجهزة الطرد المركزي عند 10000 × جم لمدة 10 دقائق عند 4 درجات مئوية.
ملاحظة: في هذه الخطوة ، يجب عدم نقل أي بقايا من المرحلة السفلية إلى أنابيب جديدة. وبالتالي ، كن حذرا للغاية عند استعادة المرحلة العليا. - نقل 600-800 ميكرولتر من المرحلة العليا إلى أنبوب جديد 1.5 مل وإضافة 450 ميكرولتر من الأيزوبروبانول. امزج المحتوى عن طريق الانعكاس واحتضانه على حرارة 25 درجة مئوية لمدة 5 دقائق.
- قم بطرد الأنابيب عند 10000 × جم لمدة 5 دقائق عند 4 درجات مئوية وتخلص من المادة الطافية باستخدام ماصة ميكروية. احرص على عدم التخلص من الحبيبات المودعة في قاع الأنبوب.
- أضف 500 ميكرولتر من الإيثانول بنسبة 80٪ وأجهزة الطرد المركزي لمدة 5 دقائق. كرر مرتين في حالة عدم توضيح الحبيبات.
- قم بإزالة الإيثانول باستخدام ماصة دقيقة وجفف الحبيبات على حرارة 37 درجة مئوية لمدة 30-60 دقيقة. أضف 30-50 ميكرولتر من الماء منزوع الأيونات ، واستخلص الحبيبات باستخدام ماصة صغيرة.
- حافظ على الأنابيب عند 4 درجات مئوية طوال الليل لشطف الحمض النووي بالكامل وقم بتجميد المحتوى عند -20 درجة مئوية.
7. استخراج الحمض النووي الكلي من أعضاء النبات لمنهجية ترميز metabarcoding (مجموعة تجارية)
ملاحظة: بالنسبة للمنهجية التالية ، من الضروري شراء المجموعة التجارية المشار إليها في جدول المواد كمجموعة لاستخراج الحمض النووي للتربة. يجب أن تكون كل مادة ومحلول وكاشف مستخدم في هذا القسم معقمة. تلك التي لا يمكن شراؤها معقمة بالفعل يجب تعقيمها عند 121 درجة مئوية لمدة 20 دقيقة. يوصى بشدة بارتداء القفازات أثناء البروتوكول بأكمله ، ويمكن إجراء الخطوات داخل غطاء التدفق الرقائقي. تم تعديل البروتوكول الموصوف من De Souza et al.12 ، من البروتوكول المفصل من قبل الشركة المصنعة.
- باستخدام مدقات البورسلين وقذائف الهاون ، قم بطحن الجذور التي تم جمعها باتباع الخطوة 1.2 في النيتروجين السائل ، مما يقلل العينات إلى مسحوق ناعم. أضف 0.3 جم من العينات الأرضية إلى أنابيب PowerBead وحركها برفق للتجانس.
- أضف 60 ميكرولتر من المحلول C1 (مضمن في المجموعة) إلى أنابيب PowerBead وامزج المحتوى عن طريق الانقلاب. باستخدام خالط الأنسجة ومحلل الخلايا (جدول المواد) ، اربط الأنابيب بإحكام بالدعم الكافي ، وقم بإقران الدعم بالدوامة ، وابدأ تشغيل الجهاز بأقصى سرعة لمدة 10-20 دقيقة.
ملاحظة: في حالة ترسيب محلول C1 ، قم بتسخينه على حرارة 60 درجة مئوية حتى يذوب تماما. - أجهزة الطرد المركزي الأنابيب عند 10000 × جم لمدة 30 ثانية عند 25 درجة مئوية. نقل 500 ميكرولتر من المادة الطافية إلى أنابيب الطرد المركزي الدقيقة 2 مل. قد يكون المحتوى المنقول جسيمات.
- أضف 250 ميكرولتر من المحلول C2 إلى الأنابيب وحركها في دوامة لمدة 5 ثوان. احتضان في 4 درجة مئوية لمدة 5 دقائق ثم الطرد المركزي في 10000 × غرام لمدة 1-2 دقيقة عند 25 درجة مئوية.
- نقل أكثر من 600 ميكرولتر من المادة الطافية إلى أنابيب 2 مل جديدة ، وتجنب الحبيبات. أضف 200 ميكرولتر من المحلول C3 وحرك على دوامة لمدة 5 ثوان.
- احتضان في 4 درجة مئوية لمدة 5 دقائق ثم أجهزة الطرد المركزي في 10000 × غرام لمدة 1 دقيقة في 25 درجة مئوية. في هذه المرحلة ، تأكد من أن المادة الطافية ليست جسيمات.
- نقل أكثر من 750 ميكرولتر من المادة الطافية إلى أنابيب 2 مل جديدة ، وتجنب الحبيبات. تجانس المحلول C4 جيدا ، أضف 1100 ميكرولتر من المحلول C4 إلى المادة الطافية ، وحرك في دوامة لمدة 5 ثوان.
- قم بتحميل 675 ميكرولتر من محتوى الأنابيب في أعمدة MB Spin ، فوق المرشح ، وأجهزة الطرد المركزي عند 10000 × g لمدة 1 دقيقة عند 25 درجة مئوية. تخلص من المحتوى السائل.
- كرر الخطوة السابقة مرتين حتى تتم معالجة كل محتوى كل أنبوب. ثم أضف 500 ميكرولتر من المحلول C5 في وسط المرشح الموجود في العمود العلوي للأنبوب وأجهزة الطرد المركزي عند 10000 × جم لمدة 30 ثانية عند 25 درجة مئوية.
- تخلص من المحتوى السائل وأجهزة الطرد المركزي مرة أخرى في ظل نفس ظروف الخطوة السابقة. انقل العمود العلوي لعمود MB Spin بعناية إلى أنابيب طرد مركزي دقيقة جديدة سعة 2 مل ، وتجنب تقطير أي محتوى سائل في العمود.
- أضف 85-100 ميكرولتر من المحلول C6 إلى مركز المرشح وانتظر 1 دقيقة. أجهزة الطرد المركزي عند 10000 × جم لمدة 30 ثانية عند 25 درجة مئوية وتجاهل عمود الدوران MB. قم بتخزين الأنابيب في درجة حرارة -80 درجة مئوية.
8. قياس كمية الحمض النووي في مقياس الطيف الضوئي (تحقق من جدول المواد)
- باستخدام مقياس الطيف الضوئي المشار إليه ، افتح البرنامج. حدد الخيار حمض نووي ، واختر الخيار DNA ، واضبط التركيز على ng / μL.
- أضف 1 ميكرولتر من الماء منزوع الأيونات إلى كاشف مقياس الطيف الضوئي وقم بالمعايرة عن طريق تحديد الخيار فارغ. بعد القراءة ، امسح الكاشف برفق بورق مناديل ناعم.
- قم بتسمية عينة الحقل برمز العزل للعينة المراد قراءتها وضع 1 ميكرولتر منها في كاشف الجهاز. حدد الخيار قياس; يتم إنشاء رسم بياني وجدول بالنتائج.
- كرر الخطوة 8.3 حتى تتم قراءة جميع العينات. يوصى بحفظ الجدول بالنتائج التي تم إنشاؤها للتسجيل والتحليل: حدد الخيار التقارير والموقع الذي سيتم حفظ ملف .xml فيه.
- أضف 5 ميكرولتر من الماء منزوع الأيونات إلى الكاشف ، وانتظر عدة دقائق ، وامسحه برفق بورق مناديل ناعم.
النتائج
في بروتوكول العزل ، بالنظر إلى وجود تلوث من المياه المستخدمة في الغسيل الأخير ويتم اكتشاف التلوث أيضا في أطباق بتري بشظايا ملقحة ، يمكن اتخاذ إجراءات مختلفة ، اعتمادا على نوع الملوث (الجدول 1). يجب تكرار هذا الإجراء من البداية في حالة وجود ملوثات فطرية شديدة التبويض ، والتي تقدم أيضا نموا متسارعا ، وبكتيريا مضاعفة بشكل مكثف ، ومقاومة للمضادات الحيوية المختارة. بدلا من ذلك ، إذا كان الملوث الفطري يمثل نموا بطيئا أو لا يتكاثر ، فمن الممكن ببساطة تجنب عزله في الخطوات اللاحقة للبروتوكول. أخيرا ، يمكن أيضا تجنب التلوث بالسلالات البكتيرية التي تتكاثر ببطء بسهولة في الخطوات الخلفية ، خاصة في التنقية ، عند استعادة الخيوط.
في جميع الحالات المقدمة سابقا ، فإن السيناريو المثالي هو إعادة إجراء التطهير باستخدام عينات أخرى وتركيب شظايا النبات في وسط استزراع يجمع بين المضادات الحيوية الأخرى ، مع مجموعة واسعة من الإجراءات ، في حالات البكتيريا المقاومة التي تلوث الأطباق الأولى. ومع ذلك ، بالنظر إلى الصعوبات التي ينطوي عليها جمع عينات جديدة والحصول على أعضاء من النباتات الفطرية ، يمكن حل بعض الحالات بنجاح في المراحل اللاحقة من البروتوكول ، كما هو موضح في الجدول 1.
| الملوثات | خاصية الملوثات | النتيجة المحتملة للتلوث | الإجراء المطلوب | |||
| بكتيريا | الضرب المكثف | تثبيط كلي أو جزئي لنمو النباتات الداخلية ذات الاهتمام | إعادة تشغيل العزل من البداية | |||
| الضرب البطيء | عزل البكتيريا جنبا إلى جنب مع endophyte من الفائدة | تجنب مستعمرات البكتيريا أثناء التنقية | ||||
| فطريات | نمو قوي و / أو تبويضات عالية | يجعل من المستحيل عزل و / أو تنقية النباتات الداخلية ذات الأهمية | إعادة تشغيل العزل من البداية | |||
| النمو البطيء و / أو عدم التبويض | عزل الملوث عن طريق الخطأ | تجنب عزل الملوث | ||||
الجدول 1: وصف الملوثات المحتملة في عملية عزل الفطريات الداخلية ، وعواقب التلوث ، وإجراءات التخفيف.
بعد 5 أيام من تركيب شظايا الأعضاء في وسط المساعد الرقمي الشخصي ، من الممكن تصور نمو مجموعات صغيرة من الفطريات الفطرية الخيطية ، الخارجة من داخل الشظايا (الشكل 3). يجب أن يؤدي كل نمط مورفوتايب فطري إلى عزل فطري بنهاية بروتوكول العزل ، مع الأخذ في الاعتبار أن كل واحد منهم يجب أن يكون مخططا في طبق بتري جديد مع وسط AA للتنقية. ينصح بعدم التخلص من الأطباق الأصلية من تركيب الجزء قبل إكمال بروتوكول العزل بالكامل. يمكن الاحتفاظ بها في الثلاجة عند 4 درجات مئوية حتى يتم الحصول على المستعمرات المنقى. أيضا ، فيما يتعلق بهذا الجزء من البروتوكول ، يمكن أن يكون تحليل IF مفيدا بشكل كبير في تقييم النسبة المئوية لعينات الأنسجة التي تؤدي إلى الفطريات المعزولة بين إجمالي العينات المركبة.
الشكل 3: شظايا الجذر للعزل الفطري في أجار سكر العنب في البطاطس. الفطريات الداخلية القابلة للزراعة تنمو من شظايا جذر السحلية الفطرية بعد حوالي 5 أيام من الحضانة. يحتوي كل طبق بتري (A و B و C) على خمس شظايا جذرية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
بعد 3 أيام من حضانة أطباق AA لتنقية العزل ، كان ينبغي أن تنمو المستعمرات الدقيقة ، غير المحسوسة تقريبا ، من السطور في وسط AA. في هذه المرحلة ، في حالة وجود أي تلوث من البكتيريا بطيئة النمو في أطباق العزل ، فمن الممكن أن تكون هذه البكتيريا قد تم نقلها أيضا إلى أطباق AA مع خيوط الفطريات الفطرية المختارة. إذا كان الأمر كذلك ، فستقتصر البكتيريا على مناطق السطور ، مع نمو ضئيل عند مقارنتها بالفطريات ، مما يسمح باستعادة الفطريات التي تهم أطباق PDA الجديدة فقط.
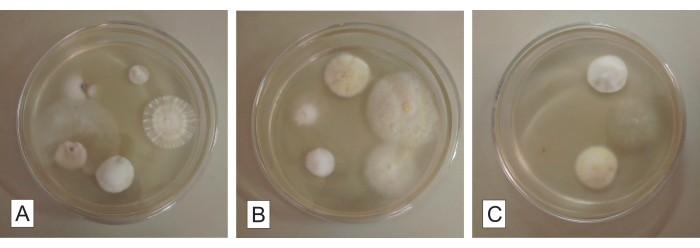
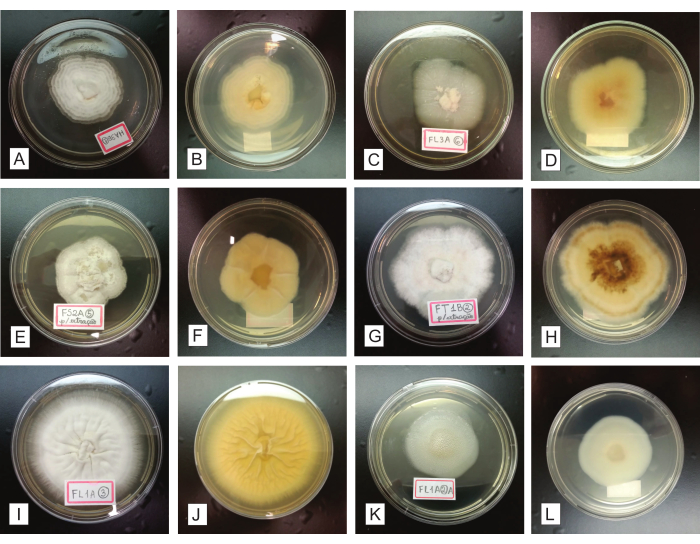
خلال 7-14 يوما من تلقيح العزلات الفطرية المنقاة في أطباق PDA ، يجب أن تنمو المستعمرة النقية بالطرد المركزي (من مركز الطبق إلى محيطه) ، وتشكل فطريات دائرية وحيدة (الشكل 4). يمكن تحديد الملوثات المحتملة بسهولة في هذه المرحلة ، لأنها تضر بشكل كبير بتجانس المستعمرة فيما يتعلق بنموها وشكلها وجانبها ولونها وإنتاج الصباغ في الوسط وما إلى ذلك (الشكل 5). بافتراض أن المستعمرات النهائية التي تم الحصول عليها ليست نقية ، يجب تقديم الفطريات التي نمت في البداية من شظايا الأعضاء مرة أخرى إلى إجراءات التنقية ، عن طريق التعرق والاستزراع الفرعي (الخطوة 2.4). من الممكن استعادة العزلات إما من الأعضاء المثبتة في البداية أو أطباق العزل النهائية التي تحتوي على ثقافات غير متجانسة.
الشكل 4: تمثيل العزلات الفطرية المنقاة ، التي نمت لمدة 7-14 يوما في وسط زراعة القناة الشريانية السالكة (PDA). في العمودين الأول والثالث (A و C و E و G و I و K) ، تظهر المستعمرات المسجلة من الجانب العلوي. يقدم العمودان الثاني والرابع (B و D و F و H و J و L) نفس المستعمرات ، على التوالي من الجانب السفلي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: تمثيل العزلات الفطرية غير النقية ، التي نمت لمدة 7-14 يوما في وسط زراعة القناة الشريانية السالوانية. في العمود الأول (A و D و G) ، يظهر منظر عام للمستعمرات من الجانب العلوي ؛ يوضح العمود الثاني (B و E و F) المستعمرات بالتفصيل ؛ يظهر العمود الثالث (C و F و I) المستعمرات من الجانب السفلي. تمثل الأرقام أنماطا مورفطرية مختلفة موجودة في كل طبق ، وتمثل الخطوط حدودا دقيقة بين العزلات الفطرية المختلفة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
لا ينبغي الحفاظ على العزلات باستخدام طريقة تخزين واحدة ، لأن كل فطر قد يمثل حساسية أكثر أو أقل لكل طريقة موصوفة. ينصح بشدة باختيار نوعين على الأقل من التخزين لكل عزل فطري ، مما يضمن المزيد من فرص النجاح في الحفاظ عليه. نسلط الضوء على أن عدم صلاحية الفطريات المحفوظة في كاستيلاني أو الزيوت المعدنية متوقعة بعد 6 أشهر أو أقل. يجب على الباحثين التفكير فيما إذا كانت هذه هي طرق الحفظ الوحيدة المختارة ، لتجنب الخسائر غير المتوقعة المحتملة للعزلات. لتمديد هذه الفترة المحدودة ، من الممكن إعادة تنشيط العزلات الفطرية عن طريق زراعتها في وسط PDA (39 جم / لتر) لمدة 2-3 أسابيع ثم تخزينها مرة أخرى. بعد فترة من التخزين ، من المتوقع أن تقدم العزلات نموا أبطأ ، مقارنة بمعدل النمو المرصود قبل الحفاظ عليها ، والمستعمرات ذات الجوانب الأقل نشاطا (أي أقل كثافة ومختلفة في اللون). إن الاستزراع الجزئي عدة مرات في وسط استزراع غني بالمغذيات يكفي لإعادة تأسيس هذه الخصائص.
عند تقييم التشكل الكلي للمستعمرات التي تم الحصول عليها في إجراء العزل ، يجب جمع البيانات النوعية ، مع مراعاة أكبر عدد ممكن من الخصائص: (أ) لون المستعمرة (العلوي والسفلي) ، والذي يمكن تحليله باستخدام أدلة الألوان المطبوعة (على سبيل المثال ، Rayner 28 ، Kornerup and Wanscher 29 ، Ridgway 30) ؛ (ب) لون المستعمرة (العلوي والسفلي) ، والذي يمكن تحليله باستخدام أدلة الألوان المطبوعة (على سبيل المثال ، Rayner 28 ، Kornerup and Wanscher 29 ، Ridgway 30) ؛ (ب) لون المستعمرة (العلوي والسفلي) ؛ (ب) لون المستعمرة (العلوي والسفلي) ؛ (ب) لون المستعمرة (العلوي والسفلي) ؛ (ب) لون المستعمرة (العلوي والسفلي) ؛ (ب) لون المستعمرة (العلوي والسفلي) ، والذي يمكن تحليله باستخدام أدلة الألوان المطبوعة (على سبيل المثال ، Rayner28 ، Kornerup and Wanscher29 ، Ridgway30) ؛ (ب) لون المستعمرة (العلوي والسفلي) ؛ (ب (ب) عتامة المستعمرة: شفافة، معتمة، شفافة؛ (ج) أصباغ قابلة للانتشار في الوسط31 (الحضور/الغياب واللون)؛ (د) الإفرازات31 (الحضور/الغياب، اللون، المظهر العام)؛ (ه) الهياكل العيانية31 (الحضور/الغياب، والنوع، والمظهر؛ مثل التصلب، والبيكنيديا)؛ (و) الفطريات الهوائية والمغمورة19،32،21 (الحضور/الغياب، المظهر الضئيل أو الوفير)؛ (ز) مظهر الهامش19 (اللون والشكل والتوحيد - مغمور أو جوي) ؛ و (ح) تضاريس المستعمرة (مكدسة ، مجعدة ، كريتريفورم ، مسطحة ، إلخ) ، المظهر العام والملمس - قطني ، مخملي ، مساحيق ، صوفي ، دهني (شمعي) ، مجعد ، طباشيري ، غروي ، جلدي ، شائك ، إلخ.19،21.
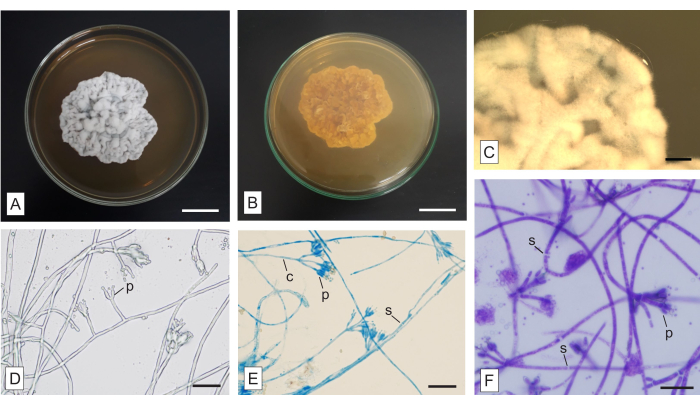
الشكل 6: التشكل الكلي والمجهري لفطر مجهول الهوية معزول من السحلية الفطرية غير المتجانسة Wullschlaegelia aphylla. (أ) الجوانب العلوية و (ب) السفلية للمستعمرة ، (ج) منظر مضخم للخيوط الهوائية (كما يظهر في المجهر المجسم). التشكل المجهري للخيوط (D) بدون بقعة وملطخة ب (E) LPCB و (F) TBO. الاختصارات: c = conidiophore ، p = phialide ، s = الحاجز. قضبان المقياس: أ ، ب = 2 سم ؛ ج = 2 مم ؛ D-F = 20 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
في الشكل 6 ، تظهر مستعمرة معزولة عن الجذور المغزلية لسحلية التغذية الفطرية Wullschlaegelia aphylla ، بتطبيق المنهجية الموصوفة. المستعمرة بيضاء إلى رمادية على الجانب العلوي (الشكل 6 أ) وبنية على الوجه السفلي (الشكل 6 ب). إنه معتم ، مع عدم وجود أصباغ قابلة للانتشار في الوسط ولا إفرازات. الميسيليا هوائية وفيرة ، والهوامش غير منتظمة وهوائية ، والمستعمرة لها نسيج مخملي وتضاريس مجعدة (الشكل 6 أ). الهياكل العيانية غائبة.
طريقة زراعة الشرائح تقليدية ومفيدة ، وعلى الرغم من أنها تستغرق وقتا طويلا ، إلا أنه يمكن تطبيقها لإنتاج شرائح دائمة يمكن فحصها بعد ذلك. يمكن استخدام الأصباغ المختلفة المعروضة هنا لإثبات الهياكل المهمة ، وتتطلب اختبارات في العينات ، لتحديد وقت الحضانة الأكثر ملاءمة. الكونغو الأحمر و TBO هي بقع للأغراض العامة. الكونغو الأحمر مناسب لإظهار بعض الهياكل الحساسة (قراءة إضافية: Malloch22). يلطخ TBO محتوى الخلية بشكل أكثر كثافة من جدار الخلية الفطرية (الشكل 6F). على الرغم من كونها صبغة معتادة للهياكل النباتية وليست شائعة جدا في الفحص المجهري الفطري ، إلا أن TBO لها خاصية ميتاكروماتية مهمة33 ، والتي تفضل التطبيقات الأخرى ، مثل التحليل الفطري في الأنسجة النباتية10. LPCB هو صبغة مطبقة على نطاق واسع في تحليل الفطريات ، على الرغم من أنها تتطلب الحذر بسبب الفينول. القطن الأزرق (مرادف: أزرق الميثيل) هو البقعة ، وحمض اللاكتيك هو عامل تطهير ، والفينول عامل قتل21. LPCB لديه تقارب للكيتين ويظهر جدران البوغ والزخارف23,24. لا يتم تلطيخ الحاجز الفطري بواسطة LPCB (الشكل 6E) ولا TBO (الشكل 6F) ، مما يسهل تحديد هذه الهياكل. يعد تطبيق البقع مفيدا لإثبات الهياكل التي لا يمكن رؤيتها بسهولة عندما لا تكون الخيوط ملطخة (الشكل 6 د).
لاستخراج الحمض النووي من الفطريات وعينات الجذر ، يجب احترام كمية العينة الأرضية في النيتروجين السائل المراد إضافتها إلى مخزن الاستخراج ، بما لا يتجاوز الكمية المحددة في البروتوكول. يجب أن نسلط الضوء على أن كمية كبيرة من العينات المعالجة لا تمثل ببساطة تركيز عال من الحمض النووي دون عيوب كبيرة ، لأنها يمكن أن تؤثر بشكل كبير على جودة الحمض النووي النهائية. يحدث هذا عند تشبع المراحل التالية من تنقية الحمض النووي. إلى جانب ذلك ، فإن المركبات المفترضة المركزة التي تنتجها النباتات أو الفطريات (مثل الأصباغ والمستقلبات الثانوية) ، الموجودة في المحلول النهائي مع الحمض النووي ، قد تعمل على تقليل جودة الحمض النووي و / أو تثبيط تفاعل البوليميراز المتسلسل (PCR). هناك مشكلة أخرى يمكن أن تقلل بشكل كبير من جودة الحمض النووي وهي التخلص من وسط الاستزراع تماما مع الفطريات الفطرية وطحنها ، والتي يجب تجنبها بشدة. قد تكون بعض الكواشف الناتجة عن إجراء الاستخراج (مثل الفينول والكحول الإيثيلي و SDS) والمواد الأخرى (مثل الأصباغ الفطرية) مثبطات تتداخل مع تفاعل البوليميراز المتسلسل.
في مراحل تطهير الحمض النووي ، عند استخدام الفينول والكلوروفورم ، يجب أن يمثل الطافي دائما المرحلة بشوائب أقل ، وعادة ما يفهم أوضح مرحلة. خلال هذه المرحلة ، يجب عدم استرداد المرحلة السفلية عند التطلع إلى المادة الطافية التي سيتم نقلها إلى أنابيب جديدة. بحلول نهاية البروتوكول ، يجب أن تقدم الحبيبات (المكونة من الحمض النووي) لونا شفافا (مرغوبا فيه للغاية) إلى اللون الأبيض. في مرحلة التجفيف ، يعد الشروع في تجفيف الحمض النووي في كتلة حرارية أمرا أساسيا لتبخير الإيثانول تماما. بعد 12 ساعة عند 4 درجات مئوية ، يجب أن تكون الحبيبات قد استلاشت تماما في المحلول المائي المضاف إلى الأنابيب ، ولا تكون مرئية بعد ذلك. في حالة عدم اكتمال الشطف ، وكان تركيز الحمض النووي أقل بكثير من التركيز المثالي ، فمن الممكن الاحتفاظ بالمحلول مبردا لمدة 12 ساعة أخرى ، دون خسائر كبيرة في جودته.
تولد تحليلات الحمض النووي في البرنامج جدولا ، كما هو موضح في الجدول 2 ، حيث تتم الإشارة إلى البيانات المتعلقة بكمية الحمض النووي وجودته. يعطى القياس الكمي للحمض النووي (DNA) من خلال تركيز الأحماض النووية بالنانوجرام لكل ميكرولتر من العينة. بالنظر إلى التحديد الجزيئي للفطريات المعزولة ، يجب أن تحتوي عينات الحمض النووي على تركيز 200 نانوغرام / ميكرولتر تقريبا ، وهي مثالية لمراحل تفاعل البوليميراز المتسلسل. في حالات العينات ذات التركيزات العالية من الأحماض النووية ، يجب تخفيف القسمة من العينة ، مع تقريب التركيز إلى القيمة المذكورة سابقا. قد تشير العينات ذات التركيزات العالية بشكل مفرط ، مثل العينات 1 و 2 في الجدول 2 ، إلى اكتشاف خاطئ بسبب الملوثات في المحلول. وفي الوقت نفسه ، لا يزال من الممكن استخدام العينات ذات التركيزات المنخفضة من الحمض النووي ، مثل الرقم 7 (الجدول 2) ، لتفاعل البوليميراز المتسلسل ، وهو أمر مهم لتطبيق حجم أكبر من العينة في التفاعلات. فيما يتعلق بمعايير الجودة ، من المرضي أن تكون القسمة 260/280 و 260/230 بين 1.8 و 2.2 ، كما هو موضح في العينات 3 و 5 و 8 (الجدول 2). يجب تقديم العينات التي تقدم مثل هذه القيم (أقل بكثير أو أعلى) إلى عمليات استخراج الحمض النووي الجديدة ، كما هو موضح في العينات 9 و 10 من الجدول 2. في حالات العينات التي تحتوي على كمية كافية من الحمض النووي وتتجاوز الحد الأدنى من نطاق الجودة المثالي ، كما هو مقترح في قيم 260/280 و 260/230 في الرقمين 4 و 6 (الجدول 2) ، فإن التخفيف هو الإجراء الأكثر فائدة لجعل تركيز الحمض النووي مناسبا لتفاعل البوليميراز المتسلسل وتخفيف المثبطات المحتملة ، مثل الكواشف الأثرية من إجراء الاستخراج ، في العينات.
| عينة | حمض نووي مخروط. | وحدة | أ 260 | أ 280 | 260/280 | 260/230 | نوع العينة |
| 1 | 14491.7 | نانوغرام/ميكرولتر | 289.833 | 141.175 | 2.05 | 1.8 | دنا |
| 2 | 13359.3 | نانوغرام/ميكرولتر | 267.187 | 124.607 | 2.14 | 2.15 | دنا |
| 3 | 1137.6 | نانوغرام/ميكرولتر | 22.751 | 10.574 | 2.15 | 2.13 | دنا |
| 4 | 1472.6 | نانوغرام/ميكرولتر | 29.452 | 13.287 | 2.22 | 2.16 | دنا |
| 5 | 3464.8 | نانوغرام/ميكرولتر | 69.295 | 33.329 | 2.08 | 1.88 | دنا |
| 6 | 1884.2 | نانوغرام/ميكرولتر | 37.684 | 17.912 | 2.1 | 1.78 | دنا |
| 7 | 187.6 | نانوغرام/ميكرولتر | 3.751 | 1.834 | 2.05 | 2.06 | دنا |
| 8 | 1580.3 | نانوغرام/ميكرولتر | 31.607 | 15.281 | 2.07 | 1.98 | دنا |
| 9 | 923.3 | نانوغرام/ميكرولتر | 18.466 | 9.196 | 2.01 | 1.37 | دنا |
| 10 | 2414.4 | نانوغرام/ميكرولتر | 48.287 | 21.008 | 2.3 | 3.45 | دنا |
الجدول 2: النتائج المتولدة في البرنامج من عينات الحمض النووي الفطرية التي تم تحليلها في مقياس الطيف الضوئي.
يختلف تركيز الحمض النووي في عينات لتحليلات مشفر الميتاباركود، يختلف عن عينات الحمض النووي من الفطريات الداخلية المعزولة، ويجب أن يقدم كميات هائلة من جزيئات الحمض النووي المستخرجة، بجودة عالية ووزن جزيئي. يجب تقييم العينات عن طريق الكهربائي في هلام الأغاروز ، والحصول على أقصى قدر ممكن من السلامة ، مع القليل من التلطيخ أو عدم تلطيخ الجل.
Discussion
يعد التطهير السطحي للعينات النباتية أحد أهم المراحل في البروتوكول المقدم. لا تلوث في أطباق المساعد الشخصي الرقمي مع قطرات من الغسيل الأخير أمر مرغوب فيه للغاية. كثيرا ما يتم ملاحظة البكتيريا كملوثات في أطباق العزل ، وعادة ما تكون أكثر من الفطريات المبوغة المحمولة جوا ، مع الأخذ في الاعتبار أن البكتيريا الداخلية شائعة أيضا داخل الأنسجة النباتية3،11. وبالتالي ، فإن إضافة المضادات الحيوية في وسط الثقافة عند تثبيت شظايا الأعضاء أمر ضروري. يتم تحقيق نتائج أفضل عند الجمع بين أنواع مختلفة من المضادات الحيوية ، مما يؤدي إلى مجموعة أوسع من الإجراءات. هناك اعتبار مهم آخر وهو التحيز الجوهري في عزل الفطريات ، حيث أن استخدام PDA و AA سيختار حتما أنواعا معينة ويكره الآخرين. قد يؤدي الجمع بين وسائل الإعلام الثقافية الأخرى إلى تقليل التحيز ، على الرغم من عدم القضاء على هذه القيود9.
بشكل عام ، تقدم الفطريات التي تنتج الجراثيم أثناء نموها في أطباق بتري معدلات بقاء أعلى في بروتوكولات الحفظ ، سواء في درجات الحرارة المنخفضة أم لا ، وقد لا تتسامح العزلات غير الأبوية مع كاستيلاني أو حفظ الزيوت المعدنية34،35،36 ، لذلك قد تكون طريقة الحفظ بالتبريد حاسمة في مثل هذه الحالات. بالإضافة إلى ذلك ، قد تكون بعض العزلات حساسة للتجميد ، وتساعد إضافة المواد الواقية بالتبريد في الحفظ ، كما هو الحال في الطريقة المقدمة باستخدام الفيرميكوليت18. قد تكون خصائص المستعمرة والخصائص الفطرية مفيدة لتجميع العزلات ذات السمات المتشابهة ، مما يسهل الاختيار للاستخدامات في علاجات الإنبات التكافلية (كما هو مفصل بواسطة Pena-Passos et al.10). تساهم هذه الخصائص أيضا في اختيار طرق الحفظ المراد تطبيقها ، خاصة بالنظر إلى التبويض أو غيابه.
كما أن التوصيف المورفولوجي للعزلات يحسن ويكمل الأوصاف المورفولوجية المتاحة في الأدبيات المتخصصة ، خاصة عندما يرتبط بالتوصيف الجزيئي. على الرغم من كونه تحديا مع العديد من العزلات ، إلا أن توصيف الفطريات شكليا يستغرق وقتا طويلا ويعتمد على البيانات المنشورة. حتى لو تم التخطيط لإجراء التوصيف الجزيئي فقط ، فمن المستحسن الاحتفاظ بسجل فوتوغرافي لمظهر المستعمرة (macromorphology) ونشره كلما أمكن ذلك ، للمساهمة في إجراءات تحديد الهوية المستقبلية. من المهم أيضا الحفاظ على صور الأطباق حيث يتم تثبيت الشظايا ، للسماح بالمقارنة بين العزلات النهائية التي تم الحصول عليها والأنماط الشكلية التي لوحظت تنمو في أطباق التثبيت. في مثل هذه الحالة ، يجب زراعة الفطريات المقارنة في نفس النوع من الوسط. تم العثور على منهجيات إضافية في Currah et al.16 لتقييم الفطريات الفطرية الأوركيدية الشائعة ، مثل الثقافة على وسط حمض التانيك (TAM) للتمييز بين أجناس Epulorhiza (teleomorph: Tulasnella) و Ceratorhiza (teleomorph: Ceratobasidium) ، والثقافة على CMA لتحفيز الخلايا أحادية اللون لتوصيف الفطريات من مجمع ريزوكتونيا .
بالنظر إلى الطرق التفصيلية لمراقبة الخيوط الفطرية تحت المجهر الضوئي ، فإن حامل الندف وحامل الشريط اللاصق أسرع من ثقافة الشريحة ، على الرغم من أن طريقة تثبيت الندف ليست كافية لتحليل الجراثيم وقياس زوايا الفروع. يحافظ حامل الشريط اللاصق على تنظيم الفطريات بشكل أفضل من تقنية تثبيت الندف ، على الرغم من أن استخدام الشريط اللاصق ليس موثوقا به مثل ثقافة الشرائح لقياس زوايا الفروع (ملاحظة المؤلفين). ثقافة الشرائح ، على الرغم من كونها تستغرق وقتا طويلا ، هي التقنية الأكثر ملاءمة لإنتاج شرائح شبه دائمة ودائمة. يتم تحليل التشكل الكلي والجزئي بالنظر إلى الأدبيات. Webster and Weber32 هو مصدر عام واسع للمعلومات ومراجع إضافية. يوفر Currah et al.16 و Zettler و Corey37 معلومات مفيدة عن الفطريات الفطرية الأوركيدية. على الرغم من وصف الفطريات ذات الأهمية الطبية ، إلا أن Walsh et al.21 و McGinnis31 مفيدان أيضا في الخصائص العامة لمستعمرات الفطريات الخيطية ، والمعلومات المرئية / الوصفية ، والمراجع الإضافية للميكرومورفولوجيا الفطرية.
وفقا ل Yu et al.38 ، فإن تحليلات القياس الكمي للحمض النووي في مقياس الطيف الضوئي تقدم دقة ودقة كبيرة ، بما يتفق مع تحليلات تفاعل البوليميراز المتسلسل الكمية في الوقت الفعلي. ملاحظة مهمة هي أن بعض العزلات قد لا توفر عينات الحمض النووي نقية بشكل كاف لمراحل التحديد الجزيئي اللاحقة ، حيث أن النباتات الفطرية الفطرية للفطريات ذاتية التغذية متنوعة للغاية ، خاصة تلك المرتبطة بالنباتات الاستوائية39 ، وكذلك الأيضات المنتجة. ويمكن استخدام تحليلات مقياس الطيف الضوئي لتقييم مثل هذه الحالات والبروتوكولات المختلفة، أو تطبيق مجموعات تجارية لتنقية الحمض النووي للعينات. المراحل اللاحقة المقترحة في التحديد الجزيئي للعزلات هي تضخيم منطقة الفاصل الداخلي المنسوخ (ITS) والتسلسل. منطقة ITS عبارة عن حمض نووي ريبوسومي لفاصل الحمض النووي الريبوزي يستخدم على نطاق واسع في الأدبيات المتخصصة ويتم قبوله رسميا باعتباره الرمز الشريطي الرئيسي لتحديد الفطريات 9,40. يمكن تضخيمه بواسطة تفاعل البوليميراز المتسلسل باستخدام البادئات ITS1 و ITS441 ، ثم تسلسله في منصة سانجر42.
قد توفر تحليلات الترميز الميتابارتيكي ، إلى جانب السماح بالتحقيق في ثراء الكائنات الحية الدقيقة ووفرتها وتكوينها التصنيفي في العينات البيئية والنباتية ، نتائج تفاعلات إيجابية أو سلبية بين هذه الكائنات الحية الدقيقة12. تهدف مرحلة النقع باستخدام النيتروجين السائل المضاف إلى بروتوكول DNeasy PowerSoil القياسي إلى كسر أكبر عدد ممكن من الخلايا الفطرية فيما يتعلق بالأنسجة النباتية ، مما يتيح أخذ عينات أفضل من المجتمع الفطري في الأنسجة المنقوعة11. يجب أن تأخذ الخيارات التمهيدية للتسلسلات الفطرية (الرموز الشريطية) في التحديد الجزيئي في الاعتبار التداخل مع الحمض النووي للنبات. ننصح باستخدام الاشعال التي تضخم المناطق المتغيرة من جين 18S الفطري ، على سبيل المثال ، ITS1-5،8S-ITS243. بعد الحصول على عينات الحمض النووي ، تقوم الخطوات اللاحقة بإعداد المكتبات الميتاجينومية ، والتي تعتمد على منصة التسلسل المختارة ، والتسلسل الخلفي للمكتبات ، وتحليل البيانات التي تم الحصول عليها باستخدام أدوات المعلوماتية الحيوية. نوصي باستخدام منصة Illumina MiSeq ، والتي تمثل خيارا أقل تكلفة مع إنتاج مرتفع ، حيث تولد تسلسلات 250 نقطة أساس في فترات زمنية قصيرة11,44.
Disclosures
ليس لدى المؤلفين ما يفصحون عنه ولا تضارب في المصالح.
Acknowledgements
نشكر التمويل من FAPESP (2015/26479-6) و CNPq (447453/2014-9). تشكر JLSM CNPq على منح الإنتاجية (303664 / 2020-7). MPP يشكر Capes (منحة درجة الماجستير ، العملية 88887.600591 / 2021-00) و CNPq.
Materials
| Name | Company | Catalog Number | Comments |
| Adhesive tape | (from any company, for adhesive tape mount in micromorphological analyses) | ||
| Ampicillin | Sigma-Aldrich | A5354 | (for installation of plant fragments; other antibiotics may be used - check step 2.2.1) |
| Autoclave | (from any company, for materials sterilization in many steps) | ||
| Bacteriological agar | Sigma-Aldrich | A1296 | (for many steps) |
| C1, C2, C3, C4, C5, and C6 solutions | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Centrifuge | Merck/Eppendorf | 5810 G | (for total DNA extraction from fungal isolates) |
| Centrifuge tubes | Merck | CLS430828 | (for samples collection) |
| Chloroform | Sigma-Aldrich | C2432 | (for total DNA extraction from fungal isolates) |
| Congo red | Supelco | 75768 | (for hyphae staining) |
| Cryotubes | Merck | BR114831 | (for many steps) |
| Ethanol | Supelco | 100983 | It will be necessary to carry out the appropriate dilutions (for many steps) |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | 3609 | (for total DNA extraction from fungal isolates) |
| Filter paper | Merck | WHA10010155 | (for many steps) |
| Glass test tubes | Merck | CLS7082516 | (for cryopreservation in unhulled rice grains) |
| Glass wool | Supelco | 20411 | (for cryopreservation in unhulled rice grains) |
| Glucose | Sigma-Aldrich | G8270 | Or dextrose (for cryopreservation in vermiculite) |
| Glycerol | Sigma-Aldrich | G5516 | Or glycerin (for cryopreservation in vermiculite, for preparing LPCB) |
| Isopropanol | Sigma-Aldrich | 563935 | (for total DNA extraction from fungal isolates) |
| Lactic acid | Sigma-Aldrich | 252476 | (for preparing LPCB - hyphae staining) |
| Lactophenol blue solution (LPCB) | Sigma-Aldrich | 61335 | (for hyphae staining) |
| Laminar flow hood | (class I, from any company, for many steps) | ||
| Light microscope | (from any company, for hyphae observation) | ||
| MB Spin Columns | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Methyl blue (cotton blue) | Sigma-Aldrich | M5528 | (for preparing LPCB - hyphae staining) |
| Microcentrifuge tube (1.5 mL) | Merck | HS4323 | (for total DNA extraction from fungal isolates) |
| Microcentrifuge tube (2 mL) | Merck | BR780546 | (for many steps) |
| Mineral oil | (for preservation of fungal isolates) | ||
| Paper bags | Average size 150 mm x 200 mm (for samples collection) | ||
| Petri dish (Glass, 120 mm x 20 mm) | Merck/Pyrex | SLW1480/10D | (autoclavable, for fungi slide culture, prefer higher ones) |
| Petri dish (Glass, 50 mm x 17 mm) | Merck/Aldrich | Z740618 | (for purification of fungal isolates); alternatively: polystyrene petri dishes (sterile, γ-irradiated, non-autoclavable) |
| Petri dish (Glass, 80 mm x 15 mm) | Merck/Brand | BR455732 | (for installation of plant fragments); alternatively: polystyrene petri dishes (sterile, γ-irradiated, non-autoclavable) |
| Phenol | Sigma-Aldrich | P1037 | (for total DNA extraction from fungal isolates, for preparing LPCB) |
| Porcelain mortar | Sigma-Aldrich | Z247464 | (for total DNA extraction from fungal isolates) |
| Porcelain pestle | Sigma-Aldrich | Z247502 | (for total DNA extraction from fungal isolates) |
| Potato dextrose agar (PDA) | Millipore | P2182 | (for many steps) |
| PowerBead tubes | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Rapid mounting medium (Entellan) | Sigma-Aldrich | 1.0796 | (for fungi slide culture) |
| Silica gel | Supelco | 717185 | (for cryopreservation in unhulled rice grains) |
| Sodium chloride (NaCl) | Sigma-Aldrich | S9888 | (for total DNA extraction from fungal isolates) |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771 | Lauryl sulfate sodium salt (for total DNA extraction from fungal isolates) |
| Sodium hypochlorite (w/ 2% active chlorine) | (commercial product, for superficial desinfestation) | ||
| Soil DNA extraction kit (DNeasy PowerSoil kit) | Qiagen | 12888-50 | (for total DNA extraction from plant organs) |
| Spectrophotometer - Nanodrop 2000/2000c | ThermoFisher Scientific | ND2000CLAPTOP | (for total DNA extraction from plant organs) |
| Stereomicroscope | (=dissecting microscope, from any company, for macromorphological analyses) | ||
| Tetracycline | Sigma-Aldrich | T7660 | (for installation of plant fragments) |
| Thermoblock | Merck/Eppendorf | EP5362000035 | (or from other companies) |
| Tissue homogenizer and cell lyzer | SPEX SamplePrep | 2010 Geno/Grinder - Automated Tissue Homogenizer and Cell Lyzer (for total DNA extraction from plant organs) | |
| Toluidine blue O | Sigma-Aldrich/Harleco | 364-M | (for hyphae staining) |
| Trehalose | Sigma-Aldrich | T9531 | (for cryopreservation in vermiculite) |
| Tris Base Solution (Tris) | Sigma-Aldrich | T1699 | (for total DNA extraction from fungal isolates) |
| Unhulled rice grains | (for cryopreservation) | ||
| U-shaped glass rod | (or an adaptation - check step 5.4.1, for fungi slide culture) | ||
| Vermiculite | Fine granulometry (for cryopreservation in vermiculite) | ||
| Vortexer | Sigma-Aldrich/BenchMixer | BMSBV1000 | (for total DNA extraction from fungal isolates) |
| Yeast extract | Sigma-Aldrich | Y1625 | (for cryopreservation in vermiculite) |
References
- de Azevedo, J. L. Endophytic microorganisms. Ecologia Microbiana. , 117-137 (1998).
- Stone, J. K., Bacon, C. W., White, J. F. An overview of endophytic microbes: endophytism defined. Microbial Endophytes. , 17-44 (2000).
- Schulz, B., Boyle, C. What are Endophytes. Microbial Root Endophytes. , Springer-Verlag. Berlin. 1-13 (2006).
- Smith, S. E., Read, D. J. Mycorrhizal Symbiosis. , Elsevier Science Academic Press. London. (2008).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Ma, X., Kang, J., Nontachaiyapoom, S., Wen, T., Hyde, K. D. Non-mycorrhizal endophytic fungi from orchids. Current Science. 109 (1), 72-87 (2015).
- Favre-Godal, Q., Gourguillon, L., Lordel-Madeleine, S., Gindro, K., Choisy, P. Orchids and their mycorrhizal fungi: an insufficiently explored relationship. Mycorrhiza. 30 (1), 5-22 (2020).
- Sun, X., Guo, L. -D. Endophytic fungal diversity: review of traditional and molecular techniques. Mycology. 3 (1), 65-76 (2012).
- Pena-Passos, M., Sisti, L. S., Mayer, J. L. S. Microscopy techniques for interpreting fungal colonization in mycoheterotrophic plants tissues and symbiotic germination of seeds. Journal of Visualized Experiments. (183), e63777(2022).
- Araújo, W. L., et al. Endophytic microorganisms: Theoretical and Practical Aspects of Isolation and Characterization. 1st ed. 1, Santarém: UFOPA. 257(2014).
- de Souza, R. S. C., et al. Unlocking the bacterial and fungal communities assemblages of sugarcane microbiome. Scientific Reports. 6, 28774(2016).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589(2019).
- Araújo, W. L., et al. Variability and interactions between endophytic bacteria and fungi isolated from leaf tissues of citrus rootstocks. Canadian Journal of Microbiology. 47 (3), 229-236 (2001).
- Castellani, A. Further researches on the long viability and growth of many pathogenic fungi and some bacteria in sterile distilled water. Mycopathologia. 20 (1-2), 1-6 (1963).
- Currah, R. S., Zelmer, C. D., Hambleton, S., Richardson, K. A. Fungi from orchid mycorrhizas. Orchid Biology: Reviews and Perspectives, VII. , 117-170 (1997).
- Freitas, E. F. S., et al. Diversity of mycorrhizal Tulasnella associated with epiphytic and rupicolous orchids from the Brazilian Atlantic Forest, including four new species. Scientific Reports. 10 (1), 7069(2020).
- Sato, M., Inaba, S., Noguchi, M., Nakagiri, A. Vermiculite as a culture substrate greatly improves the viability of frozen cultures of ectomycorrhizal basidiomycetes. Fungal Biology. 124 (8), 742-751 (2020).
- Pereira, O. L., Kasuya, M. C. M., Borges, A. C., Araújo, E. F. D. Morphological and molecular characterization of mycorrhizal fungi isolated from neotropical orchids in Brazil. Canadian Journal of Botany. 83 (1), 54-65 (2005).
- Riddell, R. W. Permanent stained mycological preparations obtained by slide culture. Mycologia. 42 (2), 265-270 (1950).
- Walsh, T. J., Hayden, R. T., Larone, D. H. Larone's Medically Important Fungi: A Guide to Identification. , ASM Press. (2018).
- Malloch, D. Moulds: Isolation, Cultivation, Identification. , Available from: http://website.nbm-mnb.ca/mycologywebpages/Moulds/Moulds.html (1997).
- Smith, P. Microscopy: Chemical Reagents. British Mycological Society. , Available from: https://www.britmycolsoc.org.uk/field_mycology/microscopy/reagents (2022).
- Senanayake, I. C., et al. Morphological approaches in studying fungi: Collection, examination, isolation, sporulation and preservation. Mycosphere. 11 (1), 2678-2754 (2020).
- Slifkin, M., Cumbie, R. Congo red as a fluorochrome for the rapid detection of fungi. Journal of Clinical Microbiology. 26 (5), 827-830 (1988).
- Raeder, U., Broda, P. Rapid preparation of DNA from filamentous fungi. Letters in Applied Microbiology. 1 (1), 17-20 (1985).
- Martins, M. K., et al. Molecular characterization of endophytic microorganisms. Endophytic microorganisms: theoretical and practical aspects of isolation and characterization. 1st edition. , Santarém: UFOPA. 189-211 (2014).
- Rayner, R. W. A Mycological Colour Chart. Commonwealth Mycological Institute. , (1970).
- Kornerup, A., Wanscher, J. H. Methuen Handbook of Colour. Methuen handbook of colour. , Methuen & Co. Ltd. London. (1967).
- Ridgway, R. Color Standards and Color Nomenclature. , Washington, DC. Published by the author (1912).
- McGinnis, M. R. Laboratory Handbook of Medical Mycology. , Elsevier Science. (2012).
- Webster, J., Weber, R. Introduction to Fungi. , Cambridge University Press. Cambridge, UK. (2007).
- Sridharan, G., Shankar, A. A. Toluidine blue: A review of its chemistry and clinical utility. Journal of Oral and Maxillofacial Pathology. 16 (2), 251-255 (2012).
- Smith, D., Onions, A. H. S. A comparison of some preservation techniques for fungi. Transactions of the British Mycological Society. 81 (3), 535-540 (1983).
- Ryan, M. J., Smith, D., Jeffries, P. A decision-based key to determine the most appropriate protocol for the preservation of fungi. World Journal of Microbiology and Biotechnology. 16 (2), 183-186 (2000).
- Lalaymia, I., Cranenbrouck, S., Declerck, S. Maintenance and preservation of ectomycorrhizal and arbuscular mycorrhizal fungi. Mycorrhiza. 24 (5), 323-337 (2014).
- Zettler, L. W., Corey, L. L. Orchid mycorrhizal fungi: isolation and identification techniques. Orchid Propagation: From Laboratories to Greenhouses-Methods and Protocols. , 27-59 (2018).
- Yu, S., Wang, Y., Li, X., Yu, F., Li, W. The factors affecting the reproducibility of micro-volume DNA mass quantification in Nanodrop 2000 spectrophotometer. Optik. 145, 555-560 (2017).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Schoch, C. L., et al. Nuclear ribosomal internal transcribed spacer (ITS) region as a universal DNA barcode marker for Fungi. Proceedings of the National Academy of Sciences. 109 (16), 6241-6246 (2012).
- White, T. J., Bruns, T., Lee, S., Taylor, J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR Protocols: A Guide to Methods and Applications. 18 (1), 315-322 (1990).
- Sanger, F., Nicklen, S., Coulson, A. R. DNA sequencing with chain-terminating inhibitors. Proceedings of the National Academy of Sciences. 74 (12), 5463-5467 (1977).
- Ranjard, L., et al. Characterization of bacterial and fungal soil communities by automated ribosomal intergenic spacer analysis fingerprints: biological and methodological variability. Applied and Environmental Microbiology. 67 (10), 4479-4487 (2001).
- Metzker, M. L. Sequencing technologies-the next generation. Nature Reviews Genetics. 11 (1), 31-46 (2010).
Erratum
Formal Correction: Erratum: Isolation, Characterization, and Total DNA Extraction to Identify Endophytic Fungi in Mycoheterotrophic Plants
Posted by JoVE Editors on 1/01/1970. Citeable Link.
An erratum was issued for: Isolation, Characterization, and Total DNA Extraction to Identify Endophytic Fungi in Mycoheterotrophic Plants. The Authors section was updated from:
Juliana Lishcka Sampaio Mayer
to:
Juliana Lischka Sampaio Mayer
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved