Method Article
Пробоподготовка и относительное количественное определение с использованием восстановительного метилирования аминов для исследований пептидомики
В этой статье
Резюме
В этой статье описывается метод пробоподготовки, основанный на тепловой инактивации для сохранения эндогенных пептидов, избегающих деградации посмертно, с последующим относительным количественным определением с использованием изотопной маркировки плюс LC-MS.
Аннотация
Пептидомику можно определить как качественный и количественный анализ пептидов в биологическом образце. Его основные применения включают идентификацию пептидных биомаркеров заболевания или экологического стресса, идентификацию нейропептидов, гормонов и биологически активных внутриклеточных пептидов, обнаружение антимикробных и нутрицевтических пептидов из гидролизатов белка и могут быть использованы в исследованиях для понимания протеолитических процессов. Недавний прогресс в подготовке образцов, методах разделения, методах масс-спектрометрии и вычислительных инструментах, связанных с секвенированием белка, способствовал увеличению числа идентифицированных пептидов и характеризуемых пептидов. Пептидомические исследования часто анализируют пептиды, которые естественным образом генерируются в клетках. Здесь описан протокол пробоподготовки, основанный на термоинактивации, который исключает активность протеазы и экстракцию в мягких условиях, поэтому нет расщепления пептидных связей. Кроме того, показано относительное количественное определение пептидов с использованием метки стабильных изотопов путем восстановительного метилирования аминов. Этот метод маркировки имеет некоторые преимущества, поскольку реагенты коммерчески доступны, недороги по сравнению с другими, химически стабильны и позволяют анализировать до пяти образцов за один прогон LC-MS.
Введение
«Омические» науки характеризуются глубоким анализом набора молекул, таких как ДНК, РНК, белки, пептиды, метаболиты и т.д. Эти крупномасштабные наборы данных (геномика, транскриптомика, протеомика, пептидомика, метаболомика и т. д.) произвели революцию в биологии и привели к продвинутому пониманию биологических процессов1. Термин пептидомика начал вводиться в начале 20 века, и некоторые авторы называли его ветвью протеомики2. Однако пептидомика имеет отличительные особенности, где основной интерес заключается в исследовании содержания естественно генерируемых пептидов в ходе клеточных процессов, а также характеристике биологической активности этих молекул3,4.
Первоначально исследования биологически активных пептидов были ограничены нейропептидами и гормональными пептидами через деградацию Эдмана и радиоиммуноанализ. Однако эти методики не позволяют провести глобальный анализ, в зависимости от выделения каждого пептида в высоких концентрациях, времени генерации антител, кроме возможности перекрестной реактивности5.
Анализ пептидомики стал возможен только после нескольких достижений в области жидкостной хроматографии, связанной с масс-спектрометрией (LC-MS) и проектами генома, которые предоставили комплексные пулы данных для исследований протеомики / пептидомики6,7. Кроме того, необходимо было установить специфический протокол экстракции пептидов для пептидов, потому что первые исследования, которые анализировали нейропептиды в глобальном масштабе в образцах мозга, показали, что на обнаружение влияет массивная деградация белков, которая происходит в основном в этой ткани через 1 мин после вскрытия. Присутствие этих пептидных фрагментов маскировало сигнал нейропептида и не представляло собой пептидом in vivo. Эта проблема решалась в основном применением быстрой нагревательной инактивации протеаз с помощью микроволнового облучения, что резко уменьшило присутствие этих фрагментов артефактов и позволило не только идентифицировать фрагменты нейропептидов, но и выявило наличие набора пептидов из цитозольных, митохондриальных и ядерных белков, отличающихся от деградома6,8,9.
Эти методологические процедуры позволили расширить пептидом за пределы известных нейропептидов, где сотни внутриклеточных пептидов, генерируемых главным образом действием протеасом, были идентифицированы в дрожжах10, рыбках данио11, тканях грызунов12 и клетках человека13. Было широко показано, что десятки этих внутриклеточных пептидов обладают как биологической, так и фармакологической активностью14,15. Кроме того, эти пептиды могут быть использованы в качестве биомаркеров заболевания и, возможно, имеют клиническое значение, как показано в спинномозговой жидкости у пациентов с внутричерепными мешковидными аневризмами16.
В настоящее время, помимо идентификации пептидных последовательностей, можно с помощью масс-спектрометрии получить данные абсолютного и относительного количественного определения. В абсолютном количественном определении уровни пептидов в биологическом образце сравниваются с синтетическими стандартами, в то время как в относительном количественном определении уровни пептидов сравниваются между двумя или более образцами17. Относительное количественное определение может быть выполнено с использованием следующих подходов: 1) «без меток»18; 2) метаболическая маркировка in vivo или 3) химическая маркировка. Последние два основаны на использовании стабильных изотопных форм, включенных в пептиды19,20. В анализе без меток уровни пептидов оцениваются с учетом силы сигнала (спектральных показателей) во время LC-MS18. Однако изотопная маркировка может получить более точные относительные уровни пептидов.
Во многих пептидомических исследованиях в качестве химической маркировки использовался триметиламмоний бутират (TMAB), а в последнее время было использовано восстановительное метилирование аминов (RMA) с дейтерированными и невейтерированными формами формальдегида и реагентов цианоборогидрида натрия11,21,22. Однако этикетки TMAB коммерчески недоступны, а процесс синтеза очень трудоемкий. С другой стороны, в RMA реагенты коммерчески доступны, недороги по сравнению с другими этикетками, процедура проста в выполнении, а меченые пептиды стабильны23,24.
Использование RMA включает в себя формирование основания Шиффа, позволяя пептидам реагировать с формальдегидом с последующей реакцией восстановления через цианоборогидрид. Эта реакция вызывает диметилирование свободных аминогрупп на N-концевых и лизиновых боковых цепях и монометилатах N-концевых пролинов. Поскольку остатки пролина часто редки на N-конце, практически все пептиды со свободными аминами на N-конце помечены двумя метильными группами23,24,25.
протокол
Следующая процедура экстракции пептидов и восстановительного метилирования была адаптирована из ранее опубликованных процедур24,25,26,27. Этот протокол следовал руководящим принципам Национального совета по контролю за экспериментами на животных (CONCEA) и был одобрен Комиссией по этике использования животных (CEUA) в Институте бионауки Государственного университета Сан-Паулу. Шаги протокола показаны на рисунке 1.
ПРИМЕЧАНИЕ: Приготовьте все водные растворы в сверхчистой воде.
1. Экстракция пептидов
- Клеточная культура
- Культивируйте клетки SHSY5Y в 15-сантиметровой чашке при 37 °C при 5% CO2 в модифицированной среде Dulbecco Eagle's, содержащей 15% фетальной бычьей сыворотки и 1% пенициллина-стрептомицина.
- Используйте 2-3 тарелки для каждого образца. Вырастите клетки до 100% слияния.
- После предполагаемого лечения промыть клетки дважды фосфатно-буферным физиологическим раствором. Затем добавьте 10 мл фосфатно-буферного физиологического раствора, соскоблите клетки и соберите в пробирку объемом 15 мл.
- Центрифугат при 800 х г в течение 5 мин и удаляют супернатант. Повторно суспендировать гранулу в 1 мл ультраочищенной деионизированной воды при 80 °C.
- Перенесите содержимое трубки (клеточного лизата) в микрофьюжную трубку объемом 2 мл.
- Ткани животных (в основном нервные ткани):
- Обезболить самца дикого типа Danio rerio (рыбок данио ) смертельной дозой MS 222 (100 мг/л) и немедленно подвергнуть его 8 с микроволнового излучения для инактивации пептидазы и протеазы.
ПРИМЕЧАНИЕ: Можно использовать микроволновую печь бытового типа. Микроволновая печь мощностью 900 Вт использовалась в течение 8-10 с на полной мощности. Используемая микроволновая печь должна быть в состоянии поднять температуру мозга до > 80 ° C в течение 10 с. Воспроизводимость при нагревании между образцами также будет достигнута при размещении ткани в том же месте в микроволновой печи. - После термоинактивации соберите весь мозг в микрофьюжную трубку объемом 2 мл и заморозьте при −80 °C до анализа.
- Повторно суспендировать образец ткани в 1 мл ультраочищенной деионизированной воды при 80 °C. Обработайте ткань ультразвуком с помощью зонда, используя 30 импульсов (4 Гц) 1 с.
ПРИМЕЧАНИЯ: Для тканей печени и почек используйте механический гомогенизатор при 10 000-30 000 об/мин в течение 20 с. Для мышечных тканей измельчите ткань в жидком азоте с помощью фарфорового тигля и пестика. Следующие этапы одинаковы для клеточного лизата или гомогенатной ткани.
- Обезболить самца дикого типа Danio rerio (рыбок данио ) смертельной дозой MS 222 (100 мг/л) и немедленно подвергнуть его 8 с микроволнового излучения для инактивации пептидазы и протеазы.
- Инкубируют клеточный лизат или гомогенатную ткань при 80 °C в течение 20 мин. Далее охладите его на льду в течение 10-30 мин.
- Добавляют 10 мкл 1 М HCl запасного раствора на каждый 1 мл объема образца для получения конечной концентрации 10 мМ. Перемешать путем вихря в течение 20 с и далее инкубировать на льду в течение 15 мин.
ПРИМЕЧАНИЕ: Перед подкислением убедитесь, что образец полностью охлажден, чтобы избежать разрыва пептидных связей, вызванных подкислением при повышенных температурах. - Центрифугируют клеточный лизат или гомогенатную ткань при 12 000 х г при 4 °C в течение 15 мин. Соберите супернатант в низкосвязывающие белковые микроцентрифужные трубки и храните его при -80 °C.
- Очистите ультрафильтрационные устройства (отсечные фильтры 10 кДа), добавив воду и центрифугу при 2300 х г в течение 3 мин. Повторите этот шаг еще два раза.
- Поместите супернатант в предварительно промытые отсечные фильтры 10 кДа и центрифугу при 2 300 х г при 4 °C в течение 50 мин в центрифуге с рефрижераторной обработкой. Проточный представляет собой пептидный экстракт.
- Обессоливание образцов на колоннах очистки обратной фазы в соответствии с инструкциями завода-изготовителя с использованием растворов ацетонитрила (ACN) и трифторуксусной кислоты (TFA), как описано ниже:
- Уравновешивайте колонку 1 мл 100% ACN.
- Промыть колонну 1 мл раствором 5% ACN с 0,1% TFA.
- Загрузите весь объем образца в колонку.
- Промыть колонну 1 мл раствором 5% ACN с 0,1% TFA
- Элюируют пептиды из колонки раствором 1,8 мл 100% ACN с 0,15% TFA в белковых низкосвязывающих микроцентрифужных трубках.
- Полностью высушите образец в вакуумной центрифуге. Установить метод концентрации органических растворителей и температуру на уровне 30 °C. Время концентрации контролируется на дисплее.
- Храните образцы при температуре −80°C до следующего шага.
2. Количественная оценка пептидов флуорескамином
ПРИМЕЧАНИЕ: Количество пептида может быть оценено с использованием флуорескамина при рН 6,8, как описано ранее11,28. Этот способ заключается в присоединении молекулы флуорескамина к первичным аминам, присутствующим в остатках лизина (К) и/или N-конце пептидов. Реакцию проводят при рН 6,8, чтобы гарантировать, что флуорескамин реагирует только с аминогруппами пептидов, а не со свободными аминокислотами. Флуорескамин измеряется с помощью спектрофлуорометра на длине волны возбуждения 370 нм и длине волны излучения 480 нм.
- Получают различные концентрации стандартного пептида (0,05, 0,1, 0,15, 0,2, 0,3, 0,5 и 0,7 мкг/мкл) и хранят аликвоты при -20 °C.
ПРИМЕЧАНИЕ: Пептид 5А (LTLRTKL) предлагается, поскольку он имеет известный состав и концентрацию. - Готовят раствор флуорескамина (0,3 мг/мл) в ацетоне. Aliquot быстро в микроцентрифужных трубках (1 мл), герметизируется с помощью парапленки и хранится при -20 °C в темноте.
- Приготовьте 0,2 М фосфатного буфера (ПБ) при рН 6,8.
ПРИМЕЧАНИЕ: Приготовьте 0,2 М ПБ, добавив 0,1 М фосфатного буфера pH 6,8 (26,85 мл Na2HPO3 1M) и 0,1 М фосфатного буфера pH 6,8 (23,15 мл NaH2PO3 1M) к 250 мл воды - Повторное суспендирование пептидных образцов в 100-200 мкл ультраочищенной воды.
- Пипетка 2,5 мкл стандартных концентраций пептидов и образцов на белой 96-луночной пластине для флуоресцентных анализов в трех экземплярах. Добавьте 25 мкл 0,2 М фосфатного буфера.
- Добавьте 12,5 мкл флуорескамина с помощью многоканальной пипетки. Мягко гомогенизируйте в течение 1 мин на орбитальном вращательном шейкере.
- Затем добавьте 110 мкл воды с помощью многоканальной пипетки, чтобы остановить реакцию.
ПРИМЕЧАНИЕ: Переложите раствор флуорескамина и сверхчистую воду в два резервуара, чтобы соединить эти растворы с помощью многоканальной пипетки. - Отрегулируйте следующие параметры считывания на спектрофлуорометре: считывание образцов сверху, длина волны возбуждения при 370 нм и длина волны излучения при 480 нм.
- Считывание пластины на спектрофторометре.
3. Восстановительное метилирование маркировки аминов
ПРИМЕЧАНИЕ: Данный изотопный метод маркировки основан на диметилировании аминных групп дейтерированными и недейтерированными формами формальдегидных и цианоборогидридных реагентов натрия. Конечный продукт этой реакции добавляет 28 Da, 30 Da, 32 Da, 34 Da или 36 Da к конечной массе каждого пептида в каждом доступном месте маркировки (лизин или N-терминал). Эта реакция производит разность m/z в пептидах, меченных различными формами, наблюдаемыми в спектре MS (таблица 1).
ВНИМАНИЕ: Для обработки этих соединений следует использовать надлежащее оборудование для обеспечения безопасности, и следует соблюдать осторожность, чтобы свести к минимуму воздействие. Процедуры с формальдегидными и цианоборогидридными реагентами натрия следует проводить в вытяжном шкафу, поскольку они очень токсичны (включая взвешивание цианоборогидрида натрия). Во время реакции закалки и подкисления может образовываться токсичный газ (цианистый водород).
- Приготовьте следующие свежие растворы из запаса или реагентов в день процедуры в сверхчистой воде:
- Разбавляют запас 37% формальдегида (CH2O) до 4%.
- Разбавляют запас 20% формальдегида дейтерированным (CD2O) до 4%.
- Разбавить запас 20 % дейтерированного формальдегида C13 (13CD2O) до 4%.
- Подготовьте 0,6 м NaBH3CN.
- Приготовьте 0,6 м NaBD3CN.
- Готовят раствор 1% бикарбоната аммония.
- Готовят раствор 5% муравьиной кислоты.
ПРИМЕЧАНИЕ: Что касается относительного количественного определения пептидов, поскольку различные экспериментальные схемы могут быть выполнены в зависимости от количества используемых этикеток, во время процедуры химической маркировки необходимо внимание. Рекомендуется разделять небольшие аликвоты этикеток в отдельных стойках с соответствующими образцами, подлежащими маркировке, чтобы уменьшить вероятность человеческой ошибки при добавлении неправильного реагента в пробирки для образцов.
- Подготовьте каждый образец, содержащий до 25 мкг пептида. Образцы не должны содержать трис или бикарбонат аммония.
ПРИМЕЧАНИЕ: Описанные ниже количества достаточны для каждого образца в объеме 100 мкл.
Выполните шаги 3.3-3.8 в вытяжном шкафу. - Добавьте к образцам 1/10-й объем 1 М TEAB (конечная концентрация раствора 100 мМ TEAB). Проверьте pH с помощью бумаги для индикатора pH; он должен быть в пределах 5-8. При необходимости настройте с помощью HCl или NaOH.
- Добавьте 4 мкл недейтерированного, дейтерированного формальдегида или C13 дейтерированного формальдегида в соответствии с установленной схемой маркировки. Перемешивать в течение 5 с путем вихря.
- Добавьте 4 мкл NaBH3CN (0,6 М) или NaBD3CN (0,6 М) в соответствии с установленной схемой маркировки. Перемешивать в течение 5 с путем вихря.
- Инкубировать в вытяжке в течение 2 ч при комнатной температуре, перемешивая каждые 30 мин.
- Повторите шаги 3.4 и 3.5. Инкубируйте образцы в вытяжке на ночь при комнатной температуре.
- Добавьте 16 мкл бикарбоната аммония (1%) и перемешайте путем вихря. Поместите образец на лед, добавьте 8 мкл муравьиной кислоты (5%) и перемешайте вихрем в течение 5 с.
- Объедините образцы, отрегулируйте рН до 2-4 и обессолите объединенные образцы на колоннах очистки с обратной фазой, как описано ранее в шаге 1.8.
- Полностью высушите образец в вакуумной центрифуге. Установить метод концентрации органических растворителей и температуру на уровне 30 °C. Время концентрации контролируется на дисплее.
- Храните образцы при температуре -20 °C.
4. Жидкостная хроматография и масс-спектрометрия
- Выполняйте анализ LC-MS с использованием системы nanoHPLC, соединенной с прибором MS, совместимым с метильными метками.
ПРИМЕЧАНИЕ: Различные инструменты MS совместимы с маркировкой RMA. Система nanoHPLC, связанная с Orbitrap, обычно используется для выполнения анализа LC-MS через источник ионов наноэлектроспрея. Сначала образец загружается в преколонку, а пептиды разделяют в аналитической колонке. Элюирование пептидов проводят с использованием линейного градиента 5%-45% ацетонитрила, в 0,1% муравьиной кислоты, в течение 90 мин, с течением 200 нл/мин. Масс-спектрометр настроен на работу в режиме, зависящем от данных. Каждое полное сканирование приобретается при интенсивности 10-30 эВ, 2,3 кВ, а затем выбирают десять самых высоких пиков для фрагментации диссоциации, вызванной столкновением (CID). Время впрыска устанавливается на ионную ловушку в 100 мс, а инжекция преобразования Фурье (FT)-MS фиксируется с разрешением 1000 мс 30 000 при м/з 300-1800. Для выполнения сканирования фрагментации используется не менее 5000 отсчетов и динамическое исключение 70 с.
5. Относительное количественное определение пептидов
ПРИМЕЧАНИЕ: Ms-спектры анализируются в программном обеспечении масс-спектрометра. Пиковые группы меченых пептидов с различными метками идентифицируются в спектрах МС. Относительное количественное определение рассчитывается по интенсивности каждого моноизотопного пика. Каждая обработанная группа сравнивается с соответствующей контрольной группой.
- Дважды щелкните правой кнопкой мыши необработанный образец файла, чтобы открыть программное обеспечение для анализа спектра. Загрузите хроматограммы времени времени удержания (RT) и спектра MS (EM) в две вкладки, верхнюю и нижнюю соответственно.
- Щелкните правой кнопкой мыши один раз последовательно на значках Параметры отображения и Массы на панели инструментов программного обеспечения и установите точность массы в четыре десятичных знака.
- Поместите курсор мыши в любом месте вкладки RT. Найдите время удержания соответствующего анализируемого иона и нажмите правую кнопку мыши. Ms спектр выбранного времени будет автоматически показан на вкладке EM.
- Поместите курсор мыши в любом месте вкладки EM. Ищите ионы, подлежащие анализу.
- Щелкните правой кнопкой мыши и удерживайте в соседней области слева рядом с этими ионами. Затем перетащите указатель мыши вправо в нужном диапазоне, чтобы увеличить интересующую область.
- Держите мышь расположенной на вкладке EM и нажимайте на стрелки правой или левой клавиатуры, чтобы определить диапазон ионов для анализа.
- Снова поместите курсор мыши на вкладку RT в начале нужного интервала времени.
- Щелкните правой кнопкой мыши и перетащите мышь до выбранного значения времени. Оставьте кнопку. Накопленная интенсивность ионов будет автоматически показана на вкладке ЭМ.
- Соберите данные об интенсивности m/z, z и ионов в электронной таблице.
ПРИМЕЧАНИЕ: Моноизотопная масса каждого пептида без добавления метильных групп рассчитывается по следующей формуле:
Масса немодифицированного пептида = (m/z a x z) - (C a x T) - (1,008 x z)
m/za - наблюдаемая масса для заряда значения для моноизотопного пика для каждого пептида, помеченного различными комбинациями меток (a = 1, 2, 3, 4 или 5, соответствующий номеру образца).
z — состояние заряда.
Ca — моноизотопная масса пары метильных групп:
Для a=1 Ca = 28,0313 (чистое добавление двух групп CH3 к первичному амину)
Для a=2 Ca = 30,0439 для двух групп CHD2
Для a=3 Ca = 32,0564 для двух групп CD2H
Для a=4 Ca= 34,0690 для двух групп CD3
Для a=5, Ca = 36,0757 для двух 13 групп CD3
T - число пар метильных групп, включенных в пептид. Это можно вычислить по следующей формуле при использовании пяти тегов: T=z*(m/z5 - m/z1)/8. Для пептидов, которые содержат один первичный амин и, следовательно, помечены только двумя метильными группами, присутствуют пиковые перекрытия на спектрах MS при использовании смежных меток. Пиковая интенсивность каждого меченого пептида может быть скорректирована с помощью уравнений, описанных Tashima и Fricker25.
6. Идентификация пептидов
- Для идентификации пептидов проанализируйте данные MS/MS с помощью поисковой системы базы данных29,30.
- Чтобы рассчитать коэффициент ложного обнаружения (FDR) с помощью метода слияния приманок, выполните поиск в базе данных приманок.
ПРИМЕЧАНИЕ: Обычно используемые параметры поиска не являются специфичными для ферментов; допуск по массе предшественника установлен 15-50 ppm; допуск массы ионов фрагмента 0,5 Да; переменные модификации: реакционноспособные амины из остатков Lys и N-конца изотопных метилированных меток пептидов (L1 (+28), L2 (+30), L3 (+32), L4 (+34) и L5 (+36)), окисленный метионин (+15,99 Да) и ацетилирование (+42,01 Да). - Затем отсортируйте пептиды по их средней локальной достоверности, чтобы выбрать лучшие спектры для аннотирования и отфильтровать их по FDR ≤5%.

Рисунок 1: Рабочий процесс пептидомических исследований. Этапы экстракции пептидов и восстановительного метилирования аминов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
Результаты, полученные в результате запусков, проведенных на масс-спектрометре, хранятся в необработанных файлах данных, которые могут быть открыты в программном обеспечении масс-спектрометра. В спектрах MS можно наблюдать пиковые группы, представляющие меченые пептиды по используемой схеме маркировки, начиная от 2-5 меток. Например, на рисунке 2 пары пиков, обнаруженных в хроматографическое время, представлены в эксперименте, где в двух разных образцах в одном и том же прогоне использовались только две изотопные метки. На рисунке 3 показаны другие возможности положительных результатов, используя 3 и 4 различные метки в каждом запуске LC-MS. При использовании 4 или 5 меток в прогоне LC/MS может наблюдаться перекрытие пиков меченых пептидов с различными метками, которые необходимо скорректировать для получения реального значения интенсивности каждого пика (рисунок 4).
Изотопная маркировка также может быть использована для демонстрации субстратов и продуктов in vitro для данной протеазы или пептидазы, как показано на рисунке 5. Наконец, для идентификации меченых пептидов можно использовать различное программное обеспечение, такое как Peaks Studio или MASCOT. Эти программные приложения были созданы для протеомного анализа; поэтому данные количественного определения белка не должны рассматриваться для анализа пептидомики, и каждый меченый пептид, идентифицированный в пределах параметров надежности, должен быть проверен, а затем количественно определен. Если пептиды были успешно обнаружены и помечены, эти программы предоставят список идентифицированных пептидных последовательностей, содержащих метки. На рисунке 6 показан пример идентификации пептидной последовательности, выполненной программой. В этом случае для маркировки трех разных образцов по отдельности использовались только 3 различные формы этикеток (L1, L3 и L5), которые затем смешивались и анализировались масс-спектрометрией за один прогон.
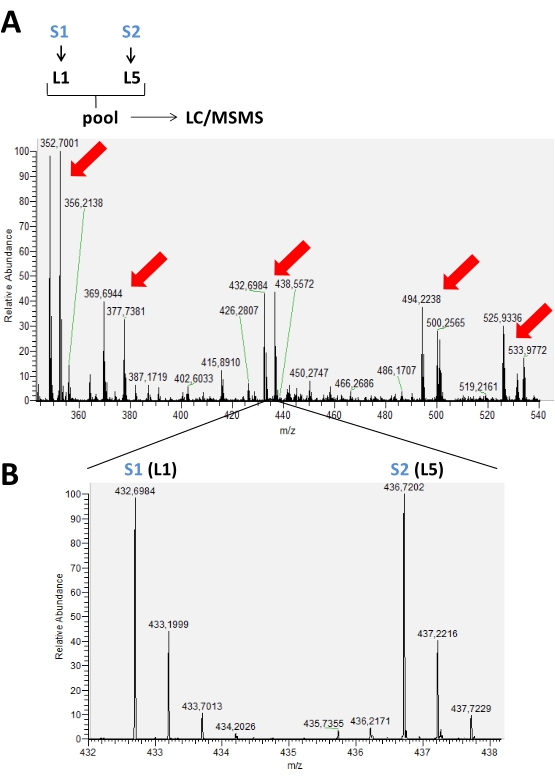
Рисунок 2: Спектр MS представляет хроматографическое время, накопленное в типичном эксперименте по маркировке с использованием восстановительного диметилирования аминов. В (A) красные стрелки указывают на наличие пиковых пар различных пептидов, помеченных 2 изотопными формами (L1 и L5) для сравнения между двумя различными образцами (S1 и S2). В (B) увеличенное изображение спектра РС одного и того же пептида, показывающее разные m/z из-за использования меток. В этом случае не было никаких изменений в пиковой интенсивности для этого пептида, присутствующего в этих образцах. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Репрезентативный спектр MS меченых пептидов с восстановительным метилированием аминов с использованием различного количества меток. (A) Использовалась триплексная маркировка. Можно наблюдать MS-спектр пептида, присутствующего в 3 различных образцах (S1, S2 и S3), помеченных метками L1, L3 и L5 соответственно. В этом случае уровень меченого пептида с L5 был в два раза выше уровня, наблюдаемого для того же пептида, меченного метками L1 и L3. (B) Маркировка квадрипекса выполнялась с использованием этикеток L1, L2, L3 и L4. При этом контрольные образцы (S1 и S3) маркировали L1 и L3 соответственно и сравнивали с двумя экспериментальными образцами (S2 и S4), маркированными метками L2 и L4. Никаких существенных различий для этого пептида между образцами не наблюдалось. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Репрезентативный спектр MS меченого пептида, представляющего пиковое перекрытие. На этом рисунке показан МС-спектр пептида заряда 3 массой 2098,87 Да с одним первичным амином, доступным для маркировки. Разница между мечеными пептидами составляет всего 2 Da, что приводит к перекрытию, когда 4 или 5 меток используются в одном и том же запуске LC / MS. Используя модель, основанную на кубических полиномиальных уравнениях, можно исправить эти перекрытия между метками. На графике красные полосы показывают среднее значение значений интенсивности, скорректированных для этого пептида за два прогона. Черные полосы показывают среднее значение перекрывающихся значений интенсивности. После коррекции этот пептид показал небольшое изменение интенсивности между образцами (красные полосы). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Репрезентативный спектр МС меченых пептидов с восстановительным метилированием аминов в исследовании протеолиза. Здесь пептидные экстракты инкубировали с нейролизином 200 нМ и 20 нМ для характеристики их субстратов и продуктов. Для подтверждения результата были выполнены два пробега LC/MS со стратегиями прямой и обратной маркировки. Во втором запуске положение образцов изменяется в процедуре маркировки по отношению к схеме, используемой в первом запуске. В А показан пептид, который не изменяется (NC) в присутствии фермента нейролизина. В B - пептид, который исчез в присутствии высокой концентрации фермента (S2) и который показал небольшое снижение низкой концентрации фермента (S4) как в прямой, так и в обратной маркировке. Этот пептид считается субстратом (SB) фермента. В С приведен пример пептида, который считался продуктом (БП), поскольку его концентрация была повышена (S2 и S4) в присутствии фермента. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Репрезентативный спектр MSMS и идентификация меченого пептида, выполняемая поисковой системой базы данных. В этом примере можно наблюдать 2+ ионы с m/z 672,3802, 676,4045 и 680,4241, соответствующими пептиду той же массы, меченому метилированными формами L1, L3 и L5 соответственно. Эта последовательность ADQVSASLAKQGL была идентифицирована через спектр MS/MS как фрагмент микротрубочки-ассоциированной белковой изоформы тау-X1. Этот пептид имеет N-терминал и лизин, доступные в качестве сайтов маркировки, добавляя массовую разницу в 8 дальтон между мечеными пептидами. Спектр MS этого пептида показан на рисунке 3А. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Образец | H2CO | Д2КО | Д213КО | НаБХ3CN | НаБД3CN | Ярлык | Дополнительная масса |
| 2 x 4 мкл | 2 x 4 мкл | 2 x 4 мкл | 2 x 4 мкл | 2 x 4 мкл | код | (Да) | |
| 1 | X | X | Л1 | 28.0313 | |||
| 2 | X | X | Л2 | 30.0439 | |||
| 3 | X | X | Л3 | 32.0564 | |||
| 4 | X | X | Л4 | 34.069 | |||
| 5 | X | X | Л5 | 36.0757 |
Таблица 1: Реагенты типичного эксперимента с использованием указанной комбинации дейтерированных и недейтерированных форм формальдегида и цианоборогидрида натрия.
Обсуждение
В большинстве исследований пептидомики одним из критических этапов, без сомнения, является пробоподготовка, которую следует тщательно выполнять, чтобы избежать присутствия пептидных фрагментов, генерируемых протеазами через несколько минут после вскрытия. Первоначальные исследования экстрактов мозга, полученных из образцов, не включенных в микроволновую печь, показали большое количество фрагментов белка, присутствующих в микрофильтратах 10 кДа. Для предотвращения деградации белка были описаны различные подходы, позволяющие избежать деградации пептидов: целенаправленное микроволновое облучение жертвоприношения животных6,8, рассечение криостата с последующим кипящим экстракционным буфером31 и микроволновое облучение тканей после жертвоприношения с использованием микроволновой печи бытового типа9,26 . Для клеточной культуры и некоторых тканей инактивация протеазы может быть выполнена непосредственно путем добавления воды при 80 °C. Тем не менее, некоторые образцы, такие как нервная ткань, могут быть более чувствительными к посмертным изменениям, и инактивация протеазы микроволновым облучением была указана в качестве метода выбора. Кроме того, еще одним важным моментом во время экстракции пептида является обеспечение того, чтобы экстракты были ледяными перед добавлением кислоты, чтобы предотвратить разрыв кислотно-лабильных связей, таких как расщепление связей Asp-Pro26.
Для относительной количественной оценки пептидов могут быть использованы различные стратегии, но ни одна из них не может считаться полностью идеальной. Чтобы выбрать метод, который будет использоваться, исследователь должен учитывать такие факторы, как наличие часов использования в масс-спектрометре, коммерчески доступные и стоимость маркировки реагентов, а также легкость в анализе полученных данных17,25,26,32. Метод без меток широко используется, но требует много часов в масс-спектрометре. Необходимо вводить технические реплики для каждого образца и зависит от хроматографической воспроизводимости среди образцов. Другие химические маркировочные реагенты, например, ITRAQ (изобарические метки для относительного и абсолютного количественного определения) и TMT (тандемная массовая метка), являются дорогостоящими и обеспечивают только количественное определение пептидов, выбранных для анализа MS/MS25,33,34.
Основным ограничением относительной количественной оценки посредством химической маркировки с использованием RMA является перекрытие, которое происходит для некоторых пептидов при выполнении протокола с использованием 4 или 5 меток в одном и том же прогоне, что приводит к массовым различиям 2 Da для пептидов с одним первичным амином и 1 Da для пептидов с пролином N-конца и без внутренних остатков лизина. Однако Ташима и Фрикер (2018) разработали модель для исправления изотопного перекрытия на основе кубических полиномиальных уравнений25, которые получают правильную интенсивность меченых пептидов в образцах. Кроме того, не все пептиды могут быть замечены RMA. Например, в некоторых пептидах отсутствует N-концевой свободный амин из-за ацетилирования, пироглутамилирования или другой модификации. Если внутренние лизины также отсутствуют в этих пептидах, они не будут помечены реагентом RMA и будут появляться на спектрах m/z как неизмеримые одиночные пики27.
Раскрытие информации
Конкурирующих финансовых интересов не существует.
Благодарности
Разработка и использование методов, описанных здесь, были поддержаны грантом Бразильского национального исследовательского совета 420811/2018-4 (LMC); Гранты Fundação de Amparo à Pesquisa do Estado de São Paulo (www.fapesp.br) 2019/16023-6 (LMC), 2019/17433-3 (LOF) и 21/01286-1 (MEME). Спонсоры не играли никакой роли в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке статьи.
Материалы
| Name | Company | Catalog Number | Comments |
| 10 kDa cut-off filters | Merck Millipore | UFC801024 | Amicon Ultra-4, PLGC Ultracel-PL Membrane, 10 kDa |
| Acetone | Sigma-Aldrich | 179124 | |
| Acetonitrile | Sigma-Aldrich | 1000291000 | |
| Ammonium bicarbonate | Sigma-Aldrich | 11213 | |
| analytical column (EASY-Column) | EASY-Column | (SC200) | 10 cm, ID75 µm, 3 µm, C18-A2 |
| Ethyl 3-aminobenzoate methanesulfonate | Sigma-Aldrich | E10521 | MS-222 |
| Fluorescamine | Sigma-Aldrich | F9015 | |
| Formaldehyde solution | Sigma-Aldrich | 252549 | |
| Formaldehyde-13C, d2, solution | Sigma-Aldrich | 596388 | |
| Formaldehyde-d2 solution | Sigma-Aldrich | 492620 | |
| Formic acid | Sigma-Aldrich | 33015 | |
| Fume hood | Quimis | Q216 | |
| Hydrochloric acid - HCl | Sigma-Aldrich | 258148 | |
| LoBind-Protein retention tubes | Eppendorf | EP0030108116-100EA | |
| LTQ-Orbitrap Velos | Thermo Fisher Scientific | LTQ Velos | |
| Microwave oven | Panasonic | NN-ST67HSRU | |
| n Easy-nLC II nanoHPLC | Thermo Fisher Scientific | LC140 | |
| PEAKS Studio | Bioinformatics Solutions Inc. | VERSION 8.5 | |
| Phosphate-buffered saline | Invitrogen | 3002 | tablets |
| precolumn (EASY-Column) | Thermo Fisher Scientific | (SC001) | 2 cm, ID100 µm, 5 µm, C18-A1 |
| Refrigerated centrifuge | Hermle | Z326K | for conical tubes |
| Refrigerated centrifuge | Vision | VS15000CFNII | for microtubes |
| Reversed-phase cleanup columns (Oasis HLB 1 cc Cartridge) | Waters | 186000383 | Oasis HLB 1 cc Cartridge |
| Sodium cyanoborodeuteride - NaBD3CN | Sigma-Aldrich | 190020 | |
| Sodium cyanoborohydride - NaBH3CN | Sigma-Aldrich | 156159 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | NOTE: 0.2 M PB= 0.1 M phosphate buffer pH 6.8 (26.85 mL of Na2HPO3 1M) plus 0.1 M phosphate buffer pH 6.8 (23.15 mL of NaH2PO3 1M) to 250 ml of water |
| Sodium phosphate monobasic | Sigma-Aldrich | S3139 | |
| Sonicator | Qsonica | Q55-110 | |
| Standard peptide | Proteimax | amino acid sequence: LTLRTKL | |
| Triethylammonium buffer - TEAB 1 M | Sigma-Aldrich | T7408 | |
| Trifluoroacetic acid - TFA | Sigma-Aldrich | T6508 | |
| Ultra purified water | Milli-Q | Direct-Q 3UV | |
| Vacuum centrifuge | GeneVac | MiVac DNA concentrator | |
| Water bath | Cientec | 266 | |
| Xcalibur Software | ThermoFisher Scientific | OPTON-30965 |
Ссылки
- Kandpal, R., Saviola, B., Felton, J. The era of 'omics unlimited. Biotechniques. 46 (5), 354-355 (2009).
- Farrokhi, N., Whitelegge, J. P., Brusslan, J. A. Plant peptides and peptidomics. Plant Biotechnology Journal. 6 (2), 105-134 (2008).
- Schulz-Knappe, P., Schrader, M., Zucht, H. D. The peptidomics concept. Combinatorial Chemistry & High Throughput Screening. 8 (8), 697-704 (2005).
- Dallas, D. C., et al. Current peptidomics: applications, purification, identification, quantification, and functional analysis. Proteomics. 15 (5-6), 1026-1038 (2015).
- Chard, T. An introduction to radioimmunoassay and related techniques (3rd Ed). FEBS Letters. 238 (1), 223(1988).
- Svensson, M., Sköld, K., Svenningsson, P., Andren, P. E. Peptidomics-based discovery of novel neuropeptides. Journal of Proteome Research. 2 (2), 213-219 (2003).
- Baggerman, G., et al. Peptidomics. Journal of Chromatography B. 803, 3-16 (2004).
- Theodorsson, E., Stenfors, C., Mathe, A. A. Microwave irradiation increases recovery of neuropeptides from brain tissues. Peptides. 11, 1191-1197 (1990).
- Che, F. Y., Lim, J., Pan, H., Biswas, R., Fricker, L. D. Quantitative neuropeptidomics of microwave-irradiated mouse brain and pituitary. Molecular & Cellular Proteomics. 4, 1391-1405 (2005).
- Dasgupta, S., et al. Analysis of the yeast peptidome and comparison with the human peptidome. PLoS One. 11 (9), 0163312(2016).
- Teixeira, C. M. M., Correa, C. N., Iwai, L. K., Ferro, E. S., Castro, L. M. Characterization of Intracellular Peptides from Zebrafish (Danio rerio) Brain. Zebrafish. 16 (3), 240-251 (2019).
- Fricker, L. D. Analysis of mouse brain peptides using mass spectrometry-based peptidomics: implications for novel functions ranging from non-classical neuropeptides to microproteins. Molecular BioSystems. 6 (8), 1355-1365 (2010).
- Gelman, J. S., Sironi, J., Castro, L. M., Ferro, E. S., Fricker, L. D. Peptidomic analysis of human cell lines. Journal of Proteome Research. 10 (4), 1583-1592 (2011).
- De Araujo, C. B., et al. Intracellular peptides in cell biology and pharmacology. Biomolecules. 9, 150(2019).
- Gewehr, M. C. F., Silverio, R., Rosa-Neto, J. C., Lira, F. S., Reckziegel, P., Ferro, E. S. Peptides from natural or rationally designed sources can be used in overweight, obesity, and type 2 diabetes therapies. Molecules. 25 (5), 1093(2020).
- Sakaya, G. R., et al. Peptidomic profiling of cerebrospinal fluid from patients with intracranial saccular aneurysms. Journal of Proteomics. 240 (3), 104188(2021).
- Fricker, L. Quantitative peptidomics: General considerations. Methods in Molecular Biology. 1719, 121-140 (2018).
- Southey, B. R., et al. Comparing label-free quantitative peptidomics approaches to characterize diurnal variation of peptides in the rat suprachiasmatic nucleus. Analytical Chemistry. 86 (1), 443-452 (2014).
- Chen, X., Wei, S., Ji, Y., Guo, X., Yang, F. Quantitative proteomics using SILAC: Principles, applications, and developments. Proteomics. 15 (18), 3175-3192 (2015).
- Boonen, K., et al. Quantitative peptidomics with isotopic and isobaric tags. Methods in Molecular Biology. 1719, 141-159 (2018).
- Gewehr, M. C. F., et al. The relevance of thimet oligopeptidase in the regulation of energy metabolism and diet-induced obesity. Biomolecules. 10 (2), 321(2020).
- Fiametti, L. O., Correa, C. N., Castro, L. M. Peptide profile of zebrafish brain in a 6-OHDA-induced Parkinson model. Zebrafish. 18 (1), 55-65 (2021).
- Boersema, P. J., Raijmakers, R., Lemeer, S., Mohammed, S., Heck, A. J. Multiplex peptide stable isotope dimethyl labeling for quantitative proteomics. Nature Protocols. 4 (4), 484-494 (2009).
- Dasgupta, S., Castro, L. M., Tashima, A. K., Fricker, L. Quantitative peptidomics using reductive methylation of amines. Methods in Molecular Biology. 1719, 161-174 (2018).
- Tashima, A. K., Fricker, L. D. Quantitative peptidomics with five-plex reductive methylation labels. Journal of the American Society for Mass Spectrometry. 29 (5), 866-878 (2018).
- Che, F. Y., et al. Optimization of neuropeptide extraction from the mouse hypothalamus. Journal of Proteome Research. 6 (12), 4667-4676 (2007).
- Lyons, P. J., Fricker, L. D. Peptidomic approaches to study proteolytic activity. Current Protocols in Protein Science. , Chapter 18 13(2011).
- Udenfriend, S., et al. Fluorescamine: a reagent for assay of amino acids, peptides, proteins, and primary amines in the picomole range. Science. 178 (4063), 871-872 (1972).
- Ma, B., et al. PEAKS: powerful software for peptide de novo sequencing by tandem mass spectrometry. Rapid Communications in Mass Spectrometry. 17 (20), 2337-2342 (2003).
- Zhang, J., et al. PEAKS DB: de novo sequencing assisted database search for sensitive and accurate peptide identification. Molecular & Cellular Proteomics. 11 (4), 1-8 (2012).
- Sturm, R. M., Dowell, J. A., Li, L. Rat brain neuropeptidomics: tissue collection, protease inhibition, neuropeptide extraction, and mass spectrometric analysis. Methods in Molecular Biology. 615, 217-226 (2010).
- Fricker, L. D. Limitations of mass spectrometry-based peptidomic approaches. Journal of the American Society for Mass Spectrometry. 26 (12), 1981-1991 (2015).
- Ross,, et al. Multiplexed protein quantitation in Saccharomyces cerevisiae using amine-reactive isobaric tagging reagents. Molecular & Cellular Proteomics. 3, 1154-1169 (2004).
- Thompson, A., et al. Tandem mass tags: a novel quantification strategy for comparative analysis of complex protein mixtures by MS/MS. Analytical Chemistry. 75, 1895-1904 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены