Method Article
ペプチド学研究におけるアミンの還元メチル化を用いたサンプル調製と相対定量
要約
この記事では、熱不活性化に基づくサンプル調製方法を、後分析による分解を回避する内因性ペプチドを保存し、続いて同位体標識とLC-MSを使用した相対定量を行う方法について説明します。
要約
ペプチド性は、生物学的試料中のペプチドの定性的および定量的分析として定義することができる。その主な用途は、疾患または環境ストレスのペプチドバイオマーカーの同定、神経ペプチド、ホルモン、および生理活性細胞内ペプチドの同定、タンパク質加水分解物からの抗菌および栄養補助ペプチドの発見、およびタンパク質分解プロセスを理解する研究で使用することができる。近年のサンプル調製の進歩により、分離法、質量分析技術、およびタンパク質シーケンシングに関連する計算ツールが、同定されたペプチド数およびペプチドドームの増加を特徴付けている。ペプチド学的研究は、細胞内で自然に生成されるペプチドを頻繁に分析します。.ここでは、熱不活性化に基づくサンプル調製プロトコルが記載されており、これはプロテアーゼ活性を排除し、軽度の条件で抽出するので、切断されたペプチド結合が存在しない。また、アミンの還元メチル化による安定同位体標識を用いたペプチドの相対定量も示されている。この標識法は、試薬が市販されており、他に比べて安価で、化学的に安定であり、かつ1回のLC-MSランで最大5個のサンプルの分析を可能にする利点を有する。
概要
「オミクス」科学は、DNA、RNA、タンパク質、ペプチド、代謝物などの分子集合の深い分析によって特徴付けられる。これらの生成された大規模なデータセット(ゲノミクス、トランスクリプトミクス、プロテオミクス、ペプチドミクス、メタボロミクスなど)は生物学に革命をもたらし、生物学的プロセスの高度な理解につながった1.ペプチドミクスという用語は20世紀初頭に導入され始め、一部の著者はプロテオミクス2の分岐と呼んでいます。しかしながら、ペプチド性は、細胞プロセス中に自然に生成されたペプチド含有量を調査すること、ならびにこれらの分子の生物学的活性の特性を調査することが主な関心事である、明確な特殊性を有する3,4。
当初、生理活性ペプチド研究は、エドマン分解および放射性免疫アッセイを通じて神経ペプチドおよびホルモンペプチドに限定された。しかしながら、これらの技術は、高濃度の各ペプチドの単離に応じて、抗体の生成にかかる時間、交差反応性の可能性5以外に、グローバル分析を可能にしない。
ペプチド性分析は、液体クロマトグラフィー結合質量分析(LC-MS)およびゲノムプロジェクトのいくつかの進歩の後にのみ可能となり、プロテオミクス/ペプチドミクス研究のための包括的なデータプールを提供しました6,7。さらに、脳サンプルで神経ペプチドを世界的に分析した最初の研究では、検出がタンパク質の大量分解の影響を受けたことが示されたため、ペプチドームの特定のペプチド抽出プロトコルを確立する必要がありました。これらのペプチド断片の存在は、神経ペプチドシグナルを覆い隠し、生体内でのペプチドドームを表すものではなかった。この問題は、主にマイクロ波照射を用いたプロテアーゼの高速加熱不活性化の適用によって解決され、これらのアーティファクト断片の存在を大幅に減少させ、神経ペプチド断片の同定だけでなく、細胞質、ミトコンドリア、核タンパク質からのペプチドのセットの存在を明らかにした。
これらの方法論的手順は、主にプロテアソームの作用によって生成された数百の細胞内ペプチドが酵母10、ゼブラフィッシュ11、げっ歯類組織12、およびヒトcells13で同定されている、よく知られた神経ペプチドを超えてペプチドを拡大することを可能にした。これらの細胞内ペプチドの数十は、生物学的および薬理学的活性の両方を有することが広範囲に示されている14,15。さらに、これらのペプチドは、疾患バイオマーカーとして使用することができ、おそらく臨床的意義を有する、頭蓋内嚢胞瘤を有する患者からの脳脊髄液において示されるように16。
現在、ペプチド配列の同定に加えて、質量分析を通じて絶対定量と相対定量のデータを得ることが可能である。絶対定量では、生物学的試料中のペプチドレベルは合成標準と比較され、一方、相対的定量では、ペプチドレベルは2つ以上のサンプル間で比較される17。相対定量は、次の方法で実行できます: 1) "ラベルフリー"18;2)生体内代謝標識または3)化学標識。最後の2つは、ペプチド19,20に組み込まれた安定な同位体形態の使用に基づいている。無ラベル分析では、LC-MS18の間にシグナル強度(スペクトルカウント)を考慮してペプチドレベルを推定します。しかし、同位体標識は、ペプチドのより正確な相対レベルを得ることができる。
多くのペプチド研究では、トリメチルアンモニウム・ブチレート(TMAB)標識試薬を化学標識として使用し、さらに最近では、ホルムアルデヒドおよびシアノボロヒドリル酸ナトリウム試薬を有するアミンの還元メチル化(RMA)が使用されている。しかし、TMABラベルは市販されておらず、合成プロセスは非常に面倒です。一方、RMAでは、試薬が市販されており、他のラベルに比べて安価で、手順が簡単に行われ、標識ペプチドが安定している23,24である。
RMAの使用は、ペプチドがホルムアルデヒドと反応することを可能にすることによってシッフ塩基を形成することを含み、続いてシアノボロヒドロヒドを介して還元反応を行う。この反応は、N末端およびリジン側鎖およびモノメチル化N末端プロリン上の遊離アミノ基のジメチル化を引き起こす。プロリン残基がN末端でまれであることが多く、N末端に遊離アミンを有する実質的にすべてのペプチドが2つのメチル基23,24,25で標識される。
プロトコル
ペプチド抽出および還元メチル化に関する以下の手順は、以前に公表された手順24,25,26,27から適応した。この議定書は、全米動物実験管理評議会(CONCEA)のガイドラインに従い、サンパウロ州立大学バイオサイエンス研究所の動物利用倫理委員会(CEUA)によって承認されました。プロトコルの手順を図 1 に示します。
注:超純水ですべての水溶液を準備します。
1. ペプチド抽出
- 細胞培養
- 15%の胎児ウシ血清と1%ペニシリンストレプトマイシンを含むダルベッコの改変イーグル培地で、37°Cから5%CO2 以下で15cmの皿でSHSY5Y細胞を培養します。
- 各サンプルに2~3枚のプレートを使用します。細胞を100%合流に成長させます。
- 意図した治療の後、リン酸緩衝生理食塩水で細胞を2回洗浄する。次に、リン酸緩衝生理食塩液を10mL加え、細胞を掻き取り、15mLチューブに集めます。
- 5分間800 x g で遠心ゲートし、上清を取り除く。ペレットを80°Cの超精製脱イオン水1mLで再懸濁する。
- チューブの内容物(細胞性ライセート)を2mLマイクロフュージチューブに移します。
- 動物組織(主に神経組織):
- 野生型の雄の成人 ダニオ・レリオ (ゼブラフィッシュ)をMS 222(100mg/L)の致死量で麻酔し、すぐに8秒のマイクロ波放射線を受けてペプチダーゼとプロテアーゼを不活性化する。
注意:家庭用電子レンジを使用できます。8~10sのフルパワーで900Wマイクロ波を使用しました。使用するマイクロ波は、10s以内に>80°Cに脳温度を上げることができる必要があります。サンプル間の加熱の再現性は、組織をマイクロ波内の同じ場所に配置することでも利益を得るであろう。 - 熱不活性化後、2 mLマイクロフュージチューブに脳全体を集め、分析まで−80°Cで凍結します。
- 80°Cで1mLの超精製脱イオン水で組織試料を再懸濁する。 1 sの30パルス(4Hz)を用いて、プローブで組織を超音波処理します。
注:肝臓および腎臓組織の場合、20 sの10,000-30,000 rpmで機械的ホモジナイザーを使用してください。筋肉組織の場合は、磁器のるつぼと害虫を使用して液体窒素で組織を粉砕します。以下のステップは、細胞のライセートまたはホモジネート組織について同様である。
- 野生型の雄の成人 ダニオ・レリオ (ゼブラフィッシュ)をMS 222(100mg/L)の致死量で麻酔し、すぐに8秒のマイクロ波放射線を受けてペプチダーゼとプロテアーゼを不活性化する。
- 細胞のライゼートまたはホモジネート組織を80°Cで20分間インキュベートします。次に氷の上で10〜30分間冷まします。
- 1 mLのサンプル量ごとに1M HClストック溶液10μLを加え、10mMの最終濃度を得ます。20 sの渦を混ぜて混ぜ、さらに氷の上で15分間インキュベートします。
注:酸性化する前に、高温での酸性化によって引き起こされるペプチド結合を壊さないように、サンプルが完全に冷却されていることを確認してください。 - 細胞のリセートまたはホモゲネート組織を4° Cで 15分間遠心分離する。上清を低結合タンパク質マイクロ遠心チューブに集め、-80°Cで保存します。
- 2300 x g で水と遠心分離器を 3 分間加えて、限外ろ過装置(10 kDa カットオフ フィルター)を洗浄します。この手順をさらに 2 回繰り返します。
- 上清をあらかじめ洗浄した10kDaカットオフフィルターと遠心分離機を4°Cで2,300 x gに50分間、冷蔵庫で再冷蔵庫で入れます。フロースルーは、ペプチド抽出物を表す。
- 以下に説明するように、アセトニトリル(ACN)およびトリフルオロ酢酸(TFA)溶液を使用したメーカーの指示に従って、逆相クリーンアップカラムのサンプルを脱塩します。
- 1mLのACNを1mLと平衡化します。
- 0.1%のTFAで5%ACNの1 mL溶液でカラムを洗います。
- 列にサンプルのボリューム全体をロードします。
- 0.1% TFAで5%ACNの1 mL溶液でカラムを洗浄
- タンパク質低結合マイクロ遠心分離管に0.15%TFAを有する100%ACNの1.8 mL溶液を有するカラムからペプチドをエルプする。
- 真空遠心分離機でサンプルを完全に乾燥させます。有機溶剤の濃度方法と温度を30°Cに設定します。 濃度時間は、ディスプレイ上で監視されます。
- 次のステップまで、サンプルを−80°Cで保存してください。
2. ペプチドを蛍光アミンで定量化
注:ペプチドの量は、前述のpH6.8での蛍光アミンを用いて推定することができます11,28。この方法は、リジン(K)残基および/またはペプチドのN末端に存在する一次アミンへの蛍光アミン分子の結合からなる。反応は、フルオレサミンが、遊離アミノ酸ではなく、ペプチドのアミノ基とのみ反応することを保証するために、pH 6.8で行われます。蛍光アミンは、励起波長370nmの分光蛍光計と発光波長480nmを用いて測定します。
- 標準ペプチドの異なる濃度(0.05、0.1、0.15、0.2、0.3、0.5および0.7 μg/μL)を調製し、アリコートを-20°Cに保存します。
注:ペプチド5A(LTLRTKL)は、既知の組成および濃度を有するので示唆される。 - アセトンで蛍光鉱脂のストック液(0.3mg/mL)を調製します。アリコートはマイクロ遠心チューブ(1mL)で素早く、パラフィルムを使用してシールし、暗闇の中で-20°Cで保存します。
- pH 6.8で0.2 Mリン酸緩衝液(PB)を準備します。
注:0.1 Mリン酸緩衝液pH 6.8(Na2HPO3 1Mの26.85 mL)および0.1 Mリン酸緩衝液pH 6.8(NaH2PO3 1Mの23.15 mL)を250 mLの水に加えて0.2 M PBを準備します - ペプチドサンプルを100~200μLの超精製水で再懸濁します。
- ピペット2.5 μLの標準的なペプチド濃度とサンプルを白色96ウェルプレート上に、蛍光アッセイを三重化します。0.2 Mリン酸バッファーの 25 μL を追加します。
- 12.5 μLの蛍光アミンをマルチチャンネルピペットで添加します。軌道回転式シェーカーで1分間穏やかに均質化します。
- 次に、110 μL の水をマルチチャンネルピペットで加え、反応を止めます。
注:蛍光アミンストック溶液と超純水を2つの貯水池に移し、これらの溶液をマルチチャンネルピペットでピペット化します。 - 分光フルオメーターで次の読み取りパラメータを調整します:上からサンプルを読み取り、励起波長は370 nm、発光波長は480 nmで読み取ります。
- 分光蛍光計のプレートを読みます。
3. アミン標識の還元メチル化
注:この同位体標識法は、ホルムアルデヒドおよびシアノ水素化ナトリウム試薬の重水素化および非重水素化形態を有するアミン基のジメチル化に基づいています。この反応の最終生成物は、各々の使用可能な標識部位(リジンまたはN末端)において各ペプチドの最終質量に28Da、30 Da、32 Da、34 Da、または36 Daを加える。この反応は、MSスペクトルで観察された異なる形態で標識されたペプチドにm/zの差を生じる(表1)。
注意: これらの化合物を処理するために適切な安全装置を使用する必要があり、暴露を最小限に抑えるために注意する必要があります。ホルムアルデヒドおよびシアノ水素化ナトリウム試薬は、非常に有毒であるため、ヒュームフード(シアノ水素化ナトリウムの計量を含む)で行う必要があります。焼入反応および酸性化の間に、有毒ガス(シアン化水素)が発生し得る。
- 超純水の手順の日に在庫または試薬から次の新鮮な溶液を準備します。
- 37%ホルムアルデヒド(CH2O)のストックを4%に希釈します。
- 20%ホルムアルデヒド重水素(CD2O)のストックを4%に希釈します。
- 20%の重水素C13ホルムアルデヒド(13CD2O)の在庫を4%に希釈します。
- 0.6 M NaBH3CNを準備します。
- 0.6 M NaBD3CN を準備します。
- 1%重炭酸アンモニウムの溶液を調製します。
- 溶液5%のギ酸を準備します。
注:ペプチドの相対的な定量については、使用するラベルの数に応じて異なる実験スキームを行うことができるため、化学標識手順の間に注意が必要です。サンプルチューブに誤った試薬を追加する場合の人為的ミスの可能性を減らすために、ラベルの小さなアリコートをそれぞれのサンプルと別々のラックに分けることをお勧めします。
- 最大25μgのペプチドを含む各サンプルを調製します。サンプルにはトリスまたは重炭酸アンモニウムを含んではなりません。
注:以下に説明する量は、100 μLのボリューム内の各サンプルで十分です。
ヒュームフードのステップ3.3-3.8に進みます。 - 1 M TEABの1/ 10体積をサンプルに加えます(溶液100mMの最終的な濃度はTEAB)。pH インジケータペーパーで pH をチェックします。5~8の間になければなりません。必要に応じて、HCl または NaOH を使用して調整します。
- 確立されたラベリングスキームに従って、非重水素化、重水素化ホルムアルデヒドまたはC13 重水素の4 μLを加えます。渦によって5 sのために混ぜる。
- 確立されたラベリングスキームに従ってNaBH3CN(0.6 M)またはNaBD3CN(0.6 M)の4 μLを追加します。渦によって5 sのために混ぜる。
- 煙のフードに室温で2時間インキュベートし、30分ごとに混合します。
- 手順 3.4 と 3.5 を繰り返します。室温で一晩ヒュームフードにサンプルをインキュベートします。
- 16 μLの重炭酸アンモニウム(1%)を加え、渦を混ぜて混ぜます。サンプルを氷の上に置き、8 μLのギ酸(5%)を加え、渦で5秒混ぜます。
- サンプルを組み合わせ、pHを2-4に調整し、ステップ1.8で前述したように、逆相クリーンアップカラム上の結合サンプルを脱塩します。
- 真空遠心分離機でサンプルを完全に乾燥させます。有機溶剤の濃度方法と温度を30°Cに設定します。 濃度時間は、ディスプレイ上で監視されます。
- サンプルは-20°Cで保管してください。
4. 液体クロマトグラフィーと質量分析
- メチルタグと互換性のあるMS機器に結合したnanoHPLCシステムを使用して、LC-MS分析を行います。
メモ: さまざまな MS インストゥルメントは RMA ラベル付けに対応しています。オービットラップに結合されたナノHPLCシステムは、通常、ナノエレクトロスプレーイオン源を介してLC-MS分析を行うために使用されます。まず、サンプルを予めカラムにロードし、ペプチドを分析カラムで分離します。ペプチドの溶出は、5%〜45%のアセトニトリルの線形勾配を使用して行われ、0.1%のギ酸で、90分間、200 nL/分の流れを伴う。質量分析計はデータ依存モードで機能するように設定されています。各フルスキャンは、10-30 eV、2.3 Kvの強度で取得され、衝突誘発解離(CID)断片化のために10の最高峰が選択されます。射出時間は100 msのイオントラップに設定され、フーリエ変換(FT)-MSインジェクションはm/z 300-1800で1000 ms 30,000の解像度で固定されています。断片化スキャンを実行するには、最小 5000 カウントと 70 s の動的除外が使用されます。
5. ペプチドの相対定量
注: MS スペクトルは、質量分析計ソフトウェアで分析されます。異なるタグを有する標識ペプチドのピーク群は、MSスペクトルで同定される。相対定量は、各単一同位体ピークの強度によって計算されます。各処置群は、それぞれの対照群と比較される。
- 生のサンプルファイルを右クリックして、スペクトル解析ソフトウェアを開きます。保持時間(RT)とMSスペクトル(EM)クロマトグラムをそれぞれ上下の2つのタブにロードします。
- ソフトウェアツールバーの 表示 オプションと マス オプションアイコンを順番に1回右クリックし、質量の精度を小数点以下 4 桁に設定します。
- [RT] タブの任意の場所にマウス カーソルを置きます。分析する対応するイオンの保持時間を探し、マウスの右ボタンをクリックします。選択した時間の MS スペクトルが自動的に [EM] タブに表示されます。
- [EM] タブの任意の場所にマウス カーソルを置きます。分析するイオンを探します。
- 右クリックして、これらのイオンの近くの左の隣接する領域を保持します。次に、目的の範囲でマウスを右にドラッグして、対象領域をズームします。
- マウスをEMタブに置いたまま、右または左のキーボード矢印をクリックして、分析するイオンの範囲を定義します。
- カーソルを再び RT タブに移動して、目的の時間間隔の先頭に置きます。
- マウスを右クリックし、選択した時間値までドラッグします。ボタンを離れます。イオンの累積強度は、自動的にEMタブに表示されます。
- スプレッドシートに m/z、z、イオン強度のデータを収集します。
注:メチル基を添加しない各ペプチドのモノアイソトピック質量は、次の式から計算されます。
質量未修飾ペプチド = (m/z a x z) - (C a x T) - (1.008 x z)
m/zaisは、タグの異なる組み合わせで標識 された各ペプチドのモノアイソトピックピークの電荷値を観察した質量(=1、2、3、4または5、サンプル数に対応する)。
z は充電状態です。
Caは、一対のメチル基のモノアイソトピック質量です。
a=1 の場合、Ca = 28.0313 (プライマリアミンへの 2 つの CH3 グループの正味の追加)
a=2 の場合、Ca = 30.0439 (2 つの CHD2 グループ)
a=3 の場合、CA = 32.0564 (2 つの CD2H グループ)
a=4 の場合、2 つの CD3 グループの場合は Ca= 34.0690
a=5 の場合、Ca = 36.0757 (2 つの 13 CD3 グループ)
Tは、ペプチドに組み込まれたメチル基の対数である。これは、5 つのタグを使用する場合に、次の式から計算できます。単一の一次アミンを含むペプチドの場合、隣接する標識が使用される場合、2つのメチル基のみがMSスペクトル上にピークオーバーラップを提示する。各標識ペプチドのピーク強度は、タシマとFricker25で記述された式を用いて補正することができる。
6. ペプチド同定
- ペプチドを同定するには、データベース検索エンジン29,30を用いてMS/MSデータを分析する。
- デコイ融合法を使用して偽発見率(FDR)を計算するには、おとりデータベースを検索します。
注:一般的に使用される検索パラメータは酵素の特異性ではありません。前駆体質量公差セット 15-50 ppm;0.5 Daのフラグメントイオン質量公差;可変修飾:同位体メチル化標識(L1)、L2(+30)、L3(+32)、L4(+34)およびL5(+36)、酸化メチオニン(+15.99Da)およびアセト化(+42.Da)およびアセト化(+42.Da)のリス残基およびN末語からの反応アミン。 - 次に、ペプチドを局所信頼度の平均でソートし、FDR ≤5%でコメントを付け、フィルタリングする最良のスペクトルを選択します。

図1:ペプチド学の研究のワークフロー。 ペプチド抽出とアミンの還元メチル化のステップ。 この図の大きなバージョンを表示するには、ここをクリックしてください。
結果
質量分析計で行われたランから得られた結果は、質量分析計ソフトウェアで開くことができる生データファイルに保存されます。MSスペクトルでは、2〜5ラベルの範囲で、使用される標識スキームに従って標識ペプチドを表すピーク基を観察することができる。例えば、 図2では、クロマトグラフィー時間で検出された一対のピークが、同じ実行で2つの異なるサンプルで使用された同位体ラベルが2つだけの実験で表されている。 図 3 は 、LC-MS の実行ごとに 3 と 4 つの異なるラベルを使用して、肯定的な結果の他の可能性を示しています。LC/MSランで4または5のラベルを使用する場合、各ピークの実際の強度値を得るために修正する必要がある異なるタグを持つ標識ペプチドのピークの重複がある可能性があります(図4)。
同位体標識は、図5に示すように、所定のプロテアーゼまたはペプチダーゼに対するインビトロの基質および製品を示すためにも使用することができる。最後に、異なるソフトウェアを使用して、ピークススタジオやMASCOTなどの標識ペプチドを同定することができます。これらのソフトウェアアプリケーションは、プロテオミクス解析のために作成されました。したがって、ペプチド性分析のためにタンパク質定量データを考慮すべきではなく、信頼性パラメータ内で同定された各標識ペプチドをチェックし、定量化する必要があります。ペプチドが正常に検出され、標識された場合、これらのプログラムは、標識を含む同定されたペプチド配列のリストを提供する。図6は、プログラムによって行われたペプチド配列の同定の一例を示す。この場合、3つの異なるサンプルを個別にラベル付けするために3つの異なる形態のラベル(L1、L3、およびL5)のみを使用し、その後、1回の実行で質量分析法によって混合および分析された。
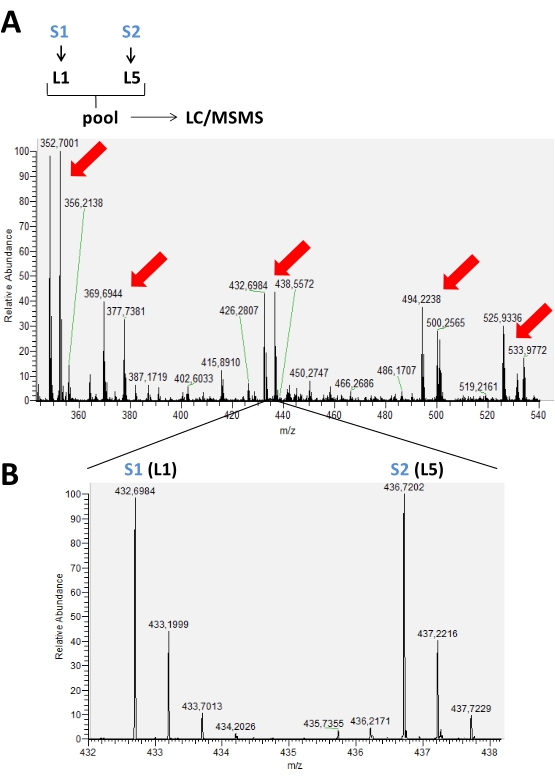
図2:アミンの還元的ジメチル化を用いた典型的な標識実験で蓄積されたクロマトグラフィー時間を表すMSスペクトル。 (A)において、赤色矢印は、2つの異なるサンプル(S1およびS2)間の比較のために2つの同位体形態(L1およびL5)で標識された異なるペプチドのピーク対の存在を示す。(B)において、ラベルの使用に応じた異なるm/zを示す同一ペプチドのMSスペクトルの拡大画像である。この場合、これらのサンプルに存在するこのペプチドのピーク強度にばらつきはなかった。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:異なる数のタグを用いたアミンの還元メチル化を有する標識ペプチドの代表的なMSスペクトル(A)トリプル標識が使用された。L1、L3、およびL5タグでそれぞれ標識された3種類のサンプル(S1、S2、およびS3)に存在するペプチドのMSスペクトルを観察することができる。この場合、L5を有する標識ペプチドのレベルは、L1およびL3タグで標識された同一のペプチドについて2倍のレベルで観察された。(B)L1、L2、L3、およびL4ラベルを用いて四肢化標識を行った。この場合、対照試料(S1およびS3)をそれぞれL1およびL3で標識し、L2およびL4ラベルで標識した2つの実験サンプル(S2およびS4)と比較した。このペプチドはサンプル間に有意差は認められなかった。この図の大きなバージョンを表示するには、ここをクリックしてください。

図4:ピークオーバーラップを呈する標識ペプチドの代表的なMSスペクトル。 この図は、電荷3のペプチドのMSスペクトルを示し、標識に利用可能な単一の一次アミンを有する2098.87 Daの質量を示す。標識ペプチドの違いはわずか2Daで、同じLC/MSランで4または5のラベルを使用すると重複を引き起こします。三次多項式に基づくモデルを使用して、これらのラベル間の重複を補正することができる。グラフでは、赤い棒は、このペプチドに対して調整された強度値の平均を2回で示している。黒いバーは、重なっている強度値の平均を示します。補正後、このペプチドはサンプル間の強度(赤い棒)の変動をほとんど示さなかった。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図5:タンパク質分解研究におけるアミンの還元メチル化を伴う標識ペプチドの代表的なMSスペクトル。 ここで、ペプチド抽出物を200nMおよび20nMの神経リシンでインキュベートし、それらの基質および産物を特徴付けた。結果を確認するために、フォワードおよびリバースラベリング戦略を使用して 2 つの LC/MS を実行しました。2 回目の実行では、最初の実行で使用されるスキームに関連して、ラベリング手順でサンプルの位置が変更されます。Aでは、神経リシン酵素の存在下で変化しないペプチド(NC)を示す。Bにおいて、酵素の高濃度の存在下で消失したペプチド(S2)であり、前方標識と逆標識の両方において酵素(S4)の低濃度の低下が少ない。このペプチドは、酵素の基質(SB)と考えられる。Cにおいて、産物と考えられたペプチド(PD)の一例であり、その濃度が上昇したため(S2及びS4)酵素の存在下で。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図6:代表的なMSMSスペクトルとデータベース検索エンジンによって行われる標識ペプチドの同定。 この例では、それぞれ、L1、L3、およびL5メチル化形態で標識された同じ質量のペプチドに対応するm/z672、3802、676、4045、および680,4241を有する2+イオンを観察することができる。この配列ADQVSASLAKQGLは、ミクロチューブ関連タンパク質タウアイソフォームX1の断片としてMS/MSスペクトルを介して同定された。このペプチドは、標識されたペプチド間に8ダルトンの質量差を加える標識部位として利用できるN末端およびリジンを有する。このペプチドのMSスペクトルを 図3Aに示す。 この図の大きなバージョンを表示するには、ここをクリックしてください。
| 見本 | H2CO | D2CO | D213CO | ナブ3CN | ナブド3CN | ラベル | 追加質量 |
| 2 x 4 μL | 2 x 4 μL | 2 x 4 μL | 2 x 4 μL | 2 x 4 μL | コード | (ダ) | |
| 1 | X | X | L1 | 28.0313 | |||
| 2 | X | X | L2 | 30.0439 | |||
| 3 | X | X | L3 | 32.0564 | |||
| 4 | X | X | L4 | 34.069 | |||
| 5 | X | X | L5 | 36.0757 |
表1:ホルムアルデヒドとシアノ水素化ナトリウム の示された重水素および非重水素形態の組み合わせを用いた代表的な実験の試薬。
ディスカッション
ほとんどのペプチド化研究では、重要なステップの1つは、間違いなく、数分後にプロテアーゼによって生成されるペプチド断片の存在を避けるために慎重に行うべきサンプル調製である。非マイクロ波サンプルから調製された脳抽出物に関する最初の研究では、10-kDaマイクロフィルトレートに存在する多数のタンパク質断片が示された。タンパク質分解によるペプチドスペクトルを避けるためにさまざまなアプローチが記載されている:焦点を合わせたマイクロ波照射動物犠牲6,8、クライオスタット解剖、沸騰抽出buffer31、家庭用型マイクロ波オーブン9,26を使用した組織のポスト犠牲マイクロ波照射.細胞培養およびいくつかの組織の場合、プロテアーゼの不活性化は、80°Cで水を加えることによって直接行うことができる。 しかし、神経組織などの一部のサンプルは、事後変化に対してより敏感であり、かつマイクロ波照射によるプロテアーゼ不活性化が選択方法として示されている。さらに、ペプチド抽出中のもう一つの重要な点は、Asp-Pro結合の切断のような酸陰唇結合が壊れないように酸を加える前に抽出物が氷冷であることを確認することです。
ペプチドの相対的な定量化には異なる戦略を用いることができますが、どれも完全に理想的とは考えられません。使用する方法を選択するには、研究者は、質量分析計での使用時間の可用性、市販および標識試薬のコスト、および得られたデータの分析における容易さなどの要因を考慮する必要があります17,25,26,32。ラベルフリー法は広く使用されてきたが、質量分析計で多くの時間を必要とします。各サンプルに技術的な複製を注入する必要があり、サンプル間のクロマトグラフィー再現性に依存します。他の化学標識試薬は、例えば、ITRAQ(相対定量および絶対定量のための等圧タグ)およびTMT(タンデム質量タグ)は高価であり、MS/MS分析25、33、34のために選択されたペプチドの定量のみを提供する。
RMAを用いた化学標識による相対的定量の主な制限は、一次アミンを有するペプチドに対しては2Da、N末流プロリンを有するペプチドで1Daの質量差を生じ、内部リジン残基を有しない場合、同じ実行で4または5のラベルを用いてプロトコルを行う場合に発生する重複である。しかし、田島とフリッカー(2018)は、サンプル中の標識ペプチドの正しい強度を得る3次多項式25に基づいて同位体重複を補正するモデルを開発しました。さらに、RMAでは全てのペプチドが見られるわけではない。例えば、いくつかのペプチドは、アセチル化、ピログルタミン化、または別の修飾によるN末端遊離アミンを欠いている。内部リジンがこれらのペプチドにも存在しない場合、それらはRMA試薬によって標識されず、m/zスペクトル上に定量化不可能な単一のピーク27として現れます。
開示事項
競合する財政的利益は存在しない。
謝辞
ここで説明する技術の開発と使用は、ブラジル国立研究評議会の助成金420811/2018-4(LMC)によってサポートされました。フンダサン・デ・アンパロ・ア・ペスキサ・ド・エスタド・デ・サンパウロ(www.fapesp.br)は、2019/16023-6(LMC)、2019/17433-3(LOF)、21/01286-1(MEME)を助成金に与えます。資金提供者は、研究設計、データ収集と分析、出版の決定、または記事の準備に何の役割も持っていませんでした。
資料
| Name | Company | Catalog Number | Comments |
| 10 kDa cut-off filters | Merck Millipore | UFC801024 | Amicon Ultra-4, PLGC Ultracel-PL Membrane, 10 kDa |
| Acetone | Sigma-Aldrich | 179124 | |
| Acetonitrile | Sigma-Aldrich | 1000291000 | |
| Ammonium bicarbonate | Sigma-Aldrich | 11213 | |
| analytical column (EASY-Column) | EASY-Column | (SC200) | 10 cm, ID75 µm, 3 µm, C18-A2 |
| Ethyl 3-aminobenzoate methanesulfonate | Sigma-Aldrich | E10521 | MS-222 |
| Fluorescamine | Sigma-Aldrich | F9015 | |
| Formaldehyde solution | Sigma-Aldrich | 252549 | |
| Formaldehyde-13C, d2, solution | Sigma-Aldrich | 596388 | |
| Formaldehyde-d2 solution | Sigma-Aldrich | 492620 | |
| Formic acid | Sigma-Aldrich | 33015 | |
| Fume hood | Quimis | Q216 | |
| Hydrochloric acid - HCl | Sigma-Aldrich | 258148 | |
| LoBind-Protein retention tubes | Eppendorf | EP0030108116-100EA | |
| LTQ-Orbitrap Velos | Thermo Fisher Scientific | LTQ Velos | |
| Microwave oven | Panasonic | NN-ST67HSRU | |
| n Easy-nLC II nanoHPLC | Thermo Fisher Scientific | LC140 | |
| PEAKS Studio | Bioinformatics Solutions Inc. | VERSION 8.5 | |
| Phosphate-buffered saline | Invitrogen | 3002 | tablets |
| precolumn (EASY-Column) | Thermo Fisher Scientific | (SC001) | 2 cm, ID100 µm, 5 µm, C18-A1 |
| Refrigerated centrifuge | Hermle | Z326K | for conical tubes |
| Refrigerated centrifuge | Vision | VS15000CFNII | for microtubes |
| Reversed-phase cleanup columns (Oasis HLB 1 cc Cartridge) | Waters | 186000383 | Oasis HLB 1 cc Cartridge |
| Sodium cyanoborodeuteride - NaBD3CN | Sigma-Aldrich | 190020 | |
| Sodium cyanoborohydride - NaBH3CN | Sigma-Aldrich | 156159 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | NOTE: 0.2 M PB= 0.1 M phosphate buffer pH 6.8 (26.85 mL of Na2HPO3 1M) plus 0.1 M phosphate buffer pH 6.8 (23.15 mL of NaH2PO3 1M) to 250 ml of water |
| Sodium phosphate monobasic | Sigma-Aldrich | S3139 | |
| Sonicator | Qsonica | Q55-110 | |
| Standard peptide | Proteimax | amino acid sequence: LTLRTKL | |
| Triethylammonium buffer - TEAB 1 M | Sigma-Aldrich | T7408 | |
| Trifluoroacetic acid - TFA | Sigma-Aldrich | T6508 | |
| Ultra purified water | Milli-Q | Direct-Q 3UV | |
| Vacuum centrifuge | GeneVac | MiVac DNA concentrator | |
| Water bath | Cientec | 266 | |
| Xcalibur Software | ThermoFisher Scientific | OPTON-30965 |
参考文献
- Kandpal, R., Saviola, B., Felton, J. The era of 'omics unlimited. Biotechniques. 46 (5), 354-355 (2009).
- Farrokhi, N., Whitelegge, J. P., Brusslan, J. A. Plant peptides and peptidomics. Plant Biotechnology Journal. 6 (2), 105-134 (2008).
- Schulz-Knappe, P., Schrader, M., Zucht, H. D. The peptidomics concept. Combinatorial Chemistry & High Throughput Screening. 8 (8), 697-704 (2005).
- Dallas, D. C., et al. Current peptidomics: applications, purification, identification, quantification, and functional analysis. Proteomics. 15 (5-6), 1026-1038 (2015).
- Chard, T. An introduction to radioimmunoassay and related techniques (3rd Ed). FEBS Letters. 238 (1), 223(1988).
- Svensson, M., Sköld, K., Svenningsson, P., Andren, P. E. Peptidomics-based discovery of novel neuropeptides. Journal of Proteome Research. 2 (2), 213-219 (2003).
- Baggerman, G., et al. Peptidomics. Journal of Chromatography B. 803, 3-16 (2004).
- Theodorsson, E., Stenfors, C., Mathe, A. A. Microwave irradiation increases recovery of neuropeptides from brain tissues. Peptides. 11, 1191-1197 (1990).
- Che, F. Y., Lim, J., Pan, H., Biswas, R., Fricker, L. D. Quantitative neuropeptidomics of microwave-irradiated mouse brain and pituitary. Molecular & Cellular Proteomics. 4, 1391-1405 (2005).
- Dasgupta, S., et al. Analysis of the yeast peptidome and comparison with the human peptidome. PLoS One. 11 (9), 0163312(2016).
- Teixeira, C. M. M., Correa, C. N., Iwai, L. K., Ferro, E. S., Castro, L. M. Characterization of Intracellular Peptides from Zebrafish (Danio rerio) Brain. Zebrafish. 16 (3), 240-251 (2019).
- Fricker, L. D. Analysis of mouse brain peptides using mass spectrometry-based peptidomics: implications for novel functions ranging from non-classical neuropeptides to microproteins. Molecular BioSystems. 6 (8), 1355-1365 (2010).
- Gelman, J. S., Sironi, J., Castro, L. M., Ferro, E. S., Fricker, L. D. Peptidomic analysis of human cell lines. Journal of Proteome Research. 10 (4), 1583-1592 (2011).
- De Araujo, C. B., et al. Intracellular peptides in cell biology and pharmacology. Biomolecules. 9, 150(2019).
- Gewehr, M. C. F., Silverio, R., Rosa-Neto, J. C., Lira, F. S., Reckziegel, P., Ferro, E. S. Peptides from natural or rationally designed sources can be used in overweight, obesity, and type 2 diabetes therapies. Molecules. 25 (5), 1093(2020).
- Sakaya, G. R., et al. Peptidomic profiling of cerebrospinal fluid from patients with intracranial saccular aneurysms. Journal of Proteomics. 240 (3), 104188(2021).
- Fricker, L. Quantitative peptidomics: General considerations. Methods in Molecular Biology. 1719, 121-140 (2018).
- Southey, B. R., et al. Comparing label-free quantitative peptidomics approaches to characterize diurnal variation of peptides in the rat suprachiasmatic nucleus. Analytical Chemistry. 86 (1), 443-452 (2014).
- Chen, X., Wei, S., Ji, Y., Guo, X., Yang, F. Quantitative proteomics using SILAC: Principles, applications, and developments. Proteomics. 15 (18), 3175-3192 (2015).
- Boonen, K., et al. Quantitative peptidomics with isotopic and isobaric tags. Methods in Molecular Biology. 1719, 141-159 (2018).
- Gewehr, M. C. F., et al. The relevance of thimet oligopeptidase in the regulation of energy metabolism and diet-induced obesity. Biomolecules. 10 (2), 321(2020).
- Fiametti, L. O., Correa, C. N., Castro, L. M. Peptide profile of zebrafish brain in a 6-OHDA-induced Parkinson model. Zebrafish. 18 (1), 55-65 (2021).
- Boersema, P. J., Raijmakers, R., Lemeer, S., Mohammed, S., Heck, A. J. Multiplex peptide stable isotope dimethyl labeling for quantitative proteomics. Nature Protocols. 4 (4), 484-494 (2009).
- Dasgupta, S., Castro, L. M., Tashima, A. K., Fricker, L. Quantitative peptidomics using reductive methylation of amines. Methods in Molecular Biology. 1719, 161-174 (2018).
- Tashima, A. K., Fricker, L. D. Quantitative peptidomics with five-plex reductive methylation labels. Journal of the American Society for Mass Spectrometry. 29 (5), 866-878 (2018).
- Che, F. Y., et al. Optimization of neuropeptide extraction from the mouse hypothalamus. Journal of Proteome Research. 6 (12), 4667-4676 (2007).
- Lyons, P. J., Fricker, L. D. Peptidomic approaches to study proteolytic activity. Current Protocols in Protein Science. , Chapter 18 13(2011).
- Udenfriend, S., et al. Fluorescamine: a reagent for assay of amino acids, peptides, proteins, and primary amines in the picomole range. Science. 178 (4063), 871-872 (1972).
- Ma, B., et al. PEAKS: powerful software for peptide de novo sequencing by tandem mass spectrometry. Rapid Communications in Mass Spectrometry. 17 (20), 2337-2342 (2003).
- Zhang, J., et al. PEAKS DB: de novo sequencing assisted database search for sensitive and accurate peptide identification. Molecular & Cellular Proteomics. 11 (4), 1-8 (2012).
- Sturm, R. M., Dowell, J. A., Li, L. Rat brain neuropeptidomics: tissue collection, protease inhibition, neuropeptide extraction, and mass spectrometric analysis. Methods in Molecular Biology. 615, 217-226 (2010).
- Fricker, L. D. Limitations of mass spectrometry-based peptidomic approaches. Journal of the American Society for Mass Spectrometry. 26 (12), 1981-1991 (2015).
- Ross,, et al. Multiplexed protein quantitation in Saccharomyces cerevisiae using amine-reactive isobaric tagging reagents. Molecular & Cellular Proteomics. 3, 1154-1169 (2004).
- Thompson, A., et al. Tandem mass tags: a novel quantification strategy for comparative analysis of complex protein mixtures by MS/MS. Analytical Chemistry. 75, 1895-1904 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved