Method Article
إعداد العينة والكمية النسبية باستخدام الميثيل الاختزالي للأمينات لدراسات علم البيبتي
In This Article
Summary
توضح هذه المقالة طريقة إعداد عينة تستند إلى تعطيل الحرارة للحفاظ على الببتيدات الذاتية تجنب تدهور بعد الوفاة، تليها الكمية النسبية باستخدام وضع العلامات النظيرية بالإضافة إلى LC-MS.
Abstract
يمكن تعريف Peptidomics على أنه التحليل النوعي والكمي للببتيدات في عينة بيولوجية. وتشمل تطبيقاتها الرئيسية تحديد المؤشرات الحيوية الببتيد للمرض أو الإجهاد البيئي، وتحديد الببتيدات العصبية والهرمونات والببتيدات النشطة بيولوجيا داخل الخلايا، واكتشاف الببتيدات المضادة للميكروبات والنوترية من التحللات المائية البروتينية، ويمكن استخدامها في الدراسات لفهم العمليات البروتيوليكية. وقد ساهم التقدم الأخير في إعداد العينات وطرق الفصل وتقنيات قياس الطيف الكتلي والأدوات الحسابية المتعلقة بتسلسل البروتين في زيادة عدد الببتيدات المحددة والببتيدات المميزة. دراسات الببتيدات في كثير من الأحيان تحليل الببتيدات التي يتم إنشاؤها بشكل طبيعي في الخلايا. هنا ، يتم وصف بروتوكول إعداد العينة على أساس تعطيل الحرارة ، مما يلغي نشاط البروتيز ، والاستخراج مع ظروف خفيفة ، لذلك لا يوجد انشقاق في روابط الببتيد. وبالإضافة إلى ذلك، يظهر أيضا الكمية النسبية للببتيدات باستخدام وسم النظائر المستقرة عن طريق الميثيل الاختزالي للأمينات. هذه الطريقة وضع العلامات لديها بعض المزايا والكواشف المتاحة تجاريا، وغير مكلفة بالمقارنة مع غيرها، مستقرة كيميائيا، ويسمح بتحليل ما يصل إلى خمس عينات في تشغيل LC-MS واحد.
Introduction
تتميز علوم "Omics" بالتحليل العميق لمجموعة الجزيئات ، مثل الحمض النووي ، الحمض النووي الريبي ، البروتينات ، الببتيدات ، المستقلبات ، إلخ. وقد أحدثت هذه مجموعات البيانات على نطاق واسع (علم الجينوم، وعلم النسخ، والبروتيوميات، وعلم البيبتيدم، وعلم الأيض، وما إلى ذلك) ثورة في علم الأحياء وأدت إلى فهم متقدم للعمليات البيولوجية1. بدأ مصطلح peptidomics في أوائل القرن العشرين ، وقد أشار إليه بعض المؤلفين على أنه فرع من proteomics2. ومع ذلك ، فإن peptidomics له خصائص متميزة ، حيث يكون الاهتمام الرئيسي هو التحقيق في محتوى الببتيدات المتولد بشكل طبيعي أثناء العمليات الخلوية ، وكذلك توصيف النشاط البيولوجي لهذه الجزيئات3،4.
في البداية، اقتصرت دراسات الببتيد النشطة بيولوجيا على الببتيدات العصبية والببتيدات الهرمونية من خلال تدهور إدمان والكيمونواساي الإشعاعي. ومع ذلك، فإن هذه التقنيات لا تسمح بإجراء تحليل عالمي، اعتمادا على عزل كل الببتيد بتركيزات عالية، والوقت لتوليد الأجسام المضادة، إلى جانب إمكانية التفاعل المتبادل5.
ولم يتسن إجراء تحليل Peptidomics إلا بعد عدة أوجه تقدم في الكروماتوغرافيا السائلة إلى جانب قياس الطيف الكتلي (LC-MS) ومشاريع الجينوم التي قدمت تجمعات بيانات شاملة لدراسات البروتيوميات/علم البيبتيديميكس6،7. وعلاوة على ذلك، كان لا بد من وضع بروتوكول محدد لاستخراج الببتيد للببتيدات لأن الدراسات الأولى التي حللت الببتيدات العصبية على الصعيد العالمي في عينات الدماغ أظهرت أن الكشف تأثر بالتدهور الهائل للبروتينات، التي تحدث أساسا في هذا النسيج بعد دقيقة واحدة بعد الوفاة. وجود هذه شظايا الببتيد يخفي إشارة الببتيد العصبي ولم يمثل الببتيدومي في الجسم الحي. تم حل هذه المشكلة بشكل رئيسي مع تطبيق تعطيل التدفئة السريعة من البروتياز باستخدام إشعاع الميكروويف ، مما قلل بشكل كبير من وجود هذه الأجزاء الأثرية وسمح ليس فقط بتحديد شظايا الببتيد العصبي ولكن كشف عن وجود مجموعة من الببتيدات من البروتينات الخلوية والميتوكوندريا والنووية ، مختلفة عن degradome6،8،9.
سمحت هذه الإجراءات المنهجية بتوسيع الببتيدوم إلى ما وراء الببتيدات العصبية المعروفة ، حيث تم تحديد مئات الببتيدات داخل الخلايا التي تم إنشاؤها بشكل رئيسي من خلال عمل البروتياسومات في yeast10 ، zebrafish11 ، أنسجة القوارض12 ، والخلايا البشرية13. وقد ثبت على نطاق واسع أن العشرات من هذه الببتيدات داخل الخلايا لديها أنشطة بيولوجية ودوائية على حد سواء14,15. وعلاوة على ذلك، يمكن استخدام هذه الببتيدات كمؤشرات بيولوجية للمرض وربما يكون لها أهمية سريرية، كما هو موضح في السائل النخاعي من المرضى الذين يعانون من تمدد الأوعية الدموية التراكمي داخل الجمجمة16.
حاليا، بالإضافة إلى تحديد تسلسل الببتيد، فمن الممكن من خلال قياس الطيف الكتلي للحصول على بيانات الكمية المطلقة والنسبية. في الكمية المطلقة ، يتم مقارنة مستويات الببتيد في العينة البيولوجية بالمعايير الاصطناعية ، بينما في الكمية النسبية ، يتم مقارنة مستويات الببتيد بين عينتين أو أكثر17. ويمكن إجراء الكمية النسبية باستخدام النهج التالية: 1) "خالية من التسمية"18؛ (2) "خالية من التسمية"18؛ (2) "3" "3" "3" و"3" "3" "3" و"1" "3 2) في الوسم الأيضي في الجسم الحي أو 3) وضع العلامات الكيميائية. ويستند الأخيران على استخدام أشكال نظائر مستقرة أدرجت في الببتيدات19,20. في التحليل الخالي من التسمية، يتم تقدير مستويات الببتيد من خلال النظر في قوة الإشارة (العد الطيفي) خلال LC-MS18. ومع ذلك، يمكن وضع العلامات النظيرية الحصول على مستويات نسبية أكثر دقة من الببتيدات.
استخدمت العديد من الدراسات peptidomic trimethylammonium butyrate (TMAB) وضع العلامات على الكواشف والعلامات الكيميائية، ومؤخرا، تم استخدام الميثيل الاختزالي للأمينات (RMA) مع أشكال من الفورمالديهايد والصوديوم السيانوبوروهيدريد الكواشف deuterated وغير deuterated. ومع ذلك، تسميات TMAB غير متوفرة تجاريا، وعملية التوليف شاقة جدا. من ناحية أخرى ، في RMA ، تكون الكواشف متاحة تجاريا ، وغير مكلفة مقارنة بالملصقات الأخرى ، والإجراء بسيط الأداء ، والببتيدات المسماة مستقرة23،24.
استخدام RMA ينطوي على تشكيل قاعدة شيف من خلال السماح للببتيدات للرد مع الفورمالديهايد، تليها رد فعل الحد من خلال cyanoborohydride. رد الفعل هذا يسبب ثنائي ميثيل من المجموعات الأمينية الحرة على N-المحطات الطرفية والسلاسل الجانبية ليسين وmonomethylates N-محطة prolines. كيف غالبا ما تكون بقايا البرولين نادرة على محطة N ، يتم تسمية جميع الببتيدات ذات الأمينات المجانية على N-terminus بمجموعتين الميثيل23،24،25.
Protocol
تم تكييف الإجراء التالي لاستخراج الببتيد والميثيل الاختزالي من الإجراءات المنشورة سابقا24,25,26,27. وقد اتبع هذا البروتوكول المبادئ التوجيهية للمجلس الوطني لمراقبة التجارب على الحيوانات ووافقت عليه لجنة الأخلاقيات لاستخدام الحيوانات في معهد العلوم البيولوجية بجامعة ولاية ساو باولو. يتم عرض خطوات البروتوكول في الشكل 1.
ملاحظة: إعداد كافة الحلول المائية في المياه فائقة النحافة.
1. استخراج الببتيد
- ثقافة الخلية
- زراعة خلايا SHSY5Y في طبق 15 سم في 37 درجة مئوية تحت 5٪ CO2 في المتوسط النسر المعدلة دولبيكو تحتوي على 15٪ مصل البقر الجنين و 1٪ البنسلين-ستريبتوميسين.
- استخدام 2-3 لوحات لكل عينة. تنمو الخلايا إلى التقاء 100٪.
- بعد العلاج المقصود، غسل الخلايا مرتين مع المالحة الفوسفات العازلة. بعد ذلك، أضف 10 مل من المالحة العازلة بالفوسفات، وكشط الخلايا وجمعها في أنبوب 15 مل.
- سنتريفوجيت في 800 × ز لمدة 5 دقائق وإزالة supernatant. Resuspend بيليه في 1 مل من المياه فائقة تنقية deionized في 80 درجة مئوية.
- نقل محتويات الأنبوب (lysate الخلوية) إلى أنبوب ميكروفوجي 2 مل.
- الأنسجة الحيوانية (الأنسجة العصبية أساسا):
- تخدير البرية من نوع الذكور البالغين دانيو rerio (حمار وحشي) مع جرعة قاتلة من MS 222 (100 ملغ / لتر) وأخضعها على الفور إلى 8 ق من إشعاع الميكروويف لتعويش peptidase وبروتيز.
ملاحظة: يمكن استخدام فرن ميكروويف منزلي. تم استخدام ميكروويف 900 واط لمدة 8 إلى 10 ق في السلطة الكاملة. يجب أن يكون الميكروويف المستخدم قادرا على رفع درجة حرارة الدماغ إلى > 80 درجة مئوية في غضون 10 ق. كما يمكن الاستفادة من إعادة التكاثر في التدفئة بين العينات عن طريق وضع الأنسجة في نفس الموقع في الميكروويف. - بعد تعطيل الحرارة، اجمع الدماغ بأكمله في أنبوب ميكروفوجي سعة 2 مل وتجمد عند −80 درجة مئوية حتى التحليل.
- إعادة إنفاق عينة الأنسجة في 1 مل من المياه شديدة التأين في 80 درجة مئوية. Sonicate الأنسجة مع التحقيق باستخدام 30 نبضة (4 هرتز) من 1 ق.
ملاحظات: بالنسبة لأنسجة الكبد والكلى، استخدم متجانس ميكانيكي عند 10,000-30,000 دورة في الدقيقة لمدة 20 s. للأنسجة العضلية، طحن الأنسجة في النيتروجين السائل باستخدام بوتقة الخزف والحشرات. الخطوات التالية هي نفسها بالنسبة للتحلل الخلوي أو الأنسجة المتجانسة.
- تخدير البرية من نوع الذكور البالغين دانيو rerio (حمار وحشي) مع جرعة قاتلة من MS 222 (100 ملغ / لتر) وأخضعها على الفور إلى 8 ق من إشعاع الميكروويف لتعويش peptidase وبروتيز.
- احتضان الأنسجة الخلوية أو المتجانسة في 80 درجة مئوية لمدة 20 دقيقة. بعد ذلك، تبريده على الجليد لمدة 10-30 دقيقة.
- إضافة 10 ميكرولتر من محلول مخزون 1 M HCl لكل مل واحد من حجم العينة للحصول على تركيز نهائي قدره 10 mM. تخلط عن طريق الدوامة لمدة 20 ق واحتضان مزيد من على الجليد لمدة 15 دقيقة.
ملاحظة: قبل التحمض، تأكد من تبريد العينة بالكامل لتجنب كسر روابط الببتيد الناجمة عن التحمض في درجات حرارة مرتفعة. - الطرد المركزي lysate الخلوية أو الأنسجة المتجانسة في 12000 س ز في 4 درجة مئوية لمدة 15 دقيقة. جمع supernatant في أنابيب البروتين microcentrifuge منخفضة الربط وتخزينها في -80 درجة مئوية.
- تنظيف أجهزة الترشيح الفائق (10 kDa قطع مرشحات) عن طريق إضافة المياه والطرد المركزي في 2300 x ز لمدة 3 دقائق. كرر هذه الخطوة مرتين أخريين.
- ضع الناطور الفائق في مرشحات القطع والطرد المركزي التي تم غسلها مسبقا 10 كيلودا عند 2300 × جم عند 4 درجات مئوية لمدة 50 دقيقة في جهاز طرد مركزي تم تجديده. تدفق من خلال يمثل استخراج الببتيد.
- تحلية العينات على أعمدة تنظيف المرحلة عكس وفقا لتعليمات الشركة المصنعة باستخدام أسيتونيتريل (ACN) وحمض ثلاثي الفلورواستيك (TFA) الحلول على النحو المبين أدناه:
- إعادة توازن العمود مع 1 مل من ACN 100٪.
- غسل العمود مع محلول 1 مل من 5٪ ACN مع 0.1٪ TFA.
- تحميل وحدة التخزين الكاملة للعينة في العمود.
- غسل العمود مع محلول 1 مل من ACN 5٪ مع 0.1٪ TFA
- Elute الببتيدات من العمود مع محلول 1.8 مل من ACN 100٪ مع 0.15٪ TFA في أنابيب الطرد الدقيق منخفضة الربط البروتين.
- جفف العينة تماما في جهاز طرد مركزي فراغي. تعيين طريقة تركيز للمذيبات العضوية ودرجة الحرارة في 30 درجة مئوية. يتم مراقبة وقت التركيز على الشاشة.
- تخزين العينات في −80 درجة مئوية حتى الخطوة التالية.
2. الببتيد الكمي مع الفلورسكمين
ملاحظة: يمكن تقدير كمية الببتيد باستخدام الفلورسكامين عند pH 6.8 كما هو موضح سابقا11,28. وتتكون هذه الطريقة من مرفق جزيء الفلورستامين إلى الأمينات الأولية الموجودة في بقايا اليسين (K) و / أو N-محطة الببتيدات. يتم تنفيذ رد الفعل في درجة الحموضة 6.8 لضمان أن الفلورسكامين يتفاعل فقط مع المجموعات الأمينية للببتيدات وليس مع الأحماض الأمينية الحرة. يتم قياس الفلورسكامين باستخدام مقياس الطيف عند طول موجي مثير قدره 370 نانومتر وطول موجي للانبعاثات قدره 480 نانومتر.
- إعداد تركيزات مختلفة من الببتيد القياسية (0.05، 0.1، 0.15، 0.2، 0.3، 0.5 و 0.7 ميكروغرام / ميكرولتر) وتخزين الاقتباسات في -20 درجة مئوية.
ملاحظة: يقترح الببتيد 5A (LTLRTKL) لأنه يحتوي على تكوين وتركيز معروفين. - إعداد محلول مخزون الفلورسكامين (0.3 ملغم/مل) في الأسيتون. Aliquot بسرعة في أنابيب الطرد الدقيق (1 مل) ، ختم باستخدام parafilm ، وتخزينها في -20 درجة مئوية في الظلام.
- إعداد 0.2 M الفوسفات العازلة (PB) في pH 6.8.
ملاحظة: تحضير 0.2 M PB بإضافة 0.1 M الفوسفات العازلة درجة الحموضة 6.8 (26.85 مل من Na2HPO3 1M) و 0.1 M الفوسفات العازلة درجة الحموضة 6.8 (23.15 مل من NaH2PO3 1M) إلى 250 مل من المياه - Resuspend عينات الببتيد في 100-200 ميكرولتر من المياه فائقة النقاء.
- ماصة 2.5 ميكرولتر من تركيزات الببتيد القياسية وعينات على لوحة بيضاء 96 جيدا لاتقياسات الفلورية في ثلاثية. إضافة 25 ميكرولتر من 0.2 متر الفوسفات العازلة.
- إضافة 12.5 ميكرولتر من الفلورسكمين مع ماصة متعددة القنوات. تجانس بلطف لمدة دقيقة واحدة على شاكر الدوار المداري.
- بعد ذلك، أضف 110 ميكرولتر من الماء مع ماصة متعددة القنوات لوقف رد الفعل.
ملاحظة: نقل محلول مخزون الفلورسكامين والمياه فائقة البور إلى خزانين لأنابيب هذه الحلول مع ماصة متعددة القنوات. - ضبط معلمات القراءة التالية على مقياس الطيف: اقرأ العينات من الأعلى، والطول الموجي للإثارة عند 370 نانومتر، والطول الموجي للانبعاثات عند 480 نانومتر.
- قراءة لوحة على مقياس الطيف.
3. اختزال ميثيل الأمينات وضع العلامات
ملاحظة: تستند طريقة وضع العلامات النظيرية هذه إلى ثنائي ميثيل مجموعات الأمين ذات الأشكال غير المقيتة وغير المقيتة من الفورمالديهايد وكواشف سيانوبوروهيدريد الصوديوم. المنتج النهائي لهذا التفاعل يضيف 28 دا، 30 دا، 32 دا، 34 دا، أو 36 دا إلى الكتلة النهائية من كل الببتيد في كل موقع وضع العلامات المتاحة (ليسين أو N-المحطة الطرفية). وينتج عن رد الفعل هذا فرق m/z في الببتيدات المسماة بأشكال مختلفة لوحظت في طيف التصلب المتعدد (الجدول 1).
تنبيه: ينبغي استخدام معدات السلامة المناسبة للتعامل مع هذه المركبات، وينبغي توخي الحذر للحد من التعرض. وينبغي إجراء الإجراءات مع الفورمالديهايد والصوديوم السيانوبوروهيدريد الكواشف في غطاء الدخان لأنها سامة جدا (بما في ذلك وزن الصوديوم سيانوبوروهيدريد). أثناء رد فعل التبريد والتحمض ، يمكن توليد غاز سام (سيانيد الهيدروجين).
- إعداد الحلول الطازجة التالية من المخزون أو الكواشف في يوم الإجراء في المياه فائقة البور:
- تمييع مخزون 37٪ الفورمالديهايد (CH2O) إلى 4٪.
- تمييع المخزون من 20٪ الفورمالديهايد Deuterated (CD2O) إلى 4٪.
- تمييع المخزون من 20 ٪ Deuterated C13 الفورمالديهايد (13CD2O) إلى 4٪.
- إعداد 0.6 M NaBH3CN.
- إعداد 0.6 M NaBD3CN.
- إعداد حل من بيكربونات الأمونيوم 1٪.
- إعداد محلول 5٪ حمض الفورميك.
ملاحظة: فيما يتعلق بالكمية النسبية للببتيدات ، حيث يمكن تنفيذ مخططات تجريبية مختلفة اعتمادا على عدد التسميات المستخدمة ، فإن الاهتمام ضروري أثناء إجراء وضع العلامات الكيميائية. فمن المستحسن لفصل aliquots صغيرة من التسميات في رفوف منفصلة مع عينات منها لتكون وصفت للحد من احتمال حدوث خطأ بشري في إضافة كاشف خاطئ إلى أنابيب العينة.
- إعداد كل عينة تحتوي على ما يصل إلى 25 ميكروغرام من الببتيد. يجب ألا تحتوي العينات على تريس أو بيكربونات الأمونيوم.
ملاحظة: الكميات الموضحة أدناه كافية لكل عينة في حجم 100 ميكرولتر.
المضي قدما في الخطوات 3.3-3.8 في غطاء الدخان. - إضافة 1/10th حجم 1 M TEAB إلى العينات (التركيز النهائي للمحلول 100 mM من TEAB). تحقق من مؤشر الحموضة بورق مؤشر pH؛ يجب أن يكون بين 5-8. ضبط مع HCl أو NaOH إذا لزم الأمر.
- إضافة 4 ميكرولتر من الفورمالديهايد غير deuterated، deuterated أو C13 deuterated الفورمالديهايد وفقا لنظام وضع العلامات المعمول بها. مزيج لمدة 5 ق عن طريق الدوامة.
- إضافة 4 ميكرولتر من NaBH3CN (0.6 M) أو NaBD3CN (0.6 M) وفقا لنظام وضع العلامات المعمول بها. مزيج لمدة 5 ق عن طريق الدوامة.
- احتضان في غطاء الدخان لمدة 2 ساعة في درجة حرارة الغرفة، وخلط كل 30 دقيقة.
- كرر الخطوتين 3.4 و3.5. احتضان العينات في غطاء الدخان بين عشية وضحاها في درجة حرارة الغرفة.
- أضف 16 ميكرولتر من بيكربونات الأمونيوم (1٪) ضع العينة على الجليد، وأضف 8 ميكرولتر من حمض الفورميك (5٪)، واخلطها حسب الدوامة لمدة 5 ق.
- اجمع العينات، واضبط درجة الحموضة إلى 2-4، وتخلص من العينات المجمعة على أعمدة تنظيف المراحل المعكوسة كما هو موضح سابقا في الخطوة 1.8.
- جفف العينة تماما في جهاز طرد مركزي فراغي. تعيين طريقة تركيز للمذيبات العضوية ودرجة الحرارة في 30 درجة مئوية. يتم مراقبة وقت التركيز على الشاشة.
- تخزين العينات في -20 درجة مئوية.
4. الكروماتوغرافيا السائلة وقياس الطيف الكتلي
- إجراء تحليل LC-MS باستخدام نظام nanoHPLC مقترنا بأداة MS متوافقة مع علامات الميثيل.
ملاحظة: مجموعة متنوعة من أدوات MS متوافقة مع وضع العلامات RMA. يستخدم نظام nanoHPLC المقترن ب Orbitrap عادة لإجراء تحليل LC-MS من خلال مصدر أيون نانوي. أولا، يتم تحميل العينة في مرحلة ما قبل الإخمد والببتيدات منفصلة في عمود تحليلي. يتم تنفيذ elution من الببتيدات باستخدام التدرج الخطي من 5٪ -45٪ أسيتونيتريل، في حمض الفورميك 0.1٪، خلال 90 دقيقة، مع تدفق 200 nL/min. تم تعيين مطياف الكتلة لتعمل في وضع البيانات تعتمد. يتم الحصول على كل مسح كامل في كثافة 10-30 eV، 2.3 كيلوفولت، ومن ثم يتم اختيار قمم أعلى عشرة للتجزئة الناجمة عن الاصطدام (CID). يتم تعيين وقت الحقن على فخ الأيونات في 100 مللي ثانية، ويتم إصلاح حقن فورييه تحويل (FT)-MS مع قرار من 1000 مللي ثانية 30،000 في م / ض 300-1800. يتم استخدام عدد 5000 على الأقل والاستبعاد الديناميكي ل 70 s لإجراء مسح التجزئة.
5. الكمية النسبية للببتيدات
ملاحظة: يتم تحليل أطياف MS في برنامج مطياف الكتلة. يتم تحديد مجموعات الذروة من الببتيدات المسماة مع علامات مختلفة في أطياف MS. يتم حساب الكمية النسبية من خلال كثافة كل قمة أحادية النظائر. تتم مقارنة كل مجموعة معالجة بمجموعة التحكم المعنية.
- انقر نقرا مزدوجا على ملف العينة الخام لفتح برنامج تحليل الطيف. قم بتحميل اللونيات الزمنية (RT) وMS الطيف (EM) في علامتي تبويب، أعلى وأسفل، على التوالي.
- انقر بزر الماوس الأيمن مرة واحدة بشكل تسلسلي على رموز خيارات العرض والكتلة في شريط أدوات البرامج وتعيين دقة الكتلة إلى أربع أرقام عشرية.
- ضع مؤشر الماوس في أي مكان على علامة التبويب RT. ابحث عن وقت الاحتفاظ بالأيون المقابل ليتم تحليله وانقر على زر الماوس الأيمن. سيتم عرض طيف MS للوقت المحدد تلقائيا في علامة التبويب EM.
- ضع مؤشر الماوس في أي مكان على علامة التبويب EM. ابحث عن الأيونات التي سيتم تحليلها.
- انقر بزر الماوس الأيمن مع الاستمرار في منطقة مجاورة إلى اليسار بالقرب من هذه الأيونات. ثم اسحب الماوس إلى اليمين في النطاق المطلوب لتكبير منطقة الاهتمام.
- إبقاء الماوس في وضع علامة التبويب EM وانقر على السهمين لوحة المفاتيح اليمنى أو اليسرى لتحديد نطاق الأيونات التي سيتم تحليلها.
- ضع مؤشر الماوس علامة التبويب RT مرة أخرى في بداية الفاصل الزمني المطلوب.
- انقر بزر الماوس الأيمن واسحبه حتى قيمة الوقت المحدد. اترك الزر. سيتم عرض الكثافة المتراكمة للاتونات تلقائيا في علامة التبويب EM.
- جمع البيانات كثافة m/z و z و أيون على جدول بيانات.
ملاحظة: يتم حساب الكتلة أحادية النظائر لكل ببتيد بدون مجموعات الميثيل المضافة من الصيغة التالية:
الببتيد غير المعدلة الشامل = (م / ض س ض) - (C a x T) - (1.008 x z)
m/zais الكتلة الملاحظة لشحن القيمة لذروة النظائر الأحادية لكل ببتيد يحمل تركيبات مختلفة من العلامات (أ = 1 أو 2 أو 3 أو 4 أو 5 ، وهو ما يتوافق مع رقم العينة).
z هي الدولة المسؤولة.
Ca هو كتلة أحادية النظائر لزوج من مجموعات الميثيل:
بالنسبة ل a=1، Ca = 28.0313 (الإضافة الصافية لمجموعتين CH3 إلى أمين أساسي)
بالنسبة ل a=2، Ca = 30.0439 لمجموعتين CHD2
بالنسبة ل a=3، Ca = 32.0564 لمجموعتين CD2H
بالنسبة ل a=4، Ca= 34.0690 لمجموعتين CD3
بالنسبة ل a=5، Ca = 36.0757 لمجموعتين من 13 CD3
T هو عدد أزواج من مجموعات الميثيل المدرجة في الببتيد. يمكن حساب ذلك من الصيغة التالية عند استخدام خمس علامات: T=z*(m/z5 - m/z1)/8. بالنسبة للببتيدات التي تحتوي على أمين أولي واحد وبالتالي يتم تصنيفها مع مجموعتين فقط من الميثيل ، توجد تداخلات الذروة على أطياف MS عند استخدام التسميات المجاورة. يمكن تصحيح كثافة الذروة لكل ببتيد المسمى باستخدام المعادلات التي وصفها تاشيما وFricker25.
6. تحديد الببتيد
- لتحديد الببتيدات، قم بتحليل بيانات MS/MS باستخدام محرك بحث قاعدة بيانات29,30.
- لحساب معدل الاكتشاف الزائف (FDR) باستخدام طريقة الانصهار الخداعي، ابحث في قاعدة بيانات الخداع.
ملاحظة: معلمات البحث المستخدمة عموما ليست خصوصية إنزيم; مجموعة التسامح كتلة السلائف 15-50 في الدقيقة; جزء أيون التسامح الجماعي من 0.5 دا; التعديلات المتغيرة: الأمينات التفاعلية من بقايا اللايس والنهابة من تسميات الببتيدات المثيلة النظيرية (L1 (+28) وL2 (+30) وL3 (+32) وL4 (+34) وL5 (+36)) والميثيونين المؤأكسد (+15.99 دا) والأستيل (+42.01 دا). - ثم، فرز الببتيدات من قبل متوسط ثقتهم المحلية لتحديد أفضل الأطياف لشرح وتصفيتها من قبل FDR ≤5٪.

الشكل 1: سير عمل الدراسات Peptidomic. خطوات استخراج الببتيد والمثيلة الاختزالية من الأمينات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
يتم تخزين النتائج التي تم الحصول عليها من أشواط أجريت على مطياف الكتلة في ملفات البيانات الخام التي يمكن فتحها في برنامج مطياف الكتلة. في أطياف MS ، من الممكن مراقبة مجموعات الذروة التي تمثل الببتيدات المسماة وفقا لنظام وضع العلامات المستخدم ، بدءا من 2-5 تسميات. على سبيل المثال، في الشكل 2، يتم تمثيل أزواج القمم التي تم اكتشافها في وقت كروماتوغرافي في تجربة حيث تم استخدام ملصقين نظائريين فقط في عينتين مختلفتين في نفس الشوط. ويبين الشكل 3 احتمالات أخرى لنتائج إيجابية، باستخدام 3 و 4 تسميات مختلفة في كل تشغيل LC-MS. عند استخدام 4 أو 5 تسميات في تشغيل LC / MS ، قد يكون هناك تداخل بين قمم الببتيدات المسماة مع العلامات المختلفة التي تحتاج إلى تصحيح للحصول على قيمة الكثافة الحقيقية لكل ذروة (الشكل 4).
ويمكن أيضا أن تستخدم الوسم النظيري لإظهار الركائز والمنتجات في المختبر لبروتيز معين أو peptidase، كما هو مبين في الشكل 5. وأخيرا، يمكن استخدام برامج مختلفة لتحديد الببتيدات المسماة، مثل استوديو القمم أو MASCOT. وقد أنشئت هذه التطبيقات البرمجية للتحليل البروتيوميكي؛ لذلك ، لا ينبغي النظر في بيانات كمية البروتين لتحليل peptidomics ، ويجب فحص كل ببتيد المسمى المحدد ضمن معلمات الموثوقية ومن ثم قياسه كميا. إذا تم الكشف عن الببتيدات بنجاح ووضع العلامات عليها ، فإن هذه البرامج ستوفر قائمة بتسلسلات الببتيد المحددة التي تحتوي على التسميات. يظهر الشكل 6 مثالا على تحديد تسلسل الببتيد الذي قام به البرنامج. في هذه الحالة، تم استخدام 3 أشكال مختلفة فقط من التسميات (L1 و L3 و L5) لتسمية ثلاث عينات مختلفة بشكل منفصل، والتي تم خلطها وتحليلها بعد ذلك عن طريق قياس الطيف الكتلي في شوط واحد.
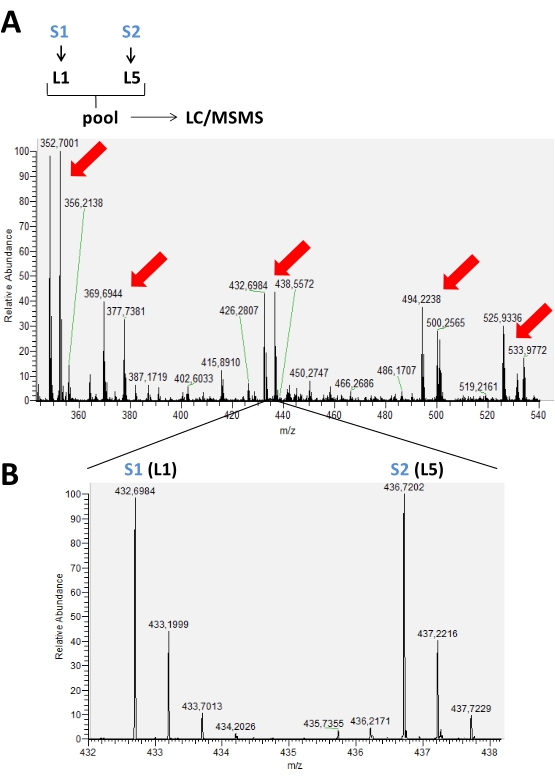
الشكل 2: ممثل طيف التصلب المتعدد لوقت كروماتوغرافي تراكم في تجربة وضع العلامات النموذجية باستخدام ثنائي ميثيل ثنائي اختزال الأمينات. في (A)، تشير الأسهم الحمراء إلى وجود أزواج الذروة من الببتيدات المختلفة المسماة بأشكال نظائرية (L1 و L5) للمقارنة بين عينتين مختلفتين (S1 و S2). في (ب)، صورة مكبرة الطيف MS من نفس الببتيد تظهر m/z مختلفة بسبب استخدام التسميات. في هذه الحالة، لم يكن هناك اختلاف في كثافة الذروة لهذا الببتيد الموجود في هذه العينات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: الطيف التمثيلي للتصلباتيدات المسماة بالمثيلة الاختزالية للأمينات باستخدام أعداد مختلفة من العلامات. (أ) تم استخدام وضع علامات ثلاثية. من الممكن ملاحظة طيف MS من الببتيد الموجود في 3 عينات مختلفة (S1 و S2 و S3) المسمى بعلامات L1 و L3 و L5 على التوالي. في هذه الحالة، كان مستوى الببتيد المسمى مع L5 ضعف المستوى الملاحظ لنفس الببتيد المسمى بعلامات L1 و L3. (ب) تم إجراء وضع علامات رباعية باستخدام تسميات L1 وL2 وL3 وL4. في هذه الحالة، تم تصنيف عينات التحكم (S1 و S3) مع L1 و L3، على التوالي، وبالمقارنة مع عينتين تجريبيتين (S2 و S4) المسمى مع تسميات L2 و L4. لم تلاحظ اختلافات كبيرة لهذا الببتيد بين العينات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: الطيف التمثيلي للتصلين المتعدد للببتيد المسمى الذي يمثل تداخلا في الذروة. يظهر هذا الرقم طيف MS من الببتيد من تهمة 3، كتلة 2098.87 دا مع أمين الابتدائية واحدة متاحة للوسم. الفرق بين الببتيدات المسماة هو 2 دا فقط، مما تسبب في تداخل عند استخدام 4 أو 5 تسميات في نفس تشغيل LC / MS. باستخدام نموذج يستند إلى معادلات متعددة الحدود مكعب، فمن الممكن لتصحيح هذه التداخلات بين التسميات. في الرسم البياني، تظهر الأشرطة الحمراء متوسط قيم الكثافة المعدلة لهذا الببتيد في شوطين. تظهر الأشرطة السوداء متوسط قيم الكثافة المتداخلة. بعد التصحيح ، أظهر هذا الببتيد اختلافا طفيفا في الكثافة بين العينات (القضبان الحمراء). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: الطيف التمثيلي MS من الببتيدات المسمى مع الميثيل الاختزالي من الأمينات في دراسة انحلال البروتين. هنا، تم احتضان مقتطفات الببتيد مع 200 nM و 20 nM neurolysin لتوصيف ركائزها ومنتجاتها. لتأكيد النتيجة، تم تنفيذ اثنين LC/MS يعمل مع استراتيجيات وضع العلامات إلى الأمام والعكس. في تشغيل الثاني تغيير موضع العينات في إجراء وضع العلامات فيما يتعلق بالمخطط المستخدم في التشغيل الأول. في A ، يظهر الببتيد الذي لا يتغير (NC) في وجود إنزيم الذهان. في B ، الببتيد الذي اختفى في وجود تركيز عال من الإنزيم (S2) ، وأظهر انخفاضا طفيفا في تركيز منخفض من الانزيم (S4) في كل من وضع العلامات إلى الأمام والعكس. ويعتبر هذا الببتيد ركيزة (SB) من الانزيم. في C مثال على الببتيد الذي كان يعتبر منتجا (PD) ، لأنه تم زيادة تركيزه (S2 و S4) في وجود الإنزيم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: الطيف التمثيلي للخدمة MSMS وتحديد الببتيد المسمى الذي يقوم به محرك بحث قاعدة البيانات. في هذا المثال، من الممكن ملاحظة 2+ أيونات مع m/z 672,3802, 676,4045, و 680,4241 المقابلة للببتيد من نفس الكتلة المسماة مع L1, L3, و L5 مثيلة أشكال, على التوالي. تم تحديد هذا التسلسل ADQVSASLAKQGL من خلال طيف MS / MS كجزء من البروتين المرتبط بالميكروتبول تاو isoform X1. هذا الببتيد لديه N-المحطة الطرفية والليوزين المتاحة كمواقع وضع العلامات إضافة فرق كتلة من 8 دالتون بين الببتيدات المسمى. يظهر طيف MS لهذا الببتيد في الشكل 3A. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| عينة | H2CO | D2CO | D213CO | NaBH3CN | NaBD3CN | تسميه | قداس إضافي |
| 2 × 4 ميكرولتر | 2 × 4 ميكرولتر | 2 × 4 ميكرولتر | 2 × 4 ميكرولتر | 2 × 4 ميكرولتر | رمز | (دا) | |
| 1 | X | X | L1 | 28.0313 | |||
| 2 | X | X | L2 | 30.0439 | |||
| 3 | X | X | L3 | 32.0564 | |||
| 4 | X | X | L4 | 34.069 | |||
| 5 | X | X | L5 | 36.0757 |
الجدول 1: الكواشف لتجربة نموذجية باستخدام المزيج المشار إليه من الأشكال المذابة وغير المقيتة من الفورمالديهايد والصوديوم سيانوبوروهيدريد.
Discussion
في معظم الدراسات peptidomics، واحدة من الخطوات الحاسمة هي، دون شك، وإعداد العينة التي ينبغي أن يؤديها بعناية لتجنب وجود شظايا الببتيد التي ولدتها proteases بعد بضع دقائق بعد الوفاة. وأظهرت الدراسات الأولية على مقتطفات الدماغ التي أعدت من عينات غير الميكروويف وجود عدد كبير من شظايا البروتين في ميكروفيترات 10-kDa. وقد وصفت نهج مختلفة لتجنب أطياف الببتيد من تدهور البروتين: تركيز الميكروويف تشعيع الحيوان sacrifice6,8, تشريح cryostat تليها عازلة استخراج الغليان31, وبعد التضحية الميكروويف تشعيع الأنسجة باستخدام نوع المنزلية فرن الميكروويف9,26 . بالنسبة زراعة الخلايا وبعض الأنسجة ، يمكن إجراء تعطيل البروتيز مباشرة عن طريق إضافة الماء عند 80 درجة مئوية. ومع ذلك ، يمكن أن تكون بعض العينات ، مثل الأنسجة العصبية ، أكثر حساسية لتغيير ما بعد الوفاة ، وقد تمت الإشارة إلى تعطيل البروتيز عن طريق تشعيع الميكروويف كطريقة اختيار. وعلاوة على ذلك، نقطة هامة أخرى خلال استخراج الببتيد هو التأكد من أن مقتطفات الجليد الباردة قبل إضافة حمض لمنع السندات حمض اللبن من كسر، مثل انشقاق السندات Asp-Pro26.
يمكن استخدام استراتيجيات مختلفة للقياس الكمي النسبي للببتيدات ، ولكن لا يمكن اعتبار أي منها مثاليا تماما. لاختيار الطريقة التي سيتم استخدامها ، يجب على الباحث النظر في عوامل مثل توافر ساعات الاستخدام في مطياف الكتلة ، والمتاحة تجاريا وتكاليف وضع العلامات على الكواشف ، وسهولة تحليل البيانات التي تم الحصول عليها 17،25،26،32. وقد استخدمت على نطاق واسع طريقة خالية من التسمية ولكن يتطلب ساعات عديدة في مطياف الكتلة. ومن الضروري حقن النسخ المتماثلة التقنية لكل عينة ويعتمد على استنساخ اللوني بين العينات. أما الكواشف الكيميائية الأخرى التي تضع العلامات، على سبيل المثال، وهي ITRAQ (علامات إيسوباك للكمية النسبية والمطلقة) وTMT (علامة الكتلة المترادفة)، فهي مكلفة ولا توفر سوى كمية الببتيدات المختارة لتحليل MS/MS25,33,34.
القيد الرئيسي للقياس الكمي النسبي من خلال وضع العلامات الكيميائية باستخدام RMA هو التداخل الذي يحدث لبعض الببتيدات عند تنفيذ بروتوكول باستخدام 4 أو 5 تسميات في نفس المدى مما يؤدي إلى اختلافات كتلة من 2 دا للببتيدات مع أمين أولي واحد و 1 دا للببتيدات مع N-terminus برولين وليس بقايا اللسين الداخلية. ومع ذلك ، طورت تاشيما وفريكر (2018) نموذجا لتصحيح التداخل النظيري استنادا إلى المعادلات متعددة الحدود المكعبة25 ، والتي تحصل على الكثافة الصحيحة للببتيدات المسماة في العينات. وعلاوة على ذلك، لا يمكن رؤية جميع الببتيدات من قبل RMA. على سبيل المثال، تفتقر بعض الببتيدات إلى أمين مجاني من N-terminal بسبب الأستيل، أو البيروغلوتاميل، أو تعديل آخر. إذا كانت اللوزينات الداخلية غائبة أيضا في هذه الببتيدات ، فلن يتم تصنيفها بواسطة كاشف RMA وستظهر على أطياف m / z على أنها قمم واحدة لا يمكن قياسها27.
Disclosures
ولا توجد مصالح مالية متنافسة.
Acknowledgements
وقد تم دعم تطوير واستخدام التقنيات الموصوفة هنا من خلال منحة المجلس الوطني البرازيلي للبحوث 420811/2018-4 (LMC)؛ منح فونداساو دي أمبارو à Pesquisa do Estado de São Paulo (www.fapesp.br) 2019/16023-6 (LMC) و2019/17433-3 (LOF) و21/01286-1 (MEME). لم يكن للممولين أي دور في تصميم الدراسة أو جمع البيانات وتحليلها أو قرار نشرها أو إعدادها.
Materials
| Name | Company | Catalog Number | Comments |
| 10 kDa cut-off filters | Merck Millipore | UFC801024 | Amicon Ultra-4, PLGC Ultracel-PL Membrane, 10 kDa |
| Acetone | Sigma-Aldrich | 179124 | |
| Acetonitrile | Sigma-Aldrich | 1000291000 | |
| Ammonium bicarbonate | Sigma-Aldrich | 11213 | |
| analytical column (EASY-Column) | EASY-Column | (SC200) | 10 cm, ID75 µm, 3 µm, C18-A2 |
| Ethyl 3-aminobenzoate methanesulfonate | Sigma-Aldrich | E10521 | MS-222 |
| Fluorescamine | Sigma-Aldrich | F9015 | |
| Formaldehyde solution | Sigma-Aldrich | 252549 | |
| Formaldehyde-13C, d2, solution | Sigma-Aldrich | 596388 | |
| Formaldehyde-d2 solution | Sigma-Aldrich | 492620 | |
| Formic acid | Sigma-Aldrich | 33015 | |
| Fume hood | Quimis | Q216 | |
| Hydrochloric acid - HCl | Sigma-Aldrich | 258148 | |
| LoBind-Protein retention tubes | Eppendorf | EP0030108116-100EA | |
| LTQ-Orbitrap Velos | Thermo Fisher Scientific | LTQ Velos | |
| Microwave oven | Panasonic | NN-ST67HSRU | |
| n Easy-nLC II nanoHPLC | Thermo Fisher Scientific | LC140 | |
| PEAKS Studio | Bioinformatics Solutions Inc. | VERSION 8.5 | |
| Phosphate-buffered saline | Invitrogen | 3002 | tablets |
| precolumn (EASY-Column) | Thermo Fisher Scientific | (SC001) | 2 cm, ID100 µm, 5 µm, C18-A1 |
| Refrigerated centrifuge | Hermle | Z326K | for conical tubes |
| Refrigerated centrifuge | Vision | VS15000CFNII | for microtubes |
| Reversed-phase cleanup columns (Oasis HLB 1 cc Cartridge) | Waters | 186000383 | Oasis HLB 1 cc Cartridge |
| Sodium cyanoborodeuteride - NaBD3CN | Sigma-Aldrich | 190020 | |
| Sodium cyanoborohydride - NaBH3CN | Sigma-Aldrich | 156159 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | NOTE: 0.2 M PB= 0.1 M phosphate buffer pH 6.8 (26.85 mL of Na2HPO3 1M) plus 0.1 M phosphate buffer pH 6.8 (23.15 mL of NaH2PO3 1M) to 250 ml of water |
| Sodium phosphate monobasic | Sigma-Aldrich | S3139 | |
| Sonicator | Qsonica | Q55-110 | |
| Standard peptide | Proteimax | amino acid sequence: LTLRTKL | |
| Triethylammonium buffer - TEAB 1 M | Sigma-Aldrich | T7408 | |
| Trifluoroacetic acid - TFA | Sigma-Aldrich | T6508 | |
| Ultra purified water | Milli-Q | Direct-Q 3UV | |
| Vacuum centrifuge | GeneVac | MiVac DNA concentrator | |
| Water bath | Cientec | 266 | |
| Xcalibur Software | ThermoFisher Scientific | OPTON-30965 |
References
- Kandpal, R., Saviola, B., Felton, J. The era of 'omics unlimited. Biotechniques. 46 (5), 354-355 (2009).
- Farrokhi, N., Whitelegge, J. P., Brusslan, J. A. Plant peptides and peptidomics. Plant Biotechnology Journal. 6 (2), 105-134 (2008).
- Schulz-Knappe, P., Schrader, M., Zucht, H. D. The peptidomics concept. Combinatorial Chemistry & High Throughput Screening. 8 (8), 697-704 (2005).
- Dallas, D. C., et al. Current peptidomics: applications, purification, identification, quantification, and functional analysis. Proteomics. 15 (5-6), 1026-1038 (2015).
- Chard, T. An introduction to radioimmunoassay and related techniques (3rd Ed). FEBS Letters. 238 (1), 223(1988).
- Svensson, M., Sköld, K., Svenningsson, P., Andren, P. E. Peptidomics-based discovery of novel neuropeptides. Journal of Proteome Research. 2 (2), 213-219 (2003).
- Baggerman, G., et al. Peptidomics. Journal of Chromatography B. 803, 3-16 (2004).
- Theodorsson, E., Stenfors, C., Mathe, A. A. Microwave irradiation increases recovery of neuropeptides from brain tissues. Peptides. 11, 1191-1197 (1990).
- Che, F. Y., Lim, J., Pan, H., Biswas, R., Fricker, L. D. Quantitative neuropeptidomics of microwave-irradiated mouse brain and pituitary. Molecular & Cellular Proteomics. 4, 1391-1405 (2005).
- Dasgupta, S., et al. Analysis of the yeast peptidome and comparison with the human peptidome. PLoS One. 11 (9), 0163312(2016).
- Teixeira, C. M. M., Correa, C. N., Iwai, L. K., Ferro, E. S., Castro, L. M. Characterization of Intracellular Peptides from Zebrafish (Danio rerio) Brain. Zebrafish. 16 (3), 240-251 (2019).
- Fricker, L. D. Analysis of mouse brain peptides using mass spectrometry-based peptidomics: implications for novel functions ranging from non-classical neuropeptides to microproteins. Molecular BioSystems. 6 (8), 1355-1365 (2010).
- Gelman, J. S., Sironi, J., Castro, L. M., Ferro, E. S., Fricker, L. D. Peptidomic analysis of human cell lines. Journal of Proteome Research. 10 (4), 1583-1592 (2011).
- De Araujo, C. B., et al. Intracellular peptides in cell biology and pharmacology. Biomolecules. 9, 150(2019).
- Gewehr, M. C. F., Silverio, R., Rosa-Neto, J. C., Lira, F. S., Reckziegel, P., Ferro, E. S. Peptides from natural or rationally designed sources can be used in overweight, obesity, and type 2 diabetes therapies. Molecules. 25 (5), 1093(2020).
- Sakaya, G. R., et al. Peptidomic profiling of cerebrospinal fluid from patients with intracranial saccular aneurysms. Journal of Proteomics. 240 (3), 104188(2021).
- Fricker, L. Quantitative peptidomics: General considerations. Methods in Molecular Biology. 1719, 121-140 (2018).
- Southey, B. R., et al. Comparing label-free quantitative peptidomics approaches to characterize diurnal variation of peptides in the rat suprachiasmatic nucleus. Analytical Chemistry. 86 (1), 443-452 (2014).
- Chen, X., Wei, S., Ji, Y., Guo, X., Yang, F. Quantitative proteomics using SILAC: Principles, applications, and developments. Proteomics. 15 (18), 3175-3192 (2015).
- Boonen, K., et al. Quantitative peptidomics with isotopic and isobaric tags. Methods in Molecular Biology. 1719, 141-159 (2018).
- Gewehr, M. C. F., et al. The relevance of thimet oligopeptidase in the regulation of energy metabolism and diet-induced obesity. Biomolecules. 10 (2), 321(2020).
- Fiametti, L. O., Correa, C. N., Castro, L. M. Peptide profile of zebrafish brain in a 6-OHDA-induced Parkinson model. Zebrafish. 18 (1), 55-65 (2021).
- Boersema, P. J., Raijmakers, R., Lemeer, S., Mohammed, S., Heck, A. J. Multiplex peptide stable isotope dimethyl labeling for quantitative proteomics. Nature Protocols. 4 (4), 484-494 (2009).
- Dasgupta, S., Castro, L. M., Tashima, A. K., Fricker, L. Quantitative peptidomics using reductive methylation of amines. Methods in Molecular Biology. 1719, 161-174 (2018).
- Tashima, A. K., Fricker, L. D. Quantitative peptidomics with five-plex reductive methylation labels. Journal of the American Society for Mass Spectrometry. 29 (5), 866-878 (2018).
- Che, F. Y., et al. Optimization of neuropeptide extraction from the mouse hypothalamus. Journal of Proteome Research. 6 (12), 4667-4676 (2007).
- Lyons, P. J., Fricker, L. D. Peptidomic approaches to study proteolytic activity. Current Protocols in Protein Science. , Chapter 18 13(2011).
- Udenfriend, S., et al. Fluorescamine: a reagent for assay of amino acids, peptides, proteins, and primary amines in the picomole range. Science. 178 (4063), 871-872 (1972).
- Ma, B., et al. PEAKS: powerful software for peptide de novo sequencing by tandem mass spectrometry. Rapid Communications in Mass Spectrometry. 17 (20), 2337-2342 (2003).
- Zhang, J., et al. PEAKS DB: de novo sequencing assisted database search for sensitive and accurate peptide identification. Molecular & Cellular Proteomics. 11 (4), 1-8 (2012).
- Sturm, R. M., Dowell, J. A., Li, L. Rat brain neuropeptidomics: tissue collection, protease inhibition, neuropeptide extraction, and mass spectrometric analysis. Methods in Molecular Biology. 615, 217-226 (2010).
- Fricker, L. D. Limitations of mass spectrometry-based peptidomic approaches. Journal of the American Society for Mass Spectrometry. 26 (12), 1981-1991 (2015).
- Ross,, et al. Multiplexed protein quantitation in Saccharomyces cerevisiae using amine-reactive isobaric tagging reagents. Molecular & Cellular Proteomics. 3, 1154-1169 (2004).
- Thompson, A., et al. Tandem mass tags: a novel quantification strategy for comparative analysis of complex protein mixtures by MS/MS. Analytical Chemistry. 75, 1895-1904 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved