Method Article
Органотипические культуры срезов в качестве доклинических моделей микроокружения опухоли при первичном раке поджелудочной железы и метастазировании
В этой статье
Резюме
В этом протоколе описывается приготовление органотипических культур срезов (OTSC). Этот метод облегчает культивирование ex vivo интактной многоклеточной ткани. OTSC могут быть немедленно использованы для проверки их соответствующей реакции на лекарства в многоклеточной среде.
Аннотация
Крайне необходимы реалистичные доклинические модели первичного рака поджелудочной железы и метастазов для проверки реакции на терапию ex vivo и содействия персонализированному лечению пациентов. Тем не менее, отсутствие опухолеспецифичного микроокружения в используемых в настоящее время моделях, например, в клеточных линиях, полученных от пациентов, и ксенотрансплантатах, позволяет получить лишь ограниченные прогностические данные. Органотипические культуры срезов (OTSC) включают в себя интактную многоклеточную ткань, которая может быть быстро использована для тестирования пространственно разрешенного лекарственного ответа.
Этот протокол описывает создание и культивирование жизнеспособных опухолевых срезов рака поджелудочной железы и его метастазирования. Вкратце, ткань отливают в агарозу с низким расплавлением и хранят в холодном изотоническом буфере. Затем с помощью вибратома генерируются срезы ткани толщиной 300 мкм. После получения срезы культивируют на границе воздух-жидкость с использованием вставок для клеточных культур и соответствующей среды для культивирования. Во время культивирования можно контролировать изменения в дифференцировке и жизнеспособности клеток. Кроме того, этот метод позволяет применять лечение к жизнеспособной опухолевой ткани человека ex vivo и последующим анализам, таким как профилирование транскриптома и протеома.
OTSC предоставляют уникальную возможность проверить индивидуальную реакцию на лечение ex vivo и идентифицировать индивидуальные транскриптомные и протеомные профили, связанные с соответствующей реакцией отдельных срезов опухоли. OTSC могут быть дополнительно изучены для определения терапевтических стратегий для персонализации лечения первичного рака поджелудочной железы и метастазов.
Введение
Существующие доклинические модели протоковой аденокарциномы поджелудочной железы (PDAC) и соответствующих метастазов являются плохими предикторами ответа на лечение у пациентов, что является серьезным недостатком при разработке лекарственных препаратов и идентификации прогностических биомаркеров1. Хотя такие модели, как органоиды, полученные от пациента, и ксенотрансплантаты, полученные от пациента, являются многообещающими, их использование остается ограниченным2. Основными ограничениями этих моделей in vitro являются отсутствие микроокружения опухоли и ксенотрансплантат у нечеловеческих видов с ослабленным иммунитетом. Особенно в отношении PDAC и его метастазов, микроокружение опухоли в последние годы значительно возросло из-за его важнейших функций в биологии опухолей. Он включает в себя клеточные и бесклеточные компоненты, такие как (мио-)фибробласты, звездчатые клетки поджелудочной железы, иммунные клетки, кровеносные сосуды, внеклеточный матрикс, цитокины и факторы роста3. Это микроокружение не является нефункциональным компонентом опухоли, но индуцирует прогрессирование опухоли и метастазирование и, по-видимому, вносит существенный вкладв устойчивость к радио- и химиотерапии. Микроокружение PDAC не только механически препятствует доставке лекарств, но и обладает иммунной и поглотительной активностью 5,6,7. Таким образом, доклинические модели, отражающие сложное взаимодействие опухолевых клеток и опухолевого микроокружения, крайне необходимы для адекватной проверки реакции пациентов на лечение ex vivo и руководства индивидуализированным клиническим лечением.
Культуры ex vivo свежих образцов опухоли представляют собой близкое приближение опухоли in situ. Недавно были разработаны и изучены органотипические культуры срезов (OTSC) для лечения нескольких опухолей, таких как рак головы, шеи, молочной железы, предстательной железы, легких, толстой кишки и поджелудочной железы 8,9,10,11,12. Было показано, что OTSC сохраняют свою исходную морфологию, пролиферативную активность и микроокружение во время культивирования в течение определенного, тканезависимого периода 11,12,13. OTSC PDAC сохраняли свою жизнеспособность, морфологию и большинство компонентов опухолевого микроокружения в течение 4-9 дней в нескольких исследованиях in vitro 5,12,14. С точки зрения перспективы, этот метод позволяет немедленно применить лечение к жизнеспособной опухолевой ткани человека ex vivo и последующим анализам, таким как профилирование транскриптома и протеома.
Создание OTSC дает уникальную возможность проверить реакцию на лечение ex vivo сразу после операции. Таким образом, OTSC в перспективе позволят определить терапевтические стратегии для персонализации лечения метастатического заболевания. Этот протокол описывает создание и культивирование жизнеспособных OTSC рака поджелудочной железы.
протокол
Образцы тканей были собраны и обработаны после одобрения местным комитетом по этике Университета Любека (# 16-281).
1. Сбор и обработка свежих тканей
ПРИМЕЧАНИЕ: С каждым незафиксированным образцом ткани человека следует обращаться с осторожностью, чтобы предотвратить риск заражения патогенами, передающимися через кровь. Все пациенты должны быть протестированы на отрицательный результат теста на ВИЧ, ВГВ и ВГС до обработки тканей. Наденьте защитное пальто и обрабатывайте образцы тканей человека в перчатках.
- Соберите свежий, незафиксированный и незамороженный образец ткани PDAC с минимальным размером 0,4 x 0,4 см сразу после операции и транспортируйте образец в лабораторию в растворе для хранения тканей.
- По возможности немедленно обработайте свежую ткань.
- В качестве альтернативы можно хранить салфетки в растворе для хранения тканей на влажном льду при температуре 4 °C в течение ночи. Тем не менее, хранение тканей может привести к нарушению жизнеспособности, и его следует избегать.
2. Подготовка
- Легкоплавкий агарозный препарат
- Приготовьте 100 мл легкоплавкой агарозы (8%), растворив 8 г агарозы в 100 мл предварительно подогретого раствора Рингера, и храните при температуре 4 °C до тех пор, пока не понадобится.
- После объявления о резекции опухоли растопите агарозу в микроволновой печи.
- Поместите агарозу на предварительно нагретую водяную баню (37 °C), дав ей остыть до физиологической температуры перед приготовлением.
- Настройка вибратома
- Поместите лезвие бритвы в держатель вибратома и выполните автоматическую регулировку угла наклона в соответствии с инструкциями производителя, если это применимо.
- Охладите рубашку режущей камеры с помощью охлаждающего агрегата или влажного льда.
- Заполните режущую камеру примерно 100 мл физиологического раствора для резки (например, раствора Рингера).
- Поместите установленное лезвие бритвы в предварительно охлажденный режущий раствор, дав лезвию бритвы остыть.
3. Заделка тканей в легкоплавкую агарозу
- Промойте образец ткани охлажденным (4 °C) PBS и поместите ткань в PBS на большую (~14 см) чашку Петри на льду.
- Удалите макроскопически видимые излишки соединительной ткани на льду с помощью скальпеля, так как это может помешать эффективности разреза.
- Поместите салфетку в маленькую чашку Петри (~3 см).
- Отрегулируйте ориентацию тканей таким образом, чтобы оставшаяся макроскопически видимая соединительная ткань имела ту же ориентацию, что и плоскость дна чашки Петри. Дно чашки Петри имеет ту же ориентацию, что и режущая плоскость.
- Подготовленную малоплавкую агарозу вылить в маленькую чашку Петри.
- При необходимости отрегулируйте ориентацию ткани с помощью щипцов.
- Поставьте чашку Петри на влажный лед для более быстрого застывания агарозы.
- Аккуратно разрежьте ткань с помощью скальпеля, оставив не менее 5 мм окружающей агарозы с каждой стороны ткани.
- Аккуратно перенесите залитую ткань и приклейте ее на держатель образца с помощью суперклея.
- Через несколько секунд поместите держатель образца в режущую камеру.
- При необходимости отрегулируйте ориентацию салфетки по отношению к лезвию бритвы.
4. Срез залитой агарозой ткани с помощью вибратома
- Определите внешние границы диапазона разреза (ось y) в соответствии с размером образца ткани.
- Отрегулируйте лезвие по направлению к верхней части тканевого блока.
- Установите скорость резки 0,04 мм/с, амплитуду реза 1 мм и толщину среза 300 мкм.
- Аккуратно нарежьте первые ломтики и переложите срезы в отдельную емкость с предварительно охлажденным (4 °C) раствором для резки на влажном льду.
5. Культура органотипических срезовых культур
- Приготовьте планшет на 6 лунок с 1 мл соответствующей среды для выращивания на лунку.
- Среда А: продвинутый DMEM/F12, 10% FBS, 1% пенициллин/стрептомицин.
- Среда В: RPMI 1640, 10% FBS, 1% пенициллин/стрептомицин, 4 мкг/мл инсулина, 8 нг/мл EGF, 0,3 мкг/мл гидрокортизона.
ПРИМЕЧАНИЕ: Среда для оптимальных условий культивирования может варьироваться в зависимости от ткани и пациента. Сравнивали две различные среды для культивирования тканей, одну на основе DMEM/F12 (среда A), вторую на основе RPMI (среда B). Существенных различий между этими средами выявлено не было. Для всех экспериментов, показанных в этом протоколе, использовалась среда А.
- Поместите 6-луночный планшет со средой в инкубатор, позволив отрегулировать температуру и pH перед выращиванием.
- Поместите срезы на вставки для клеточных культур (например, гидрофильные вставки из ПТФЭ с размером пор 0,4 мкм) с помощью фильтра взгляда.
- Удалите излишки режущего раствора, поместив загруженный фильтр на стерильную ткань.
- Поместите загруженный фильтр в подготовленную 6-луночную пластину. Не добавляйте во вставку никаких дополнительных носителей.
- Поместите 6-луночный планшет в инкубатор (37 °C, 5%CO2).
- Меняйте среду каждые 2 дня, повторяя шаги 5.1, 5.2 и 5.5 с новым 6-луночным планшетом.
ПРИМЕЧАНИЕ: Органотипические культуры срезов могут культивироваться в течение различных периодов в зависимости от конкретного исследовательского вопроса.
6. Анализ жизнеспособности резазурина
ПРИМЕЧАНИЕ: Анализ жизнеспособности резазурина измеряет общую метаболическую активность органотипических культур срезов на основе восстановления нефлуоресцентного синего резазурина до красного флуоресцентного резоруфина в живых клетках15. Анализ не оказывает токсического воздействия на клетки и может быть применен к культурам повторно в зависимости от индивидуального исследовательского вопроса. Жизнеспособность измеряли с помощью анализа на резазурин каждые 2-3 дня.
- Приготовление стокового раствора резазурина
- Выключите свет стерильной вытяжки, так как стоковый раствор резазурина светочувствительный.
- Приготовьте стоковый раствор с 10 мг/мл натриевой соли резазурина в 1x PBS.
- Храните стоковый раствор в защищенных от света аликвотах при температуре 4 °C в холодильнике до использования.
- Оценка общей жизнеспособности среза
- Выключите свет стерильной вытяжки, так как стоковый раствор резазурина светочувствительный.
- Разбавьте стоковый раствор резазурина 1:250 соответствующей средой.
ПРИМЕЧАНИЕ: Среда, используемая для разбавления, должна быть такой же, как и используемая для выращивания (среда А или среда В). - Приготовьте 1 мл конечного раствора резазурина на каждый ломтик и добавьте еще 1 мл для контроля бланка, например, на 6 ломтиков разведите 28 мкл исходного раствора резазурина в 7 мл среды.
- Дозируйте раствор резазурина в 6-луночных планшетах, по 1 мл разбавленного раствора резазурина на лунку.
- Переложите фильтры для культивации с срезами в лунки с раствором резазурина. Одна лунка с раствором резазурина остается пустой в качестве контрольной заготовки.
ПРИМЕЧАНИЕ: Для упрощения экспериментальной процедуры этот шаг можно совместить со сменой среды (шаг 5.7). Тем не менее, в случае, если необходимы дополнительные измерения жизнеспособности, анализ может быть проведен в любое время во время выращивания срезовых культур. - Поместите срезы ткани в инкубатор на 1 час при температуре 37 °C и 5%CO2.
- Приготовьте новые 6-луночные планшеты с питательной средой, если культивирование срезов продолжается (см. шаги 5.1 и 5.2).
- Снимите культивационные фильтры со срезами из раствора резазурина и удалите излишки раствора, поместив загруженный фильтр на стерильную ткань.
- Переложите фильтры для культивации со срезами на заранее подготовленную тарелку для культуры.
- Из каждой 6-лунки возьмите 100 μл раствора резазурина и переложите его на 96-луночный планшет. Из пустого контроля поместите три образца (3 x 100 μL) в отдельные лунки 96-луночного планшета.
- Количественно оцените затухание с помощью пластинчатого фотометра в соответствии с инструкциями производителя. Длина волны возбуждения установлена на 545 нм, а длина волны излучения установлена на 600 нм.
7. Фиксация формалином и встраивание парафина в OTSC
- Осторожно переложите срезы культивированной ткани в пластиковую закладную кассету. Для этого выполните следующие действия.
- Поместите фильтр для выращивания с установленным ломтиком на чашку Петри.
- Скальпелем аккуратно вырезаем фильтрующую мембрану с вмонтированным срезом ткани.
- Осторожно перенесите фильтрующую мембрану с установленным срезом в нейлоновый мешок для биопсии и поместите его в встраиваемую кассету.
- Впоследствии переложите пластиковые закладные кассеты в контейнер с предварительно охлажденным (4 °C) 4,5% формалином. Ломтики можно выдерживать в растворе формалина при температуре 4 °C до дальнейшего использования, но инкубировать следует не менее 24 часов.
ПРИМЕЧАНИЕ: OTSC нужно переносить с большой осторожностью, так как они легко разрываются.
- Осторожно промойте культуру срезов, закрепленную формалином, проточной водой из-под крана в течение 1,5 ч.
- Обезвоживайте фиксированный формалином срез ткани путем инкубации в 70% этаноле (2 раза в течение 3 часов), 95% этаноле (1 раз на ночь, 1 раз на 3 часа), а затем в абсолютном этаноле (1 раз на 3 часа, 1 раз на ночь).
- Очистите фиксированный формалином срез ткани путем 3-часовой инкубации в ксилоле дважды.
- Погрузите салфетку в парафин при температуре 60 °C (1x на ночь, 1x на 2 часа). Заложите ткань в парафиновый блок в форму для заделки ткани.
- Разрежьте микротомом залитый парафином тканевый блок толщиной 4 мкм и поплавайте в водяной бане с температурой 40 °C, содержащей дистиллированную воду. Перенесите срезы на стеклянные предметные стекла.
- Инкубируйте срезы парафина в течение 1 часа при 60 °C, чтобы ткань прилипла к стеклу. Инкубируйте предметные стекла в течение ночи при температуре 37 °C.
8. Окрашивание гематоксилином и эозином (H&E)
- Депарафинизируйте срезы с шага 7.7 путем инкубации в ксилоле (3 раза в течение 5 минут).
- Повторно увлажните путем инкубации в абсолютном спирте (2 раза в течение 5 минут), 95% спирте (2 раза в течение 5 минут) и 70% спирте (1 раз в течение 5 минут). Коротко смойте дистиллированной водой.
- Окрашивать в раствор гематоксилина по Майеру в течение 5 мин. Смыть проточной водой из-под крана в течение 10 минут.
- Противокрасить в 0,5% растворе Эозина в течение 40 с. Смойте дистиллированной водой.
- Обезвоживайте путем инкубации в 70% спирте (максимум 1 мин), 95% этаноле (2 раза в течение 3 мин) и абсолютном спирте (2 раза в течение 3 мин) соответственно.
- Очистите в трех сменах ксилол (по несколько секунд каждое). Поместите каплю монтажного носителя и накройте слайды покровным стеклом.
9. Иммуногистохимия OTSC
- Депарафинизируйте срезы путем инкубации в ксилоле 2 раза в течение 10 минут, а затем в соотношении 1:1 этанол/ксилол в течение 10 минут.
- Переведите слайды на 100% этанол (2 раза на 3 минуты), 96% этанол (2 раза на 3 минуты), 70% этанол (1 раз на 3 минуты), а затем на 50% этанол (1 раз на 3 минуты).
- Выполните забор антигена, чтобы демаскировать антигенный эпитоп. Нагрейте предметные стекла в микроволновой печи в цитратном буфере в течение 5 минут при 900 Вт, а затем 2 раза в течение 8 минут при 600 Вт. Дайте предметным стеклам остыть до комнатной температуры в течение 20 минут.
- Стирать в PBS 3x в течение 3 минут на шейкере.
- Пермеабилизацию клеточных мембран проводят путем инкубации в 0,1% Triton X-100 в PBS (200 мкл на предметное стекло) в увлажненной камере при комнатной температуре в течение 10 мин.
- Стирать в PBS в течение трех смен, по 3 мин каждая на шейкере.
- Секции инкубируют с 3% растворомН2О2 в метаноле (200 мкл на предметное стекло) в увлажненной камере при комнатной температуре в течение 10 мин для блокирования активности эндогенной пероксидазы.
- Стирать в PBS 3x в течение 3 минут на шейкере.
- Добавьте 200 мкл блокирующего буфера (1:50 лошадиной сыворотки в PBS) и инкубируйте во увлажненной камере при комнатной температуре в течение 25 минут.
- Слейте блокирующий буфер со стекол, наклонив предметное стекло на бумажной салфетке.
- Нанесите на предметные стекла 200 мкл надлежащим образом разведенного первичного антитела в разбавителе антител и инкубируйте в увлажненной камере при 4 °C в течение ночи. В качестве отрицательного контроля используйте соответствующую изоформу мышиных иммуноглобулинов в том же разведении, что и первичное антитело.
- Стирать 3 раза в течение 3 минут в PBS на шейкере.
- Нанесите 200 мкл биотинилированного вторичного антитела (1:50 раствор в PBS) на предметные стекла и инкубируйте во увлажненной камере при комнатной температуре в течение 30 минут.
- Стирать 3 раза в течение 3 минут в PBS на шейкере.
- Перед применением приготовьте комплекс пероксидазы на основе авидина/биотина в соответствии с инструкциями производителя. Нанести 200 мкл авидин-биотин-пероксидазного комплекса на предметные стекла и инкубировать во увлажненной камере при комнатной температуре в течение 30 мин.
- Стирать 3 раза в течение 3 минут в PBS на шейкере.
- Нанесите 200 μL раствора DAB (свежеприготовленного непосредственно перед использованием: 1 капля DAB на 1 мл подложки), 200 μL на предметное стекло. Дайте проявиться цвету 1-3 минуты, пока не будет достигнута желаемая интенсивность цвета.
- Смыть проточной водой из-под крана в течение 10 минут.
- Защитите предметные стекла, погрузив бортики в гематоксилин на 5 минут.
- Смыть проточной водой из-под крана в течение 10 минут.
- Закройте слайды с помощью водного монтажного носителя и покровных стекол. Смонтированные горки можно постоянно хранить при комнатной температуре.
Результаты
На рисунке 1 представлен обзор рабочего процесса культивирования OTSC из свежей, незамороженной опухолевой ткани. Образцы первичных PDAC и метастазов собирали сразу после хирургической резекции и хранили в течение ночи на влажном льду при температуре 4 °C в тканевом растворе. Образцы обрабатывали, а срезы культивировали, как описано в протоколе. Макроскопическая морфология каждого OTSC не претерпела существенных изменений во время выращивания. Тем не менее, размер площади поверхности OTSC уменьшался с течением времени, как показано на рисунке 2A во время выращивания в течение 6 дней. Общую жизнеспособность OTSC оценивали с помощью анализа жизнеспособности резазурина на 0, 2/3 и 6 день (Рисунок 2B). Анализ жизнеспособности резазурина измеряет общую метаболическую активность OTSC на основе восстановления нефлуоресцентного синего резазурина до красного флуоресцентного резоруфина в живых клетках15. На рисунке 2B показано сравнение жизнеспособности, измеренной путем снижения резазурина после культивирования OTSCs из двух репрезентативных первичных опухолей в двух разных средах. OTSC культивировали либо в среде А (продвинутый DMEM/F12, 10% FBS, 1% пенициллин/стрептомицин), либо в среде B (RPMI 1640, 10% FBS, 1% пенициллин/стрептомицин, 4 мкг/мл инсулина, 8 нг/мл EGF, 0,3 мкг/мл гидрокортизона), что приводило к сходной общей жизнеспособности независимо от питательной среды. Следует отметить, что снижение жизнеспособности после 0-го дня может наблюдаться часто и ожидается из-за процедуры среза и адаптации к условиям культивирования. Тем не менее, мы также наблюдали повышение жизнеспособности, как показано на правой панели (Рисунок 2B).
После определенных периодов культивирования в среде А ОТСК фиксировали в формалине для дальнейшей иммуногистологической характеристики (ИГХ). После фиксации формалином OTSC были введены парафин и разрезаны. Окрашенные срезы H&E показали, что общая структура ткани сохранялась в течение всего времени культивирования ex vivo (Рисунок 3). Опухолевые клетки и клетки стромы дискриминировали по ИГХ для цитокератина 7 и виментина соответственно. Существенных изменений в соотношении опухоли и стромы во время культивирования не выявлено.
Микроскопическая гистопатологическая оценка срезов H&E не выявила существенного увеличения некроза всех культивируемых тканей во время культивирования (рис. 3, рис. 4, рис. 5). Кроме того, Ki-67 и расщепленную каспазу 3 окрашивали для оценки пролиферации и апоптоза соответственно. Опять же, мы не обнаружили грубых изменений пролиферации и апоптоза в течение периода культивирования в течение 6 дней (Рисунок 3). Тем не менее, доля апоптотических клеток увеличивается с течением времени в течение длительных периодов культивирования, что измеряется окрашиванием расщепленной каспазой 3. На рисунке 4 показано увеличение расщепленных каспаз 3-положительных клеток после культивирования первичного PDAC в течение 15 дней. На рисунке 5 показана гистопатология перитонеального метастаза PDAC. Этот эксперимент демонстрирует высокую внутриопухолевую гетерогенность между отдельными срезами в отношении содержания опухоли/стромы, а также естественно возникающий апоптоз, измеряемый окрашиванием расщепленной каспазой 3. Следовательно, гистопатологическая оценка культивируемых OTSC важна для оценки архитектуры опухоли/стромы и жизнеспособности каждой культивируемой опухоли или ее метастазирования.
На рисунке 6 представлена гистопатология метастазирования PDAC в брюшную стенку. Окрашивание H&E, а также ИГХ для цитокератина 7 показало, что полученные OTSC не содержали опухолевых клеток, а состояли только из соединительной ткани, которая была частично некротической. Недостатком технологии OTSC является то, что свежая, незафиксированная и незамороженная ткань не может быть оценена на содержание опухолевых клеток до культивирования.
В целом, эти данные демонстрируют, что многоклеточная архитектура опухоли и соответствующие ей метастазы, включающие различные типы клеток, отражаются в OTSC. В частности, сохраняются взаимодействия опухоль-строма.
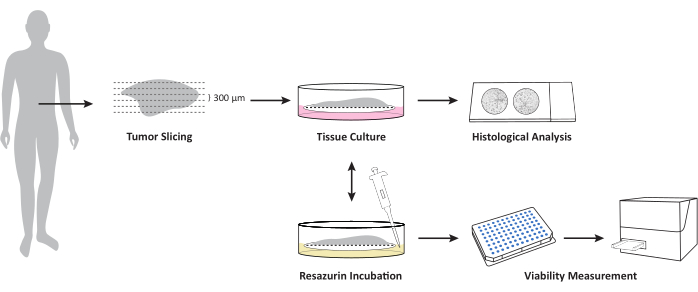
Рисунок 1: Обзор рабочего процесса культивирования OTSC из свежих, незамороженных образцов опухолей/метастазов в тканях. Свежий, незамороженный образец ткани разрезают с помощью вибратома и культивируют на границе воздух-жидкость на вставках клеточных культур из ПТФЭ. Общая жизнеспособность может быть измерена в определенные моменты времени с помощью анализа жизнеспособности резазурина. Этот анализ позволяет проводить дальнейшее культивирование после измерения жизнеспособности. Срезы фиксируются формалином в определенные моменты времени для дальнейшего гистопатологического исследования. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
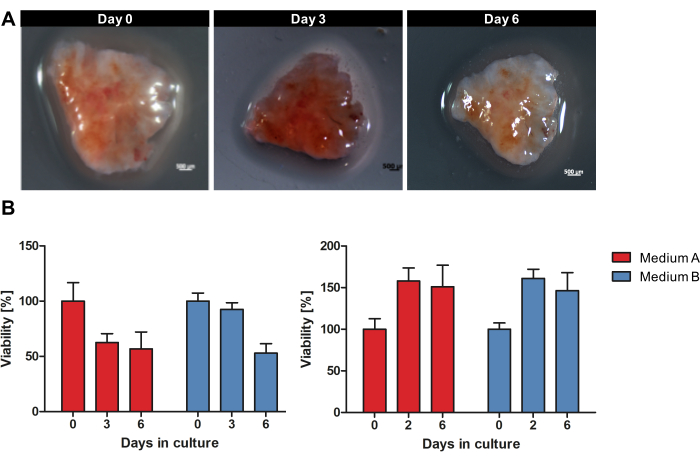
Рисунок 2: Макроскопическая морфология и жизнеспособность OTSC во время выращивания. Образец PDAC культивировали в качестве OTSC в течение 6 дней. (А) Макроскопическая морфология каждого OTSC не претерпела существенных изменений в процессе выращивания. Тем не менее, размер площади поверхности OTSC со временем уменьшался. (B) Общую жизнеспособность количественно оценивали с помощью анализа жизнеспособности резазурина в средах А и В. Снижение жизнеспособности часто может наблюдаться после 0-го дня из-за процедуры секционирования и адаптации к условиям культивирования. Тем не менее, мы также наблюдали увеличение жизнеспособности, как показано на правой панели. Каждая панель представляет собой отдельный образец опухоли с различным выходом полученных культур среза (левая панель n = 10, правая панель n = 10). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Гистопатологическая оценка OTSC после общего времени культивирования в течение 6 дней. OTSC (n = 6) культивировали в среде А. Морфологию тканей оценивали методом H&E окрашивания. Опухолевые клетки и клетки стромы дискриминировали по ИГХ для цитокератина 7 и виментина соответственно. Ki-67 и расщепленную каспазу 3 окрашивали для оценки пролиферации и апоптоза соответственно. Существенного увеличения апоптоза в течение общего периода культивирования в 6 дней не наблюдалось. Каждая масштабная линейка соответствует 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Гистопатологическая оценка OTSC после общего времени культивирования 15 дней. OTSCs (n = 8) культивировали в среде А. Морфологию тканей оценивали методом H&E окрашивания. Опухолевые клетки и клетки стромы дискриминировали по ИГХ для цитокератина 7 и виментина соответственно. Ki-67 и расщепленную каспазу 3 окрашивали для оценки пролиферации и апоптоза соответственно. Апоптоз значительно увеличивался после 15 дней культивирования, что проявлялось в окрашивании расщепленными каспазами-3. Каждая масштабная линейка соответствует 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Гистопатологическая оценка OTSC перитонеального метастаза PDAC. OTSCs (n = 8) культивировали в среде А. Морфологию тканей оценивали методом H&E окрашивания. Опухолевые клетки и клетки стромы дискриминировали по ИГХ для цитокератина 7 и виментина соответственно. Ki-67 и расщепленную каспазу 3 окрашивали для оценки пролиферации и апоптоза соответственно. Гистопатологическая оценка выявила высокую степень внутриопухолевой гетерогенности между отдельными срезами в отношении содержимого опухоли/стромы, а также естественно возникающего апоптоза, измеряемого окрашиванием расщепленными каспазами 3. Каждая масштабная линейка соответствует 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Гистопатологическая оценка OTSC метастазирования PDAC в брюшную стенку. OTSCs (n = 5) культивировали в среде А. Морфологию тканей оценивали методом H&E окрашивания. Опухолевые клетки и клетки стромы дискриминировали по ИГХ для цитокератина 7 и виментина соответственно. Ki-67 и расщепленную каспазу 3 окрашивали для оценки пролиферации и апоптоза соответственно. Гистопатологическое обследование выявило отсутствие опухолевых клеток в культивируемом метастазировании и частичный некроз, которые не удалось определить до культивирования. Каждая масштабная линейка соответствует 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
OTSC свежих образцов опухоли представляют собой близкое приближение опухоли in situ. Они сохраняют свою исходную морфологию, пролиферативную активность и микроокружение во время культивирования в течение определенного, тканезависимого периода 11,12,13. Этот метод позволяет немедленно применять лечение жизнеспособной опухолевой ткани человека ex vivo и последующие анализы, такие как профилирование транскриптома и протеома. Конкретное преимущество OTSC заключается в том, что пространственно разрешенные нисходящие анализы, такие как MALDI-визуализация, могут быть применены к интактной многоклеточной опухолевой ткани.
В данной работе мы описываем метод получения, культивирования и гистопатологической оценки OTSC PDAC и его метастазов. Ключевой проблемой для этой методики является разрезание свежей ткани без каких-либо процедур замораживания и культивирования на границе воздух-жидкость. Ограничением этого метода является то, что свежая, незафиксированная и незамороженная ткань не может быть оценена на содержание опухолевых клеток до культивирования. Как видно из наших результатов, ОТСК могут состоять из компонентов ткани, отличных от ожидаемых, при быстрых срезах других образцов из той же опухоли. Гистопатологическая оценка OTSC после культивирования является обязательным условием для оценки данных отдельных культур срезов. Описанный анализ жизнеспособности позволяет провести только общую оценку общей жизнеспособности каждого OTSC. В целом, описываемый метод может быть реализован в любой лаборатории, оборудованной установкой для вибратома и культивирования тканей. Благодаря простоте этой методики, ее можно легко модифицировать в соответствии с различными опухолями и исследовательскими вопросами.
Было разработано несколько методологий для культивирования опухолевой ткани человека ex vivo, например, первичных клеточных линий, органоидов, полученных от пациента, и ксенотрансплантатов. Однако их использование для разработки лекарств и идентификации прогностических биомаркеров остается ограниченным в основном из-за потери тканевого контекста, т.е. взаимодействия стромы и опухолевых клеток2.
Несмотря на то, что представленный метод создания органотипической культуры срезов сохраняет архитектуру многоклеточной ткани, необходимо учитывать ряд ограничений. Во-первых, необходимо принять во внимание значительную степень гетерогенности (внутри)опухоли. Отдельные OTSC, полученные в результате биопсии одной опухоли, могут демонстрировать значительные различия в соотношении опухолевых и стромальных клеток. Помимо общего качества тканей, это может быть одной из причин разной жизнеспособности срезов во время культивирования. Во-вторых, среда для оптимальных условий культивирования может варьироваться в зависимости от ткани и пациента. Мы сравнили две различные среды для культивирования тканей: первую на основе DMEM/F12 (среда A) и вторую на основе RPMI (среда B). Каждый образец первичной опухоли или ее метастазов может потребовать модификации. В-третьих, некроз опухоли может произойти уже in situ16 и не обязательно связан с недостаточными условиями культивирования OTSC. Следует рассмотреть сравнение с гистопатологией первичной опухоли.
Создание OTSC в том виде, в котором описано в этом протоколе, дает возможность быстро после операции протестировать ответ на лечение в модельной системе ex vivo , которая сохраняет микроокружение опухоли. В перспективе OTSC будут способствовать разработке индивидуальных терапевтических стратегий для персонализации лечения метастатического заболевания.
Раскрытие информации
Авторы не раскрыли никаких потенциальных конфликтов интересов.
Благодарности
Р. Браун был поддержан Школой клинических ученых Любека (DFG #413535489) и Программой финансирования для юниоров Университета Любека.
Материалы
| Name | Company | Catalog Number | Comments |
| Advanced DMEM/F-12 Medium | Gibco | 12634028 | |
| Agarose Low Melt | Roth | 6351.2 | 8% in Ringer solution |
| Antibody Diluent, Background Reducing | Dako | S3022 | |
| AquaTex | Merck | 108562 | |
| Bioethanol (99%, denatured) | CHEMSolute | 2,21,19,010 | |
| Citric Acid monohydrate | Sigma Aldrich | C7129 | |
| Cleaved Caspase-3 (Asp175) (5A1E) Rabbit mAb | Cell Signalling Technology | 9664 | 1:400 dilution |
| Derby Extra Double Edge Safety Razor Blades | Derby Tokai | ||
| Embedding cassettes | Roth | H579.1 | |
| Eosin Y-solution 0,5% aqueous | Merck | 10,98,44,100 | |
| Eukitt Quick hardening mounting medium | Sigma-Aldrich | 3989 | |
| Fetal bovine serum | Gibco | 10270106 | |
| Formaldehyde solution 4,5%, buffered | Büfa Chemikalien | B211101000 | |
| Hem alum solution acid acc. to Mayer | Roth | T865 | |
| Human EGF | Milteniy Biotec | 130-097-794 | |
| Hydrocortisone | Sigma Aldrich (Merck) | H0888 | |
| Hydrogen peroxide 30% | Merck | 1,08,59,71,000 | |
| Insulin human | Sigma Aldrich (Merck) | 12643 | |
| Liquid DAB+ Substrate Chromogen System | Dako | K3468 | |
| MACS Tissue Storage Solution | Milteniy Biotech | 130-100-008 | |
| Methanol | Merck | 10.600.092.500 | |
| Microscope Slides Superfrost Plus | Thermo Scientific | J1800AMNZ | |
| Millicell Cell Culture Insert, 30 mm, hydrophilic PTFE, 0.4 µm | Millipore (Merck) | PICM0RG50 | |
| Monoclonal mouse anti-human Cytokeratin 7 (Clone OV-TL 12/30) | Dako | M7018 | 1:200 dilution |
| Monoclonal mouse anti-human Ki67 Clone MIB-1 | Dako | M7240 | 1:200 dilution |
| Monoclonal mouse Anti-vimentin (Clone V9) | Dako | M0725 | 1:200 dilution |
| Negative control Mouse IgG2a | Dako | X0943 | 1:200 dilution |
| Negative control Mouse IgG1 | Dako | X093101-2 | 1:200 dilution |
| Paraffin (melting temperature 56°- 58°) | Merck | 10,73,37,100 | |
| Penicillin-Streptomycin (10.000 U/ml) | Gibco | 15140122 | |
| PBS pH 7,4 (1x) Flow Cytometry Grade | Gibco | A12860301 | |
| Resazurin sodium salt; 10 mg/ml in PBS | Sigma Aldrich | R7017 | 1:250 dilution |
| Ringer's solution | Fresenius Kabi | 2610813 | |
| RPMI-1640 Medium | Sigma Aldrich (Merck) | R8758 | |
| Tissue culture testplate 6 | TPP | 92006 | |
| Triton X-100 | Sigma Aldrich | 9002-93-1 | |
| VECTASTAIN Elite ABC-Peroxidase Kit | Vector Laboratories | PK-6200 | |
| Xylene (extra pure) | J.T.Baker | 8,11,85,000 | |
| Equipment | |||
| ClarioStar Microplate Reader | BMG Labtech | ||
| Paraffin Embedding Center E61110 | Leica | ||
| Rotary Microtome Microm HM355S | Thermo Scientific | ||
| Section Transfer System Microm STS | Thermo Scientific | ||
| VT 1200S Vibratom | Leica |
Ссылки
- Nevala-Plagemann, C., Hidalgo, M., Garrido-Laguna, I. From state-of-the-art treatments to novel therapies for advanced-stage pancreatic cancer. Nature Reviews. Clinical Oncology. 17 (2), 108-123 (2020).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- Waghray, M., Yalamanchili, M., di Magliano, M. P., Simeone, D. M. Deciphering the role of stroma in pancreatic cancer. Current Opinion in Gastroenterology. 29 (5), 537-543 (2013).
- Hwang, R. F., et al. Cancer-associated stromal fibroblasts promote pancreatic tumor progression. Cancer Research. 68 (3), 918-926 (2008).
- Jiang, X., et al. Long-lived pancreatic ductal adenocarcinoma slice cultures enable precise study of the immune microenvironment. Oncoimmunology. 6 (7), 1333210 (2017).
- Hessmann, E., et al. Fibroblast drug scavenging increases intratumoural gemcitabine accumulation in murine pancreas cancer. Gut. 67 (3), 497-507 (2018).
- Feig, C., et al. The pancreas cancer microenvironment. Clinical Cancer Research. 18 (16), 4266-4276 (2012).
- Koerfer, J., et al. Organotypic slice cultures of human gastric and esophagogastric junction cancer. Cancer Medicine. 5 (7), 1444-1453 (2016).
- Gerlach, M. M., et al. Slice cultures from head and neck squamous cell carcinoma: a novel test system for drug susceptibility and mechanisms of resistance. British Journal of Cancer. 110 (2), 479-488 (2014).
- Holliday, D. L., et al. The practicalities of using tissue slices as preclinical organotypic breast cancer models. Journal of Clinical Pathology. 66 (3), 253-255 (2013).
- Vaira, V., et al. Preclinical model of organotypic culture for pharmacodynamic profiling of human tumors. Proceedings of the National Academy of Sciences of the United States of America. 107 (18), 8352-8356 (2010).
- Lim, C. Y., et al. Organotypic slice cultures of pancreatic ductal adenocarcinoma preserve the tumor microenvironment and provide a platform for drug response. Pancreatology. 18 (8), 913-927 (2018).
- Brandenburger, M., et al. Organotypic slice culture from human adult ventricular myocardium. Cardiovascular Research. 93 (1), 50-59 (2012).
- Misra, S., et al. Ex vivo organotypic culture system of precision-cut slices of human pancreatic ductal adenocarcinoma. Science Reports. 9 (1), 2133 (2019).
- O'Brien, J., Wilson, I., Orton, T., Pognan, F. Investigation of the Alamar Blue (resazurin) fluorescent dye for the assessment of mammalian cell cytotoxicity. European Journal of Biochemistry. 267 (17), 5421-5426 (2000).
- Beutler, B., Cerami, A. Tumor necrosis, cachexia, shock, and inflammation: a common mediator. Annual Review of Biochemisty. 57, 505-518 (1988).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены