Method Article
Colture organotipiche di fette come modelli preclinici del microambiente tumorale nel carcinoma pancreatico primario e nelle metastasi
In questo articolo
Riepilogo
Questo protocollo descrive la preparazione di colture organotipiche di fette (OTSC). Questa tecnica facilita la coltivazione ex vivo di tessuto multicellulare intatto. Gli OTSC possono essere utilizzati immediatamente per testare la rispettiva risposta ai farmaci in un ambiente multicellulare.
Abstract
Sono urgentemente necessari modelli preclinici realistici del carcinoma pancreatico primario e delle metastasi per testare la risposta terapeutica ex vivo e facilitare il trattamento personalizzato del paziente. Tuttavia, l'assenza di un microambiente tumore-specifico nei modelli attualmente utilizzati, ad esempio linee cellulari derivate da pazienti e xenotrapianti, consente solo intuizioni predittive limitate. Le colture di fette organotipiche (OTSC) comprendono tessuto multicellulare intatto, che può essere rapidamente utilizzato per i test di risposta ai farmaci risolti spazialmente.
Questo protocollo descrive la generazione e la coltivazione di fette tumorali vitali di cancro al pancreas e le sue metastasi. In breve, il tessuto viene colato in agarosio a basso punto di fusione e conservato in un tampone isotonico freddo. Successivamente, vengono generate fette di tessuto di 300 μm di spessore con un vibratomo. Dopo la preparazione, le fette vengono coltivate in un'interfaccia aria-liquido utilizzando inserti di coltura cellulare e un terreno di coltura appropriato. Durante la coltivazione, è possibile monitorare i cambiamenti nella differenziazione e nella vitalità cellulare. Inoltre, questa tecnica consente l'applicazione del trattamento a tessuto tumorale umano vitale ex vivo e successive analisi a valle, come il trascrittoma e la profilazione del proteoma.
Le OTSC offrono un'opportunità unica per testare la risposta individuale al trattamento ex vivo e identificare i profili trascrittomici e proteomici individuali associati alla rispettiva risposta di fette distinte di un tumore. Le OTSC possono essere ulteriormente esplorate per identificare strategie terapeutiche per personalizzare il trattamento del cancro primitivo del pancreas e delle metastasi.
Introduzione
I modelli preclinici esistenti di adenocarcinoma duttale pancreatico (PDAC) e le rispettive metastasi sono scarsi predittori di risposta al trattamento nei pazienti, il che rappresenta uno dei principali svantaggi nello sviluppo di farmaci e nell'identificazione di biomarcatori predittivi1. Sebbene modelli come gli organoidi derivati da pazienti e gli xenotrapianti derivati da pazienti siano promettenti, il loro uso rimane limitato2. I principali limiti di questi modelli in vitro sono la mancanza del microambiente tumorale e lo xenotrapianto in specie immunocompromesse non umane. Soprattutto nel PDAC e nelle sue metastasi, il microambiente tumorale ha guadagnato notevole interesse negli ultimi anni a causa delle sue funzioni cruciali nella biologia dei tumori. Comprende componenti cellulari e acellulari, come i (mio-)fibroblasti, le cellule stellate pancreatiche, le cellule immunitarie, i vasi sanguigni, la matrice extracellulare, le citochine e i fattori di crescita3. Questo microambiente non è un componente tumorale non funzionale, ma induce la progressione e la metastasi del tumore e sembra contribuire in modo sostanziale alla resistenza alla radioterapia e alla chemioterapia4. Il microambiente PDAC non solo compromette meccanicamente la somministrazione dei farmaci, ma possiede anche attività immunitaria e di scavenging dei farmaci 5,6,7. Pertanto, sono urgentemente necessari modelli preclinici che riflettano la complessa interazione tra le cellule tumorali e il microambiente tumorale per testare adeguatamente la risposta al trattamento dei pazienti ex vivo e guidare un trattamento clinico individualizzato.
Le colture ex vivo di campioni di tumore fresco rappresentano una stretta approssimazione del tumore in situ. Le colture organotipiche a fette (OTSC) sono state recentemente sviluppate e studiate per diversi tumori, come i tumori della testa, del collo, della mammella, della prostata, del polmone, del colon e del pancreas 8,9,10,11,12. È stato dimostrato che le OTSC mantengono la loro morfologia di base, l'attività proliferativa e il microambiente durante la coltivazione per un periodo definito e tessuto-dipendente 11,12,13. Gli OTSC dei PDAC hanno mantenuto la loro vitalità, morfologia e la maggior parte dei componenti del loro microambiente tumorale per 4-9 giorni in diversi studi in vitro 5,12,14. In prospettiva, questa tecnica consente un'applicazione immediata del trattamento a tessuto tumorale umano vitale ex vivo e successive analisi a valle, come la profilazione del trascrittoma e del proteoma.
L'istituzione di OTSC offre un'opportunità unica per testare la risposta al trattamento ex vivo prontamente dopo l'intervento chirurgico. Pertanto, le OTSC consentiranno in modo prospettico di identificare strategie terapeutiche per personalizzare il trattamento della malattia metastatica. Questo protocollo descrive la generazione e la coltivazione di OTSC vitali di cancro al pancreas.
Protocollo
I campioni di tessuto sono stati raccolti ed elaborati dopo l'approvazione del comitato etico locale dell'Università di Lubecca (# 16-281).
1. Raccolta e manipolazione di tessuti freschi
NOTA: Ogni campione di tessuto umano non fissato deve essere maneggiato con cautela per prevenire il rischio di infezione da agenti patogeni trasmessi per via ematica. Tutti i pazienti devono essere testati per essere negativi per HIV, HBV e HCV prima del trattamento dei tessuti. Indossare un camice protettivo e maneggiare i campioni di tessuto umano con i guanti.
- Raccogliere un campione di tessuto PDAC fresco, non fissato e non congelato con una dimensione minima di 0,4 x 0,4 cm subito dopo l'intervento chirurgico e trasportare il campione in laboratorio in una soluzione di conservazione dei tessuti.
- Quando possibile, lavorare immediatamente il tessuto fresco.
- In alternativa, conservare i fazzoletti in una soluzione di conservazione dei tessuti su ghiaccio umido a 4 °C per una notte. Tuttavia, l'accumulo di tessuti potrebbe comportare una compromissione della vitalità e dovrebbe essere generalmente evitato.
2. Preparazione
- Preparato di agarosio a basso punto di fusione
- Preparare 100 mL di agarosio a basso punto di fusione (8%) sciogliendo 8 g di agarosio in 100 mL di soluzione di Ringer preriscaldata e conservarla a 4 °C fino al momento del bisogno.
- All'annuncio della resezione del tumore, sciogliere l'agarosio in un forno a microonde.
- Porre l'agarosio in un bagnomaria preriscaldato (37 °C) lasciandolo raffreddare a temperature fisiologiche prima della preparazione.
- Configurazione del vibratomo
- Posizionare una lama di rasoio nel supporto del vibratomo ed eseguire una regolazione automatica dell'angolo secondo le istruzioni del produttore, se applicabile.
- Raffreddare la camicia della camera di taglio utilizzando un'unità di raffreddamento o ghiaccio umido.
- Riempire la camera di taglio con circa 100 ml di una soluzione di taglio fisiologica (ad es. soluzione di Ringer).
- Posizionare la lama del rasoio montata nella soluzione di taglio pre-raffreddata, lasciando raffreddare la lama del rasoio.
3. Inclusione tissutale nell'agarosio a basso punto di fusione
- Lavare il campione di tessuto con PBS raffreddato (4 °C) e posizionare il tessuto in PBS su una capsula di Petri grande (~14 cm) con ghiaccio.
- Rimuovere il tessuto connettivo in eccesso macroscopicamente visibile sul ghiaccio utilizzando un bisturi poiché potrebbe ostacolare l'efficienza del taglio.
- Mettere il fazzoletto in una piccola capsula di Petri (~3 cm).
- Regolare l'orientamento del tessuto in modo che il tessuto connettivo macroscopicamente visibile rimanente abbia lo stesso orientamento del piano del fondo della capsula di Petri. Il fondo della piastra di Petri ha lo stesso orientamento del piano di taglio.
- Versare l'agarosio a basso punto di fusione preparato nella piccola capsula di Petri.
- Regolare nuovamente l'orientamento del tessuto, se necessario, utilizzando una pinza.
- Posizionare la capsula di Petri su ghiaccio umido per un indurimento più rapido dell'agarosio.
- Tagliare con cura il fazzoletto utilizzando un bisturi, lasciando almeno 5 mm di agarosio circostante su ciascun lato del tessuto.
- Trasferire con cura il tessuto incorporato e incollarlo sul supporto del campione utilizzando la super colla.
- Dopo alcuni secondi, posizionare il portacampione nella camera di taglio.
- Regolare l'orientamento del tessuto verso la lama del rasoio, se necessario.
4. Taglio del tessuto incorporato nell'agarosio mediante un vibratomo
- Definire i limiti esterni del campo di taglio (asse y) in base alle dimensioni del campione di tessuto.
- Regolare la lama verso la parte superiore del blocco di tessuto.
- Impostare la velocità di taglio a 0,04 mm/s, l'ampiezza di taglio a 1 mm e lo spessore della fetta a 300 μm.
- Tagliare con cura le prime fette e trasferirle in un contenitore separato con soluzione da taglio preraffreddata (4 °C) su ghiaccio umido.
5. Coltura di colture organotipiche di fette
- Preparare una piastra a 6 pozzetti con 1 mL del terreno di coltura appropriato per pozzetto.
- Medium A: DMEM/F12 avanzato, 10% FBS, 1% penicillina/streptomicina.
- Terreno B: RPMI 1640, 10% FBS, 1% penicillina/streptomicina, 4 μg/mL di insulina, 8 ng/mL di EGF, 0,3 μg/mL di idrocortisone.
NOTA: Il terreno per condizioni di coltura ottimali può variare a seconda del tessuto e del paziente. Sono stati confrontati due distinti terreni di coltura tissutale, uno basato su DMEM/F12 (terreno A) e il secondo basato su RPMI (terreno B). Non sono state rilevate differenze sostanziali tra questi mezzi. Per tutti gli esperimenti mostrati in questo protocollo, è stato utilizzato il mezzo A.
- Posizionare la piastra a 6 pozzetti con il terreno in un'incubatrice, consentendo la regolazione della temperatura e del pH prima della coltivazione.
- Posizionare le fette sugli inserti per colture cellulari (ad esempio, inserti in PTFE idrofilo con pori di 0,4 μm) utilizzando un filtro per lo sguardo.
- Rimuovere la soluzione di taglio in eccesso posizionando il filtro carico su un panno sterile.
- Posizionare il filtro caricato nella piastra a 6 pozzetti preparata. Non aggiungere alcun mezzo aggiuntivo all'inserto.
- Posizionare la piastra a 6 pozzetti in un incubatore (37 °C, 5% CO2).
- Cambiare il fluido ogni 2 giorni ripetendo i passaggi 5.1, 5.2 e 5.5 con una nuova piastra a 6 pozzetti.
NOTA: Le colture di fette organotipiche possono essere coltivate per vari periodi a seconda della domanda di ricerca individuale.
6. Saggio di vitalità della resazurina
NOTA: Il saggio di vitalità della resazurina misura l'attività metabolica generale delle colture organotipiche di fette sulla base della riduzione della resazurina blu non fluorescente a resorufina fluorescente rossa nelle cellule viventi15. Il test non ha effetti tossici sulle cellule e può essere applicato ripetutamente alle colture a seconda della domanda di ricerca individuale. La vitalità è stata misurata utilizzando il test della resazurina ogni 2-3 giorni.
- Preparazione della soluzione madre di resazurina
- Spegnere la luce della cappa sterile, poiché la soluzione madre di resazurina è sensibile alla luce.
- Preparare una soluzione madre con 10 mg/mL di sale sodico di resazurina in 1x PBS.
- Conservare la soluzione madre in aliquote protette dalla luce a 4 °C in frigorifero fino al momento dell'uso.
- Valutazione della vitalità complessiva delle fette
- Spegnere la luce della cappa sterile, poiché la soluzione madre di resazurina è sensibile alla luce.
- Diluire la soluzione madre di resazurina 1:250 con un mezzo appropriato.
NOTA: Il terreno utilizzato per la diluizione deve essere lo stesso utilizzato per la coltivazione (terreno A o medio B). - Preparare 1 mL della soluzione finale di resazurina per fetta e aggiungere un ulteriore 1 mL per il controllo in bianco, ad esempio, per 6 fette diluire 28 μL di soluzione madre di resazurina in 7 mL di terreno.
- Erogare la soluzione di resazurina in piastre a 6 pozzetti, con 1 mL di soluzione di resazurina diluita per pozzetto.
- Trasferire i filtri di coltivazione con le fette nei pozzetti con la soluzione di resazurina. Un pozzetto con la soluzione di resazurina viene mantenuto vuoto come controllo in bianco.
NOTA: Per semplificare la procedura sperimentale, questo passaggio può essere combinato con la sostituzione del mezzo (passaggio 5.7). Tuttavia, nel caso in cui siano necessarie ulteriori misurazioni della vitalità, il test può essere eseguito in qualsiasi momento durante la coltivazione delle colture a fette. - Porre le fette di tessuto in un'incubatrice per 1 ora a 37 °C e 5% di CO2.
- Preparare nuove piastre a 6 pozzetti con il terreno di coltura se la coltura a fette viene continuata (vedere i passaggi 5.1 e 5.2).
- Rimuovere i filtri di coltivazione con le fette dalla soluzione di resazurina e rimuovere la soluzione in eccesso posizionando il filtro caricato su un panno sterile.
- Trasferire i filtri di coltivazione con le fette sulla piastra di coltura precedentemente preparata.
- Da ogni 6 pozzetti, prelevare 100 μL di soluzione di resazurina e trasferirla su una piastra a 96 pozzetti. Dal controllo in bianco, posizionare tre campioni (3 x 100 μL) in pozzetti separati della piastra a 96 pozzetti.
- Quantificare l'estinzione con un fotometro a piastra secondo le istruzioni del produttore. La lunghezza d'onda di eccitazione è impostata su 545 nm e la lunghezza d'onda di emissione è impostata su 600 nm.
7. Fissazione della formalina e inclusione di paraffina di OTSC
- Trasferire con cautela le fette di tessuto coltivate in una cassetta di plastica per inclusione. Per fare ciò, procedi nel seguente modo.
- Posizionare il filtro di coltivazione con la fetta montata su una capsula di Petri.
- Con un bisturi, ritagliare con cura la membrana filtrante con la fetta di tessuto montata.
- Trasferire con cura la membrana filtrante con la fetta montata in una sacca di nylon per biopsia e posizionarla in una cassetta di inclusione.
- Successivamente trasferire le cassette di inclusione in plastica in un contenitore con formalina pre-refrigerata (4 °C) al 4,5%. Le fette possono essere conservate in soluzione di formalina a 4 °C fino a nuovo utilizzo, ma devono essere incubate per almeno 24 ore.
NOTA: I OTSC devono essere trasferiti con grande cautela poiché si strappano facilmente.
- Sciacquare accuratamente la coltura di fette fissate in formalina con acqua corrente del rubinetto per 1,5 ore.
- Disidratare la fetta di tessuto fissata in formalina mediante incubazione in etanolo al 70% (2 volte per 3 ore), etanolo al 95% (1 volta per la notte, 1 volta per 3 ore), seguito da etanolo assoluto (1 volta per 3 ore, 1 volta per la notte).
- Eliminare la fetta di tessuto fissata in formalina mediante incubazione di 3 ore in xilene due volte.
- Immergere il fazzoletto con paraffina a 60 °C (1 volta per tutta la notte, 1 volta per 2 ore). Incorporare il tessuto in un blocco di paraffina in uno stampo per l'inclusione dei tessuti.
- Sezionare il blocco di tessuto incorporato in paraffina a 4 μm di spessore con un microtomo e galleggiare in un bagno d'acqua a 40 °C contenente acqua distillata. Trasferire le sezioni su vetrini.
- Incubare le sezioni di paraffina per 1 ora a 60 °C per legare il tessuto al vetro. Incubare i vetrini per una notte a 37 °C.
8. Colorazione con ematossilina ed eosina (H&E)
- Deparaffinare le sezioni del passaggio 7.7 mediante incubazione in xilene (3 volte per 5 minuti).
- Reidratare mediante incubazione in alcol assoluto (2 volte per 5 minuti), alcol al 95% (2 volte per 5 minuti) e alcol al 70% (1 volta per 5 minuti). Sciacquare brevemente con acqua distillata.
- Colorare in soluzione di ematossilina Mayer per 5 min. Sciacquare con acqua corrente del rubinetto per 10 min.
- Controcolorante in soluzione di eosina allo 0,5% per 40 s. Risciacquare con acqua distillata.
- Disidratare mediante incubazione rispettivamente in alcol al 70% (massimo 1 minuto), etanolo al 95% (2 volte per 3 minuti) e alcol assoluto (2 volte per 3 minuti).
- Chiarifica in tre cambi di xilene (pochi secondi ciascuno). Posizionare una goccia di mezzo di montaggio e coprire i vetrini con un vetrino coprioggetti.
9. Immunoistochimica delle OTSC
- Deparaffinare le sezioni mediante incubazione in xilene 2 volte per 10 minuti, seguita da etanolo/xilolo 1:1 per 10 minuti.
- Trasferire i vetrini al 100% di etanolo (2 volte per 3 minuti), al 96% di etanolo (2 volte per 3 minuti), al 70% di etanolo (1 volta per 3 minuti) e infine al 50% di etanolo (1 volta per 3 minuti).
- Eseguire il recupero dell'antigene per smascherare l'epitopo antigenico. Riscaldare i vetrini in un forno a microonde in tampone citrato per 5 minuti a 900 W, seguiti da 2 volte per 8 minuti a 600 W. Lasciare raffreddare i vetrini a temperatura ambiente per 20 minuti.
- Lavare in PBS 3 volte per 3 minuti su uno shaker.
- Eseguire la permeabilizzazione delle membrane cellulari mediante incubazione in Triton X-100 allo 0,1% in PBS (200 μl per vetrino) in una camera umidificata a temperatura ambiente per 10 minuti.
- Lavare in PBS per tre cambi, 3 minuti ciascuno sullo shaker.
- Incubare le sezioni con una soluzione al 3% di H2O2 in metanolo (200 μl per vetrino) in una camera umidificata a temperatura ambiente per 10 minuti per bloccare l'attività endogena della perossidasi.
- Lavare in PBS 3 volte per 3 minuti su uno shaker.
- Aggiungere 200 μL di tampone bloccante (1:50 siero di cavallo in PBS) e incubare in una camera umidificata a temperatura ambiente per 25 minuti.
- Scaricare il tampone di bloccaggio dai vetrini inclinando il vetrino su un fazzoletto di carta.
- Applicare 200 μl di anticorpo primario opportunamente diluito in diluente anticorpale sui vetrini e incubare in una camera umidificata a 4 °C per una notte. Come controllo negativo, utilizzare un'isoforma appropriata di immunoglobuline di topo alla stessa diluizione dell'anticorpo primario.
- Lavare 3 volte per 3 minuti in PBS su uno shaker.
- Applicare 200 μL di anticorpo secondario biotinilato (soluzione 1:50 in PBS) sui vetrini e incubare in una camera umidificata a temperatura ambiente per 30 minuti.
- Lavare 3 volte per 3 minuti in PBS su uno shaker.
- Preparare il complesso perossidasi a base di avidina/biotina secondo le istruzioni del produttore prima dell'applicazione. Applicare 200 μL di complesso avidina-biotina-perossidasi sui vetrini e incubare in una camera umidificata a temperatura ambiente per 30 minuti.
- Lavare 3 volte per 3 minuti in PBS su uno shaker.
- Applicare 200 μl di soluzione di substrato DAB (appena preparata direttamente prima dell'uso: 1 goccia di DAB in 1 mL di substrato), 200 μl per vetrino. Lasciare che il colore si sviluppi per 1-3 minuti fino a raggiungere l'intensità del colore desiderata.
- Sciacquare con acqua corrente del rubinetto per 10 min.
- Controcolorare i vetrini immergendo i lati in ematossilina per 5 minuti.
- Sciacquare con acqua corrente del rubinetto per 10 min.
- Coprire i vetrini utilizzando un mezzo di montaggio acquoso e vetrini coprioggetti. Le guide montate possono essere conservate a temperatura ambiente in modo permanente.
Risultati
La Figura 1 fornisce una panoramica del flusso di lavoro per la coltura di OTSC da tessuto tumorale fresco e non congelato. I campioni di PDAC primari e metastasi sono stati raccolti direttamente dopo la resezione chirurgica e conservati per una notte su ghiaccio umido a 4 °C nella soluzione di conservazione tissutale. I campioni sono stati lavorati e le fette sono state coltivate come descritto nel protocollo. La morfologia macroscopica di ogni OTSC non è cambiata grossolanamente durante la coltivazione. Tuttavia, la dimensione della superficie delle OTSC è diminuita nel tempo, come mostrato in modo esemplare nella Figura 2A durante la coltivazione per 6 giorni. La vitalità complessiva dell'OTSC è stata valutata mediante test di vitalità della resazurina nei giorni 0, 2/3 e 6 (Figura 2B). Il saggio di vitalità della resazurina misura l'attività metabolica generale dell'OTSC sulla base della riduzione della resorufina blu non fluorescente a resorufina fluorescente rossa nelle cellule viventi15. La Figura 2B mostra il confronto della vitalità misurata dalla riduzione della resazurina dopo la coltivazione di OTSC da due tumori primari rappresentativi in due diversi mezzi. Gli OTSC sono stati coltivati in terreno A (DMEM/F12 avanzato, 10% FBS, 1% penicillina/streptomicina) o in terreno B (RPMI 1640, 10% FBS, 1% penicillina/streptomicina, 4 μg/mL di insulina, 8 ng/mL di EGF, 0,3 μg/mL di idrocortisone), il che ha portato a una vitalità complessiva simile indipendentemente dal terreno di coltura. Da notare che una diminuzione della vitalità dopo il giorno 0 può essere osservata frequentemente ed è prevista a causa della procedura di affettamento e dell'adattamento alle condizioni di coltura. Tuttavia, abbiamo anche osservato un aumento della vitalità, come mostrato in modo esemplare nel pannello di destra (Figura 2B).
Dopo periodi definiti di coltivazione nel terreno A, le OTSC sono state fissate in formalina per un'ulteriore caratterizzazione immunoistologica (IHC). Dopo la fissazione della formalina, le OTSC sono state incorporate in paraffina e sezionate. Le sezioni colorate con H&E hanno mostrato che la struttura complessiva del tessuto è stata preservata per tutto il tempo di coltivazione ex vivo (Figura 3). Le cellule tumorali e stromali sono state discriminate dall'IHC rispettivamente per la citocheratina 7 e la vimentina. Durante la coltivazione non sono stati rilevati cambiamenti sostanziali nei rapporti tumore/stroma.
La valutazione istopatologica microscopica delle sezioni H&E non ha rivelato un aumento sostanziale della necrosi di tutti i tessuti coltivati durante la coltivazione (Figura 3, Figura 4, Figura 5). Inoltre, il Ki-67 e la caspasi 3 scissa sono stati colorati per la valutazione della proliferazione e dell'apoptosi, rispettivamente. Anche in questo caso, non abbiamo rilevato cambiamenti grossolani di proliferazione e apoptosi durante il periodo di coltura di 6 giorni (Figura 3). Tuttavia, la percentuale di cellule apoptotiche aumenta nel tempo durante periodi di coltivazione prolungati, come misurato dalla colorazione con caspasi 3 scissata. La Figura 4 mostra l'aumento delle cellule positive alla caspasi 3 scissa dopo aver coltivato un PDAC primario per 15 giorni. La Figura 5 mostra l'istopatologia di una metastasi peritoneale di un PDAC. Questo esperimento dimostra un'elevata eterogeneità intratumorale tra le singole fette per quanto riguarda il contenuto di tumore/stroma e l'apoptosi naturale misurata mediante colorazione con caspasi 3 scissata. Pertanto, la valutazione istopatologica delle OTSC coltivate è importante per la valutazione dell'architettura tumorale/stromale e della vitalità di ciascun tumore coltivato o delle sue metastasi.
La Figura 6 mostra l'istopatologia di una metastasi PDAC della parete addominale. La colorazione H&E e l'IHC per la citocheratina 7 hanno dimostrato che gli OTSC derivati non contenevano cellule tumorali, ma consistevano solo di tessuto connettivo, che era parzialmente necrotico. Uno svantaggio della tecnologia OTSC è che il tessuto fresco, non fissato e non congelato non può essere valutato per il suo contenuto di cellule tumorali prima della coltivazione.
Nel complesso, questi dati dimostrano che l'architettura multicellulare di un tumore e le sue rispettive metastasi, comprendenti tipi cellulari distinti, si riflettono nelle OTSC. In particolare, le interazioni tumore-stroma sono preservate.
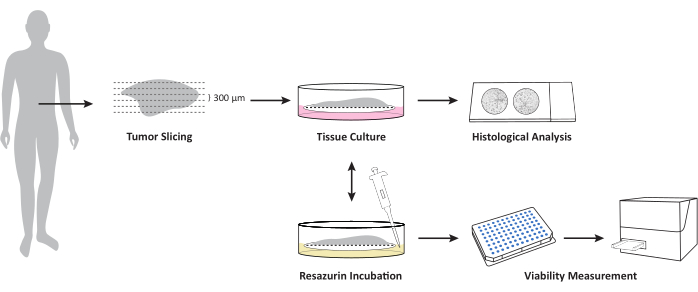
Figura 1: Panoramica del flusso di lavoro per la coltivazione di OTSC da campioni di tumore/metastasi di tessuti freschi e non congelati. Il campione di tessuto fresco e non congelato viene sezionato utilizzando un vibratomo e coltivato all'interfaccia aria-liquido su inserti di coltura cellulare in PTFE. La vitalità complessiva può essere misurata in punti temporali definiti mediante il saggio di vitalità della resazurina. Questo test consente un'ulteriore coltivazione dopo la misurazione della vitalità. Le fette vengono fissate in formalina in punti temporali definiti per ulteriori esami istopatologici. Clicca qui per visualizzare una versione più grande di questa figura.
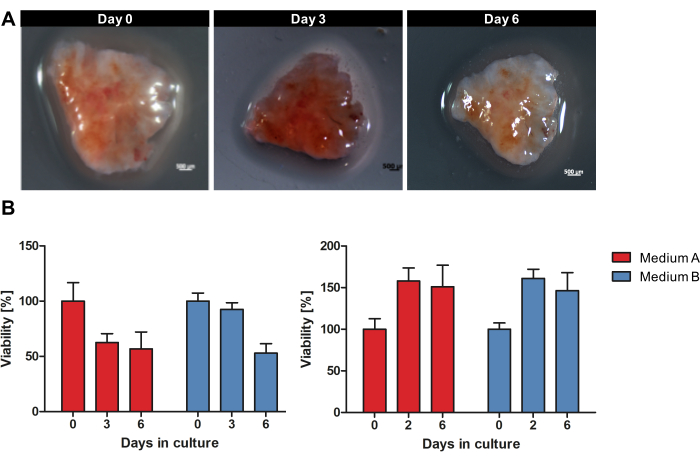
Figura 2: Morfologia macroscopica e vitalità delle OTSC durante la coltivazione. Un campione di PDAC è stato coltivato come OTSC per 6 giorni. (A) La morfologia macroscopica di ciascun OTSC non è cambiata in modo significativo durante la coltivazione. Tuttavia, la dimensione della superficie delle OTSC è diminuita nel tempo. (B) La vitalità complessiva è stata quantificata mediante saggio di vitalità della resazurina nel terreno A e B. Una diminuzione della vitalità può essere osservata frequentemente dopo il giorno 0 a causa della procedura di sezionamento e dell'adattamento alle condizioni di coltura. Tuttavia, abbiamo anche osservato un aumento della vitalità, come mostrato in modo esemplare nel pannello di destra. Ogni pannello rappresenta un singolo campione tumorale con diverse rese di colture di fette derivate (pannello di sinistra n = 10, pannello di destra n = 10). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Valutazione istopatologica delle OTSC dopo un tempo di coltivazione totale di 6 giorni. Le OTSC (n = 6) sono state coltivate nel terreno A. La morfologia tissutale è stata valutata mediante colorazione H&E. Le cellule tumorali e stromali sono state discriminate dall'IHC rispettivamente per la citocheratina 7 e la vimentina. Ki-67 e la caspasi 3 scissa sono stati colorati per la valutazione della proliferazione e dell'apoptosi, rispettivamente. Non è stato osservato alcun aumento sostanziale dell'apoptosi per un periodo di coltivazione totale di 6 giorni. Ogni barra della scala rappresenta 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Valutazione istopatologica delle OTSC dopo un tempo di coltivazione totale di 15 giorni. Le OTSC (n = 8) sono state coltivate nel terreno A. La morfologia tissutale è stata valutata mediante colorazione H&E. Le cellule tumorali e stromali sono state discriminate dall'IHC rispettivamente per la citocheratina 7 e la vimentina. Ki-67 e la caspasi 3 scissa sono stati colorati per la valutazione della proliferazione e dell'apoptosi, rispettivamente. L'apoptosi è sostanzialmente aumentata dopo 15 giorni di coltivazione, come esemplificato dalla colorazione con caspasi-3 scissata. Ogni barra della scala rappresenta 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Valutazione istopatologica delle OTSC di una metastasi peritoneale di un PDAC. Le OTSC (n = 8) sono state coltivate nel terreno A. La morfologia tissutale è stata valutata mediante colorazione H&E. Le cellule tumorali e stromali sono state discriminate dall'IHC rispettivamente per la citocheratina 7 e la vimentina. Ki-67 e la caspasi 3 scissa sono stati colorati per la valutazione della proliferazione e dell'apoptosi, rispettivamente. La valutazione istopatologica ha rivelato un alto grado di eterogeneità intratumorale tra le singole fette per quanto riguarda il contenuto di tumore/stroma e l'apoptosi naturale misurata mediante colorazione con caspasi 3 scissata. Ogni barra della scala rappresenta 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6: Valutazione istopatologica delle OTSC di una metastasi PDAC della parete addominale. Le OTSC (n = 5) sono state coltivate nel terreno A. La morfologia tissutale è stata valutata mediante colorazione H&E. Le cellule tumorali e stromali sono state discriminate dall'IHC rispettivamente per la citocheratina 7 e la vimentina. Ki-67 e la caspasi 3 scissa sono stati colorati per la valutazione della proliferazione e dell'apoptosi, rispettivamente. La valutazione istopatologica ha rivelato la mancanza di cellule tumorali nelle metastasi coltivate e la necrosi parziale, che non è stato possibile determinare prima della coltivazione. Ogni barra della scala rappresenta 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Gli OTSC di campioni di tumore fresco sono una stretta approssimazione del tumore in situ. Mantengono la loro morfologia di base, l'attività proliferativa e il microambiente durante la coltivazione per un periodo definito e dipendente dai tessuti 11,12,13. Questa tecnica consente l'applicazione immediata del trattamento a tessuto tumorale umano vitale ex vivo e le successive analisi a valle, come la profilazione del trascrittoma e del proteoma. Un vantaggio specifico delle OTSC è che le analisi a valle risolte spazialmente, come l'imaging MALDI, possono essere applicate al tessuto tumorale multicellulare intatto.
Qui descriviamo un metodo per la generazione, la coltivazione e la valutazione istopatologica delle OTSC del PDAC e delle sue metastasi. Il problema chiave per questa tecnica è quello di tagliare il tessuto fresco senza alcuna procedura di congelamento e la coltivazione in un'interfaccia aria-liquido. Una limitazione di questo metodo è che il tessuto fresco, non fissato e non congelato non può essere valutato per il suo contenuto di cellule tumorali prima della coltivazione. Come esemplificato nei nostri risultati, le OTSC possono rivelarsi costituite da componenti tissutali diverse da quelle attese da sezioni rapide di altri campioni dello stesso tumore. La valutazione istopatologica delle OTSC dopo la coltura è fondamentale per la valutazione dei dati delle singole colture di fette. Il saggio di vitalità descritto consente solo una valutazione generale della vitalità globale di ciascun OTSC. In generale, il metodo descritto può essere implementato in qualsiasi laboratorio dotato di un'unità di vibratomo e coltura tissutale. Grazie alla semplicità di questa tecnica, può essere facilmente modificata verso vari tumori e domande di ricerca.
Sono state sviluppate diverse metodologie per la coltura di tessuto tumorale umano ex vivo, ad esempio linee cellulari primarie, organoidi derivati da pazienti e xenotrapianti. Tuttavia, il loro uso per lo sviluppo di farmaci e l'identificazione di biomarcatori predittivi rimane limitato principalmente a causa della perdita del contesto tissutale, cioè dell'interazione tra stroma e cellule tumorali2.
Sebbene il metodo presentato per l'insediamento di colture di fette organotipiche preservi l'architettura del tessuto multicellulare, è necessario considerare diverse limitazioni. In primo luogo, è necessario prendere in considerazione un notevole grado di eterogeneità (intra)tumorale. OTSC distinti derivati da una singola biopsia tumorale potrebbero mostrare variazioni considerevoli nelle loro proporzioni di cellule tumorali e stromali. Oltre alla qualità complessiva del tessuto, questo potrebbe essere uno dei motivi della diversa vitalità della fetta durante la coltura. In secondo luogo, il terreno per condizioni di coltura ottimali può variare a seconda del tessuto e del paziente. Sono stati confrontati due distinti terreni di coltura tissutale: il primo basato su DMEM/F12 (terreno A) e il secondo basato su RPMI (terreno B). Ogni campione di tumori primari o le sue metastasi potrebbero richiedere modifiche. In terzo luogo, la necrosi tumorale potrebbe verificarsi già in situ16 e non è necessariamente dovuta a condizioni di coltura insufficienti degli OTSC. Deve essere preso in considerazione il confronto con l'istopatologia del tumore primitivo.
La definizione di OTSC come descritto in questo protocollo offre l'opportunità di testare la risposta al trattamento prontamente dopo l'intervento chirurgico in un sistema modello ex vivo che preserva il microambiente tumorale. In prospettiva, le OTSC faciliteranno lo sviluppo di strategie terapeutiche individuali per personalizzare il trattamento della malattia metastatica.
Divulgazioni
Gli autori non hanno rivelato potenziali conflitti di interesse.
Riconoscimenti
R. Braun è stato supportato dalla Clinician Scientist School Lübeck (DFG #413535489) e dal Junior Funding Program dell'Università di Lubecca.
Materiali
| Name | Company | Catalog Number | Comments |
| Advanced DMEM/F-12 Medium | Gibco | 12634028 | |
| Agarose Low Melt | Roth | 6351.2 | 8% in Ringer solution |
| Antibody Diluent, Background Reducing | Dako | S3022 | |
| AquaTex | Merck | 108562 | |
| Bioethanol (99%, denatured) | CHEMSolute | 2,21,19,010 | |
| Citric Acid monohydrate | Sigma Aldrich | C7129 | |
| Cleaved Caspase-3 (Asp175) (5A1E) Rabbit mAb | Cell Signalling Technology | 9664 | 1:400 dilution |
| Derby Extra Double Edge Safety Razor Blades | Derby Tokai | ||
| Embedding cassettes | Roth | H579.1 | |
| Eosin Y-solution 0,5% aqueous | Merck | 10,98,44,100 | |
| Eukitt Quick hardening mounting medium | Sigma-Aldrich | 3989 | |
| Fetal bovine serum | Gibco | 10270106 | |
| Formaldehyde solution 4,5%, buffered | Büfa Chemikalien | B211101000 | |
| Hem alum solution acid acc. to Mayer | Roth | T865 | |
| Human EGF | Milteniy Biotec | 130-097-794 | |
| Hydrocortisone | Sigma Aldrich (Merck) | H0888 | |
| Hydrogen peroxide 30% | Merck | 1,08,59,71,000 | |
| Insulin human | Sigma Aldrich (Merck) | 12643 | |
| Liquid DAB+ Substrate Chromogen System | Dako | K3468 | |
| MACS Tissue Storage Solution | Milteniy Biotech | 130-100-008 | |
| Methanol | Merck | 10.600.092.500 | |
| Microscope Slides Superfrost Plus | Thermo Scientific | J1800AMNZ | |
| Millicell Cell Culture Insert, 30 mm, hydrophilic PTFE, 0.4 µm | Millipore (Merck) | PICM0RG50 | |
| Monoclonal mouse anti-human Cytokeratin 7 (Clone OV-TL 12/30) | Dako | M7018 | 1:200 dilution |
| Monoclonal mouse anti-human Ki67 Clone MIB-1 | Dako | M7240 | 1:200 dilution |
| Monoclonal mouse Anti-vimentin (Clone V9) | Dako | M0725 | 1:200 dilution |
| Negative control Mouse IgG2a | Dako | X0943 | 1:200 dilution |
| Negative control Mouse IgG1 | Dako | X093101-2 | 1:200 dilution |
| Paraffin (melting temperature 56°- 58°) | Merck | 10,73,37,100 | |
| Penicillin-Streptomycin (10.000 U/ml) | Gibco | 15140122 | |
| PBS pH 7,4 (1x) Flow Cytometry Grade | Gibco | A12860301 | |
| Resazurin sodium salt; 10 mg/ml in PBS | Sigma Aldrich | R7017 | 1:250 dilution |
| Ringer's solution | Fresenius Kabi | 2610813 | |
| RPMI-1640 Medium | Sigma Aldrich (Merck) | R8758 | |
| Tissue culture testplate 6 | TPP | 92006 | |
| Triton X-100 | Sigma Aldrich | 9002-93-1 | |
| VECTASTAIN Elite ABC-Peroxidase Kit | Vector Laboratories | PK-6200 | |
| Xylene (extra pure) | J.T.Baker | 8,11,85,000 | |
| Equipment | |||
| ClarioStar Microplate Reader | BMG Labtech | ||
| Paraffin Embedding Center E61110 | Leica | ||
| Rotary Microtome Microm HM355S | Thermo Scientific | ||
| Section Transfer System Microm STS | Thermo Scientific | ||
| VT 1200S Vibratom | Leica |
Riferimenti
- Nevala-Plagemann, C., Hidalgo, M., Garrido-Laguna, I. From state-of-the-art treatments to novel therapies for advanced-stage pancreatic cancer. Nature Reviews. Clinical Oncology. 17 (2), 108-123 (2020).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- Waghray, M., Yalamanchili, M., di Magliano, M. P., Simeone, D. M. Deciphering the role of stroma in pancreatic cancer. Current Opinion in Gastroenterology. 29 (5), 537-543 (2013).
- Hwang, R. F., et al. Cancer-associated stromal fibroblasts promote pancreatic tumor progression. Cancer Research. 68 (3), 918-926 (2008).
- Jiang, X., et al. Long-lived pancreatic ductal adenocarcinoma slice cultures enable precise study of the immune microenvironment. Oncoimmunology. 6 (7), 1333210 (2017).
- Hessmann, E., et al. Fibroblast drug scavenging increases intratumoural gemcitabine accumulation in murine pancreas cancer. Gut. 67 (3), 497-507 (2018).
- Feig, C., et al. The pancreas cancer microenvironment. Clinical Cancer Research. 18 (16), 4266-4276 (2012).
- Koerfer, J., et al. Organotypic slice cultures of human gastric and esophagogastric junction cancer. Cancer Medicine. 5 (7), 1444-1453 (2016).
- Gerlach, M. M., et al. Slice cultures from head and neck squamous cell carcinoma: a novel test system for drug susceptibility and mechanisms of resistance. British Journal of Cancer. 110 (2), 479-488 (2014).
- Holliday, D. L., et al. The practicalities of using tissue slices as preclinical organotypic breast cancer models. Journal of Clinical Pathology. 66 (3), 253-255 (2013).
- Vaira, V., et al. Preclinical model of organotypic culture for pharmacodynamic profiling of human tumors. Proceedings of the National Academy of Sciences of the United States of America. 107 (18), 8352-8356 (2010).
- Lim, C. Y., et al. Organotypic slice cultures of pancreatic ductal adenocarcinoma preserve the tumor microenvironment and provide a platform for drug response. Pancreatology. 18 (8), 913-927 (2018).
- Brandenburger, M., et al. Organotypic slice culture from human adult ventricular myocardium. Cardiovascular Research. 93 (1), 50-59 (2012).
- Misra, S., et al. Ex vivo organotypic culture system of precision-cut slices of human pancreatic ductal adenocarcinoma. Science Reports. 9 (1), 2133 (2019).
- O'Brien, J., Wilson, I., Orton, T., Pognan, F. Investigation of the Alamar Blue (resazurin) fluorescent dye for the assessment of mammalian cell cytotoxicity. European Journal of Biochemistry. 267 (17), 5421-5426 (2000).
- Beutler, B., Cerami, A. Tumor necrosis, cachexia, shock, and inflammation: a common mediator. Annual Review of Biochemisty. 57, 505-518 (1988).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon