Method Article
원발성 췌장암 및 전이에서 종양 미세환경의 전임상 모델로서의 유기형 절편 배양
요약
이 프로토콜은 유기형 절편 배양(OTSC)의 준비에 대해 설명합니다. 이 기술은 온전한 다세포 조직의 체외 배양을 용이하게 합니다. OTSC는 다세포 환경에서 약물에 대한 각각의 반응을 테스트하는 데 즉시 사용할 수 있습니다.
초록
원발성 췌장암 및 전이에 대한 현실적인 전임상 모델은 생체 외 에서 치료 반응을 테스트하고 개인화된 환자 치료를 촉진하기 위해 시급히 필요합니다. 그러나 현재 사용되는 모델(예: 환자 유래 세포주 및 이종이식)에서 종양 특이적 미세환경이 없기 때문에 제한된 예측 통찰력만 얻을 수 있습니다. 유기형 절편 배양(OTSC)은 온전한 다세포 조직으로 구성되며, 공간적으로 분해된 약물 반응 검사에 신속하게 사용할 수 있습니다.
이 프로토콜은 췌장암의 생존 가능한 종양 절편과 그 전이의 생성 및 배양에 대해 설명합니다. 간단히 말해서, 조직은 저용융 아가로스에서 주조되고 차가운 등장성 완충액에 저장됩니다. 다음으로, 300μm 두께의 조직 절편을 진동체로 생성합니다. 준비 후, 슬라이스는 세포 배양 인서트와 적절한 배양 배지를 사용하여 공기-액체 계면에서 배양합니다. 배양 중에 세포 분화 및 생존력의 변화를 모니터링할 수 있습니다. 또한 이 기술을 통해 생존 가능한 인간 종양 조직 체외(ex vivo )에 치료를 적용하고 전사체 및 단백질체 프로파일링과 같은 후속 다운스트림 분석을 수행할 수 있습니다.
OTSC는 개별 치료 반응을 체외(ex vivo )로 테스트하고 종양의 개별 절편의 각 반응과 관련된 개별 전사체 및 단백질체 프로필을 식별할 수 있는 고유한 기회를 제공합니다. OTSC는 원발성 췌장암 및 전이의 치료를 개인화하기 위한 치료 전략을 식별하기 위해 추가로 탐색될 수 있습니다.
서문
췌관 선암(PDAC) 및 각각의 전이에 대한 기존 전임상 모델은 환자의 치료에 대한 반응을 예측하지 못하며, 이는 약물 개발 및 예측 바이오마커 식별에 큰 단점이 된다1. 환자 유래 오가노이드 및 환자 유래 이종이식과 같은 모델이 유망하지만 그 사용은 여전히 제한적입니다2. 이러한 in vitro 모델의 주요 한계는 비인간 면역 저하 종에서 종양 미세환경과 이종 이식이 부족하다는 것입니다. 특히 PDAC와 그 전이에서 종양 미세환경은 종양 생물학에서 중요한 기능을 하기 때문에 지난 몇 년 동안 상당한 관심을 받았습니다. 그것은 (myo-) fibroblast, 췌장 성상 세포, 면역 세포, 혈관, 세포 외 기질, 사이토 카인 및 성장 인자와 같은 세포 및 무세포 구성 요소로 구성됩니다3. 이러한 미세환경은 비기능적인 종양 성분은 아니지만, 종양의 진행과 전이를 유도하고 방사선 및 화학요법 내성에 실질적으로 기여하는 것으로 보인다4. PDAC 미세환경은 약물 전달을 기계적으로 손상시킬 뿐만 아니라 면역 및 약물 제거 활성을 가지고 있습니다 5,6,7. 따라서 종양 세포와 종양 미세환경의 복잡한 상호작용을 반영하는 전임상 모델은 환자의 치료 반응을 체외에서 적절하게 테스트하고 개별화된 임상 치료를 안내하기 위해 시급히 필요합니다.
새로운 종양 샘플의 Ex vivo 배양은 in situ 종양의 근접한 근사치를 나타냅니다. 기관형 절편 배양(OTSC)은 최근 두암, 목암, 유방암, 전립선암, 폐암, 결장암, 췌장암과 같은 여러 종양에 대해 개발되고 연구되고 있습니다 8,9,10,11,12. OTSC는 정의된 조직 의존적 기간 동안 배양 중에 기준선 형태, 증식 활동 및 미세환경을 유지하는 것으로 나타났습니다 11,12,13. PDAC의 OTSC는 여러 시험관 내 연구에서 4-9일 동안 생존력, 형태 및 종양 미세환경의 대부분의 구성 요소를 유지했습니다 5,12,14. 관점에서, 이 기술을 사용하면 생존 가능한 인간 종양 조직 ex vivo에 치료법을 즉시 적용하고 전사체 및 단백질체의 프로파일링과 같은 후속 다운스트림 분석을 수행할 수 있습니다.
OTSC의 확립은 수술 후 즉시 생체 외 에서 치료 반응을 테스트할 수 있는 독특한 기회를 제공합니다. 따라서 OTSC는 전이성 질환의 치료를 개인화하기 위한 치료 전략을 전향적으로 식별할 수 있게 해줄 것입니다. 이 프로토콜은 췌장암의 생존 가능한 OTSC의 생성 및 배양을 설명합니다.
프로토콜
조직 표본은 뤼벡 대학(University of Lübeck)의 지역 윤리 위원회(# 16-281)의 승인을 받아 수집 및 처리되었습니다.
1. 신선한 조직 수집 및 취급
알림: 고정되지 않은 모든 인체 조직 표본은 혈액 매개 병원체의 감염 위험을 방지하기 위해 주의해서 취급해야 합니다. 모든 환자는 조직 처리 전에 HIV, HBV 및 HCV에 대해 음성 판정을 받아야 합니다. 보호 코트를 착용하고 장갑으로 인체 조직 표본을 다루십시오.
- 수술 직후 최소 0.4 x 0.4cm 크기의 신선하고 고정되지 않은 비고정 PDAC 조직 표본을 수집하고 조직 보관 용액에 넣어 실험실로 운반합니다.
- 가능하면 새 조직을 즉시 처리하십시오.
- 또는 4 °C의 젖은 얼음 위에 티슈 보관 용액에 조직을 밤새 보관하십시오. 그러나 조직 보관은 생존력을 손상시킬 수 있으므로 일반적으로 피해야 합니다.
2. 준비
- 저융점 아가로스 제제
- 예열된 링거 용액 100mL에 아가로스 8g을 용해시켜 저융점 아가로스 8mL(100%)를 준비하고 필요할 때까지 4°C에서 보관합니다.
- 종양 절제술이 발표되면 아가로스를 전자레인지에 녹입니다.
- 아가로스를 예열된 수조(37°C)에 넣고 준비 전에 생리적 온도로 냉각시킵니다.
- 비브라톰 설정
- 면도날을 진동 홀더에 넣고 해당되는 경우 제조업체의 지침에 따라 자동 각도 조정을 수행합니다.
- 냉각 장치 또는 젖은 얼음을 사용하여 절단 챔버의 재킷을 식히십시오.
- 절단 챔버를 약 100mL의 생리학적 절단 용액(예: Ringer's solution)으로 채웁니다.
- 장착된 면도날을 미리 냉각된 절단 용액에 넣고 면도날을 식히십시오.
3. 낮 녹는 아가로스에 있는 조직 끼워넣기
- 냉각된(4°C) PBS로 조직 표본을 세척하고 PBS의 조직을 얼음 위의 큰(~14cm) 페트리 접시에 놓습니다.
- 절단 효율성을 방해할 수 있으므로 메스를 사용하여 얼음에서 매크로로 볼 수 있는 과도한 결합 조직을 제거하십시오.
- 티슈를 작은 페트리 접시(~3cm)에 넣습니다.
- 거시적으로 볼 수 있는 남아 있는 결합 조직이 페트리 접시 바닥의 평면과 동일한 방향을 갖도록 조직 방향을 조정합니다. 페트리 접시의 바닥은 절단면과 동일한 방향을 갖습니다.
- 준비된 저융 아가로스를 작은 페트리 접시에 붓습니다.
- 필요한 경우 겸자를 사용하여 조직의 방향을 다시 조정하십시오.
- 아가로스를 더 빨리 굳히기 위해 페트리 접시를 젖은 얼음 위에 놓습니다.
- 메스를 사용하여 조직을 조심스럽게 자르고 조직의 양쪽에 아가로스를 최소 5mm 정도 둘러쌉니다.
- 내장된 조직을 조심스럽게 옮기고 슈퍼 접착제를 사용하여 샘플 홀더에 붙입니다.
- 몇 초 후 샘플 홀더를 절단 챔버에 넣습니다.
- 필요한 경우 면도날 쪽으로 티슈의 방향을 조정합니다.
4. 비브라톰을 사용하여 아가로스 포매 조직 절단
- 조직 표본의 크기에 따라 절단 범위(y축)의 외부 한계를 정의합니다.
- 칼날을 티슈 블록의 위쪽으로 조정합니다.
- 절단 속도를 0.04mm/s로, 절단 진폭을 1mm로, 슬라이스 두께를 300μm로 설정합니다.
- 첫 번째 조각을 조심스럽게 자르고 젖은 얼음에 미리 냉각된(4°C) 절단 용액이 있는 별도의 용기에 조각을 옮깁니다.
5. 유기형 절편 배양의 배양
- 웰당 적절한 배양 배지 6mL가 있는 1웰 플레이트를 준비합니다.
- 매체 A : 고급 DMEM / F12, 10 % FBS, 1 % 페니실린 / 스트렙토 마이신.
- 배지 B: RPMI 1640, 10% FBS, 1% 페니실린/스트렙토마이신, 4μg/mL 인슐린, 8ng/mL EGF, 0.3μg/mL 하이드로코르티손.
참고: 최적의 배양 조건을 위한 배지는 조직과 환자에 따라 다를 수 있습니다. 두 개의 서로 다른 조직 배양 배지를 비교했는데, 하나는 DMEM/F12(배지 A)를 기반으로 하고 다른 하나는 RPMI(배지 B)를 기반으로 했습니다. 이러한 매체 간에 실질적인 차이는 발견되지 않았습니다. 이 프로토콜에 표시된 모든 실험에 대해 매체 A가 사용되었습니다.
- 배지가 있는 6웰 플레이트를 인큐베이터에 넣고 배양 전에 온도와 pH가 조정되도록 합니다.
- 시선 필터를 사용하여 세포 배양 삽입물(예: 0.4μm 공극 크기의 친수성 PTFE 삽입물)에 절편을 놓습니다.
- 로드된 필터를 멸균 천에 올려 과도한 절단 용액을 제거합니다.
- 로드된 필터를 준비된 6웰 플레이트에 놓습니다. 인서트에 추가 매체를 추가하지 마십시오.
- 6웰 플레이트를 인큐베이터(37°C, 5% CO 2)에 놓습니다.
- 새 2웰 플레이트로 5.1, 5.2, 5.5단계를 반복하여 6일마다 매체를 교체합니다.
참고: 유기형 절편 배양은 개별 연구 질문에 따라 다양한 기간 동안 배양할 수 있습니다.
6. Resazurin 생존력 분석
참고: 레사주린 생존도 분석은 살아있는 세포에서 비형광 청색 레사주린을 적색 형광 레소루핀으로 환원하여 유기체형 절편 배양의 일반적인 대사 활성을 측정합니다15. 이 분석은 세포에 독성 영향을 미치지 않으며 개별 연구 질문에 따라 배양에 반복적으로 적용할 수 있습니다. 생존력은 2-3일마다 resazurin 분석을 사용하여 측정하였다.
- resazurin 원액의 제조
- resazurin 스톡 용액은 빛에 민감하므로 멸균 후드의 불을 끄십시오.
- 1x PBS에 10mg/mL의 레사주린 나트륨 염이 포함된 원액을 준비합니다.
- 원액을 빛으로부터 보호된 부분 표본에 담아 4 °C의 냉장고에서 사용할 때까지 보관하십시오.
- 전체 slice 생존력 평가
- resazurin 스톡 용액은 빛에 민감하므로 멸균 후드의 불을 끄십시오.
- 레자주린 원액을 적절한 매체로 1:250으로 희석합니다.
알림: 희석에 사용되는 배지는 배양에 사용되는 배지(배지 A 또는 배지 B)와 동일해야 합니다. - 슬라이스당 최종 레자주린 용액 1mL를 준비하고 블랭크 대조군을 위해 1mL를 추가로 추가합니다(예: 6슬라이스의 경우 7mL의 배지에 28μL의 레자주린 원액을 희석).
- 레자주린 용액을 웰당 1mL의 희석된 레사주린 용액과 함께 6웰 플레이트에 분주합니다.
- 슬라이스가 있는 배양 필터를 레사주린 용액과 함께 우물로 옮깁니다. resazurin 용액이 있는 하나의 우물은 빈 대조군으로 비어 있습니다.
참고: 실험 절차를 단순화하기 위해 이 단계를 매체 교체(단계 5.7)와 결합할 수 있습니다. 그러나 추가적인 생존도 측정이 필요한 경우 절편 배양 중 언제든지 분석을 수행할 수 있습니다. - 조직 조각을 인큐베이터에 37 ° C 및 5 % CO2 에서 1 시간 동안 놓습니다.
- slice 배양이 계속되는 경우 배양 배지로 새 6웰 플레이트를 준비합니다(5.1 및 5.2단계 참조).
- 레사주린 용액에서 조각이 있는 배양 필터를 제거하고 적재된 필터를 멸균 천에 올려 과도한 용액을 제거합니다.
- 슬라이스가 있는 배양 필터를 미리 준비된 배양 플레이트에 옮깁니다.
- 각 6웰에서 100μL의 레사주린 용액을 96웰 플레이트에 옮깁니다. 블랭크 대조군에서 3개의 샘플(3 x 100 μL)을 96웰 플레이트의 별도 웰에 넣습니다.
- 제조업체의 지침에 따라 판 광도계로 소멸을 정량화하십시오. 여기 파장은 545nm로 설정되고 방출 파장은 600nm로 설정됩니다.
7. OTSC의 포르말린 고정 및 파라핀 삽입
- 배양된 조직 조각을 플라스틱 내장 카세트에 조심스럽게 옮깁니다. 이렇게 하려면 아래 단계를 따르세요.
- 장착된 조각이 있는 배양 필터를 페트리 접시에 놓습니다.
- 메스를 사용하여 장착된 조직 조각이 있는 필터 멤브레인을 조심스럽게 잘라냅니다.
- 장착된 슬라이스가 있는 필터 멤브레인을 생검 나일론 백에 조심스럽게 옮기고 내장 카세트에 넣습니다.
- 그런 다음 사전 냉각된(4°C) 4.5% 포르말린이 있는 용기에 플라스틱 내장 카세트를 옮깁니다. 슬라이스는 4°C의 포르말린 용액에 보관하여 나중에 사용할 때까지 사용할 수 있지만 최소 24시간 동안 배양해야 합니다.
참고: OTSC는 쉽게 찢어지므로 각별히 주의하여 운반해야 합니다.
- 포르말린 고정 슬라이스 배양액을 흐르는 수돗물로 1.5시간 동안 조심스럽게 헹굽니다.
- 70% 에탄올(3시간 동안 2x), 95% 에탄올(하룻밤 동안 1x, 3시간 동안 1x)에서 배양하여 포르말린 고정 조직 조각을 탈수한 다음 절대 에탄올(3시간 동안 1x, 야간 1x)을 배양합니다.
- 포르말린 고정 조직 슬라이스를 크실렌에서 3시간 배양하여 두 번 청소합니다.
- 60 ° C에서 파라핀으로 조직을 담그십시오 (하룻밤 동안 1 회, 2 시간 동안 1 회). 조직 매끼 주형의 파라핀 블록에 조직을 삽입합니다.
- 파라핀이 포매된 조직 블록을 마이크로톰으로 4μm 두께로 절단하고 증류수가 포함된 40°C 수조에 띄웁니다. 단면을 유리 슬라이드로 옮깁니다.
- 60 °C에서 1 시간 동안 파라핀 절편을 배양하여 조직을 유리에 접착합니다. 슬라이드를 37°C에서 밤새 배양합니다.
8. Hematoxylin 및 Eosin (H &E) 염색
- 7.7 단계의 절편을 자일렌에서 배양하여 탈파라핀화합니다(5분 동안 3회).
- 절대 알코올(5분 동안 2회), 95% 알코올(5분 동안 2회) 및 70% 알코올(5분 동안 1회)로 배양하여 재수분을 보충합니다. 증류수로 간단히 헹굽니다.
- Mayer 헤마톡실린 용액을 5분 동안 염색합니다. 흐르는 수돗물로 10분 동안 헹굽니다.
- 0.5% 에오신 용액에 40초 동안 대조염색합니다. 증류수로 헹굽니다.
- 각각 70% 알코올(최대 1분), 95% 에탄올(3분 동안 2배) 및 절대 알코올(3분 동안 2배)에서 배양하여 탈수합니다.
- 크실렌을 세 번 교체하여 제거합니다(각각 몇 초). 장착 매체 한 방울을 놓고 커버슬립으로 슬라이드를 덮습니다.
9. OTSC의 면역조직화학(Immunohistochemistry of OTSCs)
- 자일렌 2회에 10분 동안 배양하여 절편을 탈파라핀화한 다음 10분 동안 1:1 에탄올/크실롤을 배양합니다.
- 슬라이드를 100% 에탄올(3분 동안 2회), 96% 에탄올(3분 동안 2회), 70% 에탄올(3분 동안 1회), 50% 에탄올(3분 동안 1회)로 옮깁니다.
- 항원 추출을 수행하여 항원 에피토프의 마스킹을 해제합니다. 슬라이드를 구연산염 완충액에 넣은 전자레인지에 900W에서 5분 동안 가열한 다음 600W에서 8분 동안 2배 가열합니다. 슬라이드를 실온으로 20분 동안 식힙니다.
- PBS 3x로 셰이커에 3분 동안 세척합니다.
- 실온의 가습 챔버에서 10분 동안 PBS(슬라이드당 200μL)의 0.1% Triton X-100을 배양하여 세포막의 투과화를 수행합니다.
- PBS에서 셰이커에서 각각 3분씩 3회 교체합니다.
- 실온의 가습 챔버에서 10분 동안 메탄올(슬라이드당 200μL)의 3% H2O2 용액으로 절편을 배양하여 내인성 과산화효소 활성을 차단합니다.
- PBS 3x로 셰이커에 3분 동안 세척합니다.
- 200 μL의 차단 완충액(PBS의 1:50 말 혈청)을 추가하고 실온의 가습 챔버에서 25분 동안 배양합니다.
- 종이 티슈에서 슬라이드를 기울여 슬라이드에서 차단 버퍼를 제거합니다.
- 적절하게 희석된 1차 항체 200μL를 슬라이드의 항체 희석액에 적용하고 4°C의 가습 챔버에서 밤새 배양합니다. 음성 대조군으로, 1차 항체와 동일한 희석액으로 마우스 면역글로불린의 적절한 동형을 사용하십시오.
- 셰이커의 PBS에서 3분 동안 3번 씻습니다.
- 슬라이드에 200μL의 비오틴화 2차 항체(PBS의 1:50 용액)를 적용하고 실온의 가습 챔버에서 30분 동안 배양합니다.
- 셰이커의 PBS에서 3분 동안 3번 씻습니다.
- 적용하기 전에 제조업체의 지침에 따라 avidin/biotin-based peroxidase 복합체를 준비합니다. 슬라이드에 200μL의 아비딘-비오틴-과산화효소 복합체를 적용하고 실온의 가습 챔버에서 30분 동안 배양합니다.
- 셰이커의 PBS에서 3분 동안 3번 씻습니다.
- 200 μL의 DAB 기판 용액(사용 직전에 갓 만든: 1mL의 기판에 DAB 1방울), 슬라이드당 200 μL를 적용합니다. 원하는 색상 강도에 도달할 때까지 1-3분 동안 색상 전개를 허용합니다.
- 흐르는 수돗물로 10분 동안 헹굽니다.
- 측면을 Hematoxylin에 5분 동안 담가 슬라이드를 대조염색합니다.
- 흐르는 수돗물로 10분 동안 헹굽니다.
- 수성 장착 매체와 커버슬립을 사용하여 슬라이드를 덮습니다. 장착된 슬라이드는 실온에서 영구적으로 보관할 수 있습니다.
결과
그림 1은 신선하고 동결되지 않은 종양 조직에서 OTSC를 배양하는 워크플로우에 대한 개요를 제공합니다. 원발성 PDAC 및 전이의 검체는 외과적 절제 후 직접 채취하여 조직 저장 용액에서 4°C의 젖은 얼음 위에서 밤새 보관했습니다. 검체를 처리하고, 프로토콜에 설명된 대로 절편을 배양했습니다. 각 OTSC의 거시적 형태는 재배 중에 크게 변하지 않았습니다. 그러나, OTSC의 표면적의 크기는 6일 동안 배양하는 동안 그림 2A 에 예시적으로 나타난 바와 같이 시간이 지남에 따라 감소하였다. OTSC의 전반적인 생존력은 0일, 2/3일, 6일에 레사주린 생존도 분석으로 평가되었습니다(그림 2B). 레사주린 생존도 분석은 살아있는 세포에서 비형광 청색 레사주린이 적색 형광 레소루핀으로 감소하는 것을 기반으로 OTSC의 일반적인 대사 활성을 측정합니다15. 그림 2B 는 두 개의 다른 배지에서 두 개의 대표적인 원발성 종양에서 OTSC를 배양한 후 레자주린 감소로 측정한 생존력의 비교를 보여줍니다. OTSC는 배지 A(고급 DMEM/F12, 10% FBS, 1% 페니실린/스트렙토마이신) 또는 배지 B(RPMI 1640, 10% FBS, 1% 페니실린/스트렙토마이신, 4 μg/mL 인슐린, 8 ng/mL EGF, 0.3 μg/mL 하이드로코르티손)에서 배양되었으며, 이는 배양 배지와 독립적으로 유사한 전체 생존율을 보였습니다. 주목할 점은, 0일 이후의 생존력 감소는 자주 관찰될 수 있으며, 이는 슬라이싱 절차와 배양 조건에 대한 조정으로 인해 예상된다는 것입니다. 그러나 오른쪽 패널에서 예시적으로 볼 수 있듯이 생존력이 증가하는 것도 관찰되었습니다(그림 2B).
배지 A에서 정의된 배양 기간 후, OTSC는 추가 면역조직학적 특성 분석(IHC)을 위해 포르말린에 고정되었습니다. 포르말린 고정 후, OTSC는 파라핀을 포매하고 절편했습니다. H&E 염색 절편은 조직의 전체 구조가 생체 외 배양의 전체 시간 동안 보존되었음을 보여주었습니다(그림 3). 종양 세포와 기질 세포는 각각 사이토케라틴 7과 비멘틴에 대해 IHC에 의해 구별되었습니다. 배양 중 종양 대 기질 비율에서 실질적인 변화는 감지되지 않았습니다.
H&E 절편의 현미경적 조직병리학적 평가에서는 배양 중 모든 배양 조직의 괴사가 크게 증가하지 않았습니다(그림 3, 그림 4, 그림 5). 또한, Ki-67 및 절단된 카스파제 3를 각각 증식 및 세포사멸 평가를 위해 염색했습니다. 다시 말하지만, 6일의 배양 기간 동안 증식과 세포사멸의 총체적인 변화는 감지되지 않았습니다(그림 3). 그러나 apoptotic cell의 비율은 cleaved caspase 3 염색으로 측정된 바와 같이 연장된 배양 기간 동안 시간이 지남에 따라 증가합니다. 그림 4 는 1차 PDAC를 15일 동안 배양한 후 절단된 카스파제 3 양성 세포의 증가를 보여줍니다. 그림 5 는 PDAC의 복막 전이의 조직 병리를 보여줍니다. 이 실험은 종양/기질 함량과 관련하여 개별 절편 간의 높은 종양 내 이질성뿐만 아니라 절단된 카스파제 3 염색에 의해 측정된 자연적으로 발생하는 세포 사멸을 보여줍니다. 따라서 배양된 OTSC의 조직병리학적 평가는 각 배양된 종양 또는 그 전이의 종양/기질 구조 및 생존력을 평가하는 데 중요합니다.
그림 6은 복벽의 PDAC 전이의 조직 병리학을 보여줍니다. H&E 염색 및 사이토케라틴 7에 대한 IHC는 파생된 OTSC가 종양 세포를 포함하지 않고 부분적으로 괴사하는 결합 조직으로만 구성되어 있음을 보여주었습니다. OTSC 기술의 단점은 신선하고 고정되지 않은 동결되지 않은 조직은 배양 전에 종양 세포 함량을 평가할 수 없다는 것입니다.
전반적으로, 이러한 데이터는 종양의 다세포 구조와 별개의 세포 유형을 포함하는 각각의 전이가 OTSC에 반영된다는 것을 보여줍니다. 특히 종양-기질 상호작용이 보존됩니다.
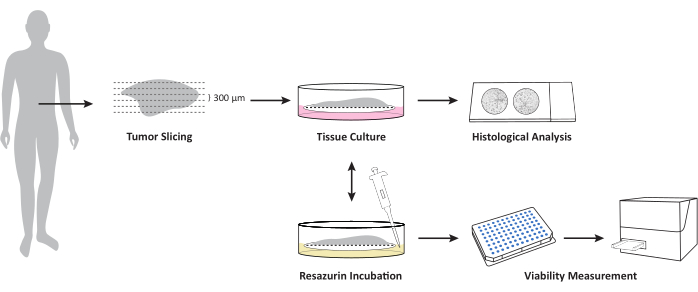
그림 1: 신선하고 동결되지 않은 조직 종양/전이 표본에서 OTSC를 배양하기 위한 워크플로우에 대한 개요. 신선하고 동결되지 않은 조직 표본은 진동체를 사용하여 절단하고 PTFE 세포 배양 삽입물의 공기-액체 계면에서 배양합니다. 전체 생존율은 resazurin 생존력 분석을 통해 정의된 시점에서 측정할 수 있습니다. 이 분석은 생존도 측정 후 추가 배양을 가능하게 합니다. 슬라이스는 추가 조직 병리학적 검사를 위해 정의된 시점에서 포르말린으로 고정됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
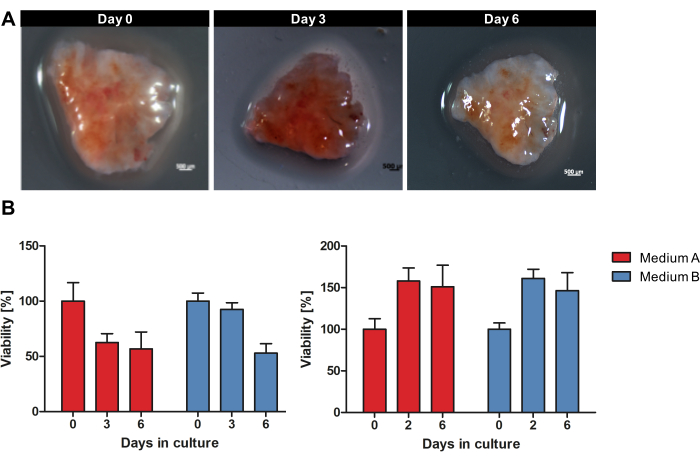
그림 2: 배양 중 OTSC의 거시적 형태 및 생존력. PDAC 검체를 6일 동안 OTSC로 배양했습니다. (A) 각 OTSC의 거시적 형태는 재배 중에 크게 변하지 않았습니다. 그러나 OTSC의 표면적 크기는 시간이 지남에 따라 감소했습니다. (B) 전체 생존력은 배지 A 및 B에서 resazurin 생존력 분석에 의해 정량화되었습니다. 생존율의 감소는 절편 절차와 배양 조건에 대한 조정으로 인해 0일 이후에 자주 관찰될 수 있습니다. 그러나 우리는 또한 오른쪽 패널에서 예시적으로 보여지는 것처럼 생존 가능성의 증가를 관찰했습니다. 각 패널은 파생된 절편 배양물의 수율이 서로 다른 개별 종양 표본을 나타냅니다(왼쪽 패널 n = 10, 오른쪽 패널 n = 10). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 총 배양 시간 6일 후 OTSC의 조직병리학적 평가. OTSC(n=6)는 배지 A에서 배양하고, 조직 형태는 H&E 염색으로 평가하였다. 종양 세포와 기질 세포는 각각 사이토케라틴 7과 비멘틴에 대해 IHC에 의해 구별되었습니다. Ki-67 및 절단된 카스파제 3은 각각 증식 및 세포사멸 평가를 위해 염색되었습니다. 총 6일의 재배 기간 동안 세포사멸의 실질적인 증가는 관찰되지 않았습니다. 각 눈금 막대는 100μm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 총 배양 시간 15일 후 OTSC의 조직병리학적 평가. OTSC(n=8)는 배지 A에서 배양하고, 조직 형태는 H&E 염색으로 평가하였다. 종양 세포와 기질 세포는 각각 사이토케라틴 7과 비멘틴에 대해 IHC에 의해 구별되었습니다. Ki-67 및 절단된 카스파제 3은 각각 증식 및 세포사멸 평가를 위해 염색되었습니다. 세포사멸은 절단된 카스파제-3 염색으로 예시된 바와 같이 배양 15일 후에 실질적으로 증가하였다. 각 눈금 막대는 100μm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: PDAC의 복막 전이에 대한 OTSC의 조직병리학적 평가. OTSC(n=8)는 배지 A에서 배양하고, 조직 형태는 H&E 염색으로 평가하였다. 종양 세포와 기질 세포는 각각 사이토케라틴 7과 비멘틴에 대해 IHC에 의해 구별되었습니다. Ki-67 및 절단된 카스파제 3은 각각 증식 및 세포사멸 평가를 위해 염색되었습니다. 조직병리학적 평가는 종양/기질 함량과 관련하여 개별 절편 간에 높은 수준의 종양 내 이질성을 보여주었으며 절단된 카스파제 3 염색으로 측정된 자연적으로 발생하는 세포사멸을 보여주었습니다. 각 눈금 막대는 100μm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 복벽의 PDAC 전이에 대한 OTSC의 조직병리학적 평가. OTSC(n=5)는 배지 A에서 배양하고, 조직 형태는 H&E 염색으로 평가하였다. 종양 세포와 기질 세포는 각각 사이토케라틴 7과 비멘틴에 대해 IHC에 의해 구별되었습니다. Ki-67 및 절단된 카스파제 3은 각각 증식 및 세포사멸 평가를 위해 염색되었습니다. 조직병리학적 평가 결과 배양된 전이에서 종양 세포가 부족하고 부분 괴사가 나타났으며, 이는 배양 전에 확인할 수 없었습니다. 각 눈금 막대는 100μm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
새로운 종양 샘플의 OTSC는 상피내 종양에 대한 근접한 근사치입니다. 그들은 정의된 조직 의존적 기간 동안 배양 동안 기준 형태, 증식 활동 및 미세환경을 유지합니다 11,12,13. 이 기술을 사용하면 생존 가능한 인간 종양 조직에 대한 치료를 ex vivo 및 전사체 프로파일링과 같은 후속 다운스트림 분석에 즉시 적용할 수 있습니다. OTSC의 특별한 장점은 MALDI 이미징과 같은 공간적으로 분해된 다운스트림 분석을 온전한 다세포 종양 조직에 적용할 수 있다는 것입니다.
여기에서는 PDAC 및 그 전이의 OTSC의 생성, 배양 및 조직 병리학적 평가를 위한 방법을 설명합니다. 이 기술의 핵심 쟁점은 냉동 절차 없이 신선한 조직을 절단하고 공기-액체 계면에서 배양하는 것입니다. 이 방법의 한계는 신선하고 고정되지 않은 및 동결되지 않은 조직을 배양 전에 종양 세포 함량에 대해 평가할 수 없다는 것입니다. 본 연구의 결과에서 예시된 바와 같이, OTSC는 동일한 종양에서 발견된 다른 검체의 빠른 절편에서 예상한 것과 다른 조직 성분으로 구성되어 있음이 드러날 수 있습니다. 배양 후 OTSC의 조직병리학적 평가는 개별 절편 배양에 대한 데이터 평가에 필수적입니다. 설명된 생존도 분석은 각 OTSC의 전반적인 생존력에 대한 일반적인 평가만 허용합니다. 일반적으로, 설명된 방법은 진동체 및 조직 배양 유닛을 갖춘 모든 실험실에서 구현될 수 있다. 이 기술의 단순성으로 인해 다양한 종양 및 연구 질문에 대해 쉽게 수정할 수 있습니다.
인간 종양 조직을 체외(ex-vivo)에서 배양하기 위해 일차 세포주, 환자 유래 오가노이드 및 이종이식편과 같은 여러 방법론이 개발되었습니다. 그러나 약물 개발 및 예측 바이오마커 식별을 위한 사용은 주로 조직 맥락, 즉 기질과 종양 세포의 상호 작용의 손실로 인해 제한되어 있습니다2.
제시된 유기형 절편 배양 확립 방법이 다세포 조직 구조를 보존하지만, 몇 가지 제한 사항을 고려해야 합니다. 첫째, 상당한 정도의 (종양 내) 이질성을 고려해야 합니다. 단일 종양 생검에서 파생된 뚜렷한 OTSC는 종양 및 기질 세포의 비율에서 상당한 차이를 보일 수 있습니다. 전반적인 조직 품질 외에도, 이는 배양 중 절편 생존율이 다른 한 가지 이유일 수 있습니다. 둘째, 최적의 배양 조건을 위한 배지는 조직과 환자에 따라 달라질 수 있습니다. 두 가지 뚜렷한 조직 배양 배지를 비교했는데, 첫 번째는 DMEM/F12(배지 A)를 기반으로 하고 두 번째는 RPMI(배지 B)를 기반으로 합니다. 원발성 종양 또는 전이의 각 표본은 수정이 필요할 수 있습니다. 셋째, 종양 괴사는 이미 in situ16 에서 발생할 수 있으며 반드시 OTSC의 불충분한 배양 조건으로 인한 것은 아닙니다. 원발성 종양의 조직 병리학과의 비교를 고려해야 합니다.
이 프로토콜에 설명된 OTSC의 확립은 종양 미세환경을 보존하는 생체 외 모델 시스템에서 수술 후 즉시 치료 반응을 테스트할 수 있는 기회를 제공합니다. 장래적으로, OTSC는 전이성 질환의 치료를 개인화하기 위한 개별 치료 전략의 개발을 촉진할 것입니다.
공개
저자들은 잠재적인 이해 상충을 공개하지 않았습니다.
감사의 말
R. Braun은 Lübeck Clinician Scientist School (DFG #413535489)과 University of Lübeck의 Junior Funding Program의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Advanced DMEM/F-12 Medium | Gibco | 12634028 | |
| Agarose Low Melt | Roth | 6351.2 | 8% in Ringer solution |
| Antibody Diluent, Background Reducing | Dako | S3022 | |
| AquaTex | Merck | 108562 | |
| Bioethanol (99%, denatured) | CHEMSolute | 2,21,19,010 | |
| Citric Acid monohydrate | Sigma Aldrich | C7129 | |
| Cleaved Caspase-3 (Asp175) (5A1E) Rabbit mAb | Cell Signalling Technology | 9664 | 1:400 dilution |
| Derby Extra Double Edge Safety Razor Blades | Derby Tokai | ||
| Embedding cassettes | Roth | H579.1 | |
| Eosin Y-solution 0,5% aqueous | Merck | 10,98,44,100 | |
| Eukitt Quick hardening mounting medium | Sigma-Aldrich | 3989 | |
| Fetal bovine serum | Gibco | 10270106 | |
| Formaldehyde solution 4,5%, buffered | Büfa Chemikalien | B211101000 | |
| Hem alum solution acid acc. to Mayer | Roth | T865 | |
| Human EGF | Milteniy Biotec | 130-097-794 | |
| Hydrocortisone | Sigma Aldrich (Merck) | H0888 | |
| Hydrogen peroxide 30% | Merck | 1,08,59,71,000 | |
| Insulin human | Sigma Aldrich (Merck) | 12643 | |
| Liquid DAB+ Substrate Chromogen System | Dako | K3468 | |
| MACS Tissue Storage Solution | Milteniy Biotech | 130-100-008 | |
| Methanol | Merck | 10.600.092.500 | |
| Microscope Slides Superfrost Plus | Thermo Scientific | J1800AMNZ | |
| Millicell Cell Culture Insert, 30 mm, hydrophilic PTFE, 0.4 µm | Millipore (Merck) | PICM0RG50 | |
| Monoclonal mouse anti-human Cytokeratin 7 (Clone OV-TL 12/30) | Dako | M7018 | 1:200 dilution |
| Monoclonal mouse anti-human Ki67 Clone MIB-1 | Dako | M7240 | 1:200 dilution |
| Monoclonal mouse Anti-vimentin (Clone V9) | Dako | M0725 | 1:200 dilution |
| Negative control Mouse IgG2a | Dako | X0943 | 1:200 dilution |
| Negative control Mouse IgG1 | Dako | X093101-2 | 1:200 dilution |
| Paraffin (melting temperature 56°- 58°) | Merck | 10,73,37,100 | |
| Penicillin-Streptomycin (10.000 U/ml) | Gibco | 15140122 | |
| PBS pH 7,4 (1x) Flow Cytometry Grade | Gibco | A12860301 | |
| Resazurin sodium salt; 10 mg/ml in PBS | Sigma Aldrich | R7017 | 1:250 dilution |
| Ringer's solution | Fresenius Kabi | 2610813 | |
| RPMI-1640 Medium | Sigma Aldrich (Merck) | R8758 | |
| Tissue culture testplate 6 | TPP | 92006 | |
| Triton X-100 | Sigma Aldrich | 9002-93-1 | |
| VECTASTAIN Elite ABC-Peroxidase Kit | Vector Laboratories | PK-6200 | |
| Xylene (extra pure) | J.T.Baker | 8,11,85,000 | |
| Equipment | |||
| ClarioStar Microplate Reader | BMG Labtech | ||
| Paraffin Embedding Center E61110 | Leica | ||
| Rotary Microtome Microm HM355S | Thermo Scientific | ||
| Section Transfer System Microm STS | Thermo Scientific | ||
| VT 1200S Vibratom | Leica |
참고문헌
- Nevala-Plagemann, C., Hidalgo, M., Garrido-Laguna, I. From state-of-the-art treatments to novel therapies for advanced-stage pancreatic cancer. Nature Reviews. Clinical Oncology. 17 (2), 108-123 (2020).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- Waghray, M., Yalamanchili, M., di Magliano, M. P., Simeone, D. M. Deciphering the role of stroma in pancreatic cancer. Current Opinion in Gastroenterology. 29 (5), 537-543 (2013).
- Hwang, R. F., et al. Cancer-associated stromal fibroblasts promote pancreatic tumor progression. Cancer Research. 68 (3), 918-926 (2008).
- Jiang, X., et al. Long-lived pancreatic ductal adenocarcinoma slice cultures enable precise study of the immune microenvironment. Oncoimmunology. 6 (7), 1333210 (2017).
- Hessmann, E., et al. Fibroblast drug scavenging increases intratumoural gemcitabine accumulation in murine pancreas cancer. Gut. 67 (3), 497-507 (2018).
- Feig, C., et al. The pancreas cancer microenvironment. Clinical Cancer Research. 18 (16), 4266-4276 (2012).
- Koerfer, J., et al. Organotypic slice cultures of human gastric and esophagogastric junction cancer. Cancer Medicine. 5 (7), 1444-1453 (2016).
- Gerlach, M. M., et al. Slice cultures from head and neck squamous cell carcinoma: a novel test system for drug susceptibility and mechanisms of resistance. British Journal of Cancer. 110 (2), 479-488 (2014).
- Holliday, D. L., et al. The practicalities of using tissue slices as preclinical organotypic breast cancer models. Journal of Clinical Pathology. 66 (3), 253-255 (2013).
- Vaira, V., et al. Preclinical model of organotypic culture for pharmacodynamic profiling of human tumors. Proceedings of the National Academy of Sciences of the United States of America. 107 (18), 8352-8356 (2010).
- Lim, C. Y., et al. Organotypic slice cultures of pancreatic ductal adenocarcinoma preserve the tumor microenvironment and provide a platform for drug response. Pancreatology. 18 (8), 913-927 (2018).
- Brandenburger, M., et al. Organotypic slice culture from human adult ventricular myocardium. Cardiovascular Research. 93 (1), 50-59 (2012).
- Misra, S., et al. Ex vivo organotypic culture system of precision-cut slices of human pancreatic ductal adenocarcinoma. Science Reports. 9 (1), 2133 (2019).
- O'Brien, J., Wilson, I., Orton, T., Pognan, F. Investigation of the Alamar Blue (resazurin) fluorescent dye for the assessment of mammalian cell cytotoxicity. European Journal of Biochemistry. 267 (17), 5421-5426 (2000).
- Beutler, B., Cerami, A. Tumor necrosis, cachexia, shock, and inflammation: a common mediator. Annual Review of Biochemisty. 57, 505-518 (1988).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유