Method Article
مزارع الشرائح العضوية كنماذج قبل السريرية للبيئة المكروية للورم في سرطان البنكرياس الأولي وورم خبيث
In This Article
Summary
يصف هذا البروتوكول إعداد ثقافات شرائح النمط العضوي (OTSCs). تسهل هذه التقنية الزراعة خارج الجسم الحي للأنسجة متعددة الخلايا السليمة. يمكن استخدام OTSCs على الفور لاختبار استجابة كل منها للأدوية في بيئة متعددة الخلايا.
Abstract
هناك حاجة ماسة إلى نماذج واقعية قبل السريرية لسرطان البنكرياس الأولي وورم خبيث لاختبار استجابة العلاج خارج الجسم الحي وتسهيل العلاج الشخصي للمريض. ومع ذلك ، فإن عدم وجود بيئة دقيقة خاصة بالورم في النماذج المستخدمة حاليا ، على سبيل المثال ، خطوط الخلايا المشتقة من المريض والطعوم الخارجية ، يسمح فقط برؤى تنبؤية محدودة. تشتمل مزارع الشرائح العضوية (OTSCs) على أنسجة سليمة متعددة الخلايا ، والتي يمكن استخدامها بسرعة لاختبار الاستجابة للأدوية التي يتم حلها مكانيا.
يصف هذا البروتوكول توليد وزراعة شرائح الورم القابلة للحياة من سرطان البنكرياس ونقائله. باختصار ، يتم صب الأنسجة في أغاروز منخفض الذوبان وتخزينها في محلول متساوي التوتر بارد. بعد ذلك ، يتم إنشاء شرائح الأنسجة بسمك 300 ميكرومتر باستخدام اهتزاز. بعد التحضير ، يتم استزراع الشرائح في واجهة الهواء السائل باستخدام إدخالات زراعة الخلايا ووسط زراعة مناسب. أثناء الزراعة ، يمكن مراقبة التغيرات في تمايز الخلايا وصلاحيتها. بالإضافة إلى ذلك ، تتيح هذه التقنية تطبيق العلاج على أنسجة الورم البشري القابلة للحياة خارج الجسم الحي والتحليلات اللاحقة ، مثل التنميط بالنسخ والبروتين.
توفر OTSCs فرصة فريدة لاختبار استجابة العلاج الفردية خارج الجسم الحي وتحديد الملامح النسخية والبروتينية الفردية المرتبطة بالاستجابة المعنية لشرائح مميزة من الورم. يمكن استكشاف OTSCs بشكل أكبر لتحديد الاستراتيجيات العلاجية لتخصيص علاج سرطان البنكرياس الأولي وورم خبيث.
Introduction
النماذج قبل السريرية الحالية للسرطان الغدي القنوي البنكرياسي (PDAC) والنقائل ذات الصلة هي تنبؤات ضعيفة للاستجابة للعلاج في المرضى وهو عيب كبير في تطوير الأدوية وتحديد المؤشرات الحيوية التنبؤية1. على الرغم من أن نماذج مثل الكائنات العضوية المشتقة من المريض والطعوم الخارجية المشتقة من المريض واعدة ، إلا أن استخدامها لا يزال محدودا2. القيود الرئيسية لهذه النماذج في المختبر هي عدم وجود البيئة المكروية للورم والتطعيم الأجنبي في الأنواع غير البشرية التي تعاني من نقص المناعة. خاصة في PDAC ونقائله ، اكتسبت البيئة المكروية للورم اهتماما كبيرا على مدى السنوات الماضية بسبب وظائفها الحاسمة في بيولوجيا الورم. وهو يتألف من مكونات خلوية وغير خلوية ، مثل الخلايا الليفية (myo-) ، والخلايا النجمية البنكرياسية ، والخلايا المناعية ، والأوعية الدموية ، والمصفوفة خارج الخلية ، والسيتوكينات ، وعوامل النمو3. هذه البيئة المكروية ليست مكونا غير وظيفي للورم ، ولكنها تحفز تطور الورم وورم خبيث ويبدو أنها تساهم بشكل كبير في مقاومة الإشعاع والعلاج الكيميائي4. لا تؤثر البيئة المكروية PDAC على توصيل الدواء ميكانيكيا فحسب ، بل تمتلك أيضا نشاطا مناعيا وكسحا للأدوية5،6،7. وبالتالي ، هناك حاجة ماسة إلى النماذج قبل السريرية التي تعكس التفاعل المعقد للخلايا السرطانية والبيئة المكروية للورم لاختبار استجابة المرضى للعلاج خارج الجسم الحي بشكل كاف وتوجيه العلاج السريري الفردي.
تمثل الثقافات خارج الجسم الحي لعينات الورم الجديدة تقاربا وثيقا للورم في الموقع. تم مؤخرا تطوير ودراسة مزارع الشرائح العضوية (OTSCs) للعديد من الأورام ، مثل سرطان الرأس والرقبة والثدي والبروستاتا والرئة والقولون والبنكرياس8،9،10،11،12. لقد ثبت أن OTSCs تحافظ على مورفولوجيتها الأساسية ونشاطها التكاثري وبيئتها المكروية أثناء الزراعة لفترة محددة تعتمد على الأنسجة11،12،13. حافظت OTSCs من PDACs على صلاحيتها ، ومورفولوجيتها ، ومعظم مكونات البيئة المكروية للورم لمدة 4-9 أيام في العديد من الدراسات المختبرية 5،12،14. من منظور ، تتيح هذه التقنية التطبيق الفوري للعلاج على أنسجة الورم البشري القابلة للحياة خارج الجسم الحي والتحليلات اللاحقة ، مثل تنميط النسخ والبروتين.
يوفر إنشاء OTSCs فرصة فريدة لاختبار استجابة العلاج خارج الجسم الحي مباشرة بعد الجراحة. وبالتالي ، ستسمح OTSCs بشكل مستقبلي بتحديد الاستراتيجيات العلاجية لتخصيص علاج المرض النقيلي. يصف هذا البروتوكول توليد وزراعة OTSCs قابلة للحياة من سرطان البنكرياس.
Protocol
تم جمع عينات الأنسجة ومعالجتها بعد موافقة لجنة الأخلاقيات المحلية بجامعة لوبيك (# 16-281).
1. جمع الأنسجة الطازجة والتعامل معها
ملاحظة: يجب التعامل مع كل عينة أنسجة بشرية غير ثابتة بحذر لمنع خطر العدوى من مسببات الأمراض المنقولة بالدم. يجب اختبار جميع المرضى ليكونوا سلبيين لفيروس نقص المناعة البشرية وفيروس التهاب الكبد B و HCV قبل معالجة الأنسجة. ارتداء معطف واقية والتعامل مع عينات الأنسجة البشرية بالقفازات.
- اجمع عينة أنسجة PDAC الطازجة وغير الثابتة وغير المجمدة بحجم لا يقل عن 0.4 × 0.4 سم مباشرة بعد الجراحة وانقل العينة إلى المختبر في محلول تخزين الأنسجة.
- عندما يكون ذلك ممكنا ، قم بمعالجة الأنسجة الطازجة على الفور.
- بدلا من ذلك ، قم بتخزين المناديل في محلول تخزين الأنسجة على الثلج الرطب عند 4 درجات مئوية طوال الليل. ومع ذلك ، قد يؤدي تخزين الأنسجة إلى ضعف البقاء ويجب تجنبه بشكل عام.
2. التحضير
- إعداد الأغاروز منخفض الذوبان
- تحضير 100 مل من الأغاروز منخفض الذوبان (8٪) عن طريق إذابة 8 جم من الأغاروز في 100 مل من محلول رينغر المسخن مسبقا وتخزينه في 4 درجات مئوية لحين الحاجة.
- عند الإعلان عن استئصال الورم ، تذوب الأغاروز في الميكروويف.
- ضع الأغاروز في حمام مائي مسخن مسبقا (37 درجة مئوية) مما يسمح له بالتبريد إلى درجات حرارة فسيولوجية قبل التحضير.
- إعداد الاهتزاز
- ضع شفرة حلاقة في حامل الاهتزاز وقم بإجراء ضبط تلقائي للزاوية وفقا لتعليمات الشركة المصنعة ، إن أمكن.
- قم بتبريد غلاف غرفة القطع باستخدام وحدة تبريد أو ثلج مبلل.
- املأ حجرة القطع بحوالي 100 مل من محلول القطع الفسيولوجي (على سبيل المثال ، محلول رينغر).
- ضع شفرة الحلاقة المثبتة في محلول القطع المبرد مسبقا ، مما يسمح لشفرة الحلاقة بالتبريد.
3. تضمين الأنسجة في الأغاروز منخفض الذوبان
- اغسل عينة الأنسجة باستخدام برنامج تلفزيوني مبرد (4 درجات مئوية) وضع المنديل في برنامج تلفزيوني على طبق بتري كبير (~ 14 سم) على الثلج.
- قم بإزالة النسيج الضام الزائد المرئي مجهريا على الثلج باستخدام مشرط لأنه قد يعيق كفاءة القطع.
- ضع المنديل في طبق بتري صغير (~ 3 سم).
- اضبط اتجاه الأنسجة بحيث يكون للنسيج الضام المرئي مجهريا نفس اتجاه مستوى الجزء السفلي من طبق بتري. الجزء السفلي من طبق بتري له نفس اتجاه طائرة القطع.
- صب الأغاروز منخفض الذوبان المحضر في طبق بتري الصغير.
- أعد ضبط اتجاه الأنسجة ، إذا لزم الأمر ، باستخدام الملقط.
- ضع طبق بتري على الثلج الرطب لتصلب الأغاروز بشكل أسرع.
- قطع الأنسجة بعناية باستخدام مشرط ، وترك ما لا يقل عن 5 مم من الأغاروز المحيطة على كل جانب من الأنسجة.
- انقل الأنسجة المضمنة بعناية وألصقها على حامل العينة باستخدام الغراء الفائق.
- بعد بضع ثوان ، ضع حامل العينة في غرفة القطع.
- اضبط اتجاه الأنسجة نحو شفرة الحلاقة، إذا لزم الأمر.
4. تشريح الأنسجة المضمنة في الأغاروز باستخدام اهتزاز
- تحديد الحدود الخارجية لنطاق القطع (المحور ص) وفقا لحجم عينة الأنسجة.
- اضبط الشفرة باتجاه الجزء العلوي من كتلة الأنسجة.
- اضبط سرعة القطع على 0.04 مم / ثانية ، وسعة القطع إلى 1 مم وسمك الشريحة إلى 300 ميكرومتر.
- قطع الشرائح الأولى بعناية ونقل الشرائح إلى وعاء منفصل مع محلول قطع مبرد مسبقا (4 درجات مئوية) على الثلج الرطب.
5. ثقافة ثقافات الشرائح العضوية
- تحضير صفيحة 6 آبار مع 1 مل من وسط الزراعة المناسب لكل بئر.
- متوسط أ: DMEM / F12 المتقدم ، 10٪ FBS ، 1٪ بنسلين / ستربتومايسين.
- متوسط B: RPMI 1640 ، 10٪ FBS ، 1٪ بنسلين / ستربتومايسين ، 4 ميكروغرام / مل أنسولين ، 8 نانوغرام / مل EGF ، 0.3 ميكروغرام / مل هيدروكورتيزون.
ملاحظة: قد يختلف الوسط لظروف المزرعة المثلى اعتمادا على الأنسجة والمريض. وتمت مقارنة وسطين متميزين لزراعة الأنسجة، أحدهما يعتمد على DMEM/F12 (الوسط A)، والثاني يعتمد على RPMI (الوسط B). لم يتم الكشف عن اختلافات جوهرية بين هذه الوسائط. بالنسبة لجميع التجارب الموضحة في هذا البروتوكول ، تم استخدام الوسيط A.
- ضع اللوحة المكونة من 6 آبار مع الوسط في حاضنة ، مما يسمح بضبط درجة الحرارة ودرجة الحموضة قبل الزراعة.
- ضع الشرائح على حشوات زراعة الخلايا (على سبيل المثال ، إدخالات PTFE المحبة للماء بحجم مسام 0.4 ميكرومتر) باستخدام مرشح نظرة.
- قم بإزالة أي محلول قطع زائد عن طريق وضع المرشح المحمل على قطعة قماش معقمة.
- ضع المرشح المحمل في اللوحة المعدة المكونة من 6 آبار. لا تقم بإضافة أي وسيط إضافي إلى الإدخال.
- ضع اللوحة المكونة من 6 آبار في حاضنة (37 درجة مئوية ، 5٪ CO2).
- قم بتغيير الوسيط كل يومين عن طريق تكرار الخطوات 5.1 و 5.2 و 5.5 باستخدام لوحة جديدة ذات 6 آبار.
ملاحظة: يمكن استزراع ثقافات شرائح النمط العضوي لفترات مختلفة اعتمادا على سؤال البحث الفردي.
6. مقايسة جدوى ريزازورين
ملاحظة: يقيس مقايسة صلاحية resazurin النشاط الأيضي العام لثقافات الشرائح العضوية بناء على تقليل resazurin الأزرق غير الفلوري إلى resorufin الفلوري الأحمر في الخلايا الحية15. ليس للفحص أي آثار سامة على الخلايا ويمكن تطبيقه على الثقافات بشكل متكرر اعتمادا على سؤال البحث الفردي. تم قياس الجدوى باستخدام مقايسة resazurin كل 2-3 أيام.
- إعداد حل الأسهم resazurin
- أطفئ ضوء الغطاء المعقم ، لأن محلول مخزون resazurin حساس للضوء.
- تحضير محلول مرق مع 10 ملغ / مل من ملح الصوديوم ريسازورين في 1x PBS.
- قم بتخزين محلول المرق في قسامات محمية من الضوء على حرارة 4 درجات مئوية في الثلاجة حتى الاستخدام.
- تقييم الجدوى الإجمالية للشريحة
- أطفئ ضوء الغطاء المعقم ، لأن محلول مخزون resazurin حساس للضوء.
- تمييع حل الأسهم resazurin 1: 250 مع وسيلة مناسبة.
ملاحظة: يجب أن يكون الوسط المستخدم للتخفيف هو نفسه المستخدم في الزراعة (الوسط A أو الوسيط B). - قم بإعداد 1 مل من محلول resazurin النهائي لكل شريحة وأضف 1 مل إضافي للتحكم الفارغ ، على سبيل المثال ، ل 6 شرائح تمييع 28 ميكرولتر من محلول مخزون resazurin في 7 مل من الوسط.
- قم بتوزيع محلول resazurin في ألواح ذات 6 آبار ، مع 1 مل من محلول resazurin المخفف لكل بئر.
- نقل مرشحات الزراعة مع شرائح إلى الآبار مع حل resazurin. يتم الاحتفاظ ببئر واحد مع محلول resazurin فارغا كعنصر تحكم فارغ.
ملاحظة: لتبسيط الإجراء التجريبي ، يمكن دمج هذه الخطوة مع تغيير الوسيط (الخطوة 5.7). ومع ذلك ، في حالة الحاجة إلى قياسات جدوى إضافية ، يمكن إجراء الفحص في أي وقت أثناء زراعة مزارع الشرائح. - ضع شرائح الأنسجة في حاضنة لمدة 1 ساعة عند 37 درجة مئوية و 5٪ CO2.
- قم بإعداد ألواح جديدة ذات 6 آبار باستخدام وسيط الاستزراع إذا استمر استزراع الشرائح (انظر الخطوتين 5.1 و 5.2).
- قم بإزالة مرشحات الزراعة بالشرائح من محلول resazurin وإزالة المحلول الزائد عن طريق وضع المرشح المحمل على قطعة قماش معقمة.
- انقل مرشحات الزراعة مع الشرائح إلى طبق الاستزراع المعد مسبقا.
- من كل 6 آبار ، خذ 100 ميكرولتر من محلول resazurin وانقله إلى لوحة 96 بئرا. من عنصر تحكم فارغ ، ضع ثلاث عينات (3 × 100 ميكرولتر) في آبار منفصلة من لوحة 96 بئرا.
- حدد كمية الانقراض باستخدام مقياس ضوئي للوحة وفقا لتعليمات الشركة الصانعة. تم ضبط الطول الموجي للإثارة على 545 نانومتر والطول الموجي للانبعاث على 600 نانومتر.
7. تثبيت الفورمالين وتضمين البارافين في OTSCs
- انقل شرائح الأنسجة المزروعة بحذر إلى شريط تضمين بلاستيكي. للقيام بذلك ، اتبع الخطوات أدناه.
- ضع مرشح الزراعة مع الشريحة المركبة على طبق بتري.
- باستخدام مشرط ، قم بقطع غشاء المرشح بعناية باستخدام شريحة الأنسجة المركبة.
- انقل غشاء المرشح بعناية باستخدام الشريحة المركبة إلى كيس نايلون خزعة وضعه في شريط تضمين.
- بعد ذلك ، قم بنقل علب التضمين البلاستيكية في حاوية تحتوي على فورمالين مبرد مسبقا (4 درجات مئوية) بنسبة 4.5٪. يمكن حفظ الشرائح في محلول الفورمالين عند 4 درجات مئوية حتى الاستخدام مرة أخرى ولكن يجب تحضينها لمدة 24 ساعة على الأقل.
ملاحظة: يجب نقل OTSCs بحذر شديد لأنها تتمزق بسهولة.
- اشطف بحذر ثقافة الشرائح المثبتة بالفورمالين بماء الصنبور الجاري لمدة 1.5 ساعة.
- قم بتجفيف شريحة الأنسجة الثابتة بالفورمالين عن طريق الحضانة في 70٪ إيثانول (2x لمدة 3 ساعات) ، 95٪ إيثانول (1x لليلة واحدة ، 1x لمدة 3 ساعات) ، متبوعا بالإيثانول المطلق (1x لمدة 3 ساعات ، 1x للمبيت).
- قم بإزالة شريحة الأنسجة المثبتة بالفورمالين بمقدار 3 ساعات في حضانة الزيلين مرتين.
- اغمر المنديل بالبارافين عند 60 درجة مئوية (1x طوال الليل ، 1x لمدة 2 ساعة). قم بتضمين المنديل في كتلة البارافين في قالب تضمين الأنسجة.
- قسم كتلة الأنسجة المضمنة في البارافين بسمك 4 ميكرومتر باستخدام ميكروتوم وتطفو في حمام مائي 40 درجة مئوية يحتوي على ماء مقطر. نقل الأقسام إلى شرائح زجاجية.
- احتضان أقسام البارافين لمدة 1 ساعة عند 60 درجة مئوية لربط الأنسجة بالزجاج. احتضان الشرائح طوال الليل عند 37 درجة مئوية.
8. تلطيخ الهيماتوكسيلين واليوسين (H&E & E)
- إزالة المقاطع من الخطوة 7.7 عن طريق الحضانة في الزيلين (3x لمدة 5 دقائق).
- إعادة الترطيب عن طريق الحضانة في الكحول المطلق (2x لمدة 5 دقائق) ، 95٪ كحول (2x لمدة 5 دقائق) ، و 70٪ كحول (1x لمدة 5 دقائق). شطف لفترة وجيزة بالماء المقطر.
- صمة عار في محلول ماير الهيماتوكسيلين لمدة 5 دقائق. شطف بماء الصنبور الجاري لمدة 10 دقائق.
- كاونترستي في محلول Eosin 0.5٪ لمدة 40 ثانية. شطف بالماء المقطر.
- الجفاف عن طريق الحضانة في 70 ٪ الكحول (الحد الأقصى 1 دقيقة) ، 95 ٪ من الإيثانول (2x لمدة 3 دقائق) ، والكحول المطلق (2x لمدة 3 دقائق) ، على التوالي.
- واضح في ثلاثة تغييرات من الزيلين (بضع ثوان لكل منهما). ضع قطرة من وسيط التثبيت وقم بتغطية الشرائح بغطاء غطاء.
9. الكيمياء الهيستولوجية المناعية ل OTSCs
- إزالة المقاطع عن طريق الحضانة في الزيلين 2x لمدة 10 دقائق ، تليها 1: 1 إيثانول / زيلول لمدة 10 دقائق.
- انقل الشرائح إلى إيثانول 100٪ (2x لمدة 3 دقائق) ، و 96٪ إيثانول (2x لمدة 3 دقائق) ، و 70٪ إيثانول (1x لمدة 3 دقائق) ، ثم إلى 50٪ إيثانول (1x لمدة 3 دقائق).
- إجراء استرجاع المستضد للكشف عن حاتمة المستضد. سخني الشرائح في الميكروويف في محلول سيترات لمدة 5 دقائق عند 900 واط ، متبوعا ب 2x لمدة 8 دقائق عند 600 واط. اترك الشرائح لتبرد إلى درجة حرارة الغرفة لمدة 20 دقيقة.
- يغسل في برنامج تلفزيوني 3x لمدة 3 دقائق على شاكر.
- إجراء نفاذية أغشية الخلايا عن طريق الحضانة في 0.1 ٪ Triton X-100 في PBS (200 ميكرولتر لكل شريحة) في غرفة مرطبة في درجة حرارة الغرفة لمدة 10 دقائق.
- اغسل في برنامج تلفزيوني لثلاثة تغييرات ، 3 دقائق لكل منها على شاكر.
- احتضان الأقسام بمحلول 3٪ H2O2 في الميثانول (200 ميكرولتر لكل شريحة) في غرفة مرطبة في درجة حرارة الغرفة لمدة 10 دقائق لمنع نشاط البيروكسيديز الداخلي.
- يغسل في برنامج تلفزيوني 3x لمدة 3 دقائق على شاكر.
- أضف 200 ميكرولتر من المخزن المؤقت المانع (1:50 مصل حصان في برنامج تلفزيوني) واحتضانه في غرفة مرطبة في درجة حرارة الغرفة لمدة 25 دقيقة.
- قم بتصريف المخزن المؤقت للحظر من الشرائح عن طريق إمالة الشريحة على منديل ورقي.
- ضع 200 ميكرولتر من الجسم المضاد الأولي المخفف بشكل مناسب في مخفف الأجسام المضادة على الشرائح واحتضانها في غرفة رطبة عند 4 درجات مئوية طوال الليل. كعنصر تحكم سلبي ، استخدم الشكل المتماثل المناسب للغلوبولين المناعي للفأر بنفس التخفيف مثل الجسم المضاد الأساسي.
- اغسل 3 مرات لمدة 3 دقائق في برنامج تلفزيوني على شاكر.
- ضع 200 ميكرولتر من الأجسام المضادة الثانوية البيوتينيلة (محلول 1:50 في PBS) على الشرائح واحتضانها في غرفة مرطبة في درجة حرارة الغرفة لمدة 30 دقيقة.
- اغسل 3 مرات لمدة 3 دقائق في برنامج تلفزيوني على شاكر.
- قم بإعداد مركب البيروكسيديز القائم على أفيدين / البيوتين وفقا لتعليمات الشركة الصانعة قبل التطبيق. ضع 200 ميكرولتر من مركب avidin-biotin-peroxidase على الشرائح واحتضانها في غرفة رطبة في درجة حرارة الغرفة لمدة 30 دقيقة.
- اغسل 3 مرات لمدة 3 دقائق في برنامج تلفزيوني على شاكر.
- ضع 200 ميكرولتر من محلول ركيزة DAB (مصنوع حديثا مباشرة قبل الاستخدام: قطرة واحدة من DAB في 1 مل من الركيزة) ، 200 ميكرولتر لكل شريحة. اسمح بتطوير اللون لمدة 1-3 دقائق حتى يتم الوصول إلى كثافة اللون المطلوبة.
- شطف بماء الصنبور الجاري لمدة 10 دقائق.
- قم بعكس الشرائح عن طريق غمر الجوانب في الهيماتوكسيلين لمدة 5 دقائق.
- شطف بماء الصنبور الجاري لمدة 10 دقائق.
- قم بتغطية الشرائح باستخدام وسيط التثبيت المائي وأغطية الغطاء. يمكن تخزين الشرائح المثبتة في درجة حرارة الغرفة بشكل دائم.
النتائج
يقدم الشكل 1 نظرة عامة على سير العمل لاستزراع OTSCs من أنسجة الورم الطازجة غير المجمدة. تم جمع عينات من PDACs الأولية والانبثاث مباشرة بعد الاستئصال الجراحي وتخزينها طوال الليل على الثلج الرطب عند 4 درجات مئوية في محلول تخزين الأنسجة. تمت معالجة العينات ، وتم استزراع الشرائح كما هو موضح في البروتوكول. لم يتغير التشكل العياني لكل OTSC بشكل كبير أثناء الزراعة. ومع ذلك ، انخفض حجم مساحة سطح OTSCs بمرور الوقت كما هو موضح في الشكل 2A أثناء الزراعة لمدة 6 أيام. تم تقييم الجدوى الإجمالية ل OTSC من خلال مقايسة صلاحية resazurin في الأيام 0 و 2/3 و 6 (الشكل 2B). يقيس اختبار صلاحية resazurin النشاط الأيضي العام ل OTSC بناء على تقليل resazurin الأزرق غير الفلوري إلى resorufin الفلوري الأحمر في الخلايا الحية15. يوضح الشكل 2B مقارنة الجدوى المقاسة بتقليل الريسازورين بعد زراعة OTSCs من ورمين أوليين تمثيليين في وسطين مختلفين. تمت زراعة OTSCs إما في الوسط A (DMEM / F12 المتقدم ، 10٪ FBS ، 1٪ البنسلين / الستربتومايسين) أو المتوسط B (RPMI 1640 ، 10٪ FBS ، 1٪ البنسلين / الستربتومايسين ، 4 ميكروغرام / مل الأنسولين ، 8 نانوغرام / مل EGF ، 0.3 ميكروغرام / مل هيدروكورتيزون) ، مما أدى إلى قابلية إجمالية مماثلة بشكل مستقل عن وسط الاستزراع. وتجدر الإشارة إلى أنه يمكن ملاحظة انخفاض في الصلاحية بعد اليوم 0 بشكل متكرر ومن المتوقع بسبب إجراء التقطيع والتكيف مع ظروف الاستزراع. ومع ذلك ، لاحظنا أيضا زيادة الجدوى كما هو موضح بشكل نموذجي في اللوحة اليمنى (الشكل 2 ب).
بعد فترات محددة من الزراعة في الوسط A ، تم تثبيت OTSCs في الفورمالين لمزيد من التوصيف المناعي النسيجي (IHC). بعد تثبيت الفورمالين ، كانت OTSCs عبارة عن بارافين مدمج ومقسم. أظهرت المقاطع الملطخة H& E أن البنية الكلية للأنسجة تم الحفاظ عليها طوال فترة الزراعة خارج الجسم الحي (الشكل 3). تم تمييز خلايا الورم والسدى بواسطة IHC للسيتوكيراتين 7 والفيمنتين ، على التوالي. لم يتم الكشف عن أي تغييرات جوهرية في نسب الورم إلى السدى أثناء الزراعة.
لم يكشف التقييم النسيجي المرضي المجهري لأقسام H&E عن زيادة كبيرة في نخر جميع الأنسجة المزروعة أثناء الزراعة (الشكل 3 ، الشكل 4 ، الشكل 5). بالإضافة إلى ذلك ، تم تلطيخ Ki-67 و caspase 3 المشقوق لتقييم الانتشار وموت الخلايا المبرمج ، على التوالي. مرة أخرى ، لم نكتشف تغييرات جسيمة في الانتشار وموت الخلايا المبرمج خلال فترة الاستزراع البالغة 6 أيام (الشكل 3). ومع ذلك ، تزداد نسبة الخلايا المبرمج بمرور الوقت خلال فترات الزراعة الممتدة كما تم قياسها بواسطة تلطيخ caspase 3 المشقوق. يوضح الشكل 4 الزيادة في الخلايا الإيجابية المشقوقة في الكاسباز 3 بعد زراعة PDAC الأولي لمدة 15 يوما. يوضح الشكل 5 التشريح المرضي للورم الخبيث البريتوني ل PDAC. توضح هذه التجربة عدم تجانس عالي داخل الورم بين الشرائح الفردية فيما يتعلق بمحتوى الورم / السدى بالإضافة إلى موت الخلايا المبرمج الذي يحدث بشكل طبيعي والذي يتم قياسه بواسطة تلطيخ caspase 3 المشقوق. ومن ثم ، فإن التقييم النسيجي المرضي ل OTSCs المزروعة مهم لتقييم بنية الورم / السدى وصلاحية كل ورم مزروع أو ورم خبيث.
يوضح الشكل 6 التشريح المرضي لورم خبيث PDAC لجدار البطن. أظهر تلطيخ H&E وكذلك IHC للسيتوكيراتين 7 أن OTSCs المشتقة لا تحتوي على أي خلايا ورمية ، ولكنها تتكون فقط من نسيج ضام ، والذي كان نخريا جزئيا. عيب تقنية OTSC هو أنه لا يمكن تقييم الأنسجة الطازجة وغير الثابتة وغير المجمدة لمحتوى الخلايا السرطانية قبل الزراعة.
بشكل عام ، توضح هذه البيانات أن البنية متعددة الخلايا للورم وورم خبيث خاص به ، يضم أنواعا متميزة من الخلايا ، ينعكس في OTSCs. يتم الحفاظ على تفاعلات الورم وسدى بشكل خاص.
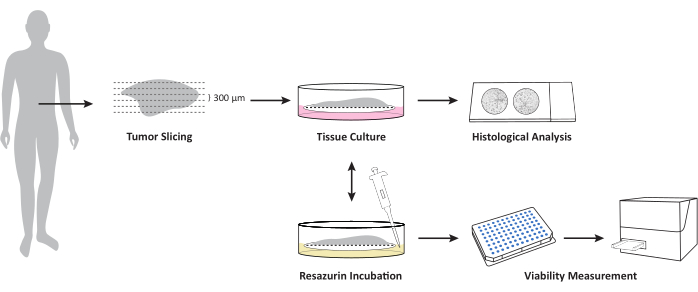
الشكل 1: نظرة عامة على سير العمل لزراعة OTSCs من عينات ورم خبيث / ورم خبيث جديدة غير مجمدة. يتم تقسيم عينة الأنسجة الطازجة غير المجمدة باستخدام اهتزاز وتزرع في واجهة الهواء السائل على إدراج زراعة خلايا PTFE. يمكن قياس الجدوى الإجمالية في نقاط زمنية محددة عن طريق مقايسة صلاحية resazurin. يسمح هذا الفحص بمزيد من الزراعة بعد قياس الجدوى. يتم تثبيت الشرائح بالفورمالين في نقاط زمنية محددة لمزيد من الفحص النسيجي المرضي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
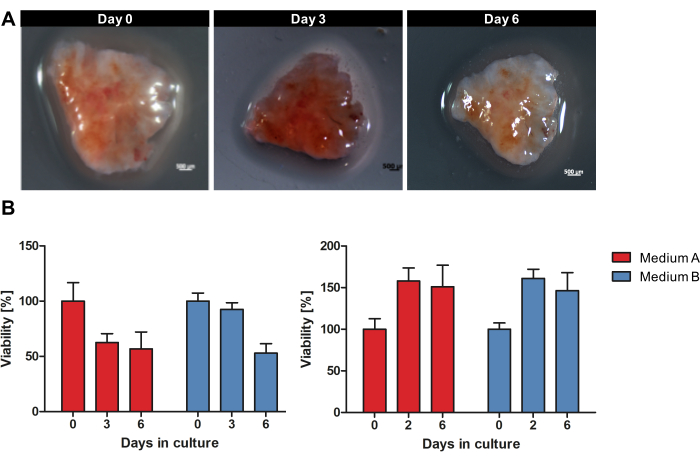
الشكل 2: التشكل العياني وصلاحية OTSCs أثناء الزراعة. تمت زراعة عينة PDAC ك OTSCs لمدة 6 أيام. (أ) لم يتغير التشكل العياني لكل OTSC بشكل كبير أثناء الزراعة. ومع ذلك ، انخفض حجم مساحة سطح OTSCs بمرور الوقت. (ب) تم تحديد الصلاحية الإجمالية كميا عن طريق مقايسة صلاحية resazurin في الوسيطين A و B. يمكن ملاحظة انخفاض في الجدوى بشكل متكرر بعد اليوم 0 بسبب إجراء التقسيم والتكيف مع ظروف الثقافة. ومع ذلك ، لاحظنا أيضا زيادات في الجدوى كما هو موضح بشكل نموذجي في اللوحة اليمنى. تمثل كل لوحة عينة ورم فردية ذات عوائد مختلفة من ثقافات الشرائح المشتقة (اللوحة اليسرى n = 10 ، اللوحة اليمنى n = 10). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: التقييم النسيجي المرضي ل OTSCs بعد وقت زراعة إجمالي قدره 6 أيام. تم استزراع OTSCs (n = 6) في الوسط A. تم تقييم مورفولوجيا الأنسجة بواسطة تلطيخ H&E. تم تمييز خلايا الورم والسدى بواسطة IHC للسيتوكيراتين 7 والفيمنتين ، على التوالي. تم تلطيخ Ki-67 و caspase 3 المشقوق لتقييم الانتشار وموت الخلايا المبرمج ، على التوالي. لم تلاحظ أي زيادة كبيرة في موت الخلايا المبرمج خلال فترة زراعة إجمالية قدرها 6 أيام. يمثل كل شريط مقياس 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 4: التقييم النسيجي المرضي ل OTSCs بعد وقت زراعة إجمالي قدره 15 يوما. تم استزراع OTSCs (ن = 8) في وسط A. تم تقييم مورفولوجيا الأنسجة بواسطة تلطيخ H&E. تم تمييز خلايا الورم والسدى بواسطة IHC للسيتوكيراتين 7 والفيمنتين ، على التوالي. تم تلطيخ Ki-67 و caspase 3 المشقوق لتقييم الانتشار وموت الخلايا المبرمج ، على التوالي. زاد موت الخلايا المبرمج بشكل كبير بعد 15 يوما من الزراعة كما يتضح من تلطيخ caspase-3 المشقوق . يمثل كل شريط مقياس 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 5: التقييم النسيجي المرضي ل OTSCs للورم الخبيث البريتوني ل PDAC. تم استزراع OTSCs (ن = 8) في وسط A. تم تقييم مورفولوجيا الأنسجة بواسطة تلطيخ H&E. تم تمييز خلايا الورم والسدى بواسطة IHC للسيتوكيراتين 7 والفيمنتين ، على التوالي. تم تلطيخ Ki-67 و caspase 3 المشقوق لتقييم الانتشار وموت الخلايا المبرمج ، على التوالي. كشف التقييم النسيجي المرضي عن درجة عالية من عدم التجانس داخل الورم بين الشرائح الفردية فيما يتعلق بمحتوى الورم / السدى بالإضافة إلى موت الخلايا المبرمج الذي يحدث بشكل طبيعي والذي تم قياسه بواسطة تلطيخ كاسباز 3 المشقوق. يمثل كل شريط مقياس 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 6: التقييم النسيجي المرضي ل OTSCs لورم خبيث PDAC لجدار البطن. تم استزراع OTSCs (n = 5) في وسط A. تم تقييم مورفولوجيا الأنسجة بواسطة تلطيخ H&E. تم تمييز خلايا الورم والسدى بواسطة IHC للسيتوكيراتين 7 والفيمنتين ، على التوالي. تم تلطيخ Ki-67 و caspase 3 المشقوق لتقييم الانتشار وموت الخلايا المبرمج ، على التوالي. كشف التقييم النسيجي المرضي عن نقص الخلايا السرطانية في ورم خبيث مزروع ونخر جزئي ، والذي لا يمكن تحديده قبل الزراعة. يمثل كل شريط مقياس 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
OTSCs لعينات الورم الطازجة هي تقريب قريب للورم في الموقع. يحافظون على مورفولوجيتهم الأساسية ونشاطهم التكاثري وبيئتهم المكروية أثناء الزراعة لفترة محددة تعتمد على الأنسجة11،12،13. تتيح هذه التقنية التطبيق الفوري للعلاج على أنسجة الورم البشري القابلة للحياة خارج الجسم الحي والتحليلات اللاحقة ، مثل تنميط النسخ والبروتين. من المزايا المحددة ل OTSCs أنه يمكن تطبيق التحليلات النهائية التي تم حلها مكانيا مثل تصوير MALDI على أنسجة الورم متعددة الخلايا السليمة.
هنا نصف طريقة لتوليد وزراعة وتقييم التشريح المرضي ل OTSCs من PDAC ونقائلها. القضية الرئيسية لهذه التقنية هي قطع الأنسجة الطازجة دون أي إجراءات تجميد والزراعة في واجهة الهواء والسائل. أحد قيود هذه الطريقة هو أنه لا يمكن تقييم الأنسجة الطازجة وغير الثابتة وغير المجمدة لمحتواها من الخلايا السرطانية قبل الزراعة. كما هو موضح في نتائجنا ، قد تكشف OTSCs أنها تتكون من مكونات أنسجة أخرى غير متوقعة من أقسام سريعة من عينات أخرى من نفس الورم. يعد التقييم النسيجي المرضي ل OTSCs بعد الزراعة أمرا ضروريا لتقييم بيانات ثقافات الشرائح الفردية. يسمح فحص الجدوى الموصوف فقط بإجراء تقييم عام للجدوى الإجمالية لكل OTSC. بشكل عام ، يمكن تنفيذ الطريقة الموصوفة في أي مختبر مجهز بوحدة زراعة الاهتزاز والأنسجة. نظرا لبساطة هذه التقنية ، يمكن تعديلها بسهولة نحو الأورام المختلفة وأسئلة البحث.
تم تطوير منهجيات متعددة لزراعة أنسجة الورم البشري خارج الجسم الحي ، على سبيل المثال ، خطوط الخلايا الأولية ، والكائنات العضوية المشتقة من المريض ، والطعوم الخارجية. ومع ذلك ، فإن استخدامها لتطوير الأدوية وتحديد المؤشرات الحيوية التنبؤية لا يزال محدودا في الغالب بسبب فقدان سياق الأنسجة ، أي تفاعل السدى والخلايا السرطانية2.
على الرغم من أن الطريقة المقدمة لإنشاء زراعة الشرائح العضوية تحافظ على بنية الأنسجة متعددة الخلايا ، إلا أنه يجب مراعاة العديد من القيود. أولا ، يجب مراعاة درجة كبيرة من عدم تجانس الورم (الداخلي). قد تظهر OTSCs المميزة المشتقة من خزعة ورم واحد اختلافات كبيرة في نسب خلايا الورم والسدى. إلى جانب الجودة الشاملة للأنسجة ، قد يكون هذا أحد أسباب بقاء الشريحة المختلفة أثناء الثقافة. ثانيا ، قد يختلف الوسط لظروف الاستزراع المثلى اعتمادا على الأنسجة والمريض. قارنا بين وسطين متميزين لزراعة الأنسجة: الأول يعتمد على DMEM / F12 (الوسيط A) والثاني يعتمد على RPMI (المتوسط B). قد تتطلب كل عينة من الأورام الأولية أو نقائلها تعديلات. ثالثا ، قد يحدث نخر الورم بالفعل في الموقع16 وليس بالضرورة بسبب عدم كفاية ظروف الاستزراع في OTSCs. ينبغي النظر في مقارنة مع التشريح المرضي للورم الرئيسي.
يوفر إنشاء OTSCs كما هو موضح في هذا البروتوكول فرصة لاختبار استجابة العلاج على الفور بعد الجراحة في نظام نموذج خارج الجسم الحي يحافظ على البيئة المكروية للورم. في المستقبل ، ستسهل OTSCs تطوير استراتيجيات علاجية فردية لتخصيص علاج المرض النقيلي.
Disclosures
ولم يكشف المؤلفان عن أي تضارب محتمل في المصالح.
Acknowledgements
تم دعم R. Braun من قبل مدرسة العلماء السريريين لوبيك (DFG # 413535489) وبرنامج تمويل المبتدئين بجامعة لوبيك.
Materials
| Name | Company | Catalog Number | Comments |
| Advanced DMEM/F-12 Medium | Gibco | 12634028 | |
| Agarose Low Melt | Roth | 6351.2 | 8% in Ringer solution |
| Antibody Diluent, Background Reducing | Dako | S3022 | |
| AquaTex | Merck | 108562 | |
| Bioethanol (99%, denatured) | CHEMSolute | 2,21,19,010 | |
| Citric Acid monohydrate | Sigma Aldrich | C7129 | |
| Cleaved Caspase-3 (Asp175) (5A1E) Rabbit mAb | Cell Signalling Technology | 9664 | 1:400 dilution |
| Derby Extra Double Edge Safety Razor Blades | Derby Tokai | ||
| Embedding cassettes | Roth | H579.1 | |
| Eosin Y-solution 0,5% aqueous | Merck | 10,98,44,100 | |
| Eukitt Quick hardening mounting medium | Sigma-Aldrich | 3989 | |
| Fetal bovine serum | Gibco | 10270106 | |
| Formaldehyde solution 4,5%, buffered | Büfa Chemikalien | B211101000 | |
| Hem alum solution acid acc. to Mayer | Roth | T865 | |
| Human EGF | Milteniy Biotec | 130-097-794 | |
| Hydrocortisone | Sigma Aldrich (Merck) | H0888 | |
| Hydrogen peroxide 30% | Merck | 1,08,59,71,000 | |
| Insulin human | Sigma Aldrich (Merck) | 12643 | |
| Liquid DAB+ Substrate Chromogen System | Dako | K3468 | |
| MACS Tissue Storage Solution | Milteniy Biotech | 130-100-008 | |
| Methanol | Merck | 10.600.092.500 | |
| Microscope Slides Superfrost Plus | Thermo Scientific | J1800AMNZ | |
| Millicell Cell Culture Insert, 30 mm, hydrophilic PTFE, 0.4 µm | Millipore (Merck) | PICM0RG50 | |
| Monoclonal mouse anti-human Cytokeratin 7 (Clone OV-TL 12/30) | Dako | M7018 | 1:200 dilution |
| Monoclonal mouse anti-human Ki67 Clone MIB-1 | Dako | M7240 | 1:200 dilution |
| Monoclonal mouse Anti-vimentin (Clone V9) | Dako | M0725 | 1:200 dilution |
| Negative control Mouse IgG2a | Dako | X0943 | 1:200 dilution |
| Negative control Mouse IgG1 | Dako | X093101-2 | 1:200 dilution |
| Paraffin (melting temperature 56°- 58°) | Merck | 10,73,37,100 | |
| Penicillin-Streptomycin (10.000 U/ml) | Gibco | 15140122 | |
| PBS pH 7,4 (1x) Flow Cytometry Grade | Gibco | A12860301 | |
| Resazurin sodium salt; 10 mg/ml in PBS | Sigma Aldrich | R7017 | 1:250 dilution |
| Ringer's solution | Fresenius Kabi | 2610813 | |
| RPMI-1640 Medium | Sigma Aldrich (Merck) | R8758 | |
| Tissue culture testplate 6 | TPP | 92006 | |
| Triton X-100 | Sigma Aldrich | 9002-93-1 | |
| VECTASTAIN Elite ABC-Peroxidase Kit | Vector Laboratories | PK-6200 | |
| Xylene (extra pure) | J.T.Baker | 8,11,85,000 | |
| Equipment | |||
| ClarioStar Microplate Reader | BMG Labtech | ||
| Paraffin Embedding Center E61110 | Leica | ||
| Rotary Microtome Microm HM355S | Thermo Scientific | ||
| Section Transfer System Microm STS | Thermo Scientific | ||
| VT 1200S Vibratom | Leica |
References
- Nevala-Plagemann, C., Hidalgo, M., Garrido-Laguna, I. From state-of-the-art treatments to novel therapies for advanced-stage pancreatic cancer. Nature Reviews. Clinical Oncology. 17 (2), 108-123 (2020).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- Waghray, M., Yalamanchili, M., di Magliano, M. P., Simeone, D. M. Deciphering the role of stroma in pancreatic cancer. Current Opinion in Gastroenterology. 29 (5), 537-543 (2013).
- Hwang, R. F., et al. Cancer-associated stromal fibroblasts promote pancreatic tumor progression. Cancer Research. 68 (3), 918-926 (2008).
- Jiang, X., et al. Long-lived pancreatic ductal adenocarcinoma slice cultures enable precise study of the immune microenvironment. Oncoimmunology. 6 (7), 1333210 (2017).
- Hessmann, E., et al. Fibroblast drug scavenging increases intratumoural gemcitabine accumulation in murine pancreas cancer. Gut. 67 (3), 497-507 (2018).
- Feig, C., et al. The pancreas cancer microenvironment. Clinical Cancer Research. 18 (16), 4266-4276 (2012).
- Koerfer, J., et al. Organotypic slice cultures of human gastric and esophagogastric junction cancer. Cancer Medicine. 5 (7), 1444-1453 (2016).
- Gerlach, M. M., et al. Slice cultures from head and neck squamous cell carcinoma: a novel test system for drug susceptibility and mechanisms of resistance. British Journal of Cancer. 110 (2), 479-488 (2014).
- Holliday, D. L., et al. The practicalities of using tissue slices as preclinical organotypic breast cancer models. Journal of Clinical Pathology. 66 (3), 253-255 (2013).
- Vaira, V., et al. Preclinical model of organotypic culture for pharmacodynamic profiling of human tumors. Proceedings of the National Academy of Sciences of the United States of America. 107 (18), 8352-8356 (2010).
- Lim, C. Y., et al. Organotypic slice cultures of pancreatic ductal adenocarcinoma preserve the tumor microenvironment and provide a platform for drug response. Pancreatology. 18 (8), 913-927 (2018).
- Brandenburger, M., et al. Organotypic slice culture from human adult ventricular myocardium. Cardiovascular Research. 93 (1), 50-59 (2012).
- Misra, S., et al. Ex vivo organotypic culture system of precision-cut slices of human pancreatic ductal adenocarcinoma. Science Reports. 9 (1), 2133 (2019).
- O'Brien, J., Wilson, I., Orton, T., Pognan, F. Investigation of the Alamar Blue (resazurin) fluorescent dye for the assessment of mammalian cell cytotoxicity. European Journal of Biochemistry. 267 (17), 5421-5426 (2000).
- Beutler, B., Cerami, A. Tumor necrosis, cachexia, shock, and inflammation: a common mediator. Annual Review of Biochemisty. 57, 505-518 (1988).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved