Method Article
תרביות פרוסות אורגנוטיפיות כמודלים פרה-קליניים של מיקרו-סביבה גידולית בסרטן לבלב ראשוני וגרורות
In This Article
Summary
פרוטוקול זה מתאר את הכנת תרביות פרוסות אורגנוטיפיות (OTSCs). טכניקה זו מאפשרת טיפוח ex vivo של רקמה רב-תאית שלמה. ניתן להשתמש ב-OTSCs באופן מיידי כדי לבדוק את התגובה המתאימה שלהם לתרופות בסביבה רב-תאית.
Abstract
מודלים פרה-קליניים מציאותיים של סרטן לבלב ראשוני וגרורות נחוצים בדחיפות כדי לבחון את תגובת הטיפול ex vivo ולהקל על טיפול מותאם אישית בחולה. עם זאת, היעדר מיקרו-סביבה ספציפית לגידול במודלים הנמצאים בשימוש כיום, כגון קווי תאים שמקורם במטופל וקסנוגרפטים, מאפשר רק תובנות ניבוי מוגבלות. תרביות פרוסות אורגנוטיפיות (OTSCs) מורכבות מרקמה רב-תאית שלמה, שניתן להשתמש בה במהירות לבדיקת תגובת תרופות מפוענחת מרחבית.
פרוטוקול זה מתאר את היצירה והטיפוח של פרוסות גידול בנות קיימא של סרטן הלבלב וגרורותיו. בקצרה, רקמה יצוקה באגרוז נמס נמוך ומאוחסן בחיץ איזוטוני קר. לאחר מכן, פרוסות רקמות בעובי 300 מיקרומטר נוצרות עם ויברטום. לאחר ההכנה, הפרוסות מתורבתות בממשק אוויר-נוזל באמצעות תוספות תרבית תאים ואמצעי גידול מתאים. במהלך הטיפוח ניתן לעקוב אחר שינויים בהתמיינות התאים ובכדאיות. בנוסף, טכניקה זו מאפשרת יישום של טיפול ברקמת גידול אנושית בת קיימא ex vivo וניתוחים במורד הזרם, כגון פרופיל שעתוק ופרופיל.
OTSCs מספקים הזדמנות ייחודית לבחון את תגובת הטיפול האישית ex vivo ולזהות פרופילים שעתוק ופרוטאומיים בודדים הקשורים לתגובה בהתאמה של פרוסות גידול נפרדות. ניתן להמשיך לחקור OTSCs כדי לזהות אסטרטגיות טיפוליות להתאמה אישית של הטיפול בסרטן לבלב ראשוני וגרורות.
Introduction
מודלים פרה-קליניים קיימים של אדנוקרצינומה של צינור הלבלב (PDAC) וגרורות בהתאמה הם מנבאים גרועים של תגובה לטיפול בחולים, דבר המהווה חסרון משמעותי בפיתוח תרופות ובזיהוי סמנים ביולוגיים מנבאים1. למרות שמודלים כגון אורגנואידים שמקורם במטופל וקסנוגרפטים שמקורם במטופל מבטיחים, השימוש בהם נותר מוגבל2. המגבלות העיקריות של מודלים אלה במבחנה הן היעדר מיקרו-סביבה של הגידול וקסנוגרפטינג במינים מדוכאי חיסון שאינם אנושיים. במיוחד ב- PDAC והגרורות שלו, המיקרו-סביבה של הגידול זכתה להתעניינות רבה בשנים האחרונות בגלל תפקידיה המכריעים בביולוגיה של הגידול. הוא מורכב מרכיבים תאיים ואצלולריים, כגון (מיו-)פיברובלסטים, תאי סטלט הלבלב, תאי חיסון, כלי דם, מטריצה חוץ-תאית, ציטוקינים וגורמי גדילה3. מיקרו-סביבה זו אינה מרכיב גידולי שאינו מתפקד, אלא גורמת להתקדמות הגידול ולגרורות ונראה כי היא תורמת באופן משמעותי לעמידות לקרינה ולכימותרפיה4. המיקרו-סביבה PDAC לא רק פוגעת מכנית באספקת תרופות, אלא גם בעלת פעילות חיסונית ופעילות נבלות תרופות 5,6,7. לפיכך, מודלים פרה-קליניים המשקפים את האינטראקציה המורכבת של תאי הגידול והמיקרו-סביבה של הגידול נדרשים בדחיפות כדי לבחון כראוי את תגובת הטיפול של החולים ex vivo ולהנחות טיפול קליני אינדיבידואלי.
תרביות Ex vivo של דגימות גידול טריות מייצגות קירוב קרוב של הגידול באתרו. תרביות פרוסות אורגנוטיפיות (OTSCs) פותחו ונחקרו לאחרונה עבור מספר גידולים, כגון סרטן הראש, הצוואר, השד, הערמונית, הריאות, המעי הגס והלבלב 8,9,10,11,12. הוכח כי OTSCs שומרים על המורפולוגיה הבסיסית שלהם, פעילות ההתרבות והמיקרו-סביבה שלהם במהלך הטיפוח לתקופה מוגדרת ותלויית רקמות 11,12,13. OTSCs של PDACs שמרו על הכדאיות שלהם, מורפולוגיה, ואת רוב המרכיבים של מיקרו-סביבה הגידול שלהם במשך 4-9 ימים במספר מחקרים במבחנה 5,12,14. מבחינה פרספקטיבית, טכניקה זו מאפשרת יישום מיידי של הטיפול ברקמת גידול אנושית בת קיימא ex vivo וניתוחים במורד הזרם, כגון פרופיל של התמליל והפרוטאום.
הקמת OTSCs מספקת הזדמנות ייחודית לבחון את תגובת הטיפול ex vivo מיד לאחר הניתוח. לפיכך, OTSCs יאפשר באופן פרוספקטיבי לזהות אסטרטגיות טיפוליות כדי להתאים אישית את הטיפול במחלה גרורתית. פרוטוקול זה מתאר את הייצור והטיפוח של OTSCs קיימא של סרטן הלבלב.
Protocol
דגימות רקמות נאספו ועובדו לאחר אישור ועדת האתיקה המקומית של אוניברסיטת ליבק (# 16-281).
1. איסוף וטיפול ברקמות טריות
הערה: יש לטפל בזהירות בכל דגימת רקמה אנושית לא קבועה כדי למנוע את הסיכון לזיהום מפתוגנים הנישאים בדם. כל החולים צריכים להיבדק כדי להיות שליליים עבור HIV, HBV, ו- HCV לפני עיבוד רקמות. לבשו מעיל מגן וטפלו בדגימות רקמות אנושיות עם כפפות.
- יש לאסוף דגימת רקמת PDAC טרייה, לא קבועה ולא קפואה בגודל מינימלי של 0.4 x 0.4 ס"מ מיד לאחר הניתוח ולהעביר את הדגימה למעבדה בתמיסת אחסון רקמות.
- במידת האפשר, יש לעבד את הרקמה הטרייה באופן מיידי.
- לחלופין, אחסנו רקמות בתמיסת אחסון רקמות על קרח רטוב בטמפרטורה של 4°C למשך הלילה. עם זאת, אחסון רקמות עלול לגרום לפגיעה בכדאיות ובדרך כלל יש להימנע ממנו.
2. הכנה
- הכנת אגרוז נמס נמוך
- הכינו 100 מ"ל של אגרוז בהתכה נמוכה (8%) על ידי המסת 8 גרם אגרוז ב-100 מ"ל של תמיסת רינגר שחוממה מראש ואחסנו אותה ב-4 מעלות צלזיוס עד לצורך.
- עם ההודעה על כריתת הגידול, ממיסים את האגרוז במיקרוגל.
- הכניסו את האגרוז לאמבט מים שחומם מראש (37°C) ואפשרו לו להתקרר לטמפרטורות פיזיולוגיות לפני ההכנה.
- הגדרת Vibratome
- הכניסו סכין גילוח למחזיק הוויברטום ובצעו כוונון זווית אוטומטי בהתאם להוראות היצרן, אם רלוונטי.
- מצננים את המעיל של תא החיתוך באמצעות יחידת קירור או קרח רטוב.
- מלאו את תא החיתוך בכ-100 מ"ל של תמיסת חיתוך פיזיולוגית (למשל, תמיסת רינגר).
- הכניסו את סכין הגילוח המותקן לתמיסת החיתוך המצוננת מראש, ואפשרו לסכין הגילוח להתקרר.
3. שיבוץ רקמות באגרוז נמס נמוך
- שטפו את דגימת הרקמה עם PBS מקורר (4 °C) והניחו את הרקמה ב- PBS על צלחת פטרי גדולה (~ 14 ס"מ) על קרח.
- הסר רקמת חיבור עודפת נראית מקרוסקופית על קרח באמצעות אזמל מכיוון שהוא עלול לעכב את יעילות החיתוך.
- מניחים את הרקמה לתוך צלחת פטרי קטנה (~ 3 ס"מ).
- התאימו את כיוון הרקמה כך שלרקמת החיבור הנותרת הנראית לעין יש את אותו כיוון כמו המישור של תחתית צלחת הפטרי. החלק התחתון של צלחת פטרי יש את אותו כיוון כמו מטוס החיתוך.
- יוצקים את האגרוז המוכן בהמסה נמוכה לתוך צלחת פטרי קטנה.
- התאם מחדש את כיוון הרקמה, במידת הצורך, באמצעות מלקחיים.
- הניחו את צלחת הפטרי על קרח רטוב להתקשות מהירה יותר של האגרוז.
- בזהירות לחתוך את הרקמה באמצעות אזמל, משאיר לפחות 5 מ"מ סביב agarose בכל צד של הרקמה.
- בזהירות להעביר את הרקמה המשובצת ולהדביק אותו על מחזיק הדגימה באמצעות דבק סופר.
- לאחר מספר שניות, הכניסו את מחזיק הדגימה לתא החיתוך.
- התאימו את כיוון הרקמה לכיוון סכין הגילוח, במידת הצורך.
4. חיתוך הרקמה המשובצת באגרוז באמצעות ויברטומה
- הגדר את הגבולות החיצוניים של טווח החיתוך (ציר y) בהתאם לגודל דגימת הרקמה.
- כוונן את הלהב לכיוון החלק העליון של בלוק הרקמה.
- הגדר את מהירות החיתוך ל- 0.04 מ"מ לשנייה, משרעת חיתוך ל- 1 מ"מ ועובי פרוסה ל- 300 מיקרומטר.
- חותכים בזהירות את הפרוסות הראשונות ומעבירים את הפרוסות למיכל נפרד עם תמיסת חיתוך מצוננת (4 מעלות צלזיוס) על קרח רטוב.
5. תרבות של תרביות פרוסות אורגנוטיפיות
- הכינו צלחת 6 בארות עם 1 מ"ל של מדיום הטיפוח המתאים לכל באר.
- בינוני A: DMEM/F12 מתקדם, 10% FBS, 1% פניצילין/סטרפטומיצין.
- בינוני B: RPMI 1640, 10% FBS, 1% פניצילין/סטרפטומיצין, 4 מיקרוגרם/מ"ל אינסולין, 8 נ"ג/מ"ל EGF, 0.3 מיקרוגרם/מ"ל הידרוקורטיזון.
הערה: המדיום לתנאי תרבית אופטימליים עשוי להשתנות בהתאם לרקמה ולמטופל. הושוו שני אמצעי תרבית רקמה שונים, האחד מבוסס על DMEM/F12 (מדיום A), והשני מבוסס על RPMI (בינוני B). לא נמצאו הבדלים מהותיים בין אמצעי התקשורת הללו. עבור כל הניסויים המוצגים בפרוטוקול זה, נעשה שימוש בתווך A.
- הכניסו את צלחת 6 הקידוחים עם המדיום לאינקובטור, מה שמאפשר לטמפרטורה ול-pH להתאים את עצמם לפני הגידול.
- הניחו פרוסות על תוספות תרבית תאים (לדוגמה, תוספות PTFE הידרופיליות בגודל נקבוביות של 0.4 מיקרומטר) באמצעות מסנן מבט.
- הסר כל תמיסת חיתוך עודפת על ידי הנחת הפילטר הטעון על מטלית סטרילית.
- מניחים את הפילטר הטעון בצלחת מוכנה בת 6 בארות. אל תוסיף אמצעי נוסף להוספה.
- מניחים את צלחת 6 בארות באינקובטור (37 ° C, 5% CO2).
- שנה את המדיום כל יומיים על ידי חזרה על שלבים 5.1, 5.2 ו- 5.5 עם צלחת חדשה בעלת 6 בארות.
הערה: תרביות פרוסות אורגנוטיפיות יכולות להיות מתורבתות לתקופות שונות בהתאם לשאלת המחקר הבודדת.
6. בדיקת כדאיות Resazurin
הערה: בדיקת הכדאיות של רזזורין מודדת פעילות מטבולית כללית של תרביות פרוסות אורגנוטיפיות בהתבסס על הפחתת רזזורין כחול שאינו פלואורסצנטי לרסורופין פלואורסצנטי אדום בתאים חיים15. לבדיקה אין השפעות רעילות על תאים וניתן ליישם אותה על התרביות שוב ושוב בהתאם לשאלת המחקר הבודדת. הכדאיות נמדדה באמצעות בדיקת רסזורין כל 2-3 ימים.
- הכנת פתרון מלאי resazurin
- כבה את האור של מכסה המנוע הסטרילי, מכיוון שתמיסת מלאי רסזורין רגישה לאור.
- הכינו תמיסת ציר עם 10 מ"ג/מ"ל מלח נתרן רזזורין ב-1x PBS.
- אחסנו את תמיסת המלאי ב-aliquots מוגנים באור בטמפרטורה של 4°C במקרר עד לשימוש.
- הערכת הכדאיות הכוללת של הפרוסה
- כבה את האור של מכסה המנוע הסטרילי, מכיוון שתמיסת מלאי רסזורין רגישה לאור.
- לדלל את פתרון מלאי resazurin 1:250 עם מדיום מתאים.
הערה: המדיום המשמש לדילול צריך להיות זהה לזה המשמש לטיפוח (מדיום A או מדיום B). - הכן 1 מ"ל של תמיסת resazurin הסופית לכל פרוסה ולהוסיף 1 מ"ל נוסף עבור הבקרה הריקה, למשל, עבור 6 פרוסות לדלל 28 μL של תמיסת מלאי resazurin ב 7 מ"ל של בינוני.
- מוציאים את תמיסת הרזזורין בצלחות 6 בארות, עם 1 מ"ל של תמיסת רזזורין מדוללת לכל באר.
- מעבירים את מסנני הטיפוח עם הפרוסות לבארות עם תמיסת רסזורין. באר אחת עם תמיסת resazurin נשמרת ריקה כמו שליטה ריקה.
הערה: כדי לפשט את הליך הניסוי, ניתן לשלב שלב זה עם שינוי המדיום (שלב 5.7). עם זאת, במקרה שיש צורך במדידות כדאיות נוספות, ניתן לבצע את הבדיקה בכל עת במהלך טיפוח תרביות הפרוסות. - מניחים את פרוסות הרקמה באינקובטור למשך שעה אחת בטמפרטורה של 37°C ו-5% CO2.
- הכינו צלחות חדשות בנות 6 בארות עם מדיום התרבית אם ממשיכים בתרבית הפרוסות (ראו שלבים 5.1 ו-5.2).
- הסר את מסנני הטיפוח עם הפרוסות מתמיסת הרזזורין והסר את התמיסה העודפת על ידי הנחת הפילטר הטעון על מטלית סטרילית.
- מעבירים את מסנני הטיפוח עם הפרוסות לצלחת התרבית שהוכנה מראש.
- מכל 6-באר, לקחת 100 μL של פתרון resazurin ולהעביר אותו על צלחת 96 באר. מבקרה ריקה, מקם שלוש דגימות (3 x 100 μL) בבארות נפרדות של צלחת 96 בארות.
- כמת את ההכחדה באמצעות פוטומטר צלחת בהתאם להוראות היצרן. אורך גל עירור מוגדר ל- 545 ננומטר ואורך גל הפליטה מוגדר ל- 600 ננומטר.
7. קיבוע פורמלין והטמעת פרפין של OTSCs
- מעבירים בזהירות את פרוסות הרקמה המתורבתות לקסטת הטבעה מפלסטיק. לשם כך, בצע את השלבים הבאים.
- מניחים את מסנן הטיפוח עם הפרוסה המותקנת על צלחת פטרי.
- בעזרת אזמל, חותכים בזהירות את קרום המסנן עם פרוסת הרקמה המותקנת.
- מעבירים בזהירות את קרום המסנן עם הפרוסה המותקנת לשקית ניילון ביופסיה ומניחים אותה בקלטת הטבעה.
- לאחר מכן מעבירים קלטות הטבעה מפלסטיק במיכל עם פורמלין 4.5% מקורר מראש (4°C). ניתן לשמור את הפרוסות בתמיסת פורמלין בטמפרטורה של 4°C עד לשימוש נוסף, אך יש לדגור עליהן למשך 24 שעות לפחות.
הערה: OTSCs צריכים להיות מועברים בזהירות רבה כפי שהם נקרעים בקלות.
- שטפו בזהירות את תרבית הפרוסה הקבועה בפורמלין במי ברז זורמים במשך שעה וחצי.
- יש לייבש את פרוסת הרקמה הקבועה בפורמלין על ידי דגירה באתנול 70% (2x למשך 3 שעות), 95% אתנול (1x ללילה, 1x למשך 3 שעות), ולאחר מכן אתנול מוחלט (1x למשך 3 שעות, 1x ללילה).
- מנקים את פרוסת הרקמה הקבועה בפורמלין בדגירה של 3 שעות בקסילן פעמיים.
- לטבול את הרקמה עם פרפין ב 60 ° C (1x ללילה, 1x במשך 2 שעות). הטמיעו את הרקמה בגוש פרפין בתבנית הטבעה של רקמות.
- חתכו את גוש הרקמה המשובצת בפרפין בעובי 4 מיקרומטר עם מיקרוטום וצפים באמבט מים של 40 מעלות צלזיוס המכיל מים מזוקקים. העבירו את המקטעים לשקופיות זכוכית.
- לדגור על חלקי פרפין במשך שעה אחת ב 60 ° C כדי לקשור את הרקמה לזכוכית. לדגור את המגלשות לילה ב 37 °C (77 °F).
8. צביעת המטוקסילין ואוזין (H&E)
- פירוק מקטעים משלב 7.7 על ידי דגירה בקסילן (3x למשך 5 דקות).
- יש להחזיר את ההידרציה על ידי דגירה באלכוהול מוחלט (2x למשך 5 דקות), 95% אלכוהול (2x למשך 5 דקות) ו-70% אלכוהול (1x למשך 5 דקות). יש לשטוף לזמן קצר במים מזוקקים.
- מכתימים בתמיסת המטוקסילין של מאייר למשך 5 דקות. יש לשטוף במי ברז זורמים במשך 10 דקות.
- כתם נגדי בתמיסת אאוסין 0.5% למשך 40 שניות. יש לשטוף במים מזוקקים.
- יש לייבש על ידי דגירה ב-70% אלכוהול (מקסימום דקה), 95% אתנול (2x למשך 3 דקות) ואלכוהול מוחלט (2x למשך 3 דקות), בהתאמה.
- נקה בשלושה שינויים של קסילן (כמה שניות כל אחד). הניחו טיפה של אמצעי הרכבה וכסו את המגלשות בכיסוי.
9. אימונוהיסטוכימיה של OTSCs
- יש לנטרל מקטעים על ידי דגירה בקסילן 2x למשך 10 דקות, ולאחר מכן 1:1 אתנול/קסילול למשך 10 דקות.
- העבר שקופיות ל-100% אתנול (2x למשך 3 דקות), 96% אתנול (2x למשך 3 דקות), 70% אתנול (1x למשך 3 דקות) ולאחר מכן ל-50% אתנול (1x למשך 3 דקות).
- בצע אחזור אנטיגן כדי לחשוף את האפיטופ האנטיגני. חממו את המגלשות במיקרוגל במאגר ציטראט במשך 5 דקות ב-900 ואט, ולאחר מכן פעמיים במשך 8 דקות ב-600 ואט. תנו למגלשות להתקרר לטמפרטורת החדר למשך 20 דקות.
- יש לשטוף ב-PBS 3 פעמים במשך 3 דקות על שייקר.
- בצע חדירה של קרום התא על ידי דגירה ב 0.1% Triton X-100 ב PBS (200 μL לכל שקופיות) בתא לח בטמפרטורת החדר במשך 10 דקות.
- יש לשטוף ב-PBS לשלושה שינויים, 3 דקות כל אחד על השייקר.
- יש לדגור על מקטעים עם תמיסת 3% H2O2 במתנול (200 מיקרוליטר למגלשה) בתא לח בטמפרטורת החדר למשך 10 דקות כדי לחסום פעילות פרוקסידאז אנדוגני.
- יש לשטוף ב-PBS 3 פעמים במשך 3 דקות על שייקר.
- הוסף 200 μL של חיץ חוסם (1:50 נסיוב סוס ב- PBS) ודגור בתא לח בטמפרטורת החדר למשך 25 דקות.
- נקז את מאגר החסימה מהשקופיות על-ידי הטיית השקופית על ממחטת נייר.
- יש למרוח 200 μL של נוגדן ראשוני מדולל כראוי בנוגדן מדלל על המגלשות ולדגור בתא לח ב 4 ° C למשך הלילה. כבקרה שלילית, השתמש באיזופורם מתאים של אימונוגלובולינים של עכברים באותו דילול כמו הנוגדן הראשי.
- יש לכבס 3 פעמים במשך 3 דקות ב-PBS על שייקר.
- יש למרוח 200 μL של נוגדן משני ביוטינילציה (תמיסה 1:50 ב-PBS) על המגלשות ולדגור בתא לח בטמפרטורת החדר למשך 30 דקות.
- יש לכבס 3 פעמים במשך 3 דקות ב-PBS על שייקר.
- הכינו את קומפלקס הפרוקסידז על בסיס אבידין/ביוטין בהתאם להוראות היצרן לפני היישום. יש למרוח 200 μL של קומפלקס אבידין-ביוטין-פרוקסידאז על המגלשות ולדגור בתא לח בטמפרטורת החדר למשך 30 דקות.
- יש לכבס 3 פעמים במשך 3 דקות ב-PBS על שייקר.
- יש למרוח 200 μL של תמיסת מצע DAB (מיוצרת ישירות לפני השימוש: טיפה אחת של DAB ב-1 מ"ל של מצע), 200 μL לכל שקופית. אפשר את התפתחות הצבע 1-3 דקות עד שתגיע לעוצמת הצבע הרצויה.
- יש לשטוף במי ברז זורמים במשך 10 דקות.
- מכתימים את המגלשות על ידי טבילת הצדדים בהמטוקסילין למשך 5 דקות.
- יש לשטוף במי ברז זורמים במשך 10 דקות.
- כסו את השקופיות באמצעות אמצעי הרכבה מימיים וכיסויים. ניתן לאחסן את המגלשות המותקנות בטמפרטורת החדר לצמיתות.
תוצאות
איור 1 מספק סקירה כללית של זרימת העבודה לתרבית OTSCs מרקמת גידול טרייה ולא קפואה. דגימות של PDAC ראשוני וגרורות נאספו מיד לאחר כריתה כירורגית ואוחסנו במשך הלילה על קרח רטוב ב -4 מעלות צלזיוס בתמיסת אחסון הרקמות. הדגימות עובדו, והפרוסות תורבתו כמתואר בפרוטוקול. המורפולוגיה המקרוסקופית של כל OTSC לא השתנתה באופן גס במהלך הטיפוח. אולם גודל שטח הפנים של ה-OTSCs ירד עם הזמן, כפי שניתן לראות לדוגמה באיור 2A במהלך הטיפוח במשך 6 ימים. הכדאיות הכוללת של OTSC הוערכה על-ידי בדיקת כדאיות רסזורין בימים 0, 2/3 ו-6 (איור 2B). בדיקת הכדאיות של רסזורין מודדת את הפעילות המטבולית הכללית של OTSC בהתבסס על הפחתת רזזורין כחול שאינו פלואורסצנטי לרסורופין פלואורסצנטי אדום בתאים חיים15. איור 2B מראה את השוואת הכדאיות שנמדדה על-ידי הפחתת רסזורין לאחר טיפוח OTSCs משני גידולים ראשוניים מייצגים בשתי מדיות שונות. OTSCs תורבתו בבינוני A (DMEM/F12 מתקדם, 10% FBS, 1% פניצילין/סטרפטומיצין) או בינוני B (RPMI 1640, 10% FBS, 1% פניצילין/סטרפטומיצין, 4 מיקרוגרם/מ"ל אינסולין, 8 ננוגרם/מ"ל EGF, 0.3 מיקרוגרם/מ"ל הידרוקורטיזון), מה שהביא לכדאיות כוללת דומה ללא תלות בתווך התרבית. יש לציין כי ניתן לראות ירידה בכדאיות לאחר יום 0 לעיתים קרובות והיא צפויה עקב הליך החיתוך וההתאמה לתנאי התרבית. אולם ראינו גם כדאיות מוגברת כפי שמוצג לדוגמה בפאנל הימני (איור 2B).
לאחר תקופות מוגדרות של גידול בתווך A, OTSCs נקבעו בפורמלין לאפיון אימונוהיסטולוגי נוסף (IHC). לאחר קיבוע פורמלין, OTSCs היו פרפין משובץ וחתך. חתכים מוכתמים של H&E הראו שהמבנה הכללי של הרקמה נשמר לאורך כל זמן הטיפוח ex vivo (איור 3). תאי הגידול והסטרומה הופלו על ידי IHC עבור ציטוקרטין 7 ווימנטין, בהתאמה. לא התגלו שינויים מהותיים ביחס הגידול לסטרומה במהלך הגידול.
הערכה היסטופתולוגית מיקרוסקופית של מקטעי H&E לא חשפה עלייה משמעותית בנמק של כל הרקמות המתורבתות במהלך הטיפוח (איור 3, איור 4, איור 5). בנוסף, Ki-67 וקספז שסוע 3 הוכתמו לצורך הערכת התפשטות ואפופטוזיס, בהתאמה. שוב, לא זיהינו שינויים גסים בהתרבות ובאפופטוזיס במהלך תקופת התרבית של 6 ימים (איור 3). עם זאת, חלקם של תאים אפופטוטיים גדל עם הזמן במהלך תקופות גידול ממושכות כפי שנמדד על ידי צביעת קספז 3 שסוע. איור 4 מראה את העלייה ב-3 תאים חיוביים לקספז שסוע לאחר טיפוח PDAC ראשוני במשך 15 יום. איור 5 מראה את ההיסטופתולוגיה של גרורות פריטוניאליות של PDAC. ניסוי זה מדגים הטרוגניות תוך-סרטית גבוהה בין פרוסות בודדות לגבי תכולת הגידול/סטרומה, כמו גם אפופטוזיס טבעי שנמדד על ידי צביעת קספז 3 שסוע. לפיכך, הערכה היסטופתולוגית של OTSCs מתורבתים חשובה להערכת ארכיטקטורת הגידול/סטרומה והכדאיות של כל גידול מתורבת או גרורותיו.
איור 6 מראה את ההיסטופתולוגיה של גרורות PDAC בדופן הבטן. צביעת H&E וכן IHC עבור ציטוקרטין 7 הראו כי ה- OTSCs הנגזרים לא הכילו תאי גידול כלשהם, אלא כללו רק רקמת חיבור, שהייתה נמקית חלקית. החיסרון של טכנולוגיית OTSC הוא שלא ניתן להעריך רקמה טרייה, לא קבועה ולא קפואה עבור תכולת תאי הגידול שלה לפני הגידול.
בסך הכל, נתונים אלה מראים כי הארכיטקטורה הרב-תאית של הגידול והגרורות המתאימות לו, המורכבות מסוגי תאים נפרדים, משתקפות ב- OTSCs. במיוחד אינטראקציות גידול-סטרומה נשמרות.
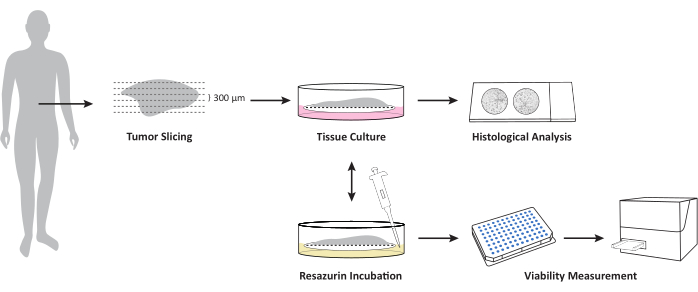
איור 1: סקירה כללית של תהליך העבודה לטיפוח OTSCs מדגימות טריות ולא קפואות של גידול/גרורות. דגימת הרקמה הטרייה והלא קפואה נחתכת באמצעות ויברטומה ומעובדת בממשק אוויר-נוזל על גבי תוספות תרבית תאי PTFE. ניתן למדוד את הכדאיות הכוללת בנקודות זמן מוגדרות על ידי בדיקת כדאיות רסזורין. בדיקה זו מאפשרת טיפוח נוסף לאחר מדידת כדאיות. הפרוסות קבועות פורמלין בנקודות זמן מוגדרות לבדיקה היסטופתולוגית נוספת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
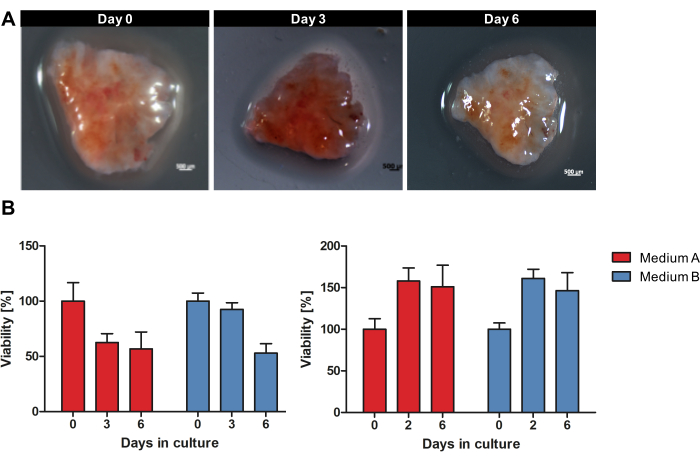
איור 2: מורפולוגיה מקרוסקופית וכדאיות של OTSCs במהלך הטיפוח. דגימת PDAC טופחה כ-OTSCs במשך 6 ימים. (A) המורפולוגיה המקרוסקופית של כל OTSC לא השתנתה באופן גס במהלך הטיפוח. עם זאת, גודל שטח הפנים של OTSCs ירד עם הזמן. (B) הכדאיות הכוללת כומתה על ידי בדיקת כדאיות רסזורין במדיום A ו-B. לעתים קרובות ניתן לראות ירידה בכדאיות לאחר יום 0 עקב הליך החתך וההתאמה לתנאי התרבית. עם זאת, ראינו גם עלייה בכדאיות כפי שמוצג באופן מופתי בפאנל הימני. כל לוח מייצג דגימת גידול בודדת עם יבולים שונים של תרביות פרוסות נגזרות (לוח שמאלי n = 10, לוח ימין n = 10). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: הערכה היסטופתולוגית של OTSCs לאחר זמן גידול כולל של 6 ימים. OTSCs (n = 6) גודלו בתרבית בינונית A. מורפולוגיה של רקמות הוערכה על ידי צביעת H&E. תאי הגידול והסטרומה הופלו על ידי IHC עבור ציטוקרטין 7 ווימנטין, בהתאמה. Ki-67 ו-cleaved caspase 3 הוכתמו לצורך הערכת התפשטות ואפופטוזיס, בהתאמה. לא נצפתה עלייה משמעותית באפופטוזיס במשך תקופת גידול כוללת של 6 ימים. כל סרגל קנה מידה מייצג 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: הערכה היסטופתולוגית של OTSCs לאחר זמן גידול כולל של 15 יום. OTSCs (n = 8) גודלו בתרבית בינונית A. מורפולוגיה של רקמות הוערכה על ידי צביעת H&E. תאי הגידול והסטרומה הופלו על ידי IHC עבור ציטוקרטין 7 ווימנטין, בהתאמה. Ki-67 ו-cleaved caspase 3 הוכתמו לצורך הערכת התפשטות ואפופטוזיס, בהתאמה. אפופטוזיס גדל באופן משמעותי לאחר 15 ימים של גידול, כפי שמודגם על ידי כתמי קספאז-3 שסוע. כל סרגל קנה מידה מייצג 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 5: הערכה היסטופתולוגית של OTSCs של גרורות פריטוניאליות של PDAC. OTSCs (n = 8) גודלו בתרבית בינונית A. מורפולוגיה של רקמות הוערכה על ידי צביעת H&E. תאי הגידול והסטרומה הופלו על ידי IHC עבור ציטוקרטין 7 ווימנטין, בהתאמה. Ki-67 ו-cleaved caspase 3 הוכתמו לצורך הערכת התפשטות ואפופטוזיס, בהתאמה. הערכה היסטופתולוגית גילתה רמה גבוהה של הטרוגניות תוך סרטנית בין פרוסות בודדות לגבי תכולת הגידול/סטרומה, כמו גם אפופטוזיס טבעי שנמדד על ידי צביעת קספז 3 שסוע. כל סרגל קנה מידה מייצג 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 6: הערכה היסטופתולוגית של OTSCs של גרורות PDAC בדופן הבטן. OTSCs (n = 5) גודלו בתרבית בינונית A. מורפולוגיה של רקמות הוערכה על ידי צביעת H&E. תאי הגידול והסטרומה הופלו על ידי IHC עבור ציטוקרטין 7 ווימנטין, בהתאמה. Ki-67 ו-cleaved caspase 3 הוכתמו לצורך הערכת התפשטות ואפופטוזיס, בהתאמה. הערכה היסטופתולוגית גילתה מחסור בתאי גידול בגרורות המתורבתות ונמק חלקי, שלא ניתן היה לקבוע לפני הגידול. כל סרגל קנה מידה מייצג 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
OTSCs של דגימות גידול טרי הם קירוב קרוב של הגידול באתרו. הם שומרים על המורפולוגיה הבסיסית שלהם, פעילות ההתרבות והמיקרו-סביבה שלהם במהלך הטיפוח לתקופה מוגדרת ותלויית רקמות 11,12,13. טכניקה זו מאפשרת יישום מיידי של הטיפול ברקמת גידול אנושית בת קיימא ex vivo וניתוחים במורד הזרם, כגון פרופיל של התמליל והפרוטאום. יתרון ספציפי של OTSCs הוא שניתן ליישם ניתוחים מפוענחים מרחבית במורד הזרם, כגון הדמיית MALDI, על רקמת גידול רב-תאית שלמה.
כאן אנו מתארים שיטה ליצירה, טיפוח והערכה היסטופתולוגית של OTSCs של PDAC וגרורותיו. נושא המפתח בטכניקה זו הוא לחתוך רקמות טריות ללא כל הליכי הקפאה וטיפוח בממשק אוויר-נוזל. מגבלה של שיטה זו היא שלא ניתן להעריך רקמה טרייה, לא קבועה ולא קפואה לגבי תכולת תאי הגידול שלה לפני הגידול. כפי שמודגם בתוצאות שלנו, OTSCs עשויים להתגלות כמורכבים מרכיבי רקמה שאינם צפויים מקטעים מהירים של דגימות אחרות מאותו גידול. הערכה היסטופתולוגית של OTSCs לאחר טיפוח היא הכרחית להערכת נתונים של תרביות פרוסות בודדות. בדיקת הכדאיות המתוארת מאפשרת רק הערכה כללית של הכדאיות הכוללת של כל OTSC. באופן כללי, השיטה המתוארת יכולה להיות מיושמת בכל מעבדה מצויד vibratome יחידת תרבית רקמות. בשל הפשטות של טכניקה זו, ניתן לשנות אותה בקלות כלפי גידולים שונים ושאלות מחקר.
מתודולוגיות רבות פותחו לתרבית רקמת גידול אנושית ex vivo, למשל, קווי תאים ראשוניים, אורגנואידים שמקורם במטופל וקסנוגרפטים. עם זאת, השימוש בהם לפיתוח תרופות ולזיהוי סמנים ביולוגיים מנבאים נותר מוגבל בעיקר בשל אובדן הקשר הרקמה, כלומר אינטראקציה של סטרומה ותאי גידול2.
למרות שהשיטה המוצגת של הקמת תרבית פרוסות אורגנוטיפית משמרת את ארכיטקטורת הרקמה הרב-תאית, יש לקחת בחשבון מספר מגבלות. ראשית, יש לקחת בחשבון מידה ניכרת של הטרוגניות (תוך) גידולית. OTSCs מובחנים הנגזרים מביופסיה של גידול בודד עשויים להראות שינויים ניכרים בפרופורציות שלהם של תאי הגידול והסטרומה. מלבד איכות הרקמה הכוללת, זו עשויה להיות אחת הסיבות לכדאיות שונה של פרוסות במהלך התרבית. שנית, המדיום לתנאי תרבית אופטימליים עשוי להשתנות בהתאם לרקמה ולמטופל. השווינו בין שני אמצעי תרבית רקמה שונים: הראשון מבוסס על DMEM/F12 (בינוני A) והשני מבוסס על RPMI (בינוני B). כל דגימה של גידולים ראשוניים או גרורות שלה עשויה לדרוש שינויים. שלישית, נמק הגידול עלול להתרחש כבר באתרו16 ואינו נובע בהכרח מתנאי תרבית לא מספיקים של OTSCs. השוואה עם היסטופתולוגיה של הגידול הראשוני יש לשקול.
הקמת OTSCs כמתואר בפרוטוקול זה מספקת הזדמנות לבחון את תגובת הטיפול מיד לאחר הניתוח במערכת מודל ex vivo המשמרת את המיקרו-סביבה של הגידול. באופן פרוספקטיבי, OTSCs יאפשרו פיתוח אסטרטגיות טיפוליות אישיות להתאמה אישית של הטיפול במחלה גרורתית.
Disclosures
המחברים לא חשפו ניגודי עניינים פוטנציאליים.
Acknowledgements
ר. בראון נתמך על ידי בית הספר למדען קליני ליבק (DFG #413535489) ותוכנית מימון הצעירים של אוניברסיטת ליבק.
Materials
| Name | Company | Catalog Number | Comments |
| Advanced DMEM/F-12 Medium | Gibco | 12634028 | |
| Agarose Low Melt | Roth | 6351.2 | 8% in Ringer solution |
| Antibody Diluent, Background Reducing | Dako | S3022 | |
| AquaTex | Merck | 108562 | |
| Bioethanol (99%, denatured) | CHEMSolute | 2,21,19,010 | |
| Citric Acid monohydrate | Sigma Aldrich | C7129 | |
| Cleaved Caspase-3 (Asp175) (5A1E) Rabbit mAb | Cell Signalling Technology | 9664 | 1:400 dilution |
| Derby Extra Double Edge Safety Razor Blades | Derby Tokai | ||
| Embedding cassettes | Roth | H579.1 | |
| Eosin Y-solution 0,5% aqueous | Merck | 10,98,44,100 | |
| Eukitt Quick hardening mounting medium | Sigma-Aldrich | 3989 | |
| Fetal bovine serum | Gibco | 10270106 | |
| Formaldehyde solution 4,5%, buffered | Büfa Chemikalien | B211101000 | |
| Hem alum solution acid acc. to Mayer | Roth | T865 | |
| Human EGF | Milteniy Biotec | 130-097-794 | |
| Hydrocortisone | Sigma Aldrich (Merck) | H0888 | |
| Hydrogen peroxide 30% | Merck | 1,08,59,71,000 | |
| Insulin human | Sigma Aldrich (Merck) | 12643 | |
| Liquid DAB+ Substrate Chromogen System | Dako | K3468 | |
| MACS Tissue Storage Solution | Milteniy Biotech | 130-100-008 | |
| Methanol | Merck | 10.600.092.500 | |
| Microscope Slides Superfrost Plus | Thermo Scientific | J1800AMNZ | |
| Millicell Cell Culture Insert, 30 mm, hydrophilic PTFE, 0.4 µm | Millipore (Merck) | PICM0RG50 | |
| Monoclonal mouse anti-human Cytokeratin 7 (Clone OV-TL 12/30) | Dako | M7018 | 1:200 dilution |
| Monoclonal mouse anti-human Ki67 Clone MIB-1 | Dako | M7240 | 1:200 dilution |
| Monoclonal mouse Anti-vimentin (Clone V9) | Dako | M0725 | 1:200 dilution |
| Negative control Mouse IgG2a | Dako | X0943 | 1:200 dilution |
| Negative control Mouse IgG1 | Dako | X093101-2 | 1:200 dilution |
| Paraffin (melting temperature 56°- 58°) | Merck | 10,73,37,100 | |
| Penicillin-Streptomycin (10.000 U/ml) | Gibco | 15140122 | |
| PBS pH 7,4 (1x) Flow Cytometry Grade | Gibco | A12860301 | |
| Resazurin sodium salt; 10 mg/ml in PBS | Sigma Aldrich | R7017 | 1:250 dilution |
| Ringer's solution | Fresenius Kabi | 2610813 | |
| RPMI-1640 Medium | Sigma Aldrich (Merck) | R8758 | |
| Tissue culture testplate 6 | TPP | 92006 | |
| Triton X-100 | Sigma Aldrich | 9002-93-1 | |
| VECTASTAIN Elite ABC-Peroxidase Kit | Vector Laboratories | PK-6200 | |
| Xylene (extra pure) | J.T.Baker | 8,11,85,000 | |
| Equipment | |||
| ClarioStar Microplate Reader | BMG Labtech | ||
| Paraffin Embedding Center E61110 | Leica | ||
| Rotary Microtome Microm HM355S | Thermo Scientific | ||
| Section Transfer System Microm STS | Thermo Scientific | ||
| VT 1200S Vibratom | Leica |
References
- Nevala-Plagemann, C., Hidalgo, M., Garrido-Laguna, I. From state-of-the-art treatments to novel therapies for advanced-stage pancreatic cancer. Nature Reviews. Clinical Oncology. 17 (2), 108-123 (2020).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- Waghray, M., Yalamanchili, M., di Magliano, M. P., Simeone, D. M. Deciphering the role of stroma in pancreatic cancer. Current Opinion in Gastroenterology. 29 (5), 537-543 (2013).
- Hwang, R. F., et al. Cancer-associated stromal fibroblasts promote pancreatic tumor progression. Cancer Research. 68 (3), 918-926 (2008).
- Jiang, X., et al. Long-lived pancreatic ductal adenocarcinoma slice cultures enable precise study of the immune microenvironment. Oncoimmunology. 6 (7), 1333210 (2017).
- Hessmann, E., et al. Fibroblast drug scavenging increases intratumoural gemcitabine accumulation in murine pancreas cancer. Gut. 67 (3), 497-507 (2018).
- Feig, C., et al. The pancreas cancer microenvironment. Clinical Cancer Research. 18 (16), 4266-4276 (2012).
- Koerfer, J., et al. Organotypic slice cultures of human gastric and esophagogastric junction cancer. Cancer Medicine. 5 (7), 1444-1453 (2016).
- Gerlach, M. M., et al. Slice cultures from head and neck squamous cell carcinoma: a novel test system for drug susceptibility and mechanisms of resistance. British Journal of Cancer. 110 (2), 479-488 (2014).
- Holliday, D. L., et al. The practicalities of using tissue slices as preclinical organotypic breast cancer models. Journal of Clinical Pathology. 66 (3), 253-255 (2013).
- Vaira, V., et al. Preclinical model of organotypic culture for pharmacodynamic profiling of human tumors. Proceedings of the National Academy of Sciences of the United States of America. 107 (18), 8352-8356 (2010).
- Lim, C. Y., et al. Organotypic slice cultures of pancreatic ductal adenocarcinoma preserve the tumor microenvironment and provide a platform for drug response. Pancreatology. 18 (8), 913-927 (2018).
- Brandenburger, M., et al. Organotypic slice culture from human adult ventricular myocardium. Cardiovascular Research. 93 (1), 50-59 (2012).
- Misra, S., et al. Ex vivo organotypic culture system of precision-cut slices of human pancreatic ductal adenocarcinoma. Science Reports. 9 (1), 2133 (2019).
- O'Brien, J., Wilson, I., Orton, T., Pognan, F. Investigation of the Alamar Blue (resazurin) fluorescent dye for the assessment of mammalian cell cytotoxicity. European Journal of Biochemistry. 267 (17), 5421-5426 (2000).
- Beutler, B., Cerami, A. Tumor necrosis, cachexia, shock, and inflammation: a common mediator. Annual Review of Biochemisty. 57, 505-518 (1988).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved