Method Article
Culturas de fatias organotípicas como modelos pré-clínicos de microambiente tumoral em câncer de pâncreas primário e metástase
Neste Artigo
Resumo
Este protocolo descreve a preparação de culturas de fatias organotípicas (OTSCs). Esta técnica facilita o cultivo ex vivo de tecido multicelular intacto. As OTSCs podem ser usadas imediatamente para testar sua respectiva resposta a medicamentos em um ambiente multicelular.
Resumo
Modelos pré-clínicos realistas de câncer de pâncreas primário e metástase são urgentemente necessários para testar a resposta à terapia ex vivo e facilitar o tratamento personalizado do paciente. No entanto, a ausência de microambiente específico do tumor nos modelos usados atualmente, por exemplo, linhagens celulares derivadas de pacientes e xenoenxertos, permite apenas insights preditivos limitados. As culturas de fatias organotípicas (OTSCs) compreendem tecido multicelular intacto, que pode ser rapidamente usado para o teste de resposta a medicamentos espacialmente resolvido.
Este protocolo descreve a geração e o cultivo de fatias tumorais viáveis de câncer de pâncreas e suas metástases. Resumidamente, o tecido é fundido em agarose de baixa fusão e armazenado em tampão isotônico frio. Em seguida, fatias de tecido de 300 μm de espessura são geradas com um vibratome. Após a preparação, as fatias são cultivadas em uma interface ar-líquido usando insertos de cultura de células e um meio de cultivo apropriado. Durante o cultivo, as mudanças na diferenciação e viabilidade celular podem ser monitoradas. Além disso, essa técnica permite a aplicação do tratamento a tecidos tumorais humanos viáveis ex vivo e análises subsequentes a jusante, como perfil de transcriptoma e proteoma.
As OTSCs oferecem uma oportunidade única para testar a resposta individual ao tratamento ex vivo e identificar perfis transcriptômicos e proteômicos individuais associados à respectiva resposta de fatias distintas de um tumor. As OTSCs podem ser exploradas para identificar estratégias terapêuticas para personalizar o tratamento do câncer de pâncreas primário e metástase.
Introdução
Os modelos pré-clínicos existentes de adenocarcinoma ductal pancreático (PDAC) e respectivas metástases são preditores fracos de resposta ao tratamento em pacientes, o que é uma grande desvantagem no desenvolvimento de medicamentos e na identificação de biomarcadores preditivos1. Embora modelos como organoides derivados de pacientes e xenoenxertos derivados de pacientes sejam promissores, seu uso permanece limitado2. As principais limitações desses modelos in vitro são a falta do microambiente tumoral e o xenoenxerto em espécies imunocomprometidas não humanas. Especialmente no PDAC e suas metástases, o microambiente tumoral ganhou consideravelmente interesse nos últimos anos devido às suas funções cruciais na biologia tumoral. É composto por componentes celulares e acelulares, como (mio)fibroblastos, células estreladas pancreáticas, células imunes, vasos sanguíneos, matriz extracelular, citocinas e fatores de crescimento3. Esse microambiente não é um componente tumoral não funcional, mas induz progressão tumoral e metástase e parece contribuir substancialmente para a resistência à rádio e quimioterapia4. O microambiente PDAC não apenas compromete mecanicamente a entrega de medicamentos, mas também possui atividade imunológica e de eliminação de medicamentos 5,6,7. Assim, modelos pré-clínicos que reflitam a complexa interação das células tumorais e do microambiente tumoral são urgentemente necessários para testar adequadamente a resposta ao tratamento ex vivo dos pacientes e orientar o tratamento clínico individualizado.
Culturas ex vivo de amostras frescas de tumores representam uma aproximação do tumor in situ. Culturas de fatias organotípicas (OTSCs) foram recentemente desenvolvidas e estudadas para vários tumores, como câncer de cabeça, pescoço, mama, próstata, pulmão, cólon e pâncreas 8,9,10,11,12. Foi demonstrado que as OTSCs mantêm sua morfologia basal, atividade proliferativa e microambiente durante o cultivo por um período definido e dependente do tecido 11,12,13. As OTSCs de PDACs mantiveram sua viabilidade, morfologia e a maioria dos componentes de seu microambiente tumoral por 4-9 dias em vários estudos in vitro 5,12,14. Perspectiva, essa técnica permite uma aplicação imediata do tratamento ao tecido tumoral humano viável ex vivo e análises subsequentes a jusante, como o perfil do transcriptoma e do proteoma.
O estabelecimento de OTSCs oferece uma oportunidade única para testar a resposta ao tratamento ex vivo imediatamente após a cirurgia. Assim, as OTSCs permitirão identificar prospectivamente estratégias terapêuticas para personalizar o tratamento da doença metastática. Este protocolo descreve a geração e o cultivo de OTSCs viáveis de câncer de pâncreas.
Protocolo
As amostras de tecido foram coletadas e processadas após aprovação pelo comitê de ética local da Universidade de Lübeck (# 16-281).
1. Coleta e manuseio de tecidos frescos
NOTA: Cada amostra de tecido humano não fixada deve ser manuseada com cautela para evitar o risco de infecção por patógenos transmitidos pelo sangue. Todos os pacientes devem ser testados para serem negativos para HIV, HBV e HCV antes do processamento do tecido. Use um casaco protetor e manuseie amostras de tecido humano com luvas.
- Colete amostras de tecido PDAC frescas, não fixadas e descongeladas com um tamanho mínimo de 0,4 x 0,4 cm imediatamente após a cirurgia e transporte a amostra para o laboratório em uma solução de armazenamento de tecidos.
- Quando possível, processe o tecido fresco imediatamente.
- Em alternativa, conservar os tecidos em solução de armazenamento de tecidos em gelo húmido a 4 °C durante a noite. No entanto, o armazenamento de tecidos pode resultar em viabilidade prejudicada e geralmente deve ser evitado.
2. Preparação
- Preparação de agarose de baixo ponto de fusão
- Prepare 100 ml de acarose de baixo ponto de fusão (8%) dissolvendo 8 g de agarose em 100 ml de solução de Ringer pré-aquecida e conserve-a a 4 °C até ser necessário.
- Após o anúncio da ressecção do tumor, derreta a agarose no micro-ondas.
- Colocar a agarose num banho-maria pré-aquecido (37 °C) para que arrefeça até às temperaturas fisiológicas antes da preparação.
- Configuração do vibratome
- Coloque uma lâmina de barbear no suporte do vibratomo e execute um ajuste de ângulo automatizado de acordo com as instruções do fabricante, se aplicável.
- Resfrie a camisa da câmara de corte usando uma unidade de resfriamento ou gelo úmido.
- Encha a câmara de corte com aproximadamente 100 mL de uma solução de corte fisiológica (por exemplo, solução de Ringer).
- Coloque a lâmina de barbear montada na solução de corte pré-resfriada, permitindo que a lâmina de barbear esfrie.
3. Incorporação de tecido em agasse de baixo ponto de fusão
- Lave a amostra de tecido com PBS resfriado (4 ° C) e coloque o tecido em PBS em uma placa de Petri grande (~ 14 cm) no gelo.
- Remova o excesso de tecido conjuntivo macroscopicamente visível no gelo usando um bisturi, pois isso pode impedir a eficiência do corte.
- Coloque o tecido em uma pequena placa de Petri (~ 3 cm).
- Ajuste a orientação do tecido para que o tecido conjuntivo macroscopicamente visível restante tenha a mesma orientação que o plano do fundo da placa de Petri. O fundo da placa de Petri tem a mesma orientação que o plano de corte.
- Despeje a agarose de baixo ponto de fusão preparada na pequena placa de Petri.
- Reajuste a orientação do tecido, se necessário, usando uma pinça.
- Coloque a placa de Petri no gelo úmido para um endurecimento mais rápido da agarose.
- Corte cuidadosamente o tecido usando um bisturi, deixando pelo menos 5 mm ao redor da agarose de cada lado do tecido.
- Transfira cuidadosamente o tecido embutido e cole-o no porta-amostras usando super cola.
- Após alguns segundos, coloque o porta-amostras na câmara de corte.
- Ajuste a orientação do tecido em direção à lâmina de barbear, se necessário.
4. Corte do tecido embebido em agarose usando um vibratomo
- Defina os limites externos da faixa de corte (eixo y) de acordo com o tamanho da amostra de tecido.
- Ajuste a lâmina em direção ao topo do bloco de tecido.
- Defina a velocidade de corte para 0,04 mm/s, a amplitude de corte para 1 mm e a espessura do corte para 300 μm.
- Corte cuidadosamente as primeiras fatias e transfira-as para um recipiente separado com solução de corte pré-resfriada (4 °C) em gelo úmido.
5. Cultura de culturas organotípicas de fatias
- Prepare uma placa de 6 poços com 1 mL do meio de cultivo apropriado por poço.
- Médio A: DMEM/F12 avançado, 10% FBS, 1% Penicilina/Estreptomicina.
- Médio B: RPMI 1640, 10% FBS, 1% Penicilina/Estreptomicina, 4 μg/mL de insulina, 8 ng/mL EGF, 0,3 μg/mL de hidrocortisona.
NOTA: O meio para condições ideais de cultura pode variar dependendo do tecido e do paciente. Dois meios de cultura de tecidos distintos foram comparados, um baseado em DMEM/F12 (meio A), o segundo baseado em RPMI (meio B). Não foram detectadas diferenças substanciais entre esses meios. Para todos os experimentos apresentados neste protocolo, foi utilizado o meio A.
- Coloque a placa de 6 poços com o meio em uma incubadora, permitindo que a temperatura e o pH se ajustem antes do cultivo.
- Coloque fatias em insertos de cultura de células (por exemplo, insertos de PTFE hidrofílico com tamanho de poro de 0,4 μm) usando um filtro de observação.
- Remova qualquer excesso de solução de corte colocando o filtro carregado em um pano estéril.
- Coloque o filtro carregado na placa de 6 poços preparada. Não adicione nenhum meio adicional à inserção.
- Coloque a placa de 6 poços em uma incubadora (37 °C, 5% CO2).
- Troque o meio a cada 2 dias repetindo as etapas 5.1, 5.2 e 5.5 com uma nova placa de 6 poços.
NOTA: As culturas de fatias organotípicas podem ser cultivadas por vários períodos, dependendo da questão de pesquisa individual.
6. Ensaio de viabilidade de resazurina
NOTA: O ensaio de viabilidade da resazurina mede a atividade metabólica geral das culturas de fatias organotípicas com base na redução da resazurina azul não fluorescente em resorufina fluorescente vermelha em células vivas15. O ensaio não tem efeitos tóxicos nas células e pode ser aplicado às culturas repetidamente, dependendo da questão de pesquisa individual. A viabilidade foi medida usando o ensaio de resazurina a cada 2-3 dias.
- Preparação da solução-mãe de resazurina
- Apague a luz do exaustor estéril, pois a solução estoque de resazurina é sensível à luz.
- Prepare uma solução estoque com 10 mg/mL de sal de resazurina sódica em 1x PBS.
- Conservar a solução-mãe em alíquotas protegidas contra a luz a 4 °C no frigorífico até à utilização.
- Avaliação da viabilidade geral da fatia
- Apague a luz do exaustor estéril, pois a solução estoque de resazurina é sensível à luz.
- Diluir a solução-mãe de resazurina 1:250 com um meio apropriado.
NOTA: O meio usado para diluição deve ser o mesmo usado para cultivo (meio A ou meio B). - Prepare 1 mL da solução final de resazurina por fatia e adicione mais 1 mL para o controle em branco, por exemplo, para 6 fatias, dilua 28 μL de solução estoque de resazurina em 7 mL de meio.
- Dispense a solução de resazurina em placas de 6 poços, com 1 mL da solução diluída de resazurina por poço.
- Transferir os filtros de cultura com as fatias para os poços com a solução de resazurina. Um poço com a solução de resazurina é mantido vazio como controle em branco.
NOTA: Para simplificar o procedimento experimental, esta etapa pode ser combinada com a troca do meio (etapa 5.7). No entanto, caso sejam necessárias medições adicionais de viabilidade, o ensaio pode ser feito a qualquer momento durante o cultivo das culturas em fatias. - Coloque as fatias de tecido em uma estufa por 1 h a 37 ° C e 5% de CO2.
- Prepare novas placas de 6 poços com o meio de cultura se a cultura de fatias for continuada (consulte as etapas 5.1 e 5.2).
- Remova os filtros de cultivo com as fatias da solução de resazurina e remova o excesso de solução colocando o filtro carregado em um pano estéril.
- Transfira os filtros de cultivo com as fatias para a placa de cultura previamente preparada.
- De cada 6 poços, pegue 100 μL de solução de resazurina e transfira-os para uma placa de 96 poços. A partir do controle em branco, coloque três amostras (3 x 100 μL) em poços separados da placa de 96 poços.
- Quantifique a extinção com um fotômetro de placa de acordo com as instruções do fabricante. O comprimento de onda de excitação é definido para 545 nm e o comprimento de onda de emissão é definido para 600 nm.
7. Fixação de formalina e incorporação de parafina de OTSCs
- Transfira cuidadosamente as fatias de tecido cultivado para um de incorporação de plástico. Para fazer isso, siga as etapas abaixo.
- Coloque o filtro de cultivo com a fatia montada em uma placa de Petri.
- Com um bisturi, corte cuidadosamente a membrana do filtro com a fatia de tecido montada.
- Transfira cuidadosamente a membrana do filtro com a fatia montada para um saco de náilon de biópsia e coloque-o em um de incorporação.
- Em seguida, transfira os de incorporação de plástico em um recipiente com formalina a 4,5% pré-resfriada (4 ° C). As fatias podem ser mantidas em solução de formalina a 4 °C até nova utilização, mas devem ser incubadas durante, pelo menos, 24 h.
NOTA: Os OTSCs precisam ser transferidos com muito cuidado, pois se despedaçam facilmente.
- Enxágue cuidadosamente a cultura de fatias fixadas em formalina com água corrente da torneira por 1,5 h.
- Desidratar a fatia de tecido fixada em formalina por incubação em etanol 70% (2x por 3 h), etanol 95% (1x durante a noite, 1x por 3 h), seguido de etanol absoluto (1x por 3 h, 1x por noite).
- Limpar a fatia de tecido fixada em formalina por 3 h de incubação em xileno duas vezes.
- Mergulhe o tecido com parafina a 60 °C (1x durante a noite, 1x por 2 h). Incorpore o tecido em um bloco de parafina em um molde de incorporação de tecido.
- Corte o bloco de tecido embebido em parafina com 4 μm de espessura com um micrótomo e flutue em banho-maria a 40 °C contendo água destilada. Transfira as seções para lâminas de vidro.
- Incubar secções de parafina durante 1 h a 60 °C para unir o tecido ao vidro. Incubar as lâminas durante a noite a 37 °C.
8. Coloração de hematoxilina e eosina (H&E)
- Desparafinize as seções da etapa 7.7 por incubação em xileno (3x por 5 min).
- Reidrate por incubação em álcool absoluto (2x por 5 min), álcool 95% (2x por 5 min) e álcool 70% (1x por 5 min). Enxágüe brevemente com água destilada.
- Manchar em solução de hematoxilina de Mayer por 5 min. Enxágue com água corrente da torneira por 10 min.
- Contracoloração em solução de eosina a 0,5% por 40 s. Enxágüe com água destilada.
- Desidratar por incubação em álcool 70% (máximo 1 min), etanol 95% (2x por 3 min) e álcool absoluto (2x por 3 min), respectivamente.
- Limpe em três trocas de xileno (alguns segundos cada). Coloque uma gota de meio de montagem e cubra as lâminas com uma lamínula.
9. Imuno-histoquímica de OTSCs
- Desparafinizar seções por incubação em xileno 2x por 10 min, seguido de etanol/xilol 1:1 por 10 min.
- Transfira as lâminas para 100% de etanol (2x por 3 min), 96% de etanol (2x por 3 min), 70% de etanol (1x por 3 min) e depois para 50% de etanol (1x por 3 min).
- Realize a recuperação do antígeno para desmascarar o epítopo antigênico. Aqueça as lâminas em um micro-ondas em tampão de citrato por 5 min a 900 W, seguido de 2x por 8 min a 600 W. Deixe as lâminas esfriarem até a temperatura ambiente por 20 min.
- Lave em PBS 3x por 3 min em uma coqueteleira.
- Realize a permeabilização das membranas celulares por incubação em 0,1% Triton X-100 em PBS (200 μL por lâmina) em uma câmara umidificada à temperatura ambiente por 10 min.
- Lave em PBS por três trocas, 3 min cada na coqueteleira.
- Incubar seções com solução de 3% de H2O2 em metanol (200 μL por lâmina) em uma câmara umidificada em temperatura ambiente por 10 min para bloquear a atividade da peroxidase endógena.
- Lave em PBS 3x por 3 min em uma coqueteleira.
- Adicione 200 μL de tampão de bloqueio (soro de cavalo 1:50 em PBS) e incube em uma câmara umidificada em temperatura ambiente por 25 min.
- Drene o tampão de bloqueio das lâminas inclinando a lâmina sobre um lenço de papel.
- Aplicar 200 μL de anticorpo primário adequadamente diluído em diluente de anticorpos nas lâminas e incubar em uma câmara umidificada a 4 °C durante a noite. Como controlo negativo, utilizar a isoforma apropriada de imunoglobulinas de ratinho com a mesma diluição que o anticorpo primário.
- Lave 3x por 3 min em PBS em uma coqueteleira.
- Aplique 200 μL de anticorpo secundário biotinilado (solução 1:50 em PBS) nas lâminas e incube em uma câmara umidificada em temperatura ambiente por 30 min.
- Lave 3x por 3 min em PBS em uma coqueteleira.
- Prepare o complexo de peroxidase à base de avidina/biotina de acordo com as instruções do fabricante antes da aplicação. Aplicar 200 μL de complexo avidina-biotina-peroxidase nas lâminas e incubar em câmara umidificada em temperatura ambiente por 30 min.
- Lave 3x por 3 min em PBS em uma coqueteleira.
- Aplicar 200 μL de solução de substrato DAB (recém-feita diretamente antes do uso: 1 gota de DAB em 1 mL de substrato), 200 μL por lâmina. Deixe o desenvolvimento da cor de 1 a 3 minutos até que a intensidade de cor desejada seja atingida.
- Enxágue com água corrente da torneira por 10 min.
- Contra-core as lâminas imergindo os lados em Hematoxilina por 5 min.
- Enxágue com água corrente da torneira por 10 min.
- Cubra as lâminas usando meio de montagem aquoso e lamínulas. As corrediças montadas podem ser armazenadas permanentemente à temperatura ambiente.
Resultados
A Figura 1 fornece uma visão geral do fluxo de trabalho para cultivar OTSCs de tecido tumoral fresco e descongelado. Amostras de PCACs primárias e metástases foram coletadas diretamente após a ressecção cirúrgica e armazenadas durante a noite em gelo úmido a 4 °C na solução de armazenamento de tecido. Os espécimes foram processados e as fatias foram cultivadas conforme descrito no protocolo. A morfologia macroscópica de cada OTSC não mudou macroscopicamente durante o cultivo. No entanto, o tamanho da área de superfície das OTSCs diminuiu ao longo do tempo, conforme mostrado exemplarmente na Figura 2A durante o cultivo por 6 dias. A viabilidade geral do OTSC foi avaliada pelo ensaio de viabilidade da resazurina nos dias 0, 2/3 e 6 (Figura 2B). O ensaio de viabilidade da resazurina mede a atividade metabólica geral do OTSC com base na redução da resazurina azul não fluorescente em resorufina fluorescente vermelha em células vivas15. A Figura 2B mostra a comparação da viabilidade medida pela redução da resazurina após o cultivo de OTSCs de dois tumores primários representativos em dois meios diferentes. As OTSCs foram cultivadas em meio A (DMEM/F12 avançado, 10% FBS, 1% Penicilina/Estreptomicina) ou meio B (RPMI 1640, 10% FBS, 1% Penicilina/Estreptomicina, 4 μg/mL de Insulina, 8 ng/mL EGF, 0,3 μg/mL de hidrocortisona), o que resultou em viabilidade geral semelhante, independentemente do meio de cultura. É importante notar que uma diminuição na viabilidade após o dia 0 pode ser observada com frequência e é esperada devido ao procedimento de fatiamento e ajuste às condições de cultivo. No entanto, também observamos aumento da viabilidade, como mostrado exemplarmente no painel direito (Figura 2B).
Após períodos definidos de cultivo em meio A, as OTSCs foram fixadas em formol para posterior caracterização imuno-histológica (IHQ). Após a fixação em formalina, as OTSCs foram embebidas em parafina e seccionadas. Os cortes corados com H&E mostraram que a estrutura geral do tecido foi preservada durante todo o tempo de cultivo ex vivo (Figura 3). As células tumorais e estroma foram discriminadas por IHQ para citoqueratina 7 e vimentina, respectivamente. Nenhuma mudança substancial na relação tumor/estroma foi detectada durante o cultivo.
A avaliação histopatológica microscópica das seções de H & E não revelou um aumento substancial na necrose de todos os tecidos cultivados durante o cultivo (Figura 3, Figura 4, Figura 5). Além disso, Ki-67 e caspase clivada 3 foram corados para avaliação de proliferação e apoptose, respectivamente. Novamente, não detectamos alterações macroscópicas de proliferação e apoptose durante o período de cultura de 6 dias (Figura 3). No entanto, a proporção de células apoptóticas aumenta ao longo do tempo durante longos períodos de cultivo, conforme medido pela coloração de caspase 3 clivada. A Figura 4 mostra o aumento de células positivas para caspase 3 clivada após o cultivo de um PDAC primário por 15 dias. A Figura 5 mostra a histopatologia de uma metástase peritoneal de um PDAC. Este experimento demonstra uma alta heterogeneidade intratumoral entre fatias individuais em relação ao conteúdo tumor/estroma, bem como apoptose natural medida pela coloração de caspase 3 clivada. Portanto, a avaliação histopatológica das OTSCs cultivadas é importante para a avaliação da arquitetura tumor/estroma e viabilidade de cada tumor cultivado ou de sua metástase.
A Figura 6 mostra a histopatologia de uma metástase de ACPD da parede abdominal. A coloração de H & E, bem como a IHC para citoqueratina 7, mostraram que as OTSCs derivadas não continham células tumorais, mas consistiam apenas em tecido conjuntivo, que era parcialmente necrótico. Uma desvantagem da tecnologia OTSC é que o tecido fresco, não fixado e descongelado não pode ser avaliado quanto ao seu conteúdo de células tumorais antes do cultivo.
No geral, esses dados demonstram que a arquitetura multicelular de um tumor e suas respectivas metástases, compreendendo tipos celulares distintos, são refletidas nas OTSCs. Particularmente, as interações tumor-estroma são preservadas.
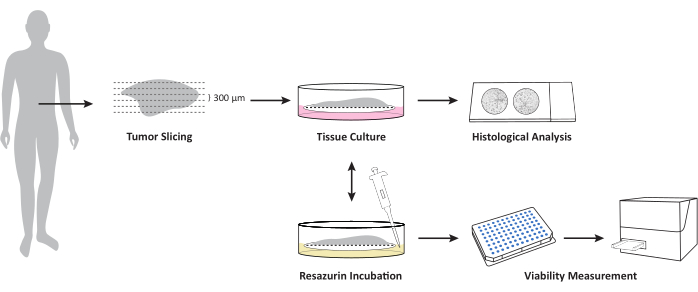
Figura 1: Visão geral sobre o fluxo de trabalho para cultivo de OTSCs a partir de amostras de tumor/metástase de tecido fresco e descongelado. A amostra de tecido fresco e descongelado é seccionada usando um vibratomo e cultivada na interface ar-líquido em inserções de cultura de células de PTFE. A viabilidade geral pode ser medida em pontos de tempo definidos pelo ensaio de viabilidade da resazurina. Este ensaio permite um cultivo posterior após a medição da viabilidade. Os cortes são fixados em formalina em pontos de tempo definidos para exame histopatológico adicional. Clique aqui para ver uma versão maior desta figura.
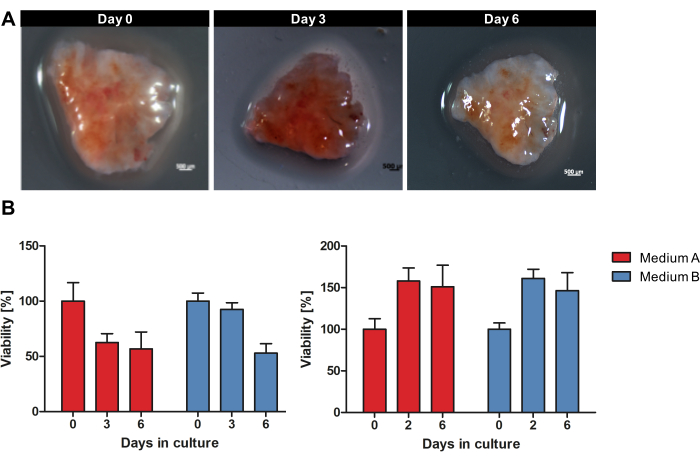
Figura 2: Morfologia macroscópica e viabilidade de OTSCs durante o cultivo. Um espécime PDAC foi cultivado como OTSCs por 6 dias. (A) A morfologia macroscópica de cada OTSC não mudou grosseiramente durante o cultivo. No entanto, o tamanho da área de superfície das OTSCs diminuiu ao longo do tempo. (B) A viabilidade global foi quantificada pelo ensaio de viabilidade da resazurina nos meios A e B. Uma diminuição na viabilidade pode ser frequentemente observada após o dia 0 devido ao procedimento de corte e ajuste às condições de cultura. No entanto, também observamos aumentos de viabilidade, conforme mostrado exemplarmente no painel direito. Cada painel representa uma amostra de tumor individual com diferentes rendimentos de culturas de fatias derivadas (painel esquerdo n = 10, painel direito n = 10). Clique aqui para ver uma versão maior desta figura.

Figura 3: Avaliação histopatológica das OTSCs após um tempo total de cultivo de 6 dias. As OTSCs (n = 6) foram cultivadas em meio A. A morfologia do tecido foi avaliada pela coloração H&E. As células tumorais e estroma foram discriminadas por IHQ para citoqueratina 7 e vimentina, respectivamente. Ki-67 e caspase clivada 3 foram corados para avaliação de proliferação e apoptose, respectivamente. Nenhum aumento substancial na apoptose foi observado durante um período total de cultivo de 6 dias. Cada barra de escala representa 100 μm. Clique aqui para ver uma versão maior desta figura.

Figura 4: Avaliação histopatológica das OTSCs após um tempo total de cultivo de 15 dias. As OTSCs (n = 8) foram cultivadas em meio A. A morfologia do tecido foi avaliada pela coloração H&E. As células tumorais e estroma foram discriminadas por IHQ para citoqueratina 7 e vimentina, respectivamente. Ki-67 e caspase clivada 3 foram corados para avaliação de proliferação e apoptose, respectivamente. A apoptose aumentou substancialmente após 15 dias de cultivo, como exemplificado pela coloração com caspase-3 clivada. Cada barra de escala representa 100 μm. Clique aqui para ver uma versão maior desta figura.

Figura 5: Avaliação histopatológica das OTSCs de uma metástase peritoneal de um PDAC. As OTSCs (n = 8) foram cultivadas em meio A. A morfologia do tecido foi avaliada pela coloração H&E. As células tumorais e estroma foram discriminadas por IHQ para citoqueratina 7 e vimentina, respectivamente. Ki-67 e caspase clivada 3 foram corados para avaliação de proliferação e apoptose, respectivamente. A avaliação histopatológica revelou um alto grau de heterogeneidade intratumoral entre cortes individuais em relação ao conteúdo tumor/estroma, bem como apoptose natural medida pela coloração de caspase 3 clivada. Cada barra de escala representa 100 μm. Clique aqui para ver uma versão maior desta figura.

Figura 6: Avaliação histopatológica das CTOs de uma metástase PDAC da parede abdominal. As OTSCs (n = 5) foram cultivadas em meio A. A morfologia do tecido foi avaliada pela coloração H&E. As células tumorais e estroma foram discriminadas por IHQ para citoqueratina 7 e vimentina, respectivamente. Ki-67 e caspase clivada 3 foram corados para avaliação de proliferação e apoptose, respectivamente. A avaliação histopatológica revelou a ausência de células tumorais na metástase cultivada e necrose parcial, que não pôde ser determinada antes do cultivo. Cada barra de escala representa 100 μm. Clique aqui para ver uma versão maior desta figura.
Discussão
As OTSCs de amostras de tumor fresco são uma aproximação do tumor in situ. Eles mantêm sua morfologia basal, atividade proliferativa e microambiente durante o cultivo por um período definido e dependente do tecido 11,12,13. Esta técnica permite a aplicação imediata do tratamento ao tecido tumoral humano viável ex vivo e análises subsequentes a jusante, como o perfil do transcriptoma e do proteoma. Uma vantagem específica das OTSCs é que análises a jusante espacialmente resolvidas, como a imagem MALDI, podem ser aplicadas ao tecido tumoral multicelular intacto.
Aqui descrevemos um método para a geração, cultivo e avaliação histopatológica de OTSCs de PDAC e suas metástases. A questão chave para esta técnica é cortar tecido fresco sem nenhum procedimento de congelamento e cultivo em uma interface ar-líquido. Uma limitação deste método é que o tecido fresco, não fixado e não congelado não pode ser avaliado quanto ao seu conteúdo de células tumorais antes do cultivo. Como exemplificado em nossos resultados, as OTSCs podem revelar consistir em componentes teciduais diferentes do esperado de cortes rápidos de outros espécimes do mesmo tumor. A avaliação histopatológica das OTSCs após o cultivo é imperativa para a avaliação dos dados de culturas de fatias individuais. O ensaio de viabilidade descrito permite apenas uma avaliação geral da viabilidade geral de cada OTSC. Em geral, o método descrito pode ser implementado em qualquer laboratório equipado com vibratomo e unidade de cultura de tecidos. Devido à simplicidade desta técnica, ela pode ser facilmente modificada para vários tumores e questões de pesquisa.
Várias metodologias foram desenvolvidas para cultivar tecido tumoral humano ex vivo, por exemplo, linhagens celulares primárias, organoides derivados de pacientes e xenoenxertos. No entanto, seu uso para o desenvolvimento de medicamentos e a identificação de biomarcadores preditivos permanece limitado principalmente devido à perda do contexto tecidual, ou seja, interação do estroma e das células tumorais2.
Embora o método apresentado de estabelecimento de cultura de fatias organotípicas preserve a arquitetura do tecido multicelular, várias limitações precisam ser consideradas. Primeiro, um grau considerável de heterogeneidade (intra) tumoral precisa ser levado em consideração. OTSCs distintas derivadas de uma única biópsia tumoral podem mostrar variações consideráveis em suas proporções de células tumorais e estroma. Além da qualidade geral do tecido, essa pode ser uma das razões para a viabilidade de fatias diferentes durante a cultura. Em segundo lugar, o meio para condições ideais de cultura pode variar dependendo do tecido e do paciente. Comparamos dois meios distintos de cultura de tecidos: o primeiro baseado em DMEM/F12 (meio A) e o segundo baseado em RPMI (meio B). Cada espécime de tumores primários ou suas metástases podem exigir modificações. Em terceiro lugar, a necrose tumoral pode ocorrer já in situ16 e não é necessariamente devido a condições de cultura insuficientes das OTSCs. A comparação com a histopatologia do tumor primário deve ser considerada.
O estabelecimento de OTSCs conforme descrito neste protocolo oferece uma oportunidade de testar a resposta ao tratamento imediatamente após a cirurgia em um sistema modelo ex vivo que preserva o microambiente tumoral. Prospectivamente, as OTSCs facilitarão o desenvolvimento de estratégias terapêuticas individuais para personalizar o tratamento da doença metastática.
Divulgações
Os autores não revelaram potenciais conflitos de interesse.
Agradecimentos
R. Braun foi apoiado pela Clinician Scientist School Lübeck (DFG # 413535489) e pelo Programa de Financiamento Júnior da Universidade de Lübeck.
Materiais
| Name | Company | Catalog Number | Comments |
| Advanced DMEM/F-12 Medium | Gibco | 12634028 | |
| Agarose Low Melt | Roth | 6351.2 | 8% in Ringer solution |
| Antibody Diluent, Background Reducing | Dako | S3022 | |
| AquaTex | Merck | 108562 | |
| Bioethanol (99%, denatured) | CHEMSolute | 2,21,19,010 | |
| Citric Acid monohydrate | Sigma Aldrich | C7129 | |
| Cleaved Caspase-3 (Asp175) (5A1E) Rabbit mAb | Cell Signalling Technology | 9664 | 1:400 dilution |
| Derby Extra Double Edge Safety Razor Blades | Derby Tokai | ||
| Embedding cassettes | Roth | H579.1 | |
| Eosin Y-solution 0,5% aqueous | Merck | 10,98,44,100 | |
| Eukitt Quick hardening mounting medium | Sigma-Aldrich | 3989 | |
| Fetal bovine serum | Gibco | 10270106 | |
| Formaldehyde solution 4,5%, buffered | Büfa Chemikalien | B211101000 | |
| Hem alum solution acid acc. to Mayer | Roth | T865 | |
| Human EGF | Milteniy Biotec | 130-097-794 | |
| Hydrocortisone | Sigma Aldrich (Merck) | H0888 | |
| Hydrogen peroxide 30% | Merck | 1,08,59,71,000 | |
| Insulin human | Sigma Aldrich (Merck) | 12643 | |
| Liquid DAB+ Substrate Chromogen System | Dako | K3468 | |
| MACS Tissue Storage Solution | Milteniy Biotech | 130-100-008 | |
| Methanol | Merck | 10.600.092.500 | |
| Microscope Slides Superfrost Plus | Thermo Scientific | J1800AMNZ | |
| Millicell Cell Culture Insert, 30 mm, hydrophilic PTFE, 0.4 µm | Millipore (Merck) | PICM0RG50 | |
| Monoclonal mouse anti-human Cytokeratin 7 (Clone OV-TL 12/30) | Dako | M7018 | 1:200 dilution |
| Monoclonal mouse anti-human Ki67 Clone MIB-1 | Dako | M7240 | 1:200 dilution |
| Monoclonal mouse Anti-vimentin (Clone V9) | Dako | M0725 | 1:200 dilution |
| Negative control Mouse IgG2a | Dako | X0943 | 1:200 dilution |
| Negative control Mouse IgG1 | Dako | X093101-2 | 1:200 dilution |
| Paraffin (melting temperature 56°- 58°) | Merck | 10,73,37,100 | |
| Penicillin-Streptomycin (10.000 U/ml) | Gibco | 15140122 | |
| PBS pH 7,4 (1x) Flow Cytometry Grade | Gibco | A12860301 | |
| Resazurin sodium salt; 10 mg/ml in PBS | Sigma Aldrich | R7017 | 1:250 dilution |
| Ringer's solution | Fresenius Kabi | 2610813 | |
| RPMI-1640 Medium | Sigma Aldrich (Merck) | R8758 | |
| Tissue culture testplate 6 | TPP | 92006 | |
| Triton X-100 | Sigma Aldrich | 9002-93-1 | |
| VECTASTAIN Elite ABC-Peroxidase Kit | Vector Laboratories | PK-6200 | |
| Xylene (extra pure) | J.T.Baker | 8,11,85,000 | |
| Equipment | |||
| ClarioStar Microplate Reader | BMG Labtech | ||
| Paraffin Embedding Center E61110 | Leica | ||
| Rotary Microtome Microm HM355S | Thermo Scientific | ||
| Section Transfer System Microm STS | Thermo Scientific | ||
| VT 1200S Vibratom | Leica |
Referências
- Nevala-Plagemann, C., Hidalgo, M., Garrido-Laguna, I. From state-of-the-art treatments to novel therapies for advanced-stage pancreatic cancer. Nature Reviews. Clinical Oncology. 17 (2), 108-123 (2020).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- Waghray, M., Yalamanchili, M., di Magliano, M. P., Simeone, D. M. Deciphering the role of stroma in pancreatic cancer. Current Opinion in Gastroenterology. 29 (5), 537-543 (2013).
- Hwang, R. F., et al. Cancer-associated stromal fibroblasts promote pancreatic tumor progression. Cancer Research. 68 (3), 918-926 (2008).
- Jiang, X., et al. Long-lived pancreatic ductal adenocarcinoma slice cultures enable precise study of the immune microenvironment. Oncoimmunology. 6 (7), 1333210 (2017).
- Hessmann, E., et al. Fibroblast drug scavenging increases intratumoural gemcitabine accumulation in murine pancreas cancer. Gut. 67 (3), 497-507 (2018).
- Feig, C., et al. The pancreas cancer microenvironment. Clinical Cancer Research. 18 (16), 4266-4276 (2012).
- Koerfer, J., et al. Organotypic slice cultures of human gastric and esophagogastric junction cancer. Cancer Medicine. 5 (7), 1444-1453 (2016).
- Gerlach, M. M., et al. Slice cultures from head and neck squamous cell carcinoma: a novel test system for drug susceptibility and mechanisms of resistance. British Journal of Cancer. 110 (2), 479-488 (2014).
- Holliday, D. L., et al. The practicalities of using tissue slices as preclinical organotypic breast cancer models. Journal of Clinical Pathology. 66 (3), 253-255 (2013).
- Vaira, V., et al. Preclinical model of organotypic culture for pharmacodynamic profiling of human tumors. Proceedings of the National Academy of Sciences of the United States of America. 107 (18), 8352-8356 (2010).
- Lim, C. Y., et al. Organotypic slice cultures of pancreatic ductal adenocarcinoma preserve the tumor microenvironment and provide a platform for drug response. Pancreatology. 18 (8), 913-927 (2018).
- Brandenburger, M., et al. Organotypic slice culture from human adult ventricular myocardium. Cardiovascular Research. 93 (1), 50-59 (2012).
- Misra, S., et al. Ex vivo organotypic culture system of precision-cut slices of human pancreatic ductal adenocarcinoma. Science Reports. 9 (1), 2133 (2019).
- O'Brien, J., Wilson, I., Orton, T., Pognan, F. Investigation of the Alamar Blue (resazurin) fluorescent dye for the assessment of mammalian cell cytotoxicity. European Journal of Biochemistry. 267 (17), 5421-5426 (2000).
- Beutler, B., Cerami, A. Tumor necrosis, cachexia, shock, and inflammation: a common mediator. Annual Review of Biochemisty. 57, 505-518 (1988).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados