Method Article
Визуализация и количественная оценка интактных нейрональных дендритов с помощью очистки тканей CLARITY
В этой статье
Резюме
Дендритная морфология нейронов часто лежит в основе функции. Действительно, многие болезненные процессы, влияющие на развитие нейронов, проявляются с морфологическим фенотипом. Этот протокол описывает простой и мощный метод анализа интактных дендритных беседок и связанных с ними шипов.
Аннотация
Активность мозга, электрохимические сигналы, передаваемые между нейронами, определяется паттернами связности нейронных сетей, а также морфологией процессов и подструктур внутри этих нейронов. Таким образом, многое из того, что известно о функции мозга, возникло наряду с разработками в технологиях визуализации, которые позволяют глубже понять, как нейроны организованы и связаны в мозге. Улучшения в очистке тканей позволили получить визуализацию толстых срезов мозга с высоким разрешением, облегчая морфологическую реконструкцию и анализ нейронных субструктур, таких как дендритные беседки и шипы. В тандеме достижения в области программного обеспечения для обработки изображений предоставляют методы быстрого анализа больших наборов данных изображений. Эта работа представляет собой относительно быстрый метод обработки, визуализации и анализа толстых срезов меченой нервной ткани с высоким разрешением с использованием очистки тканей CLARITY, конфокальной микроскопии и анализа изображений. Этот протокол облегчит усилия по пониманию паттернов связности и морфологии нейронов, которые характеризуют здоровый мозг, и изменений в этих характеристиках, которые возникают в больных состояниях мозга.
Введение
Понимание пространственной организации, паттернов связности и морфологии сложных трехмерных биологических структур имеет важное значение для разграничения функций конкретных клеток и тканей. Это особенно верно в нейробиологии, в которой огромные усилия были посвящены построению нейроанатомических карт центральной нервной системы высокого разрешения1,2. Тщательное изучение нейронов, составляющих эти карты, дает различные морфологии, со связями и местоположениями, которые отражают функцию этих разнообразных наборов нейронов3,4. Более того, исследование субклеточных структур, особенно дендритных шипов, может информировать о зрелости синапсов, тем самым отражая процессы развития и неврологические болезненные состояния5,6,7. Таким образом, подходы, которые улучшают разрешение и пропускную способность изображения, необходимы для лучшего понимания функции мозга во всех масштабах.
Последние достижения расширили молекулярно-генетический инструментарий для маркировки и манипулирования популяциями нейронов. Разработка новых флуоресцентных маркеров в сочетании с новыми методами введения этих маркеров в нейроны позволяет дифференциально маркировать популяции взаимодействующих нейронов в пределах одного и того же образца животного или мозга8,9,10,11. Поскольку свет рассеивается непрозрачными липидами и, учитывая высокое содержание липидов в мозговой ткани, визуализация нейронных популяций в основном была ограничена тонкими участками или опиралась на передовые методы микроскропии (например, конфокальную, многофотонную и светоливую микроскопию) для изображения глубоких структур. Тем не менее, эти усилия были значительно подкреплены достижениями в методах очистки тканей. Прозрачный липидообменный акриламид-гибридизированный Rigid Imaging/immunostaining/insitu гибридизация-совместимый Tissue-hYdrogel (CLARITY) является одним из таких методов, в котором ткани, представляющие интерес, вводят гидрогелевые мономеры (акриламид и бис-акриламид), а затем промывают моющими средствами12. Мономеры гидрогеля гибридизируются для создания стабильного 3D-гидрогелевого каркаса, который оптически прозрачен и проницаем для этикеток макромолекул. Нуклеиновые кислоты и белки поддерживаются в гибридизированной матрице, тогда как липиды удаляются моющими средствами(рисунок 1). Это приводит к стабильной ткани, которая достаточно жесткая, чтобы поддерживать первоначальную форму и ориентацию клеток и нелипидных молекул, в то время как оптически достаточно прозрачна, чтобы легко визуать глубокие структуры с высоким разрешением. Это поддержание структуры и ориентации ткани позволяет визуализировать толстые срезы, тем самым сохраняя межклеточные связи и пространственные отношения. Более того, поскольку местоположение и доступность белков и нуклеиновых кислот сохраняется в процессе очистки, очищенные ткани способны удерживать маркеры на основе экспрессии, а также экзогенные метки. Таким образом, CLARITY позиционируется как мощный метод визуализации большого количества глубоких структур мозга и связей между этими структурами с высоким разрешением.
Использование CLARITY значительно улучшает подходы к визуализации нейронных популяций. Этот метод особенно искусен в создании больших объемов данных визуализации. CLARITY хорошо работает с несколькими формами флуоресценции на основе белка. Этот протокол использует лентивирусный подход к разреженной маркировке клеток с помощью EGFP и tdTomato; однако обычно используются трансгенные репортерные аллели, экспрессирующие tdTomato или EGFP для маркировки клеток для реконструкции. Важно выбрать флуорофор, который является как фотостабийным, так и ярким (например, EGFP или tdTomato). Кроме того, использование сильного промотора для экспрессии флуорофора обеспечивает превосходную контрастность и качество изображения. Недостатки этой методики возникают, так как правильный анализ такого большого объема данных может быть как трудоемким, так и трудоемким. Специализированные микроскопы могут помочь повысить пропускную способность и уменьшить рабочую нагрузку. Тем не менее, создание, владение и / или эксплуатация передовых микроскопов часто являются непомерно дорогими для многих лабораторий. Эта работа представляет собой высокопроизводительный, относительно быстрый и простой метод визуализации больших объемов нервной ткани с высоким разрешением с использованием очистки тканей CLARITY от больших участков в сочетании со стандартной конфокальной микроскопией. Этот протокол описывает этот подход посредством следующих этапов: 1) рассечение и подготовка нервной ткани, 2) очистка ткани, 3) монтаж ткани, 4) визуализация подготовленных срезов и 5) обработка полных изображений с использованием программного обеспечения визуализации микроскопии реконструкции и анализа(рисунок 2). Эти усилия приводят к изображениям с высоким разрешением, которые могут быть использованы для анализа популяций нейронов, паттернов нейронных связей, морфологии 3D-дендриты, изобилия и морфологии дендритного позвоночника, а также молекулярных паттернов экспрессии в неповрежденной ткани мозга.
протокол
Следующий протокол следует всем рекомендациям по уходу за животными для Медицинского колледжа Бейлора.
1. Рассечение и подготовка тканей
- Усыпить мышь при передозировке изофлурана, поместив мышь в закрытый контейнер с полотенцем, пропитанным изофлураном (или другими одобренными IUCAC средствами).
- Перфьюзировать животное транскардиально, используя иглу 25 г с 10 мл ледяного холодного PBS, а затем 10 мл 4% PFA.
- Рассектать интересуящеую область (или ткань) мозга.
- Поместите рассеченную ткань в 4% PFA на ночь при 4 °C. Правильная фиксация является ключевым фактором для этого протокола. Не пропускайте и не сокращайте этот шаг.
- После фиксации в 4% PFA в течение не менее 12 ч переносят ткань на 4% акриламидную гидрогелевую смесь в течение 24 ч при 4 °C.
ПРИМЕЧАНИЕ: При размораживании гидрогеля убедитесь, что он не полимеризовался, это может произойти, если гидрогель станет слишком теплым. Оттаивание на льду для предотвращения преждевременной полимеризации.
2. Очистка тканей
- Поместите ткани мозга (все еще погруженные в гидрогель) в вакуумный инкубатор на 3 ч при 37 °C с вакуумом -90 кПа. Оставьте верхнюю часть трубки откручиваться, чтобы вакуум сформировался должным образом.
- Промыть салфетку PBS в течение 10 мин при комнатной температуре (25 °C) с легким встряхиванием.
- Поместите образец полимеризованной ткани в камеру электрофореза, сохраняя за этим ориентацию ткани в камере.
- Заполните камеру и резервуар прилагаемым электрофорезным буфером SDS.
- Запустите образец при 70 В, 1 А и 35 С с постоянным током около 2 ч/мм ткани.
- Периодически проверяйте образец; для правильной очистки может потребоваться больше времени в камере. Хорошей отправной точкой для очищения является 1-2 ч на мм мозговой ткани. Всему мозгу мыши требуется 8-10 ч для достаточного очищения. Запомните ориентацию образца перед извлечением его из камеры и обязательно замените его обратно в камеру в той же ориентации.
ПРИМЕЧАНИЕ: Рисунок 3А показывает, как будет выглядеть полностью очищенный мозг. Мозг будет выглядеть непрозрачным и неочищенным на этом этапе из-за наличия растворенного SDS, но после извлечения липидов практически не должно быть желтого оттенка.
- Периодически проверяйте образец; для правильной очистки может потребоваться больше времени в камере. Хорошей отправной точкой для очищения является 1-2 ч на мм мозговой ткани. Всему мозгу мыши требуется 8-10 ч для достаточного очищения. Запомните ориентацию образца перед извлечением его из камеры и обязательно замените его обратно в камеру в той же ориентации.
3. Подготовка и монтаж очищенной ткани
- После того, как образец закончит очистку и выглядит достаточно прозрачным, вымойте в PBS на ночь при комнатной температуре. Заменяйте PBS свежим PBS как можно чаще. Этот шаг имеет решающее значение для удаления остаточных SDS, которые могут образовывать осадок на последующих этапах.
- После окончательной стирки в PBS промыть ткань в течение 5 мин в деионизированной воде комнатной температуры три раза. Ткань станет непрозрачной на этом этапе и может расширяться.
- Инкубируют ткань в растворе, соответствующем рефракционному индексу (см. таблицу 1),в течение не менее 4 ч при комнатной температуре. На рисунке 3В показан кусок очищенной ткани после инкубации в растворе, соответствующем показателю преломления.
- Во время инкубации ткани в растворе, соответствующем рефракционному индексу, сконструйте подходящую камеру корпуса для получения изображения образца, если это необходимо.
- Создание камеры визуализации для небольших образцов/срезов тканей
- Используя стеклянную горку в качестве основы для монтажа, уложите резиновые или пластиковые распорки и закрепите суперклеем. Если готовые прокладки недоступны, используйте пластиковые кольца, изготовленные из конических поперечных сечений труб.
- Убедитесь, что эти части закреплены на стеклянной горке без каких-либо отверстий(рисунок 3C).
- Поместите очищенную ткань в монтажную камеру, предварительно заполненную раствором для согласования показателей преломления.
- Надежно скрепите ткань, поместив сверху стеклянную крышку и запечатав ее лаком для ногтей.
- Изобразите эту ткань, добавив каплю соответствующего показателя преломления монтажного раствора непосредственно поверх стекла.
- Большая камера визуализации тканей
- Постройте эту камеру, если толщина ткани превышает 5 мм (подходит для всего мозга или полушарий).
- Используя стеклянную тарелку размером 10 см с высокой стенкой, поместите коническую трубку объемом 50 мл в центр, убедившись, что диаметр конической линзы достаточно велик, чтобы принять ствол используемой объектива.
- Внесите 3% агарозы в воду и вылейте ее в пространство между стеклянной посудой и конической трубкой, дайте остыть в течение 1 ч(рисунок 3D). Это сформирует кольцо твердой агарозы(рисунок 3Е).
- Надежно приклейте ткань к нижней части камеры с помощью суперклея и заполните камеру раствором для согласования показателей преломления. Нанесите клей, чтобы приклеить ткань на область, которая не будет изображена, чтобы позволить рекультивацию ткани из тарелки без повреждения интересующих областей.
ПРИМЕЧАНИЕ: Этот препарат чувствителен ко времени, так как среда с показателем преломления может начать полимеризоваться, если ее не сохранить из воздуха и не хранить при 4°C.
4. Визуализация очищенных образцов тканей
- Получите изображение с помощью конфокального микроскопа, оснащенного объективом 25x/0.95 NA с рабочим расстоянием 4 мм.
- Включите все соответствующее оборудование для обработки изображений. Поместите образец на сцену и поместите каплю раствора для согласования показателей преломления на верхнюю часть монтажной камеры.
- Тщательно подойдите к погружным средам с целью и сформируйте непрерывную колонку медиа.
- Используя эпифлуоресценцию, найдите подходящее поле визуализации.
- Начните процедуру получения изображения, проверив соответствующие параметры.
- Начните с установки разрешения и настроек скорости сканирования, используя рисунок 4A в качестве руководства. При визуализации с использованием конфокального микроскопа полностью закройте точечное отверстие, чтобы получить наименьшее оптическое сечение и, следовательно, наилучшее z-разрешение.
- Постепенно увеличивайте мощность лазера/усиление датчика до тех пор, пока не будет получено подходящее изображение с высоким отношением сигнал/шум.
- При использовании стандартной двухцветной визуализации EGFP/tdTomato задайте настройки сбора света, используя рисунок 4B в качестве руководства.
- Установите параметры z-стека на основе наблюдаемых начальной и конечной точек ткани. Установите размер шага на основе желаемого z-разрешения, используя рисунок 4C в качестве руководства.
ПРИМЕЧАНИЕ: Меньшие размеры ступеней приведут к большему z-разрешению, но также приведут к большему времени выдержки лазера, что потенциально приведет к отбеливанию образца. - Когда вы удовлетворены настройками получения изображения, получите изображение.
- Убедитесь, что изображение имеет высокое отношение сигнал/шум и показывает четкие границы структур(рисунок 4D).
5. Обработка изображений и 3D-количественная оценка с использованием программного обеспечения для микроскопического анализа
ПРИМЕЧАНИЕ: Программные пакеты для анализа микроскопических изображений являются мощными инструментами для трехмерной визуализации и обработки изображений. Многие из этих программ идеально подходят для обработки больших наборов данных, которые генерируются из изображений очищенных образцов тканей. Следующие шаги и связанные с ними рисунки соответствуют рабочему процессу программного обеспечения Imaris.
- Откройте стек изображений и импортируйте его в выбранное аналитическое программное обеспечение.
- Просматривайте изображение в трехмерном пространстве и вносите необходимые изменения в таблицы подстановки с помощью регулятора дисплея для лучшей визуализации изображения.
ПРИМЕЧАНИЕ: Рисунок 5А демонстрирует возможную экстремальную глубину изображения, доступную с помощью 2-фотоонной микроскопии в сочетании с очисткой тканей CLARITY. На рисунке 5B показаны различные дендрритные процессы, а также хорошо видимые морфологии позвоночника из z-стека, представленного на рисунке 5A. - Чтобы отфильтровать любой последовательный фон, нажмите кнопку «Обработка изображений» и выберите фильтр вычитания фона.
ПРИМЕЧАНИЕ: На рисунке 5C показано изображение с последовательным туманным фоновым сигналом перед обработкой. На рисунке 5D показано изображение после применения фильтра вычитания фона. - Наблюдайте за 3D-изображением и знакомься с ним, глядя на него с разных ракурсов и уровней масштабирования.
- Запустите трассировку дендритов, сначала выбрав инструмент Трассировки нити.
- Нажмите Редактировать нить вручную, пропустить автоматическое создание.
- Установите режим автоматического контура и проверьте автоцентр и автоматическую коррекцию диаметра.
- Shift + щелкните правой кнопкой мыши на теле ячейки, чтобы установить начальную точку.
- Проследите нейрон по всей длине дендрита; щелкните левой кнопкой мыши на конце дендрита, чтобы установить конечную точку, чтобы программное обеспечение автоматически вычислял путь между начальной и конечной точками.
- Повторите этот шаг для всех дендритов и полностью проследите клеточную структуру.
- Визуализируйте прорисованную ячейку и подтвердите ее точность. При необходимости внесите изменения вручную.
- Выберите вкладку Создание.
- Выберите параметр Перевычисленный диаметр дендрита.
- Следуйте указаниям мастера до конца для получения более точного дендрита.
- Выберите вкладку Рисование.
- Нажмите на переключатель Spine, чтобы начать рисовать колючки.
- Установите приблизительный диаметр позвоночника по мере необходимости и используйте инструмент измерения, чтобы получить точное представление о диаметрах позвоночника.
- Нажмите на центр головки позвоночника, чтобы добавить новый позвоночник.
- Повторите это для всех шипов на дендрите.
ПРИМЕЧАНИЕ: Важно соблюдать дендрит со всех возможных углов при ручном добавлении шипов. - Проверьте только что добавленные шипы на точность и внесите необходимые изменения.
- Выберите вкладку Создание.
- Выберите параметр «Перекомпьют диаметр позвоночника», чтобы программное обеспечение можно было определить правильные диаметры головы и шеи, которые имеют решающее значение для последующего анализа данных.
- Следуйте указаниям мастера создания диаметра позвоночника до конца.
- Наблюдайте за результатом вычислений и вносите любые ручные корректировки по мере необходимости. На рисунке 5E показан полностью прорисованный нейрон с шипами.
- Чтобы создать классифицированный список колючки, перейдите на вкладку Сервис.
ПРИМЕЧАНИЕ: Для этого необходимо установить расширение MATLAB.- Чтобы установить расширение MATLAB, откройте окно настроек.
- Выберите параметр Пользовательские инструменты.
- Добавьте соответствующий MCR среды выполнения MATLAB.
- Нажмите на Классифицировать шипы.
- Отредактируйте нужные параметры для классификации позвоночника.
- Нажмите на Классифицировать шипы на расширении MATLAB. На рисунке 5F показан дендрит, наложенный на колючки с цветовой кодировкой.
- Выберите вкладку Статистика.
- Настройте нужную статистику для количественной оценки данных, нажав на кнопку Настроить в левом нижнем углу этой вкладки.
- После выбора метода представления статистики экспортируйте данные с помощью кнопки Экспортировать статистику на вкладке Отображение в файл, расположенной в правом нижнем углу этого окна.
- График статистики с использованием предпочтительного метода построения графиков.
Результаты
После получения изображения репрезентативную морфологию клеток анализировали с использованием встроенной статистики и скриптов классификации в программном обеспечении для анализа. Собранные данные(рисунок 6А)отражают, что нейрон 2 имеет большую дендритную структуру с более высокой плотностью шипов. В целом данные свидетельствуют о том, что нейрон 2 имеет более сложную дендритную структуру по сравнению с нейроном 1. Для обоснования этого результата был проведен стандартный анализ Шолля, который утверждает, что нейрон 2 более дендритически сложен, чем нейрон 1, что обозначается увеличением числа пересечений Шолля на 50-100 мкм от сомы(рисунок 6B). Наконец, дендритные шипы двух изображенных нейронов были классифицированы на четыре основные категории на основе их общих форм и размеров. Шипы, которые демонстрируют более филоподийоподобные формы, вероятно, являются более незрелыми подтипами позвоночника. Шипы с очерченными головками, называемые грибными шипами, вероятно, содержат более развитые и зрелые синапсы7. Анализ, представленный здесь, показывает, что нейрон 1 содержит большую долю филоподиоподобных шипов по сравнению с нейроном 2(рисунок 6C). Таким образом, основываясь на морфологии, нейрон 2 является более зрелым в развитии, поскольку он больше, более сильно разветвленный и содержит более высокую плотность зрелых шипов.
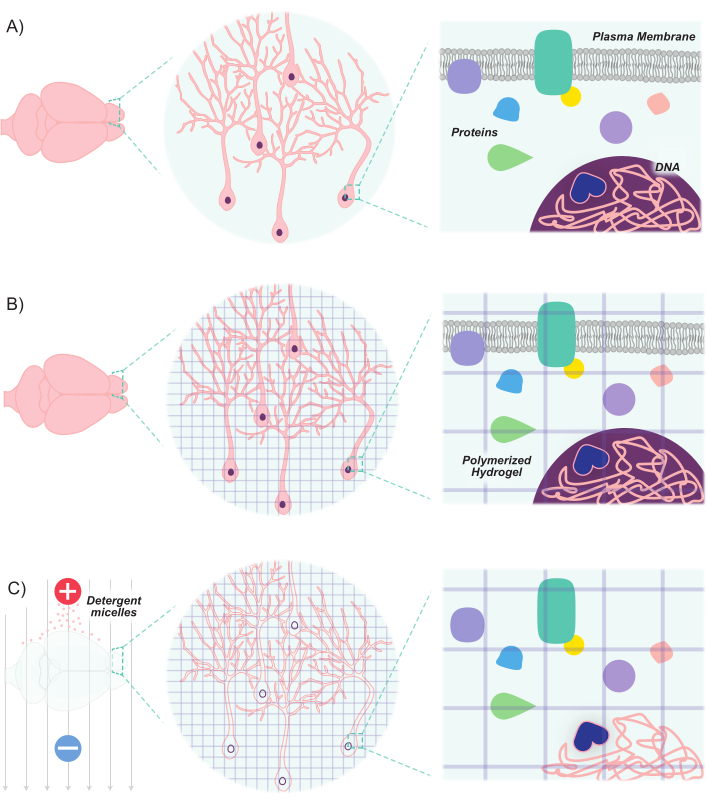
Рисунок 1:Протокол CLARITY делает ткани прозрачными, сохраняя при этом присущую структуру и пространственные отношения молекула-молекула. (A) Оригинальная ориентация нейронной ткани и межклеточных компонентов до очистки. (B) Гидрогелевые мономеры (фиолетовые линии) вводятся в ткань и полимеризуются в гидрогелевую сетку. Ткань и гидрогелевая сетка сшиваются посредством фиксации формальдегида. (C) Затем ткань промывают ионными моющими растворами при воздействии электрических полей. Во время этого процесса мицеллы детергента удаляют липидные молекулы из ткани, оставляя после себя сшитую сеть прозрачных гидрогелей и биомолекул. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
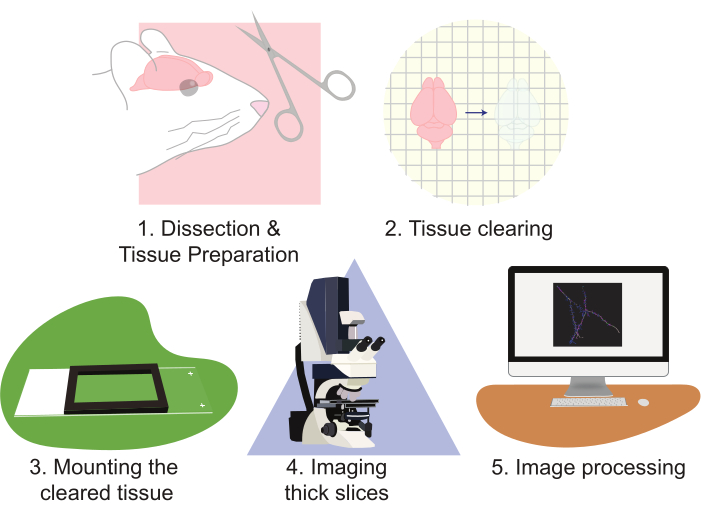
Рисунок 2:Блок-схема протокола, диаграмма подготовки тканей, очистка, монтаж, визуализация и обработка изображений. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3:Построение монтажных камер для очищенных образцов тканей. (A) Очищенный весь мозг в PBS перед погружением в раствор для сопоставления показателей преломления. (B) Срез мозга в растворе для согласования показателей преломления. (C) Камера визуализации для больших и малых очищенных образцов тканей. Камеры могут быть изготовлены с использованием различных материалов, включая, но не ограничиваясь, 3D-печатными пластмассами и вырезанными коническими трубками. (D) Камера визуализации для визуализации всего мозга или полушария, используя коническую трубку 50 мл в качестве облегчения перед заливкой агарозы. (E)Камера визуализации всего мозга или полушария с полностью установленной агарозой; эта установка оптимальна для целей погружения в большой ствол. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4:Получение высококачественных больших наборов данных из очищенных образцов тканей. (A) Параметры получения изображений, используемые для визуализации всей ячейки с высоким разрешением. Точечный отверстие было полностью закрыто, чтобы обеспечить тонкие оптические секции. Скорость сканирования определялась эмпирически на основе оптимального времени ожидания пикселей. (B) Настройки светового тракта: они будут зависеть от флуорофора и используемого оборудования. (C)Настройки Z-стека; тонкий z-шаг был использован для захвата как можно большей информации в z-направлении. (D)Репрезентативная максимальная проекция; Шкала представляет 25 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
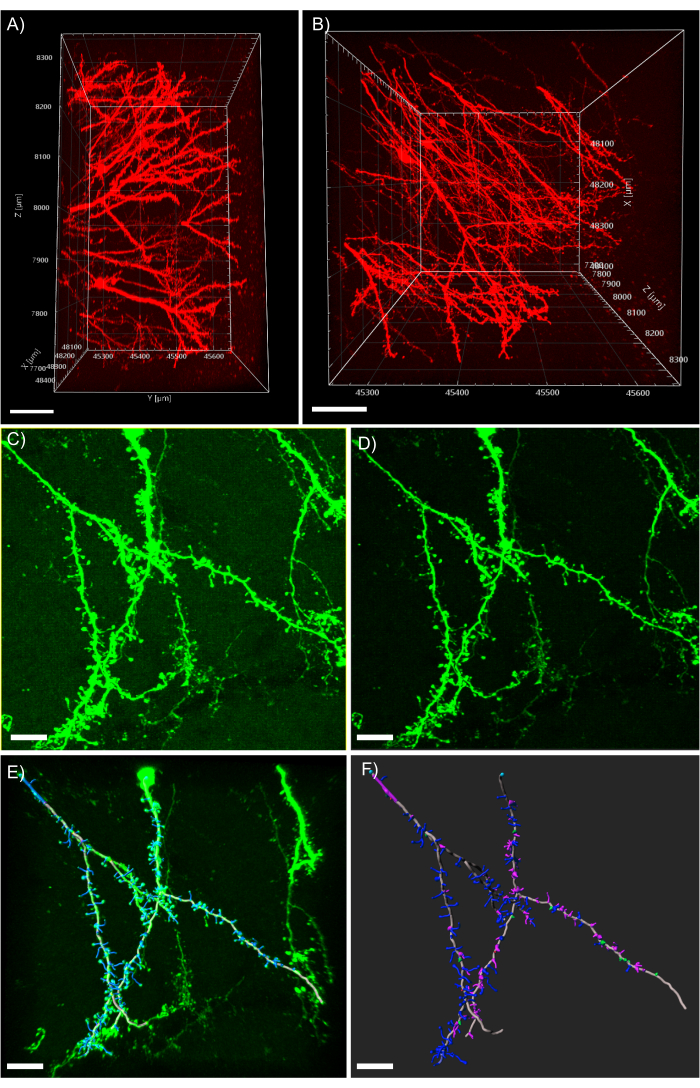
Рисунок 5:3D-анализ дендритов в аналитическом программном обеспечении. (A) Боковой вид двухфотонного полученного 600 мкм z-стека, полученного из ткани толщиной 1 мм, экспрессирующей tdTomato; шкала представляет собой 100 мкм. (B) Вид сверху того же z-стека, полученного в панели A; шкала представляет собой 100 мкм.(C)конфокальное приобретенное изображение ткани, экспрессии EGFP. Файлы изображений могут быть непосредственно импортированы в программное обеспечение для анализа и предварительно обработаны для повышения качества изображения; Шкала представляет собой 25 мкм. (D) Вычитание порога используется для удаления согласованного фонового сигнала, присутствующего в C.(E)Трассировка нити накала и идентификация позвоночника: этот процесс лучше всего выполняется при полуавтоматическом режиме с проверенной функцией автоматической глубины. Затем шипы были помечены вручную после полной реконструкции дендрита; шкала представляет собой 25 мкм. (F) Классификация позвоночника с использованием встроенного расширения MATLAB. Шипы были окрашены в зависимости от их морфологии; коряшки красные; грибные колючки зеленые; длинные тонкие шипы синие; филоподии фиолетовые; Шкала представляет 25 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
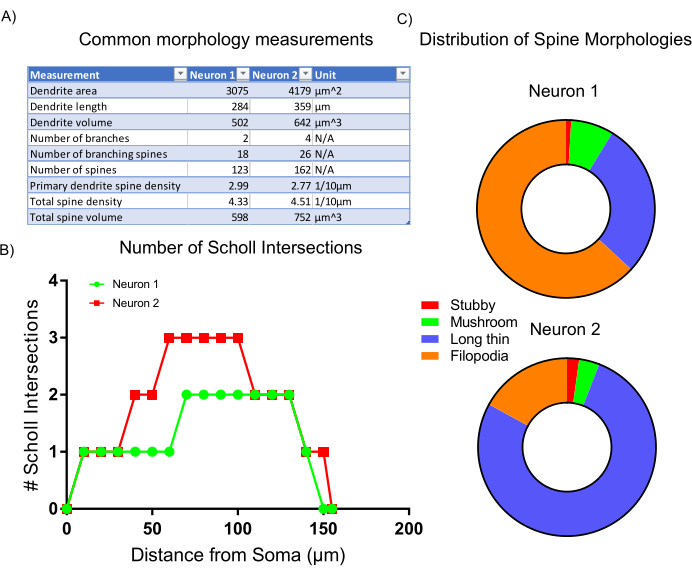
Рисунок 6:Репрезентативные результаты. (A) Таблица общих морфологических измерений, автоматически генерируемых выбранной программой анализа. (B) Количество пересечений Шолла, сгенерированных статистикой программы. (C) Круговая диаграмма, представляющая распределение морфологий дендритного позвоночника. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Решение | Состав | Примечания |
| Решение для согласования показателей преломления | 80 г гистоденза | pH до 7,5 с NaOH |
| 60 мл фосфатного буфера 0,02 М | Хранить при 4 °C | |
| 0,01% азида натрия | Адаптировано из Маркса, В. Методы природы, том 11, страницы 1209–1214 (2014) | |
| Гидрогель | 13,33 мл 30% акриламида (без бис) | Смешать на льду, иначе раствор может начать полимеризоваться |
| 10 мл 10x PBS | Аликвота и хранение при -20 °C | |
| 250 мг VA-044 | ||
| 76,66 мл ddH2O |
Таблица 1: Рецепты для сопоставления рефракционного изображения раствора и раствора гидрогеля. Приведен состав раствора для согласования показателя преломления и гидрогеля.
Обсуждение
До появления современных методов очистки тканей изучение морфологии нейронов состояло из трудоемкого сечения, визуализации и реконструкции соседних очень тонких участков. Использование электрофоретического очищения тканей в сочетании с конфокальной визуализацией обеспечивает беспрепятственное представление о полной морфологии нейронов. От неповрежденных дендритных деревьев до мельчайших синаптических бутонов визуализация и количественная оценка морфологии нейронов никогда не были более осуществимыми.
Подготовка очищенной мозговой ткани проста и требует только одного специализированного оборудования. Ткань, очищенная и изображенная с помощью этого протокола, ниспровергает необходимость утомительного тонкого сечения, обработки и монтажа, резко сокращая время от экспериментов до получения изображения. Кроме того, ткань, изображенная без сечения, остается более верной исходным структурам, так как нет источников повреждения или необходимой реконструкции после специального изображения. Наконец, этот протокол экономит время, позволяя одновременно визуализировать крупномасштабные функции, такие как дендритные деревья, наряду с мелкомасштабными субмикронные функции, такие как шипы.
Одним из важных наборов шагов в этом протоколе являются шаги промывки, которые следуют за процессом очистки. Эти шаги имеют решающее значение для удаления всех следов буфера электрофоретической очистки SDS. Если очищенная ткань недостаточно промыта, на этапе монтажа образуются осадки. Эти осадки иногда могут быть повторно разрешены путем инкубации ткани при 37-55 ° C в течение короткого времени. Однако, если осадки сохраняются, они будут рассеивать свет, что приводит к плохой глубине и качеству изображения.
Монтаж больших кусков ткани представляет собой проблему по сравнению с традиционной тонкой срезовой визуализацией. Здесь мы представляем несколько процессов для монтажа большой ткани, которые зависят от техники визуализации, свойств объектива и размера образца ткани. Во-первых, важно использовать объектив, который подходит для погружения в конкретную используемую ткани, соответствующую индексу преломления, и который имеет достаточное рабочее расстояние для визуализации больших образцов тканей. Этот протокол в значительной степени ограничен оптическими свойствами используемой платформы визуализации, в частности рабочим расстоянием целей. Визуализация на глубине легко достигается с помощью этого протокола. Однако, если цель с достаточным рабочим расстоянием недоступна, сама ткань будет представлять собой физический барьер для получения больших изображений. Следующим важным решением является метод визуализации. Двухфотонная микроскопия обычно используется для превосходного качества изображения, глубины изображения и скорости получения. Двухфотонная микроскопия позволяет визуализировать до 1 мм в очищенную ткань CLARITY без потери качества изображения, как показано на рисунке 5A,B. Тем не менее, очень похожие результаты могут быть достигнуты при использовании традиционной конфокальной микроскопии, хотя и с жертвой глубины изображения по сравнению с двухфотонной микроскопией(рисунок 5C,D).
Таким образом, этот метод обеспечивает надежную и удобную платформу для анализа морфологии нейронов как в больших, так и в малых масштабах. Кроме того, этот метод в значительной степени минимизирует время обработки и обработки, а также обеспечивает более точные и полные трехмерные изображения. Клеточная морфология является широко используемым прокси для оценки функции цепи и здоровья, лежащего в основе многих заболеваний и патологий13,14,15. Визуализация морфологии нейронов является мощной, простой и хорошо подходит для анализа во множестве моделей заболеваний.
Раскрытие информации
Авторам пока нечего раскрывать.
Благодарности
Мы хотели бы поблагодарить вирусное ядро NRDDC в Неврологическом институте Яна и Дэна Дункана за производство AAV и лентивирусов, используемых в этих экспериментах. Кроме того, мы хотели бы поблагодарить Медицинский колледж Бейлора Центр сравнительной медицины за разведение мышей и общее содержание используемых мышей. Мы хотели бы поблагодарить Американскую кардиологической ассоциацию за их поддержку под номером 20PRE35040011 и BRASS: Baylor Research Advocates for Student Scientists за их поддержку (PJH). Наконец, мы хотели бы поблагодарить Logos за предоставление нашей лаборатории электрофоретической системы очистки тканей Logos X-Clarity.
Материалы
| Name | Company | Catalog Number | Comments |
| 15 mL Conical Tube | Thermo Scientific | 339650 | |
| 25 G x 1" Needle | BD | 305127 | |
| 30% Acrylamide (No-Bis) | National Diagnostics | EC-810 | |
| 50 mL Conical Tube | Thermo Scientific | 339653 | |
| Electrophoretic Tissue Clearing Solution | Logos | C13001 | |
| Histodenz | Sigma | D2158-100G | |
| Hydrogel Solution Kit | Logos | C1310X | |
| Imaris | Oxford Instruments | N/A | |
| Paraformaldehyde 16% | EMS | 15710 | |
| PBS, 1x, 500 mL, 6 bottles/case | fisher | MT21040CV | |
| VA-044 | Wako | 925-41020 | |
| X-CLARITY Polymerization System | Logos | C20001 | |
| X-CLARITY Tissue Clearing System II | Logos | C30001 |
Ссылки
- Abbott, L. F., et al. The Mind of a mouse. Cell. 182 (6), 1372-1376 (2020).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philosophical transactions of the Royal Society of London. Series B, Biological Sciences. 314 (1165), 1(1986).
- Jiang, X., et al. Principles of connectivity among morphologically defined cell types in adult neocortex. Science. 350 (6264), (2015).
- Winnubst, J., et al. Reconstruction of 1,000 projection neurons reveals new cell types and organization of long-range connectivity in the mouse brain. Cell. 179 (1), 268-281 (2019).
- Araya, R., Vogels, T. P., Yuste, R. Activity-dependent dendritic spine neck changes are correlated with synaptic strength. Proceedings of the National Academy of Sciences of the United States of America. 111 (28), (2014).
- Bosch, M., Hayashi, Y. Structural plasticity of dendritic spines. Current Opinion in Neurobiology. 22 (3), 383-388 (2012).
- Martínez-Cerdeño, V. Dendrite and spine modifications in autism and related neurodevelopmental disorders in patients and animal models. Developmental Neurobiology. 77 (4), 393-404 (2017).
- Arenkiel, B. R., Ehlers, M. D. Molecular genetics and imaging technologies for circuit-based neuroanatomy. Nature. 461 (7266), 900-907 (2009).
- Kim, E. H., Chin, G., Rong, G., Poskanzer, K. E., Clark, H. A. Optical probes for neurobiological sensing and imaging. Accounts of Chemical Research. 51 (5), 1023-1032 (2018).
- Weissman, T. A., Pan, Y. A. Brainbow: New resources and emerging biological applications for multicolor genetic labeling and analysis. Genetics. 199 (2), 293-306 (2014).
- Haggerty, D. L., Grecco, G. G., Reeves, K. C., Atwood, B. Adeno-associated viral vectors in neuroscience research. Molecular Therapy - Methods and Clinical Development. 17, 69-82 (2020).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Kanning, K. C., Kaplan, A., Henderson, C. E. Motor neuron diversity in development and disease. Annual Review of Neuroscience. 33, 409-440 (2010).
- Ledda, F., Paratcha, G. Mechanisms regulating dendritic arbor patterning. Cellular and Molecular Life Sciences. 74 (24), 4511-4537 (2017).
- Falougy, H. E., Filova, B., Ostatnikova, D., Bacova, Z., Bakos, J. Neuronal morphology alterations in autism and possible role of oxytocin. Endocrine Regulations. 53 (1), 46-54 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
ISSN 1940-087X
Авторские права © 2025 MyJoVE Corporation. Все права защищены
Мы используем файлы cookie для улучшения качества работы на нашем веб-сайте.
Продолжая пользоваться нашим веб-сайтом или нажимая кнопку «Продолжить», вы соглашаетесь принять наши файлы cookie.
