Method Article
Imaging e quantificazione di dendriti neuronali intatti tramite CLARITY Tissue Clearing
In questo articolo
Riepilogo
La morfologia dendritica neuronale è spesso alla base della funzione. In effetti, molti processi patologici che influenzano lo sviluppo dei neuroni si manifestano con un fenotipo morfologico. Questo protocollo descrive un metodo semplice e potente per analizzare i pergole dendritiche intatte e le loro spine associate.
Abstract
L'attività cerebrale, i segnali elettrochimici passati tra i neuroni, è determinata dai modelli di connettività delle reti neuronali e dalla morfologia dei processi e delle sottostrutture all'interno di questi neuroni. Come tale, gran parte di ciò che è noto sulla funzione cerebrale è sorto insieme agli sviluppi nelle tecnologie di imaging che consentono ulteriori informazioni su come i neuroni sono organizzati e collegati nel cervello. I miglioramenti nella pulizia dei tessuti hanno permesso l'imaging ad alta risoluzione di spesse fette di cervello, facilitando la ricostruzione morfologica e le analisi delle sottostrutture neuronali, come i pergole dendritiche e le spine. In parallelo, i progressi nel software di elaborazione delle immagini forniscono metodi per analizzare rapidamente set di dati di imaging di grandi dimensioni. Questo lavoro presenta un metodo relativamente rapido di elaborazione, visualizzazione e analisi di spesse fette di tessuto neurale etichettato ad alta risoluzione utilizzando la pulizia dei tessuti CLARITY, la microscopia confocale e l'analisi delle immagini. Questo protocollo faciliterà gli sforzi verso la comprensione dei modelli di connettività e delle morfologie neuronali che caratterizzano i cervelli sani e i cambiamenti in queste caratteristiche che sorgono negli stati cerebrali patologici.
Introduzione
Comprendere l'organizzazione spaziale, i modelli di connettività e la morfologia di strutture biologiche tridimensionali complesse è essenziale per delineare le funzioni di cellule e tessuti specifici. Ciò è particolarmente vero nelle neuroscienze, in cui è stato dedicato un enorme sforzo alla costruzione di mappe neuroanatomiche ad alta risoluzione del sistema nervoso centrale1,2. Un attento esame dei neuroni che compongono queste mappe produce varie morfologie, con connessioni e posizioni che riflettono la funzione di questi diversi insiemi di neuroni3,4. Inoltre, lo studio delle strutture subcellulari, in particolare delle spine dendritiche, può informare la maturità delle sinapsi, riflettendo così i processi di sviluppo e gli stati di malattia neurologica5,6,7. Pertanto, gli approcci che migliorano la risoluzione e la produttività dell'imaging sono essenziali per comprendere meglio la funzione cerebrale a tutte le scale.
Recenti progressi hanno ampliato il toolkit molecolare e genetico per marcare e manipolare popolazioni di neuroni. Lo sviluppo di nuovi marcatori fluorescenti, combinato con nuovi metodi di introduzione di questi marcatori nei neuroni, consente l'etichettatura differenziale di popolazioni di neuroni interagenti all'interno dello stesso animale o campione di cervello8,9,10,11. Poiché la luce è dispersa da lipidi opachi e dato l'alto contenuto lipidico del tessuto cerebrale, l'imaging delle popolazioni neuronali è stato principalmente limitato a sezioni sottili o si è affidato a tecniche avanzate di microscropia (ad esempio, microscopia confocale, multi-fotone e a foglio di luce) per l'immagine di strutture profonde. Tuttavia, questi sforzi sono stati notevolmente rafforzati dai progressi nelle tecniche di pulizia dei tessuti. Clear Lipid-exchanged Acrylamide-hybridized Rigid Imaging/immunostaining/insitu hybridization-compatible Tissue-hYdrogel (CLARITY) è una di queste tecniche, in cui i tessuti di interesse vengono infusi con monomeri di idrogel (acrilammide e bis-acrilammide) e quindi lavati con detergenti12. I monomeri di idrogel si ibridano per creare uno scaffold idrogel 3D stabile che è otticamente trasparente e permeabile alle etichette delle macromolecole. Gli acidi nucleici e le proteine sono mantenuti all'interno della matrice ibridata, mentre i lipidi vengono rimossi dai lavaggi detergenti (Figura 1). Ciò si traduce in un tessuto stabile che è abbastanza rigido da mantenere la forma e l'orientamento originali delle cellule e delle molecole non lipidiche, mentre otticamente abbastanza trasparente da immaginare facilmente strutture profonde ad alta risoluzione. Questo mantenimento della struttura e dell'orientamento dei tessuti consente l'imaging di fette spesse, preservando così le connessioni cellula-cellula e le relazioni spaziali. Inoltre, poiché la posizione e la disponibilità di proteine e acidi nucleici viene mantenuta durante il processo di compensazione, i tessuti eliminati sono in grado di contenere marcatori basati sull'espressione, nonché etichette esogene. Pertanto, CLARITY si presta come un metodo potente per l'imaging di grandi quantità di strutture cerebrali profonde e le connessioni tra queste strutture ad alta risoluzione.
L'uso di CLARITY migliora notevolmente gli approcci all'imaging delle popolazioni neuronali. Questa tecnica è particolarmente abile nel generare grandi quantità di dati di imaging. CLARITY funziona bene con più forme di fluorescenza a base di proteine. Questo protocollo utilizza un approccio basato sul lentivirale per etichettare scarsamente le cellule con EGFP e tdTomato; tuttavia, gli alleli reporter transgenici che esprimono tdTomato o EGFP per etichettare le cellule per la ricostruzione sono stati utilizzati di routine. È importante scegliere un fluoroforo che sia fotostali e luminoso (ad esempio, EGFP o tdTomato). Inoltre, l'utilizzo di un forte promotore per esprimere il fluoroforo produce un contrasto e una qualità dell'immagine superiori. Gli svantaggi di questa tecnica derivano dal fatto che analizzare correttamente questa grande quantità di dati può richiedere sia lavoro che tempo. Microscopi specializzati possono aiutare a migliorare la produttività e ridurre il carico di lavoro. Tuttavia, la costruzione, la proprietà e / o l'uso di microscopi avanzati sono spesso proibitivi per molti laboratori. Questo lavoro presenta un metodo ad alto rendimento, relativamente rapido e semplice per visualizzare grandi quantità di tessuto neurale ad alta risoluzione utilizzando la pulizia dei tessuti CLARITY di grandi sezioni, combinata con la microscopia confocale standard. Questo protocollo descrive questo approccio attraverso i seguenti passaggi: 1) sezionare e preparare il tessuto neurale, 2) eliminare il tessuto, 3) montare il tessuto, 4) imaging delle fette preparate e 5) elaborare immagini di fette complete utilizzando la ricostruzione e l'analisi del software di visualizzazione al microscopio (Figura 2). Questi sforzi si traducono in immagini ad alta risoluzione che possono essere utilizzate per analizzare popolazioni di neuroni, modelli di connessione neuronale, morfologia dendritica 3D, abbondanza e morfologia della colonna vertebrale dendritica e modelli di espressione molecolare all'interno del tessuto cerebrale intatto.
Protocollo
Il seguente protocollo segue tutte le linee guida per la cura degli animali per il Baylor College of Medicine.
1. Dissezione e preparazione dei tessuti
- Eutanasia del topo con un sovradosaggio di isoflurano mettendo il topo in un contenitore chiuso con un asciugamano imbevuto di isoflurano (o con altri mezzi approvati IUCAC).
- Perfondere l'animale transcardicamente utilizzando un ago da 25 G con 10 ml di PBS ghiacciato, seguito da 10 ml di PFA al 4%.
- Sezionare la regione del cervello (o tessuto) di interesse.
- Posizionare il tessuto sezionato in PFA al 4% durante la notte a 4 °C. Una corretta fissazione è la chiave per questo protocollo. Non saltare o abbreviare questo passaggio.
- Dopo la fissazione in PFA al 4% per almeno 12 ore, trasferire il tessuto in una miscela di idrogel di acrilammide al 4% per 24 ore a 4 °C.
NOTA: Quando si scongela l'idrogel, assicurarsi che non si sia polimerizzato, questo può accadere se l'idrogel diventa troppo caldo. Scongelare sul ghiaccio per prevenire la polimerizzazione prematura.
2. Pulizia dei tessuti
- Posizionare il tessuto cerebrale (ancora immerso in idrogel) in un incubatore a vuoto per 3 ore a 37 °C con un vuoto di -90 kPa. Lasciare la parte superiore del tubo svitata per consentire al vuoto di formarsi correttamente.
- Lavare il tessuto con PBS per 10 minuti a temperatura ambiente (25 °C) con un leggero scuotimento.
- Posizionare il campione di tessuto polimerizzato nella camera di elettroforesi, tenendo nota dell'orientamento del tessuto all'interno della camera.
- Riempire la camera e il serbatoio con il buffer SDS per elettroforesi in dotazione.
- Eseguire il campione a 70 V, 1 A e 35 C, con corrente costante per circa 2 h/mm di tessuto.
- Controllare periodicamente il campione; potrebbe richiedere più tempo nella camera per cancellare correttamente. Un buon punto di partenza per la compensazione è 1-2 ore per mm di tessuto cerebrale. Un intero cervello di topo richiede 8-10 ore per una compensazione sufficiente. Ricordare l'orientamento del campione prima di rimuoverlo dalla camera e assicurarsi di sostituirlo di nuovo nella camera con lo stesso orientamento.
NOTA: la Figura 3A mostra come sarà un cervello completamente cancellato. Il cervello apparirà opaco e non chiaro in questa fase a causa della presenza di SDS disciolto, ma ci dovrebbe essere poca o nessuna tonalità colorata di tessuto giallo dopo l'estrazione dei lipidi.
- Controllare periodicamente il campione; potrebbe richiedere più tempo nella camera per cancellare correttamente. Un buon punto di partenza per la compensazione è 1-2 ore per mm di tessuto cerebrale. Un intero cervello di topo richiede 8-10 ore per una compensazione sufficiente. Ricordare l'orientamento del campione prima di rimuoverlo dalla camera e assicurarsi di sostituirlo di nuovo nella camera con lo stesso orientamento.
3. Preparazione e montaggio del tessuto eliminato
- Dopo che il campione ha terminato la pulizia e sembra sufficientemente chiaro, lavare in PBS durante la notte a temperatura ambiente. Sostituire il PBS con PBS fresco il più spesso possibile. Questo passaggio è fondamentale per rimuovere la SDS residua che può formare precipitati nelle fasi successive.
- Dopo il lavaggio finale in PBS, lavare il tessuto per 5 minuti in acqua deionizzata a temperatura ambiente tre volte. Il tessuto diventerà opaco in questa fase e potrebbe espandersi.
- Incubare il tessuto nella soluzione corrispondente all'indice di rifrazione (vedere Tabella 1) per almeno 4 ore a temperatura ambiente. La Figura 3B mostra un pezzo di tessuto eliminato dopo l'incubazione in soluzione di corrispondenza dell'indice di rifrazione.
- Durante l'incubazione del tessuto in soluzione di corrispondenza dell'indice di rifrazione, costruire una camera di alloggiamento adatta per l'immagine del campione, se necessario.
- Costruzione di una camera di imaging per piccoli campioni/fette di tessuto
- Utilizzando una diapositiva di vetro come base per il montaggio, posare distanziali in gomma o plastica e fissare con super colla. Se non sono disponibili distanziali predefiniti, utilizzare anelli di plastica realizzati con sezioni trasversali di tubi conici.
- Assicurarsi di fissare questi pezzi alla slitta di vetro senza fori (Figura 3C).
- Posizionare il tessuto eliminato nella camera di montaggio preriempita con la soluzione di corrispondenza dell'indice di rifrazione.
- Montare saldamente il tessuto posizionando una copertura di vetro sulla parte superiore e sigillandola con lo smalto per unghie.
- Immagina questo tessuto aggiungendo una goccia di soluzione di montaggio corrispondente all'indice di rifrazione direttamente sulla parte superiore del vetro.
- Grande camera di imaging tissutale
- Costruisci questa camera se il tessuto è più grande di 5 mm di spessore (adatto per cervelli o emisferi interi).
- Utilizzando un piatto di vetro da 10 cm con una parete alta, posizionare un tubo conico da 50 ml al centro, assicurandosi che il diametro del conico sia abbastanza grande da accettare la canna della lente dell'obiettivo utilizzata.
- Fare il 3% di agarose in acqua e versarlo nello spazio tra la teglia di vetro e il tubo conico, lasciare raffreddare per 1 ora (Figura 3D). Questo formerà un anello di agarose solido (Figura 3E).
- Aderire saldamente il tessuto sul fondo della camera usando super colla e riempire la camera con una soluzione di corrispondenza dell'indice di rifrazione. Applicare la colla per far aderire il tessuto su una regione che non verrà considerata per consentire il recupero del tessuto dal piatto senza danneggiare le regioni di interesse.
NOTA: questa preparazione è sensibile al tempo, poiché il mezzo dell'indice di rifrazione può iniziare a polimerizzare a meno che non sia conservato dall'aria e conservato a 4 °C.
4. Imaging di campioni di tessuto cancellati
- Acquisire l'immagine utilizzando un microscopio confocale adatto con un obiettivo 25x/0,95 NA con una distanza di lavoro di 4 mm.
- Accendere tutte le apparecchiature di imaging pertinenti. Posizionare il campione sul palco e posizionare una goccia di soluzione di corrispondenza dell'indice di rifrazione sulla parte superiore della camera di montaggio.
- Avvicinati con attenzione ai media di immersione con l'obiettivo e forma una colonna continua di media.
- Usando l'epifluorescenza, trova un campo di imaging appropriato.
- Iniziare la procedura di acquisizione delle immagini testando le impostazioni appropriate.
- Iniziare impostando le impostazioni di risoluzione e velocità di scansione utilizzando la Figura 4A come guida. Se si utilizza un microscopio confocale, chiudere completamente il foro stenopeico per ottenere la sezione ottica più piccola e quindi la migliore risoluzione z.
- Aumentare gradualmente la potenza del laser / guadagno del sensore fino a ottenere un'immagine adatta con un elevato rapporto segnale-rumore.
- Se si utilizza l'imaging a due colori EGFP/tdTomato standard, impostare le impostazioni di raccolta della luce utilizzando la Figura 4B come guida.
- Impostare i parametri z-stack in base ai punti di inizio e fine osservati del tessuto. Impostare la dimensione del passo in base alla risoluzione z desiderata utilizzando la Figura 4C come guida.
NOTA: le dimensioni dei gradini più piccole produrranno una maggiore risoluzione z, ma introdurranno anche più tempo di permanenza laser, portando potenzialmente allo sbiancamento del campione. - Se sei soddisfatto delle impostazioni di acquisizione delle immagini, acquisisci l'immagine.
- Assicurarsi che l'immagine abbia un elevato rapporto segnale-rumore e mostri confini distinti delle strutture (Figura 4D).
5. Elaborazione delle immagini e quantificazione 3D mediante software di analisi al microscopio
NOTA: i pacchetti software di analisi delle immagini microscopiche sono potenti strumenti per la visualizzazione e l'elaborazione tridimensionale delle immagini. Molti di questi programmi sono perfettamente adatti per la gestione di set di dati di grandi dimensioni generati dall'imaging di campioni di tessuto cancellati. I seguenti passaggi e le figure associate corrispondono al flusso di lavoro del software Imaris.
- Aprire lo stack di immagini e importarlo nel software di analisi selezionato.
- Visualizzare l'immagine nello spazio tridimensionale e apportare le modifiche desiderate alle tabelle di ricerca utilizzando il regolatore di visualizzazione per visualizzare meglio l'immagine.
NOTA: la Figura 5A dimostra la possibile profondità di imaging estrema accessibile attraverso la microscopia a 2 fotoni abbinata alla pulizia dei tessuti CLARITY. La Figura 5B mostra distinti processi dendrite e morfologie della colonna vertebrale chiaramente visibili dallo z-stack presentato nella Figura 5A. - Per filtrare qualsiasi sfondo coerente, fare clic sul pulsante Elaborazione immagini e selezionare il filtro di sottrazione dello sfondo.
NOTA: la Figura 5C mostra l'immagine con un segnale di sfondo confuso coerente prima dell'elaborazione. La Figura 5D mostra l'immagine dopo l'applicazione del filtro di sottrazione dello sfondo. - Osserva l'immagine 3D e acquisisci familiarità con essa osservandola da più angolazioni e livelli di zoom.
- Avviare la traccia dei dendriti selezionando prima lo strumento Tracciatore filamento.
- Fare clic su Modifica il filamento manualmente, Salta creazione automatica.
- Impostare la modalità su Percorso automatico e selezionare Le correzioni del centro automatico e del diametro automatico.
- Maiusc + clic destro sul corpo della cella per impostare un punto di partenza.
- Traccia il neurone lungo l'intera lunghezza del dendrite; fare clic con il pulsante sinistro del mouse sulla fine del dendrite per impostare il punto di terminazione in modo da consentire al software di calcolare automaticamente il percorso tra i punti iniziale e finale.
- Ripeti questo passaggio per tutti i dendriti e traccia completamente la struttura cellulare.
- Visualizza la cella tracciata e confermane l'accuratezza. Effettuare le regolazioni manuali in base alle esigenze.
- Selezionare la scheda Creazione.
- Selezionate l'opzione Ricalcolo diametro dendrite (Recompute Dendrite Diameter).
- Seguire la procedura guidata fino al completamento per un dendrite tracciato in modo più accurato.
- Selezionare la scheda Disegno.
- Fare clic sul pulsante di opzione Spine per iniziare a disegnare spine.
- Impostare il diametro approssimativo della colonna vertebrale in base alle esigenze e utilizzare lo strumento di misurazione per ottenere una rappresentazione accurata dei diametri della colonna vertebrale.
- Fare clic sul centro delle teste della colonna vertebrale per aggiungere una nuova colonna vertebrale.
- Ripeti questo per tutte le spine sul dendrite.
NOTA: È importante osservare il dendrite da tutte le angolazioni possibili quando si aggiungono manualmente spine. - Controllare la precisione delle spine appena aggiunte e apportare le modifiche necessarie.
- Selezionare la scheda Creazione.
- Selezionare l'opzione Recupera diametro colonna vertebrale per consentire al software di determinare i diametri corretti della testa e del collo, che sono fondamentali per l'analisi dei dati a valle.
- Seguire la procedura guidata di creazione del diametro della colonna vertebrale fino al completamento.
- Osservare il risultato del calcolo ed effettuare eventuali regolazioni manuali in base alle esigenze. La Figura 5E mostra un neurone completamente tracciato completo di spine.
- Per creare un elenco classificato di spine, selezionare la scheda Strumenti.
NOTA: l'estensione MATLAB deve essere installata affinché funzioni.- Per installare l'estensione MATLAB, apri la finestra delle preferenze.
- Selezionare l'opzione Strumenti personalizzati.
- Aggiungi l'MCR di runtime MATLAB appropriato.
- Fare clic su Classifica spine.
- Modificare i parametri desiderati per la classificazione della colonna vertebrale.
- Fai clic su Classifica spine nell'estensione MATLAB. La Figura 5F mostra il dendrite sovrapposto a spine classificate codificate a colori.
- Selezionare la scheda Statistiche.
- Configurare le statistiche desiderate per quantificare i dati facendo clic sul pulsante Configura nell'angolo in basso a sinistra di questa scheda.
- Una volta scelto il metodo di rappresentazione delle statistiche, esportare i dati utilizzando il pulsante Esporta statistiche su Tab Display to File situato in basso a destra di questa finestra.
- Rappresentare graficamente le statistiche utilizzando un metodo grafico preferito.
Risultati
Dopo l'acquisizione dell'immagine, la morfologia cellulare rappresentativa è stata analizzata utilizzando statistiche incorporate e classificando gli script all'interno del software di analisi. I dati raccolti (Figura 6A) riflettono che il neurone 2 ha una struttura dendritica più grande con una maggiore densità di spine. Nel complesso, i dati suggeriscono che il neurone 2 ha una struttura dendritica più complessa rispetto al neurone 1. Per corroborare questo risultato, è stata eseguita un'analisi standard di Sholl, che afferma che il neurone 2 è più dendricomente complesso del neurone 1 come indicato dall'aumento del numero di intersezioni di Sholl a 50-100 μm dal soma (Figura 6B). Infine, le spine dendritiche dei due neuroni ripresi sono state classificate in quattro categorie principali in base alle loro forme e dimensioni complessive. Le spine che presentano forme più simili a filopodi sono probabilmente sottotipi di colonna vertebrale più immaturi. Le spine con teste definite, chiamate spine di funghi, probabilmente contengono sinapsi più sviluppate e mature7. L'analisi qui presentata mostra che il neurone 1 contiene una percentuale maggiore di spine simili ai filopodi rispetto al neurone 2 (Figura 6C). Pertanto, in base alla morfologia, il neurone 2 è più maturo dal punto di vista dello sviluppo in quanto è più grande, più altamente ramificato e contiene una maggiore densità di spine mature.
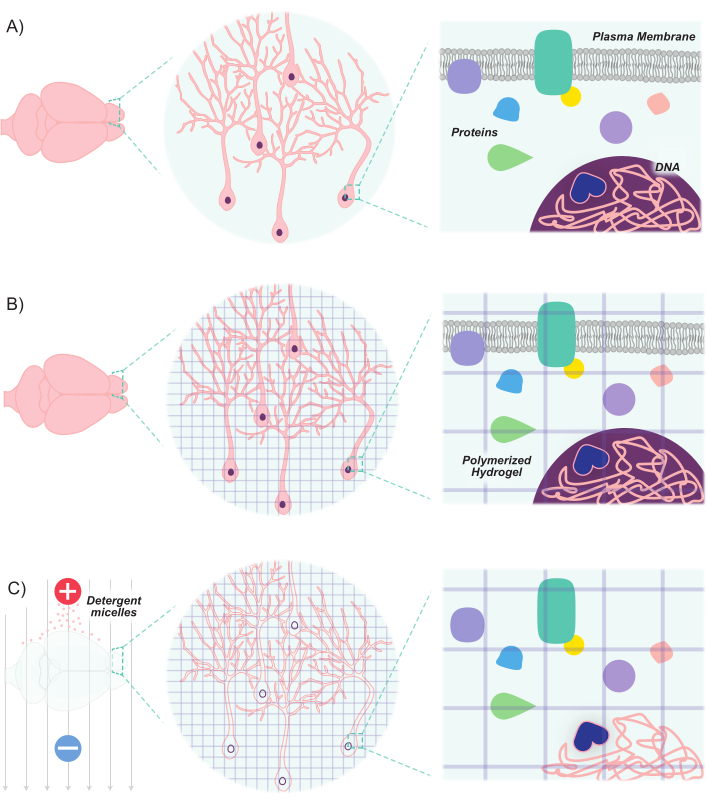
Figura 1: Il protocollo CLARITY rende i tessuti trasparenti mantenendo la struttura intrinseca e le relazioni spaziali molecola-molecola. (A) Orientamento originale del tessuto neuronale e dei componenti intercellulari prima della compensazione. (B) I monomeri di idrogel (linee viola) vengono infusi nel tessuto e polimerizzati in una rete di idrogel. Il tessuto e la rete idrogel sono reticolati tramite fissazione di formaldeide. (C) Il tessuto viene quindi lavato con soluzioni detergenti ioniche mentre esposto a campi elettrici. Durante questo processo, le micelle detergenti rimuovono le molecole lipidiche dal tessuto, lasciando dietro di sé una rete reticolata di idrogel trasparente e biomolecole. Fare clic qui per visualizzare una versione più grande di questa figura.
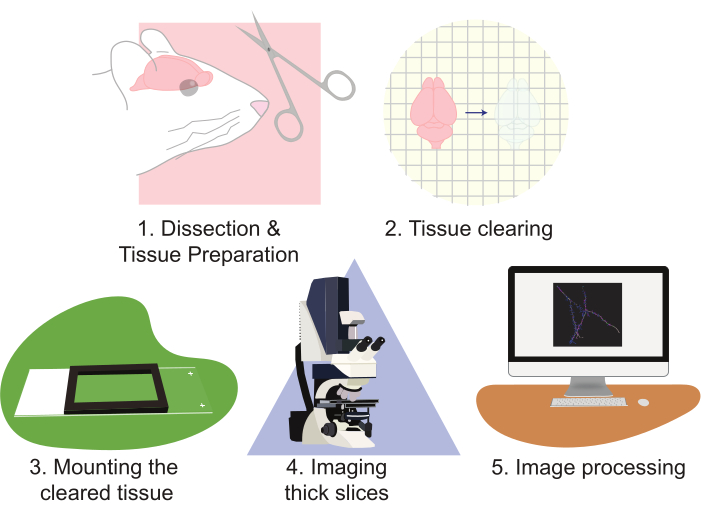
Figura 2: Diagramma di flusso del protocollo, diagramma della preparazione del tessuto, della pulizia, del montaggio, dell'imaging e dell'elaborazione delle immagini. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Costruzione di camere di montaggio per campioni di tessuto disboscati. (A) Eliminato l'intero cervello in PBS prima dell'immersione in una soluzione di corrispondenza dell'indice di rifrazione. (B) Brain slice in soluzione di corrispondenza dell'indice di rifrazione. (C) Camera di imaging per campioni di tessuto di grandi e piccoli dimensioni. Le camere possono essere realizzate utilizzando una varietà di materiali tra cui, ma non solo, plastiche stampate in 3D e tubi conici tagliati. (D) Camera di imaging per l'imaging dell'intero cervello o dell'emisfero, utilizzando un tubo conico da 50 ml come sollievo prima di versare l'agarose. (E) Camera di imaging dell'intero cervello o emisfero con agarose completamente impostato; questa configurazione è ottimale per obiettivi di immersione di barile di grandi dimensioni. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Acquisire set di dati di grandi dimensioni di alta qualità da campioni di tessuto cancellati. (A) Impostazioni di acquisizione delle immagini utilizzate per l'imaging ad alta risoluzione di intere cellule. Il foro stenopeico era completamente chiuso per consentire sezioni ottiche fini. La velocità di scansione è stata determinata empiricamente in base ai tempi di permanenza ottimali dei pixel. (B) Impostazioni del percorso luminoso: queste dipenderanno dal fluoroforo e dall'attrezzatura utilizzata. (C) impostazioni Z-stack; è stato utilizzato un fine z-step per acquisire quante più informazioni possibili nella direzione z. (D) Proiezione massima rappresentativa; la barra della scala rappresenta 25 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
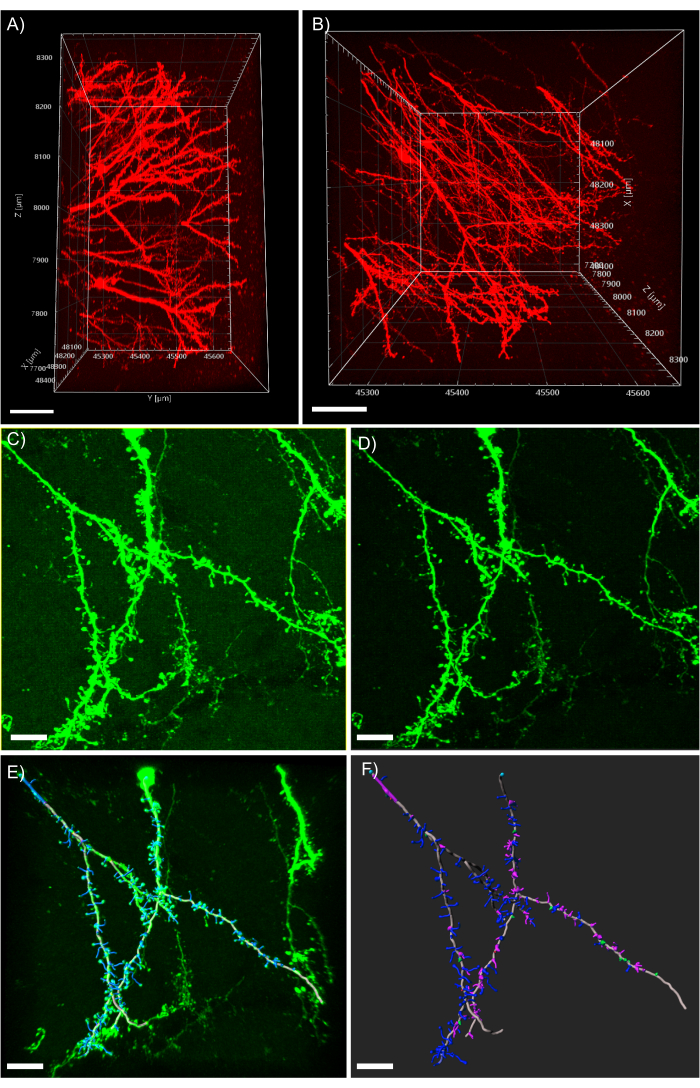
Figura 5: Analisi 3D dei dendriti nel software di analisi. (A) Vista laterale di uno z-stack di 600 μm acquisito da un tessuto di 1 mm di spessore che esprime tdTomato; la barra della scala rappresenta 100μm. (B) Vista dall'alto dello stesso z-stack acquisito nel pannello A; la barra della scala rappresenta 100μm. (C) Immagine acquisita confocale del tessuto che esprime EGFP. I file di immagine possono essere importati direttamente nel software di analisi e pre-elaborati per una maggiore qualità dell'immagine; la barra della scala rappresenta 25 μm. (D) La sottrazione di soglia viene utilizzata per rimuovere il segnale di fondo coerente presente in C. (E) Tracciatura del filamento e identificazione della colonna vertebrale: questo processo è meglio se eseguito semi-automatico con la funzione di auto-profondità controllata. Le spine sono state poi etichettate a mano dopo la ricostruzione completa della dendrite; la barra della scala rappresenta 25 μm. (F) Classificazione della colonna vertebrale utilizzando un'estensione MATLAB integrata. Le spine sono state codificate a colori in base alla loro morfologia; le spine tozze sono rosse; le spine dei funghi sono verdi; le spine lunghe e sottili sono blu; filopodia sono viola; la barra della scala rappresenta 25 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
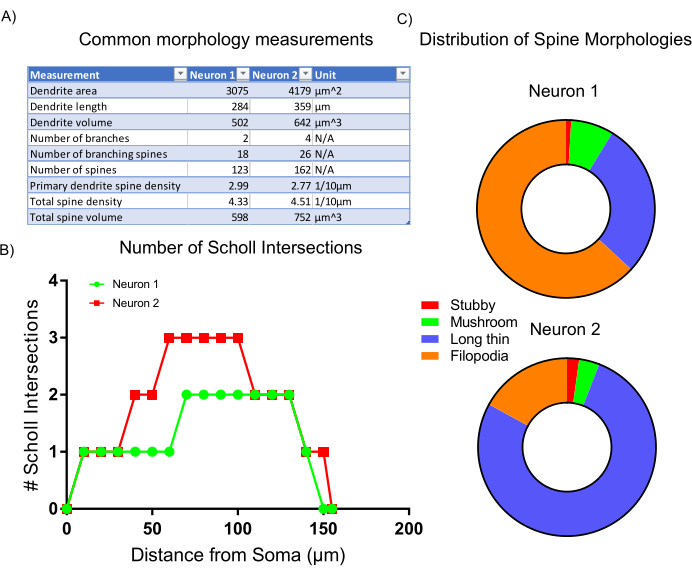
Figura 6: Risultati rappresentativi. (A) Tabella delle misure morfologiche comuni generate automaticamente dal programma di analisi selezionato. (B) Numero di intersezioni di Sholl generate dalle statistiche del programma. (C) Grafico a torta che rappresenta la distribuzione delle morfologie della colonna vertebrale dendritica. Fare clic qui per visualizzare una versione più grande di questa figura.
| Soluzione | Composizione | Note |
| Soluzione di corrispondenza dell'indice di rifrazione | 80 g di histodenz | pH a 7,5 con NaOH |
| 60 mL di tampone fosfato 0,02 M | Conservare a 4 °C | |
| 0,01% di azide di sodio | Adattato da Marx, V. Nature Methods volume 11, pagine 1209-1214 (2014) | |
| Idrogel | 13,33 ml di acrilammide al 30% (no-bis) | Mescolare insieme su ghiaccio, altrimenti la soluzione potrebbe iniziare a polimerizzare |
| 10 ml di PBS 10x | Aliquota e conservazione a -20 °C | |
| 250 mg di VA-044 | ||
| 76,66 mL di ddH2O |
Tabella 1: Ricette per la soluzione di corrispondenza delle immagini rifrattive e la soluzione idrogel. Sono elencate la composizione della soluzione di corrispondenza dell'indice di rifrazione e l'idrogel.
Discussione
Prima dell'avvento delle tecniche contemporanee di pulizia dei tessuti, lo studio della morfologia neuronale consisteva nel sezionamento, nell'imaging e nella ricostruzione di sezioni molto sottili adiacenti. L'uso della pulizia del tessuto elettroforetico in combinazione con l'imaging confocale fornisce una visione libera della morfologia neuronale completa. Dagli alberi dendritici intatti, fino al più piccolo bouton sinaptico, l'imaging e la quantificazione della morfologia neuronale non sono mai stati più fattibili.
La preparazione del tessuto cerebrale eliminato è semplice e richiede solo un pezzo di attrezzatura specializzata. Il tessuto eliminato e ripreso utilizzando questo protocollo sovverte la necessità di noiose sezioni sottili, manipolazione e montaggio, riducendo drasticamente il tempo dalla sperimentazione all'acquisizione dell'immagine. Inoltre, il tessuto ripreso senza sezionamento rimane più fedele alle strutture originali, in quanto non vi sono fonti di danno o necessaria ricostruzione dell'immagine post-hoc. Infine, questo protocollo consente di risparmiare tempo consentendo l'imaging simultaneo di caratteristiche su larga scala come gli alberi dendritici insieme a caratteristiche submicroniche su piccola scala come le spine.
Un'importante raccolta di passaggi in questo protocollo sono i passaggi di lavaggio che seguono il processo di compensazione. Questi passaggi sono fondamentali per rimuovere tutte le tracce del tampone di compensazione elettroforetica SDS. Se il tessuto eliminato non è sufficientemente lavato, si formeranno precipitati durante la fase di montaggio. Questi precipitati possono talvolta essere risolviti incubando il tessuto a 37-55 °C per un breve periodo. Tuttavia, se i precipitati persistono, disperderanno la luce, producendo scarsa profondità e qualità dell'immagine.
Il montaggio di grandi pezzi di tessuto rappresenta una sfida rispetto alla tradizionale imaging a fette sottili. Qui presentiamo più processi per montare tessuti di grandi dimensioni, che dipendono dalla tecnica di imaging, dalle proprietà della lente dell'obiettivo e dalle dimensioni del campione di tessuto. In primo luogo, è importante utilizzare una lente obiettiva adatta per l'immersione nello specifico mezzo di corrispondenza dell'indice di rifrazione utilizzato e che abbia una distanza di lavoro sufficiente per l'imaging di campioni di tessuto di grandi dimensioni. Questo protocollo è in gran parte limitato dalle proprietà ottiche della piattaforma di imaging utilizzata, in particolare dalla distanza di lavoro degli obiettivi. L'imaging in profondità è facilmente ottenuto utilizzando questo protocollo. Tuttavia, se non è disponibile un obiettivo con una distanza di lavoro sufficiente, il tessuto stesso presenterà una barriera fisica all'acquisizione di immagini di grandi dimensioni. La prossima decisione importante è la tecnica di imaging. La microscopia a due fotoni viene in genere utilizzata per la sua superba qualità dell'immagine, la profondità di imaging e la velocità di acquisizione. La microscopia a due fotoni consente l'imaging fino a 1 mm nel tessuto cancellato CLARITY senza perdita di qualità dell'immagine, come dimostrato nella Figura 5A,B. Tuttavia, risultati molto simili possono essere ottenuti quando si utilizza la microscopia confocale tradizionale anche se con un sacrificio alla profondità di imaging rispetto alla microscopia a due fotoni (Figura 5C,D).
In sintesi, questo metodo fornisce una piattaforma robusta e conveniente per analizzare la morfologia neuronale sia su larga che su piccola scala. Inoltre, questo metodo riduce in gran parte i tempi di gestione ed elaborazione, fornendo al contempo immagini tridimensionali più accurate e complete. La morfologia cellulare è un proxy comunemente usato per valutare la funzione del circuito e la salute alla base di molte malattie e patologie13,14,15. L'imaging della morfologia dei neuroni è potente, semplice e adatto per il test in una moltitudine di modelli di malattia.
Divulgazioni
Gli autori non hanno nulla da rivelare in questo momento.
Riconoscimenti
Vorremmo ringraziare il nucleo virale NRDDC presso l'Istituto neurologico Jan e Dan Duncan per la produzione di AAV e lentivirus utilizzati in questi esperimenti. Inoltre, vorremmo ringraziare il Baylor College of Medicine Center for Comparative Medicine per l'allevamento dei topi e la manutenzione generale dei topi utilizzati. Vorremmo ringraziare l'American Heart Association per il loro sostegno con il numero di premio 20PRE35040011 e BRASS: Baylor Research Advocates for Student Scientists per il loro supporto (PJH). Infine, vorremmo ringraziare Logos per aver fornito al nostro laboratorio il sistema di pulizia dei tessuti elettroforetici Logos X-Clarity.
Materiali
| Name | Company | Catalog Number | Comments |
| 15 mL Conical Tube | Thermo Scientific | 339650 | |
| 25 G x 1" Needle | BD | 305127 | |
| 30% Acrylamide (No-Bis) | National Diagnostics | EC-810 | |
| 50 mL Conical Tube | Thermo Scientific | 339653 | |
| Electrophoretic Tissue Clearing Solution | Logos | C13001 | |
| Histodenz | Sigma | D2158-100G | |
| Hydrogel Solution Kit | Logos | C1310X | |
| Imaris | Oxford Instruments | N/A | |
| Paraformaldehyde 16% | EMS | 15710 | |
| PBS, 1x, 500 mL, 6 bottles/case | fisher | MT21040CV | |
| VA-044 | Wako | 925-41020 | |
| X-CLARITY Polymerization System | Logos | C20001 | |
| X-CLARITY Tissue Clearing System II | Logos | C30001 |
Riferimenti
- Abbott, L. F., et al. The Mind of a mouse. Cell. 182 (6), 1372-1376 (2020).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philosophical transactions of the Royal Society of London. Series B, Biological Sciences. 314 (1165), 1(1986).
- Jiang, X., et al. Principles of connectivity among morphologically defined cell types in adult neocortex. Science. 350 (6264), (2015).
- Winnubst, J., et al. Reconstruction of 1,000 projection neurons reveals new cell types and organization of long-range connectivity in the mouse brain. Cell. 179 (1), 268-281 (2019).
- Araya, R., Vogels, T. P., Yuste, R. Activity-dependent dendritic spine neck changes are correlated with synaptic strength. Proceedings of the National Academy of Sciences of the United States of America. 111 (28), (2014).
- Bosch, M., Hayashi, Y. Structural plasticity of dendritic spines. Current Opinion in Neurobiology. 22 (3), 383-388 (2012).
- Martínez-Cerdeño, V. Dendrite and spine modifications in autism and related neurodevelopmental disorders in patients and animal models. Developmental Neurobiology. 77 (4), 393-404 (2017).
- Arenkiel, B. R., Ehlers, M. D. Molecular genetics and imaging technologies for circuit-based neuroanatomy. Nature. 461 (7266), 900-907 (2009).
- Kim, E. H., Chin, G., Rong, G., Poskanzer, K. E., Clark, H. A. Optical probes for neurobiological sensing and imaging. Accounts of Chemical Research. 51 (5), 1023-1032 (2018).
- Weissman, T. A., Pan, Y. A. Brainbow: New resources and emerging biological applications for multicolor genetic labeling and analysis. Genetics. 199 (2), 293-306 (2014).
- Haggerty, D. L., Grecco, G. G., Reeves, K. C., Atwood, B. Adeno-associated viral vectors in neuroscience research. Molecular Therapy - Methods and Clinical Development. 17, 69-82 (2020).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Kanning, K. C., Kaplan, A., Henderson, C. E. Motor neuron diversity in development and disease. Annual Review of Neuroscience. 33, 409-440 (2010).
- Ledda, F., Paratcha, G. Mechanisms regulating dendritic arbor patterning. Cellular and Molecular Life Sciences. 74 (24), 4511-4537 (2017).
- Falougy, H. E., Filova, B., Ostatnikova, D., Bacova, Z., Bakos, J. Neuronal morphology alterations in autism and possible role of oxytocin. Endocrine Regulations. 53 (1), 46-54 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon