Method Article
הדמיה וכימות של דנדריטים עצביים שלמים באמצעות ניקוי רקמות CLARITY
In This Article
Summary
מורפולוגיה דנדריטית עצבית לעתים קרובות עומדת בבסיס התפקוד. ואכן, תהליכי מחלה רבים המשפיעים על התפתחות הנוירונים באים לידי ביטוי עם פנוטיפ מורפולוגי. פרוטוקול זה מתאר שיטה פשוטה ורבת עוצמה לניתוח ארבורים דנדריטיים שלמים ואת קוציהם הקשורים.
Abstract
פעילות המוח, האותות האלקטרוכימיים המועברים בין נוירונים, נקבעת על ידי דפוסי הקישוריות של רשתות עצביות, ומהמורפולוגיה של תהליכים ותת-מבנים בתוך נוירונים אלה. ככזה, הרבה ממה שידוע על תפקוד המוח התעורר לצד התפתחויות בטכנולוגיות הדמיה המאפשרות תובנה נוספת על האופן שבו נוירונים מאורגנים ומחוברים במוח. שיפורים בניקוי רקמות אפשרו הדמיה ברזולוציה גבוהה של פרוסות מוח עבות, להקל על שחזור מורפולוגי ניתוחים של מבנים עצביים, כגון ארבורים דנדריטים וקוצים. במקביל, ההתקדמות בתוכנת עיבוד תמונה מספקת שיטות לניתוח מהיר של ערכות נתונים גדולות להדמיה. עבודה זו מציגה שיטה מהירה יחסית של עיבוד, הדמיה וניתוח פרוסות עבות של רקמה עצבית מסומנת ברזולוציה גבוהה באמצעות ניקוי רקמות CLARITY, מיקרוסקופיה קונפוקלית וניתוח תמונה. פרוטוקול זה יאפשר את המאמצים להבנת דפוסי הקישוריות והמורפולוגיות העצביות המאפיינות מוחות בריאים, ואת השינויים במאפיינים אלה המתעוררים במצבי מוח חולים.
Introduction
הבנת הארגון המרחבי, דפוסי הקישוריות והמורפולוגיה של מבנים ביולוגיים תלת-ממדיים מורכבים חיונית לתיווג הפונקציות של תאים ורקמות ספציפיים. זה נכון במיוחד במדעי המוח, שבהם הוקדש מאמץ עצום לבניית מפות נוירואנטומיות ברזולוציה גבוהה של מערכת העצבים המרכזית1,2. בחינה מדוקדקת של הנוירונים המרכיבים מפות אלה מניבה מורפורוגיות מגוונות, עם קשרים ומיקומים המשקפים את הפונקציה של קבוצות שונות אלה של נוירונים3,4. יתר על כן, חקירה של מבנים תת-תאיים, במיוחד קוצים דנדריטיים, יכולה ליידע את בגרות הסינפסות, ובכך לשקף תהליכים התפתחותיים ומדינות מחלה נוירולוגיות5,6,7. לכן, גישות המשפרות את רזולוציית ההדמיה ואת התפוקה חיוניות להבנה טובה יותר של תפקוד המוח בכל קנה מידה.
ההתקדמות האחרונה הרחיבה את ערכת הכלים המולקולרית והגנטית לסימון ומניפולציה של אוכלוסיות של נוירונים. הפיתוח של סמנים פלואורסצנטיים חדשים, בשילוב עם שיטות חדשות של החדרת סמנים אלה לתוך נוירונים, מאפשר תיוג דיפרנציאלי של אוכלוסיות של נוירונים אינטראקציה בתוך אותה חיה או דגימת מוח8,9,10,11. מכיוון שהאור מפוזר על ידי שומנים אטומים, ובהתחשב בתוכן השומנים הגבוה של רקמת המוח, אוכלוסיות עצביות הדמיה הוגבלה בעיקר לחלקים דקים או הסתמכה על טכניקות מיקרו-סקרופיות מתקדמות (למשל, קונפוקלית, מיקרוסקופיה רב-פוטונית וגיליון אור) למבנים עמוקים של תמונה. עם זאת, מאמצים אלה התחזקו מאוד על ידי התקדמות בטכניקות ניקוי רקמות. הדמיה נוקשה/חיסונים היברידיים/חיסונים היברידיים/חיסונים/ בהיברידיהתואמת רקמות (CLARITY) היא טכניקה אחת כזו, שבה רקמות מעניינות מושרות במונומרים הידרוג'ל (אקרילאמיד וביס-אקרילאמיד) ולאחר מכן נשטפות עם דטרגנטים12. המונומרים ההידרוג'לים מתכלים ויוצרים פיגום הידרוג'ל תלת-ממדי יציב שקוף אופטית וחדיר לתוויות מקרומולקוליות. חומצות גרעין וחלבונים נשמרים בתוך המטריצה ההיברידית, ואילו השומנים מוסרים על ידי שטיפת חומרי הניקוי(איור 1). התוצאה היא רקמה יציבה כי הוא נוקשה מספיק כדי לשמור על הצורה המקורית ואת הכיוון של תאים ומולקולות שאינן שומנים בדם, בעוד שקוף אופטית מספיק כדי בקלות לדמיין מבנים עמוקים ברזולוציה גבוהה. תחזוקה זו של מבנה הרקמה והכיוון מאפשרת הדמיה של פרוסות עבות, ובכך משמרת חיבורים בין תא לתא ויחסים מרחביים. יתר על כן, מכיוון שהמיקום והזמינות של חלבונים וחומצות גרעין נשמרים במהלך תהליך הסליקה, רקמות מנוקות מסוגלות להחזיק סמנים מבוססי ביטוי, כמו גם תוויות אקסוגניות. לכן, CLARITY משאילה את עצמה כשיטה רבת עוצמה להדמיה כמויות גדולות של מבני מוח עמוקים ואת הקשרים בין מבנים אלה ברזולוציה גבוהה.
השימוש ב- CLARITY משפר מאוד את הגישות לאוכלוסיות נוירונים הדמיה. טכניקה זו מיומנת במיוחד ביצירת כמויות גדולות של נתוני הדמיה. CLARITY עובד היטב עם צורות מרובות של פלואורסצנטיות מבוססת חלבון. פרוטוקול זה משתמש בגישה מבוססת lentiviral כדי לתייג תאים בדלילות עם EGFP ו tdTomato; עם זאת, אללס כתב מהונדס המביע tdTomato או EGFP לסמן תאים לשחזור שימשו באופן שגרתי. חשוב לבחור פלואורופור שהוא גם יציב בתמונה וגם בהיר (למשל, EGFP או tdTomato). בנוסף, שימוש במקדם חזק כדי לבטא את הפלורופור מניב ניגודיות מעולה ואיכות תמונה. החסרונות של טכניקה זו מתעוררים כמו ניתוח נכון של כמות גדולה זו של נתונים יכול להיות גם עבודה- וגם זמן אינטנסיבי. מיקרוסקופים מיוחדים יכולים לעזור לשפר את התפוקה ולהפחית את עומס העבודה. עם זאת, בנייה, בעלות ו/או הפעלת מיקרוסקופים מתקדמים הם לעתים קרובות עלות-אוסרת עבור מעבדות רבות. עבודה זו מציגה תפוקה גבוהה, מהירה יחסית, שיטה פשוטה לדמיין כמויות גדולות של רקמה עצבית ברזולוציה גבוהה באמצעות ניקוי רקמת CLARITY של חלקים גדולים, בשילוב עם מיקרוסקופיה קונפוקלית סטנדרטית. פרוטוקול זה מתאר גישה זו בשלבים הבאים: 1) ניתוח והכנת הרקמה העצבית, 2) ניקוי הרקמה, 3) הרכבת הרקמה, 4) הדמיה של הפרוסות המוכנות, ו -5) עיבוד תמונות פרוסה מלאות באמצעות שחזור וניתוח תוכנת הדמיה מיקרוסקופית(איור 2). מאמצים אלה גורמים לתמונות ברזולוציה גבוהה שניתן להשתמש בהן כדי לנתח אוכלוסיות של נוירונים, דפוסי חיבור עצביים, מורפולוגיה דנדריטית תלת-ממדית, שפע עמוד שדרה דנדריטי ומורפולוגיה, ודפוסי ביטוי מולקולריים בתוך רקמת מוח שלמה.
Protocol
הפרוטוקול הבא עוקב אחר כל הנחיות הטיפול בבעלי חיים עבור מכללת ביילור לרפואה.
1. ניתוח והכנת רקמות
- המת חסד את העכבר עם מנת יתר של איזופלוראן על ידי הצבת העכבר במיכל סגור עם מגבת ספוגה איזופלוריין (או באמצעים אחרים שאושרו IUCAC).
- לטבול את החיה באופן transcardially באמצעות מחט 25 G עם 10 מ"ל של PBS קר כקרח, ואחריו 10 מ"ל של 4% PFA.
- לנתח את אזור המוח (או רקמה) של עניין.
- מניחים את הרקמה ניתחת לתוך 4% PFA לילה ב 4 °C (50 °F). קיבוע נכון הוא המפתח לפרוטוקול זה. אל תדלג או תקצר שלב זה.
- לאחר קיבעון ב 4% PFA לפחות 12 שעות, להעביר את הרקמה לתערובת הידרוג'ל אקרילאמיד 4% עבור 24 שעות ב 4 °C (70 °F).
הערה: בעת הפשרת הידרוג'ל, ודא כי זה לא פולימר, זה יכול לקרות אם הידרוג'ל הופך חם מדי. להפשיר על קרח כדי למנוע פילמור מוקדם.
2. ניקוי רקמות
- מניחים את רקמת המוח (עדיין שקועה בהידרוג'ל) באינקובטור ואקום למשך 3 שעות ב-37 מעלות צלזיוס עם ואקום של -90 kPa. השאר את החלק העליון של הצינור ללא יצירה כדי לאפשר לוואקום להיווצר כראוי.
- לשטוף את הרקמה עם PBS במשך 10 דקות בטמפרטורת החדר (25 °C (25 °F) עם רועד עדין.
- מניחים את דגימת הרקמה הפולימרית בתא האלקטרופורזה, תוך שמירה על כיוון הרקמה בתוך התא.
- מלאו את התא והמאגר במאגר במאגר ה-SDS האלקטרופורזי שסופק.
- הפעל את המדגם ב 70 V, 1 A, ו 35 C, עם זרם קבוע עבור כ 2 h / מ"מ של רקמה.
- בדוק את המדגם מעת לעת; זה עשוי לדרוש יותר זמן בחדר כדי לנקות כראוי. נקודת התחלה טובה לסליקה היא 1-2 שעות למ"מ של רקמת המוח. מוח עכבר שלם דורש 8-10 שעות עבור ניקוי מספיק. זכור את הכיוון של המדגם לפני הסרתו מהתא והקפידו להחליף אותה בחזרה לתא באותו כיוון.
הערה: איור 3A מראה כיצד ייראה מוח נקי לחלוטין. המוח ייראה אטום ולא ברור בשלב זה בשל נוכחות של SDS מומס, אבל צריך להיות מעט מאוד גוון בצבע רקמה צהובה לאחר מיצוי שומנים בדם.
- בדוק את המדגם מעת לעת; זה עשוי לדרוש יותר זמן בחדר כדי לנקות כראוי. נקודת התחלה טובה לסליקה היא 1-2 שעות למ"מ של רקמת המוח. מוח עכבר שלם דורש 8-10 שעות עבור ניקוי מספיק. זכור את הכיוון של המדגם לפני הסרתו מהתא והקפידו להחליף אותה בחזרה לתא באותו כיוון.
3. הכנה והרכבה של הרקמה המנוקה
- לאחר המדגם סיים ניקוי ונראה ברור מספיק, לשטוף PBS לילה בטמפרטורת החדר. החלף את ה- PBS ב- PBS טרי לעתים קרובות ככל האפשר. שלב זה הוא קריטי להסרת SDS שיורית שיכולים ליצור משקעים בשלבים מאוחרים יותר.
- לאחר השטיפה הסופית ב- PBS, לשטוף את הרקמה במשך 5 דקות במים deionized בטמפרטורת החדר שלוש פעמים. הרקמה תהפוך אטומה בשלב זה ועשויה להתרחב.
- לדגור את הרקמה בתמיסת התאמת אינדקס שבירה (ראה טבלה 1) לפחות 4 שעות בטמפרטורת החדר. איור 3B מציג פיסת רקמה מנוקה לאחר הדגירה בתמיסת התאמת אינדקס שבירה.
- במהלך הדגירה של רקמות פתרון התאמת אינדקס שבירה, לבנות תא דיור מתאים כדי לדמיין את המדגם במידת הצורך.
- בניית תא הדמיה לדגימות/פרוסות רקמות קטנות
- באמצעות מגלשת זכוכית כבסיס להרכבה, הניחו מרווחי גומי או פלסטיק ומאובטחים בדבק-על. אם מרווחים מוכנים מראש אינם זמינים, השתמש בטבעות פלסטיק העשויות מקטעי צינור חרוט.
- ודאו לאבטח את החלקים האלה למגלשת הזכוכית ללא חורים(איור 3C).
- מניחים את הרקמה המנוקה בתא הרכבה ממולא מראש בתמיסת התאמת אינדקס שבירה.
- להרכיב את הרקמה בבטחה על ידי הנחת כיסוי זכוכית על גבי ואיטום אותו עם לק.
- תמונה רקמה זו על ידי הוספת טיפה של אינדקס שבירה התאמת פתרון הרכבה ישירות על גבי הזכוכית.
- תא הדמיית רקמות גדול
- בנה את התא הזה אם הרקמה גדולה מ-5 מ"מ (מתאימה למוח שלם או לחצי הכדור).
- באמצעות צלחת זכוכית 10 ס"מ עם קיר גבוה, למקם צינור חרוטי 50 מ"ל במרכז, לוודא כי הקוטר של חרוטי גדול מספיק כדי לקבל את הקנה של העדשה האובייקטיבית בשימוש.
- הפוך 3% agarose במים ולשפוך אותו בחלל בין צלחת זכוכית צינור חרוטי, לאפשר להתקרר במשך 1 שעות(איור 3D). זה יהווה טבעת של אגרוז מוצק(איור 3E).
- לדבוק את הרקמה בבטחה לתחתית התא באמצעות דבק סופר ולמלא את התא עם פתרון התאמת אינדקס שבירה. החל דבק כדי לדבוק את הרקמה על אזור שלא יהיה בתמונה כדי לאפשר טיוב של הרקמה מן המנה מבלי לפגוע באזורי העניין.
הערה: הכנה זו היא זמן רגיש, כמו מדיה אינדקס שבירה עשוי להתחיל פילמור אלא אם כן נשמר מהאוויר מאוחסן ב 4 °C (50 °F).
4. הדמיה דגימות רקמה מנוקה
- השג את התמונה באמצעות מיקרוסקופ קונפוקלי המתאים למטרה 25x/0.95 NA עם מרחק עבודה של 4 מ"מ.
- הפעל את כל ציוד ההדמיה הרלוונטי. הנח את המדגם על הבמה והנח טיפה של פתרון התאמת אינדקס שבירה על החלק העליון של תא הרכבה.
- גש בזהירות למדיית הטבילה במטרה וצור טור מדיה רציף.
- באמצעות אפיפלואורסצנטיות, למצוא שדה הדמיה מתאים.
- התחל את הליך רכישת התמונה על-ידי בדיקת ההגדרות המתאימות.
- התחל בקביעת הגדרות הרזולוציה ומהירות הסריקה באמצעות איור 4A כמדריך. אם הדמיה באמצעות מיקרוסקופ קונפוקלי, סגור באופן מלא את חור הסיכה כדי להשיג את החלק האופטי הקטן ביותר ולכן רזולוציית z הטובה ביותר.
- הגדל בהדרגה את עוצמת הלייזר/חיישן עד לקבלת תמונה מתאימה עם יחס אות לרעש גבוה.
- אם אתם משתמשים בהדמיה סטנדרטית של EGFP/tdTomato בשני צבעים, קבעו את הגדרות איסוף האור באמצעות איור 4B כמדריך.
- הגדר את הפרמטרים z-stack בהתבסס על נקודות ההתחלה והסיום שנצפו של הרקמה. הגדר את גודל השלב בהתבסס על רזולוציית z הרצויה באמצעות איור 4C כמדריך.
הערה: גדלי שלב קטנים יותר יניבו רזולוציית z גדולה יותר, אך גם יציגו זמן התעכבות לייזר גדול יותר, מה שעלול להוביל להלבנה לדוגמה. - כאשר אתה מרוצה מהגדרות רכישת התמונות, השג את התמונה.
- ודאו שלתמונה יש יחס אות לרעש גבוה ומציגים גבולות ברורים של מבנים(איור 4D).
5. עיבוד תמונה וכימות תלת-ממדי באמצעות תוכנת ניתוח מיקרוסקופיה
הערה: חבילות תוכנה לניתוח תמונה מיקרוסקופיות הן כלים רבי עוצמה להדמיה ועיבוד תמונה תלת-ממדית. רבות מתוכניות אלה מתאימות באופן מושלם לטיפול של ערכות נתונים גדולות הנוצרות מדגימות רקמות מנוקות הדמיה. השלבים הבאים והדמויות המשויכות תואמים לזרימת העבודה של התוכנה של Imaris.
- פתח את מחסנית התמונות וייבוא אותה לתוכנת הניתוח שנבחרה.
- הצג את התמונה במרחב תלת-ממדי ובצע את השינויים הרצויים בטבלאות בדיקת המידע באמצעות מתאם התצוגה כדי להציג את התמונה בצורה טובה יותר.
הערה: איור 5A מדגים את עומק ההדמיה הקיצוני האפשרי הנגיש באמצעות מיקרוסקופיה של 2 פוטונים בשילוב עם ניקוי רקמות CLARITY. איור 5B מציג תהליכי דנדריט ברורים, כמו גם מורפולוגיות עמוד שדרה גלויות בבירור מערימת z המוצגת באיור 5A. - כדי לסנן רקע עקבי, לחץ על לחצן עיבוד תמונה ובחר את מסנן חיסור הרקע.
הערה: איור 5C מציג את התמונה עם אות רקע מעורפל עקבי לפני העיבוד. איור 5D מציג את התמונה לאחר החלת מסנן חיסור הרקע. - התבונן בתמונה תלת-ממדית והיכר אותה על-ידי התבוננות בה מזוויות מרובות ורמות זום.
- התחל את המעקב של דנדריט על-ידי בחירה ראשונה בכלי מעקב הסיבים.
- לחץ על ערוך את הסיב באופן ידני, דלג על יצירה אוטומטית.
- הגדר את המצב לנתיב אוטומטי ובדוק תיקוני מרכז אוטומטי וקוטר אוטומטי.
- Shift + לחץ באמצעות לחצן העכבר הימני על גוף התא כדי להגדיר נקודת התחלה.
- לעקוב אחר הנוירון לאורך כל אורך הדנדריט; לחץ שמאל על סוף dendrite כדי להגדיר את נקודת הסיום כדי לאפשר לתוכנה לחשב באופן אוטומטי את הנתיב בין נקודות ההתחלה והסיום.
- חזור על שלב זה עבור כל הדנדריטים, ועקוב באופן מלא אחר מבנה התא.
- דמיין את התא במעקב ואשר את דיוקו. לבצע התאמות ידניות לפי הצורך.
- בחר בכרטיסיה יצירה.
- בחרו באפשרות 'קומץ מחדש של קוטר דנדריט'.
- עקוב אחר האשף כדי להשלים עבור דנדריט במעקב מדויק יותר.
- בחר בכרטיסיה ציור.
- לחץ על לחצן האפשרויות עמוד השדרה כדי להתחיל לצייר קוצים.
- הגדר את קוטר עמוד השדרה המשוער לפי הצורך, והשתמש בכלי המדידה כדי לקבל ייצוג מדויק של קטר עמוד השדרה.
- לחץ על מרכז ראשי עמוד השדרה כדי להוסיף עמוד שדרה חדש.
- חזור על זה לכל קוצי השדרה בדנדריט.
הערה: חשוב להתבונן בדנדריט מכל הזוויות האפשריות בעת הוספת קוצים באופן ידני. - בדוק את קוצים החדשים שנוספו לדיוק ובצע שינויים לפי הצורך.
- בחר בכרטיסיה יצירה.
- בחר באפשרות קומפר עמוד שדרה כדי לאפשר לתוכנה לקבוע את קטרי הראש והצוואר המתאימים, החיוניים לניתוח נתונים במורד הזרם.
- בצע את אשף יצירת קוטר עמוד השדרה עד לסיום.
- שים לב לתוצאה של החישוב ובצע התאמות ידניות לפי הצורך. איור 5E מראה נוירון במעקב מלא עם קוצים.
- כדי ליצור רשימה מסווגת של קוצים, בחר בכרטיסיה כלים.
הערה: יש להתקין את הרחבת MATLAB כדי שזה יפעל.- כדי להתקין את הרחבת MATLAB, פתח את חלון ההעדפות.
- בחר באפשרות כלים מותאמים אישית.
- הוסף את MCR זמן הריצה המתאים של MATLAB.
- לחץ על לסווג קוצים.
- ערוך את הפרמטרים הרצויים לסיווג עמוד השדרה.
- לחץ על לסווג קוצים על הרחבת MATLAB. איור 5F מציג את הדנדריט עם קוצים מסווגים מקודדים בצבע.
- בחר בכרטיסיה סטטיסטיקה.
- קבע את תצורת הסטטיסטיקה הרצויה כדי לכמת את הנתונים על-ידי לחיצה על לחצן קביעת תצורה בפינה הימנית התחתונה של כרטיסיה זו.
- לאחר בחירת שיטת הייצוג של סטטיסטיקה, יצא את הנתונים באמצעות לחצן יצא סטטיסטיקה בכרטיסיה הצג לקובץ הממוקם בפינה השמאלית התחתונה של חלון זה.
- גרף את הסטטיסטיקה בשיטת גרפים מועדפת.
תוצאות
לאחר רכישת התמונה, מורפולוגיית התא הייצוגי נותחה באמצעות סטטיסטיקה מוטבעת וסיווג סקריפטים בתוך תוכנת הניתוח. הנתונים שנאספו (איור 6A) משקפים שלנויר 2 יש מבנה דנדריטי גדול יותר עם צפיפות גבוהה יותר של קוצים. ככלל, הנתונים מראים כי נוירון 2 יש מבנה דנדריטי מורכב יותר לעומת נוירון 1. כדי לבסס תוצאה זו, בוצע ניתוח שול סטנדרטי, המאשר כי נוירון 2 מורכב יותר מבחינה דנדריטית מאשר נוירון 1 כפי שמציין המספר המוגבר של צמתים שול ב 50-100 מיקרומטר מהסומה (איור 6B). לבסוף, קוצים דנדריטיים של שני הנוירונים התדמיתיים סווגו לארבע קטגוריות עיקריות בהתבסס על הצורות והגדלים הכוללים שלהם. קוצים המציגים צורות דמויות פילופודיה יותר הם ככל הנראה תת-סוגים של עמוד שדרה לא בוגרים. קוצים עם ראשים מוגדרים, הנקראים קוצים פטריות, סביר להניח מכילים סינפסות מפותחות ובוגרות יותר7. הניתוח המוצג כאן מראה כי נוירון 1 מכיל חלק גדול יותר של קוצים דמויי פילופודיה בהשוואה לנוירון 2 (איור 6C). לכן, בהתבסס על מורפולוגיה, נוירון 2 הוא בוגר יותר מבחינה התפתחותית כפי שהוא גדול יותר, מסועף יותר, ומכיל צפיפות גבוהה יותר של קוצים בוגרים.
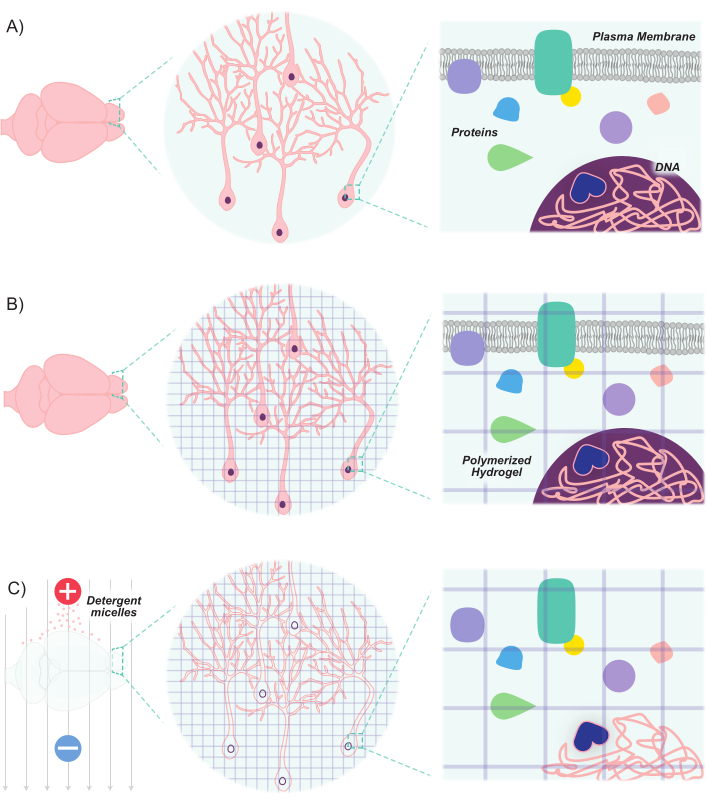
איור 1: פרוטוקול CLARITY הופך אתהרקמות לשקופות תוך שמירה על מבנה טבוע ויחסים מרחביים בין מולקולות. (A)אוריינטציה מקורית של רקמה עצבית ורכיבים בין-תאיים לפני הסליקה. (B)מונומרים הידרוג'ל (קווים סגולים) חדורים ברקמה ופולימרים לרשת הידרוג'ל. הרקמה ורשת ההידרוגלים מקושרים באמצעות קיבוע פורמלדהיד. (C)הרקמה נשטפת עם פתרונות ניקוי יוניים תוך חשיפה לשדות חשמליים. במהלך תהליך זה, מיכלי דטרגנט להסיר מולקולות שומנים מהרקמה, משאיר מאחורי רשת crosslinked של הידרוג'ל שקוף ביומולקולות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
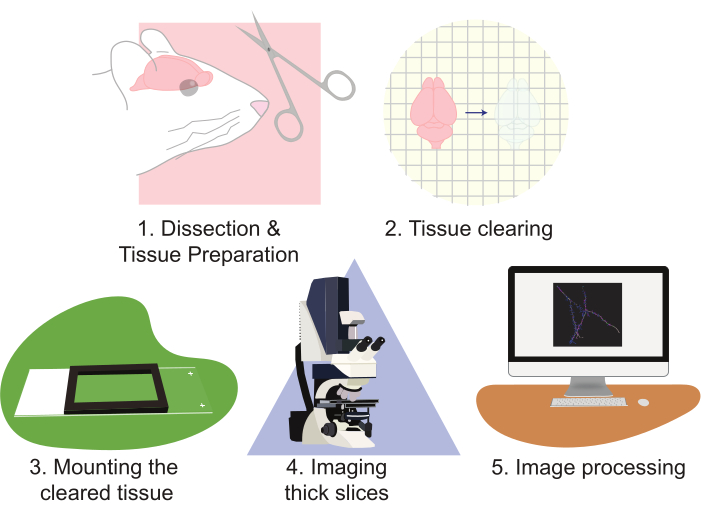
איור 2: תרשים זרימה של הפרוטוקול, תרשים הכנת הרקמה, ניקוי, הרכבה, הדמיה ועיבוד תמונה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: בניית תאי הרכבה לדגימות רקמות מנוקות. (A)פינה מוח שלם ב- PBS לפני טבילה בתמיסת התאמת אינדקס שבירה. (B)פרוסת מוח בתמיסת התאמת אינדקס שבירה. (C)תא הדמיה לדגימות רקמה גדולות וקטנות שנוקתה. ניתן ליצור את התאים באמצעות מגוון חומרים, כולל אך לא רק פלסטיק מודפס בתלת-ממד וצינורות חרוטים חתוכים. (D)חדר הדמיה להדמיית מוח או חצי כדור הארץ כולו, תוך שימוש בצינור חרוט 50 מ"ל כהקלה לפני שפיכת אגארוז. (E)תא הדמיה מוחי או חצי הכדור כולו עם אגרוז מוגדר לחלוטין; התקנה זו אופטימלית למטרות טבילה גדולות בחבית. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: רכש ערכות נתונים גדולות באיכות גבוהה מדגימות רקמה מנוקות. (A)הגדרות רכישת תמונה המשמשות להדמיה ברזולוציה גבוהה של תאים שלמים. חור הסיכה היה סגור לחלוטין כדי לאפשר מקטעים אופטיים עדינים. מהירות הסריקה נקבעה אמפירית בהתבסס על זמני השתהות פיקסלים אופטימליים. (B)הגדרות נתיב אור: אלה יהיו תלויים פלואורופור וציוד בשימוש. (C)הגדרות מחסנית Z; z-step עדין שימש כדי ללכוד מידע רב ככל האפשר בכיוון z ככל האפשר. (D)הקרנה מקסימלית מייצגת; סרגל קנה המידה מייצג 25 מיקרומטר. נא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
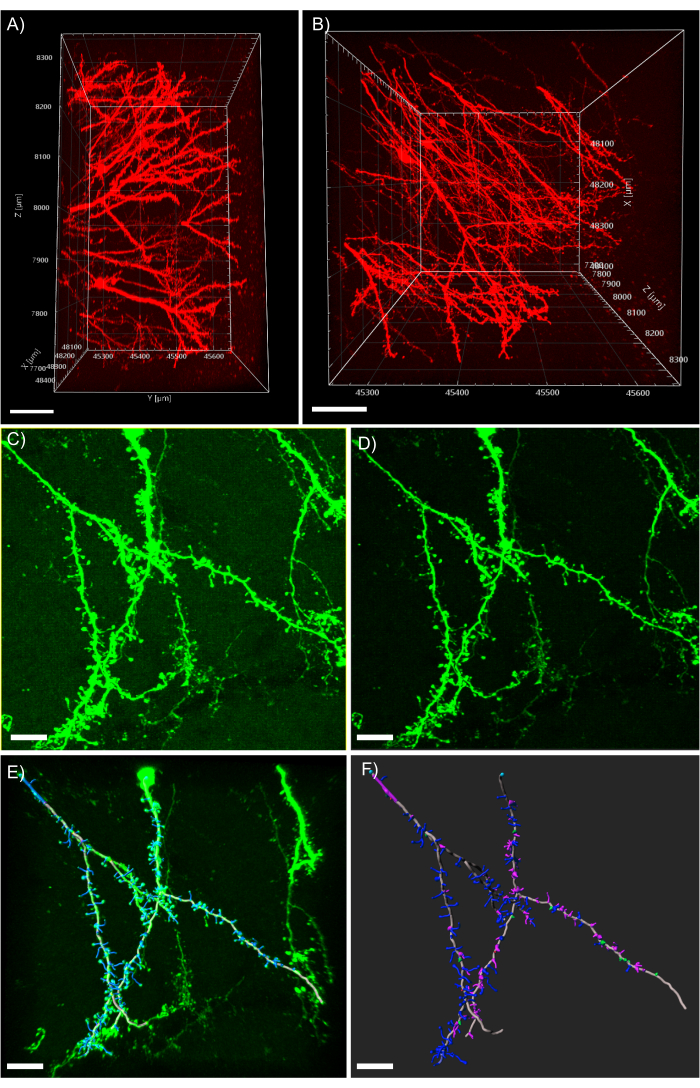
איור 5: ניתוח תלת-ממדי של דנדריטים בתוכנת הניתוח. (A)מבט צדדי של שני פוטונים שנרכשו 600 מיקרומטר z-stack שנרכשו מרקמה בעובי 1 מ"מ המבטאת tdTomato; סרגל קנה המידה מייצג 100μm. (B)תצוגה עליונה של אותה מחסנית z שנרכשה בלוח A; סרגל קנה המידה מייצג 100μm. (C) תמונה נרכשת קונפוקלית של רקמות המבטאות EGFP. ניתן לייבא קבצי תמונה ישירות לתוכנת הניתוח ולעבד אותם מראש לאיכות תמונה גבוהה יותר; סרגל קנה המידה מייצג 25 מיקרומטר. (D)חיסור סף משמש להסרת אות הרקע העקבי הקיימ ב- C. (E) מעקב חוט וזיהוי עמוד השדרה: תהליך זה הוא הטוב ביותר כאשר מתבצע חצי אוטומטי עם התכונה עומק אוטומטי מסומן. קוצים תויגו לאחר שחזור דנדריט מלא; סרגל קנה מידה מייצג 25 מיקרומטר. (F)סיווג עמוד השדרה באמצעות הרחבה מובנית של MATLAB. קוצים כבר מקודדים צבע על סמך המורפולוגיה שלהם; קוצים עבים הם אדומים; קוצים פטריות הם ירוקים; קוצים דקים ארוכים הם כחולים; פילופודיה סגולה; סרגל קנה המידה מייצג 25 מיקרומטר. נא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
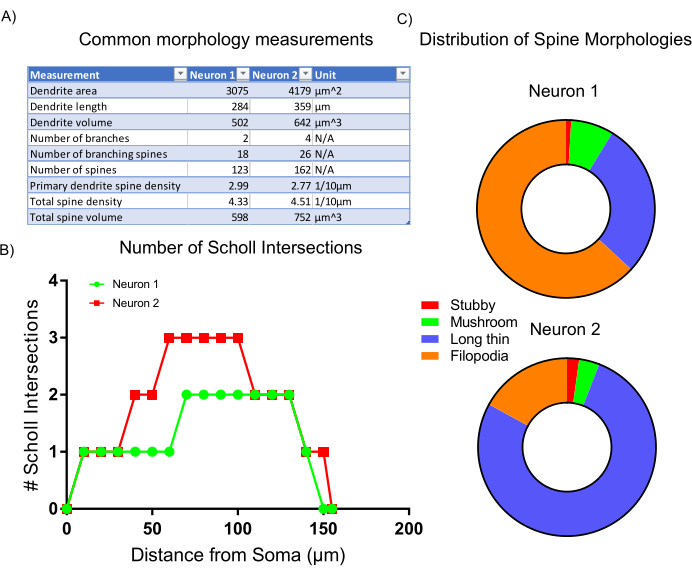
איור 6: תוצאות מייצגות. (A) טבלת מדידות מורפולוגיות נפוצות שנוצרת באופן אוטומטי על-ידי תוכנית הניתוח שנבחרה. (ב)מספר צמתים של שול שנוצרו על-ידי סטטיסטיקת תוכניות. (C)תרשים עוגה המייצג את התפלגות המורפורולוגיות של עמוד השדרה הדנדריטי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| תמיסה | הרכב | הערות |
| פתרון התאמת אינדקס שבירה | 80 גרם של היסטודנץ | pH ל-7.5 עם NaOH |
| 60 מ"ל של 0.02 M חוצץ פוספט | יש לאחסן ב- 4 °C (70 °F) | |
| 0.01% של נתרן אזיד | עיבוד מתוך מרקס, V. שיטות טבע כרך 11, עמודים 1209-1214 (2014) | |
| הידרוג'ל | 13.33 מ"ל של 30% אקרילאמיד (ללא ביס) | מערבבים יחד על קרח, אחרת הפתרון עשוי להתחיל פילמור |
| 10 מ"ל של 10x PBS | עליקוט וחנות ב -20 °C (70 °F) | |
| 250 מ"ג של VA-044 | ||
| 76.66 מ"ל של ddH2O |
טבלה 1: מתכונים לפתרון התאמת תמונה שבירה ופתרון הידרוג'ל. הרכב הפתרון התאמת אינדקס שבירה ואת הידרוג'ל מפורטים.
Discussion
לפני הופעתן של טכניקות עכשוויות לניקוי רקמות, לימוד מורפולוגיה עצבית כלל חתך, הדמיה ושחזור עתירי זמן של חלקים דקים מאוד סמוכים. שימוש בניקוי רקמות אלקטרופורטיות בשילוב עם הדמיה קונפוצלית מספק תצוגה ללא הפרעה של מורפולוגיה עצבית מלאה. מעצים דנדריטיים שלמים, עד לבוטון הסינפטי הקטן ביותר, הדמיה וכימות מורפולוגיה עצבית מעולם לא היו אפשריים יותר.
הכנת רקמת המוח המנוקה היא פשוטה ודורשת רק חתיכה אחת של ציוד מיוחד. רקמות מנוקות ומצטמצם באמצעות פרוטוקול זה חותרת תחת הצורך בחתך דק מייגע, טיפול והרכבה, ומפחיתה באופן דרסטי את הזמן מניסויים לרכישת תמונות. בנוסף, רקמה שתמונה ללא חתך נשארת נאמנה יותר למבנים המקוריים, שכן אין מקורות נזק או שחזור תמונה לאחר הוק הכרחי. לבסוף, פרוטוקול זה חוסך זמן על-ידי מתן אפשרות להדמיה סימולטנית של תכונות בקנה מידה גדול כגון עצים דנדריטיים לצד תכונות תת-מיקרון בקנה מידה קטן כגון קוצים.
אוסף חשוב אחד של שלבים בפרוטוקול זה הם שלבי הכביסה הבאים אחר תהליך הסליקה. שלבים אלה הם קריטיים להסרת כל העקבות של מאגר הסליקה האלקטרופורטית SDS. אם הרקמה המנוקה אינה שטופה מספיק, משקעים ייווצרו במהלך שלב ההרכבה. משקעים אלה יכולים לפעמים להיפתר מחדש על ידי דגירה של הרקמה ב 37-55 °C (55 °F) לזמן קצר. עם זאת, אם המשקעים יימשכו, הם יפזרו אור, שיניבו עומק הדמיה באיכות ירודים.
הרכבה של חתיכות גדולות של רקמה מהווה אתגר בהשוואה להדמיית פרוסה דקה מסורתית. כאן אנו מציגים תהליכים מרובים להרכבה על רקמות גדולות, התלויות בטכניקת ההדמיה, בתכונות העדשה האובייקטיבית ובגודל דגימת הרקמה. ראשית, חשוב להשתמש בעדשה אובייקטיבית המתאימה לטבילה במדיית ההתאמה הספציפית של אינדקס השבירה, ואשר יש לה מרחק עבודה מספיק להדמיית דגימות רקמות גדולות. פרוטוקול זה מוגבל במידה רבה על ידי המאפיינים האופטיים של פלטפורמת ההדמיה המשמשת, במיוחד מרחק העבודה של מטרות. הדמיה בעומק מושגת בקלות באמצעות פרוטוקול זה. עם זאת, אם מטרה עם מרחק עבודה מספיק אינה זמינה, הרקמה עצמה תציב מחסום פיזי לרכישת תמונות גדולות. ההחלטה החשובה הבאה היא טכניקת ההדמיה. מיקרוסקופיה דו-פוטונית משמשת בדרך כלל לאיכות התמונה המעולה שלה, עומק ההדמיה ומהירות הרכישה. מיקרוסקופיה דו-פוטונית מאפשרת הדמיה של עד 1 מ"מ לתוך רקמה מנוקה CLARITY ללא אובדן איכות התמונה כפי שהודגם באיור 5A,B. עם זאת, ניתן להשיג תוצאות דומות מאוד בעת שימוש במיקרוסקופיה קונפוקלית מסורתית אם כי עם הקרבה לעומק ההדמיה בהשוואה למיקרוסקופיה דו-פוטונית(איור 5C,D).
לסיכום, שיטה זו מספקת פלטפורמה חזקה ונוחה לניתוח מורפולוגיה עצבית בקנה מידה גדול וקטן כאחד. בנוסף, שיטה זו ממזערת במידה רבה את זמן הטיפול ועיבוד, תוך מתן תמונות תלת ממדיות מדויקות ומלאות יותר. מורפולוגיה תאית היא פרוקסי נפוץ להערכת תפקוד המעגל ובריאות שבבסיס מחלות ופתולוגיות רבות13,14,15. מורפולוגיה נוירון הדמיה הוא חזק, פשוט, ומתאים היטב כדי assay במגוון של מודלים מחלות.
Disclosures
למחברים אין מה לחשוף בשלב זה.
Acknowledgements
ברצוננו להודות ל- NRDDC הליבה הנגיפית במכון הנוירולוגי יאן ודן דאנקן על ייצור ה- AAVs וה- lentiviruses המשמשים בניסויים אלה. בנוסף, ברצוננו להודות למרכז ביילור לרפואה השוואתית על גידול עכברים ותחזוקה כללית של העכברים המשמשים. ברצוננו להודות לאיגוד הלב האמריקאי על תמיכתם תחת פרס מספר 20PRE35040011, ו- BRASS: תומכי מחקר ביילור למדעני סטודנטים על תמיכתם (PJH). לבסוף, ברצוננו להודות ללוגואים על שסיפקו למעבדה שלנו את מערכת ניקוי הרקמות האלקטרופורטיות Logos X-Clarity.
Materials
| Name | Company | Catalog Number | Comments |
| 15 mL Conical Tube | Thermo Scientific | 339650 | |
| 25 G x 1" Needle | BD | 305127 | |
| 30% Acrylamide (No-Bis) | National Diagnostics | EC-810 | |
| 50 mL Conical Tube | Thermo Scientific | 339653 | |
| Electrophoretic Tissue Clearing Solution | Logos | C13001 | |
| Histodenz | Sigma | D2158-100G | |
| Hydrogel Solution Kit | Logos | C1310X | |
| Imaris | Oxford Instruments | N/A | |
| Paraformaldehyde 16% | EMS | 15710 | |
| PBS, 1x, 500 mL, 6 bottles/case | fisher | MT21040CV | |
| VA-044 | Wako | 925-41020 | |
| X-CLARITY Polymerization System | Logos | C20001 | |
| X-CLARITY Tissue Clearing System II | Logos | C30001 |
References
- Abbott, L. F., et al. The Mind of a mouse. Cell. 182 (6), 1372-1376 (2020).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philosophical transactions of the Royal Society of London. Series B, Biological Sciences. 314 (1165), 1 (1986).
- Jiang, X., et al. Principles of connectivity among morphologically defined cell types in adult neocortex. Science. 350 (6264), (2015).
- Winnubst, J., et al. Reconstruction of 1,000 projection neurons reveals new cell types and organization of long-range connectivity in the mouse brain. Cell. 179 (1), 268-281 (2019).
- Araya, R., Vogels, T. P., Yuste, R. Activity-dependent dendritic spine neck changes are correlated with synaptic strength. Proceedings of the National Academy of Sciences of the United States of America. 111 (28), (2014).
- Bosch, M., Hayashi, Y. Structural plasticity of dendritic spines. Current Opinion in Neurobiology. 22 (3), 383-388 (2012).
- Martínez-Cerdeño, V. Dendrite and spine modifications in autism and related neurodevelopmental disorders in patients and animal models. Developmental Neurobiology. 77 (4), 393-404 (2017).
- Arenkiel, B. R., Ehlers, M. D. Molecular genetics and imaging technologies for circuit-based neuroanatomy. Nature. 461 (7266), 900-907 (2009).
- Kim, E. H., Chin, G., Rong, G., Poskanzer, K. E., Clark, H. A. Optical probes for neurobiological sensing and imaging. Accounts of Chemical Research. 51 (5), 1023-1032 (2018).
- Weissman, T. A., Pan, Y. A. Brainbow: New resources and emerging biological applications for multicolor genetic labeling and analysis. Genetics. 199 (2), 293-306 (2014).
- Haggerty, D. L., Grecco, G. G., Reeves, K. C., Atwood, B. Adeno-associated viral vectors in neuroscience research. Molecular Therapy - Methods and Clinical Development. 17, 69-82 (2020).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Kanning, K. C., Kaplan, A., Henderson, C. E. Motor neuron diversity in development and disease. Annual Review of Neuroscience. 33, 409-440 (2010).
- Ledda, F., Paratcha, G. Mechanisms regulating dendritic arbor patterning. Cellular and Molecular Life Sciences. 74 (24), 4511-4537 (2017).
- Falougy, H. E., Filova, B., Ostatnikova, D., Bacova, Z., Bakos, J. Neuronal morphology alterations in autism and possible role of oxytocin. Endocrine Regulations. 53 (1), 46-54 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved