Method Article
Imagem e quantificação de dendritos neuronais intactos via clareza de tecido
Neste Artigo
Resumo
A morfologia dendrítica neuronal muitas vezes está por trás da função. De fato, muitos processos de doenças que afetam o desenvolvimento de neurônios se manifestam com um fenótipo morfológico. Este protocolo descreve um método simples e poderoso para analisar arbores dendríticas intactas e suas espinhas associadas.
Resumo
A atividade cerebral, os sinais eletroquímicos passados entre os neurônios, é determinada pelos padrões de conectividade das redes neuronais, e pela morfologia dos processos e subestruturas dentro desses neurônios. Como tal, muito do que se sabe sobre a função cerebral surgiu ao lado de desenvolvimentos em tecnologias de imagem que permitem uma visão mais aprofundada sobre como os neurônios são organizados e conectados no cérebro. Melhorias na limpeza tecidual permitiram imagens de alta resolução de fatias cerebrais grossas, facilitando a reconstrução morfológica e análises de subestruturas neuronais, como arbóreos dendráticos e espinhas. Em conjunto, os avanços no software de processamento de imagens fornecem métodos de análise rápida de grandes conjuntos de dados de imagens. Este trabalho apresenta um método relativamente rápido de processamento, visualização e análise de fatias grossas de tecido neural rotulado em alta resolução usando clareira de tecido CLARITY, microscopia confocal e análise de imagem. Este protocolo facilitará os esforços para entender os padrões de conectividade e morfologias neuronais que caracterizam cérebros saudáveis, e as mudanças nessas características que surgem em estados cerebrais doentes.
Introdução
Compreender a organização espacial, padrões de conectividade e morfologia de estruturas biológicas tridimensionais complexas é essencial para delinear as funções de células e tecidos específicos. Isso é especialmente verdadeiro na neurociência, na qual um tremendo esforço tem sido dedicado à construção de mapas neuroanatomômicos de alta resolução do sistema nervoso central1,2. O exame minucial dos neurônios que compõem esses mapas produz morfologias variadas, com conexões e locais que refletem a função desses diversos conjuntos de neurônios3,4. Além disso, a investigação de estruturas subcelulares, especialmente colunas dendríticas, pode informar a maturidade das sinapses, refletindo assim processos de desenvolvimento e estados de doenças neurológicas5,6,7. Assim, abordagens que melhoram a resolução e o throughput de imagem são essenciais para uma melhor compreensão da função cerebral em todas as escalas.
Os recentes avanços expandiram o kit de ferramentas moleculares e genéticas para marcar e manipular populações de neurônios. O desenvolvimento de novos marcadores fluorescentes, combinados com novos métodos de introdução desses marcadores em neurônios, permite rotulagem diferencial de populações de neurônios interagindo dentro da mesma amostra animal ou cerebral8,9,10,11. Como a luz é dispersa por lipídios opacos, e dado o alto teor lipídeca do tecido cerebral, as populações neuronais de imagem foram limitadas principalmente a seções finas ou se basearam em técnicas avançadas de microscroba (por exemplo, confocal, multifótons e microscopia de folha de luz) para estruturas profundas de imagem. No entanto, esses esforços têm sido muito reforçados pelos avanços nas técnicas de limpeza de tecidos. Imagem rígida hibridada de lipídida/imunostaining/in situ hybridization-compatible Tissue-hYdrogel (CLARITY) é uma dessas técnicas, na qual tecidos de interesse são infundidos com monômeros de hidrogel (acrilamida e bis-acrilamida) e depois lavados com detergentes12. Os monômeros de hidrogel hibridizam-se para criar um andaime de hidrogel 3D estável que seja opticamente transparente e permeável aos rótulos de macromolécula. Os ácidos e proteínas nucleicos são mantidos dentro da matriz hibridizada, enquanto os lipídios são removidos pelas lavagens de detergente(Figura 1). Isso resulta em um tecido estável que é rígido o suficiente para manter a forma e orientação originais das células e moléculas não lipídicas, enquanto opticamente transparente o suficiente para facilmente imaginar estruturas profundas em alta resolução. Essa manutenção da estrutura e orientação tecidual permite a imagem de fatias grossas, preservando assim conexões célula-célula e relações espaciais. Além disso, como a localização e a disponibilidade de proteínas e ácidos nucleicos são mantidas durante o processo de compensação, os tecidos limpos são capazes de conter marcadores baseados em expressão, bem como rótulos exógenos. Assim, a CLARITY se presta como um método potente para a imagem de grandes quantidades de estruturas cerebrais profundas e as conexões entre essas estruturas em alta resolução.
O uso da CLARITY melhora muito as abordagens para as populações neuronais de imagem. Esta técnica é especialmente adepta à geração de grandes quantidades de dados de imagem. A CLARIDADE funciona bem com múltiplas formas de fluorescência à base de proteínas. Este protocolo utiliza uma abordagem baseada em lentiviral para células de rótulos escassos com EGFP e tdTomato; no entanto, alelos repórteres transgênicos expressando tdTomato ou EGFP para rotular células para reconstrução têm sido usados rotineiramente. É importante escolher um fluoróforo que seja foto-estável e brilhante (por exemplo, EGFP ou tdTomato). Além disso, usar um promotor forte para expressar o fluorohore produz contraste superior e qualidade de imagem. As desvantagens dessa técnica surgem como uma análise adequada dessa grande quantidade de dados pode ser tanto trabalhoso quanto tempo-intensivo. Microscópios especializados podem ajudar a melhorar o throughput e diminuir a carga de trabalho. No entanto, construir, possuir e/ou operar microscópios avançados são muitas vezes proibitivos de custos para muitos laboratórios. Este trabalho apresenta um método de alta produtividade, relativamente rápido e simples de visualizar grandes quantidades de tecido neural em alta resolução usando clareira de tecido DE GRANDE seções, combinada com microscopia confocal padrão. Este protocolo descreve essa abordagem através das seguintes etapas: 1) dissecação e preparação do tecido neural, 2) limpeza do tecido, 3) montagem do tecido, 4) imagens das fatias preparadas e 5) processamento de imagens completas de fatias utilizando reconstrução e análise de software de visualização de microscopia(Figura 2). Esses esforços resultam em imagens de alta resolução que podem ser usadas para analisar populações de neurônios, padrões de conexão neuronal, morfologia dendrítica 3D, abundância e morfologia da coluna dendrítica e padrões de expressão molecular dentro do tecido cerebral intacto.
Protocolo
O protocolo a seguir segue todas as diretrizes de cuidados com animais para o Baylor College of Medicine.
1. Dissecção e preparação de tecidos
- Eutanize o rato com uma overdose de isoflurane colocando o rato em um recipiente fechado com uma toalha encharcada em isoflurane (ou por outros meios aprovados pelo IUCAC).
- Perfumar o animal transcardialmente usando uma agulha de 25 G com 10 mL de PBS gelado, seguido por 10 mL de 4% pfa.
- Dissecar a região cerebral (ou tecido) de interesse.
- Coloque o tecido dissecado em 4% pfa durante a noite a 4 °C. A fixação adequada é a chave para este protocolo. Não pule ou encurte esta etapa.
- Após fixação em 4% de PFA por pelo menos 12h, transfira o tecido para uma mistura de hidrgel de acrilamida de 4% por 24 h a 4 °C.
NOTA: Ao descongelar o hidrogel, certifique-se de que ele não tenha polimerizado, isso pode acontecer se o hidrogel ficar muito quente. Descongele no gelo para evitar a polimerização prematura.
2. Limpeza de tecidos
- Coloque o tecido cerebral (ainda submerso em hidrogel) em uma incubadora de vácuo por 3h a 37 °C com um vácuo de -90 kPa. Deixe a parte superior do tubo desparafusada para permitir que o vácuo se forme corretamente.
- Lave o tecido com PBS por 10 minutos em temperatura ambiente (25 °C) com agitação suave.
- Coloque a amostra de tecido polimerizado na câmara de eletroforese, observando a orientação do tecido dentro da câmara.
- Encha a câmara e o reservatório com o tampão SDS de eletroforese fornecido.
- Execute a amostra a 70 V, 1 A e 35 C, com corrente constante para cerca de 2 h/mm de tecido.
- Verifique a amostra periodicamente; pode exigir mais tempo na câmara para limpar adequadamente. Um bom ponto de partida para limpar é 1-2 h por mm de tecido cerebral. Um cérebro inteiro de rato requer 8-10 h para limpeza suficiente. Lembre-se da orientação da amostra antes de removê-la da câmara e certifique-se de substituí-la de volta para a câmara na mesma orientação.
NOTA: A figura 3A mostra como será um cérebro totalmente limpo. O cérebro parecerá opaco e não claro nesta fase devido à presença de SDS dissolvido, mas deve haver pouco ou nenhum tom de tecido amarelo colorido após a extração lipídica.
- Verifique a amostra periodicamente; pode exigir mais tempo na câmara para limpar adequadamente. Um bom ponto de partida para limpar é 1-2 h por mm de tecido cerebral. Um cérebro inteiro de rato requer 8-10 h para limpeza suficiente. Lembre-se da orientação da amostra antes de removê-la da câmara e certifique-se de substituí-la de volta para a câmara na mesma orientação.
3. Preparar e montar o tecido limpo
- Depois que a amostra terminar de limpar e parecer suficientemente clara, lave em PBS durante a noite à temperatura ambiente. Substitua o PBS por PBS fresco o mais frequentemente possível. Esta etapa é fundamental para remover SDS residuais que podem formar precipitados em etapas posteriores.
- Após a lavagem final na PBS, lave o tecido por 5 minutos em água deionizada à temperatura ambiente três vezes. O tecido ficará opaco nesta etapa e poderá se expandir.
- Incubar o tecido na solução de correspondência de índice refrativo (ver Tabela 1) por pelo menos 4h à temperatura ambiente. A Figura 3B mostra um pedaço de tecido limpo após a incubação na solução de correspondência de índices refrativos.
- Durante a incubação de tecidos em solução de correspondência de índices refrativos, construa uma câmara de habitação adequada para a imagem da amostra, se necessário.
- Construindo uma câmara de imagem para pequenas amostras/fatias de tecido
- Usando um slide de vidro como base para montagem, deite borracha ou espaçadores plásticos e fixe com super cola. Se os espaçadores pré-fabricados não estiverem disponíveis, use anéis plásticos feitos de seções transversais de tubos cônicos.
- Certifique-se de fixar essas peças na lâmina de vidro sem nenhum furo(Figura 3C).
- Coloque o tecido limpo na câmara de montagem pré-preenchido com a solução de correspondência de índice refrativo.
- Montar o tecido com segurança colocando uma mancha de vidro em cima e selando-o com esmalte.
- Imagem deste tecido adicionando uma gota de índice de refração combinando solução de montagem diretamente em cima do vidro.
- Câmara de imagem de tecido grande
- Construa esta câmara se o tecido tiver mais de 5 mm de espessura (adequado para cérebros inteiros ou hemisférios).
- Usando um prato de vidro de 10 cm com uma parede alta, coloque um tubo cônico de 50 mL no centro, certificando-se de que o diâmetro do cônico é grande o suficiente para aceitar o barril da lente objetiva utilizada.
- Faça 3% de agarose na água e despeje-a no espaço entre o prato de vidro e o tubo cônico, deixe esfriar por 1 h(Figura 3D). Isso formará um anel de agarose sólida(Figura 3E).
- Adere firmemente o tecido à parte inferior da câmara usando super cola e encha a câmara com solução de correspondência de índice refrativo. Aplique cola para aderir o tecido em uma região que não será imageda para permitir a recuperação do tecido do prato sem danificar as regiões de interesse.
NOTA: Esta preparação é sensível ao tempo, pois a mídia de índice de refração pode começar a polimerizar a menos que seja preservada do ar e armazenada a 4 °C.
4. Amostras de tecidos limpos por imagem
- Adquira a imagem usando um microscópio confocal com um objetivo DE 25x/0,95 NA com uma distância de trabalho de 4 mm.
- Ligue todos os equipamentos de imagem relevantes. Coloque a amostra no palco e coloque uma gota de solução de correspondência de índice refrativo na parte superior da câmara de montagem.
- Aproxime cuidadosamente os meios de comunicação de imersão com o objetivo e forme uma coluna contínua de mídia.
- Usando epifluorescência, encontre um campo de imagem apropriado.
- Inicie o procedimento de aquisição de imagens testando as configurações apropriadas.
- Comece definindo as configurações de resolução e digitalização de velocidade usando a Figura 4A como guia. Se a imagem usar um microscópio confocal, feche totalmente o pinhole para obter a menor seção óptica e, portanto, melhor resolução z.
- Aumente gradualmente o ganho de potência/sensor a laser até que uma imagem adequada seja obtida com uma alta relação sinal-ruído.
- Se utilizar imagens padrão EGFP/tdTomato de duas cores, defina as configurações da coleta de luz usando a Figura 4B como guia.
- Defina os parâmetros de pilha z com base nos pontos de partida e extremidade observados do tecido. Defina o tamanho da etapa com base na resolução z desejada usando a Figura 4C como guia.
NOTA: Tamanhos de passos menores produzirão uma resolução z maior, mas também introduzirão mais tempo de moradia a laser, potencialmente levando ao branqueamento da amostra. - Quando estiver satisfeito com as configurações de aquisição de imagens, adquira a imagem.
- Certifique-se de que a imagem tenha uma alta relação sinal-ruído e mostre limites distintos de estruturas(Figura 4D).
5. Processamento de imagem e quantificação 3D utilizando software de análise de microscopia
NOTA: Os pacotes de software de análise de imagens microscópicas são ferramentas poderosas para visualização e processamento de imagens tridimensionais. Muitos desses programas são perfeitamente adequados para o manuseio de grandes conjuntos de dados que são gerados a partir de amostras de tecidos limpos por imagens. As etapas a seguir e as figuras associadas correspondem ao fluxo de trabalho do software Imaris.
- Abra a pilha de imagens e importe-a para o software de análise selecionado.
- Visualize a imagem em espaço tridimensional e faça quaisquer alterações desejadas nas tabelas de imagens usando o ajustador de exibição para visualizar melhor a imagem.
NOTA: A Figura 5A demonstra a possível profundidade extrema de imagem acessível através de microscopia de 2 fótons emparelhadas com a limpeza do tecido CLARITY. A Figura 5B mostra processos dendrite distintos, bem como morfologias claramente visíveis da coluna vertebral da pilha z apresentadas na Figura 5A. - Para filtrar qualquer plano de fundo consistente, clique no botão Processamento de imagens e selecione o filtro de subtração de fundo.
NOTA: A figura 5C mostra a imagem com um sinal de fundo nebuloso consistente antes do processamento. A figura 5D mostra a imagem após a aplicação do filtro de subtração de fundo. - Observe a imagem 3D e familiarize-se com ela olhando-a de vários ângulos e níveis de zoom.
- Inicie o traçado dendrite selecionando primeiro a ferramenta rastreador Filamento.
- Clique em Editar o Filamento manualmente, pular a criação automática.
- Defina o modo para o caminho automático e verifique correções de auto-centro e de diâmetro automático.
- Shift + clique com o botão direito do mouse no corpo da célula para definir um ponto de partida.
- Traçar o neurônio ao longo de toda a extensão do dendrite; clique à esquerda na extremidade do dendrite para definir o ponto de término para permitir que o software calcule automaticamente o caminho entre os pontos de partida e final.
- Repita este passo para todos os dendritos, e rastreie totalmente a estrutura celular.
- Visualize a célula rastreada e confirme sua precisão. Faça ajustes manuais conforme necessário.
- Selecione a guia Criação.
- Selecione a opção Diâmetro do dendrite de recomputar.
- Siga o assistente até a conclusão para um dendrite mais precisamente rastreado.
- Selecione a guia Desenhar.
- Clique no botão de rádio Spine para começar a desenhar colunas.
- Defina o diâmetro aproximado da coluna vertebral conforme necessário e use a ferramenta de medição para obter uma representação precisa dos diâmetros da coluna vertebral.
- Clique no centro das cabeças da coluna para adicionar uma nova coluna.
- Repita isso para todas as espinhas no dendrite.
NOTA: É importante observar o dendrite de todos os ângulos possíveis ao adicionar manualmente as espinhas. - Verifique as espinhas recém-adicionadas para obter precisão e faça alterações conforme necessário.
- Selecione a guia Criação.
- Selecione a opção Recompute Spine Diameter para permitir que o software determine os diâmetros adequados da cabeça e do pescoço, que são cruciais para a análise dos dados a jusante.
- Siga o mago de criação do diâmetro da coluna até a conclusão.
- Observe o resultado da computação e faça quaisquer ajustes manuais conforme necessário. A Figura 5E mostra um neurônio totalmente traçado com espinhas.
- Para criar uma lista classificada de colunas, selecione a guia Ferramentas.
NOTA: A extensão MATLAB deve ser instalada para que isso funcione.- Para instalar a extensão MATLAB, abra a janela de preferências.
- Selecione a opção Ferramentas Personalizadas.
- Adicione o MCR de tempo de execução MATLAB apropriado.
- Clique em Classificar espinhas.
- Edite os parâmetros desejados para classificação da coluna vertebral.
- Clique em Classificar colunas na extensão MATLAB. A Figura 5F mostra o dendrite sobreposto com colunas classificadas codificadas por cores.
- Selecione a guia Estatísticas.
- Configure as estatísticas desejadas para quantificar os dados clicando no botão Configurar no canto inferior esquerdo desta guia.
- Uma vez escolhido o método de representação estatística, exporte os dados usando o botão Export Statistics on Tab Display to File localizado no canto inferior direito desta janela.
- Gráfico das estatísticas usando um método de grafação preferido.
Resultados
Após a aquisição de imagens, a morfologia celular representativa foi analisada utilizando estatísticas incorporadas e classificando scripts dentro do software de análise. Os dados coletados (Figura 6A) refletem que o neurônio 2 tem uma estrutura dendrítica maior com maior densidade de espinhas. Como um todo, os dados sugerem que o neurônio 2 tem uma estrutura dendrítica mais complexa em comparação com o neurônio 1. Para comprovar esse resultado, foi realizada a análise padrão de Sholl, que afirma que o neurônio 2 é mais dendriticamente complexo que o neurônio 1, conforme denotado pelo aumento do número de intersecções de Sholl a 50-100 μm da soma(Figura 6B). Finalmente, as espinhas dendríticas dos dois neurônios imagem foram classificadas em quatro categorias principais com base em suas formas e tamanhos gerais. Espinhos que exibem formas mais filopodias são provavelmente subtipos mais imaturos da coluna vertebral. Espinhos com cabeças definidas, chamadas espinhos de cogumelo, provavelmente contêm sinapses mais desenvolvidas e maduras7. A análise aqui apresentada mostra que o neurônio 1 contém uma proporção maior de espinhas semelhantes à filopodia em comparação com o neurônio 2 (Figura 6C). Assim, com base na morfologia, o neurônio 2 é mais maduro de desenvolvimento por ser maior, mais ramificado e contém uma maior densidade de espinhas maduras.
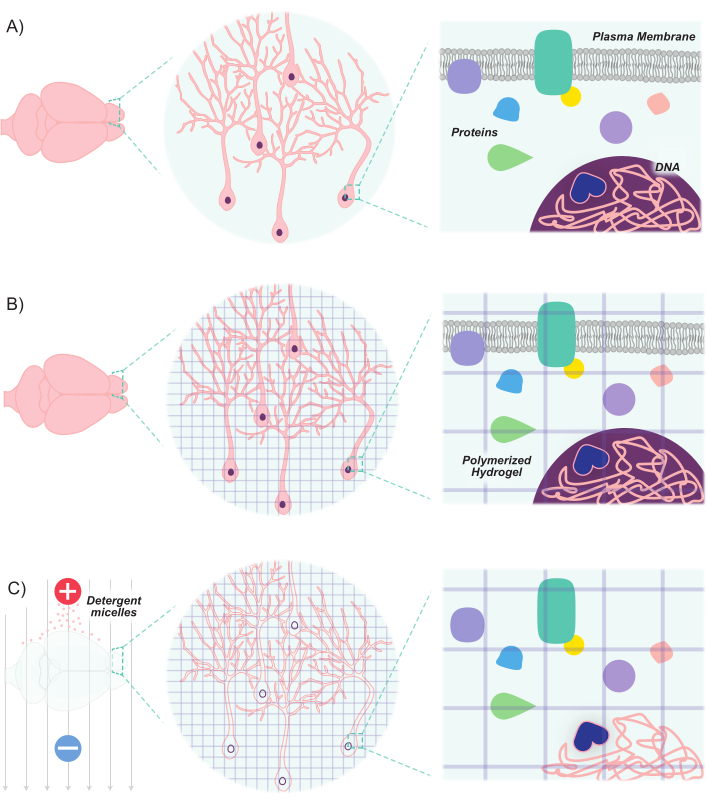
Figura 1: O protocolo CLARITY torna os tecidos transparentes, mantendo a estrutura inerente e as relações espaciais molécula-molécula. (A) Orientação original do tecido neuronal e componentes intercelulares antes da limpeza. (B) Monômeros de hidrogel (linhas roxas) são infundidos no tecido e polimerizados em uma malha de hidrogel. A malha de tecido e hidrogel são interligadas através da fixação de formaldeído. (C) O tecido é então lavado com soluções de detergente iônico enquanto exposto a campos elétricos. Durante esse processo, as micelas detergentes removem moléculas lipídicas do tecido, deixando para trás uma rede interligada de hidrogel transparente e biomoléculas. Clique aqui para ver uma versão maior desta figura.
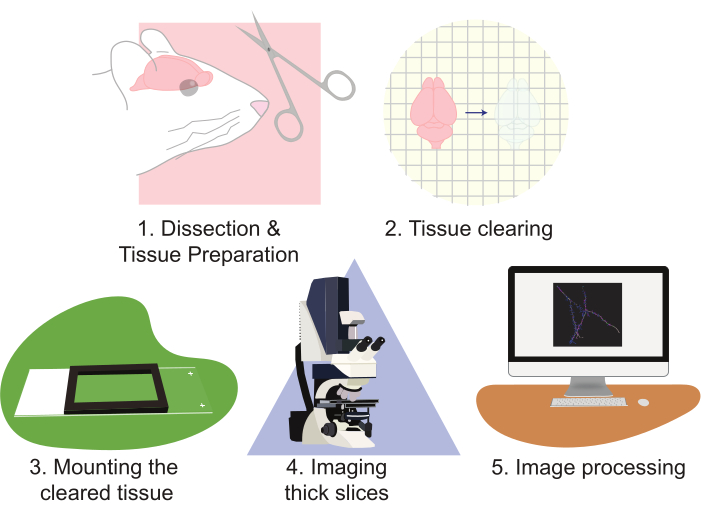
Figura 2: Fluxograma do protocolo, diagramando a preparação do tecido, limpeza, montagem, imagem e processamento de imagens. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 3: Construção de câmaras de montagem para amostras de tecido limpo. (A) Limpou cérebro inteiro em PBS antes da imersão na solução de correspondência de índices refrativos. (B) Fatia cerebral na solução de correspondência de índices refrativos. (C) Câmara de imagem para amostras de tecido grande e pequeno. As câmaras podem ser feitas usando uma variedade de materiais, incluindo, mas não se limitando a plásticos impressos em 3D e tubos cônicos cortados. (D) Câmara de imagem para imagens cerebrais inteiras ou hemisférios, usando tubo cônico de 50 mL como um alívio antes de derramar agarose. (E) Câmara de imagem do cérebro ou hemisfério inteiro com agarose totalmente definida; esta configuração é ideal para grandes objetivos de imersão de barril. Clique aqui para ver uma versão maior desta figura.

Figura 4: Adquira grandes conjuntos de dados de alta qualidade a partir de amostras de tecido limpo. (A) Configurações de aquisição de imagens usadas para imagens de alta resolução de células inteiras. O orifício foi totalmente fechado para permitir seções ópticas finas. A velocidade de varredura foi determinada empiricamente com base nos melhores tempos de moradia dos pixels. (B) Configurações de caminho leve: estes dependerão do fluorohore e do equipamento utilizado. (C) Configurações de pilha de Z; um passo z fino foi usado para capturar o máximo de informações na direção z possível. (D) Projeção máxima representativa; barra de escala representa 25 μm. Por favor clique aqui para ver uma versão maior desta figura.
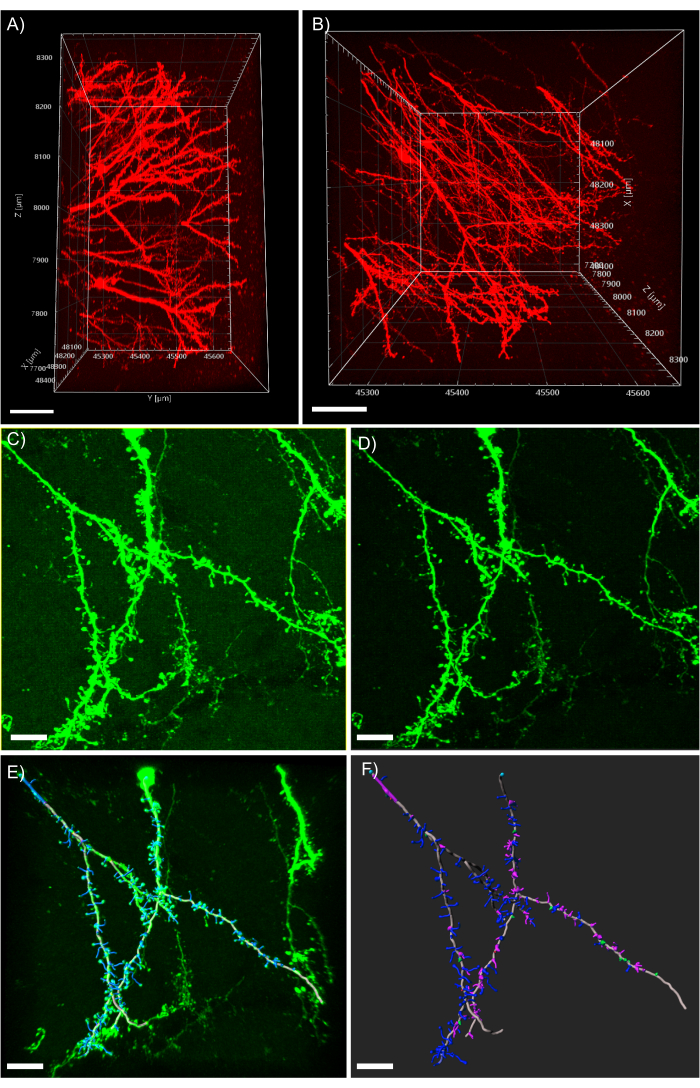
Figura 5: Análise 3D de dendritos no software de análise. (A) Visão lateral de uma pilha de 600 μm z adquirida a partir de um tecido de 1 mm de espessura expressando tdTomato; barra de escala representa 100μm. (B) Visão superior da mesma pilha z adquirida no painel A; barra de escala representa 100μm. (C) Imagem adquirida confocal de tecido expressando EGFP. Os arquivos de imagem podem ser importados diretamente para o software de análise e pré-processados para maior qualidade de imagem; barra de escala representa 25 μm. (D) A subtração do limiar é usada para remover o sinal de fundo consistente presente em C. (E) Traçamento de filamento e identificação da coluna vertebral: este processo é melhor quando executado semiautomático com o recurso de profundidade automática verificado. As espinhas foram então rotuladas à mão após a reconstrução completa do dendrite; a barra de escala representa 25 μm. (F) Classificação da coluna vertebral utilizando uma extensão MATLAB incorporada. As espinhas foram codificadas por cores com base em sua morfologia; espinhos stubby são vermelhos; espinhos de cogumelo são verdes; espinhas longas finas são azuis; filopodia são roxas; barra de escala representa 25 μm. Por favor clique aqui para ver uma versão maior desta figura.
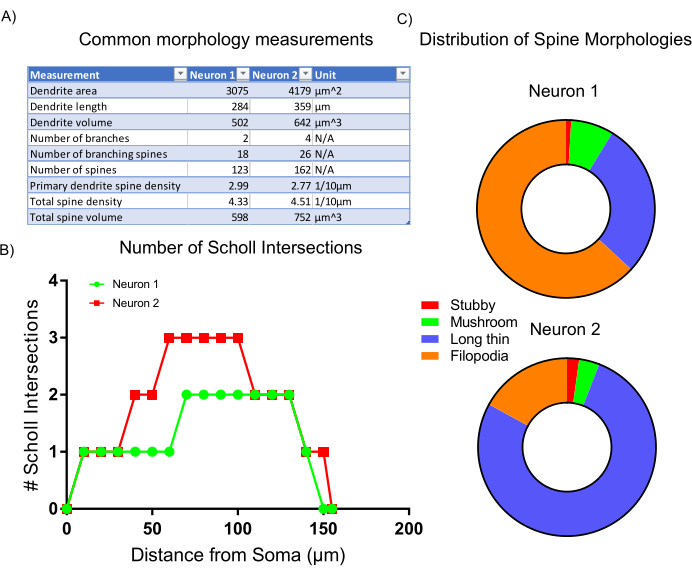
Figura 6: Resultados representativos. (A) Tabela de medições morfológicas comuns geradas automaticamente pelo programa de análise selecionado. (B) Número de intersecções de Sholl geradas pelas estatísticas do programa. (C) Gráfico de tortas representando a distribuição de morfologias dendríticas da coluna vertebral. Clique aqui para ver uma versão maior desta figura.
| Solução | Composição | Anotações |
| Solução de correspondência de índices refrativos | 80 g de histodenz | pH para 7,5 com NaOH |
| 60 mL de tampão fosfato de 0,02 M | Armazenar a 4 °C | |
| 0,01% de azida de sódio | Adaptada de Marx, V. Nature Methods volume 11, páginas 1209-1214 (2014) | |
| Hidrogel | 13,33 mL de 30% Acrilamida (sem bis) | Misture-se no gelo, caso contrário a solução pode começar a polimerizar |
| 10 mL de 10x PBS | Aliquot e armazenar a -20 °C | |
| 250 mg de VA-044 | ||
| 76,66 mL de ddH2O |
Tabela 1: Receitas para solução de correspondência de imagens refrativas e solução de hidrogel. A composição da solução de correspondência do índice de refração e do hidrogel estão listadas.
Discussão
Antes do advento das técnicas contemporâneas de limpeza de tecidos, o estudo da morfologia neuronal consistia em seção intensiva de tempo, imagem e reconstrução de seções muito finas adjacentes. O uso de limpeza de tecido eletroforético em combinação com imagens confocal fornece uma visão desobstruída da morfologia neuronal completa. De árvores dendríticas intactas, até o menor ataque sináptico, a imagem e a morfologia neuronal quantificada nunca foram tão viáveis.
A preparação do tecido cerebral limpo é simples e requer apenas um equipamento especializado. O tecido limpo e imageado usando este protocolo subverte a necessidade de seção, manuseio e montagem tediosas, diminuindo drasticamente o tempo da experimentação à aquisição de imagens. Além disso, o tecido imageado sem secção permanece mais fiel às estruturas originais, pois não há fontes de dano ou reconstrução de imagem pós-hoc necessária. Finalmente, este protocolo economiza tempo permitindo imagens simultâneas de características em larga escala, como árvores dendríticas ao lado de características de submicron de pequena escala, como colunas vertebrais.
Uma importante coleta de etapas neste protocolo são as etapas de lavagem que seguem o processo de compensação. Estas etapas são fundamentais para remover todos os traços do buffer de compensação eletroforética SDS. Se o tecido limpo não for suficientemente lavado, os precipitados se formarão durante a etapa de montagem. Estes precipitados às vezes podem ser redissucionados incubando o tecido a 37-55 °C por um curto período de tempo. No entanto, se os precipitados persistirem, eles espalharão luz, produzindo baixa profundidade de imagem e qualidade.
A montagem de grandes pedaços de tecido apresenta um desafio em comparação com a imagem tradicional de fatia fina. Aqui apresentamos múltiplos processos para montar tecidos grandes, que dependem da técnica de imagem, propriedades objetivas das lentes e do tamanho da amostra de tecido. Em primeiro lugar, é importante usar uma lente objetiva adequada para imersão nas mídias específicas de correspondência de índices refrativos utilizados, e que tenha distância de trabalho suficiente para imagens de grandes amostras de tecido. Este protocolo é em grande parte limitado pelas propriedades ópticas da plataforma de imagem utilizada, especificamente a distância de trabalho dos objetivos. A imagem em profundidade é prontamente alcançada usando este protocolo. No entanto, se um objetivo com distância de trabalho suficiente não estiver disponível, o tecido em si apresentará uma barreira física para a aquisição de imagens grandes. A próxima decisão importante é a técnica de imagem. A microscopia de dois fótons é tipicamente usada para sua excelente qualidade de imagem, profundidade de imagem e velocidade de aquisição. A microscopia de dois fótons permite imagens de até 1 mm em tecido limpo CLARITY sem perda de qualidade de imagem, como demonstrado na Figura 5A,B. No entanto, resultados muito semelhantes podem ser alcançados ao usar a microscopia confocal tradicional, embora com um sacrifício à profundidade de imagem em comparação com a microscopia de dois fótons(Figura 5C,D).
Em resumo, este método fornece uma plataforma robusta e conveniente para analisar a morfologia neuronal em grandes e pequenas escalas. Além disso, este método minimiza em grande parte o tempo de manuseio e processamento, ao mesmo tempo em que fornece imagens tridimensionais mais precisas e completas. A morfologia celular é um proxy comumente utilizado para avaliar a função do circuito e a saúde subjacente a muitas doenças e patologias13,14,15. A morfologia do neurônio de imagem é poderosa, simples e adequada para ensaios em uma infinidade de modelos de doenças.
Divulgações
Os autores não têm nada a revelar no momento.
Agradecimentos
Gostaríamos de agradecer ao núcleo viral NRDDC no Jan e Dan Duncan Neurological Institute por produzir os AAVs e lentivírus usados nesses experimentos. Além disso, gostaríamos de agradecer ao Baylor College of Medicine Center for Comparative Medicine pela criação de ratos e manutenção geral dos camundongos utilizados. Gostaríamos de agradecer à American Heart Association por seu apoio sob o prêmio número 20PRE35040011, e BRASS: Baylor Research Advocates for Student Scientists por seu apoio (PJH). Finalmente, gostaríamos de agradecer à Logos por fornecer ao nosso laboratório o sistema de limpeza de tecidos eletroforéticos Logos X-Clarity.
Materiais
| Name | Company | Catalog Number | Comments |
| 15 mL Conical Tube | Thermo Scientific | 339650 | |
| 25 G x 1" Needle | BD | 305127 | |
| 30% Acrylamide (No-Bis) | National Diagnostics | EC-810 | |
| 50 mL Conical Tube | Thermo Scientific | 339653 | |
| Electrophoretic Tissue Clearing Solution | Logos | C13001 | |
| Histodenz | Sigma | D2158-100G | |
| Hydrogel Solution Kit | Logos | C1310X | |
| Imaris | Oxford Instruments | N/A | |
| Paraformaldehyde 16% | EMS | 15710 | |
| PBS, 1x, 500 mL, 6 bottles/case | fisher | MT21040CV | |
| VA-044 | Wako | 925-41020 | |
| X-CLARITY Polymerization System | Logos | C20001 | |
| X-CLARITY Tissue Clearing System II | Logos | C30001 |
Referências
- Abbott, L. F., et al. The Mind of a mouse. Cell. 182 (6), 1372-1376 (2020).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philosophical transactions of the Royal Society of London. Series B, Biological Sciences. 314 (1165), 1 (1986).
- Jiang, X., et al. Principles of connectivity among morphologically defined cell types in adult neocortex. Science. 350 (6264), (2015).
- Winnubst, J., et al. Reconstruction of 1,000 projection neurons reveals new cell types and organization of long-range connectivity in the mouse brain. Cell. 179 (1), 268-281 (2019).
- Araya, R., Vogels, T. P., Yuste, R. Activity-dependent dendritic spine neck changes are correlated with synaptic strength. Proceedings of the National Academy of Sciences of the United States of America. 111 (28), (2014).
- Bosch, M., Hayashi, Y. Structural plasticity of dendritic spines. Current Opinion in Neurobiology. 22 (3), 383-388 (2012).
- Martínez-Cerdeño, V. Dendrite and spine modifications in autism and related neurodevelopmental disorders in patients and animal models. Developmental Neurobiology. 77 (4), 393-404 (2017).
- Arenkiel, B. R., Ehlers, M. D. Molecular genetics and imaging technologies for circuit-based neuroanatomy. Nature. 461 (7266), 900-907 (2009).
- Kim, E. H., Chin, G., Rong, G., Poskanzer, K. E., Clark, H. A. Optical probes for neurobiological sensing and imaging. Accounts of Chemical Research. 51 (5), 1023-1032 (2018).
- Weissman, T. A., Pan, Y. A. Brainbow: New resources and emerging biological applications for multicolor genetic labeling and analysis. Genetics. 199 (2), 293-306 (2014).
- Haggerty, D. L., Grecco, G. G., Reeves, K. C., Atwood, B. Adeno-associated viral vectors in neuroscience research. Molecular Therapy - Methods and Clinical Development. 17, 69-82 (2020).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Kanning, K. C., Kaplan, A., Henderson, C. E. Motor neuron diversity in development and disease. Annual Review of Neuroscience. 33, 409-440 (2010).
- Ledda, F., Paratcha, G. Mechanisms regulating dendritic arbor patterning. Cellular and Molecular Life Sciences. 74 (24), 4511-4537 (2017).
- Falougy, H. E., Filova, B., Ostatnikova, D., Bacova, Z., Bakos, J. Neuronal morphology alterations in autism and possible role of oxytocin. Endocrine Regulations. 53 (1), 46-54 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados