Method Article
선명도 조직 클리어링을 통한 손상되지 않은 뉴런 덴라이트의 이미징 및 정량화
요약
신경 수지상 형태는 종종 기능의 근간을 이수합니다. 실제로, 뉴런의 발달에 영향을 미치는 많은 질병 프로세스는 형태학적 표현형으로 나타납니다. 이 프로토콜은 그대로 수지상 식소및 연관된 척추를 분석하는 간단하고 강력한 방법을 설명합니다.
초록
뇌 활동, 신경 사이 전달 된 전기 화학 신호, 신경 네트워크의 연결 패턴에 의해 결정, 그리고 이러한 뉴런 내에서 프로세스 및 하위 구조의 형태에서. 따라서 뇌 기능에 대해 알려진 많은 것들이 뇌에서 뉴런이 조직되고 연결되는 방법에 대한 추가 통찰력을 허용하는 이미징 기술의 발전과 함께 발생했습니다. 조직 정리의 개선은 두꺼운 뇌 조각의 고해상도 이미징을 허용, 형태 학적 재건을 용이하게하고 신경 하위 구조의 분석, 수지상 식소 및 척추와 같은. 이미지 처리 소프트웨어의 발전은 대규모 이미징 데이터 집합을 신속하게 분석하는 방법을 제공합니다. 이 작품은 CLARITY 조직 클리어링, 공초점 현미경 검사및 이미지 분석을 사용하여 고해상도로 표지된 신경 조직의 두꺼운 조각을 처리, 시각화 및 분석하는 비교적 빠른 방법을 제시합니다. 이 프로토콜은 건강한 두뇌를 특징짓는 연결 패턴 및 신경 형태학및 병들인 두뇌 상태에서 생기는 이 특성에 있는 변경을 이해하기 위한 노력을 촉진할 것입니다.
서문
복잡한 3차원 생물학적 구조의 공간 조직, 연결 패턴 및 형태에 대해 이해하는 것은 특정 세포 및 조직의 기능을 파기하는 데 필수적입니다. 이것은 신경 과학에서 특히 사실이다, 있는 엄청난 노력은 중추 신경계의 고해상도 신경 해부학지도를 구축하는 데 전념하고있다1,2. 이러한 지도를 구성하는 뉴런의 면밀한 검사는 다양한 형태학을 산출하며, 이러한 다양한 뉴런 세트의 기능을 반영하는 연결 및위치3,4. 더욱이, 세포외 구조, 특히 수지상 척추에 대한 조사는 시냅스의 성숙도를 알릴 수 있어 발달 과정 및 신경질환 상태를 반영하여5,6,7. 따라서 이미징 해상도와 처리량을 개선하는 접근 방식은 모든 척도에서 뇌 기능을 더 잘 이해하는 데 필수적입니다.
최근 발전은 뉴런의 인구를 표시하고 조작하기위한 분자 및 유전 도구 키트를 확장했다. 뉴런에 이러한 마커를 도입하는 새로운 방법과 결합 된 새로운 형광 마커의 개발은 동일한 동물 또는 뇌 샘플8,9,10,11내에서 상호 작용하는 뉴런의 인구의 차동 라벨링을 허용합니다. 빛은 불투명한 지질에 의해 흩어져 있고, 뇌 조직의 높은 지질 함량을 감안할 때, 이미징 신경 인구는 주로 얇은 섹션으로 제한되었거나 고급 현미경 기술 (예를 들어, 공초점, 다광자 및 광시트 현미경 검사법)에 의존하여 깊은 구조를 이미지화합니다. 그러나, 이러한 노력은 크게 조직 정리 기술에 어드밴스에 의해 강화 되었습니다. 클리어 지질 교환 아크릴아미드-혼성 경질 영상/면역스테인링/시투 혼성화 호환 티슈-하이드로겔(CLARITY)은 하이드로겔 모노머(아크릴아미드와 비스 아크릴아미드)를 주입한 후 세제12로세척하는 기술 중 하나입니다. 하이드로겔 모노머는 매시분자 라벨에 광학적으로 투명하고 투과성이 있는 안정적인 3D 하이드로겔 스캐폴드를 만들기 위해 혼성화한다. 핵산과 단백질은 혼성화된 매트릭스 내에서 유지되는 반면, 지질은 세제 세시에 의해 제거된다(도1). 이것은 세포와 비 지질 분자의 원래 모양과 방향을 유지하기에 충분히 단단한 안정된 조직을 초래하고, 광학적으로 고해상도로 깊은 구조를 쉽게 이미지할 수 있을 만큼 충분히 투명합니다. 조직 구조와 방향의 이러한 유지 보수는 두꺼운 슬라이스의 이미징을 허용하여 세포 대 세포 연결 및 공간 관계를 보존합니다. 더욱이, 단백질과 핵산의 위치 및 가용성이 청산 과정에서 유지되기 때문에, 클리어 조직은 발현 기반 마커뿐만 아니라 외인성 라벨을 보유할 수 있다. 따라서 CLARITY는 많은 양의 심층 뇌 구조와 고해상도에서 이러한 구조 사이의 연결을 이미징하는 강력한 방법으로 자신을 빌려줍니다.
CLARITY의 사용은 크게 이미징 신경 인구에 대한 접근을 향상시킵니다. 이 기술은 많은 양의 이미징 데이터를 생성하는 데 특히 능숙합니다. CLARITY는 여러 형태의 단백질 기반 형광과 잘 어립니다. 이 프로토콜은 EGFP 및 tdTomato를 사용하여 세포에 드물게 라벨을 붙이기 위해 렌즈피바이러스 기반 접근법을 활용합니다. 그러나, tdTomato 또는 EGFP를 표현하는 형질 전환 기자 는 정기적으로 사용되었습니다. 사진 안정적이고 밝은 형광소를 선택하는 것이 중요합니다 (예 : EGFP 또는 tdTomato). 또한, 강력한 프로모터를 사용하여 플루오로포어를 표현하면 뛰어난 콘트라스트와 이미지 품질을 얻을 수 있습니다. 이 기술의 단점은 이 많은 양의 데이터를 적절히 분석하는 것으로 발생하며, 이는 인건비와 시간 집약적일 수 있습니다. 특수 현미경은 처리량을 개선하고 작업 부하를 줄이는 데 도움이 될 수 있습니다. 그러나, 건물, 소유 및/또는 고급 현미경을 운영하는 것은 종종 많은 실험실에 대한 비용 금지입니다. 이 작품은 표준 공초점 현미경 검사법과 결합된 큰 단면의 CLARITY 조직 클리어링을 사용하여 고해상도로 많은 양의 신경 조직을 시각화하는 높은 처리량, 상대적으로 빠르고 간단한 방법을 제시합니다. 본 프로토콜은 다음 단계를 통해 이러한 접근법을 설명한다: 1) 해부 및 신경 조직 준비, 2) 조직을 청산, 3) 조직을 장착, 4) 준비된 조각을 이미징, 및 5) 현미경 시각화 소프트웨어 재구성 및 분석을 사용하여 전체 슬라이스 이미지를처리(그림 2). 이러한 노력은 뉴런의 인구, 신경 연결 패턴, 3D 수지상 형태, 수지상 척추 풍부 및 형태학, 그리고 그대로 뇌 조직 내에서 분자 발현 패턴을 분석하는 데 사용할 수있는 고해상도 이미지를 초래합니다.
프로토콜
다음 프로토콜은 베일러 의과 대학에 대한 모든 동물 관리 지침을 따릅니다.
1. 해부 및 조직 준비
- 이소플루란 (또는 다른 IUCAC 승인 수단에 의해) 젖은 수건으로 닫힌 용기에 마우스를 배치하여 이소플루란의 과다 복용으로 마우스를 안락사.
- 10mL의 얼음 차가운 PBS를 가진 25 G 바늘을 사용하여 동물을 트랜스카디로 사용하고, 그 다음으로 4% PFA의 10mL가 그 뒤를 따릅니다.
- 관심의 뇌 영역 (또는 조직)을 해부.
- 해부된 조직을 4°C에서 하룻밤 사이에 4% PFA로 넣습니다. 적절한 고정은 이 프로토콜의 핵심입니다. 이 단계를 건너뛰거나 단축하지 마십시오.
- 4% PFA에서 최소 12시간 동안 고정한 후, 4°C에서 24시간 동안 4%의 아크릴아미드 하이드로겔 혼합물로 조직을 이송한다.
참고: 하이드로겔을 해동할 때 중합되지 않았는지 확인하면 하이드로겔이 너무 따뜻해지면 발생할 수 있습니다. 얼음에 녹동하여 조기 중합을 방지합니다.
2. 조직 청산
- -90 kPa 진공상태에서 37°C에서 3시간 동안 진공 인큐베이터에 뇌 조직(여전히 하이드로겔에 잠긴)을 놓습니다. 진공이 제대로 형성될 수 있도록 튜브 상단을 나사로 두십시오.
- 부드러운 흔들림으로 실온(25°C)에서 10분 동안 PBS로 티슈를 씻으시다.
- 중합화된 조직 샘플을 전기전도챔버에 놓고 챔버 내의 조직의 방향을 주의하십시오.
- 공급된 전기전도 SDS 버퍼로 챔버와 저수지를 채웁니다.
- 70V, 1 A 및 35C에서 샘플을 실행하여 약 2 h/mm의 조직에 대한 일정한 전류를 가합니다.
- 정기적으로 샘플을 확인; 제대로 지우기 위해 챔버에 더 많은 시간이 필요할 수 있습니다. 클리어링을 위한 좋은 출발점은 뇌 조직의 mm당 1-2h입니다. 전체 마우스 뇌는 충분한 클리어링을 위해 8-10 h가 필요합니다. 챔버에서 제거하기 전에 샘플의 방향을 기억하고 동일한 방향으로 챔버로 다시 교체해야합니다.
참고 : 그림 3A는 완전히 지워진 뇌가 어떻게 생겼는지 보여줍니다. 뇌는 용해 된 SDS의 존재로 인해이 단계에서 불투명하고 명확하지 않지만 지질 추출 후 노란색 조직 색이 거의 없어야합니다.
- 정기적으로 샘플을 확인; 제대로 지우기 위해 챔버에 더 많은 시간이 필요할 수 있습니다. 클리어링을 위한 좋은 출발점은 뇌 조직의 mm당 1-2h입니다. 전체 마우스 뇌는 충분한 클리어링을 위해 8-10 h가 필요합니다. 챔버에서 제거하기 전에 샘플의 방향을 기억하고 동일한 방향으로 챔버로 다시 교체해야합니다.
3. 클리어된 조직을 준비하고 장착
- 샘플이 클리어링을 완료하고 충분히 맑은 후 실온에서 하룻밤 PBS로 씻어 보십시오. PBS를 가능한 한 자주 신선한 PBS로 교체하십시오. 이 단계는 이후 단계에서 침전을 형성할 수 있는 잔류 SDS를 제거하는 데 중요합니다.
- PBS에서 마지막 세척에 이어, 실온에서 5 분 동안 티슈를 3 번 씻으시면 하십시오. 조직은 이 단계에서 불투명해지고 확장될 수 있습니다.
- 굴절률 매칭 용액(표 1참조)에서 조직을 실온에서 최소 4시간 동안 배양한다. 도 3B는 굴절지수 매칭 용액에서 배양 후 지워진 조직의 조각을 나타낸다.
- 굴절지수 매칭 용액에서 조직의 배양 중에 필요한 경우 시료를 이미지화하는 적절한 하우징 챔버를 구성한다.
- 작은 조직 샘플/슬라이스를 위한 이미징 챔버 구축
- 유리 슬라이드를 장착의 베이스로 사용하여 고무 또는 플라스틱 스페이서를 내려 놓고 슈퍼 접착제로 고정하십시오. 미리 만들어진 스페이서를 사용할 수 없는 경우 원물 튜브 단면으로 만든 플라스틱 링을 사용하십시오.
- 구멍없이 유리 슬라이드에이러한 조각을 고정해야합니다(그림 3C).
- 굴절률 매칭 용액으로 미리 채워진 마운팅 챔버에 클리어된 조직을 배치합니다.
- 유리 커버슬립을 위에 놓고 매니큐어로 밀봉하여 조직을 단단히 장착합니다.
- 유리 위에 직접 굴절 지수 매칭 마운팅 솔루션을 추가하여이 조직을 이미지.
- 대형 조직 이미징 챔버
- 조직이 5mm 두께보다 큰 경우이 챔버를 구성하십시오 (전체 뇌 또는 반구에 적합).
- 높은 벽이있는 10cm 유리 접시를 사용하여 중앙에 50mL 원색 튜브를 배치하여 원적 직경이 사용되는 객관적인 렌즈의 배럴을 받아 들일 만큼 충분히 큰지 확인하십시오.
- 물에 3% 아가로즈를 만들고 유리 접시와 원물 튜브 사이의 공간에 붓고 1 h(그림 3D)로식힙니다. 이것은 고체 아가로즈의 고리를 형성합니다(그림 3E).
- 슈퍼 접착제를 사용하여 조직을 챔버 바닥에 단단히 부착하고 굴절률 매칭 용액으로 챔버를 채웁니다. 접착제를 적용하여 관심 영역을 손상시키지 않고 접시에서 조직의 매립을 허용하도록 이미지화되지 않는 부위에 조직을 부착하십시오.
참고: 이러한 제제는 굴절지수 매체가 공기로부터 보존되고 4°C에 저장되지 않는 한 중합화되기 시작할 수 있기 때문에 시간에 민감하다.
4. 이미징 클리어 조직 샘플
- 4mm 작동 거리를 가진 25x/0.95 NA 목표에 맞는 공초점 현미경을 사용하여 이미지를 획득하십시오.
- 모든 관련 이미징 장비를 켭니다. 시료를 스테이지에 놓고 굴절률 매칭 용액을 장착 챔버 의 상단에 놓습니다.
- 신중하게 목표와 몰입 미디어에 접근하고 미디어의 지속적인 열을 형성한다.
- 피형성 경위를 사용하여 적절한 이미징 필드를 찾습니다.
- 적절한 설정을 테스트하여 이미지 수집 절차를 시작합니다.
- 먼저 그림 4A를 사용하여 해상도를 설정하고 속도 설정을 검사합니다. 공초점 현미경을 사용하여 이미징하는 경우 핀홀을 완전히 닫아 가장 작은 광학 섹션을 확보하므로 가장 좋은 z 해상도를 얻습니다.
- 높은 신호 대 잡음 비율로 적절한 이미지를 얻을 때까지 레이저 전력 /센서 게인을 점차적으로 증가시다.
- 표준 EGFP/tdTomato 2색 이미징을 활용하는 경우 그림 4B를 사용하여 라이트 컬렉션 설정을 가이드로 설정합니다.
- 조직의 관찰된 시작 점 및 끝점을 기반으로 z-스택 매개변수를 설정합니다. 그림 4C를 가이드로 사용하여 원하는 z 해상도를 기반으로 단계 크기를 설정합니다.
참고: 걸음 크기가 작을수록 z 해상도가 향상되지만 더 많은 레이저 거주 시간을 도입하여 시료 표백으로 이어질 수 있습니다. - 이미지 획득 설정에 만족하면 이미지를 획득합니다.
- 이미지가 높은 신호 대 잡음 비율을 가지고 있고 구조의 고유한 경계를 표시했는지 확인합니다(그림4D).
5. 현미경 분석 소프트웨어를 사용하여 이미지 처리 및 3D 정량화
참고: 현미경 이미지 분석 소프트웨어 패키지는 3차원 이미지 시각화 및 처리를 위한 강력한 도구입니다. 이러한 프로그램의 대부분은 이미징 클리어 조직 샘플에서 생성되는 큰 데이터 집합의 처리에 완벽하게 적합합니다. 다음 단계와 관련 수치는 Imaris 소프트웨어 워크플로우에 해당합니다.
- 이미지 스택을 열고 선택한 분석 소프트웨어로 가져옵니다.
- 이미지를 3차원 공간으로 보고 디스플레이 조정기를 사용하여 조회 테이블을 원하는 방식으로 변경하여 이미지를 더 잘 시각화합니다.
참고: 그림 5A는 CLARITY 조직 클리어링과 결합된 2광현미경검사를 통해 접근할 수 있는 극단적인 이미징 깊이를 보여줍니다. 도 5B는 도 5A에제시된 z 스택에서 뚜렷한 점자 프로세스뿐만 아니라 명확하게 보이는 척추 형태를 나타낸다. - 일관된 배경을 필터링하려면 이미지 처리 버튼을 클릭하고 백그라운드 빼기 필터를 선택합니다.
참고: 그림 5C는 처리 하기 전에 일관 된 흐릿한 배경 신호와 이미지를 보여줍니다. 도 5D는 배경 빼기 필터가 적용된 후 이미지를 표시합니다. - 3D 이미지를 관찰하고 여러 각도및 줌 수준에서 보고 익숙해집니다.
- 필라멘트 추적기 도구를 먼저 선택하여 수상월트 추적을 시작합니다.
- 필라멘트를 수동으로 편집하고 자동 생성을 건너뜁니다.
- 모드를 자동 경로로 설정하고 자동 중심 및 자동 직경 보정을 확인합니다.
- 시프트 + 셀 본문을 마우스 오른쪽 버튼으로 클릭하여 시작점을 설정합니다.
- 선장의 전체 길이를 따라 뉴런을 추적; 왼쪽 은점의 끝을 클릭하여 종료 점을 설정하여 소프트웨어가 시작 점과 끝점 사이의 경로를 자동으로 계산할 수 있도록 합니다.
- 모든 수상달이에 대해이 단계를 반복하고 셀 구조를 완전히 추적합니다.
- 추적된 셀을 시각화하고 정확성을 확인합니다. 필요에 따라 수동 조정을 합니다.
- 만들기 탭을 선택합니다.
- 재계산 덴트라이트 직경 옵션을 선택합니다.
- 마법사를 따라 완성하여 보다 정확하게 추적된 수상월을 완료합니다.
- 그리기 탭을 선택합니다.
- 척추 라디오 버튼을 클릭하여 가시 그리기를 시작합니다.
- 필요에 따라 대략적인 척추 직경을 설정하고 측정 도구를 사용하여 척추 직경을 정확하게 표현합니다.
- 척추 머리 의 중심을 클릭하여 새 척추를 추가합니다.
- 수상자의 모든 척추에 대해 이 것을 반복합니다.
참고: 가시를 수동으로 추가할 때 가능한 모든 각도에서 점반을 관찰하는 것이 중요합니다. - 새로 추가된 가시를 확인하여 정확도를 확인하고 필요에 따라 변경합니다.
- 만들기 탭을 선택합니다.
- 소프트웨어가 다운스트림 데이터 분석에 중요한 적절한 헤드 및 목 직경을 결정할 수 있도록 재계산 척추 직경 옵션을 선택합니다.
- 척추 직경 생성 마법사를 따라 완료합니다.
- 계산 결과를 관찰하고 필요에 따라 수동 조정을 합니다. 그림 5E는 척추가 있는 완전히 추적된 뉴런을 보여줍니다.
- 분류된 등뼈 목록을 만들려면 도구 탭을 선택합니다.
참고: 이 작업을 위해 MATLAB 확장을 설치해야 합니다.- MATLAB 확장을 설치하려면 기본 설정 창을 엽니다.
- 사용자 지정 도구 옵션을 선택합니다.
- 적절한 MATLAB 런타임 MCR을 추가합니다.
- 등뼈 분류를 클릭합니다.
- 척추 분류에 대해 원하는 매개 변수를 편집합니다.
- MATLAB 확장에서 척추 분류를 클릭합니다. 도 5F는 색상으로 구분된 분류 된 척추가 겹쳐진 수상인사를 보여줍니다.
- 통계 탭을 선택합니다.
- 원하는 통계를 구성하여 이 탭의 왼쪽 아래 모서리에 있는 구성 단추를 클릭하여 데이터를 정량화합니다.
- 통계 표현 방법을 선택한 후 탭 디스플레이의 내보내기 통계를 사용하여 이 창 의 오른쪽 하단에 있는 파일 버튼으로 데이터를 내보냅니다.
- 선호하는 그래프 를 사용하여 통계를 그래프로 그립니다.
결과
이미지 수집 후, 대표적인 세포 형태는 임베디드 통계를 사용하여 분석 소프트웨어 내에서 스크립트를 분류했다. 수집된데이터(도 6A)는뉴런 2가 척추밀도가 높은 더 큰 수지상 구조를 갖는다는 것을 반영한다. 전체적으로, 데이터는 뉴런 2가 뉴런 1에 비해 더 복잡한 수지상 구조를 가지고 있음을 시사한다. 이러한 결과를 입증하기 위해, 표준 Sholl 분석이 수행되었으며, 이는 뉴런 2가 소마로부터 50-100 μm에서 Sholl 교차의 증가수에 의해 표시된 바와 같이 뉴런 1보다 더 수지상적으로 복잡하다는 것을 확인하였다(도6B). 마지막으로, 두 개의 이미지 뉴런의 수지상 척추는 전반적인 모양과 크기에 따라 네 가지 주요 범주로 분류되었다. 더 많은 filopodia 같은 모양을 전시 하는 척추는 가능성이 더 미숙한 척추 하위 유형. 버섯 등뼈라고 불리는 정의된 머리를 가진 척추는 더 발달되고 성숙한 시냅스7을포함할 가능성이 높습니다. 여기에 제시된 분석은 뉴런 1이 뉴런2(도 6C)에비해 filopodia 와 같은 척추의 더 큰 비율을 포함하고 있음을 보여줍니다. 따라서, 형태학에 기초하여, 뉴런 2는 더 크고, 더 높게 분기되고, 성숙한 척추의 더 높은 밀도를 포함하기 때문에 더 발달성숙이다.
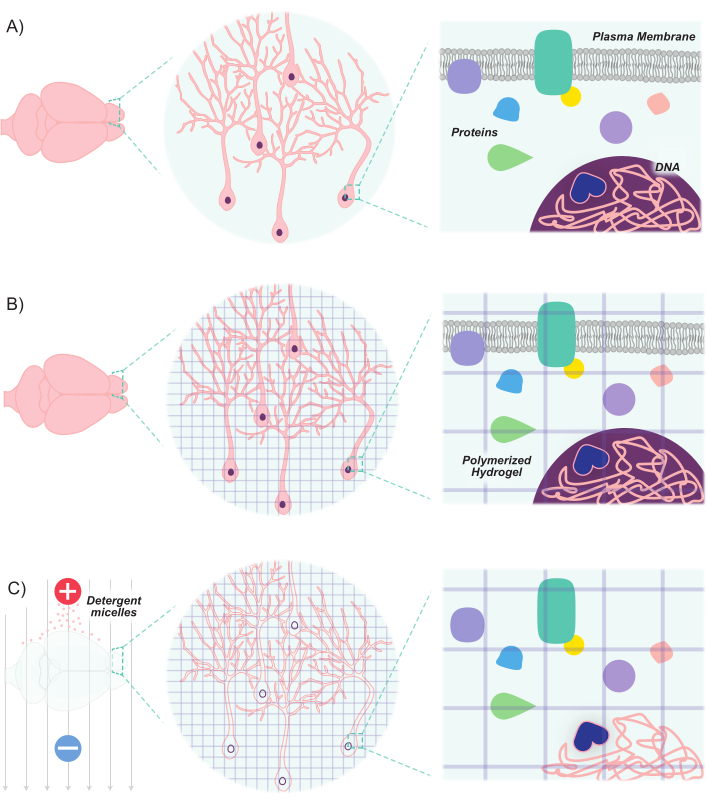
도 1: CLARITY 프로토콜은 내재된 구조 와 분자 분자 공간 관계를 유지하면서 조직을 투명하게 렌더링합니다. (A)클리어링 전에 신경 조직 및 세포간 구성 요소의 원래 방향. (B)하이드로겔 단량체(보라색 선)는 조직내로 주입되어 하이드로겔 메쉬로 중합된다. 조직 및 하이드로겔 메쉬는 포름알데히드 고정을 통해 교차 연결됩니다. (C)조직은 전기장에 노출되는 동안 이온 세제 솔루션으로 세척됩니다. 이 과정에서 세제 미젤은 조직에서 지질 분자를 제거하고 투명 하이드로겔과 생체 분자의 교차 연결 네트워크를 남깁니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
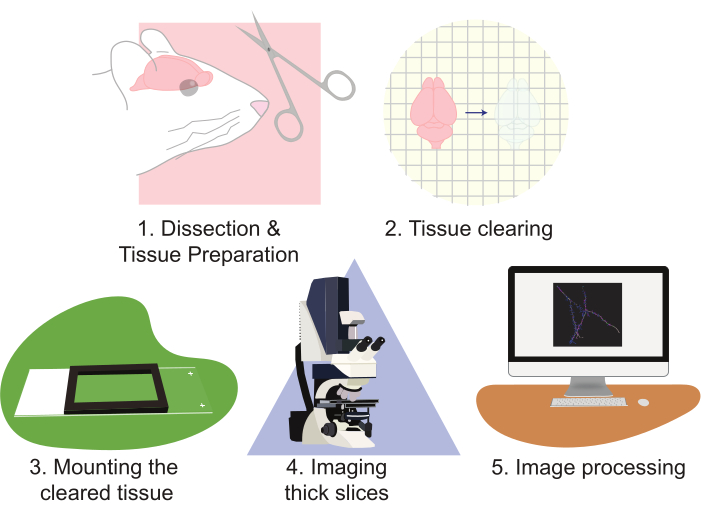
그림 2: 프로토콜의 흐름 차트, 조직 준비, 지우기, 마운팅, 이미징 및 이미지 처리를 다이어그램.

그림 3: 클리어 티슈 샘플을 위한 마운팅 챔버를 구성합니다. (A)굴절률 매칭 솔루션에 침수하기 전에 PBS에서 뇌 전체를 클리어하였다. (B)굴절률 매칭 솔루션의 뇌 슬라이스. (C)크고 작은 지워진 조직 샘플을 위한 이미징 챔버. 챔버는 3D 인쇄 플라스틱및 절단 원문 튜브를 포함하되 이에 국한되지 않는 다양한 재료를 사용하여 만들 수 있습니다. (D)전체 뇌 또는 반구 이미징을 위한 이미징 챔버, 아가로즈를 붓기 전에 50mL 원내관을 구호로 사용한다. (E)아가로즈를 가진 전체 뇌 또는 반구 이미징 챔버는 완전히 설정; 이 설정은 큰 배럴 침지 목표에 최적입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 지워진 조직 샘플에서 고품질의 대용량 데이터 세트를 획득합니다. (A)전신 고해상도 이미징에 사용되는 이미지 수집 설정. 핀홀은 미세한 광학 섹션을 가능하게 하기 위해 완전히 닫혔습니다. 스캔 속도는 최적의 픽셀 거주 시간에 따라 경험적으로 결정되었습니다. (B)경경로 설정: 이 것들은 사용되는 플루오로포어 및 장비에 따라 달라집니다. (C)Z 스택 설정; 미세 z 단계는 가능한 한 z 방향으로 많은 정보를 캡처하는 데 사용되었다. (D)대표 최대 투영; 스케일 바는 25 μm을 나타냅니다.
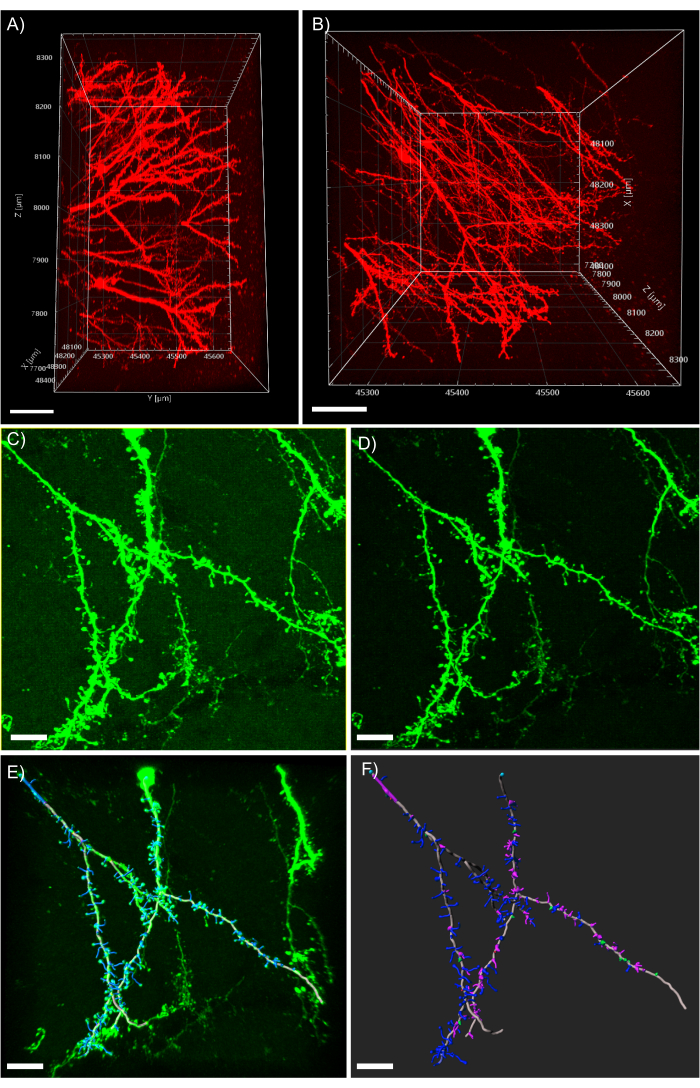
도 5: 분석 소프트웨어에서 원점의 3D 분석. (A)tdTomato을 발현하는 1mm 두께의 조직에서 획득한 600 μm z-stack을 획득한 2개의 광자의 측면 보기; 스케일 바는 패널 A에서 획득한 동일한 z 스택의 100μm.(B)최고보기를 나타낸다; 스케일 바는 EGFP를 발현하는 조직의 100μm.(C)공초점 획득 이미지를 나타낸다. 이미지 파일은 분석 소프트웨어로 직접 가져오고 이미지 품질을 높이기 위해 미리 처리될 수 있습니다. 스케일 바는 25 μm을 나타낸다.(D)임계값 빼기는 C.(E)필라멘트 추적 및 척추 식별에 존재하는 일관된 배경 신호를 제거하는 데 사용됩니다: 이 과정은 자동 깊이 피쳐를 검사하여 반자동를 수행할 때 가장 좋습니다. 척추는 완전한 수상월트 재건 후 손으로 라벨을 붙였습니다. 스케일 바는 내장 된 MATLAB 확장을 사용하여 25 μm.(F)척추 분류를 나타냅니다. 척추는 형태에 따라 색으로 코딩되었습니다. 스터비 척추는 빨간색입니다. 버섯 등뼈는 녹색; 긴 얇은 가시가 파란색입니다. 필로포디아는 보라색입니다. 스케일 바는 25 μm을 나타냅니다.
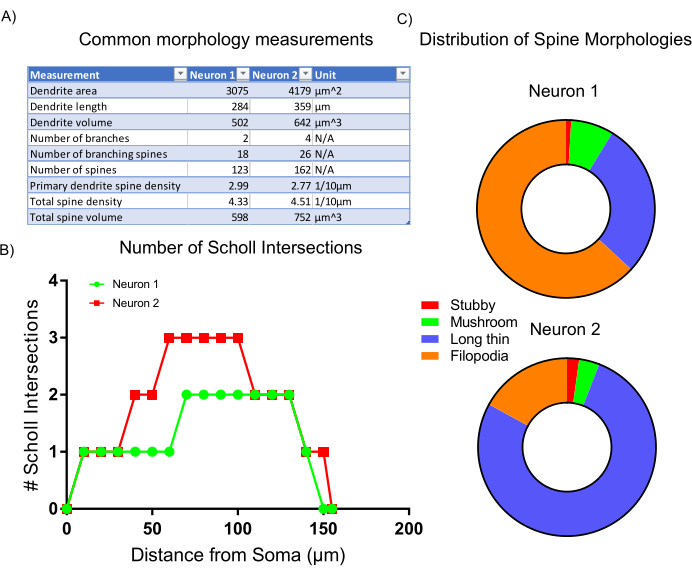
그림 6: 대표 결과. (A)선택한 분석 프로그램에 의해 자동으로 생성되는 일반적인 형태학적 측정표. (B)프로그램 통계에 의해 생성된 Sholl 교차의 수입니다. (C)수지상 척추 형태학의 분포를 나타내는 원형 차트. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 용액 | 구성 | 노트 |
| 굴절인덱스 매칭 솔루션 | 히스토덴츠 80 g | pH ~ 7.5 NaOH |
| 60 mL 0.02 M 인산염 완충제 | 4°C에 보관 | |
| 아지드 나트륨 0.01% | 마르크스, V. 네이처 메소드 볼륨 11, 1209-1214쪽 (2014) | |
| 하이드로겔 | 아크릴아미드 30%의 13.33mL (노비스) | 얼음에 함께 혼합, 그렇지 않으면 용액은 중합하기 시작할 수 있습니다 |
| 10x PBS 10mL | 알리쿼트 및 -20 °C에 보관 | |
| VA-044 250 mg | ||
| 76.66 mL 의 ddH2O |
표 1: 굴절 성 이미지 매칭 솔루션 및 하이드로겔 용액을 위한 레시피. 굴절지수 매칭 솔루션 및 하이드로겔의 조성이 나열됩니다.
토론
현대 조직 청산 기술의 출현 전에, 신경 형태를 공부하는 것은 시간 집약적인 단면, 화상 진찰 및 인접한 아주 얇은 단면도의 재건으로 이루어져 있습니다. 공초점 화상 진찰과 함께 전기 전구 클리어링을 사용하면 완전한 신경 형태에 대한 방해받지 않는 시각을 제공합니다. 그대로 수지상 나무에서 가장 작은 시냅스 부톤까지, 신경 형태에 이미징과 정량화하는 것은 그 어느 때보다 도드라졌습니다.
지워진 뇌 조직의 준비는 간단하며 특수 장비의 한 조각만 필요합니다. 이 프로토콜을 사용하여 지워지고 이미지화된 조직은 지루한 얇은 단면, 처리 및 장착의 필요성을 대체하여 실험에서 이미지 수집에 이르는 시간을 크게 줄입니다. 또한, 단면없이 이미지 된 조직은 손상또는 필요한 포스트 혹 후 이미지 재구성의 소스가 없기 때문에 원래 구조에 더 충실하게 남아 있습니다. 마지막으로, 이 프로토콜은 가스와 같은 소규모 서브미크론 피처와 함께 수지상 나무와 같은 대규모 기능의 동시 이미징을 허용함으로써 시간을 절약합니다.
이 프로토콜의 중요한 단계 모음 중 하나는 청산 프로세스를 따르는 세척 단계입니다. 이러한 단계는 SDS 전기 전광 청산 버퍼의 모든 흔적을 제거하는 데 중요합니다. 지워진 조직이 충분히 세척되지 않으면 장착 단계에서 침전제가 형성됩니다. 이러한 침전은 때때로 짧은 시간 동안 37-55 °C에서 조직을 배양하여 재용해 질 수 있습니다. 그러나 침전이 지속되면 빛을 분산시켜 이미징 깊이와 품질이 떨어집니다.
조직의 큰 조각을 장착전통적인 얇은 슬라이스 이미징에 비해 도전을 제시한다. 여기서 우리는 이미징 기술, 객관적인 렌즈 특성 및 조직 샘플의 크기에 의존하는 대형 조직을 탑재하는 여러 공정을 제시합니다. 첫째, 사용되는 특정 굴절률 매칭 미디어에 침지하기에 적합한 객관적인 렌즈를 사용하는 것이 중요하며, 이는 대형 조직 샘플을 이미징하기에 충분한 작업 거리를 갖는다. 이 프로토콜은 사용되는 이미징 플랫폼의 광학 적 특성, 특히 목표의 작업 거리에 의해 크게 제한됩니다. 깊이에서 이미징은 이 프로토콜을 사용하여 쉽게 달성됩니다. 그러나 충분한 작업 거리를 가진 목표를 사용할 수없는 경우 조직 자체는 큰 이미지를 획득하는 물리적 장벽을 제시합니다. 다음 중요한 결정은 이미징 기술입니다. 2광자 현미경 검사는 일반적으로 뛰어난 이미지 품질, 이미징 깊이 및 획득 속도에 사용됩니다. 2광광현미경검사는 도 5A,B에서 입증된 바와 같이 이미지 품질의 손실 없이 CLARITY 클리어 티슈로 최대 1mm의 이미징을 가능하게한다. 그러나, 2-광자 현미경검사(도5C,D)에비해 이미징 깊이에 희생을 희생하지만 기존의 공초점 현미경을 사용할 때 매우 유사한 결과를 얻을 수 있다.
요약하자면, 이 방법은 크고 작은 저울 모두에서 신경 형태를 분석하기 위한 강력하고 편리한 플랫폼을 제공합니다. 또한 이 방법은 처리 및 처리 시간을 크게 최소화하는 동시에 보다 정확하고 완전한 3차원 이미지를 제공합니다. 세포 형태는 많은 질병 및병리학13,14,15의근본적인 회로 기능 및 건강을 평가하기 위해 일반적으로 사용되는 프록시입니다. 이미징 뉴런 형태는 강력하고 간단하며 다양한 질병 모델의 분석에 적합합니다.
공개
저자는 이 시점에서 공개할 것이 없습니다.
감사의 말
우리는 이러한 실험에 사용되는 AAV 및 렌즈 바이러스를 생산하기위한 1 월과 댄 던컨 신경 학 연구소의 바이러스 코어 NRDDC에 감사드립니다. 또한, 우리는 마우스 축산 및 사용되는 마우스의 일반적인 유지 보수에 대한 비교 의학에 대한 베일러 대학 의학 센터에 감사드립니다. 20PRE35040011, 황동: 베일러 연구 옹호자들의 지원에 감사드립니다(PJH). 마지막으로, 로고X-선명도 전기전도 조직 정리 시스템을 실험실에 제공한 로고스에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 15 mL Conical Tube | Thermo Scientific | 339650 | |
| 25 G x 1" Needle | BD | 305127 | |
| 30% Acrylamide (No-Bis) | National Diagnostics | EC-810 | |
| 50 mL Conical Tube | Thermo Scientific | 339653 | |
| Electrophoretic Tissue Clearing Solution | Logos | C13001 | |
| Histodenz | Sigma | D2158-100G | |
| Hydrogel Solution Kit | Logos | C1310X | |
| Imaris | Oxford Instruments | N/A | |
| Paraformaldehyde 16% | EMS | 15710 | |
| PBS, 1x, 500 mL, 6 bottles/case | fisher | MT21040CV | |
| VA-044 | Wako | 925-41020 | |
| X-CLARITY Polymerization System | Logos | C20001 | |
| X-CLARITY Tissue Clearing System II | Logos | C30001 |
참고문헌
- Abbott, L. F., et al. The Mind of a mouse. Cell. 182 (6), 1372-1376 (2020).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philosophical transactions of the Royal Society of London. Series B, Biological Sciences. 314 (1165), 1 (1986).
- Jiang, X., et al. Principles of connectivity among morphologically defined cell types in adult neocortex. Science. 350 (6264), (2015).
- Winnubst, J., et al. Reconstruction of 1,000 projection neurons reveals new cell types and organization of long-range connectivity in the mouse brain. Cell. 179 (1), 268-281 (2019).
- Araya, R., Vogels, T. P., Yuste, R. Activity-dependent dendritic spine neck changes are correlated with synaptic strength. Proceedings of the National Academy of Sciences of the United States of America. 111 (28), (2014).
- Bosch, M., Hayashi, Y. Structural plasticity of dendritic spines. Current Opinion in Neurobiology. 22 (3), 383-388 (2012).
- Martínez-Cerdeño, V. Dendrite and spine modifications in autism and related neurodevelopmental disorders in patients and animal models. Developmental Neurobiology. 77 (4), 393-404 (2017).
- Arenkiel, B. R., Ehlers, M. D. Molecular genetics and imaging technologies for circuit-based neuroanatomy. Nature. 461 (7266), 900-907 (2009).
- Kim, E. H., Chin, G., Rong, G., Poskanzer, K. E., Clark, H. A. Optical probes for neurobiological sensing and imaging. Accounts of Chemical Research. 51 (5), 1023-1032 (2018).
- Weissman, T. A., Pan, Y. A. Brainbow: New resources and emerging biological applications for multicolor genetic labeling and analysis. Genetics. 199 (2), 293-306 (2014).
- Haggerty, D. L., Grecco, G. G., Reeves, K. C., Atwood, B. Adeno-associated viral vectors in neuroscience research. Molecular Therapy - Methods and Clinical Development. 17, 69-82 (2020).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Kanning, K. C., Kaplan, A., Henderson, C. E. Motor neuron diversity in development and disease. Annual Review of Neuroscience. 33, 409-440 (2010).
- Ledda, F., Paratcha, G. Mechanisms regulating dendritic arbor patterning. Cellular and Molecular Life Sciences. 74 (24), 4511-4537 (2017).
- Falougy, H. E., Filova, B., Ostatnikova, D., Bacova, Z., Bakos, J. Neuronal morphology alterations in autism and possible role of oxytocin. Endocrine Regulations. 53 (1), 46-54 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유