Method Article
التصوير والتحديد الكمي للتشعبات العصبية السليمة عن طريق إزالة الأنسجة الوضوح
In This Article
Summary
المورفولوجيا التشجرية العصبية غالبا ما تكمن وراء وظيفة. في الواقع، العديد من العمليات المرض التي تؤثر على تطوير الخلايا العصبية تظهر مع النمط الظاهري المورفولوجي. يصف هذا البروتوكول طريقة بسيطة وقوية لتحليل المشجرات التشجرية السليمة والعمود الفقري المرتبط بها.
Abstract
يتم تحديد نشاط الدماغ ، والإشارات الكهروكيميائية التي تنتقل بين الخلايا العصبية ، من خلال أنماط الاتصال في شبكات الخلايا العصبية ، ومن مورفولوجيا العمليات والهياكل الفرعية داخل هذه الخلايا العصبية. على هذا النحو، نشأ الكثير مما هو معروف عن وظيفة الدماغ جنبا إلى جنب مع التطورات في تقنيات التصوير التي تسمح بمزيد من البصيرة في كيفية تنظيم الخلايا العصبية وتوصيلها في الدماغ. وقد سمحت التحسينات في تطهير الأنسجة للتصوير عالي الدقة لشرائح الدماغ السميكة، مما يسهل إعادة البناء المورفولوجي وتحليل الهياكل الفرعية العصبية، مثل المشجرات والعمود الفقري. جنبا إلى جنب ، والتقدم في برامج معالجة الصور توفير أساليب لتحليل مجموعات البيانات بسرعة التصوير الكبيرة. يقدم هذا العمل طريقة سريعة نسبيا لمعالجة وتصور وتحليل شرائح سميكة من الأنسجة العصبية المسماة بدقة عالية باستخدام إزالة الأنسجة CLARITY ، والتنظير المجهري confocal ، وتحليل الصور. سيسهل هذا البروتوكول الجهود الرامية إلى فهم أنماط الاتصال ومورفولوجيا الخلايا العصبية التي تميز الأدمغة السليمة، والتغيرات في هذه الخصائص التي تنشأ في حالات الدماغ المريضة.
Introduction
فهم التنظيم المكاني، وأنماط الاتصال، ومورفولوجيا الهياكل البيولوجية ثلاثية الأبعاد المعقدة أمر ضروري لتحديد وظائف خلايا وأنسجة محددة. وهذا صحيح بشكل خاص في علم الأعصاب، حيث تم تكريس جهد هائل لبناء خرائط عصبية تحليلية عالية الدقة للجهاز العصبي المركزي1،2. الفحص الدقيق للخلايا العصبية التي تتألف منها هذه الخرائط تسفر عن مورفولوجيا متنوعة، مع الاتصالات والمواقع التي تعكس وظيفة هذه المجموعات المتنوعة من الخلايا العصبية3،4. وعلاوة على ذلك، التحقيق في الهياكل دون الخلوية، وخاصة العمود الفقري التشجر، يمكن أن تبلغ نضج نقاط الاشتباك العصبي، وبالتالي تعكس عمليات النمو والأمراض العصبية الدول5،6،7. وهكذا، فإن النهج التي تحسن دقة التصوير والإنتاجية ضرورية لفهم أفضل لوظيفة الدماغ على جميع المقاييس.
وقد وسعت التطورات الأخيرة مجموعة الأدوات الجزيئية والجينية لوضع علامات والتلاعب بمجموعات الخلايا العصبية. تطوير علامات الفلورسنت جديدة, جنبا إلى جنب مع أساليب جديدة لإدخال هذه العلامات في الخلايا العصبية, يسمح للتفاضلي وضع العلامات من السكان من الخلايا العصبية التفاعل داخل نفس الحيوان أو عينة الدماغ8,9,10,11. نظرا لأن الضوء مبعثر بواسطة الدهون المبهمة ، ونظرا للمحتوى الدهني العالي لأنسجة الدماغ ، فقد اقتصر تصوير مجموعات الخلايا العصبية في المقام الأول على أقسام رقيقة أو اعتمد على تقنيات ميكروسكوبي متقدمة (على سبيل المثال ، المجهر confocal ، متعدد الفوتونات ، وورقة الضوء) لتصوير الهياكل العميقة. ومع ذلك، فقد تعززت هذه الجهود إلى حد كبير من خلال التقدم في تقنيات إزالة الأنسجة. واضح الدهون تبادل الأكريلاميد الهجين التصوير جامدة / المناعة /في الموقع التهجين متوافقة مع الأنسجة hYdrogel (وضوح) هي واحدة من هذه التقنية، التي يتم غرس الأنسجة ذات الاهتمام مع مونومرات هيدروجيل (الأكريلاميد وببيس أكريلاميد) ومن ثم غسلها مع المنظفات12. تهجين مونومرات الهيدروجيل لإنشاء سقالة هيدروجيل ثلاثية الأبعاد مستقرة شفافة بصريا و نفاذية لتسميات الجزيئات الكبيرة. يتم الحفاظ على الأحماض النووية والبروتينات داخل المصفوفة المهجنة ، في حين تتم إزالة الدهون بواسطة يغسل المنظفات(الشكل 1). وهذا يؤدي إلى نسيج مستقر جامد بما يكفي للحفاظ على الشكل الأصلي والتوجه للخلايا والجزيئات غير الدهنية ، في حين شفافة بصريا بما يكفي لتصوير الهياكل العميقة بسهولة بدقة عالية. تسمح هذه الصيانة لهيكل الأنسجة واتجاهها بتصوير الشرائح السميكة ، وبالتالي الحفاظ على الاتصالات من خلية إلى خلية والعلاقات المكانية. وعلاوة على ذلك، ونظرا للحفاظ على موقع وتوافر البروتينات والأحماض النووية أثناء عملية التطهير، فإن الأنسجة المطهية قادرة على الاحتفاظ بعلامات مستندة إلى التعبير، بالإضافة إلى التسميات الخارجية. وهكذا ، CLARITY يفسح المجال كوسيلة قوية لتصوير كميات كبيرة من هياكل الدماغ العميقة والاتصالات بين هذه الهياكل في دقة عالية.
استخدام وضوح يحسن كثيرا النهج لتصوير مجموعات الخلايا العصبية. هذه التقنية بارعة بشكل خاص في توليد كميات كبيرة من بيانات التصوير. يعمل CLARITY بشكل جيد مع أشكال متعددة من الفلورسينس القائم على البروتين. يستخدم هذا البروتوكول نهجا قائما على العدسية للخلايا ذات التسمية القليلة مع EGFP و tdTomato؛ ومع ذلك، تم استخدام الأليل مراسل المعدلة وراثيا التعبير عن tdTomato أو EGFP لتسمية الخلايا لإعادة الإعمار بشكل روتيني. من المهم اختيار الفلوروفور المستقر والمشراق (على سبيل المثال، EGFP أو tdTomato). بالإضافة إلى ذلك، استخدام مروج قوي للتعبير عن الفلوروفور ينتج تباينا فائقا وجودة صورة. عيوب هذه التقنية تنشأ كما تحليل صحيح هذا الكم الكبير من البيانات يمكن أن تكون كثيفة العمالة والوقت على حد سواء. يمكن للمجاهر المتخصصة المساعدة في تحسين الإنتاجية وتقليل عبء العمل. ومع ذلك، فإن بناء المجاهر المتقدمة وامتلاكها و/أو تشغيلها غالبا ما تكون باهظة التكلفة بالنسبة للعديد من المختبرات. يقدم هذا العمل طريقة عالية الإنتاجية وسريعة وبسيطة نسبيا لتصور كميات كبيرة من الأنسجة العصبية بدقة عالية باستخدام مسح أنسجة CLARITY للأقسام الكبيرة ، إلى جانب المجهر الكونفوفيكال القياسي. يصف هذا البروتوكول هذا النهج من خلال الخطوات التالية: 1) تشريح وإعداد الأنسجة العصبية ، 2) تطهير الأنسجة ، 3) تركيب الأنسجة ، 4) تصوير الشرائح المعدة ، و 5) معالجة صور الشريحة الكاملة باستخدام إعادة بناء وتحليل برامج التصور المجهري(الشكل 2). هذه الجهود تؤدي إلى صور عالية الدقة التي يمكن استخدامها لتحليل مجموعات من الخلايا العصبية، وأنماط اتصال الخلايا العصبية، مورفولوجيا التشجرات ثلاثية الأبعاد، وفرة العمود الفقري التغصني ومورفولوجيا، وأنماط التعبير الجزيئي داخل أنسجة الدماغ سليمة.
Protocol
يتبع البروتوكول التالي جميع إرشادات رعاية الحيوان لكلية بايلور للطب.
1. تشريح وإعداد الأنسجة
- قتل رحيم الماوس مع جرعة زائدة من isoflurane عن طريق وضع الماوس في حاوية مغلقة مع منشفة غارقة في isoflurane (أو من قبل وسائل أخرى وافق IUCAC).
- Perfuse الحيوان عبر البطاقة باستخدام إبرة 25 G مع 10 مل من الجليد البارد PBS، تليها 10 مل من 4٪ PFA.
- تشريح منطقة الدماغ (أو الأنسجة) من الفائدة.
- ضع الأنسجة المتشرخة في 4٪ PFA بين عشية وضحاها عند 4 درجة مئوية. التثبيت الصحيح هو المفتاح لهذا البروتوكول. لا تخطي أو تقصير هذه الخطوة.
- بعد التثبيت في 4٪ PFA لمدة 12 ساعة على الأقل، نقل الأنسجة إلى خليط هيدروجيل الأكريلاميد 4٪ لمدة 24 ساعة في 4 درجة مئوية.
ملاحظة: عند إذابة الهيدروجيل، تأكد من أنه لم يبوليمر، وهذا يمكن أن يحدث إذا الهيدروجيل يصبح دافئا جدا. ذوبان الجليد لمنع البلمرة المبكرة.
2. تطهير الأنسجة
- ضع أنسجة الدماغ (التي لا تزال مغمورة في الهيدروجيل) في حاضنة فراغ لمدة 3 ساعة عند 37 درجة مئوية مع فراغ -90 كيلو باسكال. اترك الأنبوب العلوي غير مفكك للسماح للفراغ بالتشكل بشكل صحيح.
- اغسل الأنسجة باستخدام برنامج تلفزيوني لمدة 10 دقائق في درجة حرارة الغرفة (25 درجة مئوية) مع اهتزاز لطيف.
- ضع عينة الأنسجة البلمرة في غرفة الكهرومورفوريس، مع ملاحظة اتجاه الأنسجة داخل الغرفة.
- ملء الغرفة والخزان مع العازلة SDS الكهربائي الموردة.
- تشغيل العينة في 70 V، 1 A، و 35 C، مع تيار ثابت لحوالي 2 ساعة / ملم من الأنسجة.
- تحقق من العينة بشكل دوري؛ قد يتطلب الأمر المزيد من الوقت في الغرفة لمسح بشكل صحيح. نقطة انطلاق جيدة للمقاصة هي 1-2 ساعة لكل ملم من أنسجة الدماغ. دماغ الفأر كله يتطلب 8-10 ساعة لتطهير كافية. تذكر اتجاه العينة قبل إزالتها من الغرفة وتأكد من استبدالها مرة أخرى في الغرفة في نفس الاتجاه.
ملاحظة: يوضح الشكل 3A كيف سيبدو الدماغ الذي تم مسحه بالكامل. الدماغ سوف تبدو مبهمة وغير واضحة في هذه المرحلة بسبب وجود SDS الذائبة، ولكن ينبغي أن يكون هناك القليل أو لا لون الأنسجة الصفراء هوى بعد استخراج الدهون.
- تحقق من العينة بشكل دوري؛ قد يتطلب الأمر المزيد من الوقت في الغرفة لمسح بشكل صحيح. نقطة انطلاق جيدة للمقاصة هي 1-2 ساعة لكل ملم من أنسجة الدماغ. دماغ الفأر كله يتطلب 8-10 ساعة لتطهير كافية. تذكر اتجاه العينة قبل إزالتها من الغرفة وتأكد من استبدالها مرة أخرى في الغرفة في نفس الاتجاه.
3. إعداد وتركيب الأنسجة تطهيرها
- بعد الانتهاء من مسح العينة وتبدو واضحة بما فيه الكفاية، وغسل في برنامج تلفزيوني بين عشية وضحاها في درجة حرارة الغرفة. استبدال برنامج تلفزيوني مع برنامج تلفزيوني جديد في كثير من الأحيان ممكن. هذه الخطوة ضرورية لإزالة SDS المتبقية التي يمكن أن تشكل ترسبات في خطوات لاحقة.
- بعد الغسل النهائي في PBS، اغسل الأنسجة لمدة 5 دقائق في الماء المتأين في درجة حرارة الغرفة ثلاث مرات. سوف تصبح الأنسجة مبهمة في هذه الخطوة وقد تتوسع.
- احتضان الأنسجة في محلول مطابقة مؤشر الانكسار (انظر الجدول 1)لمدة 4 ساعة على الأقل في درجة حرارة الغرفة. الشكل 3B يظهر قطعة من الأنسجة مسح بعد الحضانة في معامل الانكسار مطابقة الحل.
- أثناء احتضان الأنسجة في محلول مطابقة مؤشر الانكسار ، قم ببناء غرفة سكنية مناسبة لتصوير العينة إذا لزم الأمر.
- بناء غرفة تصوير لعينات/شرائح الأنسجة الصغيرة
- باستخدام شريحة زجاجية كقاعدة للتركيب ، ضع إما مسافات مطاطية أو بلاستيكية وآمنة مع الغراء الفائق. إذا لم تتوفر الفواصل مسبقة الصنع، استخدم الحلقات البلاستيكية المصنوعة من مقاطع عرضية أنبوبية مخروطية.
- ضمان تأمين هذه القطع إلى الشريحة الزجاجية دون أي ثقوب(الشكل 3C).
- ضع الأنسجة التي تم مسحها في غرفة التركيب المعبأة مسبقا بمحلول مطابقة الفهرس الانكساري.
- جبل آمن الأنسجة عن طريق وضع غطاء زجاجي على رأس وختم مع طلاء الأظافر.
- صورة هذا النسيج عن طريق إضافة قطرة من مؤشر الانكسار مطابقة حل تصاعد مباشرة على رأس الزجاج.
- غرفة تصوير الأنسجة الكبيرة
- بناء هذه الغرفة إذا كان النسيج أكبر من 5 مم سميكة (مناسبة للأدمغة أو نصفي الكرة الأرضية كله).
- باستخدام طبق زجاجي طوله 10 سم مع جدار مرتفع ، ضع أنبوبا مخروطيا سعة 50 مل في المركز ، مع التأكد من أن قطر المخروطية كبير بما يكفي لقبول برميل العدسة الموضوعية المستخدمة.
- جعل 3٪ agarose في الماء وتصب في الفضاء بين طبق زجاجي وأنبوب مخروطي، والسماح لتبرد لمدة 1 ساعة(الشكل 3D). هذا وسوف تشكل حلقة من agarose الصلبة (الشكل 3E).
- تلتزم بأمان الأنسجة إلى الجزء السفلي من الغرفة باستخدام الغراء السوبر وملء الغرفة مع حل مطابقة مؤشر الانكسار. تطبيق الغراء على الالتزام الأنسجة على المنطقة التي لن تكون صورة للسماح لاستصلاح الأنسجة من الطبق دون الإضرار المناطق ذات الاهتمام.
ملاحظة: هذا التحضير حساس للوقت، حيث قد تبدأ وسائط الفهرس الانكسار في البلمرة ما لم يتم حفظها من الهواء وتخزينها عند 4 درجات مئوية.
4. تصوير عينات الأنسجة مسح
- احصل على الصورة باستخدام مجهر كونفوجكال يتناسب مع هدف 25x/0.95 NA مع مسافة عمل 4 مم.
- قم بتشغيل جميع معدات التصوير ذات الصلة. ضع العينة على المسرح وضع قطرة من معامل الانكسار مطابقة الحل على الجزء العلوي من غرفة تصاعد.
- اقترب بعناية من وسائل الإعلام الغمر مع الهدف وتشكيل عمود مستمر من وسائل الإعلام.
- باستخدام الفلورة، ابحث عن حقل تصوير مناسب.
- ابدأ إجراء الحصول على الصورة عن طريق اختبار الإعدادات المناسبة.
- ابدأ بتعيين إعدادات الدقة وسرعة المسح الضوئي باستخدام الشكل 4A كدليل. إذا التصوير باستخدام المجهر confocal، إغلاق الثقب تماما للحصول على أصغر قسم البصرية وبالتالي أفضل z-القرار.
- قم بزيادة زيادة قوة الليزر/ مستشعره تدريجيا حتى يتم الحصول على صورة مناسبة بنسبة إشارة إلى ضوضاء عالية.
- إذا كنت تستخدم معيار EGFP / tdTomato التصوير بلونين ، تعيين إعدادات جمع الضوء باستخدام الشكل 4B كدليل.
- تعيين المعلمات z-كومة على أساس نقطة البداية والنهاية الملاحظة من الأنسجة. تعيين حجم الخطوة استنادا إلى الدقة z المطلوب باستخدام الشكل 4C كدليل.
ملاحظة: أحجام الخطوات الأصغر سوف تسفر عن دقة z أكبر ولكن سوف تقدم أيضا المزيد من الوقت يسكن الليزر، مما قد يؤدي إلى تبييض العينة. - عندما تكون راضيا عن إعدادات الحصول على الصورة، احصل على الصورة.
- تأكد من أن الصورة لديها نسبة عالية من الإشارة إلى الضوضاء ويظهر حدود متميزة من الهياكل(الشكل 4D).
5. معالجة الصور وتكميم 3D باستخدام برنامج تحليل المجهر
ملاحظة: حزم برامج تحليل الصور المجهرية هي أدوات قوية لتصور الصور ثلاثية الأبعاد ومعالجتها. العديد من هذه البرامج مناسبة تماما للتعامل مع مجموعات البيانات الكبيرة التي يتم إنشاؤها من عينات الأنسجة التصويرية. تتوافق الخطوات التالية والأرقام المقترنة مع سير عمل برنامج Imaris.
- افتح مكدس الصور واستورده إلى برنامج التحليل المحدد.
- عرض الصورة في الفضاء ثلاثي الأبعاد وإجراء أية تغييرات المطلوبة إلى الجداول البحث باستخدام جهاز ضبط العرض لتصور الصورة بشكل أفضل.
ملاحظة: يوضح الشكل 5A عمق التصوير الشديد المحتمل الذي يمكن الوصول إليه من خلال مجهر 2 فوتون مقترن بمسح أنسجة CLARITY. الشكل 5B يظهر عمليات التشعب متميزة وكذلك مورفولوجيا العمود الفقري مرئية بوضوح من المكدس z المعروضة في الشكل 5A. - لتصفية أي خلفية متناسقة، انقر على زر معالجة الصور وحدد فلتر الطرح الخلفية.
ملاحظة: يظهر الشكل 5C الصورة مع إشارة خلفية ضبابية متناسقة قبل المعالجة. يظهر الشكل 5D الصورة بعد تطبيق عامل تصفية الطرح الخلفية. - مراقبة الصورة 3D وتصبح مألوفة معها من خلال النظر إليها من زوايا متعددة ومستويات التكبير.
- بدء تتبع التشعب عن طريق تحديد أداة التتبع Filament أولا.
- انقر على تحرير خيوط يدويا، تخطي إنشاء التلقائي.
- تعيين الوضع إلى المسار التلقائي والتحقق من التصحيحات التلقائية في الوسط وقطرها التلقائي.
- التحول + انقر بزر الماوس الأيمن على هيئة الخلية لتعيين نقطة انطلاق.
- تتبع الخلايا العصبية على طول كامل من dendrite; انقر على اليسار في نهاية dendrite لتعيين نقطة إنهاء للسماح للبرنامج لحساب المسار تلقائيا بين نقطة البداية والنهاية.
- كرر هذه الخطوة لجميع dendrites، وتتبع تماما من بنية الخلية.
- تصور الخلية المتتبعة وتأكيد دقتها. إجراء تعديلات يدوية حسب الحاجة.
- حدد علامة التبويب إنشاء.
- حدد خيار إعادة تركيب قطر Dendrite.
- اتبع المعالج لإكمال dendrite تتبع أكثر دقة.
- حدد علامة التبويب رسم.
- انقر على زر العمود الفقري لبدء رسم العمود الفقري.
- تعيين قطر العمود الفقري التقريبي حسب الحاجة، واستخدام أداة القياس للحصول على تمثيل دقيق لأقطار العمود الفقري.
- انقر على مركز رأس العمود الفقري لإضافة عمود فقري جديد.
- كرر هذا لجميع العمود الفقري على التشعب.
ملاحظة: من المهم مراقبة التشعب من جميع الزوايا الممكنة عند إضافة العمود الفقري يدويا. - تحقق من العمود الفقري المضاف حديثا للتأكد من دقته وإجراء التغييرات حسب الحاجة.
- حدد علامة التبويب إنشاء.
- حدد خيار Recompute Spine Diameter للسماح للبرنامج بتحديد أقطار الرأس والرقبة المناسبة ، والتي تعتبر حاسمة لتحليل البيانات في المصب.
- اتبع العمود الفقري القطر خلق المعالج إلى الانتهاء.
- مراقبة نتيجة الحساب وإجراء أي تعديلات يدوية حسب الحاجة. الشكل 5E يظهر الخلايا العصبية تتبع تماما كاملة مع العمود الفقري.
- لإنشاء قائمة سرية للعمود الفقري، حدد علامة التبويب أدوات.
ملاحظة: يجب تثبيت ملحق MATLAB لهذا العمل.- لتثبيت ملحق MATLAB افتح إطار التفضيلات.
- حدد الخيار أدوات مخصصة.
- إضافة وقت تشغيل MATLAB المناسبة MCR.
- انقر على تصنيف العمود الفقري.
- تحرير المعلمات المطلوبة لتصنيف العمود الفقري.
- انقر على تصنيف العمود الفقري على امتداد MATLAB. الشكل 5F يظهر dendrite مضافا مع العمود الفقري المصنفة مرمزة بالألوان.
- حدد علامة التبويب إحصائيات.
- تكوين الإحصائيات المطلوبة لتحديد البيانات بالنقر فوق الزر تكوين في الزاوية السفلية اليسرى من علامة التبويب هذه.
- بمجرد اختيار طريقة تمثيل الإحصائيات، قم بتصدير البيانات باستخدام الزر تصدير الإحصائيات على شاشة التبويب إلى ملف الموجود أسفل يمين هذه النافذة.
- رسم بياني للإحصاءات باستخدام طريقة رسم بياني مفضلة.
النتائج
بعد الحصول على الصورة ، تم تحليل مورفولوجيا الخلية التمثيلية باستخدام إحصاءات مضمنة وتصنيف البرامج النصية داخل برنامج التحليل. البيانات التي تم جمعها(الشكل 6A)يعكس أن الخلايا العصبية 2 لديها بنية أكبر dendritic مع كثافة أعلى من العمود الفقري. ككل، تشير البيانات إلى أن الخلايا العصبية 2 لديها بنية أكثر تعقيدا التشجر مقارنة مع الخلايا العصبية 1. لإثبات هذه النتيجة، تم إجراء تحليل شول القياسية، مما يؤكد أن الخلايا العصبية 2 هو أكثر تعقيدا dendritically من الخلايا العصبية 1 كما يدل على ذلك زيادة عدد التقاطعات شول في 50-100 ميكرومتر من سوما (الشكل 6B). وأخيرا، تم تصنيف العمود الفقري التشجر من الخلايا العصبية اثنين من الصور إلى أربع فئات رئيسية على أساس الأشكال والأحجام عموما. العمود الفقري التي تظهر المزيد من الأشكال الشبيهة filopodia هي على الأرجح أكثر الأنواع الفرعية العمود الفقري غير ناضجة. العمود الفقري مع رؤساء محددة، ودعا العمود الفقري الفطر، من المرجح أن تحتوي على نقاط الاشتباك العصبي أكثر تطورا ونضجا7. التحليل المعروض هنا يظهر أن الخلايا العصبية 1 يحتوي على نسبة أكبر من العمود الفقري مثل filopodia بالمقارنة مع الخلايا العصبية 2(الشكل 6C). وهكذا، استنادا إلى مورفولوجيا، الخلايا العصبية 2 هو أكثر نضجا تنمويا كما هو أكبر، أكثر تشعبتا للغاية، ويحتوي على كثافة أعلى من العمود الفقري ناضجة.
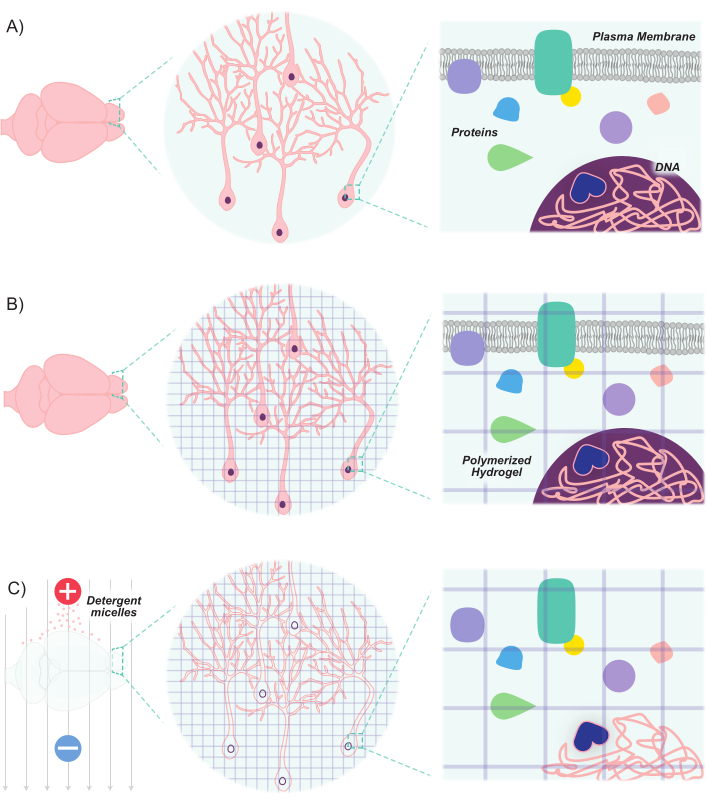
الشكل 1:بروتوكول الوضوح يجعل الأنسجة شفافة مع الحفاظ على البنية المتأصلة والعلاقات المكانية جزيء جزيء. (أ) التوجه الأصلي للأنسجة العصبية والمكونات بين الخلايا قبل المقاصة. (ب)يتم غرس مونومرات هيدروجيل (خطوط أرجوانية) في الأنسجة وبوليمرات في شبكة هيدروجيل. ترتبط الأنسجة وشبكة الهيدروجيل عبر تثبيت الفورمالديهايد. (ج)ثم يتم غسل الأنسجة مع حلول المنظفات الأيونية في حين تتعرض للحقول الكهربائية. خلال هذه العملية ، تزيل ميشيل المنظفات جزيئات الدهون من الأنسجة ، تاركة وراءها شبكة مترابطة من الهيدروجيل الشفاف والجزيئات الحيوية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
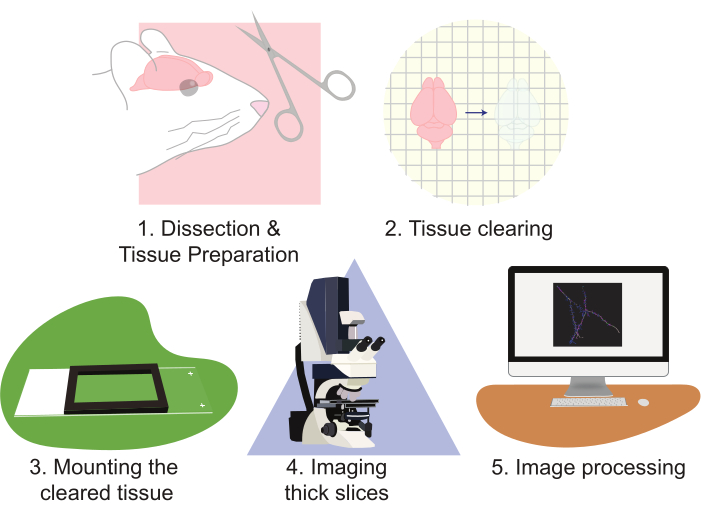
الشكل 2:مخطط تدفق البروتوكول، رسم تخطيطي لإعداد الأنسجة، والتطهير، والتصاعد، والتصوير، ومعالجة الصور.

الشكل 3: بناء غرف التركيب لعينات الأنسجة مسح. (أ) مسح الدماغ كله في برنامج تلفزيوني قبل الانغماس في معامل الانكسار مطابقة الحل. (ب) شريحة الدماغ في معامل الانكسار مطابقة الحل. (ج) غرفة التصوير لعينات الأنسجة الكبيرة والصغيرة التي تم مسحها. يمكن إجراء الغرف باستخدام مجموعة متنوعة من المواد بما في ذلك على سبيل المثال لا الحصر البلاستيك المطبوع ثلاثي الأبعاد وقطع الأنابيب المخروطية. (د) غرفة التصوير لكامل الدماغ أو نصف الكرة الأرضية التصوير، وذلك باستخدام أنبوب مخروطي 50 مل كراحة قبل صب agarose. (E) الدماغ كله أو نصف الكرة غرفة التصوير مع agarose مجموعة كاملة; هذا الإعداد هو الأمثل لأهداف الغمر برميل كبير. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4:الحصول على مجموعات بيانات كبيرة عالية الجودة من عينات الأنسجة التي تم مسحها. (أ) إعدادات الحصول على الصور المستخدمة للتصوير عالي الدقة للخلية بأكملها. تم إغلاق الثقب بالكامل لتمكين المقاطع البصرية الدقيقة. تم تحديد سرعة المسح الضوئي تجريبيا استنادا إلى أوقات البكسل المثالية. (ب) إعدادات المسار الخفيف: تعتمد هذه على الفلوروفور والمعدات المستخدمة. (C) إعدادات المكدس Z; تم استخدام غرامة z-الخطوة لالتقاط أكبر قدر ممكن من المعلومات في الاتجاه z. (D) الإسقاط الحد الأقصى التمثيلي؛ يمثل شريط المقياس 25 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
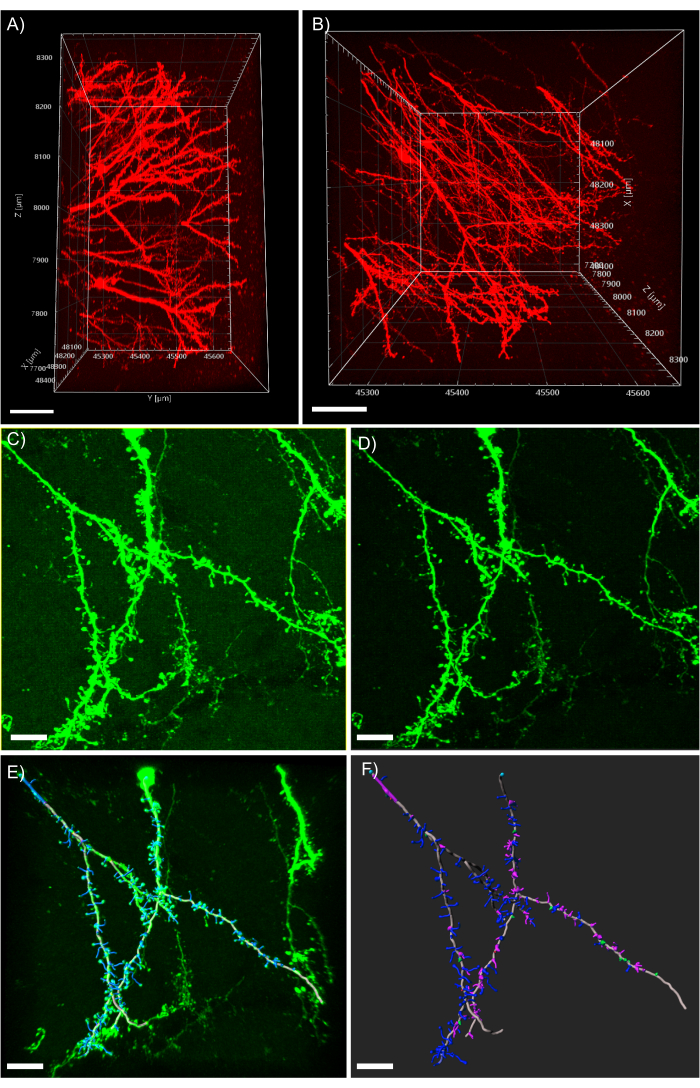
الشكل 5: تحليل ثلاثي الأبعاد لل dendrites في برنامج التحليل. (A)عرض جانبي ل فوتونين اثنين المكتسبة 600 ميكرومتر z-كومة المكتسبة من أنسجة سميكة 1 مم التعبير عن tdTomato; يمثل شريط المقياس 100μm. (B) أعلى عرض لنفس المكدس z المكتسبة في لوحة A; مقياس شريط يمثل 100μm. (C) Confocal الصورة المكتسبة من الأنسجة التي تعبر عن EGFP. يمكن استيراد ملفات الصور مباشرة إلى برنامج التحليل ومعالجتها مسبقا للحصول على جودة صورة أكبر؛ يمثل شريط المقياس 25 ميكرومتر (D) يتم استخدام الطرح العتبي لإزالة إشارة الخلفية الثابتة الموجودة في C. (E) تتبع خيوط وتحديد العمود الفقري: هذه العملية هي الأفضل عند تنفيذها بشكل شبه تلقائي مع فحص ميزة العمق التلقائي. ثم وصفت العمود الفقري اليد بعد إعادة بناء التشعب الكامل; يمثل شريط المقياس 25 ميكرومتر (F) تصنيف العمود الفقري باستخدام ملحق MATLAB مدمج. وقد تم ترميز العمود الفقري على أساس مورفولوجيا بهم; العمود الفقري كعب أحمر; العمود الفقري الفطر الخضراء; العمود الفقري رقيقة طويلة زرقاء; filopodia الأرجواني; يمثل شريط المقياس 25 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
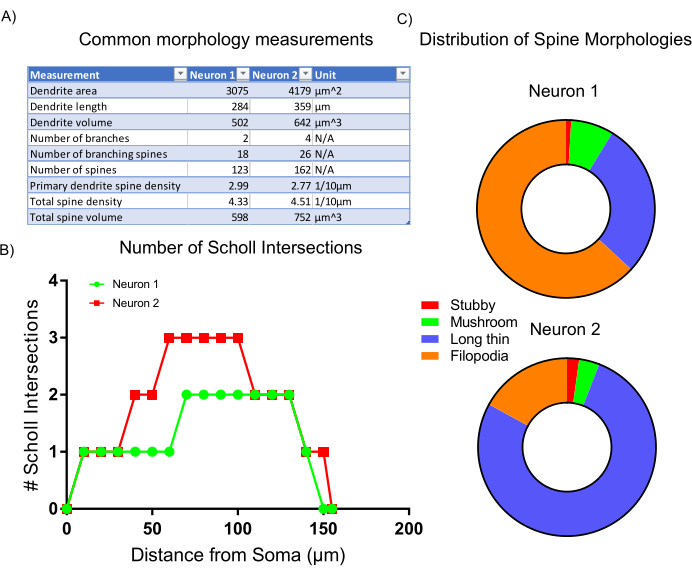
الشكل 6: النتائج التمثيلية. (أ) جدول القياسات المورفولوجية الشائعة التي يتم إنشاؤها تلقائيا من خلال برنامج التحليل المحدد. (ب) عدد تقاطعات شول الناتجة عن إحصائيات البرنامج. (ج) مخطط دائري يمثل توزيع مورفولوجيا العمود الفقري التشعبي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| حل | تكوين | تلاحظ |
| حل مطابقة الفهرس الانكساري | 80 غرام من هيستودينز | pH إلى 7.5 مع NaOH |
| 60 مل من 0.02 متر من الفوسفات العازلة | يخزن عند درجة حرارة 4 درجة مئوية | |
| 0.01٪ من أزيد الصوديوم | مقتبس من ماركس، المجلد الخامس لطرق الطبيعة 11، الصفحات 1209-1214 (2014) | |
| هيدروجيل | 13.33 مل من 30٪ أكريلاميد (بدون مكرر) | مزيج معا على الجليد، وإلا فإن الحل قد تبدأ في البلمرة |
| 10 مل من برنامج تلفزيوني 10x | Aliquot و متجر في -20 °C | |
| 250 ملغ من VA-044 | ||
| 76.66 مل من ddH2O |
الجدول 1: وصفات لحل مطابقة الصور الانكسارية وحل الهيدروجيل. يتم سرد تكوين معامل الانكسار مطابقة الحل والهيدروجيل.
Discussion
قبل ظهور تقنيات إزالة الأنسجة المعاصرة ، كانت دراسة مورفولوجيا الخلايا العصبية تتكون من قسم مكثف الوقت والتصوير وإعادة بناء الأجزاء الرقيقة جدا المجاورة. باستخدام تطهير الأنسجة الكهربائية في تركيبة مع التصوير confocal يوفر وجهة نظر دون عائق من مورفولوجيا الخلايا العصبية كاملة. من الأشجار التغصنية سليمة، وصولا الى أصغر بوتون متشابك، والتصوير وتحديد مورفولوجيا الخلايا العصبية لم يكن أبدا أكثر جدوى.
إعداد أنسجة الدماغ مسح واضحة ويتطلب قطعة واحدة فقط من المعدات المتخصصة. الأنسجة مسح وصورت باستخدام هذا البروتوكول يقوض الحاجة إلى تقسيم رقيقة مملة، والتعامل معها، وتصاعد، وخفض كبير في الوقت من التجريب إلى الحصول على الصورة. بالإضافة إلى ذلك ، تظل الأنسجة المصورة دون تقسيم أكثر إخلاصا للهياكل الأصلية ، حيث لا توجد مصادر للضرر أو إعادة بناء الصور الضرورية بعد المخصصة. وأخيرا، يوفر هذا البروتوكول الوقت من خلال السماح بالتصوير المتزامن للميزات واسعة النطاق مثل الأشجار التشجرية إلى جانب ميزات الميكرون الصغيرة مثل العمود الفقري.
مجموعة هامة واحدة من الخطوات في هذا البروتوكول هي الخطوات غسل التي تتبع عملية المقاصة. تعتبر هذه الخطوات هامة لإزالة كافة آثار المخزن المؤقت للتطهير الكهربائي SDS. إذا لم يتم غسل الأنسجة المطهية بما فيه الكفاية ، فإن الرواسب تتشكل أثناء الخطوة المتصاعدة. يمكن أحيانا إعادة حل هذه الرواسب عن طريق احتضان الأنسجة عند 37-55 درجة مئوية لفترة قصيرة. ومع ذلك ، إذا استمرت الرواسب ، فإنها ستبعثر الضوء ، مما يؤدي إلى عمق التصوير الضعيف وجودته.
تركيب قطع كبيرة من الأنسجة يمثل تحديا بالمقارنة مع التصوير شريحة رقيقة التقليدية. هنا نقدم عمليات متعددة لتركيب الأنسجة الكبيرة ، والتي تعتمد على تقنية التصوير ، وخصائص العدسة الموضوعية ، وحجم عينة الأنسجة. أولا، من المهم استخدام عدسة موضوعية مناسبة للغمر في الوسائط المطابقة لمؤشر الانكسار المحدد المستخدمة، والتي لديها مسافة عمل كافية لتصوير عينات الأنسجة الكبيرة. هذا البروتوكول محدود إلى حد كبير من الخصائص البصرية لمنصة التصوير المستخدمة ، وتحديدا مسافة العمل للأهداف. يتم تحقيق التصوير في العمق بسهولة باستخدام هذا البروتوكول. ومع ذلك ، إذا لم يكن هناك هدف مع مسافة عمل كافية متاحة ، فإن النسيج نفسه يمثل حاجزا ماديا أمام الحصول على صور كبيرة. القرار الهام التالي هو تقنية التصوير. يستخدم المجهر ثنائي الفوتون عادة لجودة الصورة الرائعة وعمق التصوير وسرعة الاستحواذ. يتيح المجهر ثنائي الفوتون التصوير بما يصل إلى 1 مم في الأنسجة الواضحة دون فقدان جودة الصورة كما هو موضح في الشكل 5A،B. ومع ذلك ، يمكن تحقيق نتائج مشابهة جدا عند استخدام المجهر confocal التقليدية وإن كان مع التضحية إلى عمق التصوير مقارنة مع اثنين من الفوتون المجهر(الشكل 5C،D).
وباختصار، توفر هذه الطريقة منصة قوية ومريحة لتحليل مورفولوجيا الخلايا العصبية على نطاقين كبير وصغير. بالإضافة إلى ذلك، تقلل هذه الطريقة إلى حد كبير من وقت المعالجة والمعالجة، مع توفير صور ثلاثية الأبعاد أكثر دقة وإكمال. مورفولوجيا الخلوية هو وكيل شائعة الاستخدام لتقييم وظيفة الدائرة والصحة الكامنة وراء العديد من الأمراض والأمراض13،14،15. تصوير مورفولوجيا الخلايا العصبية قوية ومباشرة ومناسبة تماما لل المقايسة في العديد من نماذج المرض.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه في هذا الوقت.
Acknowledgements
نود أن نشكر NRDDC الأساسية الفيروسية في معهد جان ودان دنكان العصبي لإنتاج AAVs والفيروسات العدسية المستخدمة في هذه التجارب. بالإضافة إلى ذلك، نود أن نشكر مركز كلية بايلور للطب المقارن تربية الفئران والصيانة العامة للفئران المستخدمة. نود أن نشكر جمعية القلب الأمريكية على دعمها بموجب الجائزة رقم 20PRE35040011 ، و BRASS: Baylor دعاة البحوث للطلاب العلماء لدعمهم (PJH). وأخيرا، نود أن نشكر Logos على تزويد مختبرنا بنظام إزالة الأنسجة الكهربائية X-Clarity.
Materials
| Name | Company | Catalog Number | Comments |
| 15 mL Conical Tube | Thermo Scientific | 339650 | |
| 25 G x 1" Needle | BD | 305127 | |
| 30% Acrylamide (No-Bis) | National Diagnostics | EC-810 | |
| 50 mL Conical Tube | Thermo Scientific | 339653 | |
| Electrophoretic Tissue Clearing Solution | Logos | C13001 | |
| Histodenz | Sigma | D2158-100G | |
| Hydrogel Solution Kit | Logos | C1310X | |
| Imaris | Oxford Instruments | N/A | |
| Paraformaldehyde 16% | EMS | 15710 | |
| PBS, 1x, 500 mL, 6 bottles/case | fisher | MT21040CV | |
| VA-044 | Wako | 925-41020 | |
| X-CLARITY Polymerization System | Logos | C20001 | |
| X-CLARITY Tissue Clearing System II | Logos | C30001 |
References
- Abbott, L. F., et al. The Mind of a mouse. Cell. 182 (6), 1372-1376 (2020).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philosophical transactions of the Royal Society of London. Series B, Biological Sciences. 314 (1165), 1 (1986).
- Jiang, X., et al. Principles of connectivity among morphologically defined cell types in adult neocortex. Science. 350 (6264), (2015).
- Winnubst, J., et al. Reconstruction of 1,000 projection neurons reveals new cell types and organization of long-range connectivity in the mouse brain. Cell. 179 (1), 268-281 (2019).
- Araya, R., Vogels, T. P., Yuste, R. Activity-dependent dendritic spine neck changes are correlated with synaptic strength. Proceedings of the National Academy of Sciences of the United States of America. 111 (28), (2014).
- Bosch, M., Hayashi, Y. Structural plasticity of dendritic spines. Current Opinion in Neurobiology. 22 (3), 383-388 (2012).
- Martínez-Cerdeño, V. Dendrite and spine modifications in autism and related neurodevelopmental disorders in patients and animal models. Developmental Neurobiology. 77 (4), 393-404 (2017).
- Arenkiel, B. R., Ehlers, M. D. Molecular genetics and imaging technologies for circuit-based neuroanatomy. Nature. 461 (7266), 900-907 (2009).
- Kim, E. H., Chin, G., Rong, G., Poskanzer, K. E., Clark, H. A. Optical probes for neurobiological sensing and imaging. Accounts of Chemical Research. 51 (5), 1023-1032 (2018).
- Weissman, T. A., Pan, Y. A. Brainbow: New resources and emerging biological applications for multicolor genetic labeling and analysis. Genetics. 199 (2), 293-306 (2014).
- Haggerty, D. L., Grecco, G. G., Reeves, K. C., Atwood, B. Adeno-associated viral vectors in neuroscience research. Molecular Therapy - Methods and Clinical Development. 17, 69-82 (2020).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Kanning, K. C., Kaplan, A., Henderson, C. E. Motor neuron diversity in development and disease. Annual Review of Neuroscience. 33, 409-440 (2010).
- Ledda, F., Paratcha, G. Mechanisms regulating dendritic arbor patterning. Cellular and Molecular Life Sciences. 74 (24), 4511-4537 (2017).
- Falougy, H. E., Filova, B., Ostatnikova, D., Bacova, Z., Bakos, J. Neuronal morphology alterations in autism and possible role of oxytocin. Endocrine Regulations. 53 (1), 46-54 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved