Method Article
通过 CLARITY 组织清除对完整神经元树突进行成像和定量
摘要
神经元树突形态通常是功能的基础。事实上,许多影响神经元发育的疾病过程都表现为形态表型。该协议描述了一种简单而强大的方法,用于分析完整的树突状乔木及其相关的棘。
摘要
大脑活动,即神经元之间传递的电化学信号,由神经元网络的连接模式以及这些神经元内过程和子结构的形态决定。因此,关于大脑功能的许多已知知识都与成像技术的发展一起出现,这些技术可以进一步了解神经元在大脑中的组织和连接方式。组织清除的改进允许对厚厚的脑切片进行高分辨率成像,促进形态重建和神经元下部结构的分析,如树突状乔木和棘。同时,图像处理软件的进步提供了快速分析大型成像数据集的方法。这项工作提出了一种相对快速的方法,使用CLARITY组织清除,共聚焦显微镜和图像分析,以高分辨率处理,可视化和分析标记神经组织的厚片。该协议将有助于理解健康大脑特征的连接模式和神经元形态,以及患病大脑状态中出现的这些特征的变化。
引言
了解复杂三维生物结构的空间组织,连接模式和形态对于描绘特定细胞和组织的功能至关重要。这在神经科学中尤其如此,其中投入了巨大的精力来构建中枢神经系统的高分辨率神经解剖图1,2。仔细检查构成这些图谱的神经元会产生不同的形态,其连接和位置反映了这些不同神经元集的功能3,4。此外,对亚细胞结构的研究,特别是树突棘,可以告知突触的成熟,从而反映发育过程和神经系统疾病状态5,6,7。因此,提高成像分辨率和通量的方法对于更好地了解所有尺度上的大脑功能至关重要。
最近的进展扩展了用于标记和操纵神经元群体的分子和遗传工具包。新的荧光标记物的发展,结合将这些标记物引入神经元的新方法,允许对同一动物或大脑样本8,9,10,11中的相互作用神经元群体进行差异标记。由于光被不透明的脂质散射,并且考虑到脑组织的高脂质含量,成像神经元群体主要局限于薄切片或依赖于先进的显微技术(例如,共聚焦,多光子和光片显微镜)来成像深层结构。然而,这些努力得到了组织清除技术的进步的极大支持。透明脂质交换丙烯酰胺杂交的刚性成像/免疫染色/原位杂交相容的组织 - hYdrogel(CLARITY)就是这样一种技术,其中感兴趣的组织注入水凝胶单体(丙烯酰胺和双丙烯酰胺),然后用洗涤剂洗涤12。水凝胶单体杂交以产生稳定的3D水凝胶支架,该支架具有光学透明性且可渗透到大分子标签。核酸和蛋白质保持在杂交基质中,而脂质通过洗涤剂洗涤剂除去(图1)。这导致稳定的组织足够坚固,以保持细胞和非脂质分子的原始形状和方向,同时光学透明,足以以高分辨率轻松成像深层结构。这种组织结构和方向的维持允许对厚切片进行成像,从而保留细胞间连接和空间关系。此外,由于蛋白质和核酸的位置和可用性在清除过程中得到维持,因此清除的组织能够持有基于表达的标记物以及外源标记。因此,CLARITY是一种有效的方法,用于以高分辨率对大量深部脑结构以及这些结构之间的联系进行成像。
CLARITY的使用大大改进了神经元群体成像的方法。这种技术特别擅长生成大量的成像数据。CLARITY适用于多种形式的基于蛋白质的荧光。该协议利用基于慢病毒的方法,用EGFP和tdTomato稀疏标记细胞;然而,表达tdTomato或EGFP以标记细胞进行重建的转基因报告等位基因已被常规使用。选择光稳定且明亮的荧光团(例如EGFP或tdTomato)非常重要。此外,使用强力启动剂表达荧光团可产生卓越的对比度和图像质量。这种技术的缺点是,正确分析如此大量的数据既费力又费时。专用显微镜可以帮助提高通量并减少工作量。然而,对于许多实验室来说,建造、拥有和/或操作先进的显微镜往往成本过高。这项工作提出了一种高通量,相对快速和简单的方法,使用CLARITY组织清除大切片,结合标准共聚焦显微镜,以高分辨率可视化大量神经组织。该协议通过以下步骤描述了这种方法:1)解剖和制备神经组织,2)清除组织,3)安装组织,4)成像制备的切片,以及5)使用显微镜可视化软件重建和分析处理全切片图像(图2)。这些努力产生了高分辨率图像,可用于分析神经元群体,神经元连接模式,3D树突形态,树突状脊柱丰度和形态以及完整脑组织内的分子表达模式。
研究方案
以下方案遵循贝勒医学院的所有动物护理指南。
1. 解剖和组织准备
- 通过将小鼠置于封闭的容器中,用毛巾浸泡在异氟醚中(或通过其他IUCAC批准的方法)用过量的异氟醚对小鼠实施安乐死。
- 使用 25 G 针头和 10 mL 冰冷 PBS 经心电泳为动物灌注,然后用 10 mL 4% PFA 输注动物。
- 解剖感兴趣的大脑区域(或组织)。
- 将解剖的组织置于4°C下4%PFA过夜。 正确固定是该协议的关键。请勿跳过或缩短此步骤。
- 在4%PFA中固定至少12小时后,将组织转移到4%丙烯酰胺水凝胶混合物中,在4°C下24小时。
注意:解冻水凝胶时,请确保它没有聚合,如果水凝胶变得太热,可能会发生这种情况。在冰上解冻以防止过早聚合。
2. 组织清除
- 将脑组织(仍浸没在水凝胶中)置于真空培养箱中,在37°C下用-90 kPa真空培养3小时。将管顶部拧下,以使真空正确形成。
- 用PBS在室温(25°C)下用轻轻摇动洗涤组织10分钟。
- 将聚合组织样品置于电泳室中,记下室内组织的方向。
- 用随附的电泳SDS缓冲液填充腔室和储液槽。
- 在70 V,1 A和35 C下运行样品,恒定电流约2小时/mm的组织。
- 定期检查样品;它可能需要在腔室中花费更多时间才能正确清除。清除的良好起点是每毫米脑组织1-2小时。整个小鼠的大脑需要8-10小时才能充分清除。在将样品从腔室中取出之前,请记住样品的方向,并确保以相同的方向将其更换回腔室中。
注意: 图3A 显示了完全清除的大脑的样子。由于存在溶解的SDS,大脑在这个阶段看起来不透明且不清晰,但是在脂质提取后应该几乎没有黄色组织色相。
- 定期检查样品;它可能需要在腔室中花费更多时间才能正确清除。清除的良好起点是每毫米脑组织1-2小时。整个小鼠的大脑需要8-10小时才能充分清除。在将样品从腔室中取出之前,请记住样品的方向,并确保以相同的方向将其更换回腔室中。
3. 准备和安装清除的组织
- 样品完成清除并看起来足够清晰后,在室温下在PBS中洗涤过夜。尽可能经常地将 PBS 替换为新的 PBS。此步骤对于去除可能在后续步骤中形成沉淀物的残留SDS至关重要。
- 在PBS中最后洗涤后,在室温下用去离子水洗涤组织5分钟三次。组织在此步骤中将变得不透明并可能扩大。
- 在室温下将组织在折射率匹配溶液(见 表1)中孵育至少4小时。 图3B 示出了在折光率匹配溶液中孵育后清除的一块组织。
- 在折光率匹配溶液中孵育组织期间,如有必要,构建合适的壳室以对样品进行成像。
- 为小组织样品/切片构建成像室
- 使用载玻片作为安装底座,放下橡胶或塑料垫片,并用超级胶水固定。如果没有预制垫片,请使用由锥形管横截面制成的塑料环。
- 确保将这些部件固定在载玻片上,没有任何孔(图3C)。
- 将清除的组织放入预先填充有折射率匹配溶液的安装室中。
- 将玻璃盖玻片放在顶部并用指甲油密封,以牢固地安装纸巾。
- 通过直接在玻璃顶部添加一滴折射率匹配的安装溶液来成像该组织。
- 大型组织成像室
- 如果组织大于5毫米厚(适用于整个大脑或半球),则构建此腔室。
- 使用壁厚的10厘米玻璃盘,在中心放置一个50 mL锥形管,确保锥形的直径足够大,可以接受所用物镜的镜筒。
- 在水中加入3%琼脂糖,倒入玻璃盘和锥形管之间的空间,冷却1小时(图3D)。这将形成固体琼脂糖环(图3E)。
- 使用超级胶水将组织牢固地粘附在腔室底部,并用折射率匹配溶液填充腔室。涂上胶水将组织粘附在不会成像的区域,以便从培养皿中回收组织而不会损坏感兴趣的区域。
注意:这种制备是时间敏感的,因为折射率介质可能开始聚合,除非从空气中保存并储存在4°C。
4. 成像清除的组织样本
- 使用共聚焦显微镜获取图像,该显微镜具有25x / 0.95 NA物镜,工作距离为4 mm。
- 打开所有相关的成像设备。将样品放在载物台上,并将一滴折射率匹配溶液滴到安装室的顶部。
- 小心地接近带有物镜的浸入式介质,并形成连续的介质柱。
- 使用落射荧光,找到合适的成像区域。
- 通过测试适当的设置开始图像采集过程。
- 首先使用 图4A 作为指南设置分辨率和扫描速度设置。如果使用共聚焦显微镜进行成像,请完全关闭针孔以获得最小的光学截面,从而获得最佳的z分辨率。
- 逐渐增加激光功率/传感器增益,直到获得具有高信噪比的合适图像。
- 如果使用标准的EGFP/tdTomato双色成像,请使用 图4B 作为指导设置光收集设置。
- 根据观察到的组织起点和终点设置 z-stack 参数。使用 图4C 作为指导,根据所需的z分辨率设置步长。
注意:较小的步长将产生更大的z分辨率,但也会带来更多的激光停留时间,可能导致样品漂白。 - 当对图像采集设置感到满意时,采集图像。
- 确保图像具有高信噪比,并显示结构的明显边界(图4D)。
5. 使用显微镜分析软件进行图像处理和3D定量
注:显微图像分析软件包是用于三维图像可视化和处理的强大工具。其中许多程序非常适合处理从成像清除的组织样本生成的大型数据集。以下步骤和相关数字对应于 Imaris 软件工作流程。
- 打开图像堆栈并将其导入到选定的分析软件中。
- 在三维空间中查看图像,并使用显示调节器对查找表进行任何所需的更改,以更好地可视化图像。
注: 图5A 显示了通过双光子显微镜与CLARITY组织清除相结合可以获得的极端成像深度。 图5B 显示了不同的枝晶过程以及 图5A所示的z-stack的清晰可见的脊柱形态。 - 要过滤掉任何一致的背景,请单击" 图像处理 "按钮,然后选择背景减法过滤器。
注: 图5C 显示了处理前具有一致模糊背景信号的图像。 图5D 显示了应用背景减法滤波器后的图像。 - 观察3D图像,并通过从多个角度和缩放级别查看它来熟悉它。
- 通过首先选择 灯丝 跟踪器工具开始树突追踪。
- 单击 手动 编辑灯丝, 跳过 自动创建。
- 将模式设置为自动路径,并选中 自动居中 和 自动直径 校正。
- 按住 Shift 键并右键单击单元格主体以设置起点。
- 沿着树突的整个长度追踪神经元;左键单击树突的末端以设置端点,以允许软件自动计算起点和终点之间的路径。
- 对所有树突重复此步骤,并完全追踪细胞结构。
- 可视化追踪的单元格并确认其准确性。根据需要进行手动调整。
- 选择" 创建 "选项卡。
- 选择" 重新计算树突直径 "选项。
- 按照向导完成操作,以获得更准确地跟踪树突。
- 选择" 绘制 "选项卡。
- 单击" 脊柱" 单选按钮开始绘制脊柱。
- 根据需要设置近似脊柱直径,并使用测量工具获得脊柱直径的准确表示。
- 单击脊柱头的中心以添加新的脊柱。
- 对树突上的所有刺重复此操作。
注意:手动添加脊柱时,从所有可能的角度观察树突非常重要。 - 检查新添加的棘刺的准确性,并根据需要进行更改。
- 选择" 创建 "选项卡。
- 选择" 重新计算脊柱直径 "选项,以允许软件确定正确的头部和颈部直径,这对于下游数据分析至关重要。
- 按照脊柱直径创建向导完成操作。
- 观察计算结果,并根据需要进行任何手动调整。 图5E 显示了一个完全追踪的神经元,并带有棘。
- 要创建脊柱的分类列表,请选择 "工具" 选项卡。
注意:必须安装 MATLAB 扩展才能正常工作。- 要安装 MATLAB 扩展,请打开首选项窗口。
- 选择" 自定义工具" 选项。
- 添加相应的 MATLAB 运行时 MCR。
- 点击 分类棘。
- 编辑脊柱分类的所需参数。
- 单击 MATLAB 扩展上的"对棘刺进行分类"。图5F显示了覆盖着颜色编码的分类棘刺的枝晶。
- 选择" 统计信息 "选项卡。
- 配置所需的统计数据以量化数据,方法是单击此选项卡左下角的 配置 按钮。
- 选择统计表示方法后,使用此窗口右下角的 将选项卡上的统计数据导出到文件按钮导出 数据。
- 使用首选的图形方法绘制统计数据。
结果
图像采集后,使用分析软件中的嵌入式统计数据和分类脚本分析具有代表性的细胞形态。收集到的数据(图6A)反映了神经元2具有更大的树突结构和更高的棘密度。总体而言,数据表明,与神经元1相比,神经元2具有更复杂的树突状结构。为了证实这一结果,进行了标准的Sholl分析,该分析肯定了神经元2比神经元1更具树突复杂性,这表示为从体细胞50-100μm处增加的Sholl交叉点数量(图6B)。最后,两个成像神经元的树突棘根据其整体形状和大小分为四大类。表现出更多丝状体形状的脊柱可能是更不成熟的脊柱亚型。具有明确头部的棘,称为蘑菇棘,可能包含更发达和成熟的突触7。这里提出的分析表明,与神经元2相比,神经元1包含更大比例的丝状棘(图6C)。因此,基于形态学,神经元2在发育上更成熟,因为它更大,分支更高,并且包含更高密度的成熟棘。
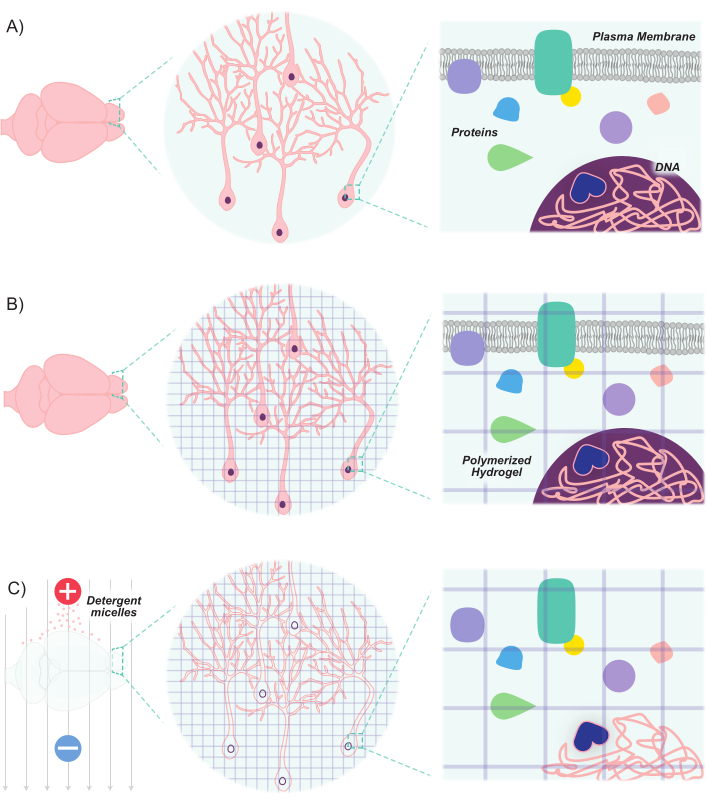
图1:CLARITY方案使组织透明,同时保持固有的结构和分子 - 分子空间关系。 (B)水凝胶单体(紫色线)被注入组织并聚合成水凝胶网格。组织和水凝胶网通过甲醛固定交联。(C)然后将组织用离子洗涤剂溶液洗涤,同时暴露于电场。在此过程中,洗涤剂胶束从组织中去除脂质分子,留下透明水凝胶和生物分子的交联网络。请点击此处查看此图的放大版本。
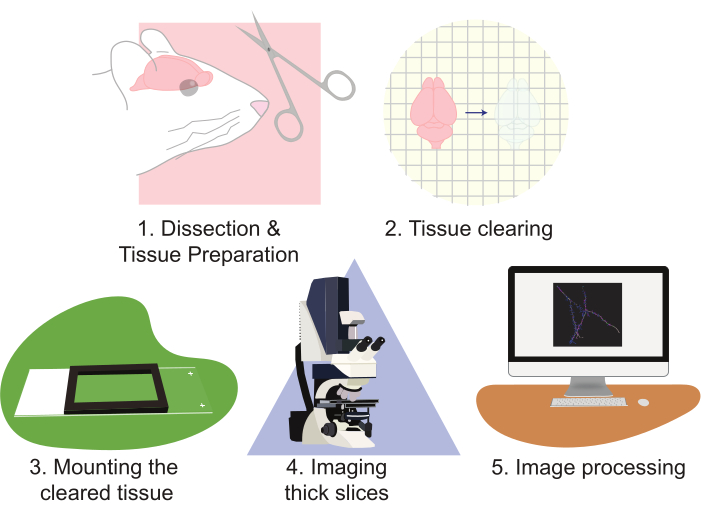
图2:实验方案的流程图,组织制备、清除、安装、成像和图像处理的图表。请单击此处查看此图的大图。

图3:为清除的组织样品构建安装室(A)在浸入折射率匹配溶液之前在PBS中清除整个大脑。(B) 折射率匹配溶液中的脑切片。(C)成像室,用于大大小小的清除组织样品。腔室可以使用各种材料制成,包括但不限于3D打印塑料和切割锥形管。(D) 成像室用于全脑或半球成像,在倒入琼脂糖之前使用50 mL锥形管作为浮雕。(E) 全脑或半球成像室与琼脂糖完全设置;这种设置最适合大型枪管浸入式物镜。请点击此处查看此图的放大版本。

图4:从清除的组织样本中获取高质量的大型数据集。 (A) 用于全细胞高分辨率成像的图像采集设置。针孔完全关闭,以实现精细的光学部分。扫描速度根据最佳像素停留时间根据经验确定。(B) 光路设置:这些将取决于所使用的荧光团和设备。(C) Z 堆栈设置;使用精细的z步长在z方向上捕获尽可能多的信息。(D) 代表性最大投影;比例尺代表25μm, 请点击此处查看此图的放大版本。
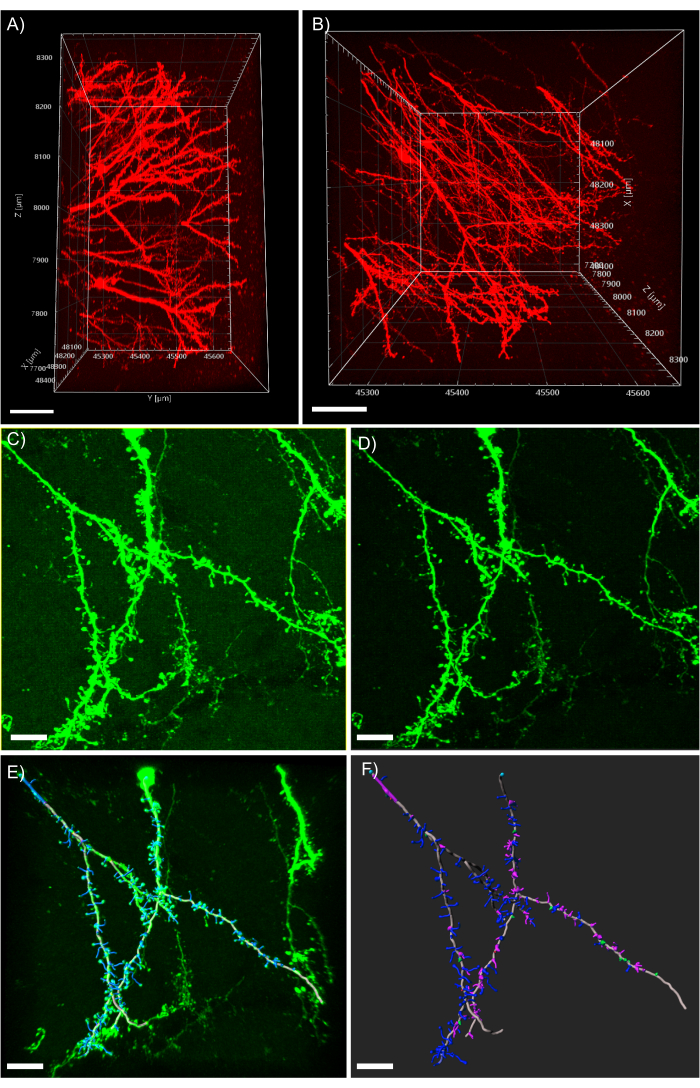
图5:分析软件中树突的3D分析(A)双光子的侧视图,从1毫米厚的表达tdTomato的组织中获取600μmz-stack;比例尺代表100μm.(B)在面板A中获取的相同z-stack的俯视图;比例尺代表100μm(C)表达EGFP的组织共聚焦获取的图像。图像文件可以直接导入分析软件并进行预处理,以获得更高的图像质量;(D)阈值减法用于去除C.(E)灯丝追踪和脊柱识别中存在的一致背景信号:此过程在半自动执行并检查自动深度功能时最好。然后在完全树突重建后手工标记刺;比例尺表示 25 μm. (F) 使用内置 MATLAB 扩展的脊柱分类。棘已根据其形态进行了颜色编码;粗刺是红色的;蘑菇刺是绿色的;长而细的刺是蓝色的;丝状体是紫色的;比例尺代表25μm,请点击此处查看此图的放大版本。
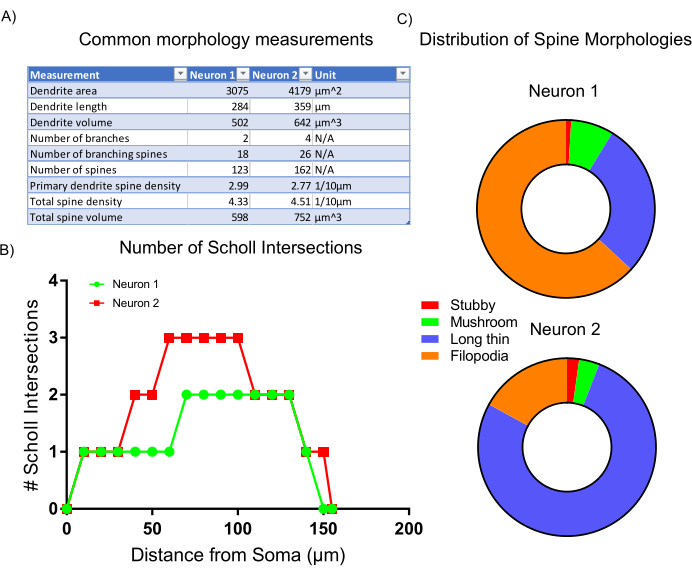
图6:代表性结果(A)由所选分析程序自动生成的常见形态测量表。(B) 程序统计生成的 Sholl 交叉点数。(C) 代表树突状脊柱形态分布的饼图。请点击此处查看此图的放大版本。
| 溶液 | 组成 | 笔记 |
| 折射率匹配解决方案 | 80克组织 | 使用钠时 pH 值可达 7.5 |
| 60 mL 0.02 M 磷酸盐缓冲液 | 储存于 4 °C | |
| 叠氮化钠的0.01% | 改编自马克思,V.自然方法第11卷,第1209-1214页(2014年) | |
| 水 凝 胶 | 13.33 mL 30% 丙烯酰胺(无双) | 在冰上混合在一起,否则溶液可能开始聚合 |
| 10 毫升 10 倍 PBS | 等分试样并储存在-20°C | |
| 250毫克VA-044 | ||
| 76.66 毫升滴定H2O |
表1:屈光图像匹配溶液和水凝胶溶液的配方。 列出了折射率匹配溶液和水凝胶的组成。
讨论
在当代组织清除技术出现之前,研究神经元形态学包括时间密集型切片,成像和相邻非常薄切片的重建。将电泳组织清除与共聚焦成像结合使用,可提供完整神经元形态的无障碍视图。从完整的树突树到最小的突触,成像和量化神经元形态从未如此可行。
清除脑组织的准备非常简单,只需要一件专用设备。使用该协议清除和成像组织颠覆了繁琐的薄切片,处理和安装的需求,大大减少了从实验到图像采集的时间。此外,在没有切片的情况下成像的组织仍然更忠实于原始结构,因为没有损坏源或必要的事后图像重建。最后,该协议允许同时成像大尺度特征(如树突树)以及小尺度亚微米特征(如棘)来节省时间。
该协议中的一个重要步骤集合是清除过程之后的洗涤步骤。这些步骤对于去除SDS电泳清除缓冲液的所有痕迹至关重要。如果清除的组织未充分洗涤,则在安装步骤中会形成沉淀物。这些沉淀物有时可以通过在37-55°C下孵育组织短时间来重新溶解。但是,如果沉淀物持续存在,它们将散射光线,从而产生较差的成像深度和质量。
与传统的薄片成像相比,安装大块组织是一项挑战。在这里,我们介绍了安装大组织的多种过程,这取决于成像技术,物镜特性和组织样品的大小。首先,重要的是使用适合浸入所用特定折射率匹配介质中的物镜,并且具有足够的工作距离以成像大型组织样品。该协议在很大程度上受到所用成像平台的光学特性的限制,特别是物镜的工作距离。使用该协议可以很容易地实现深度成像。但是,如果没有足够的工作距离的物镜可用,则组织本身将为获取大图像提供物理障碍。下一个重要的决定是成像技术。双光子显微镜通常用于其卓越的图像质量,成像深度和采集速度。双光子显微镜可以成像高达1毫米的CLARITY清除组织,而不会损失图像质量,如图5A,B所示。然而,当使用传统的共聚焦显微镜时,可以达到非常相似的结果,尽管与双光子显微镜相比,牺牲了成像深度(图5C,D)。
总之,该方法为在大尺度和小尺度上分析神经元形态提供了一个强大而方便的平台。此外,这种方法在很大程度上最大限度地减少了处理和处理时间,同时还提供了更准确和完整的三维图像。细胞形态学是评估许多疾病和病理背后的回路功能和健康状况的常用代理13,14,15。成像神经元形态学功能强大,简单明了,非常适合在多种疾病模型中进行测定。
披露声明
作者目前没有什么可透露的。
致谢
我们要感谢Jan和Dan Duncan神经学研究所的病毒核心NRDDC生产了这些实验中使用的AAV和慢病毒。此外,我们要感谢贝勒医学院比较医学中心为小鼠饲养和所用小鼠的一般维护。我们要感谢美国心脏协会对奖项编号20PRE35040011的支持,以及BRASS:贝勒学生科学家研究倡导者(PJH)的支持。最后,我们要感谢Logos为我们的实验室提供了Logos X-Clarity电泳组织清除系统。
材料
| Name | Company | Catalog Number | Comments |
| 15 mL Conical Tube | Thermo Scientific | 339650 | |
| 25 G x 1" Needle | BD | 305127 | |
| 30% Acrylamide (No-Bis) | National Diagnostics | EC-810 | |
| 50 mL Conical Tube | Thermo Scientific | 339653 | |
| Electrophoretic Tissue Clearing Solution | Logos | C13001 | |
| Histodenz | Sigma | D2158-100G | |
| Hydrogel Solution Kit | Logos | C1310X | |
| Imaris | Oxford Instruments | N/A | |
| Paraformaldehyde 16% | EMS | 15710 | |
| PBS, 1x, 500 mL, 6 bottles/case | fisher | MT21040CV | |
| VA-044 | Wako | 925-41020 | |
| X-CLARITY Polymerization System | Logos | C20001 | |
| X-CLARITY Tissue Clearing System II | Logos | C30001 |
参考文献
- Abbott, L. F., et al. The Mind of a mouse. Cell. 182 (6), 1372-1376 (2020).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philosophical transactions of the Royal Society of London. Series B, Biological Sciences. 314 (1165), 1 (1986).
- Jiang, X., et al. Principles of connectivity among morphologically defined cell types in adult neocortex. Science. 350 (6264), (2015).
- Winnubst, J., et al. Reconstruction of 1,000 projection neurons reveals new cell types and organization of long-range connectivity in the mouse brain. Cell. 179 (1), 268-281 (2019).
- Araya, R., Vogels, T. P., Yuste, R. Activity-dependent dendritic spine neck changes are correlated with synaptic strength. Proceedings of the National Academy of Sciences of the United States of America. 111 (28), (2014).
- Bosch, M., Hayashi, Y. Structural plasticity of dendritic spines. Current Opinion in Neurobiology. 22 (3), 383-388 (2012).
- Martínez-Cerdeño, V. Dendrite and spine modifications in autism and related neurodevelopmental disorders in patients and animal models. Developmental Neurobiology. 77 (4), 393-404 (2017).
- Arenkiel, B. R., Ehlers, M. D. Molecular genetics and imaging technologies for circuit-based neuroanatomy. Nature. 461 (7266), 900-907 (2009).
- Kim, E. H., Chin, G., Rong, G., Poskanzer, K. E., Clark, H. A. Optical probes for neurobiological sensing and imaging. Accounts of Chemical Research. 51 (5), 1023-1032 (2018).
- Weissman, T. A., Pan, Y. A. Brainbow: New resources and emerging biological applications for multicolor genetic labeling and analysis. Genetics. 199 (2), 293-306 (2014).
- Haggerty, D. L., Grecco, G. G., Reeves, K. C., Atwood, B. Adeno-associated viral vectors in neuroscience research. Molecular Therapy - Methods and Clinical Development. 17, 69-82 (2020).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Kanning, K. C., Kaplan, A., Henderson, C. E. Motor neuron diversity in development and disease. Annual Review of Neuroscience. 33, 409-440 (2010).
- Ledda, F., Paratcha, G. Mechanisms regulating dendritic arbor patterning. Cellular and Molecular Life Sciences. 74 (24), 4511-4537 (2017).
- Falougy, H. E., Filova, B., Ostatnikova, D., Bacova, Z., Bakos, J. Neuronal morphology alterations in autism and possible role of oxytocin. Endocrine Regulations. 53 (1), 46-54 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。