Method Article
CLARITY組織クリアリングによるインタクトニューロンデンドライトのイメージングと定量化
要約
神経樹状形態は、しばしば機能の根底にある。実際、ニューロンの発達に影響を与える多くの疾患プロセスは、形態表現型で現れる。このプロトコルは、無傷の樹状樹状の樹状樹状の樹状樹状の、および関連する脊椎を分析するための簡単で強力な方法を記述します。
要約
脳活動は、ニューロン間で受け渡される電気化学的信号であり、ニューロンネットワークの接続性パターンと、これらのニューロン内のプロセスおよびサブ構造の形態から決定される。したがって、脳機能について知られていることの多くは、ニューロンがどのように組織化され、脳内で接続されているかについてのさらなる洞察を可能にするイメージング技術の発展と一緒に生じています。組織除去の改善により、太い脳スライスの高解像度イメージングが可能になり、樹状樹状の樹状や脊椎などの神経部分構造の形態学的再構築と分析が容易になっています。並行して、画像処理ソフトウェアの進歩により、大規模なイメージングデータセットを迅速に分析できます。この研究は、CLARITY組織クリアリング、共焦点顕微鏡、画像解析を用いて、標識された神経組織の厚いスライスを高解像度で処理、視覚化、分析する比較的迅速な方法を提示する。このプロトコルは、健康な脳を特徴づける接続パターンと神経形態の理解に向けた取り組みを促進し、病気の脳状態で生じるこれらの特性の変化を促進する。
概要
複雑な三次元生物構造の空間的構成、接続性のパターン、形態を理解することは、特定の細胞や組織の機能を解析するために不可欠です。これは、中枢神経系1,2の高解像度神経解剖学的地図を構築することに多大な努力が捧げられてきた神経科学において特に当てはまります。これらのマップを構成するニューロンを綿密に調べると、これらの多様なニューロンのセット3,4の機能を反映した接続と位置を持つ多様な形態が生じます。また、細胞下の構造、特に樹状脊椎の調査は、シナプスの成熟度を知らせることができ、それにより発達過程および神経疾患状態5、6、7を反映することができる。したがって、イメージングの分解能とスループットを向上させるアプローチは、すべてのスケールで脳機能をよりよく理解するために不可欠です。
最近の進歩は、ニューロンの集団をマーキングし、操作するための分子および遺伝的ツールキットを拡大しています。新しい蛍光マーカーの開発は、ニューロンにこれらのマーカーを導入する新しい方法と組み合わせることで、同じ動物または脳サンプル8、9、10、11内の相互作用ニューロンの集団の微分標識を可能にする。光は不透明な脂質によって散乱され、脳組織の脂質含有量が高いため、ニューロン集団のイメージングは主に細い切片に限定されているか、または高度なマイクロスクロピー技術(例えば、共焦点、多光子、光シート顕微鏡)に依存して画像深部構造に依存している。しかし、これらの取り組みは、組織クリア技術の進歩によって大幅に強化されています。透明脂質交換アクリルアミドハイブリダイドハイブリジッドイメージング/免疫染色/その場でハイブリダイゼーション適合組織-hYdrogel(CLARITY)は、対象となる組織にヒドロゲルモノマー(アクリルアミドおよびビスアクリルアミド)を注入し、次いで洗剤12で洗浄する技術の1つである。ヒドロゲルモノマーはハイブリダイズして、光学的に透明で高分子ラベルに透過性のある安定した3Dヒドロゲル足場を作り出します。核酸およびタンパク質は、ハイブリダイズマトリックス内で維持され、一方、脂質は洗浄剤洗浄によって除去される(図1)。これにより、細胞や非脂質分子の元の形状と配向を維持するのに十分な剛性の安定した組織が生じ、光学的に透明化され、高解像度で深部構造を容易に画像化できます。このように組織構造と配向を維持することで、厚いスライスのイメージングが可能になり、細胞間の接続と空間的関係が維持されます。また、クリアリングプロセス中にタンパク質や核酸の位置や入手可能性が維持されるため、クリアされた組織は、外因性標識だけでなく、発現ベースのマーカーを保持することができます。したがって、CLARITYは、大量の深部脳構造とこれらの構造間の接続を高解像度でイメージングするための強力な方法として自分自身を貸します。
CLARITYの使用は、ニューロン集団をイメージングするアプローチを大幅に改善します。この技術は、特に大量のイメージングデータを生成する上で熟達しています。CLARITYは、タンパク質ベースの蛍光の複数の形態でうまく機能します。このプロトコルはレンチウイルスベースのアプローチを利用して、細胞にEGFPとtdTomatoをスパースにラベル付けします。しかし、再構成のために細胞を標識するtdTomatoまたはEGFPを発現するトランスジェニックレポーターアレスが日常的に使用されてきた。光安定性と明るい(例えば、EGFPやtdTomato)の両方である蛍光色素を選択することが重要です。さらに、強力なプロモーターを使用して蛍光素を発現させることで、優れたコントラストと画質が得られます。この手法の欠点は、この大量のデータを適切に分析すると、労力と時間の両方が必要になる可能性がある場合に生じます。特殊な顕微鏡は、スループットの向上と作業負荷の軽減に役立ちます。しかし、高度な顕微鏡の構築、所有、運用は、多くの研究室にとってコストが高い場合が多い。この研究は、標準的な共焦点顕微鏡と組み合わせた大きなセクションのCLARITY組織クリアリングを使用して、高解像度で大量の神経組織を視覚化する高スループット、比較的迅速かつ簡単な方法を提示する。このプロトコルは、このアプローチを次の手順を通して説明します:1)神経組織を解剖して準備する、2)組織を取り除く、組織を取り付ける、4)準備されたスライスをイメージングする、および5)顕微鏡観察可視化ソフトウェアの再構築と分析を使用して完全なスライス画像を処理する(図2)。これらの取り組みは、ニューロンの集団、ニューロン接続パターン、3D樹状形態、樹状脊椎の豊富さと形態、および無傷の脳組織内の分子発現パターンを分析するために使用できる高解像度画像をもたらす。
プロトコル
以下のプロトコルは、ベイラー医科大学のすべての動物ケアガイドラインに従います。
1. 解剖と組織の準備
- イオブルランに浸したタオル(または他のIUCAC承認手段)で閉じた容器にマウスを入れることで、イオブルランの過剰摂取でマウスを安楽死させます。
- 10 mLの氷冷PBSを用いて25G針を使用して動物を透過して、続いて4%PFAの10mLを使用する。
- 目的の脳領域(または組織)を解剖する。
- 解剖した組織を4°Cで一晩4%PFAに入れる。 このプロトコルでは、適切な固定が重要です。この手順をスキップしたり短縮したりしないでください。
- 少なくとも12時間4%PFAに固定した後、4°Cで24時間4%アクリルアミドヒドロゲル混合物に組織を移す。
注:ヒドロゲルを解凍する際に、重合していないことを確認してください。これは、ヒドロゲルが過度に暖かくなると起こり得ます。氷上で解凍して、早期重合を防ぎます。
2. 組織のクリアリング
- 脳組織(まだヒドロゲルに沈んだ状態)を37°Cの真空インキュベーターに-90 kPa真空で入れる。真空が正しく形成されるようにチューブトップを緩めておいてください。
- PBSで室温(25°C)で10分間、穏やかな揺れで洗浄します。
- 重合した組織試料を電気泳動室に入れ、チャンバ内の組織の向きをメモしておく。
- チャンバとリザーバに、供給された電気泳動SDSバッファーを充填します。
- サンプルを70 V、1 A、35 Cで、約2時間/mmの組織に対して一定の電流で実行します。
- サンプルを定期的にチェックします。それは適切にクリアするためにチャンバーでより多くの時間を必要とするかもしれません。クリアリングの良い出発点は、脳組織の1mmあたり1〜2時間です。マウスの脳全体が十分なクリアのために8-10時間を必要とします。チャンバーから取り外す前にサンプルの向きを覚えておいてください、そして同じ方向の部屋に戻ってそれを取り替えてください。
注: 図 3A は 、完全にクリアされた脳の外観を示しています。脳は、溶解したSDSの存在のために、この段階では不透明で明確に見えないが、脂質抽出後に色付きの黄色の組織はほとんどないはずです。
- サンプルを定期的にチェックします。それは適切にクリアするためにチャンバーでより多くの時間を必要とするかもしれません。クリアリングの良い出発点は、脳組織の1mmあたり1〜2時間です。マウスの脳全体が十分なクリアのために8-10時間を必要とします。チャンバーから取り外す前にサンプルの向きを覚えておいてください、そして同じ方向の部屋に戻ってそれを取り替えてください。
3. クリアした組織を準備し、取り付ける
- 試料がクリア化を終え、十分に透明に見えた後、室温で一晩PBSで洗浄します。できるだけ頻繁に新しいPBSでPBSを交換してください。このステップは、後のステップで沈殿を形成する残留SDSを除去するために重要です。
- PBSでの最終洗浄に続き、室温で5分間脱イオン水で洗浄します。このステップでは組織が不透明になり、膨張する可能性があります。
- 屈折率整合溶液中の組織をインキュベートし( 表1参照)室温で少なくとも4時間培養する。 図3B は、屈折率整合溶液中のインキュベーション後にクリアされた組織の一部を示す。
- 屈折率整合溶液中の組織のインキュベーション中に、必要に応じてサンプルを画像化するのに適したハウジングチャンバーを構築する。
- 小さな組織サンプル/スライス用のイメージングチャンバーの構築
- 取り付けのベースとしてガラススライドを使用して、ゴムまたはプラスチックのスペーサーのいずれかを置き、スーパー接着剤で固定します。あらかじめ作成されたスペーサーが使用できない場合は、円錐形のチューブ断面から作られたプラスチックリングを使用してください。
- 穴を開けずにガラススライドにこれらの部分を固定することを確認します(図3C)。
- クリアした組織を、屈折率整合溶液であらかじめ充填された取り付けチャンバーに入れます。
- ガラスカバースリップを上に置き、マニキュアで密封して、ティッシュをしっかりと取り付けます。
- ガラスの上に直接屈折率一致付け取り付け溶液の滴を加えることによって、この組織を画像化します。
- 大きいティッシュのイメージ投射の部屋
- 組織が5mm厚(脳全体または半球に適している)より大きい場合は、このチャンバーを構築します。
- 壁が高い10cmガラス皿を使用して、50mLの円錐形チューブを中央に置き、円錐の直径が使用する対物レンズのバレルを受け入れるのに十分な大きさであることを確認します。
- 3%アガロースを水中に作り、ガラス皿と円錐管の間の空間に注ぎ、1時間冷却することを許可する(図3D)。これは固体アガロースの環を形成します (図 3E).
- スーパー接着剤を使用してチャンバーの底部に組織をしっかりと接着し、屈折率マッチング溶液でチャンバーを充填します。接着剤を塗布して、対象領域を損傷することなく、皿から組織の埋め立てを可能にするために画像化されない領域に組織を接着します。
注:この調製は、空気から保存され、4°Cで保存されない限り、屈折率媒体が重合し始める可能性があるため、時間に敏感です。
4. 画像化はティッシュのサンプルを取り除いた
- 4 mmの作動距離を持つ25x/0.95 NAの目的と合う共焦点顕微鏡を使用して画像を取得します。
- 関連するすべての画像機器をオンにします。サンプルをステージ上に置き、屈折率マッチング溶液を取り付けチャンバーの上部に置きます。
- 慎重に目的と浸漬メディアにアプローチし、メディアの連続カラムを形成します。
- 蛍光を用いて、適切な画像分野を見つける。
- 適切な設定をテストして、画像取得手順を開始します。
- まず、 図 4A をガイドとして使用して、解像度とスキャン速度の設定を行います。共焦点顕微鏡を使用してイメージングする場合は、ピンホールを完全に閉じて最小の光学断面を得るため、Z解像度が最適です。
- 信号対雑音比が高い適切な画像が得られるまで、レーザーパワー/センサーゲインを徐々に増加させます。
- 標準EGFP/tdTomato 2色イメージングを利用する場合は、 図4B を参考にして、ライトコレクション設定を行います。
- 組織の観測開始点と終点に基づいて Z スタック パラメータを設定します。 図4C をガイドとして使用して、目的のZ解像度に基づいてステップサイズを設定します。
注:ステップサイズを小さくすると、Z解像度が大きくなりますが、レーザードウェル時間も増え、サンプルの漂白につながる可能性があります。 - 画像取得設定に満足した場合は、画像を取得します。
- 画像の信号対雑音比が高く、構造の境界が異なっていることを確認します(図4D)。
5. 顕微鏡解析ソフトウェアを用いた画像処理と3D定量
注: 顕微鏡画像解析ソフトウェア パッケージは、3 次元画像の視覚化と処理に強力なツールです。これらのプログラムの多くは、クリアされた組織サンプルのイメージングから生成される大規模なデータセットの処理に最適です。次の手順と関連する図は、Imaris ソフトウェア ワークフローに対応しています。
- イメージ スタックを開き、選択した解析ソフトウェアにインポートします。
- 画像を 3 次元空間で表示し、表示アジャスターを使用してルックアップ テーブルに必要な変更を加えて、画像をより適切に視覚化します。
注: 図5A は、CLARITY組織クリアリングと組み合わせた2光子顕微鏡でアクセス可能な極端なイメージング深さを示しています。 図 5B は、図 5Aに示す z スタックからの明確な脊椎形態と同様に、別個の樹状突起プロセスを示しています。 - 一貫した背景を除外するには、[ 画像処理 ]ボタンをクリックし、バックグラウンド減算フィルタを選択します。
注: 図 5C は、処理前に一貫したかすんだバックグラウンド信号を持つ画像を示しています。 図5D は、背景減算フィルタが適用された後の画像を示しています。 - 3D 画像を観察し、複数の角度とズーム レベルから見ることで、その画像に慣れ親しみます。
- フィ ラメント トレーサーツールを選択して、樹状突起トレースを開始します。
- フィ ラメントを手動で編集するをクリックし、自動作成をスキップします。
- モードを自動パスに設定し、[ 自動中心 ]および[ 自動直径]補正を オンにします。
- シフト + セル本体を右クリックして、開始点を設定します。
- 樹状突起の全長に沿ってニューロンをトレースします。デンドライトの終点を左クリックして終了点を設定し、ソフトウェアが開始点と終了点の間のパスを自動的に計算できるようにします。
- すべての樹状突起に対してこの手順を繰り返し、セル構造を完全にトレースします。
- トレースされたセルを視覚化し、その精度を確認します。必要に応じて手動で調整します。
- [ 作成 ] タブを選択します。
- [ デンドライト直径を再計算]オプションを 選択します。
- より正確に追跡された樹状突起を実行するには、ウィザードに従って完了します。
- [ 描画 ] タブを選択します。
- 脊椎の描画を開始するには、[ 脊椎 ]ラジオボタンをクリックします。
- 必要に応じて脊椎の直径を設定し、測定ツールを使用して脊椎の直径を正確に表現します。
- 脊椎の頭の中心をクリックして、新しい脊椎を追加します。
- 樹状突起上のすべての脊椎に対してこれを繰り返します。
注: 手動で脊椎を追加する場合は、あらゆる角度から樹状突起を観察することが重要です。 - 新しく追加された脊椎の正確性を確認し、必要に応じて変更を加えます。
- [ 作成 ] タブを選択します。
- [ 脊椎の直径を再計算 ]オプションを選択すると、下流のデータ解析に不可欠な適切な頭と首の直径をソフトウェアで決定できます。
- 完了するには、脊椎の直径の作成ウィザードに従います。
- 計算結果を観察し、必要に応じて手動で調整します。 図5E は、脊椎を備えた完全に追跡されたニューロンを示す。
- 脊椎の分類されたリストを作成するには、[ ツール] タブを選択します。
注: これを動作させるには、MATLAB 拡張機能をインストールする必要があります。- MATLAB 拡張機能をインストールするには、環境設定ウィンドウを開きます。
- [ カスタム ツール] オプションを選択します。
- 適切な MATLAB ランタイム MCR を追加します。
- [ 脊椎の分類] をクリックします。
- 脊椎分類に必要なパラメータを編集します。
- MATLAB 拡張の [脊椎を分類 ]をクリックします。 図5F は、色分けされた分類された脊椎でオーバーレイされた樹状突起を示す。
- [統計] タブ を 選択します。
- このタブの左下隅にある [構成 ] ボタンをクリックして、データを定量化する必要な統計情報を構成します。
- 統計表現の方法を選択したら、このウィンドウの右下にある [タブ表示時に統計をファイルにエクスポート ]ボタンを使用してデータをエクスポートします。
- 推奨のグラフ作成方法を使用して統計をグラフ化します。
結果
画像取得後、代表的な細胞形態を、組み込み統計を用いて解析し、解析ソフトウェア内でスクリプトを分類した。収集されたデータ(図6A)は、ニューロン2がより大きな樹状構造を有し、より高密度の脊椎を有することを反映している。全体として、データはニューロン2がニューロン1と比較してより複雑な樹状構造を有することを示唆している。この結果を立証するために、標準的なSholl分析が行われ、これは、ニューロン2が、ソーマから50〜100μmでのショル交点の増加によって示されるようにニューロン1よりも樹状に複雑であることを肯定する(図6B)。最後に、2つの画像ニューロンの樹状脊椎は、その全体的な形状と大きさに基づいて4つの主要なカテゴリに分類されました。より多くのフィロポディアのような形を示す棘は、より未熟な脊柱サブタイプである可能性が高い。キノコの棘と呼ばれる定義された頭部を持つ棘は、おそらくより発達し、成熟したシナプス7を含む。ここで示した分析は、ニューロン1がニューロン2(図6C)と比較してフィロポディアのような棘のより大きな割合を含むということを示している。したがって、形態に基づいて、ニューロン2は、より大きく、より高度に分岐し、成熟した脊椎のより高い密度を含むほど、より発達的に成熟する。
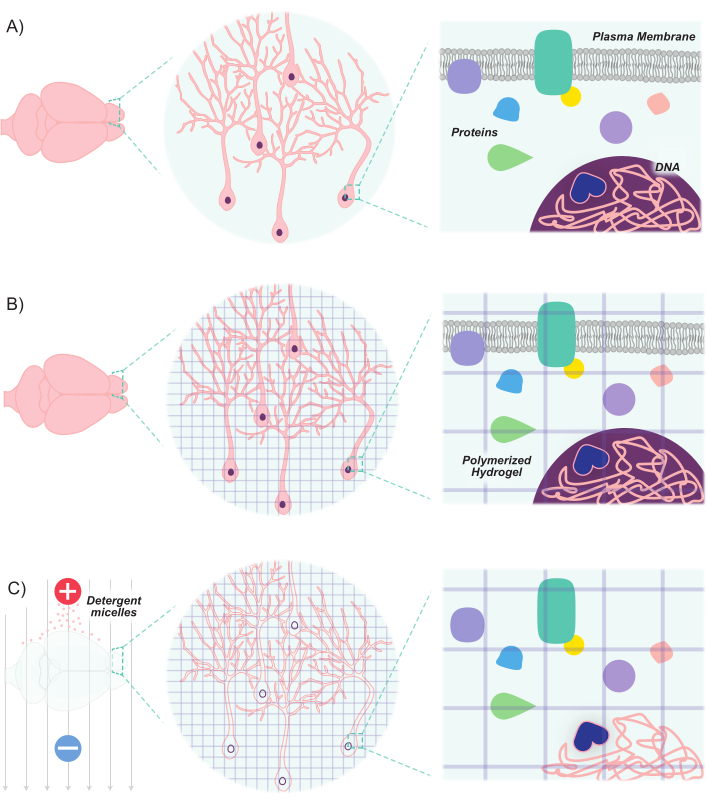
図1:CLARITYプロトコルは、固有の構造と分子分子との空間的関係を維持しながら組織を透明にする。(B)ヒドロゲルモノマー(紫色の線)を組織に注入し、ヒドロゲルメッシュに重合する。組織およびヒドロゲルメッシュはホルムアルデヒド固定によって架橋される。(C)電界に曝露しながら、組織をイオン洗剤溶液で洗浄する。このプロセスの間、洗剤ミセルは、透明なヒドロゲルおよび生体分子の架橋ネットワークを残して、組織から脂質分子を除去する。この図の大きなバージョンを表示するには、ここをクリックしてください。
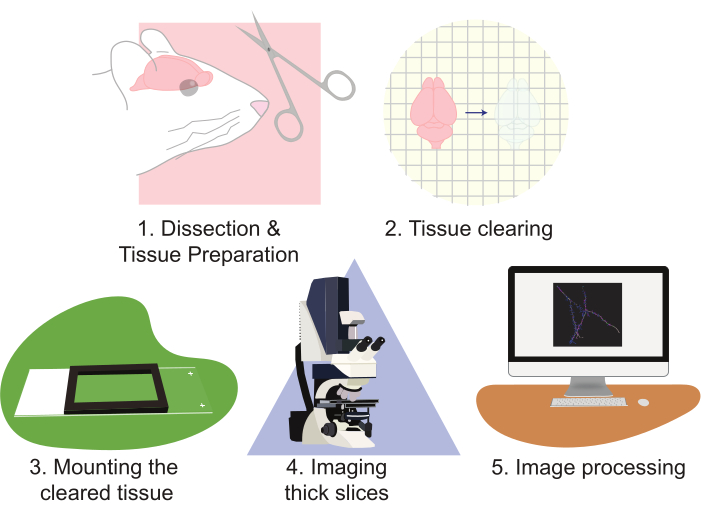
図2: プロトコルのフローチャート、組織の準備、クリア、取り付け、イメージング、画像処理を図示 しています。

図3:クリアされた組織サンプルの取り付けチャンバーを構築 する(A)屈折率マッチング溶液に浸漬する前にPBSで全脳をクリアした。(B) 屈折率マッチングソリューションにおける脳スライス(C)大小のクリアされた組織サンプルのためのイメージ投射室。チャンバーは、3Dプリントプラスチックやカット円錐形チューブを含むが、これらに限定されない様々な材料を使用して作ることができます。(D) 脳全体または半球イメージング用のイメージングチャンバーで、アガロースを流す前に50 mL円錐管をリリーフとして使用する。(E)アガロース完全に設定された全脳または半球イメージングチャンバー。この設定は大きいバレルの浸漬の目的のために最適である。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図4:クリアされた組織サンプルから高品質の大規模データセットを取得する。(A) 全セル高解像度イメージングに使用される画像取得設定。ピンホールは、微細な光学断面を可能にするために完全に閉じられました。スキャン速度は、最適なピクセルのドウェル時間に基づいて経験的に決定した。(B)ライトパス設定:これらは、使用される蛍光素と機器に依存します。(C) Z スタック設定できるだけ多くの情報を z 方向にキャプチャするために、細かい z ステップが使用されました。(D) 代表最大投影法スケールバーは25 μmを表します。
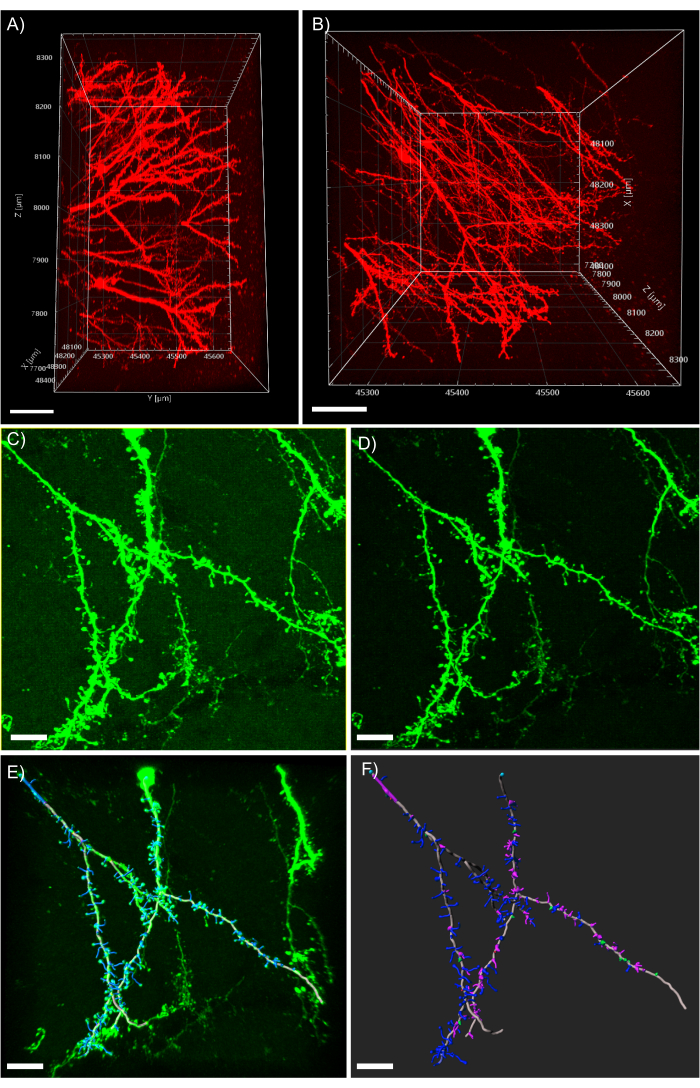
図5:分析ソフトウェア中のデンドライトの3D解析. (A) tdTomatoを発現する1mm厚組織から取得した600μm zスタックを取得した2光子のサイドビュー;スケールバーは、パネルAで取得した同じzスタックの100μm(B)トップビューを表します。スケールバーは、EGFPを発現する組織の100μm(C)共焦点獲得画像を表す。画像ファイルは、解析ソフトウェアに直接インポートし、より高い画質を得るための事前処理が可能です。スケールバーは25 μmを表します(D) しきい値減算は、C. (E) フィラメントトレースと脊椎識別に存在する一貫したバックグラウンド信号を除去するために使用されます: このプロセスは、オート深度機能をチェックして半自動で実行する場合に最適です。その後、脊椎は完全な樹状突起再建後に手でラベル付けされました。スケールバーは、組み込みのMATLAB拡張を使用した25μm(F)スパイン分類を表します。棘は、その形態に基づいて色分けされています。頑固な棘は赤です。キノコの棘は緑色です。長い細い棘は青い。フィロポディアは紫色です。スケールバーは25 μmを表します。
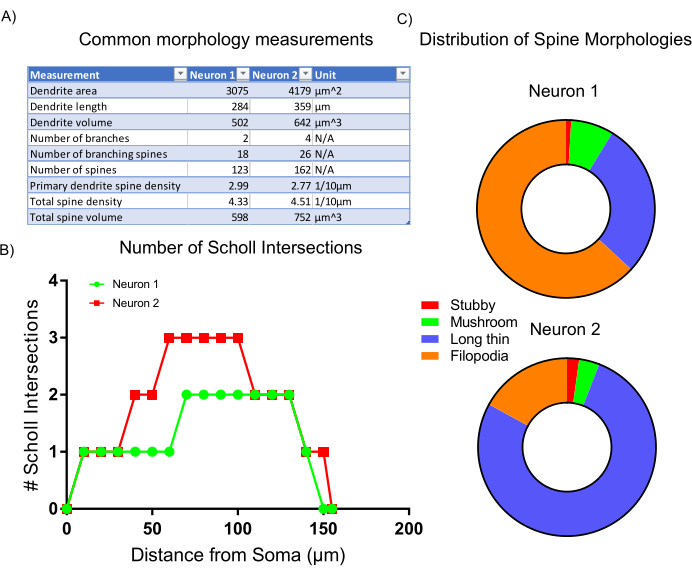
図6: 代表的な結果( A)選択した解析プログラムによって自動的に生成される一般的な形態学的測定の表。(B) プログラム統計によって生成される Sholl 交点の数。(C) 樹状脊椎形態の分布を表す円グラフ。 この図の大きなバージョンを表示するには、ここをクリックしてください。
| 解決 | 組成 | 筆記 |
| 屈折率マッチングソリューション | ヒストデンツ80g | NaOH で 7.5 に pH |
| 0.02 Mリン酸緩衝液の60 mL | 4 °Cで保管 | |
| アジ化ナトリウムの0.01% | マルクス、V.ネイチャーメソッド第11巻、1209-1214ページ(2014) | |
| ハイドロゲル | 13.33 mL 30% アクリルアミド (ノービス) | 氷の上で一緒に混ぜ合わせると、そうでなければ溶液が重合し始める可能性がある |
| 10x PBS 10 mL | アリコートと-20 °Cで保管 | |
| VA-044の250mg | ||
| 76.66 mL の ddH2O |
表1:屈折画像マッチング溶液とヒドロゲル溶液のレシピ。 屈折率整合溶液とヒドロゲルの組成が挙げられている。
ディスカッション
現代の組織クリアリング技術の出現前に、神経形態学の研究は、隣接する非常に薄いセクションの時間のかかる断面化、イメージング、および再構築で構成されていました。共焦点画像と組み合わせて電気泳動組織クリアリングを使用すると、完全な神経形態の妨げられないビューを提供します。無傷の樹状樹木から、最小のシナプス・ブトンまで、神経細胞形態のイメージングと定量化はかつてないほど実現可能であった。
クリアされた脳組織の準備は簡単で、専用の機器を1つだけ必要とします。このプロトコルを使用してクリアされ、画像化された組織は、退屈な薄い切り離し、取り扱い、および取り付けの必要性を覆し、実験から画像取得までの時間を大幅に短縮します。さらに、切断せずに画像化された組織は、損傷源や必要なポストホック画像再構成の原因がないため、元の構造に忠実なままです。最後に、このプロトコルは、樹状樹木などの大規模な特徴を、脊椎などの小規模なサブミクロン機能と同時にイメージングできるようにすることで、時間を節約します。
このプロトコルの手順の重要なコレクションの 1 つは、クリアリング プロセスに従う洗浄手順です。これらのステップはSDS電気泳動のクリアリングの緩衝の全ての跡を取除く場合に重要である。クリアされた組織が十分に洗浄されない場合、沈殿物は、取り付け工程中に形成される。これらの沈殿物は、37-55°Cで短時間組織をインキュベートすることによって再溶解することがあります。しかし、沈殿物が持続すると、光が散乱し、イメージングの深さと品質が悪くなります。
大きな組織を取り付けることは、従来の薄いスライスイメージングと比較して課題を提示します。ここでは、イメージング技術、対物レンズの特性、および組織サンプルのサイズに依存する大きな組織を取り付ける複数のプロセスを提示します。まず、使用する特定の屈折率マッチング媒体に浸漬するのに適した対物レンズを用いることが重要であり、大きな組織サンプルを撮像するのに十分な作業距離を有する。このプロトコルは、使用されるイメージングプラットフォームの光学特性、特に目標の作動距離によって大きく制限される。深さでのイメージングは、このプロトコルを使用して容易に達成される。しかし、十分な作業距離を持つ目的が利用できない場合、組織自体は大きな画像を取得するための物理的な障壁を提示する。次に重要な決定は、イメージング技術です。二光子顕微鏡は、一般的にその優れた画質、イメージングの深さ、および取得速度のために使用されます。2光子顕微鏡は、図5A、Bに示すように、画像品質を損なうことなく、最大1mmのCLARITYクリア組織へのイメージングを可能にする。しかし、従来の共焦点顕微鏡を使用する場合でも、2光子顕微鏡と比較してイメージング深度に犠牲を払う場合に非常によく似た結果を得ることができます(図5C、D)。
要約すると、この方法は、大小の両方のスケールで神経形態を分析するための堅牢で便利なプラットフォームを提供します。さらに、この方法は、処理時間と処理時間を大幅に短縮すると同時に、より正確で完全な 3 次元画像を提供します。細胞形態は、回路機能と健康を評価するために一般的に使用されるプロキシであり、多くの疾患および病理の基礎13、14、15。ニューロンの形態をイメージングすることは、強力で、簡単で、多数の疾患モデルにおけるアッセイに適しています。
開示事項
著者らは現時点で開示するものは何もない。
謝辞
これらの実験で使用されるAAVとレンチウイルスを生産するためのヤンとダンダンカン神経研究所のウイルスコアNRDDCに感謝したいと思います。また、ベイラー医科大学の比較医学センターに対して、マウスの畜産と使用されたマウスの一般的なメンテナンスに感謝したいと思います。私たちは、賞番号20PRE35040011の下で彼らのサポートのためにアメリカ心臓協会に感謝したいと思います, そしてBRASS: 彼らのサポートのための学生科学者のためのベイラー研究提唱者 (PJH).最後に、私たちは、Logos X-Clarity電気泳動組織クリアリングシステムをラボに提供してくれたロゴスに感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| 15 mL Conical Tube | Thermo Scientific | 339650 | |
| 25 G x 1" Needle | BD | 305127 | |
| 30% Acrylamide (No-Bis) | National Diagnostics | EC-810 | |
| 50 mL Conical Tube | Thermo Scientific | 339653 | |
| Electrophoretic Tissue Clearing Solution | Logos | C13001 | |
| Histodenz | Sigma | D2158-100G | |
| Hydrogel Solution Kit | Logos | C1310X | |
| Imaris | Oxford Instruments | N/A | |
| Paraformaldehyde 16% | EMS | 15710 | |
| PBS, 1x, 500 mL, 6 bottles/case | fisher | MT21040CV | |
| VA-044 | Wako | 925-41020 | |
| X-CLARITY Polymerization System | Logos | C20001 | |
| X-CLARITY Tissue Clearing System II | Logos | C30001 |
参考文献
- Abbott, L. F., et al. The Mind of a mouse. Cell. 182 (6), 1372-1376 (2020).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philosophical transactions of the Royal Society of London. Series B, Biological Sciences. 314 (1165), 1 (1986).
- Jiang, X., et al. Principles of connectivity among morphologically defined cell types in adult neocortex. Science. 350 (6264), (2015).
- Winnubst, J., et al. Reconstruction of 1,000 projection neurons reveals new cell types and organization of long-range connectivity in the mouse brain. Cell. 179 (1), 268-281 (2019).
- Araya, R., Vogels, T. P., Yuste, R. Activity-dependent dendritic spine neck changes are correlated with synaptic strength. Proceedings of the National Academy of Sciences of the United States of America. 111 (28), (2014).
- Bosch, M., Hayashi, Y. Structural plasticity of dendritic spines. Current Opinion in Neurobiology. 22 (3), 383-388 (2012).
- Martínez-Cerdeño, V. Dendrite and spine modifications in autism and related neurodevelopmental disorders in patients and animal models. Developmental Neurobiology. 77 (4), 393-404 (2017).
- Arenkiel, B. R., Ehlers, M. D. Molecular genetics and imaging technologies for circuit-based neuroanatomy. Nature. 461 (7266), 900-907 (2009).
- Kim, E. H., Chin, G., Rong, G., Poskanzer, K. E., Clark, H. A. Optical probes for neurobiological sensing and imaging. Accounts of Chemical Research. 51 (5), 1023-1032 (2018).
- Weissman, T. A., Pan, Y. A. Brainbow: New resources and emerging biological applications for multicolor genetic labeling and analysis. Genetics. 199 (2), 293-306 (2014).
- Haggerty, D. L., Grecco, G. G., Reeves, K. C., Atwood, B. Adeno-associated viral vectors in neuroscience research. Molecular Therapy - Methods and Clinical Development. 17, 69-82 (2020).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Kanning, K. C., Kaplan, A., Henderson, C. E. Motor neuron diversity in development and disease. Annual Review of Neuroscience. 33, 409-440 (2010).
- Ledda, F., Paratcha, G. Mechanisms regulating dendritic arbor patterning. Cellular and Molecular Life Sciences. 74 (24), 4511-4537 (2017).
- Falougy, H. E., Filova, B., Ostatnikova, D., Bacova, Z., Bakos, J. Neuronal morphology alterations in autism and possible role of oxytocin. Endocrine Regulations. 53 (1), 46-54 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved