Method Article
Последовательная блочно-лицевая сканирующая электронная микроскопия (SBF-SEM) образцов биологических тканей
В этой статье
Резюме
Этот протокол описывает рутинный метод использования последовательной блочной сканирующей электронной микроскопии (SBF-SEM), мощного метода 3D-визуализации. Успешное применение SBF-SEM зависит от правильной фиксации и окрашивания тканей, а также тщательного рассмотрения настроек визуализации. Этот протокол содержит практические соображения для всего этого процесса.
Аннотация
Последовательная блочная сканирующая электронная микроскопия (SBF-SEM) позволяет коллекционировать от сотен до тысяч серийно зарегистрированных ультраструктурных изображений, предлагая беспрецедентный трехмерный вид микроанатомии тканей. В то время как sBF-SEM в последние годы наблюдается экспоненциальный рост использования, технические аспекты, такие как надлежащая подготовка тканей и параметры визуализации, имеют первостепенное значение для успеха этого метода визуализации. Эта система визуализации выигрывает от автоматизированного характера устройства, позволяя оставлять микроскоп без присмотра во время процесса визуализации, с автоматизированным сбором сотен изображений, возможных за один день. Однако без соответствующей тканевой подготовки клеточная ультраструктура может быть изменена таким образом, что могут быть сделаны неправильные или вводящие в заблуждение выводы. Кроме того, изображения генерируются путем сканирования лицевой стороны блока биологического образца, встроенного в смолу, и это часто создает проблемы и соображения, которые необходимо решить. Накопление электронов внутри блока во время визуализации, известное как «заряд ткани», может привести к потере контраста и неспособности оценить клеточную структуру. Более того, в то время как увеличение интенсивности / напряжения электронного пучка или снижение скорости сканирования пучка может увеличить разрешение изображения, это также может иметь неприятный побочный эффект повреждения смоляного блока и искажения последующих изображений в серии изображений. Здесь мы представляем рутинный протокол подготовки образцов биологических тканей, который сохраняет клеточную ультраструктуру и уменьшает заряд тканей. Мы также предоставляем визуальные соображения для быстрого получения высококачественных серийных изображений с минимальным повреждением тканевого блока.
Введение
Последовательная блочная сканирующая электронная микроскопия (SBF-SEM) была впервые описана Лейтоном в 1981 году, где он создал сканирующий электронный микроскоп, дополненный встроенным микротомом, который мог разрезать и визуализировать тонкие участки ткани, встроенные в смолу. К сожалению, технические ограничения ограничили его использование проводящими образцами, поскольку непроводящие образцы, такие как биологическая ткань, накапливали неприемлемые уровни зарядки (накопление электронов в образцеткани) 1. В то время как покрытие грани блока между разрезами испаривающимся углеродным снижением тканевой зарядки, это значительно увеличило время получения изображений и хранения изображений оставалось проблемой, поскольку компьютерные технологии в то время были недостаточны для управления большими размерами файлов, созданных устройством. Эта методология была пересмотрена Denk и Horstmann в 2004 году с использованием SBF-SEM, оснащенного камерой переменного давления2. Это позволило ввести водяной пар в камеру визуализации, что уменьшает заряд внутри образца, делая визуализацию непроводниковых образцов жизнеспособной, хотя и с потерей разрешения изображения. Дальнейшие усовершенствования в методах подготовки тканей и визуализации теперь позволяют проводить визуализацию с использованием высокого вакуума, а визуализация SBF-SEM больше не полагается на водяной пар для рассеивания заряда3,4,5,6,7,8,9. В то время как sBF-SEM в последние годы наблюдается экспоненциальный рост использования, технические аспекты, такие как надлежащая подготовка тканей и параметры визуализации, имеют первостепенное значение для успеха этого метода визуализации.
SBF-SEM позволяет автоматически получать тысячи серийно зарегистрированных изображений электронной микроскопии с планарным разрешением до 3-5 нм10,11. Ткань, пропитанная тяжелыми металлами и встроенная в смолу, помещается в сканирующий электронный микроскоп (SEM), содержащий ультрамикротом, оснащенный алмазным ножом. Алмазным ножом ограняется плоская поверхность, нож убирается, а поверхность блока сканируется в растровом рисунке электронным пучком для создания изображения ультраструктуры ткани. Затем блок поднимается на определенное количество (например, 100 нм) по оси z, известное как «z-шаг», и новая поверхность разрезается перед повторением процесса. Таким образом, создается 3-мерный (3D) блок изображений по мере разрезания ткани. Эта система визуализации также выигрывает от автоматизированного характера устройства, позволяя оставлять микроскоп без присмотра во время процесса визуализации, с автоматизированным сбором сотен изображений, возможных за один день.
В то время как визуализация SBF-SEM в основном использует обратно рассеянные электроны для формирования изображения лица блока, вторичные электроны генерируются во время процесса визуализации12. Вторичные электроны могут накапливаться вместе с обратно рассеянными и первичными пучковыми электронами, которые не покидают блок, и производить «заряд ткани», что может привести к локализованному электростатическому полю на грани блока. Это накопление электронов может исказить изображение или привести к выбросу электронов из блока и способствовать сигналу, собранного детектором обратного рассеяния, уменьшая отношение сигнал/шум13. В то время как уровень заряда тканей может быть уменьшен за счет снижения напряжения или интенсивности электронного пучка или уменьшения времени пребывания пучка, это приводит к уменьшению отношения сигнал/шум14. Когда используется электронный пучок более низкого напряжения или интенсивности, или пучку разрешено обитать только в пределах каждого пиксельного пространства в течение более короткого периода времени, меньше обратно рассеянных электронов выбрасывается из ткани и захватывается электронным детектором, что приводит к более слабому сигналу. Денк и Хорстманн решли эту проблему, вводя водяной пар в камеру, тем самым уменьшая заряд в камере и на лицевой стороне блока за счет разрешения изображения. При давлении в камере 10-100 Па часть электронного пучка рассеивается, способствуя шуму изображения и потере разрешения, однако это также производит ионы в камере образца, которые нейтрализуют заряд в блоке образца2. Более поздние методы нейтрализации заряда внутри блока образца используют фокальный газовый впрыск азота по лицевой стороне блока во время визуализации или введение отрицательного напряжения на ступень SBF-SEM для уменьшения энергии зонда-пучка-зацепки и увеличения собранного сигналана 6,7,15. Вместо того, чтобы вводить смещение ступени, давление в камеру или локализованную инъекцию азота для уменьшения накопления заряда на поверхности блока, также можно увеличить проводимость смолы путем введения углерода в смесь смолы, что позволяет более агрессивные настройки изображения16. Следующий общий протокол является адаптацией протокола Deerinck et al., опубликованного в 2010 году, и охватывает модификации методологий подготовки тканей и визуализации, которые мы сочли полезными для минимизации заряда тканей при сохранении получения изображений с высоким разрешением3,17,18,19. В то время как ранее упомянутый протокол сосредоточен на обработке тканей и пропитке тяжелыми металлами, этот протокол дает представление о визуализации, анализе данных и рабочем процессе реконструкции, присущем исследованиям SBF-SEM. В нашей лаборатории этот протокол был успешно и воспроизводимо применен к широкому кругу тканей, включая структуры роговицы и переднего сегмента, веко, слезную и более твердую железу, сетчатку и зрительный нерв, сердце, легкие и дыхательные пути, почки, печень, мышцы кремастера и кору головного мозга / продолговатый мозг, а также у различных видов, включая мышь, крысу, кролика, морскую свинку, рыбу, монослойные и стратифицированные клеточные культуры, свиней, нечеловеческих приматов, а также человека20,21,22,23. Хотя небольшие изменения могут быть полезны для конкретных тканей и приложений, этот общий протокол оказался очень воспроизводимым и полезным в контексте нашего основного средства визуализации.
протокол
Все животные обрабатывались в соответствии с руководящими принципами, описанными в Заявлении Ассоциации исследований в области зрения и офтальмологии для использования животных в исследованиях зрения и офтальмологических исследованиях и Руководящих принципах обращения с животными Колледжа оптометрии Университета Хьюстона. Все процедуры для животных были одобрены учреждениями, в которых они обрабатывались: процедуры для мышей, крыс, кроликов, морских свинок и нечеловеческих приматов были одобрены Комитетом по уходу и использованию животных Университета Хьюстона, процедуры для рыбок данио были одобрены Комитетом по уходу за животными и использованию животных Университета ДеПау, а процедуры для свиней были одобрены Комитетом по уходу и использованию животных Медицинского колледжа Бейлора. Все человеческие ткани были обработаны в соответствии с Хельсинкской декларацией в отношении исследований тканей человека, и было получено соответствующее одобрение институционального наблюдательного совета.
1. Обработка тканей
- Готовят запасной раствор 0,4 М буфера какодилата натрия путем смешивания порошка какодилата натрия в ddH2O. Тщательно перемешайте буфер и pH дорегулируйте раствор до 7,3. Этот буфер используют для изготовления фиксаторного (композиция, описанная ниже на этапе 1.3), промывки буфера, а также растворов осмия и ферроцианида калия.
ПРИМЕЧАНИЕ: Фиксация перфузии часто является лучшим методом фиксации для исследований SBF-SEM, так как фиксация происходит быстро и по всему телу. Если фиксация перфузии невозможна в рамках вашего проекта исследования, перейдите к шагу 1.3. - Выполняют перфузионную фиксацию с соответствующим физиологическим давлением для животного модели24,25,26. Это делается с помощью транскардиальной последовательной перфузии с гепаринизированным физиологическим раствором, за которым следует фиксатор, каждый из которых помещается на определенной высоте (например, 100 см) над организмом (соответствующему физиологическому давлению сосудистой системы в животной модели), с фиксатором, протекающим в левый желудочек и выходящим из разреза, сделанного в правом предсердии. Ткань, представляющий интерес, станет бледной, поскольку кровь заменяется фиксатором, если вся или часть вашей ткани не бланшируется, то ткань может быть не фиксирована должным образом, а ультраструктура может не сохраняться.
- Используйте лезвие бритвы или острый скальпель, чтобы обрезать образцы тканей на блоки размером не более 2 мм х 2 мм х 2 мм. Если шаг 1.2 был пропущен, сделайте это быстро, чтобы ткань могла быть зафиксирована как можно быстрее.
- В качестве альтернативы рассечение ткани под фиксатором и перевод на свежий фиксатор для завершения процесса погружения. Конечная композиция фиксатора состоит из 0,1 М буфера какодилата натрия, содержащего 2,5% глутаральдегида и 2 мМ хлорида кальция. Дайте фиксации продолжаться в течение минимум 2 часов при комнатной температуре и максимум в течение ночи при 4 °C. Если возможно, используйте качельку/наклонную пластину для осторожного перемешивать образцы во время фиксации.
- В качестве альтернативы, если инверторная микроволновая печь доступна, зафиксируйте ткань в вышеупомянутом фиксаторе под вакуумом при 150 Вт в течение 4 циклов 1 минута включена, 1 минута выключена. Микроволновая фиксация является предпочтительным методом для этапа 1.3, поскольку она быстро фиксирует ткань и сохраняет ультраструктуруткани 27.
ПРИМЕЧАНИЕ: Ткани никогда не следует позволять высыхать во время этого протокола, следует позаботиться о том, чтобы быстро перенести ткань из одного раствора в другой.
- Промыть фиксированную ткань 5 раз в течение 3 минут каждая (всего 15 минут) при комнатной температуре в буфере какодилата натрия 0,1 М, содержащем 2 мМ хлорида кальция.
- Сделайте следующий раствор ферроцианида осмия свежим, предпочтительно во время предыдущих этапов промывки. Соединить 4% раствор тетроксида осмия (приготовленный в ddH2O) с равным объемом 3% ферроцианида калия в 0,2 М какодилатного буфера с 4 мМ хлорида кальция. После предыдущего этапа промывания поместите ткань в этот раствор на 1 час на лед в темноте и в вытяжной капюшон.
ПРИМЕЧАНИЕ: Тетроксид осмия представляет собой желтое кристаллическое вещество, которое входит в ампулу. Чтобы создать раствор тетроксида осмия, раскройте ампулу, добавьте ddH2O и прожайте ультразвуком в течение 3-4 часов в темноте до полного растворения кристаллов. Раствор тетроксида осмия представляет собой прозрачный желтый раствор, если раствор черный, осмий был восстановлен и больше не должен использоваться. - Пока ткань инкубируется в растворе ферроцианида осмия, начинают приготовление раствора тиокарбогидразида (ТХ). Приготовьте этот раствор свежим и исправьте его в свободном доступе в конце 1-часового периода фиксации ферроцианида осмия. Соединить 0,1 г тиокарбогидразида с 10 мл ddH2Oи поместить этот раствор в духовку с 60 °C на 1 час. Чтобы раствор растворился, осторожно закручивайте каждые 10 минут. Перед использованием отфильтруйте этот раствор через шприцевой фильтр 0,22 мкм.
- Перед инкубацией в ТП промыть ткань с комнатной температурой ddH2O 5x в течение 3 минут каждая (всего 15 минут).
- Поместите ткань в фильтрованный раствор ТКП в общей сложности на 20 минут при комнатной температуре(рисунок 1А-С).
- После инкубации в ТП промойте ткань по 5 раз в течение 3 минут каждая (всего 15 минут) при комнатной температуре ddH2O.
- Поместите ткань в ddH2O, содержащую 2% тетроксид осмия (не осмий, восстановленный ферроцианидом калия) в течение 30 минут при комнатной температуре. Это следует делать в вытяжном капюшоне и в темноте, так как осмий может быть уменьшен светом (например, под алюминиевой фольгой)(рисунок 1D-F).
- После инкубации тетроксида осмия промыть ткань по 5 раз в течение 3 минут (всего 15 минут) при комнатной температуре ddH2O.
- Поместите ткань в 1% водный уранилацетат (порошок уранилацетата, смешанный с ddH2O) на ночь в холодильник при 4 °C.
- Непосредственно перед извлечением ткани из холодильника приготовьте свежий раствор аспартата свинца Уолтона. Начинают с растворения 0,066 г нитрата свинца в 10 мл 0,03 М раствора аспарагиновой кислоты (0,04 г аспарагиновой кислоты в 10 мл дистиллированной воды) и регулируют рН до 5,5 с 1 Н КОН (0,5611 г в 10 мл дистиллированной воды).
ВНИМАНИЕ: При регулировке рН может образовываться осадок. Это неприемлемо.- Используя перемешивающий батончик, медленно добавляйте 1 Н КОН по каплям при мониторинге рН. Предварительно нагрейте готовый прозрачный раствор аспартата свинца в духовке при температуре 60 °C в течение 30 минут. Если образуется осадок, раствор не может быть использован и должен быть приготовлен другой раствор.
- Достаньте салфетку из холодильника и промывайте по 5 раз по 3 минуты (всего 15 минут) при комнатной температуре ddH2O.
- После промывания поместите ткань в подогретый раствор аспартата свинца Уолтона на 30 минут, сохраняя при этом температуру на уровне 60 °C.
- После инкубации в аспартате свинца Уолтона промыть ткань 5x в течение 3 минут каждая (всего 15 минут) при комнатной температуре ddH2O(рисунок 1G-I).
- Обезвоживание ткани через ледяной ацетоновый ряд (30%, 50%, 70%, 95%, 95%, 100%, 100% и 100% ацетон (в ddH2O, где это применимо), давая 10 минут для каждой ступени в серии.
- После серии ледяного обезвоживания поместите ткань в ацетон комнатной температуры на 10 минут.
- За это время формулируют Embed 812 ACM смолу. Используйте рецепт «твердой смеси», так как она более устойчива к повреждению пучком. Тщательно перемешайте смолу и поместите ткань в Embed 812: ацетон (1: 3 смеси) в течение 4 часов, затем Embed 812: ацетон (1: 1 смесь) в течение 8 часов или на ночь, и, наконец, вставить 812: ацетон (3: 1 смесь) на ночь. Выполните эти шаги по инфильтрации смолы при комнатной температуре.
- На следующий день поместите ткань в 100% Embed 812 на 4-8 часов, затем в свежую 100% Embed 812 на ночь и, наконец, в свежую 100% Embed 812 в течение 4 часов. Выполните эти шаги по инфильтрации смолы при комнатной температуре.
- Непосредственно перед встраиванием поместите небольшое количество смолы в контейнер для смешивания и медленно перемешайте (деревянная палочка может быть использована для перемешивания) в порошке технического углерода, пока смола не насытится порошком, но все еще будет жидкой и не станет зернистой. Он должен напоминать толстые чернилки и уметь медленно капать с деревянной палочки без видимых комков.
- Сориентируйте образцы тканей в силиконовой резиновой форме и сделайте снимок, чтобы ориентация образца в смоляном блоке была записана и на нее можно было ссылаться. Накройте образцы насыщенной смолой технического углерода на кончике силиконовой формы и поместите форму в духовку на ~1 час при 65 °C.
- Поместите форму под наклон, чтобы она содержала смолу на кончике формы, где она покрывает образец ткани. Поместите этикетку с идентификатором образца эксперимента/ткани в форму на противоположном конце смолы(рисунок 2A).
- Извлеките силиконовую форму из духовки и заполните оставшуюся часть формы прозрачной смолой (без технического углерода), убедившись, что этикетка остается видимой. Отвержь смолу, настоявшую на саженом, достаточно, чтобы не смешиваться с прозрачной смолой.
- Подготовьте дополнительный колодец внутри формы, который не содержит ткани. Начиная с дополнительного колодца, заполните оставшуюся часть формы прозрачной смолой.
- Если смола, наполненная сажим углеродом, начинает сливаться в прозрачную смолу, поместите силиконовую форму обратно в духовку на дополнительное время (например, 15 минут).
- После того, как все образцы тканей будут покрыты прозрачной смолой, поместите силиконовую форму обратно в духовку (плоскую, без наклона) при 65 ° C в течение 48 часов, чтобы завершить процесс отверждения.
2. Подготовка блока
ПРИМЕЧАНИЕ: Метод будет зависеть от того, как образец ориентирован в блоке и как будет происходить секционирование. Однако наиболее распространенная ориентация ткани обнаруживает ткань, центрированную в кончике смоляного блока, перпендикулярную длинному концу смоляного блока.
- В большинстве случаев сначала обрезают конец блока, чтобы найти ткань, помещая блок образца в микротомный патрон с конусным концом, торчащий примерно на 5-6 мм из патрона. Зафиксируйте его на месте с помощью установленного винта и поместите под тепловую лампу.
- Через несколько минут блок станет податливым и легко обрезаемым. Поместите патрон в держатель стереомикроскопа и используйте новое лезвие бритвы с двойными краями, чтобы сделать тонкие участки параллельными лицевой стороне блока, пока ткань не будет видна. Это лучше всего видно, проводя свет через лицо блока, образец ткани будет менее отражающим и зернистым по сравнению с теми частями смолы, которые лишены ткани. Обратитесь к фотографии, сделанной образцами тканей перед введением насыщенной смолы технического углерода, чтобы получить представление о том, как и где находится ткань.
- Отложите один держатель штифта для обрезки. Этот держатель штифта никогда не помещается в камеру SEM и поэтому может работать без перчаток, это будет называться держателем для обрезки штифта. Любой держатель образца, предназначенный для размещения в камере визуализации, никогда не должен быть тронут без перчаток. Это позволяет избежать введения смазки и масла в камеру микроскопа.
- Поместите алюминиевый штифт в держатель обрезного штифта и слегка затяните установленный винт лицевой стороной (плоской поверхностью) штифта, удерживаемым на 3-4 мм выше держателя штифта.
- Сделайте несколько глубоких, пересекающихся царапин на лицевой стороне штифта, чтобы обеспечить большую площадь поверхности для клея, используемого для удержания образца на месте. Если используется алюминиевый штифт, для этого шага рекомендуется небольшая стальная отвертка с плоской головкой(рисунок 2B).
- Поместите патрон, содержащий образец ткани, обратно под тепловую лампу до тех пор, пока смола не станет мягкой и податливой, затем поместите ее в патрон-сосуд под стереомикроскопом.
- Использование обоюдоострого лезвия бритвы для обрезки избытка смолы из части смоляного блока, содержащего образец ткани. В конечном итоге размер тканевого блока, прикрепленного к штифту, составит примерно 3 мм в диаметре и 2-3 мм в высоту.
- Осторожно протолкнуйте бритву прямо вниз в смоляной блок примерно на 1-2 мм, затем осторожно протолкнуть бритву горизонтально в смоляной блок на глубине, равной предыдущему срезу. Делайте это медленно и с большой осторожностью, так как можно повредить или отрезать часть блока, содержащую образец ткани. Когда два разреза встречаются, избыток смолы отделяется от блока. Продолжайте удалять смолу до тех пор, пока не останется только приподнятая область 3 мм х 3 мм.
- После этой первоначальной обрезки поместите блок (все еще в патрон) под лампу нагрева на несколько минут.
- Как только смола станет мягкой и податливой, поместите блок обратно под стереомикроскоп. Используя новое лезвие бритвы с двойным лезвием, отрежьте верхнюю часть смоляного блока, примерно на 1 мм ниже обрезанной части, с одним гладким срезом. Плоская поверхность предпочтительнее, так как она будет приклеена к штифту образца. Будьте осторожны, чтобы не позволить образцу потеряться, так как этот шаг требует некоторой силы, которая может перейти на удаленную часть блока и заставить его улететь. Отложите разрезанный и обрезанный образец в сторону.
- Поместите держатель обрезного штифта, содержащий разрезанный алюминиевый штифт, в розетку стереомикроскопа. Нанесите тонкий слой цианоакрилатного клея на лицевую сторону булавки так, чтобы она полностью закрывала булавку, не образуя видимого мениска. Подберите обрезанный кусок тканевого блока щипцами и поместите на лицевую сторону булавки. Центрирование образца ткани на штифте образца. Нажмите на него и удерживайте в течение нескольких секунд. Дайте клею сложиться в течение нескольких минут.
- Когда клей полностью высохнет, поместите держатель обрезного штифта обратно под стереомикроскоп. Используя тонкий файл, уберите избыток смолы, чтобы ни одна смола не нависла над контактом. Форма смолы должна напоминать круглую головку булавки.
- Расположение ткани на приподнятой части вашего смоляного блока, для этого полезно косое освещение. С помощью бритвы с двойным лезвием приподнятая часть смолы, содержащая образец ткани, должна быть обрезана до площади не более 1мм2. По возможности блок-грань можно обрезать еще меньше, это снизит нагрузку на алмазный нож и улучшит его долговечность.
- Удалите как можно больше лишней смолы, оставив блок немного длиннее в одном измерении. Это делается медленно и с осторожностью, так как смола, содержащая образец ткани, может отколоться, если прикладывается слишком много силы. Хотя рекомендуется бритва, для этого шага можно использовать тонкий металлический файл.
- С тонким углом металлического напильни избытка смолы, в области за пределами поднятой части, содержащей образец ткани, вниз к краю штифта(рисунок 2C).
- Удалите частицы смолы и пыли из подготовленного образца перед нанесением серебряной краски с последующим распылением золота. Смешайте серебро с ацетоном так, чтобы оно было легко намазываемой жидкостью, похожей на лак для ногтей (но не настолько тонкой, чтобы она капает с аппликатора) и нанесите тонкий слой на всю поверхность блока образцов. Ацетон быстро испаряется, поэтому может потребоваться добавить дополнительный ацетон, когда серебряная краска начинает утолщаться.
- Дайте серебряной краске высохнуть в течение ночи перед загрузкой в микроскоп.
ПРИМЕЧАНИЕ: Этот серебряный слой должен быть тонким, чтобы избежать расширения грани блока за пределы 1 мм х 1 мм, и хотя серебряная краска никогда не повреждала алмазный нож, меньшие грани блока по-прежнему рекомендуются для сохранения долговечности алмазного ножа. Ацетон, смешанный с серебром, должен полностью испариться перед распылением золота или загрузкой образца в микроскоп, чтобы избежать введения паров ацетона в камеру визуализации. - После нанесения серебряной краски нанесите тонкий слой золота на блок образца. При использовании стандартного вакуумного напыляющего устройства, оснащенного стандартной мишенью из золотой фольги, давление в камере 200 миллиТорр (газ аргон) и 40 миллиампер, работающее в течение 2 минут, приведет к золотому покрытию толщиной 20 нм.
- Дайте серебряной краске высохнуть в течение ночи перед загрузкой в микроскоп.
- После нанесения покрытия поместите смонтированный и обрезанный блок в трубку с соответствующей экспериментальной этикеткой. Создавайте пользовательские трубки с помощью одноразовых трансферных пипеток.
- Разрежьте передаточную пипетку чуть ниже колбы, оставив короткую часть трубки для переноски, прикрепленную ниже луковичного конца. Укоротите трубчатую часть, которая была отрезана, и отрежьте наконечник пипетки назад настолько, чтобы алюминиевый штифт образца можно было прижать к нему.
- Поместите конец, содержащий алюминиевый образец штифта, в колбовый конец модифицированной передаточной пипетки.
- Перед загрузкой подготовленного тканевого блока аккуратно обрежьте избыток серебристой краски с поверхности блока.
3. Настройки SEM для визуализации лица блока
ПРИМЕЧАНИЕ: Приведенные ниже настройки изображения были созданы на устройстве, используемом авторами, которое указано в таблице материалов. Хотя это устройство способно к визуализации с переменным давлением, наилучшие результаты были получены при высоком вакууме.
- Время пребывания: Используйте 12 мкс/пиксель во время последовательного сечения. Когда область интереса идентифицирована, изображение с более высоким разрешением может быть получено при 32 мкс/пиксель.
- Настройки вакуума: Используйте давление пушки 9e-008 Pa, давление в колонке 1,1e-004 Pa и давление в камере 9,5e-002 Pa.
- Время захвата: С помощью вышеуказанных настроек фиксируйте стек изображений размером 2048x2048 пикселей со скоростью 50 секунд на изображение. Изображения с более высоким разрешением интересующих областей могут быть получены с разрешением 4096x4096 пикселей со скоростью чуть менее 9 минут на изображение.
- Толщина секции: Используйте 100-200 нм. Меньше возможно, но может потребоваться более низкое напряжение луча, интенсивность или время выдержки.
- Высокое напряжение (HV): Используйте 7-12 кВ. В то время как увеличение напряжения уменьшает размер пятна и увеличивает разрешение, это создает больше возможностей для повреждения луча. Более высокое кВ увеличивает проникновение луча, что приводит к потере деталей. Однако понижение кВ ухудшает отношение сигнал/шум(рисунок 3)14.
- Интенсивность луча (BI): Авторский прибор SBF-SEM предлагает шкалу интенсивности луча в диапазоне от 1 до 20. По этой шкале значения 5-7 дают качественные изображения без чрезмерной зарядки и повреждения луча. Чем выше BI, тем больше разрешение, однако, больше шансов на зарядку и повреждениелуча 14.
- Размер пятна и увеличение изображения: Определите размер пятна по интенсивности луча и уровню напряжения. В идеале размер пятна не должен быть больше используемого размера пикселя. Размер пикселя определяется путем деления поля зрения (FOV) на количество пикселей. Например, 25-мкм FOV с размером изображения 2048x2048 пикселей даст 12,2 нм на пиксель. Поэтому размер пятна не должен превышать 12,2 нм. На рисунке 4 показано, как связаны HV, BI и размер пятна.
- Рабочее расстояние (WD) - При блочной визуализации лица рабочее расстояние не регулируется. Это просто фактор фокусировки. Он будет почти идентичен для всех изображенных блоков. Хотя рабочее расстояние не регулируется, оно играет решающую роль в разрешении захваченного изображения. По мере уменьшения рабочего расстояния ограничение разрешения на захваченные изображения увеличивается. В некоторых случаях может быть возможно уменьшить рабочее расстояние путем внесения изменений в камеру визуализации, однако эти изменения должны быть сделаны по усмотрению пользователя. Чтобы уменьшить рабочее расстояние и увеличить разрешение изображения, мы ослабили винты микротома дверного крепления и перепозиционировали микротом так, чтобы он лежал примерно на 2 мм ближе к детектору луча после повторного затягивания винтов.
- Разрешение - Используя вышеуказанные настройки, возможно разрешение x & y до 3,8 нм. Важно отметить, что разрешение ограничено размером пятна луча, а также пиксельным разрешением захвата изображения (например, поле зрения 20 мкм, снятое в пиксельном изображении 2048x2048 пикселей, имеет разрешение в пикселях 9,8 нм, даже если использовался размер пятна 3,8 нм). Разрешение изображения в z-плоскости зависит от толщины сечения, мы находим, что 100-200 нм хорошо работает с этим протоколом.
Результаты
Роговица мыши
Этот протокол широко применялся к роговице мыши. Было показано, что с помощью визуализации SBF-SEM сеть пучков микрофибрила без эластина (EFMB) присутствует в роговице взрослой мыши. Ранее считалось, что эта сеть присутствовала только во время эмбрионального и раннего постнатального развития. SBF-SEM выявил обширную сеть EFMB по всей роговице, причем отдельные волокна были обнаружены в диаметре 100-200 нм при измерении в поперечном сечении. Также было обнаружено, что эта сеть EFMB была организована в отдельные слои, с волокнами, тесно связанными с кератоцитами, даже лежащими в неглубоких инвагинациях на поверхности кератоцитов(рисунок 5). Открытие волокон EFMB во взрослой роговице привело к электронной микроскопии с прощающей маркировкой иммунозолотой (TEM), флуоресценции и конфокальным исследованиям для дальнейшего понимания природы этой сети23.
Дальнейшее применение этого протокола привело к открытию ранее неизвестной популяции центральных нервов роговицы, которые сливаются с базальными эпителиальными клетками на стромально-эпителиальной границе(рисунок 6). Ранее считалось, что все нервы, взаимодействующие с эпителием на этой границе, проникают в эпителий роговицы и разветвляются, производя суббазальные и эпителиальные сплетения. В этом исследовании ~ 45% центральных нервов, взаимодействующих с базальным эпителием, подверглись слиянию клеток и клеток, а не простому проникновению. Используя стереологические методы, примененные к наборам данных SBF-SEM, можно было показать, что эта новая нервная популяция имела отношение поверхности к объему примерно вдвое меньше, чем у проникающих нервов, что согласуется с их «опухшим» внешним видом (Nerve Fusion - 3,32±0,25, Nerve Penetration - 1,39±0,14, p ≤ 0,05). Были созданы 3D-реконструкции проникающих и сливающихся нервных пучков и их митохондрий, подчеркивающих отсутствие митохондрий в сросшихся частях нервных пучков. Открытие слияния нейронально-эпителиальных клеток с использованием SBF-SEM привело к флуоресцентным исследованиям, подтверждающим непрерывность мембраны между двумя слитыми клетками21.
Центральная роговица представляет собой аваскулярную ткань, и как таковая периферическая лимбальная сосудистая ткань имеет особое значение для общего здоровья роговицы. Клеточно-клеточные отношения и ультраструктура этой области сложны; однако способность оценивать эти клеточно-клеточные взаимодействия и ультраструктурные связи была ограничена в исследованиях флуоресценции и одного сечения ТЕА. По этой причине стек изображений SBF-SEM, содержащий лимбальную сосудистую, нервные пучки и связанные с ними клетки, был вручную сегментирован для 3D-реконструкции(рисунок 7). На этом изображении можно увидеть тесную связь между сосудистыми эндотелиальными соединениями и накладным перицитом, отдельными гранулами периваскулярной тучной клетки, ядром и передним краем нейтрофила, ползущего по наружной поверхности стенки кровеносного сосуда, а также проходящим нервным пучком.
Взятые вместе, эта работа демонстрирует способность этого протокола производить высококачественные наборы данных электронной 3D-микроскопии в тканях, богатых внеклеточным матриксом и эпителием, а также сосудистая система и связанные с ними клетки.
Сетчатка приматов высшего порядка - нервное сплетение и сосудистая сеть
Слой нервных волокон сетчатки (РНФЛ) приматов высшего порядка содержит и зависит от обширной сосудистой сети. Часто заболевания сетчатки включают изменения как параметров слоя нервных волокон сетчатки, так и сосудистой системы, обнаруженной в ней. Понимание взаимосвязи между РНФЛ и ее сосудистой сетью в здоровой, не патологической ткани является первым шагом к пониманию любых изменений, которые могут произойти в результате заболевания. Чтобы лучше понять эту взаимосвязь, протокол SBF-SEM был применен к нормальной сетчатке приматов высшего порядка и выполнена реконструкция сосудистой сети и извлечены объемные данные из этой реконструкции(рисунок 8). Эта область РНФЛ размером 4 642307 мкм3 содержала сосудистое русло объемом 1,207x10-4 мкл, что составляет 2,6% от общего объема РНФЛ. Эта работа демонстрирует способность этого протокола производить высококачественные наборы данных 3D-электронной микроскопии в плотной неврологической ткани.
Сердце рыбки данио и гигантского данио - понизанные мышцы и развивающиеся сосуды
И рыбка данио, и гигантский данио являются важными моделями для развития и регенерации сердца. Исторически считается, что сердце рыбки данио состоит из двух анатомически различных сегментов миокарда, функционирующих вместе в поддержку физиологических потребностей рыбок данио. Однако интерфейс между этими двумя желудочковыми слоями не был хорошо понят. С помощью этого протокола была обнаружена ранее нераспознанная соединительная область, состоящая из тонкого листа фибробластов. Было обнаружено, что отверстия внутри этого листа позволили двум отдельным сегментам миокарда вступить в контакт и образовать сложные спаечные соединения, включая десмосомы и фасции22.
Этот протокол был использован в дальнейшей работе по изучению сосудистой сети развивающегося гигантского сердца данио(рисунок 9). Этот метод позволяет 3D оценить развивающуюся сердечную миоцитарную сеть и ее связь с развивающимся микроциркулятурным руслом. Взятые вместе, эта работа демонстрирует способность этого протокола производить высококачественные наборы данных электронной 3D-микроскопии в мышцах и сильно васкуляризированных тканях.
Настройки изображения, зарядка и разрешение
Хотя для качественной визуализации SBF-SEM необходима надлежащая фиксация и окрашивание тяжелых металлов, не менее важным является использование проводящей смолы и надлежащих настроек визуализации для рассматриваемых вопросов. В этом протоколе используется использование технического углерода для того, чтобы увеличить проводимость блока образца и обеспечить канал к монтажным штифтам для очистки вторичных электронов от грани блока. Это доказало свою эффективность в борьбе с тканевой зарядкой, которая часто ухудшает качество изображения в тканях, не подготовленных с помощью технического углерода16. Кроме того, серебряная краска и золотое напыление, нанесенные на блок, обеспечивают путь рассеивания для накопления электронов. Некоторые устройства допускают добавление компенсатора фокального заряда, который уменьшает зарядку путем нанесения затяжки азота на грань блока, однако мы имели аналогичный успех с использованием технического углерода и нанесением серебряной краски и напыления золота на блок15. Отсутствие проводимости образца может привести к накоплению электронов, видимому как зарядкатканей (рисунок 1),а также к разрядам, которые видны как резкое смещение и деформацию изображения, что резко снижает качество изображения(рисунок 10B & F). Использование технического углерода позволяет получать изображения в условиях высокого вакуума и использовать настройки изображения, которые приводят к высокому соотношению сигнал/шум и улучшению разрешения изображения. Одной из таких настроек, которая приводит к улучшению качества изображения, является время выдержки пикселя. Процесс визуализации SBF-SEM включает в себя растровое сканирование электронного пучка по поверхности образца для генерации обратно рассеянных электронов, которые детектор микроскопа может собирать и интерпретировать как сигнал. Продолжительность времени, в течение которого этому лучу разрешено находиться в пространстве каждого пикселя, приводит к тому, что каждому местоположению пикселя присваивается более точное значение пикселя(рисунок 3A и B)2. Однако необходимо найти баланс между повышенным соотношением сигнал-шум, разрешением и повреждением, наносимым лицевой стороне блока. Пучок эффективно облучает грань блока электронами высокой энергии, которые могут разрушать и размягчать смолу, что приводит к ухудшению изображения и усложнению резки(рисунок 10)28. Чем тоньше требуемое z-разрешение, тем сложнее становится поддерживать изображения с высоким разрешением. Мы обычно используем z-шаги 100-200 нм, однако z-шаговые размеры 25-50 нм были зарегистрированы5,29,30,31. При z-ступенях такого размера разлом и размягчение смолы из-за повреждения балки может привести либо к сжатию смолы, в результате чего нож пропустит порез, либо к порезу грани блока, но с «болтовней», когда нож пропускает по поверхности блока, создавая рябь и полосы13. Хотя небольшие z-шаги являются привлекательной перспективой, важно помнить о конкретном исследовательском вопросе при выборе подходящего z-шага. Чрезмерная выборка может привести к существенным соображениям хранения данных, а также к увеличению времени, необходимого для создания 3D-реконструкций.
Фиксация и окрашивание тканей
Перед инкубацией тяжелых металлов ткани должны быть зафиксированы в глутаральдегиде. Хотя мы настоятельно рекомендуем микроволновую фиксацию под вакуумом для сохранения тканевой ультраструктуры27,если микроволновая печь лабораторного класса недоступна, коммерческая инверторная микроволновая печь с переменной мощностью может быть заменена32,33,34,35. Если это сделано, следует проявлять особую осторожность, чтобы гарантировать, что искажение тканей не происходит. Неправильная фиксация тканей может привести к изменению морфологии ткани, как показано на рисунке 10E. Этот протокол, как и большинство современных протоколов окрашивания SBF-SEM, был адаптирован из процедуры окрашивания, описанной Диринком в 2010году 17,на основе окрашиваний осмий-тиокарбогидразид-осмий, созданных Уиллингемом и Резерфордом в 1984году 36. Тяжелые металлы, используемые в этом протоколе, добавляют контраст клеточным структурам в образцеткани (рисунок 1). Начальная инкубация осмия происходит с восстановленным осмием, который связывается с C=C связями в ненасыщенных жирах, что приводит к окрашиванию мембран и липидов37,38. Осмий восстанавливается ферроцианидом калия, который способствует окрашиванию насыщенных липидов, а также действует для стабилизации фосфолипидов39,40. Тиокарбогидразид впоследствии добавляют в качестве мордента, который связывается с осмием из первой инкубации, действуя как мост, на котором связывается дальнейший осмий на более поздней стадии протокола41. Уранилацетат, представляющий собой соль урана, является эффективным контрастным веществом для липидов, нуклеиновых кислот и белков, в то время как цитрат свинца усиливает контраст белков и гликогенов. Различное сродство этих агентов к клеточным компонентам дополнительно усиливает общий контраст в тканях сверх инкубаций осмия42.
Визуализация лица блока
Рисунок 11, Рисунок 12, Рисунок 13 иллюстрируют комбинированные эффекты напряжения, времени выдержки пикселей и интенсивности луча. Традиционная практика предполагает, что сочетание низкого напряжения, короткого времени выдержки и интенсивности ближнего света необходимо для оптимальной визуализации и предотвращения повреждения луча блока образца. Вопреки этим настройкам, Рисунок 11, Рисунок 12, Рисунок 13 иллюстрируют, что более высокие напряжения (например, 7 кВ), более длительное время выдержки (32 мкс/px) и более высокая интенсивность пучка (установка 6 в нашем случае) могут обеспечить превосходное качество изображения по сравнению с обычными настройками.
SBF-SEM позволяет собирать последовательные изображения электронной микроскопии, которые могут быть собраны в виде набора 3D-данных, состоящего из вокселей. Хотя это невероятно мощное использование SBF-SEM, этот метод также позволяет быстро и повторяемо визуализуть редкие биологические события или клетки. Получение изображений с помощью SBF-SEM можно отслеживать на предмет редких событий, а съемку приостанавливать, чтобы собирать изображения этих событий с более высоким увеличением / разрешением. Кроме того, блок может быть извлечен из камеры микроскопа и секционирован блоком для визуализации просвечивающих электронных микроскопий (ТЭМ). Таким образом, большие наборы данных редких событий могут быть собраны с использованием SBF-SEM, а также оценены в масштабе ангстрема с использованием TEM.

Рисунок 1:Сравнение SBF-SEM и TEM на различных этапах протокола. Этот протокол содержит несколько этапов, на которых ткань образца окрашивается тяжелыми металлами. Это влияет не только на контраст тканей и оценку клеточных структур и органелл, но и на уровни зарядки, которые возникают при изображении ткани. Этот рисунок содержит три различных вида подготовленной ткани: вид с низким увеличением(A, D & G),вид с высоким увеличением(B, E & H)и сравнение TEM подготовленной роговицы мыши(C, F & I). Можно отметить, что изображения с более высоким увеличением могут привести к увеличению заряда тканей, поскольку электронный пучок концентрируется в меньшей области ткани. Верхний ряд(A-C)представляет собой репрезентативный образец из ткани, обработанной через завершение этапа 1.8, и был пропитан ферроцианидом калия, тетроксидом осмия и тиокарбогидразидом. Стрелки в первых двух столбцах показывают эпителиально-стромальный интерфейс в качестве ориентира. Обратите внимание на низкий уровень контрастности по сравнению с двумя нижними рядами, а также на повышенный уровень заряда тканей. Образец в среднем ряду(D-F)был обработан путем завершения этапа 1.10 и получает дополнительную ступень тетроксида осмия и заметно более контрастен, чем образец в верхнем ряду. В то время как клеточные структуры различимы, зарядка все еще присутствует. Образец в нижнем ряду(G-I)выигрывает от полного протокола окрашивания и имеет минимальную зарядку тканей. Визуализация TEM показывает уровни контраста тканей, придаваемые тяжелыми металлами, присутствующими на каждом этапе (правая колонка): органеллы в эндотелии роговицы (*) более контрастны и очевидны, поскольку обработка тканей продолжается через протокол. Кроме того, детали стромального коллагена и фибриллина становятся более заметными (наконечник стрелы) по мере завершения протокола. Панель A, шкала D & G = 50 мкм. Панель B, шкала E & H = 10 мкм. Шкала панели C, F & I = 1 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2:Схема встроенного тканевого блока, образца штифта и окончательной подготовки. (А) Ткань должна быть помещена в известную ориентацию на самом кончике смоляной формы, а верхняя треть формы заполнена насыщенной смолой технического углерода. Область плесени, наиболее дальняя от ткани, должна оставаться четкой, чтобы можно было четко видеть метку эксперимента. (B) Поверхность штифта образца должна быть поцарапана для получения рисунка сетки, что позволяет обеспечить большую площадь контакта для цианоакрилатного клея для затвердевания между подготовленным блоком образца и штифтом. (C)Насыщенная смола технического углерода должна иметь широкую область контакта с головкой булавки образца, однако область, разрезаемая алмазным ножом, должна быть не более 1x1 мм. Хорошей практикой является сужание блока к наконечнику. Это сводит к минимуму режущие усилия алмазного ножа и, имея более широкое основание, блок более устойчив к отделению от штифта во время сечения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
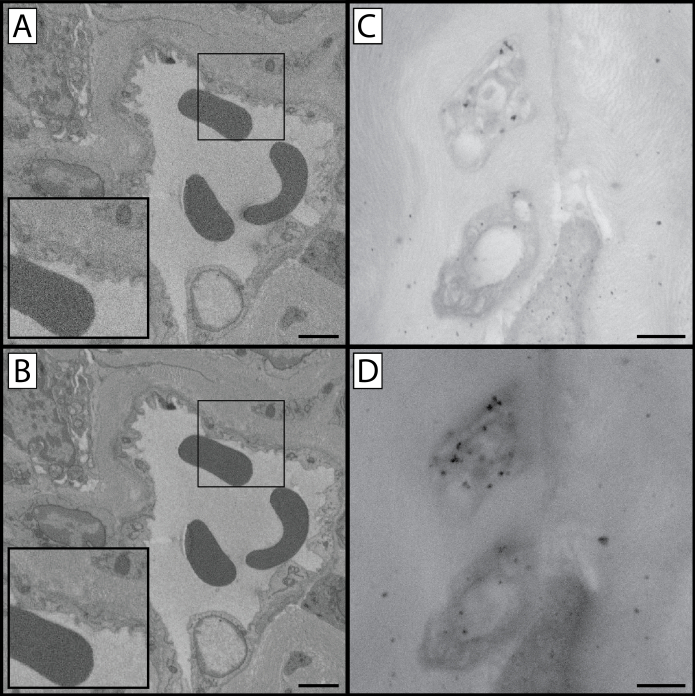
Рисунок 3:Сравнение настроек захвата изображения. (A & B) Панели A и B сравнивают качество и разрешение изображения в соответствии со временем выдержки пикселей. Панель A была создана с использованием времени выдержки 32 мкс/пиксель при 4 кВ и страдает от уменьшенного отношения сигнал/шум, что проявляется в «зернистом» виде увеличенной вставки. Панель B была создана с использованием времени выдержки 100 мкс/пиксель при 4 кВ. Увеличение времени выдержки пикселя увеличивает отношение сигнал/шум и показывает повышенный уровень детализации сотовой связи, однако увеличенное время выдержки пикселя может привести к зарядке тканей и / или накоплению тепла, что смягчает блок и вводит режущие артефакты (болтовню) при сечении. Панели C и D сравнивают изображения, снятые в одинаковых условиях экспозиции, но с двумя различными значениями луча кВ. Ткань в этих панелях была пропитана частицами нанозолотого золота, чтобы сделать различия в глубинах проникновения пучка более очевидными. Панель C была захвачена при 9 кВ, а панель D была захвачена при 21 кВ. Повышенное кВ имеет преимущество повышенной контрастности(D),однако детали теряются в результате сбора электронов из большей глубины ткани(C). В результате отбора проб большего поперечного сечения видно большее количество частиц иммунозолотого, специфичных для GAP 43, в то время как неспецифическая маркировка остается прежней, что приводит к увеличению отношения сигнал/шум. Панель шкалы A & B = 2 мкм. Панель C & D шкала шкалы = 1 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4:Интенсивность пучка, кВ и размер пятна. (A)При контакте с образцом ткани электронный пучок (светло-синий) дает каплевидный объем взаимодействия, из которого образуются различные формы энергии от взаимодействия между пучковыми электронами и образцом ткани. Каплевидная форма является функцией плотности тканей и окрашивания тяжелых металлов вместе с энергией пучка и углом наклона электронного пучка43. В то время как рентгеновские лучи, шнековые электроны и третичные электроны производятся во время визуализации SBF-SEM, основная проблема связана с обратно рассеянными (темно-синими) и вторичными (зеленые) электронами13. Изображение, полученное с помощью визуализации SBF-SEM, создается путем сбора обратно рассеянных электронов. Эти электроны возникают из-за упругих взаимодействий между пучком и образцом, а собранный сигнал сильно зависит от атомного номера атомов, с которыми взаимодействуют - отсюда необходимость окрашивания тяжелых металлов44. Вторичные электроны возникают из неупругих взаимодействий между пучком и образцом, и обнаружение их сигнала сильно зависит от ориентации поверхности. Поскольку грань блока плоская в SBF-SEM, вторичные электроны не вносят значимого вклада в собранный сигнал13. Фактически, вторичное накопление электронов на поверхности блока может быть основным источником зарядки и оказывает паспельное влияние на качество изображения2. (B)На этом графике показана взаимосвязь между интенсивностью пучка, кВ пучка и размером пятна. Размер пятна является пространственным разрешением луча и определяет предел разрешения создаваемых изображений. Снижение кВ увеличивает размер пятна, но также уменьшает глубину изображения, позволяя более точно оценить детали. Это также уменьшает обнаруживаемый сигнал. Увеличение интенсивности луча обеспечивает первоначальное улучшение размера пятна и обнаружения сигнала, но быстро увеличивает уровень зарядки тканей. В конечном счете, выбранные значения интенсивности пучка и кВ зависят от образца и лучше всего определяются эмпирически в связи с задаваемым научным вопросом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5:Сеть пучков микрофибрилов без эластина в роговице мыши. 3D-реконструкция микрофибрилл (белых), тесно связанных с кератоцитами (желтыми, оранжевыми и зелеными) в строме роговицы. Микрофибриллы можно увидеть рядом с кератоцитами роговицы (стрелками)(А),а в некоторых случаях и в пределах неглубоких бороздок. Эта сеть микрофибрилл без эластина организована в отдельные слои внутри стромы роговицы(B). Шкала = 2 мкм. Реконструированный блок изображения составляет 45x45 мкм по оси x & y и 30 мкм по оси z с разрешением 22x22x100 нм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6:Реконструкция нервов роговицы, проходящих через базальную пластинку на стромально-эпителиальной границе. 3D реконструкция проникающего нерва (фиолетового) по мере его прохождения через базальную пластинку (зеленая). Можно увидеть, что этот нерв раздваивается перед проникновением. После проникновения в эпителий обе нервные ветви подверглись разветвлению. Митохондрии (желтый) видны в стромальной и эпителиальной частях нервного пучка. Шкала = 2,5 мкм. Реконструированный блок изображения составляет 25x25 мкм по оси x & y и 14 мкм по оси z с воксельным разрешением 12x12x100 нм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 7:Лимбальная сосудистая и связанные с ней клетки в периферической роговице мыши. Можно увидеть одно изображение(A)из блока 3D-изображения(B),через которое перемещается сосуд, нервный пучок и связанные с ним клетки. Панель C показывает реконструированный сосуд (красный) с соответствующим перицитом (серым), обернутым вокруг него, покрывающим соединения эндотелиальных клеток. Нервный пучок (синий) раздваивается в непосредственной близости от этого сосуда, когда он проходит через ткань. Нейтрофил (желтый) можно увидеть параллельно длинной оси сосуда, с его полиморфным ядром, видимым в его клеточном теле, и задним уроподом, видимым как выступ справа от изображения. Тучная клетка (пурпурная) видна на нижней стороне сосуда. Панель D изолирует эту тучную клетку, где ее гранулы (зеленые) легче увидеть, накладывая ядро (фиолетовый) внутри клетки. Панель E выделяет клеточные структуры, наложенные на клеточные реконструкции, с эндотелиальными ядрами, обозначенными синим цветом, и адгезивными микрочастицами, видимыми в просвете сосуда (оранжевый). Стрелки показывают границы между клетками эндотелия, которые в дальнейшем можно увидеть как приподнятые гребни, простирающиеся вдоль клеток на просветной стороне сосуда. Панель A шкала шкалы = 2 мкм. Блок изображения, используемый для реконструкции этих ячеек, составляет 30x30 мкм по оси x & y и 42,5 мкм по оси z с разрешением вокселя 14,6x14,6x100 нм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 8:Реконструированная сосудистая сеть слоя нервных волокон сетчатки приматов. (A)Изображение сетчатки приматов размером 200x200 мкм SBF-SEM, снятое с разрешением 8192x8192 пикселей. Местоположение отобранного составляет ~ 500 микрон от нижнего края височного края здорового глаза без патологии. Серия изображений, реконструированных в панелях C & D, была снята с разрешением 2048x2048 пикселей, при этом изображение было приостановлено, чтобы интересующие регионы могли быть изображены в 8192x8192 px. Панель B представляет собой инкрустированную область панели A,взятую непосредственно из исходного изображения. Обратите внимание на большое количество аксонов и их митохондрий. (C) Ортосличное сечение через объем ткани 200x200x200 мкм нижнего слоя височного нервного волокна контрольного глаза, с сегментированной сосудистой тканью. (D)Z-проекция сосудистого слоя нервного волокна. Эта серия иллюстрирует решение, возможное в большой области с использованием этой методологии. Панель A шкала = 20 мкм. Панель B шкала bar = 2 мкм. Разрешение вокселя серии изображений составляет 97.6x97.6x500 нм. Область интереса разрешение пикселей составляет 24.4x24.4 нм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
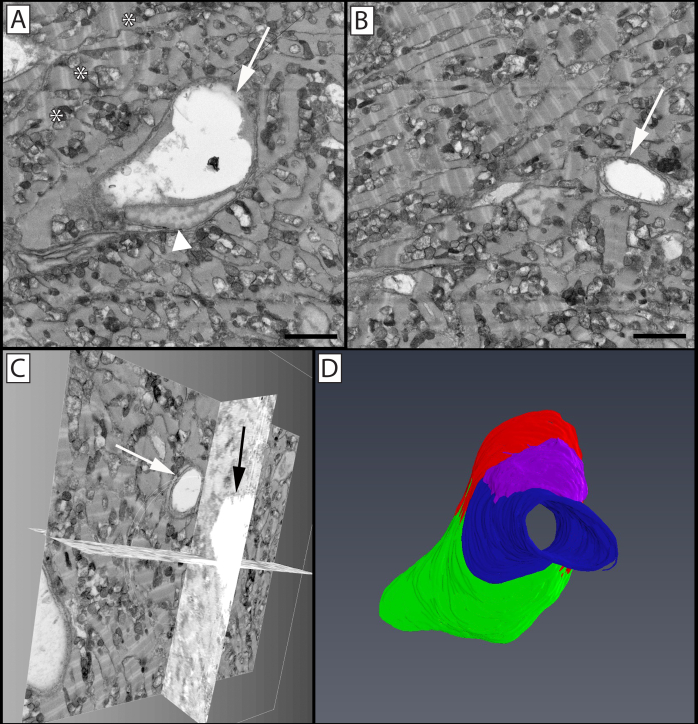
Рисунок 9:Сегментация и 3D объемная визуализация сосудов в гигантском данио(Devario malabaricus)компактном сердце. (A)Двумерная микрофотография в стеке изображений, показывающая профиль центрального сосуда венуллярного размера (стрелы) и эндотелиального ядра (наконечник стрелы), с окружающими сердечными миоцитами, богатыми митохондриями и хорошо организованными саркомерами (*). (B) Двумерная микрофотография стека изображений с капиллярным сосудом (стрелкой). (C)Биортогональные проекции стека микрофотографии, показывающие капилляр на панели B, проецируемый через один ортогональный срез. (D)3D-рендеринг сегментированных эндотелиальных клеток, выстилающих реконструированный сосуд. Зеленым, красным, синим и фиолетовым цветами изображены четыре отдельные эндотелиальные клетки; эндотелиальную клетку, изображенную синим цветом, можно увидеть в поперечном сечении на панели B (стрелка), в то время как эндотелиальные клетки, изображенные красным (стрелка) и зеленым (наконечник стрелки), видны в поперечном сечении на панели A. Панели A & B шкала bar = 2 мкм. Реконструированный блок изображения составляет 30x30 мкм по оси x & y и 16 мкм по оси z с воксельным разрешением 14,6x14,6x100 нм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
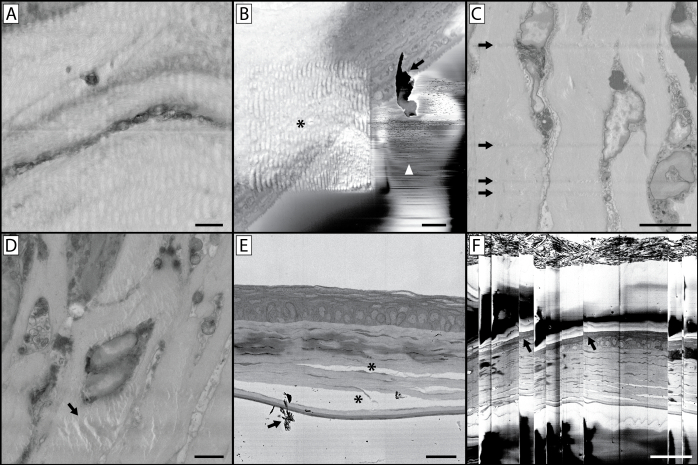
Рисунок 10:Усложнение изображения и артефакты. (A) Волнистый и искаженный характер этого изображения является результатом изображения с использованием слишком долгого времени ожидания пикселя. Это нагревает смоляной блок, оставляя лицо блока мягким и резиновым, что приводит к искажению изображения при резке. (B) Это изображение содержит множество артефактов. Звездочка указывает на волнообразное искажение, вызванное предыдущим изображением при более высоком увеличении и похожее на панель А,концентрация луча на меньшей области с более длительным временем выдержки пикселя смягчила смолу в этой интересующей области. В то время как собранное изображение с более высоким увеличением было свободным от артефактов, это может привести к последующей серии изображений, где образец, лежащий в основе интересующей области, кажется искаженным. Эта панель также иллюстрирует проблему накопления мусора на лицевой стороне блока (стрелка) во время визуализации, также обозначаемую стрелкой на панели E. Если это станет постоянной проблемой визуализации, необходимо будет сломать вакуум, открыть камеру и сдуть мусор, скопившийся на алмазном ноже и вокруг образца. Небольшие разряды электронов от блока-грани могут привести к быстрым изменениям контраста и линиям, обозначаемым белым наконечником стрелки. (C) Это изображение иллюстрирует царапины ножа на лицевой стороне блока. Это может произойти из-за поврежденного ножа или скопления мусора на острие ножа. (D)Артефакт, обозначаемый (стрелка), является результатом электронного пучка, сфокусированного на (без сечения) грани блока в течение длительного периода времени, когда образец все еще находится в камере визуализации. (E) Неправильная фиксация ткани может привести к разделению клеточных структур и соединительной ткани (*). (F)Если в вашей ткани или смоляном блоке происходит большое количество заряда, может произойти последующее накопление и разрядка, что приводит к «пропуску» изображения, как видно на этом изображении. Обратите внимание на искажение ткани на изображении в этих точках пропуска (стрелках). Панель A шкалы = 1 мкм. Панель B шкала бар = 2 мкм. Панель C шкала bar = 5 мкм. Панель D шкала bar = 2 мкм. Панель E шкала bar = 25 мкм. Шкала панели F = 50 um. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 11:Визуализация ткани при 3 кВ с использованием различного времени выдержки пикселей и интенсивности пучка. Все снимки собирались с помощью пучка 3 кВ, интенсивность пучка находится в специфической для устройства шкале от 1 до 20. Изображенное поле представляет из сосудистого просвета, содержащего белые и красные кровяные клетки. При таком низком кВ трудно оценить клеточную детализацию. Увеличение времени выдержки пикселя не имело большого эффекта. Увеличение интенсивности луча до 6 улучшило контрастность изображения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
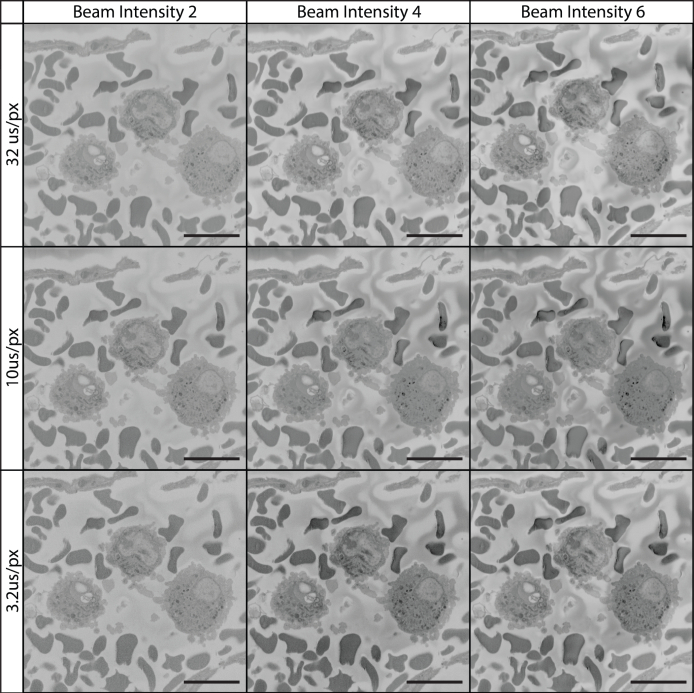
Рисунок 12:Визуализация ткани при 7 кВ с использованием различного времени выдержки пикселей и интенсивности пучка. Все снимки были собраны с использованием пучка 7 кВ, интенсивность луча находится в специфической для устройства шкале от 1 до 20. Изображенное поле представляет из сосудистого просвета, содержащего белые и красные кровяные клетки. При 7 кВ увеличение интенсивности луча и времени выдержки пикселей способствовало более высокому качеству изображения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 13:Визуализация ткани при 12 кВ с использованием различного времени выдержки пикселей и интенсивности пучка. Все изображения были собраны с использованием пучка 12 кВ, интенсивность пучка находится в специфической для устройства шкале от 1 до 20. Изображенное поле представляет из сосудистого просвета, содержащего белые и красные кровяные клетки. При 12 кВ изображение оптимизируется путем регулировки времени выдержки пикселей и интенсивности луча. Зарядка уменьшается / отсутствует при более коротком времени ожидания пикселей, в то время как сотовые детали и контраст изображения лучше всего с более длительным временем ожидания пикселя и более высокой интенсивностью луча. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Целью данной работы по методам является освещение методологии подготовки и визуализации тканей, которая позволила нашей лаборатории надежно захватывать изображения серийной электронной микроскопии высокого разрешения, и указать на критические шаги, которые приводят к этому результату, а также на потенциальные подводные камни, которые могут возникнуть при проведении визуализации SBF-SEM. Успех использования этого протокола требует правильной фиксации ткани, пропитки тяжелых металлов в образец, модификации встраиваемой смолы для уменьшения заряда, а также понимания микроскопа и настроек визуализации, используемых для сбора изображений. Максима «качество входит, качество выходит» является подходящей аксиомой для визуализации SBF-SEM. Поскольку целью SBF-SEM часто является оценка или количественная оценка ультраструктурных деталей, необходимо уделять особое внимательное внимательство стратегии фиксации, чтобы гарантировать, что искажение тканей не происходит. Если ткань искажается в любой момент подготовки образцов (т.е. подвергается отеку, сокращению или нарушению клеточной морфологии), то реконструкция и квантование тканей не дадут точных данных. Кроме того, использование неправильных настроек изображения может привести к потере данных, которые не могут быть повторно получены, поскольку визуализация SBF-SEM является разрушительным процессом. Кроме того, необходимо соблюдать осторожность при загрузке образца ткани, так как тонкий алмазный нож может быть поврежден поспешной или неправильной подготовкой образца. Это может привести к сколам или разрывам в ноже, которые могут оставить видимые царапины на изображениях(рисунок 10C). Алмазный нож также может быть поврежден кальцинированными структурами, твердыми гранулами или случайно встроенным стеклом (например, из ампул реагентов).
В то время как большая часть литературы SBF-SEM на сегодняшний день использует напряжения ускорения луча в диапазоне от 1 до 3 кВ наряду со временем выдержки пикселей ближе к 1-5 мкс / px (Рисунок 11)45,46,47,48,49, текущий протокол использует напряжения ускорения 7-12 кВ и время ожидания пикселя 12 мкс/пиксель для последовательного изображения и 32 мкс/px для интересующих областей изображения (Рисунки 12 и 13). Эти настройки в сочетании с толщиной среза 100-200 нм позволяют получать высококачественную и высокую разрешаемую визуализацию широкого спектра биологических тканей. Повышенное напряжение ускорения позволяет увеличить контрастность, разрешение, а также отношение сигнал/шум. Увеличенное время выдержки еще больше увеличивает разрешение и отношение сигнал/шум, в то время как увеличение толщины среза приводит к уменьшению заряда на поверхности блока во время сечения и борется с повреждениями, вызванными лучом, на последующих изображениях14. Хотя этот метод визуализации может отличаться от соглашения, полученные изображения и наборы данных говорят сами за себя. Если бы нам пришлось размышлять о причине этого успеха, возможно, что это результат нашей уникальной комбинации высоких значений кВ, более длительного времени ожидания пикселей и подготовки блока. Увеличение изображения кВ приводит к увеличению объема взаимодействия между электронным пучком и образцом. Этот объем взаимодействия является как более глубоким, так и более широким, что приводит к теоретическому увеличению числа обнаруженных электронов, которые происходят из глубины блока образца или из более широкого поперечного сечения ткани по мере увеличения размера каплевидного пятна в диаметре. Поскольку SBF-SEM интересуется деталями поверхности блока, это приводит к теоретическому снижению отношения сигнал/шум. Однако увеличение кВ также толкает электроны глубже в образец, где они с меньшей вероятностью покинут блок и внесут свой вклад в электроны, собранные детектором. С дополнительным преимуществом увеличения сигнала за счет более длительного времени ожидания пикселей и более высокой интенсивности луча, возможно, что этот метод визуализации приводит к большему увеличению сигнала с поверхности образца по отношению к шуму, возникая в пределах объема взаимодействия. Кроме того, повышенная проводимость образца, введенная с помощью технического углерода, а также серебряного и золотого покрытия, помогает улучшить накопление заряда, которое теперь происходит глубже внутри блока и дальше от грани блока. действительно Рисунок 11, Рисунок 12, Рисунок 13 показать, что по мере увеличения кВ заряд образца начинает уменьшаться, поскольку он потенциально выталкивается глубже в блок. Образцы, изображенные при низком увеличении, могут быть сняты с адекватной контрастностью с использованием обычных настроек, однако этим изображениям часто не хватает деталей при ближайшем рассмотрении. Наши данные ясно показывают, что при использовании относительно высокого увеличения, где целью является клеточная детализация, увеличение обычных настроек может дать исключительные результаты. В статье 2020 года P. Goggin et al. приводится полезная таблица, описывающая влияние изменения настроек изображения на конечное качество изображения, и это полезная ссылка для консультаций, если оптимизация протокола для новых тканей становится необходимой.14. Рекомендуемая в этом протоколе толщина среза 100-200 нм имеет дополнительное преимущество, позволяющее быстро получать большие наборы данных SBF-SEM. Например, при сборе изображений со скоростью 12 мкс/пиксельная съемка на глубине 100 мкм при 2048x2048 пикселей требует ~ 14 часов при секционировании при 100 нм/секция, но при секции на 25 нм/секция потребуется ~56 часов при секции на 25 нм/секция. Хотя разрешение x,y остается неизменным в результате толщины сечения, не учитывая дополнительную возможность изображения с использованием более высоких значений кВ и времени ожидания пикселей, которые приходят с большими участками, важно отметить, что разрешение вдоль оси Z действительно страдает. Потеря z-разрешения является важным соображением и должна учитываться при принятии решения о том, как ткань должна быть ориентирована в смоляном блоке и по отношению к плоскости визуализации, и может препятствовать изучению более мелких клеточных особенностей или взаимодействий (например, синаптических инвагинаций или внутриклеточных признаков в масштабе десятков нанометров). Однако, в дополнение к быстрому времени визуализации, этот протокол имеет дополнительные дополнительные преимущества в том, что он быстро создает идеальные наборы данных для стереологического анализа, а также изучения редких биологических событий или клеток. Большая толщина сечения также может помочь в ручной 3D-реконструкции, так как область 100 мкм, разделенная со скоростью 100 нм / сечение, потребует ручной сегментации 1000 изображений, в то время как та же область, разделенная на 25 нм / секция, потребует ручной сегментации 4000 изображений.
Преимущество SBF-SEM в том, что он генерирует большие наборы данных за относительно короткий период. Хотя анализ данных может быть выполнен с использованием количественных методов, таких как стереология, которые будут обсуждаться ниже, часто может быть информативным создание 3D-реконструкций с помощью сегментации изображения. Стек изображений, созданный с использованием SBF-SEM, можно рассматривать как коллекцию вокселей, в то время как сегментация - это процесс присвоения этих вокселов пользовательским объектам, тем самым создавая 3D-представления тканевых структур. Эти реконструкции часто дают до сих пор невидимый взгляд на ультраструктуру тканей и взаимодействие клеток с клетками(рисунок 5, рисунок 6, рисунок 7, рисунок 8, рисунок 9). Кроме того, после того, как реконструкции были созданы, можно использовать данные, присущие реконструкциям, для извлечения большого количества информации из сегментированной ткани. Параметры, варьирующиеся от площади поверхности, объема, длины и расстояния, а также угловые данные легко доступны после создания реконструкции50,51. Хотя это может быть невероятно полезно, особенно в сочетании с видео и изображениями, взятыми из реконструированных наборов данных, время, необходимое для ручной сегментации, является важным фактором при попытке экстраполировать данные из наборов данных SBF-SEM. В настоящее время существует множество как бесплатных, так и покупаемых программ для ручной и полуручной сегментации стеков изображений SBF-SEM. Одним из бесплатных вариантов программного обеспечения для реконструкции является пакет обработки изображений Fiji для ImageJ, программа обработки изображений с открытым исходным кодом, которая содержит плагин редактора сегментации, который позволяет вручную сегментировать52,53. Кроме того, программное обеспечение Reconstruct предлагает альтернативный вариант свободной сегментации54 (рисунок 8). Несмотря на потенциальную дороговизму, приобретаемые опции часто содержат более надежные наборы функций, такие как полуавтоматические процессы сегментации или наборы для создания фильмов и изображений. Один из таких вариантов был использован для создания реконструкций, найденных на рисунке 5, рисунке 6, рисунке 7 и рисунке 9 (подробности доступны в таблице материалов). Кроме того, доступны инструменты для создания, анализа и рендеринга контрастных 3D-реконструкций с использованием виртуальной реальности с потенциалом значительно ускорить процесс реконструкции20,55. Хотя это не всегда доступно для всех приложений, для компьютерной ручной сегментации доступно множество программных средств, которые могут значительно сократить время, необходимое для сегментации56,57,58. Независимо от используемого программного обеспечения, значительной предусмотрительности и понимания вопроса, на который дается ответ, или пробела в знаниях, который необходимо заполнить, последовательные реконструкции должны предшествовать сегментации, поскольку процесс является трудоемким и трудоемким.
Производство 3D-реконструкций имеет свои собственные соображения. При больших наборах данных вычислительная мощность может быть ограничивающим фактором, и поэтому оптимизация использования системных ресурсов может иметь решающее значение для поддержания продуктивного рабочего процесса и ускорения процесса реконструкции и рендеринга. При рендеринге 3D-реконструкции большинство программ преобразует сегментированные стеки изображений в поверхность, состоящую из взаимосвязанных треугольников. Если проект реконструкции большой или сложный, рендеринг этих треугольников может потребовать большой вычислительной мощности. При работе над 3D-реконструкцией может быть полезно ограничить количество треугольников, которые программное обеспечение реконструкции может использовать для преобразования сегментированных изображений в реконструированные поверхности. Это может быть полезно для мониторинга хода 3D-реконструкции в процессе сегментации. После завершения сегментации ограничение треугольника может быть снято перед рендерингом изображений или видео реконструкций. В качестве альтернативы, и если программное обеспечение реконструкции позволяет это, мы добились успеха в мониторинге хода реконструкции с использованием объемного рендеринга, а не поверхностной генерации. Объемный рендеринг, хотя и не подходит для изображений или видео, предназначенных для публикации или презентации, требует гораздо меньшей вычислительной мощности и, как таковой, может быть полезен для обеспечения плавного опыта при реконструкции и подготовке изображений и видео реконструкций. Кроме того, при ручной сегментировке набора данных SBF-SEM рекомендуется определить каждый реконструируемый объект с собственным уникальным идентификатором. Например, если реконструируется поле эпителиальных клеток, вместо того, чтобы присваивать все эпителиальные клетки в воксельную группу под названием «эпителий», каждой эпителиальной клетке должно быть присвоено свое собственное прозвище (например, Epi1, Epi2, Epi3 и т. Д.). Это дает большую свободу, когда реконструкция завершена, так как каждая ячейка может быть либо включена, либо исключена из окончательного рендеринга, назначены различные цвета или прозрачные каналы, или удалена или введена индивидуально, если создается видео. Кроме того, это позволяет собирать такие метрики, как площадь поверхности или объем, из каждого реконструированного объекта, а не для группы объектов в целом.
Еще одним невероятно мощным инструментом для извлечения количественных данных из стеков изображений SBF-SEM является практика стереологии. Стереология использует преимущества присущих математических отношений между трехмерными объектами и их двумерными представлениями (т. е. электронными микроснимками). Наборы данных SBF-SEM идеально подходят для применения стереологии, так как этот метод извлечения 3D-информации из больших наборов данных значительно менее трудоемкий по сравнению с сегментированной реконструкцией. Стереология обычно состоит из применения геометрических сеток к случайным, равномерно отобранным изображениям и широко использовалась в течение последних 50 лет для получения точных и непредвзятых оценок числа клеток / органелл, длины, площади поверхности и объема21,59,60,61,62,63. Хотя 3D-реконструкции могут быть впечатляющими и обеспечивают новый взгляд на биологические ткани, часто более быстрым, точным, воспроизводимым и способствующим большим размерам выборки использовать стереологический подход к извлечению данных. Хотя существует много работ, обсуждающих практическое применение стереологии64,65,66,ряд учебников предоставляют полезные, углубленные обзоры методологии, а также предоставляют ряд стереологических сеток, которые могут быть применены к изучению ультраструктурытканей 67,68,69.
SBF-SEM - это мощный метод визуализации, который позволяет трехмерную оценку ультраструктуры тканей. В то время как возможность создавать 3D-наборы данных с разрешением SEM ставит ранее неразрешимые вопросы в пределах нашей досягаемости, правильная подготовка тканей и понимание визуализации SBF-SEM имеют первостепенное значение для успеха исследований, в которые используется этот метод микроскопии. Мы надеемся, что применение этого протокола к будущим исследованиям приведет ко все большему и большему пониманию биологических тайн, которые нас окружают, и продолжит подталкивать нас дальше к границам человеческого знания.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы хотели бы поблагодарить д-ра Сэма Хэнлона, Эвелин Браун и Маргарет Гондо за их прекрасную техническую помощь. Это исследование было частично поддержано Национальными институтами здравоохранения (NIH) R01 EY-018239 и P30 EY007551 (Национальный институт глаз), частично Фондом льва для зрения, а частично NIH 1R15 HD084262-01 (Национальный институт детского здоровья и развития человека).
Материалы
| Name | Company | Catalog Number | Comments |
| 1/16 x 3/8 Aluminum Rivets | Industrial Rivet & Fastener Co. | 6N37RFLAP/1100 | Used as specimen pins. |
| 2.5mm Flathead Screwdriver | Wiha Quality Tools | 27225 | |
| Acetone | Electron Microscopy Sciences | RT 10000 | Used to dilute silver paint. |
| Aspartic Acid | Sigma-Aldrich | A8949 | |
| Calcium Chloride | FisherScientific | C79-500 | |
| Conductive Silver Paint | Ted Pella | 16062 | |
| Denton Desk-II Vacuum Sputtering Device equipped with standard gold foil target | Denton Vacuum | N/A | This is the gold-sputtering device used by the authors, alternates are acceptable. |
| Double-edged Razors | Fisher Scientific | 50-949-411 | |
| Embed 812 | Electron Microscopy Sciences | 14120 | |
| Gatan 3View2 mounted in a Tescan Mira3 Field emission SEM | Gatan & Tescan | N/A | This is the SBF-SEM device used by the authors, alternates are acceptable. |
| Glass Shell Vials, 0.5 DRAM (1.8 ml) | Electron Microscopy Sciences | 72630-05 | |
| Gluteraldehyde | Electron Microscopy Sciences | 16320 | |
| Gorilla Super Glue - Impact Tough | NA | NA | Refered to as cyanoacrylate glue in text. |
| Ketjen Black | HM Royal | EC-600JD | Refered to as carbon black in text. |
| KOH | FisherScientific | 18-605-593 | |
| Lead Nitrate | Fisher Scientific | L62-100 | |
| Microwave | Pelco | BioWave Pro | This is the microwave used by the authors, alternates are acceptable. |
| Osmium Tetroxide | Sigma-Aldrich | 201030 | |
| Potassium Ferrocyanide | Sigma-Aldrich | P9387 | |
| Silicone Embedding Mold | Ted Pella | 10504 | |
| Sodium Cacodylate Trihydrate | Electron Microscopy Sciences | 12300 | |
| Samco Transfer Pipette | ThermoFisher Scientific | 202 | Used to make specimen pin storage tubes. |
| Swiss Pattern Needle Files | Electron Microscopy Sciences | 62115 | |
| Thiocarbohydrazide | Sigma-Aldrich | 223220 | |
| Uranyl Acetate | Polysciences, Inc. | 21447-25 | |
| Reconstruction Software | |||
| Amira Software | Thermo Scientific | N/A | Used to create the reconstructions found in figures 5-7 and 9. |
| Fiji (Fiji is Just ImageJ) | ImageJ.net | N/A | TrakEM2 can be added to Fiji to asist in manual segmentation. |
| Microscopy Image Browser (MIB) | University of Helsinki, Institute of Biotechnology | N/A | |
| Reconstuct Software | Neural Systems Lab | N/A | |
| SuRVoS Workbench | Diamond Light Source & The University of Nottingham | N/A | |
| SyGlass | IstoVisio, Inc. | N/A | Allows for reconstruction in virtual reality and histogram-based reconstruction methods. |
Ссылки
- Leighton, S. B. SEM images of block faces, cut by a miniature microtome within the SEM - a technical note. Scanning Electron Microscopy. , 73-76 (1981).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three-dimensional tissue nanostructure. PLOS Biology. 2 (11), 329 (2004).
- He, Q., Hsueh, M., Zhang, G., Joy, D. C., Leapman, R. D. Biological serial block face scanning electron microscopy at improved z-resolution based on Monte Carlo model. Scientific Reports. 8 (1), 12985 (2018).
- Zankel, A., Wagner, J., Poelt, P. Serial sectioning methods for 3D investigations in materials science. Micron. 62, 66-78 (2014).
- Titze, B., Genoud, C. Volume scanning electron microscopy for imaging biological ultrastructure. Biology of the Cell. 108 (11), 307-323 (2016).
- Ohta, K., et al. Beam deceleration for block-face scanning electron microscopy of embedded biological tissue. Micron. 43 (5), 612-620 (2012).
- Bouwer, J. C., et al. Deceleration of probe beam by stage bias potential improves resolution of serial block-face scanning electron microscopic images. Advanced Structural and Chemical Imaging. 2 (1), 11 (2017).
- Kizilyaprak, C., Longo, G., Daraspe, J., Humbel, B. M. Investigation of resins suitable for the preparation of biological sample for 3-D electron microscopy. Journal of Structural Biology. 189 (2), 135-146 (2015).
- Kittelmann, M., Hawes, C., Hughes, L. Serial block face scanning electron microscopy and the reconstruction of plant cell membrane systems. Journal of Microscopy. 263 (2), 200-211 (2016).
- Biazik, J., Vihinen, H., Anwar, T., Jokitalo, E., Eskelinen, E. L. The versatile electron microscope: an ultrastructural overview of autophagy. Methods. 75, 44-53 (2015).
- Peddie, C. J., Collinson, L. M. Exploring the third dimension: Volume electron microscopy comes of age. Micron. 61, 9-19 (2014).
- Piňos, J., Mikmeková, &. #. 3. 5. 2. ;., Frank, L. About the information depth of backscattered electron imaging. Journal of Microscopy. 266 (3), 335-342 (2017).
- Smith, D., Starborg, T. Serial block face scanning electron microscopy in cell biology: Applications and technology. Tissue Cell. 57, 111-122 (2019).
- Goggin, P., et al. Development of protocols for the first serial block-face scanning electron microscopy (SBF SEM) studies of bone tissue. Bone. 131, 115107 (2020).
- Deerinck, T. J., et al. High-performance serial block-face SEM of nonconductive biological samples enabled by focal gas injection-based charge compensation. Journal of Microscopy. 270 (2), 142-149 (2018).
- Nguyen, H. B., et al. Conductive resins improve charging and resolution of acquired images in electron microscopic volume imaging. Scientific Reports. 6, 23721 (2016).
- Deerinck, T. J., Bushong, E. A., Thor, A., Ellisman, M. H. NCMIR methods for 3D EM: a new protocol for preparation of biological specimens for serial block face scanning electron microscopy. National Center for Microscopy and Imaging Research. 6 (8), (2010).
- Deerinck, T. J., et al. Enhancing Serial Block-Face Scanning Electron Microscopy to Enable High Resolution 3-D Nanohistology of Cells and Tissues. Microscopy and Microanalysis. 16, 1138-1139 (2010).
- Kubota, Y. New developments in electron microscopy for serial image acquisition of neuronal profiles. Microscopy (Oxf). 64 (1), 27-36 (2015).
- Courson, J. A., et al. Serial block-face scanning electron microscopy: A provocative technique to define 3-dimensional ultrastructure of microvascular thrombosis. Thrombosis Research. 196, 519-522 (2020).
- Courson, J. A., et al. Serial block-face scanning electron microscopy reveals neuronal-epithelial cell fusion in the mouse cornea. PLoS One. 14 (11), 0224434 (2019).
- Lafontant, P. J., et al. Cardiac Myocyte Diversity and a Fibroblast Network in the Junctional Region of the Zebrafish Heart Revealed by Transmission and Serial Block-Face Scanning Electron Microscopy. PLoS One. 8 (8), 72388 (2013).
- Hanlon, S. D., Behzad, A. R., Sakai, L. Y., Burns, A. R. Corneal stroma microfibrils. Experimental Eye Research. 132, 198-207 (2015).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Davenport, A. T., Grant, K. A., Szeliga, K. T., Friedman, D. P., Daunais, J. B. Standardized method for the harvest of nonhuman primate tissue optimized for multiple modes of analyses. Cell Tissue Bank. 15 (1), 99-110 (2014).
- Schuster, A., et al. An isolated perfused pig heart model for the development, validation and translation of novel cardiovascular magnetic resonance techniques. Journal of Cardiovascular Magnetic Resonance. 12 (1), 53 (2010).
- Hanlon, S. D., Patel, N. B., Burns, A. R. Assessment of postnatal corneal development in the C57BL/6 mouse using spectral domain optical coherence tomography and microwave-assisted histology. Experimental Eye Research. 93 (4), 363-370 (2011).
- Longiéras, N., Sebban, M., Palmas, P., Rivaton, A., Gardette, J. L. Multiscale approach to investigate the radiochemical degradation of epoxy resins under high-energy electron-beam irradiation. Journal of Polymer Science Part A: Polymer Chemistry. 44 (2), 865-887 (2006).
- Hashimoto, T., Thompson, G. E., Zhou, X., Withers, P. J. 3D imaging by serial block face scanning electron microscopy for materials science using ultramicrotomy. Ultramicroscopy. 163, 6-18 (2016).
- Rouquette, J., et al. Revealing the high-resolution three-dimensional network of chromatin and interchromatin space: A novel electron-microscopic approach to reconstructing nuclear architecture. Chromosome Research. 17 (6), 801 (2009).
- Briggman, K. L., Helmstaedter, M., Denk, W. Wiring specificity in the direction-selectivity circuit of the retina. Nature. 471 (7337), 183-188 (2011).
- Katoh, K. Microwave-Assisted Tissue Preparation for Rapid Fixation, Decalcification, Antigen Retrieval, Cryosectioning, and Immunostaining. International Journal of Biochemistry & Cell Biology. 2016, 7076910 (2016).
- Login, G. R., Dvorak, A. M. A review of rapid microwave fixation technology: its expanding niche in morphologic studies. Scanning. 15 (2), 58-66 (1993).
- Jamur, M. C., Faraco, C. D., Lunardi, L. O., Siraganian, R. P., Oliver, C. Microwave fixation improves antigenicity of glutaraldehyde-sensitive antigens while preserving ultrastructural detail. Journal of Histochemistry and Cytochemistry. 43 (3), 307-311 (1995).
- Leong, A. S., Sormunen, R. T. Microwave procedures for electron microscopy and resin-embedded sections. Micron. 29 (5), 397-409 (1998).
- Willingham, M. C., Rutherford, A. V. The use of osmium-thiocarbohydrazide-osmium (OTO) and ferrocyanide-reduced osmium methods to enhance membrane contrast and preservation in cultured cells. Journal of Histochemistry and Cytochemistry. 32 (4), 455-460 (1984).
- Khan, A. A., Riemersma, J. C., Booij, H. L. The reactions of osmium tetroxide with lipids and other compounds. Journal of Histochemistry and Cytochemistry. 9, 560-563 (1961).
- Belazi, D., Solé-Domènech, S., Johansson, B., Schalling, M., Sjövall, P. Chemical analysis of osmium tetroxide staining in adipose tissue using imaging ToF-SIMS. Histochemistry and Cell Biology. 132 (1), 105-115 (2009).
- Rivlin, P. K., Raymond, P. A. Use of osmium tetroxide-potassium ferricyanide in reconstructing cells from serial ultrathin sections. Journal of Neuroscience Methods. 20 (1), 23-33 (1987).
- Aguas, A. P. The use of osmium tetroxide-potassium ferrocyanide as an extracellular tracer in electron microscopy. Stain Technology. 57 (2), 69-73 (1982).
- Seligman, A. M., Wasserkrug, H. L., Hanker, J. S. A new staining method (OTO) for enhancing contrast of lipid--containing membranes and droplets in osmium tetroxide--fixed tissue with osmiophilic thiocarbohydrazide(TCH). Journal of Cell Biology. 30 (2), 424-432 (1966).
- Watson, M. L. Staining of tissue sections for electron microscopy with heavy metals. II. Application of solutions containing lead and barium. Journal of Biophysical and Biochemical Cytology. 4 (6), 727-730 (1958).
- Zhou, W., Apkarian, R., Wang, Z., Joy, D. Fundamentals of Scanning Electron Microscopy. Scanning Microscopy in Nanotechnology. , 1-40 (2006).
- Tapia, J. C., et al. High-contrast en bloc staining of neuronal tissue for field emission scanning electron microscopy. Nature Protocols. 7 (2), 193-206 (2012).
- Buchacker, T., et al. Assessment of the Alveolar Capillary Network in the Postnatal Mouse Lung in 3D Using Serial Block-Face Scanning Electron Microscopy. Frontiers in Physiology. 10, 1357 (2019).
- Keeling, E., et al. 3D-Reconstructed Retinal Pigment Epithelial Cells Provide Insights into the Anatomy of the Outer Retina. International Journal of Molecular Sciences. 21 (21), (2020).
- Shang, P., et al. Chronic Alcohol Exposure Induces Aberrant Mitochondrial Morphology and Inhibits Respiratory Capacity in the Medial Prefrontal Cortex of Mice. Frontiers in Neuroscience. 14, 561173 (2020).
- Pfeifer, C. R., et al. Quantitative analysis of mouse pancreatic islet architecture by serial block-face SEM. Journal of Structural Biology. 189 (1), 44-52 (2015).
- Wilke, S. A., et al. Deconstructing complexity: serial block-face electron microscopic analysis of the hippocampal mossy fiber synapse. Journal of Neuroscience. 33 (2), 507-522 (2013).
- Cocks, E., Taggart, M., Rind, F. C., White, K. A guide to analysis and reconstruction of serial block face scanning electron microscopy data. Journal of Microscopy. 270 (2), 217-234 (2018).
- Borrett, S., Hughes, L. Reporting methods for processing and analysis of data from serial block face scanning electron microscopy. Journal of Microscopy. 263 (1), 3-9 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529 (2017).
- Fiala, J. C. Reconstruct: a free editor for serial section microscopy. Journal of Microscopy. 218, 52-61 (2005).
- Pidhorskyi, S., Morehead, M., Jones, Q., Spirou, G., Doretto, G. syGlass: interactive exploration of multidimensional images using virtual reality Head-mounted displays. arXiv . , (2018).
- Cardona, A., et al. TrakEM2 software for neural circuit reconstruction. PLoS One. 7 (6), 38011 (2012).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy Image Browser: A Platform for Segmentation and Analysis of Multidimensional Datasets. PLOS Biology. 14 (1), 1002340 (2016).
- Luengo, I., et al. SuRVoS: Super-Region Volume Segmentation workbench. Journal of Structural Biology. 198 (1), 43-53 (2017).
- Anderson, H. R., Stitt, A. W., Gardiner, T. A., Archer, D. B. Estimation of the surface area and volume of the retinal capillary basement membrane using the stereologic method of vertical sections. Analytical & Quantitative Cytology & Histology. 16 (4), 253-260 (1994).
- Gibbons, C. H., Illigens, B. M., Wang, N., Freeman, R. Quantification of sweat gland innervation: a clinical-pathologic correlation. Neurology. 72 (17), 1479-1486 (2009).
- Knust, J., Ochs, M., Gundersen, H. J., Nyengaard, J. R. Stereological estimates of alveolar number and size and capillary length and surface area in mice lungs. Anat Rec. 292 (1), 113-122 (2009).
- Mahon, G. J., et al. Chloroquine causes lysosomal dysfunction in neural retina and RPE: implications for retinopathy. Current Eye Research. 28 (4), 277-284 (2004).
- Michel, R. P., Cruz-Orive, L. M. Application of the Cavalieri principle and vertical sections method to lung: estimation of volume and pleural surface area. Journal of Microscopy. 150, 117-136 (1988).
- Weibel, E. R. Stereological methods in cell biology: where are we--where are we going. Journal of Histochemistry and Cytochemistry. 29 (9), 1043-1052 (1981).
- Schmitz, C., Hof, P. R. Design-based stereology in neuroscience. Neuroscience. 130 (4), 813-831 (2005).
- Kristiansen, S. L., Nyengaard, J. R. Digital stereology in neuropathology. Apmis. 120 (4), 327-340 (2012).
- Howard, C. V., Reed, M. G. . Unbiased Stereology. 2nd edn. , (2005).
- Reith, A., Mayhew, T. M. . Stereology and Morphometry in Electron Microscopy: Problems and Solutions. , (1988).
- Mouton, P. R. . Principles and practices of unbiased stereology: an introduction for bioscientists. , (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены