Method Article
生体組織試料のシリアルブロック顔走査電子顕微鏡(SBF-SEM)
要約
このプロトコルは、強力な3Dイメージング技術であるシリアルブロック顔走査電子顕微鏡(SBF-SEM)を使用するための日常的な方法を概説しています。SBF-SEMヒンジの適用に成功し、適切な固定および組織染色技術に加え、イメージング設定を慎重に検討します。このプロトコルには、このプロセス全体に対する実用的な考慮事項が含まれています。
要約
シリアルブロック顔走査電子顕微鏡(SBF-SEM)は、数百から数千の連続登録された超構造画像の収集を可能にし、組織微小解剖学の前例のない3次元ビューを提供します。SBF-SEMは近年、使用が急激に増加していますが、このイメージングモダリティの成功には、適切な組織調製やイメージングパラメータなどの技術的側面が最も重要です。このイメージングシステムは、デバイスの自動化された性質から恩恵を受け、イメージングプロセス中に顕微鏡を放置することができ、1日で何百もの画像を自動収集することができます。しかし、適切な組織製剤がなければ、細胞の超構造は、誤った結論や誤解を招く結論が導かれるような方法で変更することができます。さらに、画像は、樹脂組み込み生物学的サンプルのブロック面をスキャンすることによって生成され、これはしばしば対処しなければならない課題と考慮事項を提示します。「組織充電」と呼ばれるイメージング中のブロック内の電子の蓄積は、コントラストの喪失と細胞構造を理解できないことにつながる可能性があります。さらに、電子ビームの強度/電圧を上げたり、ビームスキャン速度を下げたりすると画像解像度が向上しますが、これはまた、樹脂ブロックを損傷し、イメージングシリーズの後続の画像を歪めるという不幸な副作用を持つことができます。ここでは、細胞の超構造を維持し、組織の充電を減少させる生体組織サンプルの調製のためのルーチンプロトコルを提示する。また、組織ブロックへのダメージを最小限に抑えた高品質のシリアル画像の迅速な取得に関する画像化に関する考慮事項も提供しています。
概要
シリアルブロック顔走査電子顕微鏡(SBF-SEM)は、1981年にレイトンによって最初に説明され、樹脂に埋め込まれた組織の薄い部分を切断して画像化できる内蔵のミクロトームで増強された走査型電子顕微鏡を作りました。残念ながら、技術的な制限は、生体組織などの非導電性サンプルが許容できないレベルの充電(組織サンプル内の電子蓄積)を蓄積したように、その使用を導電性試料に制限した。蒸発した炭素減らされたティッシュの充満で切り傷の間のブロック面をコーティングする間、この画像取得時間およびイメージ貯蔵は、当時のコンピュータ技術が装置によって作成された大きなファイルサイズを管理するのに不十分であったため、問題が残った。この方法論は、可変圧室2を搭載したSBF-SEMを用いて、2004年にデンクとホルストマンによって再検討された。これにより、サンプル内の充電を低減するイメージングチャンバに水蒸気を導入することができ、非導電性サンプルのイメージングは、画像解像度の損失とはいえ実行可能になります。組織調製法およびイメージング法のさらなる改善により、高真空を用いたイメージングが可能となり、SBF-SEMイメージングは、もはや、充電3、4、5、6、7、8、9を放散するために水蒸気に依存しなくなりました。SBF-SEMは近年、使用が急激に増加していますが、このイメージングモダリティの成功には、適切な組織調製やイメージングパラメータなどの技術的側面が最も重要です。
SBF-SEMは、3-5 nm10、11の小さな平面解像度で、何千もの連続登録電子顕微鏡画像の自動収集を可能にします。重金属を含浸させ、樹脂に埋め込まれた組織は、ダイヤモンドナイフを取り付けた超ミクロトームを含む走査型電子顕微鏡(SEM)内に配置される。平らな表面をダイヤモンドナイフで切断し、ナイフを引き込み、ブロックの表面を電子ビームでラスターパターンでスキャンして組織の超構造の画像を作成します。次に、ブロックは「z ステップ」と呼ばれる z 軸で指定された量 (例えば 100 nm) を上げ、プロセスが繰り返される前に新しいサーフェスがカットされます。このようにして、組織が切り取られると、画像の3次元(3D)ブロックが生成されます。このイメージングシステムは、デバイスの自動化された性質からさらに恩恵を受け、イメージングプロセス中に顕微鏡を放置することができ、1日で何百もの画像を自動収集することができます。
SBF-SEMイメージングは主にブロック面の画像を形成するために後方散乱電子を使用するが、二次電子は、撮像プロセス12の間に生成される。二次電子は、ブロックから逃げない後方散乱型電子や一次ビーム電子と並んで蓄積し、ブロック面に局在する静電場につながる「組織充電」を生み出す。この電子蓄積は、画像を歪めたり、ブロックから放出される電子を発生させ、後方散乱検出器によって集められた信号に寄与し、信号対雑音比13を減少させる。組織の帯電のレベルは、電子線の電圧または強度を低減させることによって減少させることができるが、またはビームのドウェル時間を短縮するが、これは減少する信号対雑音比14をもたらす。低電圧または強度の電子ビームを使用する場合、またはビームが各ピクセル空間内に短期間だけ収まる場合、組織から放出される後方散乱電子が少なく、より弱い信号をもたらす電子検出器によって捕捉される。デンクとホルストマンは、チャンバーに水蒸気を導入することによってこの問題に対処し、それによって画像解像度を犠牲にしてチャンバーとブロック面の電荷を低減した。チャンバー圧力が10-100 Paの場合、電子ビームの一部が散乱して画像ノイズや分解能の損失を起こしますが、試料室ではイオンが生成され、サンプルブロック2内の電荷が中和します。サンプルブロック内の電荷を中和する方法は、撮像中にブロック面上に窒素の焦点ガス注入を使用する、またはプローブビーム集荷エネルギーを減少させ、6、7、15を集めた信号を増加させるためにSBF-SEM段階に負の電圧を導入する。ステージバイアスを導入するのではなく、チャンバー圧力や局在窒素注入をブロック表面への電荷蓄積を低減させ、より積極的な撮像設定16を可能にする樹脂ミックスにカーボンを導入することにより樹脂の導電率を高めることも可能である。以下の一般的なプロトコルは、2010年に発表されたDeerinckら.プロトコルの適応であり、高分解能画像取得3、17、18、19を維持しながら組織の充電を最小限に抑えるために有用であるとわかった組織準備およびイメージング方法論の変更をカバーしている。前述のプロトコルは組織処理と重金属含浸に焦点を当てていますが、このプロトコルはSBF-SEM研究に固有のイメージング、データ分析、および再構築ワークフローに関する洞察を提供します。当研究室では、このプロトコルは、角膜や前部構造を含む多種多様な組織にうまく、再現的に適用されています。 まぶた、涙液および硬直腺、失明および視神経、心臓、肺および気道、腎臓、肝臓、クレマスター筋肉、および大脳皮質/髄質、およびマウス、ラット、ウサギ、モルモット、魚、単層および層状細胞培養、豚、非ヒト霊長類、ヒト20、22、23小さな変更は特定の組織やアプリケーションにとって価値があるかもしれませんが、この一般的なプロトコルは、当社のコアイメージング機能のコンテキストで非常に再現性と有用性が証明されています。
プロトコル
すべての動物は、視力および眼科研究における動物の使用に関する視覚および眼科研究の研究声明およびヒューストン大学検眼動物取り扱いガイドラインに記載されているガイドラインに従って取り扱われました。すべての動物の手順は、彼らが取り扱われた機関によって承認されました:マウス、ラット、ウサギ、モルモット、および非ヒト霊長類の手順はヒューストン大学動物ケアと使用委員会によって承認され、ゼブラフィッシュの手順はDePauuu大学動物ケアと使用委員会によって承認され、豚の手順はベイラー医科大学動物ケアと使用委員会によって承認されました。ヒト組織に関する研究に関する全てのヒト組織はヘルシンキ宣言に従って取り扱われ、適切な機関審査委員会の承認が得られた。
1. 組織処理
- 0.4 Mナトリウムカコチル酸ナトリウム粉末をddH2Oに混合して、0.4 Mのカコチル酸ナトリウム溶液を調製し、バッファーを十分に混合し、pH溶液を7.3に調整します。このバッファーは固定液(ステップ1.3で後述する組成物)、洗浄バッファー、オスミウムおよびフェロシアン化カリウム溶液を作るために使用される。
注:灌流固定は、多くの場合、固定が急速に、体全体で発生するので、SBF-SEM研究のための固定の最良の方法です。スタディ設計内で灌流固定が不可能な場合は、ステップ 1.3 に進みます。 - 動物モデル24、25、26に適切な生理学的圧力で灌流固定を行う。これは、ヘパリン化生理食塩水と固定剤を伴う経心連続灌流を介して行われ、それぞれが生物の上の特定の高さ(例えば、100cm)(例えば、100cm)上に置かれ、固定剤が左心室に流れ込み、右心房で作られた切開部から出て出る。目的の組織は、血液が固定剤に置き換えられるにつれて青白くなり、組織のすべてまたは一部がブランシュしない場合、組織が適切に固定されず、超構造が保存されない可能性があります。
- カミソリの刃または鋭いメスを使用して、2 mm x 2 mm x 2 mm 以下のブロックに組織サンプルをトリミングします。ステップ1.2がスキップされた場合、組織をできるだけ早く浸漬固定できるように迅速にこれを行います。
- あるいは、固定液の下で組織を解剖し、浸漬プロセスを完了するために新鮮な固定剤に移す。固定液の最終組成物は、2.5%グルタルアルデヒドおよび2mM塩化カルシウムを含む0.1Mナトリウムカコジレート緩衝液から構成される。固定は最低2時間室温で、最大4°Cで一晩進みます。 可能であれば、ロッカー/チルトプレートを使用して、固定中にサンプルを静かに攪拌します。
- あるいは、インバータマイクロ波が利用可能な場合は、1分間、1分間の4サイクルで150ワットの真空下で前述の固定剤で組織を固定する。マイクロ波固定は、組織を迅速に固定し、組織の超構造27を保存するので、ステップ1.3の好ましい方法である。
注:このプロトコル中に組織が乾燥することは決して許されるべきではない、注意して、ある溶液から次の溶液に迅速に組織を移す必要があります。
- 固定組織を2mM塩化カルシウムを含む0.1Mカコチル酸ナトリウム緩衝液中の室温で、それぞれ3分間(合計15分)洗浄します。
- 以下のオスミウムフェロシアン化物溶液を新鮮なものにし、前の洗浄工程中に好ましい。4%オスミウム四酸化溶液(ddH2 Oで調製)を0.2 Mカコチル酸緩衝液中の3%カリウムフェロシアン化物と4mM塩化カルシウムで等量と組み合わせます。前の洗浄ステップの後、この溶液中の組織を暗闇の中の氷の上に1時間置き、ヒュームフードに入れます。
注:オスミウム四酸化物質は、アンプルに入って来黄色の結晶性物質です。オスミウム四酸化溶液を作成するには、アンプルを開き、ddH2Oを追加し、結晶が完全に溶解するまで暗闇の中で3〜4時間超音波処理します。オスミウム四酸化溶液は、透明黄色の溶液であり、溶液が黒である場合オスミウムは減少しており、もはや使用すべきではない。 - オスミウムフェロシアン化物溶液中で組織がインキュベートされている間に、チオカルボヒドラジド(TCH)溶液の調製を開始する。この溶液を新鮮に調製し、1時間オスミウムフェロシアン化物固定期間の終了時に容易に入手できるようにしてください。チオカルボヒドラジド0.1gをddH2Oの10 mLと組み合わせ、この溶液を60°Cのオーブンに1時間置きます。溶液が溶解していることを確認するために、10分ごとに静かに旋回する。使用前に、0.22 μmのシリンジフィルターを使用してこの溶液をフィルターします。
- TCHでインキュベートする前に、室温ddH2O 5xをそれぞれ3分間(合計15分間)洗浄します。
- 組織を濾過したTCH溶液に室温で合計20分間入れる(図1A-C)。
- TCHでインキュベーションした後、室温ddH2Oで各3分間(合計15分)の組織を5x洗浄する。
- 2%オスミウム四酸化(フェロシアン化カリウムで還元しないオスミウム)を室温で30分間含むddH2Oに組織を入れる。これは、ヒュームフードで、オスミウムが光によって減少することができるように暗闇の中で行われるべきです(例えば、アルミニウム箔の下で) (図1D-F)。
- 四酸化オスミウムインキュベーションに続き、室温ddH2Oでそれぞれ3分間(合計15分)の組織を5倍洗浄する。
- 組織を1%酢酸尿素水溶液(ウラニル酢酸粉末ddH2O中に混合)を冷蔵庫に一晩4°Cで入れる。
- 冷蔵庫からティッシュを取り出す直前に、新鮮なウォルトンの鉛アスパラギンス溶液を準備します。0.03 Mアスパラギン酸溶液(蒸留水10mLで0.04 gアスパラギン酸)の10mLに0.066gの硝酸鉛を溶解し、1N KOH(蒸留水10mLで0.5611g)でpHを5.5に調整します。
注意: pHを調整するときに沈殿物が形成される可能性があります。これは受け入れられません。- 攪拌バーを使用して、pHを監視しながら1 N KOHをゆっくりと滴下します。完成した透明な鉛アスパラギンス溶液を60°Cのオーブンで30分間予熱します。沈殿物が形成された場合、溶液は使用できず、別の溶液を準備する必要があります。
- 冷蔵庫から組織を取り出し、室温ddH2Oでそれぞれ3分間(合計15分)5倍洗浄する。
- 洗浄後、温めたウォルトンの鉛アスパラギンス溶液に組織を30分間入れ、温度を60°Cに保ちます。
- ウォルトンの鉛アスパラギンスでインキュベーションした後、組織を室温ddH2Oでそれぞれ3分間(合計15分)洗浄する(図1G-I)。
- 氷冷アセトンシリーズ(30%、50%、70%、95%、95%、100%、100%、および100%アセトン(該当する場合はddH2O)を介して組織を脱水し、シリーズの各ステップごとに10分を許容する。
- 氷冷脱水系列に続いて、室温アセトンに組織を10分間入れる。
- この間、埋め込み812 ACM樹脂を配合する。それはビーム損傷に対してより耐性であるように「ハードミックス」のレシピを使用してください。樹脂を十分に混合し、4時間埋め込み812:アセトン(1:3ミックス)に組織を入れ、続いて812:アセトン(1:1ミックス)を8時間または一晩埋め込み、最後に埋め込み812:アセトン(3:1ミックス)を一晩で埋め込みます。これらの樹脂浸透工程を室温で行います。
- 翌日、組織を100%Embed 812に入れ、次に新鮮な100%Embed 812で一晩、最後に新鮮な100%埋め込み812に4時間置く。これらの樹脂浸透工程を室温で行います。
- 埋め込む直前に、少量の樹脂を混合容器に入れ、樹脂が粉末で飽和するが、まだ液体で粒状にならないまで、カーボンブラックパウダーにゆっくりと混ぜる(木製スティックを攪拌することができます)。それは厚いインクに似ていて、目に見える塊なしで木製の棒からゆっくりと滴り落ちることができるはずです。
- シリコーンゴム型の組織サンプルを向け、樹脂ブロック内のサンプルの向きが記録され、参照できるように写真を撮ります。シリコンモールドの先端にカーボンブラック飽和樹脂でサンプルを覆い、65°Cで約1時間オーブンに金型を入れます。
- 材料を傾斜に置き、組織サンプルを覆う金型の先端に樹脂を含みます。実験/組織サンプル識別子を持つラベルを、樹脂の反対側の端にある金型に配置します(図2A)。
- オーブンからシリコーンモールドを取り出し、透明な樹脂(カーボンブラックなし)で金型の残りの部分を充填して、ラベルが見える状態を保つようにします。透明樹脂と容易に混ぜないほどカーボンブラックを注入した樹脂を硬化する。
- ティッシュを含まない型の中に余分な井戸を準備する。余分な井戸から始まり、透明な樹脂で金型の残りの部分を埋めます。
- カーボンブラック注入樹脂が透明樹脂にブリードし始めた場合は、シリコーンモールドをオーブンに戻して追加時間(例えば、15分)置きます。
- すべての組織サンプルに透明な樹脂がトッピングされたら、シリコーンモールドをオーブンに戻し(平らで、傾斜なし)65°Cで48時間硬化プロセスを完了します。
2. ブロックの準備
注: この方法は、サンプルがブロック内でどのように向き付けされているか、および断面がどのように行われるかによって異なります。しかし、最も一般的な組織の配向は、樹脂ブロックの先端に中心となる組織を見つけ、樹脂ブロックの長い端に垂直である。
- ほとんどの場合、まず、ブロックの端部をトリムして、標本ブロックをミクロトームチャックに入れ、テーパーエンドをチャックから約5〜6mm突き出して組織を見つけます。セットネジで所定の位置にロックし、ヒートランプの下に置きます。
- 数分後にブロックは可鍛性があり、簡単にトリムできます。分型顕微鏡ホルダーにチャックを置き、ティッシュが見えるまで薄いセクションをブロック面と平行にするために新しい二重刃のカミソリの刃を使用する。これは、ブロック面を横切って光を釣ることによって最もよく見られ、組織サンプルは、組織を欠いている樹脂のそれらの部分に比べて、より少ない反射および粒状になります。カーボンブラック飽和樹脂の導入前に採取した組織サンプルの写真を参考に、組織の位置と場所を知る。
- トリミング目的で1本の検体ピンホルダーを脇に置きます。このピンホルダーは、SEMチャンバに配置されることはありませんので、手袋なしで処理することができ、これはトリミングピンホルダーと呼ばれます。 画像の部屋に置かれる運命の標本のホールダーは手袋なしで触れられてはならない。これは顕微鏡の部屋にグリースおよびオイルを導入することを避ける。
- トリムピンホルダーにアルミニウム製のピンを入れ、ピンホルダーの上に3~4mm保持したピンの面(平らな面)でセットねじを少し締めます。
- ピンの面にいくつかの深い十字架の傷を作り、標本を所定の位置に保持するために使用される接着剤のためのより大きな表面積を提供します。アルミニウム製ピンを使用する場合は、このステップに小さなスチール製のフラットヘッドドライバーをお勧めします(図2B)。
- ティッシュサンプルを含むチャックをヒートランプの下に戻し、樹脂が柔らかく可鍛性になるまで置き、それを実体顕微鏡下のチャック容器に入れます。
- 両刃のカミソリ刃を用いて、組織試料を含む樹脂ブロックの部分から余分な樹脂を切り取る。最終的にピンに取り付けられた組織ブロックのサイズは直径約3mm、高さ2〜3mmになります。
- 約1〜2mmの樹脂ブロックに慎重にカミソリをまっすぐに押し込み、前のカットに等しい深さでレシンブロックに慎重に横方向に押し込みます。組織サンプルを含むブロックの部分を損傷または切り取ることができるので、ゆっくりと細心の注意を払ってこれを行います。2つのカットが合うと、余分な樹脂がブロックから分離します。3 mm x 3 mm の上がった領域が残るまで、樹脂の取り外しを続けます。
- この最初のトリミングの後、数分間、ヒートランプの下にブロック(チャック内に残る)を置きます。
- 樹脂が柔らかく可鍛性になったら、ブロックを実体顕微鏡の下に戻します。新しいダブルエッジカミソリブレードを使用して、樹脂ブロックの上部を切り落とし、トリミングされた部分の約1mm下に、単一の滑らかなカットで切断します。これは、試料のピンに接着されますので、平らな表面が好ましいです。このステップでは、ブロックの除去された部分に転送され、飛び去ることができるいくつかの力が必要となるため、サンプルが失われないように注意してください。カットとトリミングしたサンプルは脇に置きます。
- 切断したアルミニウムピンを含むトリミングピンホルダーを立体型レセプタクルに入れる。シアノアクリル酸接着剤の薄い層をピン面に塗布し、目に見える半月板を形成することなくピンを完全に覆います。鉗子でティッシュブロックのトリミングされた部分を拾い、ピンの面に置きます。組織サンプルを検体ピンの上に中央に置きます。押し下げて数秒間押し続けます。接着剤を数分間設定します。
- 接着剤が完全に乾燥したら、トリミングピンホルダーを実体顕微鏡の下に戻します。細かいファイルを使用して、余分な樹脂をファイルし、ピンに樹脂が張り出さないようにします。樹脂の形状は、円形のピンヘッドに似ているはずです。
- あなたの樹脂ブロックの上げられた部分のティッシュを見つける、斜めの照明はこのために有用である。二重エッジカミソリを使用して、組織サンプルを含む樹脂の隆起部分を1mm2以下の領域にトリミングする必要があります。可能であれば、ブロック面はさらに小さくトリミングすることができ、これはダイヤモンドナイフのストレスを軽減し、その長寿を改善します。
- できるだけ多くの余分な樹脂を取り除き、ブロックを1次元に少し長く残します。これは、あまりにも多くの力が加えられる場合に組織サンプルを含む樹脂が分解することが可能であるため、ゆっくりと注意して行われます。カミソリを推奨しますが、このステップには細かい金属ファイルを使用できます。
- 過剰な樹脂を細かい金属ファイルの角度で、組織試料を含む上げ部の外側の領域において、ピンの端に向かって下降する(図2C)。
- 銀色の塗料を塗布する前に、準備したサンプルから樹脂の粒子とほこりを取り除き、金スパッタリングを施します。銀とアセトンを混ぜて、マニキュアに似た液体(ただし、アプリケーターから滴り落ちるほど薄くない)になるようにし、サンプルブロック表面全体に薄いコートを塗ります。アセトンは急速に蒸発するので、銀色の塗料が増え始めると、アセトンを追加する必要があるかもしれません。
- 顕微鏡に積み込む前に、銀色の塗料を一晩乾燥させます。
注:この銀の層は、1 mm x 1 mm を超えてブロック面を拡大しないように薄くする必要があり、銀色の塗料がダイヤモンドナイフを損傷したことがないが、ダイヤモンドナイフの寿命を維持するために、より小さなブロック面を引き続き推奨します。銀と混合したアセトンは、光学器にアセトン蒸気を導入しないように、金スパッタリングまたはサンプルを顕微鏡にロードする前に完全に蒸発する必要があります。 - 銀色の塗料の適用に続いて、サンプルブロックに金の薄い層を適用します。標準の金箔ターゲットを装備した標準的な真空スパッタリング装置を使用して、200ミリトール(アルゴンガス)と2分間実行する40ミリアンペアのチャンバー圧力は、20 nmの厚い金のコーティングになります。
- 顕微鏡に積み込む前に、銀色の塗料を一晩乾燥させます。
- コーティング後、取り付けられたトリミングされたブロックを適切な実験ラベルを取り付けたチューブに入れてください。使い捨て可能な移動ピペットを使用してカスタムチューブを作成します。
- 転写ピペットを球根のすぐ下に切り、転写ピペットチューブの短い部分を球根端の下に取り付けたままにします。切り取った管状部分を短くし、ピペットチップを十分に切り戻して、アルミニウム製の標本ピンを内側にぴったりと押し込むことができます。
- アルミニウム製の試料ピンを含む端部を、変性転写ピペットの球根端に入れる。
- 準備されたティッシュブロックをロードする前に、ブロック面の表面から余分な銀色のペンキを慎重に切り取る。
3. ブロック面をイメージングするための SEM 設定
注: 以下の画像設定は、著者が使用するデバイスで作成されたもので、提供されている 資料表 に記載されています。この装置は可変的な圧力のイメージ投射が可能である間、最もよい結果は高真空の下で捕獲された。
- ドウェルタイム: シリアル断面の際は12μs/pxを使用してください。対象領域が特定されると、32 μs/pxで高解像度の画像を取得できます。
- 真空設定: 9e-008 Paの銃圧力、1.1e-004 Paの柱圧力、および9.5e-002 Paのチャンバー圧力を使用してください。
- キャプチャ時間: 上記の設定では、イメージあたり 50 秒のレートで 2048x2048 px のイメージ スタックをキャプチャします。対象領域の高解像度画像は、画像あたり 9 分弱で 4096x4096 px でキャプチャできます。
- 断面の厚さ: 100-200 nm を使用します。少ないは可能ですが、低いビーム電圧、強度、またはドウェル時間を必要とする場合があります。
- 高電圧(HV):7-12 kVを使用してください。電圧を大きくするとスポットサイズが小さくなり、解像度が高くなりますが、ビーム損傷の可能性が高まります。高いkVは細部の損失をもたらすビームの浸透を増加させる。しかし、kVを下げると、信号対雑音比(図3)14が低下する。
- ビーム強度(BI): 著者のSBF-SEM装置は1から20までの範囲のビームの強度のスケールを提供する。このスケールでは、5-7の値は、過度の充電やビーム損傷なしで品質の画像を与えます。ただし、BI の解像度が高いほど、充電やビームダメージ14が発生する可能性が高くなります。
- スポットサイズと画像倍率: ビーム強度と電圧レベルでスポットサイズを決定します。スポット サイズは、使用するピクセル サイズよりも大きくならないのが理想的です。ピクセル サイズは、視野 (FOV) をピクセル数で割ることによって決まります。たとえば、25 μm の FOV の画像サイズが 2048x2048 ピクセルの場合、ピクセルあたり 12.2 nm になります。したがって、スポット サイズは 12.2 nm 以下にする必要があります。 図4 は、HV、BI、スポットサイズがどのように関連しているかを示しています。
- 作動距離(WD) - ブロック面イメージングでは、作業距離は調整できません。それは単に焦点の要因です。これは、イメージ化されたすべてのブロックでほぼ同一になります。作動距離は調整できませんが、キャプチャした画像の解像度において重要な役割を果たします。作業距離が短くなるほど、キャプチャした画像の解像度制限が大きくなります。場合によっては、イメージングチャンバー内で変更を行うことで作業距離を短くすることができる場合もありますが、これらの変更はユーザーの裁量で行う必要があります。作業距離を短くして画像解像度を高めるために、ドアマウントミクロトームネジを緩め、ネジを締め直した後、ビーム検出器に約2mm近く置くようにミクロトームを再配置しました。
- 解像度 - 上記の設定を使用して、3.8 nmの高いxとyの解像度が可能です。解像度は、ビームスポットサイズと画像キャプチャのピクセル解像度によって制限されることに注意することが重要です(例えば、2048x2048ピクセル画像で撮影された20μmの視野は、3.8nmのスポットサイズを使用した場合でも、ピクセル解像度は9.8nmです)。z平面における画像解像度は断面厚さに依存しており、100-200 nmはこのプロトコルでうまく機能することがわかります。
結果
マウスコルネア
このプロトコルは、マウス角膜に広く適用されています。SBF-SEMイメージングを用いて、エラスチンフリーマイクロフィブリル束(EFMB)のネットワークが成体マウス角膜内に存在することが示された。以前は、このネットワークは胚性および出生後早期の発達中にのみ存在すると考えられていました。SBF-SEMは角膜全体に広範なEFMBネットワークを明らかにし、断面で測定すると個々の繊維の直径は100〜200nmであることが判明した。また、このEFMBネットワークは、角膜細胞と密接に関連する繊維を持ち、角質細胞表面上の浅い内層に横たわっている異なる層に編成されていたことも明らかになった(図5)。成体角膜におけるEFMB繊維の発見は、免疫金標識透過電子顕微鏡(TEM)に至り、このネットワーク23の性質をさらに理解するための蛍光および共焦点研究である。
このプロトコルのさらなる応用は、間質上皮境界で基底上皮細胞と融合する、これまで知られていなかった中央角膜神経の集団の発見に至った(図6)。以前は、この国境で上皮と相互作用するすべての神経が角膜上皮に浸透し、下基底および上皮のプレキシを産生するランピングされたと考えられていた。この研究では、基底上皮と相互作用する中心神経の約45%が、単純な浸透ではなく細胞細胞融合を受けた。SBF-SEMデータセットに適用された立体的方法を使用して、この新しい神経集団は、その「腫れた」外観と一致する、貫通神経の表面対体積比の約半分を有することを示すことができます(神経融合 - 3.32±0.25、神経浸透 - 1.39±0.14、p ≤0.05)。神経束とそのミトコンドリアを貫通して融合する3D再構成が作成され、神経束の融合部分におけるミトコンドリアの欠如が強調された。SBF-SEMを用いた神経上皮細胞融合の発見により、2つの融合細胞21間の膜連続性を検証する蛍光研究が行われた。
中央角膜は血管組織であり、末梢血管血管系は角膜の全体的な健康にとって特に重要である。この領域の細胞と細胞の関係と超構造は複雑です。しかし、これらの細胞間相互作用と超構造的な結合を理解する能力は、蛍光および単一のセクションTEM研究において制限されている。このため、四肢血管系、神経束、および関連する細胞を含むSBF-SEM画像スタックを3D再構成のために手動でセグメント化した(図7)。この画像では、血管内皮接合部と重なる周皮間の密接な関連は、血管周血管内肥満細胞の個々の顆粒、血管壁の外面に沿って這う好中球の核および前縁、ならびに通過する神経束が見られる。
この研究機関は、細胞外マトリックスや上皮、血管系および関連細胞が豊富な組織で高品質の3D電子顕微鏡データセットを生成するこのプロトコルの能力を実証しています。
高次霊長類のRetina - 神経叢と血管ネットワーク
高次霊長類の神経繊維層(RNFL)は、広範な血管ネットワークを含み、依存する。多くの場合、疾患は、その中に見られる血管系と同様に、筋神経線維層の両方のパラメータの変化を伴う。健康で非病的な組織におけるRNFLとその血管ネットワークとの関係を理解することは、疾患の結果として起こり得るあらゆる変化を理解するための第一歩である。この関係をよりよく理解するために、SBF-SEMプロトコルを正常高次霊長類のレティナに適用し、血管網の再構築を行い、この再構成から抽出された容積データを行った(図8)。この4,642,307 μm3領域のRNFLは、血管床1.207x10-4 μLの体積を含み、RNFLの総容積の2.6%を占めた。この研究は、このプロトコルが緻密な神経組織で高品質の3D電子顕微鏡データセットを生成する能力を実証する。
ゼブラフィッシュとジャイアントダニオハート - 線条体筋と血管構造の発達
ゼブラフィッシュと巨大なダニオの両方が心臓の発達と再生のための重要なモデルです。歴史的に、ゼブラフィッシュの心臓は、ゼブラフィッシュの生理学的要求を支持して一緒に機能する2つの解剖学的に異なる心筋セグメントで構成されていると考えられている。しかし、これら2つの心室層間の界面は十分に理解されなかった。このプロトコルを用いて、線維芽細胞の薄いシートからなる未認識の接合領域が発見された。このシート内の開口部により、2つの別々の心筋セグメントが接触し、デスモソームおよび鼻隠し付着部22を含む複雑な接着接合部を形成することが判明した。
このプロトコルは、開発途上の巨大なダオ心臓の血管ネットワークを調べるさらなる作業に利用されている(図9)。この方法は、発達中の心臓筋細胞ネットワークの3D鑑賞と微小血管系の発達との関係を可能にする。この研究を組み合わせることで、このプロトコルが筋肉および高血管化組織で高品質の3D電子顕微鏡データセットを生成する能力を実証する。
イメージの設定、充電、解像度
SBF-SEMイメージングの品質には適切な固定と重金属染色が必要ですが、同様に重要なのは、取り組む問題に対する導電性樹脂と適切なイメージング設定の使用です。このプロトコルでは、サンプルブロックの導電率を高め、ブロック面からの二次電子のクリアランスのための取り付けピンに導管を提供するためにカーボンブラックを使用する。これは、カーボンブラック16で調製されていない組織の画質を低下させることが多い組織充電と戦うのに有効であることが証明されています。さらに、ブロックに適用される銀色塗料と金スパッタリングは、電子の蓄積のための散逸経路を提供します。一部のデバイスでは、ブロック面の上に窒素のパフを適用することによって充電を低減するフォーカルチャージ補償器の追加を可能にしますが、カーボンブラックの使用とブロック15への銀色塗料と金スパッタリングの適用と同様の成功を収めています。サンプル伝導率の欠如は、組織の充電(図1)として見える電子蓄積、ならびに急激な画像シフトと歪みとして見える放電を引き起こし、画像品質を劇的に低下させる(図10B及びF)。カーボンブラックを使用することで、高真空下での撮像や、高い信号対雑音比と画像解像度の向上を実現する画像設定を使用できます。画質の向上につながる設定の 1 つがピクセルドウェル時間です。SBF-SEMイメージングプロセスでは、サンプル表面を横切る電子ビームのラスタスキャンを行い、顕微鏡検出器が収集して信号として解釈できる反射電子を生成します。このビームが各ピクセルの空間内に収まる時間の長さは、各ピクセル位置に割り当てられるより正確なピクセル値につながります(図3A&B) 2。しかし、ブロック面に与えられる信号対雑音、分解能、ダメージの間にはバランスが取れなければなりません。ビームは、効果的にブロック面に高エネルギーの電子を照射し、樹脂を分解して軟化させ、画像分解や切断合併症を生じる(図10)28。Z解像度が薄くなるほど、高解像度イメージングを維持することが難しくなります。我々は一般的に100-200 nmのzステップを使用しますが、25-50 nmのzステップサイズは5、29、30、31と報告されています。このサイズのzステップでは、ビーム損傷による樹脂の分解と軟化は、ナイフが切断を逃すか、ブロックフェイスを切断する樹脂の圧縮につながる可能性がありますが、ナイフがブロックの表面を横切ってスキップする「チャタ」でリップルとバンド13を作成します。小さなzステップは魅力的な見通しですが、適切なzステップを選択する際には、特定の研究課題を念頭に置いておく必要があります。オーバーサンプリングは、データストレージに関する重要な考慮事項と、3D再構成の作成に必要な時間の増加につながる可能性があります。
組織固定と染色
重金属インキュベーションの前に、組織はグルタルアルデヒドで固定する必要があります。我々は、組織の超構造27の保存のために真空下でのマイクロ波固定を強く推奨するが、実験室グレードのマイクロ波が利用できない場合は、可変ワット数を有する商用インバータマイクロ波を32、33、34、35に置き換えることができる。これを行う場合は、組織の歪みが発生しないように特別な注意を払う必要があります。不適切な組織の固定は、図10Eに見られるように組織形態の変化をもたらす可能性があります。このプロトコルは、ほとんどの現代のSBF-SEM染色プロトコルと同様に、1984年36年にウィリンガムとラザフォードによって作成されたオスミウムチオカルボヒドラジドオスミウム染色に基づいて、201017年にDeerinckによって概説された染色手順から適応されています。このプロトコルで利用される重金属は、組織サンプル内の細胞構造に対して対比を加える(図1)。初期オスミウムインキュベーションは、膜および脂質染色につながる不飽和脂肪中のC=C結合に結合する還元オスミウムで起こる37,38.オスミウムは、フェロシアン化カリウムによって還元され、飽和脂質の染色を補助し、またリン脂質39,40を安定化させる作用をする。チオカルボヒドラジドは、続いて、第1インキュベーションからオスミウムに結合するモルデントとして添加され、プロトコル41の後の段階で更にオスミウムが結合する橋として作用する。ウラン塩であるウラニル酢酸は、脂質、核酸、タンパク質に対して有効な対比剤であり、クエン酸鉛はタンパク質とグリコーゲンのコントラストを高めます。細胞成分に対するこれらの薬剤の様々な親和性は、オスミウムインキュベーション42以上の組織内の全体的なコントラストをさらに高める。
ブロック面のイメージング
図11、図12、図13は、電圧、ピクセルドウェル時間およびビーム強度の組み合わせ効果を示す。従来の練習では、最適なイメージングとサンプルブロックへのビーム損傷を防ぐために必要な低電圧、短いドウェル時間と低ビーム強度の組み合わせが示唆されています。これらの設定とは対照的に、図11、図12、図13は、より高い電圧(例えば、7 kV)、より長いドウェル時間(32 μs /px)および高いビーム強度(我々の場合は6)が従来の設定よりも優れた画質を生み出すことができることを示しています。
SBF-SEMはボクセルから成る3Dデータセットとして収集することができる連続電子顕微鏡画像の収集を可能にする。これはSBF-SEMの非常に強力な使用ですが、この方法はまた、まれな生物学的事象または細胞の迅速かつ再現可能なイメージングを可能にします。SBF-SEMを使用した画像取得は、まれな事象を監視することができ、これらのイベントのより高い倍率/解像度画像を収集するためにイメージングを一時停止します。さらに、透過型電子顕微鏡(TEM)イメージング用に、ブロック面を顕微鏡室およびブロック面から取り外すことができる。このようにして、希少事象の大規模なデータセットは、SBF-SEMを使用して収集することができ、TEMを使用してオングストロームスケールで評価することができます。

図1:プロトコルの様々なステップでのSBF-SEMとTEMの比較 このプロトコルは、サンプル組織が重金属で染色される複数のステップを含む。これは、細胞構造および小器官の組織コントラストおよび鑑賞だけでなく、組織が画像化されるときに起こる充電のレベルにも影響を及ぼす。この図には、調製された組織の3つの異なるビューが含まれています:低倍率ビュー(A、D&G)、高倍率ビュー(B、E&H)、および調製されたマウス角膜(C、F&I)のTEM比較)。より高い倍率画像は、電子線がより小さな組織領域に集中するので、組織の充電を増加させることができることに留意することができる。一番上の行(A-C)は、ステップ1.8の完了まで処理された組織からの代表的な試料であり、フェロシアン化カリウム、四酸化オスミウム、チオカルボヒドラジドを含浸させている。最初の2つの列の矢印は、参照点として上皮間質界面を示しています。下部の2行と比較してコントラストの低いレベルだけでなく、組織の充電のレベルの増加に注意してください。中間行(D-F)のサンプルはステップ1.10の完了によって処理され、追加のオスミウム四酸化ステップの恩恵を受け、最上列のサンプルよりも目に見えて対照的である。細胞構造は識別可能ですが、充電はまだ存在しています。一番下の行(G-I)のサンプルは完全な染色の議定書の恩恵を受け、最低ティッシュの充満を有する。TEMイメージングは、各ステップ(右カラム)に存在する重金属によって与えられた組織コントラストレベルを明らかにする:角膜内皮(*)のオルガネラは、組織処理がプロトコルを通じて続くにつれて、より対照的で明らかである。さらに、間質コラーゲンおよびフィブリリンの詳細は、プロトコルが完了するにつれてより目に見える(矢印頭)になる。パネルA、D&Gスケールバー=50 μmパネルB、E&Hスケールバー=10 μmパネルC、F&Iスケールバー=1μm。 この図の大きなバージョンを表示するにはここをクリックしてください。

図2:埋め込み組織ブロック、検体ピン、最終調製物の模式図.(A)組織は、樹脂金型の先端とカーボンブラック飽和樹脂で満たされた金型の上3分の1の位置に既知の向きに配置する必要があります。実験標識がはっきりと見えるように、組織から最も遠いカビの領域は明確なままであるべきである。(B)検体ピン表面は、グリッドパターンを生成するために傷を付ける必要があり、これは、調製された標本ブロックとピンの間で硬化するシアノクリレート接着剤のためのより大きな接触領域を可能にする。(C)カーボンブラック飽和樹脂は、試料ピンヘッドとの接触の広い領域を作る必要がありますが、ダイヤモンドナイフで切断される領域は1x1 mm以下でなければなりません。先端に向かってブロックをテーパするのが良い習慣です。これはダイヤモンドのナイフの切断力を最小にし、より広い基盤を有することによって、ブロックは、切断中にピンから分離することに対してより耐性である。この図の大きなバージョンを表示するには、ここをクリックしてください。
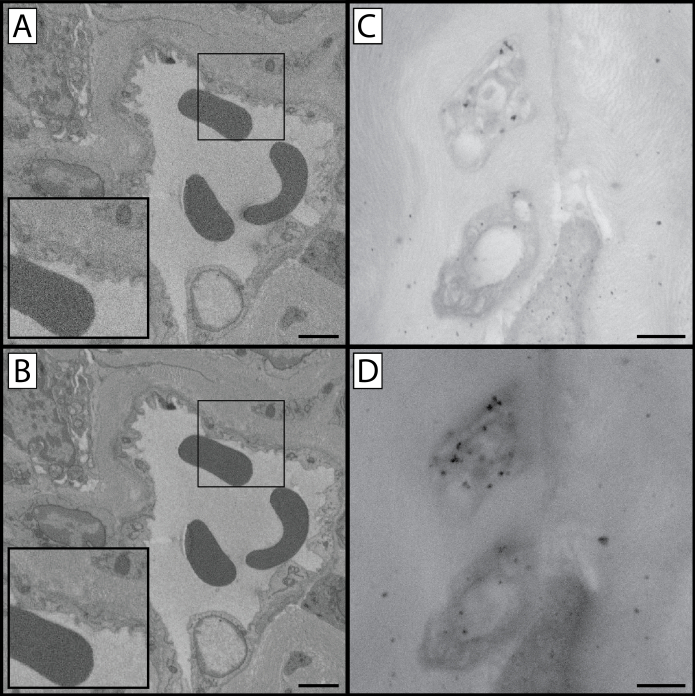
図3:画像キャプチャ設定の比較(AとB)パネルAとBは、画像の品質と解像度をピクセルのドウェル時間の関数として比較します。パネルAは4kVで32μs/ピクセルのドウェル時間を使用して作成され、拡大されたインセットの「粒状」の外観に明らかなように、ノイズ比に対する信号の減少に苦しんでいます。パネルBは、4kVで100μs/ピクセルのドウェル時間を使用して作成されました。ピクセルのドウェル時間を増やすと、信号対ノイズ比が増加し、細胞の詳細のレベルが増加しますが、ピクセルのドウェル時間の増加は、組織の充電や熱の蓄積につながる可能性があり、ブロックを柔らかくし、断面時に切削アーティファクト(チャタ)を導入します。パネルCとDは、同一の露出条件でキャプチャされた画像を比較しますが、ビーム kV 値は異なります。これらのパネルの組織は、ビーム浸透深さの違いをより明白にするために金色のナノゴールド粒子を含浸させた。パネルCは9kVで捕捉され、パネルDは21kVで捕捉された。増加したkVはコントラストの増加(D)の利点を有するが、より深い組織(C)から電子を集めて詳細が失われる。より大きな断面をサンプリングした結果、GAP 43に特異的な多数のイムノゴールド粒子が見える一方で、非特異的標識は同じままであり、信号対雑音比が増加する。パネルA&Bスケールバー= 2 μm. パネルC&Dスケールバー = 1 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。

図4:ビーム強度、kV、スポットサイズ(A)組織試料に接触すると、電子ビーム(水色)は涙形の相互作用体積を生み出し、そこからビーム電子と組織サンプルの相互作用から様々な形のエネルギーが生成される。涙の形状は、ビームエネルギーと共に組織密度と重金属染色の機能であり、電子ビーム43の傾き角としている。X線、オーガー電子、および三次電子はSBF-SEMイメージング中に生成されますが、主な関心事は後方散乱(ダークブルー)および二次(緑色)電子13です。SBF-SEMイメージングで生成された画像は、後方散乱電子を集めることによって生成されます。これらの電子は、ビームと試料の間の弾性相互作用に由来し、収集された信号は相互作用する原子数に大きく依存する-したがって重金属染色44の必要性。二次電子はビームとサンプルの間の非弾性相互作用に由来し、その信号の検出は表面の向きに大きく依存します。ブロック面はSBF-SEMでは平坦であるため、二次電子は集められた信号13に意味を持たないようにする。実際、ブロックの表面上の二次電子蓄積は、充電の主要な源となり得、画像品質2に有害な影響を及ぼす。(B)このグラフは、ビーム強度、ビームkV、スポットサイズの関係を示しています。スポット サイズは、ビームの空間解像度で、生成される画像の解像度の制限を決定します。kVを小さくするとスポットサイズが大きくなりますが、イメージング深度も小さくなり、細部の理解が細くなります。これは検出可能な信号を減らす効果もあります。ビーム強度を高めることは、スポットサイズと信号検出の初期の改善を提供しますが、急速に組織の充電のレベルを増加させます。最終的には、選択されたビーム強度とkV値はサンプル依存的であり、尋ねられる科学的な質問に関連して経験的に最もよく決定されます。この図の大きなバージョンを表示するには、ここをクリックしてください。

図5:マウス角膜中のエラスチンフリーマイクロフィブリル束ネットワーク. 角膜間質内の角質細胞(黄色、オレンジ、緑)と密接に関連する微小フィブリル(白)の3D再構成。マイクロフィブリルは、隣接して見ることができ、そして場合によっては浅い溝内で、角膜角質細胞(矢印)(A)が見られる。エラスチンフリーマイクロフィブリルのこのネットワークは、角膜間質内の異なる層(B)に編成されています。スケールバー= 2 μmイメージブロックの再構築は、x軸とy軸で45x45 μm、22x22x100 nmの解像度をボクセルでz軸で30 μmとします。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図6:間質上皮境界で基底層層を通過する角膜神経の再構築. 基底層層(緑色)を通過する貫通神経(紫色)の3D再構成この神経は、浸透する前に二分するために見ることができます。上皮に浸透した後、両方の神経枝が影響を受けた。ミトコンドリア(黄色)は、神経束の間質および上皮部分に見える。スケールバー= 2.5 μm。イメージブロックの再構築は、x軸とy軸で25x25μm、12x12x100 nmのボクセル解像度を持つz軸で14 μmです。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図7:末梢マウス角膜における四肢血管系および関連細胞3D画像ブロック(B)からの単一の画像(A)は、血管、神経束、および関連する細胞が移動する際に見ることができます。パネルCは、内皮細胞接合部を覆う周囲(灰色)を巻き付けた、関連する血管(赤)を示す。神経束(青)は、組織を通過するこの血管の近くで二分する。好中球(黄色)は、その多形核がその細胞体の中に見え、後ろの尿道動物が画像の右側に向かって突起として見える、血管の長い軸に平行に見ることができる。マストセル(マゼンタ)は、容器の下側に見えます。パネルDは、このマスト細胞を分離し、その顆粒(緑色)が細胞内の核(紫色)を重ね合わせやすく見ることができる。パネルEは、細胞再建に重ね合った細胞構造を強調し、内皮核は青色で示され、粘着性のある微粒子は血管内腔(オレンジ)に見える。矢印は内皮細胞間の細胞細胞境界を示し、血管の明るい側の細胞に沿って伸びる隆起した隆起と見なすことができる。パネルスケールバー= 2 μm。これらの細胞の再構築に使用される画像ブロックは、x軸とy軸で30x30 μm、ボクセル解像度が14.6x4.6x100 nmのz軸で42.5 μmです。この図の大きなバージョンを表示するには、ここをクリックしてください。

図8:ヒト非霊長類の神経線維層の血管網を再構築した。 (A) 8192x8192 pxで撮影した霊長類のRetinaの200x200 μm SBF-SEM画像。サンプリングされた位置は、病理のない健康な眼の下側頭縁部から〜500ミクロンである。パネル C&D で再構築された画像シリーズは2048x2048 pxで撮影され、画像処理は一時停止され、関心のある領域を8192x8192 pxで画像化することができました。パネル B は、パネル Aのインレイ領域で、元のイメージから直接撮影されます。軸索とそのミトコンドリアの数が多い。(C)オルソスライス部は、血管系をセグメント化した制御眼部の200x200x200μmの組織体積を制御眼下側神経線維層に及ぼす。(D) 神経線維層血管系のZ-投影法。このシリーズは、この方法を使用して大きなフィールドで可能な解像度を示しています。パネル A スケールバー = 20 μm. パネル B スケールバー = 2 μmイメージシリーズのボクセルの解像度は97.6x97.6x500 nmです。対象ピクセル解像度の領域は 24.4x24.4 nm です。 この図の大きなバージョンを表示するには、ここをクリックしてください。
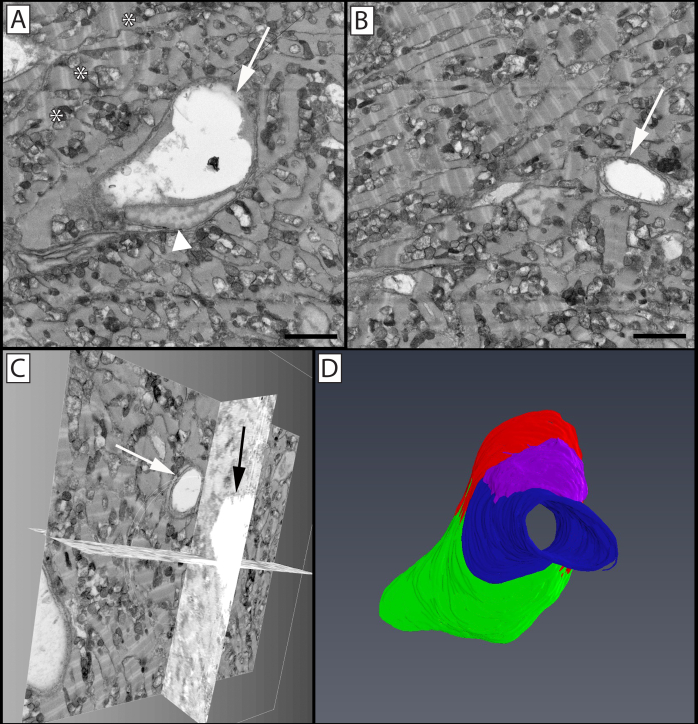
図9:巨大なダニオ(デバリオ・マラバリカス)コンパクト心臓の血管のセグメンテーションと3D体積レンダリング(A)画像スタック内の2次元顕微鏡写真、中央静脈大血管(矢印)と内皮核(矢頭)のプロファイルを示し、ミトコンドリアとよく組織化されたサルコメア(*)を囲む心臓筋細胞を取り囲む。(B)毛細管サイズの容器(矢印)を用いた画像スタックの2次元顕微鏡写真。(C)1つの直交スライスを通して投影されたパネルBの毛細管を示す顕微鏡写真スタックの二元投影。(D)再構成された容器を裏打ちするセグメント化された内皮細胞の3Dレンダリング。緑、赤、青、紫で示されている 4 つの別々の内皮細胞です。青で描かれた内皮細胞はパネルB(矢印)の断面に見られ、赤(矢印)と緑(矢印)で描かれた内皮細胞はパネルAの断面に見られます。イメージブロックの再構築は、x軸とy軸で30x30μm、16 μmの場合はボクセル解像度が14.6x14.6x100 nmのz軸で行われます。この図の大きなバージョンを表示するには、ここをクリックしてください。
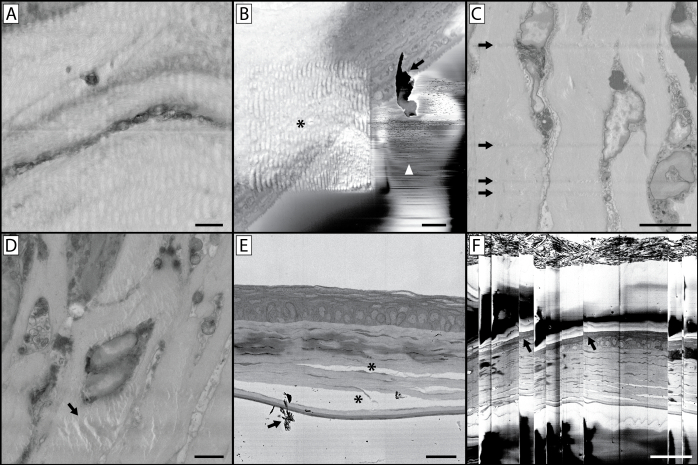
図10: 画像化の複雑さとアーティファクト( A) この画像の波状と歪みのある性質は、長すぎるピクセルのドウェル時間を使用してイメージングした結果です。これは樹脂ブロックを加熱し、ブロック面を柔らかくゴム状のままにして、切断時に歪んだ画像を生じる。(B) この画像には多くの工芸品が含まれています。アスタリスクは、より高い倍率での事前撮像によって引き起こされる波状の歪みを示し、パネル Aに似ており、より長いピクセルの内寄り時間を持つ小さい領域にビームを集中させることで、この関心領域の樹脂が軟化した。収集された高倍率画像にはアーティファクトが含まれなかったが、その後の一連の画像が、対象領域の根底にあるサンプルが歪んでいるように見える可能性がある。また、このパネルは、撮像中のブロック面(矢印)上の破片蓄積の問題を示し、パネル Eの矢印でも示す。これが持続的なイメージングの問題になる場合は、真空を破り、チャンバーを開き、ダイヤモンドナイフとサンプルの周りに蓄積された破片を吹き飛ばす必要があります。ブロック面からの電子の小さな放電は、白い矢印で示される急速なコントラスト変化と線につながることができます。(C) この画像は、ブロック面にナイフの傷を示しています。これは、損傷したナイフ、またはナイフの端に破片の蓄積のために発生する可能性があります。(D)と表記されたアーテファクト(矢印)は、試料が撮像チャンバー内に残っている状態でブロック面に長時間焦点を当てた(断面化せずに)電子ビームの結果である。(E) 組織の不適切な固定は、細胞構造と結合組織の分離につながることができます (*).(F)組織や樹脂ブロックに大量の充電が発生すると、その後の蓄積や放電が発生し、この画像に見られるように「スキップ」画像が生じることがあります。これらのスキップポイント(矢印)での画像内の組織の歪みに注意してください。パネル A スケール バー = 1 μm. パネル B スケール バー = 2 μm. パネル C スケール バー = 5 μm. パネル D スケール バー = 2 μm. パネル E スケール バー = 25 um.パネルFスケールバー= 50 um. この図の大きなバージョンを表示するには、ここをクリックしてください。

図11:様々な画素のドウェル時間とビーム強度を用いて3kVでの組織をイメージングする。 全ての画像は3kVビームを用いて収集し、ビーム強度は1から20までのデバイス固有のスケールである。画像化されたフィールドは、白血球および赤血球を含む血管内腔である。この低kVでは細胞の詳細を理解することは困難である。ピクセルのドウェル時間を増やすことはほとんど効果がなかった。ビーム強度を6に増加させると、画像コントラストが改善されました。 この図の大きなバージョンを表示するには、ここをクリックしてください。
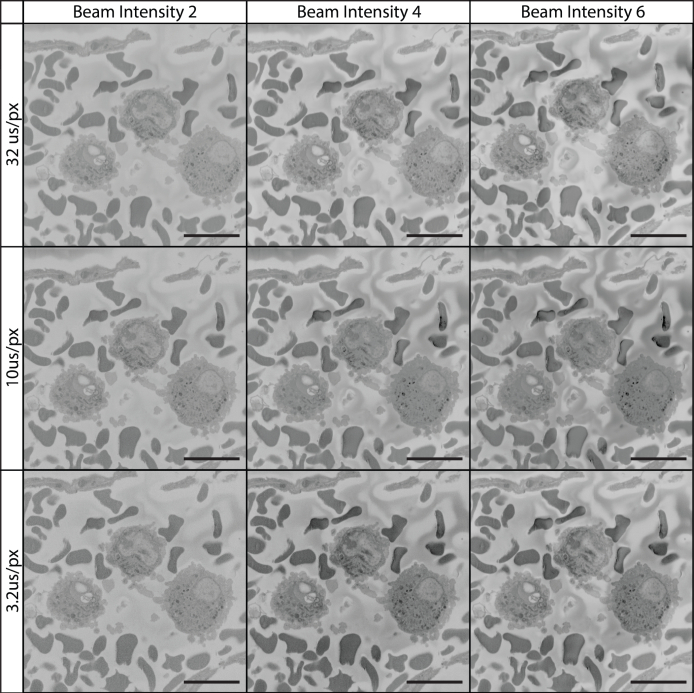
図12:様々な画素のドウェル時間およびビーム強度を用いて7kVでの組織をイメージングする。 全ての画像は7kVビームを用いて収集し、ビーム強度は1から20までの範囲の装置固有のスケールで収集した。画像化されたフィールドは、白血球および赤血球を含む血管内腔である。7 kVでは、ビーム強度とピクセルのドウェル時間の増加は、より高品質のイメージングに貢献しました。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図13:様々な画素のドウェル時間およびビーム強度を用いて12kVでの組織をイメージングする。 全ての画像は12kVのビームを用いて収集し、ビーム強度は1から20までの範囲の装置固有のスケールにある。画像化されたフィールドは、白血球および赤血球を含む血管内腔である。12 kV では、ピクセルのドウェル時間とビーム強度を調整することでイメージングが最適化されます。セルラーディテールと画像コントラストは、ピクセルのドウェル時間が長く、ビーム強度が高いほど、充電はピクセルのドウェル時間が短い場合に減らされる/不在です。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
この方法論文の目的は、当社の研究室が高解像度のシリアル電子顕微鏡画像を確実にキャプチャすることを可能にした組織調製法とイメージング方法論を強調し、この結果につながる重要なステップと、SBF-SEMイメージングを行う際に起こり得る潜在的な落とし穴を指摘することです。このプロトコルを使用して成功するには、組織の適切な固定、サンプルへの重金属の含浸、充填樹脂の改質による充電の低減、画像収集に使用される顕微鏡およびイメージング設定の理解が必要です。「品質、品質アウト」は、SBF-SEMイメージングに適した公理です。SBF-SEMの目標は、多くの場合、超構造詳細の評価または定量化であるため、組織の歪みが発生しないように、固定戦略に特別な注意を払う必要があります。サンプルの調製の任意の時点で組織が歪んだ場合(すなわち、細胞形態の腫脹、縮小、または破壊を受ける)、組織の再構成および量子化は正確なデータを得ない。さらに、誤ったイメージング設定を使用すると、SBF-SEMイメージングが破壊プロセスであるために再キャプチャできないデータの損失につながる可能性があります。また、繊細なダイヤモンドナイフは急いでまたは誤ったサンプル調製によって損傷を受ける可能性がありますので、組織サンプルをロードする際には注意が必要です。これにより、ナイフにチップや破断が生じ、画像に目に見える傷跡が残る可能性があります(図10C)。ダイヤモンドナイフは、石灰化構造、硬顆粒、または誤って埋め込まれたガラス(例えば、試薬アンプルから)によっても損傷を受ける可能性があります。
現在までのSBF-SEM文献の大半は、1〜5μs/pxに近いピクセルの住み合い時間と一緒に1〜3kVの範囲でビーム加速電圧を使用しますが(図 11)45,46,47,48,49現在のプロトコルでは、7~12 kVの加速電圧と、シリアルイメージングでは12 μs/pxのピクセルドウェル時間、対象のイメージング領域では32 μs/pxを使用します(図12及び図13).これらの設定は、100〜200 nmのスライス厚さと結合され、幅広い生体組織の高品質かつ高解像度のイメージングを可能にする。加速電圧の増加により、コントラスト、解像度、信号対雑音比の増加が可能になります。ドウェル時間の増加は解像度と信号対雑音比をさらに増加させ、スライス厚さの増加は断面中のブロック表面の充電の減少につながり、その後の画像でビーム誘発損傷と戦う14.このイメージング方法は慣習とは異なる場合がありますが、生成された画像とデータセットは自分自身を代弁します。この成功の理由を推測する必要がある場合、高いkV値、長いピクセルのドウェル時間、およびブロックの準備のユニークな組み合わせの結果である可能性があります。イメージングkVを増加させると、電子ビームとサンプル間の相互作用量が増加します。この相互作用量は深く、より広く、サンプルブロック内のより深い、またはスポットサイズの涙が大きくなるにつれて組織のより広い断面から発生する電子の数の理論的な増加をもたらす。SBF-SEMはブロックの表面の詳細に興味を持っているため、信号対雑音比の理論上の低下が生じます。しかし、kVの増加はまた、電子をサンプルに深く押し込み、ブロックを脱出し、検出器によって収集された電子に寄与する可能性が低くなります。より長いピクセルのドウェル時間とより高いビーム強度を介して信号を増加させる付加的な利点を用いて、このイメージング法は、相互作用ボリューム内で発生するノイズに関連して、サンプル表面からの信号の増加をもたらす可能性がある。さらに、カーボンブラックと銀および金のコーティングと共に導入されたサンプル伝導率の増加は、ブロック内で、ブロック面からさらに深く発生する電荷の蓄積を改善するのに役立ちます。確かに 図 11, 図 12, 図 13 kVが増加するにつれて、サンプルの充電は、潜在的にブロックに深く押し込まれるにつれて減少し始めていることを示しています。低倍率で画像化されたサンプルは、従来の設定を使用して適切なコントラストでキャプチャできますが、これらの画像は、多くの場合、綿密な検査時に詳細を欠いています。当社のデータは、目標が細胞の詳細である比較的高い倍率を使用すると、従来の設定を増やすと例外的な結果を生じることができることを明確に示しています。P. Gogginによる2020年の記事は、最終的な画質に対する画像設定の変更の効果を概説する有用な表を提供し、新しい組織のためのプロトコルを最適化する必要が生じた場合の相談に役立つ参考資料です14.このプロトコルで推奨される 100~200 nm のスライス厚さには、大規模な SBF-SEM データ セットを迅速に収集できるという利点があります。例えば12μs/pxで画像を収集する間、2048x2048 pxで100μmの深さを通してイメージングを行うには、100nm/sectionで断面化中に約14時間必要ですが、25nm/sectionで切り離した場合は約56時間かかります。断面の厚さの結果として X,Y 解像度は変更されませんが、より大きな kV 値を使用してイメージを作成する機能や、より大きなセクションに付属するピクセルのドウェル時間を考慮する必要はありませんが、Z 軸に沿った解像度が損なわれることに注意することが重要です。Z解像度の損失は重要な考慮事項であり、樹脂ブロック内およびイメージングプレーンに関連して組織をどのように向けるべきかを決定する際に考慮されるべきであり、より小さな細胞の特徴または相互作用(例えば、シナプスイン膣または数十ナノメートルのスケールでの細胞内特徴)の研究を妨げる可能性がある。しかし、迅速なイメージング時間に加えて、このプロトコルは、立体解析だけでなく、まれな生物学的事象または細胞の研究のための理想的なデータセットを迅速に生成するという点で追加の利点を有する。100 nm/sectionで切り離された100 μm領域は1,000枚の画像を手動で分割する必要がありますが、25 nm/sectionで切り離された同じ領域は4,000枚の画像を手動で分割する必要があります。
SBF-SEM には、比較的短期間で大規模なデータセットを生成するという利点があります。データ解析は、以下で説明するステテロロジーなどの定量的手法を用いて行うことができますが、画像セグメンテーションを通じて3D再構成を作成することは有益な場合が多い。SBF-SEMを使用して作成されたイメージスタックはボクセルの集合体と考えることができますが、セグメンテーションは、これらのボクセルをユーザー定義オブジェクトに割り当てるプロセスであり、それによって組織構造の3D表現を作成します。これらの再構成は、多くの場合、組織の超構造および細胞間相互作用に関する、ここまで見えない視点を提供する(図5、図6、図7、図8、図9)。 さらに、再構築が作成されると、再構成に固有のデータを使用して、セグメント化された組織から豊富な情報を抽出することが可能です。表面積、体積、長さ、距離、角度データの範囲のパラメータは、再構築が作成されるとすべて容易に利用できます50,51。これは、特に再構築されたデータセットから取得したビデオや画像と組み合わせる場合には非常に便利ですが、SBF-SEM データセットからデータを推定する際に、手動セグメンテーションに必要な時間は重要な考慮事項です。現在、SBF-SEMイメージスタックの手動および半手動セグメンテーションに利用可能な無料および購入可能なソフトウェアのホストがあります。再構築ソフトウェアのための1つの自由なオプションは、画像処理パッケージのフィジー、オープンソースの画像処理プログラムであり、手動セグメンテーション52、53を可能にするセグメンテーションエディタプラグインが含まれています。さらに、ソフトウェア再構築は、代替の無料セグメンテーションオプション54を提供しています(図8)。コストが高くなる可能性がありますが、購入可能なオプションには、半自動化されたセグメンテーション プロセスやムービーや画像作成スイートなど、より堅牢な機能セットが含まれていることがよくあります。このようなオプションの 1 つを使用して、図5、図 6、図7、図 9 (資料一覧で参照できる) で見られる再構築を作成しました。さらに、仮想現実を用いたコントラストベースの3D再構成の作成、解析、レンダリングにツールが利用可能であり、再構築プロセス20,55を大幅に高速化する可能性がある。すべてのアプリケーションで常に利用できるわけではありませんが、コンピュータ支援の手動セグメンテーションには多くのソフトウェア ツールが用意されており、セグメンテーション56、57、58に必要な時間を大幅に短縮する可能性があります。使用されるソフトウェアに関係なく、かなりの予見と答えられている質問の理解、または連続再構築によって満たされるべき知識のギャップは、プロセスが面倒で時間がかかるため、セグメンテーションの前にする必要があります。
3D再構成の生産には、独自の考慮事項が付属しています。より大きなデータセットの処理能力が制限要因になる可能性があるため、システムリソースの使用を最適化することは、生産的なワークフローを維持し、再構築とレンダリングプロセスをスピードアップするために重要です。3D 再構成をレンダリングする場合、ほとんどのソフトウェアは、セグメント化されたイメージ スタックを相互接続された三角形で構成されるサーフェスに変換します。再構築プロジェクトが大規模または複雑な場合、これらの三角形のレンダリングには多くのコンピューティング能力が必要になる可能性があります。3D 再構成に取り組んでいる間、再構築ソフトウェアがセグメント化された画像を再構成されたサーフェスに変換するために使用できる三角形の数を制限すると便利です。これは、セグメンテーション プロセス中の 3D 再構築の進行状況を監視する場合に役立ちます。セグメンテーションが完了すると、イメージまたは再構成のビデオをレンダリングする前に、三角形の制限を削除できます。あるいは、再構築ソフトウェアがそれを可能にすれば、表面生成ではなくボリュームレンダリングを用いて再構成の進捗を監視する成功を見つけました。ボリューム レンダリングは、公開やプレゼンテーション用の画像やビデオには適していませんが、処理能力が非常に低く、再構築のイメージやビデオを再構築して準備する際にスムーズな操作を提供するのに役立ちます。さらに、SBF-SEM データ・セットを手動でセグメント化して、再構成するすべてのオブジェクトを独自の固有 ID で定義する場合に、ベスト・プラクティスです。例えば、上皮細胞のフィールドが再構築されている場合、すべての上皮細胞を「上皮」と題するボクセル群に割り当てるのではなく、各上皮細胞に独自のモニカー(すなわち、Epi1、Epi2、Epi3など)を割り当てるべきである。これにより、各セルを最終レンダリングに含めたり除外したり、異なる色や透明度を割り当てたり、ビデオが生成されている場合は個別に削除または導入したりできるため、再構築が完了すると、より自由になります。さらに、これにより、オブジェクトグループ全体ではなく、各再構成されたオブジェクトから、表面積や体積などのメトリックを収集できます。
SBF-SEM画像スタックから定量的データを抽出するためのもう一つの非常に強力なツールは、ステテロロジーの実践です。ステレロジーは、3次元物体とその2次元表現(電子顕微鏡写真)との間の固有の数学的関係を利用する。SBF-SEM データセットは、大規模なデータセットから 3D 情報を抽出する方法は、セグメント化された再構築と比較して時間と労力を要する時間が大幅に少ないため、ステテロロジーの適用に最適です。一般に、ステレロジーは、ランダムで均一にサンプリングされた画像に幾何学的グリッドを適用することで構成され、細胞/オルガネラ数、長さ、表面積、および容積21、59、60、61、62、63の正確かつ公平な推定値を生成するために、過去50年間にわたって広く使用されてきました。3D再構成は印象的であり、生物学的組織に関する新しい視点を提供することができますが、多くの場合、データ抽出に対するステレオロジカルなアプローチを使用するために、より速く、より正確で、再現性があり、大きなサンプルサイズを助長します。ステレロジー64、65、66の実用化について議論する論文は多くありますが、多くの教科書は、方法論の有用かつ詳細な概要を提供するだけでなく、組織の超構造67、68、69の研究に適用することができる多くの立体学的グリッドを提供します。
SBF-SEMは、組織の超構造の立体的な鑑定を可能にする強力なイメージング方法です。SEM解像度で3Dデータセットを作成する機能は、これまで答えられなかった質問を手の届くところに置きますが、この顕微鏡法を利用した研究を成功させるためには、適切な組織の準備とSBF-SEMイメージングの理解が最も重要です。このプロトコルを将来の研究に応用することが、私たちを取り巻く生物学的謎に対するより大きな洞察をもたらし、人類の知識のフロンティアに私たちをさらに押し込み続けることを願っています。
開示事項
著者らは開示するものは何もない。
謝辞
サム・ハンロン博士、エブリン・ブラウン博士、マーガレット・ゴンド博士の優れた技術支援に感謝します。この研究は、国立衛生研究所(NIH)R01 EY-018239およびP30 EY007551(国立眼科研究所)の一部、一部はライオン視覚財団、一部はNIH 1R15 HD084262-01(国立小児保健人間開発研究所)によって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| 1/16 x 3/8 Aluminum Rivets | Industrial Rivet & Fastener Co. | 6N37RFLAP/1100 | Used as specimen pins. |
| 2.5mm Flathead Screwdriver | Wiha Quality Tools | 27225 | |
| Acetone | Electron Microscopy Sciences | RT 10000 | Used to dilute silver paint. |
| Aspartic Acid | Sigma-Aldrich | A8949 | |
| Calcium Chloride | FisherScientific | C79-500 | |
| Conductive Silver Paint | Ted Pella | 16062 | |
| Denton Desk-II Vacuum Sputtering Device equipped with standard gold foil target | Denton Vacuum | N/A | This is the gold-sputtering device used by the authors, alternates are acceptable. |
| Double-edged Razors | Fisher Scientific | 50-949-411 | |
| Embed 812 | Electron Microscopy Sciences | 14120 | |
| Gatan 3View2 mounted in a Tescan Mira3 Field emission SEM | Gatan & Tescan | N/A | This is the SBF-SEM device used by the authors, alternates are acceptable. |
| Glass Shell Vials, 0.5 DRAM (1.8 ml) | Electron Microscopy Sciences | 72630-05 | |
| Gluteraldehyde | Electron Microscopy Sciences | 16320 | |
| Gorilla Super Glue - Impact Tough | NA | NA | Refered to as cyanoacrylate glue in text. |
| Ketjen Black | HM Royal | EC-600JD | Refered to as carbon black in text. |
| KOH | FisherScientific | 18-605-593 | |
| Lead Nitrate | Fisher Scientific | L62-100 | |
| Microwave | Pelco | BioWave Pro | This is the microwave used by the authors, alternates are acceptable. |
| Osmium Tetroxide | Sigma-Aldrich | 201030 | |
| Potassium Ferrocyanide | Sigma-Aldrich | P9387 | |
| Silicone Embedding Mold | Ted Pella | 10504 | |
| Sodium Cacodylate Trihydrate | Electron Microscopy Sciences | 12300 | |
| Samco Transfer Pipette | ThermoFisher Scientific | 202 | Used to make specimen pin storage tubes. |
| Swiss Pattern Needle Files | Electron Microscopy Sciences | 62115 | |
| Thiocarbohydrazide | Sigma-Aldrich | 223220 | |
| Uranyl Acetate | Polysciences, Inc. | 21447-25 | |
| Reconstruction Software | |||
| Amira Software | Thermo Scientific | N/A | Used to create the reconstructions found in figures 5-7 and 9. |
| Fiji (Fiji is Just ImageJ) | ImageJ.net | N/A | TrakEM2 can be added to Fiji to asist in manual segmentation. |
| Microscopy Image Browser (MIB) | University of Helsinki, Institute of Biotechnology | N/A | |
| Reconstuct Software | Neural Systems Lab | N/A | |
| SuRVoS Workbench | Diamond Light Source & The University of Nottingham | N/A | |
| SyGlass | IstoVisio, Inc. | N/A | Allows for reconstruction in virtual reality and histogram-based reconstruction methods. |
参考文献
- Leighton, S. B. SEM images of block faces, cut by a miniature microtome within the SEM - a technical note. Scanning Electron Microscopy. , Pt 2 73-76 (1981).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three-dimensional tissue nanostructure. PLOS Biology. 2 (11), 329(2004).
- He, Q., Hsueh, M., Zhang, G., Joy, D. C., Leapman, R. D. Biological serial block face scanning electron microscopy at improved z-resolution based on Monte Carlo model. Scientific Reports. 8 (1), 12985(2018).
- Zankel, A., Wagner, J., Poelt, P. Serial sectioning methods for 3D investigations in materials science. Micron. 62, 66-78 (2014).
- Titze, B., Genoud, C. Volume scanning electron microscopy for imaging biological ultrastructure. Biology of the Cell. 108 (11), 307-323 (2016).
- Ohta, K., et al. Beam deceleration for block-face scanning electron microscopy of embedded biological tissue. Micron. 43 (5), 612-620 (2012).
- Bouwer, J. C., et al. Deceleration of probe beam by stage bias potential improves resolution of serial block-face scanning electron microscopic images. Advanced Structural and Chemical Imaging. 2 (1), 11(2017).
- Kizilyaprak, C., Longo, G., Daraspe, J., Humbel, B. M. Investigation of resins suitable for the preparation of biological sample for 3-D electron microscopy. Journal of Structural Biology. 189 (2), 135-146 (2015).
- Kittelmann, M., Hawes, C., Hughes, L. Serial block face scanning electron microscopy and the reconstruction of plant cell membrane systems. Journal of Microscopy. 263 (2), 200-211 (2016).
- Biazik, J., Vihinen, H., Anwar, T., Jokitalo, E., Eskelinen, E. L. The versatile electron microscope: an ultrastructural overview of autophagy. Methods. 75, 44-53 (2015).
- Peddie, C. J., Collinson, L. M. Exploring the third dimension: Volume electron microscopy comes of age. Micron. 61, 9-19 (2014).
- Piňos, J., Mikmeková, Š, Frank, L. About the information depth of backscattered electron imaging. Journal of Microscopy. 266 (3), 335-342 (2017).
- Smith, D., Starborg, T. Serial block face scanning electron microscopy in cell biology: Applications and technology. Tissue Cell. 57, 111-122 (2019).
- Goggin, P., et al. Development of protocols for the first serial block-face scanning electron microscopy (SBF SEM) studies of bone tissue. Bone. 131, 115107(2020).
- Deerinck, T. J., et al. High-performance serial block-face SEM of nonconductive biological samples enabled by focal gas injection-based charge compensation. Journal of Microscopy. 270 (2), 142-149 (2018).
- Nguyen, H. B., et al. Conductive resins improve charging and resolution of acquired images in electron microscopic volume imaging. Scientific Reports. 6, 23721(2016).
- Deerinck, T. J., Bushong, E. A., Thor, A., Ellisman, M. H. NCMIR methods for 3D EM: a new protocol for preparation of biological specimens for serial block face scanning electron microscopy. National Center for Microscopy and Imaging Research. 6 (8), (2010).
- Deerinck, T. J., et al. Enhancing Serial Block-Face Scanning Electron Microscopy to Enable High Resolution 3-D Nanohistology of Cells and Tissues. Microscopy and Microanalysis. 16, 1138-1139 (2010).
- Kubota, Y. New developments in electron microscopy for serial image acquisition of neuronal profiles. Microscopy (Oxf). 64 (1), 27-36 (2015).
- Courson, J. A., et al. Serial block-face scanning electron microscopy: A provocative technique to define 3-dimensional ultrastructure of microvascular thrombosis. Thrombosis Research. 196, 519-522 (2020).
- Courson, J. A., et al. Serial block-face scanning electron microscopy reveals neuronal-epithelial cell fusion in the mouse cornea. PLoS One. 14 (11), 0224434(2019).
- Lafontant, P. J., et al. Cardiac Myocyte Diversity and a Fibroblast Network in the Junctional Region of the Zebrafish Heart Revealed by Transmission and Serial Block-Face Scanning Electron Microscopy. PLoS One. 8 (8), 72388(2013).
- Hanlon, S. D., Behzad, A. R., Sakai, L. Y., Burns, A. R. Corneal stroma microfibrils. Experimental Eye Research. 132, 198-207 (2015).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- Davenport, A. T., Grant, K. A., Szeliga, K. T., Friedman, D. P., Daunais, J. B. Standardized method for the harvest of nonhuman primate tissue optimized for multiple modes of analyses. Cell Tissue Bank. 15 (1), 99-110 (2014).
- Schuster, A., et al. An isolated perfused pig heart model for the development, validation and translation of novel cardiovascular magnetic resonance techniques. Journal of Cardiovascular Magnetic Resonance. 12 (1), 53(2010).
- Hanlon, S. D., Patel, N. B., Burns, A. R. Assessment of postnatal corneal development in the C57BL/6 mouse using spectral domain optical coherence tomography and microwave-assisted histology. Experimental Eye Research. 93 (4), 363-370 (2011).
- Longiéras, N., Sebban, M., Palmas, P., Rivaton, A., Gardette, J. L. Multiscale approach to investigate the radiochemical degradation of epoxy resins under high-energy electron-beam irradiation. Journal of Polymer Science Part A: Polymer Chemistry. 44 (2), 865-887 (2006).
- Hashimoto, T., Thompson, G. E., Zhou, X., Withers, P. J. 3D imaging by serial block face scanning electron microscopy for materials science using ultramicrotomy. Ultramicroscopy. 163, 6-18 (2016).
- Rouquette, J., et al. Revealing the high-resolution three-dimensional network of chromatin and interchromatin space: A novel electron-microscopic approach to reconstructing nuclear architecture. Chromosome Research. 17 (6), 801(2009).
- Briggman, K. L., Helmstaedter, M., Denk, W. Wiring specificity in the direction-selectivity circuit of the retina. Nature. 471 (7337), 183-188 (2011).
- Katoh, K. Microwave-Assisted Tissue Preparation for Rapid Fixation, Decalcification, Antigen Retrieval, Cryosectioning, and Immunostaining. International Journal of Biochemistry & Cell Biology. 2016, 7076910(2016).
- Login, G. R., Dvorak, A. M. A review of rapid microwave fixation technology: its expanding niche in morphologic studies. Scanning. 15 (2), 58-66 (1993).
- Jamur, M. C., Faraco, C. D., Lunardi, L. O., Siraganian, R. P., Oliver, C. Microwave fixation improves antigenicity of glutaraldehyde-sensitive antigens while preserving ultrastructural detail. Journal of Histochemistry and Cytochemistry. 43 (3), 307-311 (1995).
- Leong, A. S., Sormunen, R. T. Microwave procedures for electron microscopy and resin-embedded sections. Micron. 29 (5), 397-409 (1998).
- Willingham, M. C., Rutherford, A. V. The use of osmium-thiocarbohydrazide-osmium (OTO) and ferrocyanide-reduced osmium methods to enhance membrane contrast and preservation in cultured cells. Journal of Histochemistry and Cytochemistry. 32 (4), 455-460 (1984).
- Khan, A. A., Riemersma, J. C., Booij, H. L. The reactions of osmium tetroxide with lipids and other compounds. Journal of Histochemistry and Cytochemistry. 9, 560-563 (1961).
- Belazi, D., Solé-Domènech, S., Johansson, B., Schalling, M., Sjövall, P. Chemical analysis of osmium tetroxide staining in adipose tissue using imaging ToF-SIMS. Histochemistry and Cell Biology. 132 (1), 105-115 (2009).
- Rivlin, P. K., Raymond, P. A. Use of osmium tetroxide-potassium ferricyanide in reconstructing cells from serial ultrathin sections. Journal of Neuroscience Methods. 20 (1), 23-33 (1987).
- Aguas, A. P. The use of osmium tetroxide-potassium ferrocyanide as an extracellular tracer in electron microscopy. Stain Technology. 57 (2), 69-73 (1982).
- Seligman, A. M., Wasserkrug, H. L., Hanker, J. S. A new staining method (OTO) for enhancing contrast of lipid--containing membranes and droplets in osmium tetroxide--fixed tissue with osmiophilic thiocarbohydrazide(TCH). Journal of Cell Biology. 30 (2), 424-432 (1966).
- Watson, M. L. Staining of tissue sections for electron microscopy with heavy metals. II. Application of solutions containing lead and barium. Journal of Biophysical and Biochemical Cytology. 4 (6), 727-730 (1958).
- Zhou, W., Apkarian, R., Wang, Z., Joy, D. Fundamentals of Scanning Electron Microscopy. Scanning Microscopy in Nanotechnology. , 1-40 (2006).
- Tapia, J. C., et al. High-contrast en bloc staining of neuronal tissue for field emission scanning electron microscopy. Nature Protocols. 7 (2), 193-206 (2012).
- Buchacker, T., et al. Assessment of the Alveolar Capillary Network in the Postnatal Mouse Lung in 3D Using Serial Block-Face Scanning Electron Microscopy. Frontiers in Physiology. 10, 1357(2019).
- Keeling, E., et al. 3D-Reconstructed Retinal Pigment Epithelial Cells Provide Insights into the Anatomy of the Outer Retina. International Journal of Molecular Sciences. 21 (21), (2020).
- Shang, P., et al. Chronic Alcohol Exposure Induces Aberrant Mitochondrial Morphology and Inhibits Respiratory Capacity in the Medial Prefrontal Cortex of Mice. Frontiers in Neuroscience. 14, 561173(2020).
- Pfeifer, C. R., et al. Quantitative analysis of mouse pancreatic islet architecture by serial block-face SEM. Journal of Structural Biology. 189 (1), 44-52 (2015).
- Wilke, S. A., et al. Deconstructing complexity: serial block-face electron microscopic analysis of the hippocampal mossy fiber synapse. Journal of Neuroscience. 33 (2), 507-522 (2013).
- Cocks, E., Taggart, M., Rind, F. C., White, K. A guide to analysis and reconstruction of serial block face scanning electron microscopy data. Journal of Microscopy. 270 (2), 217-234 (2018).
- Borrett, S., Hughes, L. Reporting methods for processing and analysis of data from serial block face scanning electron microscopy. Journal of Microscopy. 263 (1), 3-9 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529(2017).
- Fiala, J. C. Reconstruct: a free editor for serial section microscopy. Journal of Microscopy. 218, Pt 1 52-61 (2005).
- Pidhorskyi, S., Morehead, M., Jones, Q., Spirou, G., Doretto, G. syGlass: interactive exploration of multidimensional images using virtual reality Head-mounted displays. arXiv . , arXiv:1804.08197 (2018).
- Cardona, A., et al. TrakEM2 software for neural circuit reconstruction. PLoS One. 7 (6), 38011(2012).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy Image Browser: A Platform for Segmentation and Analysis of Multidimensional Datasets. PLOS Biology. 14 (1), 1002340(2016).
- Luengo, I., et al. SuRVoS: Super-Region Volume Segmentation workbench. Journal of Structural Biology. 198 (1), 43-53 (2017).
- Anderson, H. R., Stitt, A. W., Gardiner, T. A., Archer, D. B. Estimation of the surface area and volume of the retinal capillary basement membrane using the stereologic method of vertical sections. Analytical & Quantitative Cytology & Histology. 16 (4), 253-260 (1994).
- Gibbons, C. H., Illigens, B. M., Wang, N., Freeman, R. Quantification of sweat gland innervation: a clinical-pathologic correlation. Neurology. 72 (17), 1479-1486 (2009).
- Knust, J., Ochs, M., Gundersen, H. J., Nyengaard, J. R. Stereological estimates of alveolar number and size and capillary length and surface area in mice lungs. Anat Rec. 292 (1), Hoboken. 113-122 (2009).
- Mahon, G. J., et al. Chloroquine causes lysosomal dysfunction in neural retina and RPE: implications for retinopathy. Current Eye Research. 28 (4), 277-284 (2004).
- Michel, R. P., Cruz-Orive, L. M. Application of the Cavalieri principle and vertical sections method to lung: estimation of volume and pleural surface area. Journal of Microscopy. 150, Pt 2 117-136 (1988).
- Weibel, E. R. Stereological methods in cell biology: where are we--where are we going. Journal of Histochemistry and Cytochemistry. 29 (9), 1043-1052 (1981).
- Schmitz, C., Hof, P. R. Design-based stereology in neuroscience. Neuroscience. 130 (4), 813-831 (2005).
- Kristiansen, S. L., Nyengaard, J. R. Digital stereology in neuropathology. Apmis. 120 (4), 327-340 (2012).
- Howard, C. V., Reed, M. G. Unbiased Stereology. 2nd edn. , Garland Science/BIOS Scientific Publishers. (2005).
- Reith, A., Mayhew, T. M. Stereology and Morphometry in Electron Microscopy: Problems and Solutions. , Hemisphere Publishing Corporation. (1988).
- Mouton, P. R. Principles and practices of unbiased stereology: an introduction for bioscientists. , Johns Hopkins University Press. (2002).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved
当社はcookieを使用しています。
「続行」をクリックすることで、当社のcookieへの同意となります。