Method Article
المجهر الإلكتروني المتسلسل لمسح الوجه الكتلي (SBF-SEM) لعينات الأنسجة البيولوجية
In This Article
Summary
يحدد هذا البروتوكول طريقة روتينية لاستخدام المجهر الإلكتروني للمسح التسلسلي لوجه الكتلة (SBF-SEM)، وهي تقنية تصوير ثلاثية الأبعاد قوية. يعتمد التطبيق الناجح ل SBF-SEM على تقنيات التثبيت وتلطيخ الأنسجة المناسبة ، بالإضافة إلى النظر بعناية في إعدادات التصوير. ويتضمن هذا البروتوكول اعتبارات عملية لهذه العملية برمتها.
Abstract
يسمح المجهر الإلكتروني المتسلسل لمسح الوجه الكتلي (SBF-SEM) بجمع مئات إلى آلاف الصور فائقة الهيكلة المسجلة بشكل متسلسل ، مما يوفر رؤية ثلاثية الأبعاد غير مسبوقة لاستئصال الأنسجة الدقيقة. في حين شهدت SBF-SEM زيادة هائلة في الاستخدام في السنوات الأخيرة ، فإن الجوانب التقنية مثل إعداد الأنسجة السليمة ومعلمات التصوير لها أهمية قصوى لنجاح طريقة التصوير هذه. يستفيد نظام التصوير هذا من الطبيعة الآلية للجهاز ، مما يسمح للمرء بترك المجهر دون مراقبة أثناء عملية التصوير ، مع إمكانية جمع مئات الصور تلقائيا في يوم واحد. ومع ذلك، دون إعداد الأنسجة المناسبة البنية الفوقية الخلوية يمكن تغييرها بطريقة يمكن استخلاص استنتاجات غير صحيحة أو مضللة. وبالإضافة إلى ذلك، يتم إنشاء الصور عن طريق مسح الوجه الكتلي لعينة بيولوجية مضمنة في الراتنج، وهذا غالبا ما يمثل تحديات واعتبارات يجب معالجتها. تراكم الإلكترونات داخل الكتلة أثناء التصوير، والمعروفة باسم "شحن الأنسجة"، يمكن أن يؤدي إلى فقدان التباين وعدم القدرة على تقدير الهيكل الخلوي. وعلاوة على ذلك، في حين أن زيادة كثافة شعاع الإلكترون / الجهد أو خفض سرعة مسح شعاع يمكن أن تزيد من دقة الصورة، وهذا يمكن أن يكون أيضا الآثار الجانبية المؤسفة من إتلاف كتلة الراتنج وتشويه الصور اللاحقة في سلسلة التصوير. هنا نقدم بروتوكول روتيني لإعداد عينات الأنسجة البيولوجية التي تحافظ على البنية الفوقية الخلوية ويقلل من شحن الأنسجة. كما نقدم اعتبارات التصوير للحصول السريع على صور تسلسلية عالية الجودة مع الحد الأدنى من الضرر لكتلة الأنسجة.
Introduction
تم وصف المجهر الإلكتروني (SBF-SEM) لأول مرة من قبل Leighton في عام 1981 حيث صمم مجهرا إلكترون المسح الضوئي معززا بفغر صغير مدمج يمكن أن يقطع ويصور أقساما رقيقة من الأنسجة المضمنة في الراتنج. لسوء الحظ، القيود التقنية حصرت استخدامه في العينات التوصيلية، حيث تراكمت عينات غير موصلة مثل الأنسجة البيولوجية مستويات غير مقبولة من الشحن (تراكم الإلكترون داخل عينة الأنسجة)1. في حين طلاء كتلة الوجه بين التخفيضات مع الكربون المتبخر خفض شحن الأنسجة، وهذا الوقت زيادة كبيرة في اقتناء التصوير وتخزين الصور ظلت مشكلة كما تكنولوجيا الكمبيوتر في ذلك الوقت لم تكن كافية لإدارة أحجام الملفات الكبيرة التي أنشأها الجهاز. تمت إعادة النظر في هذه المنهجية من قبل دنك وهورستمان في عام 2004 باستخدام SBF-SEM مجهزة بغرفة ضغطمتغيرة 2. وقد سمح ذلك بإدخال بخار الماء إلى غرفة التصوير مما يقلل من الشحن داخل العينة ، مما يجعل تصوير العينات غير التوصيلية قابلا للتطبيق وإن كان مع فقدان دقة الصورة. مزيد من التحسينات في إعداد الأنسجة وطرق التصوير تسمح الآن للتصوير باستخدام فراغ عالية، والتصوير SBF-SEM لم يعد يعتمد على بخار الماء لتبديل الشحن3،4،5،6،7،8،9. في حين شهدت SBF-SEM زيادة هائلة في الاستخدام في السنوات الأخيرة ، فإن الجوانب التقنية مثل إعداد الأنسجة السليمة ومعلمات التصوير لها أهمية قصوى لنجاح طريقة التصوير هذه.
SBF-SEM يسمح لجمع الآلي من الآلاف من الصور المجهر الإلكتروني المسجلة تسلسليا، مع قرار مستو صغيرة مثل 3-5 نانومتر10،11. يتم وضع الأنسجة، المشربة بالمعادن الثقيلة والمضمنة في الراتنج، داخل المجهر الإلكتروني المسح الضوئي (SEM) التي تحتوي على بروتين فائق مزود بسكين الماس. يتم قطع سطح مستو بسكين الماس ، ويتم سحب السكين ، ويتم مسح سطح الكتلة في نمط النقطية مع شعاع الإلكترون لإنشاء صورة للبنية فوقية الأنسجة. ثم يتم رفع الكتلة كمية محددة (على سبيل المثال، 100 نانومتر) في المحور z، والمعروفة باسم "خطوة z"، ويتم قطع سطح جديد قبل تكرار العملية. وبهذه الطريقة يتم إنتاج كتلة ثلاثية الأبعاد (ثلاثية الأبعاد) من الصور أثناء قطع الأنسجة. يستفيد نظام التصوير هذا بشكل أكبر من الطبيعة الآلية للجهاز ، مما يسمح للمرء بترك المجهر دون مراقبة أثناء عملية التصوير ، مع إمكانية جمع مئات الصور تلقائيا في يوم واحد.
في حين أن التصوير SBF-SEM يستخدم في المقام الأول الإلكترونات المكثرة لتشكيل صورة لوجه الكتلة ، يتم إنشاء الإلكترونات الثانوية أثناء عملية التصوير12. يمكن أن تتراكم الإلكترونات الثانوية ، إلى جانب الإلكترونات المكبتة والحزمة الأولية التي لا تفلت من الكتلة ، وتنتج "شحن الأنسجة" ، مما يمكن أن يؤدي إلى حقل كهربائي محلي في وجه الكتلة. يمكن أن يشوه تراكم الإلكترون هذا الصورة أو يتسبب في إخراج الإلكترونات من الكتلة والمساهمة في الإشارة التي يجمعها كاشف الرواصد الخلفي ، مما يقلل من نسبة الإشارة إلى الضوضاء13. في حين يمكن خفض مستوى شحن الأنسجة عن طريق تقليل الجهد شعاع الإلكترون أو كثافة، أو تقليل وقت الإسهاب شعاع، وهذا يؤدي إلى انخفاض نسبة الإشارة إلى الضوضاء14. عندما يتم استخدام شعاع إلكترون من الجهد المنخفض أو الكثافة ، أو يسمح للشعاع فقط بالسكن داخل كل مساحة بكسل لفترة أقصر من الزمن ، يتم إخراج الإلكترونات الأقل تشتتا من الأنسجة والتقاطها بواسطة كاشف الإلكترونات مما يؤدي إلى إشارة أضعف. تعامل دنك وهورستمان مع هذه المشكلة من خلال إدخال بخار الماء إلى الغرفة ، وبالتالي تقليل الشحن في الغرفة وعلى وجه الكتلة على حساب دقة الصورة. مع ضغط غرفة من 10-100 السلطة الفلسطينية، وتناثر جزء من شعاع الإلكترون المساهمة في ضوضاء الصورة وفقدان الدقة، ولكن هذا ينتج أيضا أيونات في غرفة العينة التي تحييد تهمة داخل كتلة العينة2. أساليب أكثر حداثة لتحييد تهمة داخل كتلة عينة استخدام حقن الغاز البؤري من النيتروجين على كتلة الوجه أثناء التصوير، أو إدخال الجهد السلبي إلى مرحلة SBF-SEM لتقليل طاقة المسبار شعاع الشحن وزيادةإشارةجمعت 6،7،15. بدلا من إدخال التحيز المرحلة، ضغط الغرفة أو حقن النيتروجين المترجمة لتقليل تراكم تهمة على سطح الكتلة، فمن الممكن أيضا لزيادة الموصلية من الراتنج عن طريق إدخال الكربون إلى مزيج الراتنج السماح لإعدادات التصوير أكثر عدوانية16. البروتوكول العام التالي هو تكييف لبروتوكول Deerinck et al. الذي نشر في عام 2010 ويغطي التعديلات على منهجيات إعداد الأنسجة والتصوير التي وجدناها مفيدة لتقليل شحن الأنسجة مع الحفاظ على اكتساب صورة عالية الدقة3و17و18و19. في حين أن البروتوكول المذكور سابقا ركز على معالجة الأنسجة وتلقيح المعادن الثقيلة ، يوفر هذا البروتوكول نظرة ثاقبة في سير عمل التصوير وتحليل البيانات وإعادة الإعمار المتأصل في دراسات SBF-SEM. في مختبرنا، تم تطبيق هذا البروتوكول بنجاح واستنساخ على مجموعة واسعة من الأنسجة بما في ذلك القرنية وهياكل الجزء الأمامي، الجفن، الغدة الكظرية والأصعب، شبكية العين والعصب البصري، القلب، الرئة والمجرى الهوائي، الكلى، الكبد، عضلة كريماستر، والقشرة الدماغية / النخاع، وفي مجموعة متنوعة من الأنواع بما في ذلك الماوس، الفئران، الأرانب، خنزير غينيا، الأسماك، أحادي الطبقة وثقافات الخلايا الطبقية، الخنزير، الرئيسيات غير البشرية، وكذلك الإنسان20،21،22،23. في حين أن التغييرات الصغيرة قد تكون جديرة بالاهتمام بالنسبة لأنسجة وتطبيقات محددة ، فقد أثبت هذا البروتوكول العام أنه قابل للاستنساخ ومفيد للغاية في سياق منشأة التصوير الأساسية لدينا.
Protocol
تم التعامل مع جميع الحيوانات وفقا للمبادئ التوجيهية الموصوفة في بيان جمعية البحوث في الرؤية وطب العيون لاستخدام الحيوانات في أبحاث الرؤية وطب العيون وكلية هيوستن للمبادئ التوجيهية للتعامل مع الحيوانات البصريات. تمت الموافقة على جميع الإجراءات الحيوانية من قبل المؤسسات التي تم التعامل معها: الماوس والجرذ والأرنب وخنزير غينيا ، وتمت الموافقة على إجراءات الرئيسيات غير البشرية من قبل لجنة رعاية واستخدام الحيوانات في جامعة هيوستن ، وتمت الموافقة على إجراءات حمار وحشي من قبل لجنة رعاية الحيوان واستخدامه في جامعة ديباو ، ووافقت لجنة رعاية واستخدام الحيوانات في كلية بايلور للطب. وقد عولجت جميع الأنسجة البشرية وفقا لإعلان هلسنكي فيما يتعلق بالبحوث المتعلقة بالأنسجة البشرية وتم الحصول على موافقة مجلس المراجعة المؤسسية المناسبة.
1. معالجة الأنسجة
- إعداد محلول الأسهم من 0.4 M صوديوم cacodylate العازلة عن طريق خلط مسحوق cacodylate الصوديوم في ddH2O. مزيج تماما العازلة وHH ضبط الحل إلى 7.3. يستخدم هذا المخزن المؤقت لجعل مثبت (تكوين الموضحة أدناه في الخطوة 1.3)، المخزن المؤقت الغسيل، وكذلك حلول الأوسميوم والبوتاسيوم ferrocyanide.
ملاحظة: تثبيت Perfusion غالبا ما يكون أفضل طريقة لتثبيت الدراسات SBF-SEM، كما التثبيت يحدث بسرعة وفي جميع أنحاء الجسم. إذا لم يكن تثبيت التغلغل ممكنا في تصميم الدراسة، فتخطى الخطوة 1.3. - تنفيذ تثبيت التشوه مع الضغط الفسيولوجي المناسب لنموذج الحيوان24،25،26. ويتم ذلك عن طريق التشوه التسلسلي عبر القلب مع محلول ملحي مهجر يليه مثبت ، يتم وضع كل منها على ارتفاع محدد (على سبيل المثال ، 100 سم) فوق الكائن الحي (مناسب للضغط الفسيولوجي لنظام الأوعية الدموية في النموذج الحيواني) ، مع تدفق مثبت إلى البطين الأيسر ، والخروج من شق في الأذين الأيمن. سوف تصبح الأنسجة ذات الاهتمام شاحبة حيث يتم استبدال الدم بتثبيت ، إذا لم يبيض كل أو جزء من الأنسجة الخاصة بك ، فقد لا تكون الأنسجة ثابتة بشكل مناسب وقد لا يتم الحفاظ على البنية الفوقية.
- استخدم شفرة حلاقة أو مشرط حاد لتقليم عينات الأنسجة إلى كتل لا يزيد حجمها عن 2 مم × 2 مم × 2 مم. إذا تم تخطي الخطوة 1.2، قم بذلك بسرعة بحيث يمكن إصلاح الأنسجة في أسرع وقت ممكن.
- بدلا من ذلك، تشريح الأنسجة تحت المثبت ونقلها إلى مثبت جديد لإكمال عملية الغمر. التركيب النهائي للمثبت يتكون من 0.1 M صوديوم cacodylate العازلة التي تحتوي على 2.5٪ الغلوتارالدهيد و 2 MM كلوريد الكالسيوم. السماح التثبيت المضي قدما لمدة لا تقل عن 2 ساعة في درجة حرارة الغرفة والحد الأقصى لليلة واحدة في 4 °C. إذا كان ذلك ممكنا، استخدم لوحة الروك / الميل للتحريض بلطف العينات أثناء تحديد.
- بدلا من ذلك، إذا كان الميكروويف العاكس متوفرا، قم بإصلاح الأنسجة في المثبت المذكور أعلاه تحت الفراغ عند 150 واط لمدة 4 دورات من دقيقة واحدة، و1 دقيقة. تثبيت الميكروويف هو الطريقة المفضلة للخطوة 1.3 لأنه يصلح بسرعة الأنسجة ويحافظ على البنية الفوقية للأنسجة27.
ملاحظة: لا ينبغي السماح للأنسجة بالجفاف خلال هذا البروتوكول، وينبغي توخي الحذر لنقل الأنسجة بسرعة من محلول إلى آخر.
- غسل الأنسجة الثابتة 5x لمدة 3 دقائق لكل منهما (مجموع 15 دقيقة) في درجة حرارة الغرفة في 0.1 M صوديوم cacodylate العازلة التي تحتوي على 2 mM كلوريد الكالسيوم.
- جعل محلول أوسميوم ferrocyanide التالية الطازجة، ويفضل خلال خطوات غسل السابقة. الجمع بين محلول 2 أكسيد الأوسميوم 4٪ (أعدت في DDH2O) مع حجم متساو من 3٪ فيروكيانيد البوتاسيوم في 0.2 M cacodylate العازلة مع كلوريد الكالسيوم 4 MM. بعد خطوة الغسيل السابقة، ضع الأنسجة في هذا المحلول لمدة ساعة واحدة على الجليد في الظلام، وفي غطاء الدخان.
ملاحظة: تيج أكسيد الأوسميوم هو مادة بلورية صفراء تأتي في أمبول. لإنشاء محلول tetroxide osmium، الكراك فتح أمبول، إضافة ddH2O، و sonicate لمدة 3-4 ساعات في الظلام حتى يتم حل البلورات تماما. محلول تيج أكسيد الأوسميوم هو حل أصفر واضح ، إذا كان الحل أسود فقد تم تقليل الأوسميوم ويجب ألا يستخدم بعد الآن. - في حين أن النسيج هو احتضان في محلول فيروكيانيد أوسميوم، والبدء في إعداد محلول ثيوكاربوهيدرازيد (TCH). إعداد هذا الحل الطازجة ويكون ذلك متاحة بسهولة في نهاية فترة تثبيت أوسميوم ferrocyanide 1 ساعة. الجمع بين 0.1 غرام من ثيوكاربوهيدرازايد مع 10 مل من DDH2O ووضع هذا الحل في فرن 60 درجة مئوية لمدة 1 ساعة. لضمان حل الحل، قم بتدفيره برفق كل 10 دقائق. قبل الاستخدام، قم بتصفية هذا الحل من خلال فلتر حقنة 0.22 ميكرومتر.
- قبل احتضان في TCH، وغسل الأنسجة مع درجة حرارة الغرفة ddH2O 5x لمدة 3 دقائق لكل منهما (15 دقيقة المجموع).
- ضع الأنسجة في محلول TCH المصفى لمدة إجمالية قدرها 20 دقيقة في درجة حرارة الغرفة(الشكل 1A-C).
- بعد الحضانة في TCH، اغسل الأنسجة 5x لمدة 3 دقائق لكل منها (إجمالي 15 دقيقة) في درجة حرارة الغرفة ddH2O.
- ضع الأنسجة في DDH2O التي تحتوي على 2٪ من التيتروكسيد أوسميوم (وليس الأوسميوم خفضت مع فيروكيانيد البوتاسيوم) لمدة 30 دقيقة في درجة حرارة الغرفة. وينبغي أن يتم ذلك في غطاء الدخان وفي الظلام كما يمكن تخفيض osmium بواسطة الضوء (على سبيل المثال، تحت رقائق الألومنيوم) (الشكل 1D-F).
- بعد حضانة أكسيد الأوسميوم، اغسل الأنسجة 5x لمدة 3 دقائق لكل منها (إجمالي 15 دقيقة) في درجة حرارة الغرفة ddH2O.
- ضع الأنسجة في 1٪ خلات أورانيل مائي (مسحوق خلات أورانيل مختلطة في ddH2O) بين عشية وضحاها في ثلاجة عند 4 درجة مئوية.
- قبل إزالة الأنسجة من الثلاجة، قم بإعداد محلول الأسبارتات الرصاصي الطازج لوالتون. ابدأ بحل 0.066 غرام من نترات الرصاص في 10 مل من محلول حمض الأسبارتيك 0.03 M (0.04 غرام من حمض الأسبارتيك في 10 مل من الماء المقطر) وضبط درجة الحموضة إلى 5.5 مع 1 N KOH (0.5611 غرام في 10 مل من الماء المقطر).
تنبيه: يمكن أن يتشكل عجل عند ضبط درجة الحموضة. هذا غير مقبول.- باستخدام شريط تحريك، إضافة ببطء 1 N KOH دروبوايز أثناء رصد pH. سخني مسبقا محلول الأسبارتات الرصاصي الواضح النهائي في فرن 60 درجة مئوية لمدة 30 دقيقة. إذا كان التعجيل يشكل الحل لا يمكن استخدامها ويجب إعداد حل آخر.
- إزالة الأنسجة من الثلاجة وغسل 5x لمدة 3 دقائق لكل منهما (15 دقيقة المجموع) في درجة حرارة الغرفة ddH2O.
- بعد الغسيل، ضع الأنسجة في محلول الأسبارتات الرصاصي الدافئ ل والتون لمدة 30 دقيقة مع الحفاظ على درجة الحرارة عند 60 درجة مئوية.
- بعد الحضانة في aspartate الرصاص والتون، وغسل الأنسجة 5X لمدة 3 دقائق لكل منهما (15 دقيقة المجموع) في درجة حرارة الغرفة ddH2O (الشكل 1G-I).
- يجفف النسيج من خلال سلسلة الأسيتون الباردة الجليد (30٪، 50٪، 70٪، 95٪، 95٪، 100٪، 100٪، و 100٪ الأسيتون (في ddH2O حيثما ينطبق ذلك) مما يسمح 10 دقائق لكل خطوة في هذه السلسلة.
- بعد سلسلة الجفاف البارد، ضع الأنسجة في الأسيتون في درجة حرارة الغرفة لمدة 10 دقائق.
- خلال هذا الوقت، صياغة تضمين 812 ACM الراتنج. استخدام وصفة "المزيج الصلب" كما هو أكثر مقاومة للضرر شعاع. خلط الراتنج جيدا، ووضع الأنسجة في تضمين 812:الأسيتون (1:3 مزيج) لمدة 4 ساعات، تليها تضمين 812:الأسيتون (1:1 مزيج) لمدة 8 ساعات أو بين عشية وضحاها، وأخيرا تضمين 812:الأسيتون (3:1 مزيج) بين عشية وضحاها. قم بتنفيذ خطوات تسلل الراتنج هذه في درجة حرارة الغرفة.
- في اليوم التالي، ضع الأنسجة في تضمين 100٪ 812 لمدة 4-8 ساعات، ثم في تضمين 812 100٪ الطازجة بين عشية وضحاها، وأخيرا في تضمين 100٪ جديدة 812 لمدة 4 ساعات. قم بتنفيذ خطوات تسلل الراتنج هذه في درجة حرارة الغرفة.
- قبل التضمين مباشرة، ضع كمية صغيرة من الراتنج في حاوية خلط واخلط ببطء (يمكن استخدام عصا خشبية للإثارة) في مسحوق أسود كربوني حتى تشبع الراتنج بالمسحوق ولكنه لا يزال سائلا ولا يصبح محببا. وينبغي أن تشبه الحبر السميك وتكون قادرة على بالتنقيط ببطء من عصا خشبية دون كتل مرئية.
- توجيه عينات الأنسجة في قالب مطاطي السيليكون واتخاذ صورة بحيث يتم تسجيل اتجاه العينة داخل كتلة الراتنج ويمكن الرجوع إليها. تغطية العينات في الكربون الأسود المشبعة الراتنج في غيض من قالب السيليكون ووضع القالب في الفرن لمدة ~ 1 ساعة في 65 درجة مئوية.
- ضع القالب في منحدر لاحتواء الراتنج في طرف القالب حيث يغطي عينة الأنسجة. ضع ملصقا مع معرف عينة التجربة /الأنسجة في القالب في الطرف المقابل من الراتنج(الشكل 2A).
- إزالة قالب السيليكون من الفرن وملء ما تبقى من القالب مع الراتنج واضحة (لا أسود الكربون) التأكد من أن التسمية لا تزال مرئية. علاج الراتنج غرست مع أسود الكربون بما فيه الكفاية لعدم خلط بسهولة مع الراتنج واضحة.
- إعداد بئر إضافية داخل القالب الذي لا يحتوي على الأنسجة. بدءا من بئر اضافية، وملء ما تبقى من القالب مع الراتنج واضحة.
- إذا بدأ الراتنج المشبع بغاز الكربون الأسود ينزف في الراتنج الواضح ، ضع قالب السيليكون مرة أخرى في الفرن لوقت إضافي (على سبيل المثال ، 15 دقيقة).
- مرة واحدة وقد تصدرت جميع عينات الأنسجة قبالة مع الراتنج واضحة، ووضع قالب السيليكون مرة أخرى في الفرن (شقة، لا المنحدر) في 65 درجة مئوية لمدة 48 ساعة لإكمال عملية المعالجة.
2. إعداد كتلة
ملاحظة: الأسلوب يعتمد على كيفية توجيه العينة في الكتلة وكيفية المقطع هو أن تأخذ مكان. ومع ذلك ، فإن اتجاه الأنسجة الأكثر شيوعا يجد الأنسجة المتمركزة في طرف كتلة الراتنج ، عموديا على النهاية الطويلة لكتلة الراتنج.
- في معظم الحالات، تقليم أولا نهاية الكتلة لتحديد موقع الأنسجة عن طريق وضع كتلة العينة في تشاك microtome مع نهاية مدبب الشائكة ما يقرب من 5-6 ملم من تشاك. قفله في مكانه مع المسمار مجموعة ووضعه تحت مصباح الحرارة.
- بعد عدة دقائق سوف تكون كتلة مرن وسهلة لتقليم. ضع تشاك في حامل المنظار المجسم واستخدم شفرة حلاقة جديدة ذات حافة مزدوجة لجعل المقاطع الرقيقة متوازية مع وجه الكتلة حتى يصبح النسيج مرئيا. وينظر إلى هذا أفضل من خلال الصيد الضوء عبر الوجه كتلة، فإن عينة الأنسجة تكون أقل عاكسة وحبيبية بالمقارنة مع تلك الأجزاء من الراتنج التي تخلو من الأنسجة. راجع الصورة الملتقطة لعينات الأنسجة قبل إدخال الراتنج المشبع الأسود الكربوني للحصول على فكرة عن كيفية ومكان وجود الأنسجة.
- وضع حامل دبوس عينة واحد جانبا لأغراض التشذيب. هذا الدبوس حامل أبدا وضعت في غرفة SEM، وبالتالي يمكن التعامل معها دون قفازات، وهذا سوف يشار إلى حامل دبوس التشذيب. أي حامل عينة متجهة إلى وضعها في غرفة التصوير لا ينبغي أبدا أن تطرق دون قفازات. وهذا يتجنب إدخال الشحوم والزيت إلى غرفة المجهر.
- ضع دبوس عينة الألومنيوم في حامل دبوس التشذيب وتشديد قليلا المسمار مجموعة مع الوجه (سطح مستو) من دبوس عقد 3-4mm فوق حامل دبوس.
- جعل العديد من الخدوش العميقة، متقاطعة في وجه دبوس لتوفير مساحة أكبر للغراء المستخدمة لعقد العينة في مكانها. إذا تم استخدام دبوس الألومنيوم، ينصح مفك مسطح الصلب الصغيرة لهذه الخطوة(الشكل 2B).
- ضع تشاك التي تحتوي على عينة الأنسجة مرة أخرى تحت مصباح الحرارة حتى يصبح الراتنج لينة ومرنة، ثم وضعه في وعاء تشاك تحت المنظار المجسم.
- باستخدام شفرة حلاقة ذات حدين لتقليم الراتنج الزائد من جزء من كتلة الراتنج التي تحتوي على عينة الأنسجة. في نهاية المطاف حجم كتلة الأنسجة تعلق على دبوس سيكون ما يقرب من 3 ملم في القطر و 2-3 ملم في الارتفاع.
- ادفع ماكينة الحلاقة بعناية إلى أسفل مباشرة إلى كتلة الراتنج حوالي 1-2 مم ، ثم ادفع الحلاقة بعناية أفقيا إلى كتلة الراتنج على عمق يساوي القطع السابق. القيام بذلك ببطء وبعناية كبيرة، كما أنه من الممكن أن تلحق الضرر أو قطع جزء من كتلة تحتوي على عينة الأنسجة. كما يلتقي خفضين، فإن الراتنج الزائدة منفصلة عن الكتلة. استمر في إزالة الراتنج حتى تبقى مساحة مرفوعة 3 مم × 3 مم فقط.
- بعد هذا التشذيب الأولي، ضع الكتلة (لا تزال في تشاك) تحت مصباح الحرارة لعدة دقائق.
- بمجرد أن يصبح الراتنج ناعما ومرنا ، ضع الكتلة مرة أخرى تحت المنظار المجسم. باستخدام شفرة حلاقة جديدة ذات حافة مزدوجة، قطع الجزء العلوي من كتلة الراتنج، ما يقرب من 1 ملم تحت الجزء قلصت، مع قطع واحد على نحو سلس. سطح مستو هو الأفضل لأن هذا سيتم لصقها على دبوس العينة. يجب الحرص على عدم السماح للعينة لتصبح فقدت، كما تتطلب هذه الخطوة بعض القوة التي يمكن نقلها إلى الجزء إزالتها من كتلة وتسبب لها أن تطير بعيدا. ضع العينة المقطوعة والمشذبة جانبا.
- ضع حامل دبوس التشذيب الذي يحتوي على دبوس الألومنيوم المقطوع في وعاء المنظار المجسم. تطبيق طبقة رقيقة من الغراء سيانواكريلات على الوجه دبوس بحيث يغطي تماما دبوس دون تشكيل الغضروف المفصلي مرئية. التقاط قطعة قلصت من كتلة الأنسجة مع ملقط ومكان في على الوجه دبوس. مركز عينة الأنسجة على دبوس العينة. ادفعه للأسفل واحمله لعدة ثوان. السماح للغراء لتعيين لعدة دقائق.
- عندما يكون الغراء جاف تماما، ضع حامل دبوس التشذيب مرة أخرى تحت المنظار المجسم. باستخدام ملف غرامة، ملف بعيدا الراتنج الزائد بحيث لا الراتنج هو معلقة دبوس. يجب أن يشبه شكل الراتنج رأس الدبوس الدائري.
- تحديد موقع الأنسجة على الجزء الذي أثار من كتلة الراتنج الخاص بك، والإضاءة المائلة مفيدة لهذا الغرض. باستخدام شفرة حلاقة ذات حافة مزدوجة ، يجب أن يتم تشذيب الجزء المرفوع من الراتنج الذي يحتوي على عينة الأنسجة إلى منطقة لا تزيد عن 1 مم2. إذا كان ذلك ممكنا، يمكن قلصت كتلة الوجه حتى أصغر، وهذا سوف يقلل من الضغط على سكين الماس وتحسين طول العمر.
- إزالة الراتنج الزائد قدر الإمكان، وترك كتلة أطول قليلا في بعد واحد. ويتم ذلك ببطء وبعناية، حيث أنه من الممكن للراتنج الذي يحتوي على عينة الأنسجة أن ينفصل إذا تم تطبيق الكثير من القوة. في حين ينصح الحلاقة، يمكن استخدام ملف معدني غرامة لهذه الخطوة.
- مع زاوية ملف معدني غرامة الراتنج الزائد، في المنطقة خارج الجزء الذي أثار يحتوي على عينة الأنسجة، وصولا الى حافة دبوس(الشكل 2C).
- إزالة جزيئات الراتنج والغبار من العينة المعدة قبل تطبيق الطلاء الفضي تليها الذهب البصق. مزيج الفضة مع الأسيتون بحيث يكون السائل يمكن نشرها بسهولة، أقرب إلى طلاء الأظافر (ولكن ليس رقيقة بحيث يقطر الخروج من قضيب) وتطبيق معطف رقيقة على سطح كتلة العينة بأكملها. أسيتون يتبخر بسرعة، لذلك قد يكون من الضروري إضافة الأسيتون إضافية كما يبدأ الطلاء الفضة لسماكة.
- السماح للطلاء الفضة لتجف بين عشية وضحاها قبل تحميل في المجهر.
ملاحظة: يجب أن تكون هذه الطبقة الفضية رقيقة من أجل تجنب توسيع الوجه كتلة وراء 1 مم × 1 ملم، وعلى الرغم من أن الطلاء الفضي لم يضر سكين الماس، لا يزال ينصح أصغر كتلة وجوه للحفاظ على طول العمر من سكين الماس. يجب أن يتبخر الأسيتون المختلط مع الفضة تماما قبل رش الذهب أو تحميل العينة في المجهر لتجنب إدخال بخار الأسيتون إلى غرفة التصوير. - بعد تطبيق الطلاء الفضي، وتطبيق طبقة رقيقة من الذهب إلى كتلة العينة. باستخدام جهاز فراغ قياسي مجهز بهدف قياسي لرقائق الذهب ، سيؤدي ضغط الغرفة البالغ 200 مللي تور (غاز الأرجون) و 40 مللي أمبير يعمل لمدة دقيقتين إلى طلاء ذهبي سميك 20 نانومتر.
- السماح للطلاء الفضة لتجف بين عشية وضحاها قبل تحميل في المجهر.
- بعد الطلاء، ضع الكتلة المثبتة والمشذبة في أنبوب مع ملصق التجربة المناسب المرفق. إنشاء أنابيب مخصصة باستخدام ماصة نقل المتاح.
- قطع ماصة نقل فقط تحت لمبة، وترك جزء قصير من أنبوب نقل ماصة تعلق تحت نهاية لمبة. تقصير الجزء الأنبوبي الذي تم قطع بعيدا، وقطع تلميح ماصة مرة أخرى بما فيه الكفاية بحيث يمكن دفع دبوس عينة الألومنيوم دافئ داخله.
- ضع النهاية التي تحتوي على دبوس عينة الألومنيوم داخل الطرف اللامع من ماصة النقل المعدلة.
- قبل تحميل كتلة الأنسجة المعدة، تقليم بعناية بعيدا الطلاء الفضة الزائدة من سطح الوجه كتلة.
3. إعدادات SEM لتصوير الوجه بلوك
ملاحظة: تم إنتاج إعدادات التصوير التالية على الجهاز المستخدم من قبل المؤلفين، والمدرج في جدول المواد المقدمة. في حين أن هذا الجهاز قادر على التصوير الضغط المتغير، تم التقاط أفضل النتائج تحت فراغ عالية.
- وقت السكن: استخدم 12 ميكروجرام/بكسل أثناء المقطع التسلسلي. عندما يتم تحديد منطقة ذات أهمية، يمكن الحصول على صورة ذات دقة أعلى عند 32 ميكروجرام/بكسل.
- إعدادات الفراغ: استخدام ضغط بندقية من 9e-008 السلطة الفلسطينية، وضغط العمود من 1.1e-004 السلطة الفلسطينية، وضغط غرفة من 9.5e-002 السلطة الفلسطينية.
- وقت الالتقاط: مع الإعدادات المذكورة أعلاه، التقط مكدس صور 2048x2048 بكسل بمعدل 50 ثانية لكل صورة. يمكن التقاط صور ذات دقة أعلى للمناطق ذات الأهمية بمعدل 4096 × 4096 بكسل بمعدل أقل بقليل من 9 دقائق لكل صورة.
- سمك المقطع: استخدام 100-200 نانومتر. أقل من الممكن، ولكن قد تتطلب انخفاض الجهد شعاع، وكثافة، أو يسكن الوقت.
- الجهد العالي (HV): استخدام 7-12 كيلو فولت. في حين أن زيادة الجهد يقلل من حجم البقعة ويزيد من الدقة ، فإنه يقدم المزيد من إمكانية تلف الحزمة. ارتفاع كيلو فولت يزيد من اختراق الحزمة مما يؤدي إلى فقدان التفاصيل. ومع ذلك، خفض كيلو فولت يحط من نسبة الإشارة إلى الضوضاء (الشكل 3)14.
- كثافة الحزمة (BI): يقدم جهاز SBF-SEM الخاص بالمؤلف مقياسا لشدة الحزم يتراوح بين 1-20. على هذا المقياس، تعطي قيم 5-7 صورا عالية الجودة دون شحن مفرط وتلف في الحزمة. كلما ارتفع BI كلما زادت الدقة ، هناك فرصة أكبر للشحن وتلفالحزمة 14.
- حجم البقعة وتكبير الصورة: تحديد حجم البقعة من خلال كثافة الحزمة ومستوى الجهد. وبشكل مثالي، يجب ألا يكون حجم النقطة أكبر من حجم البكسل المستخدم. يتم تحديد حجم البكسل بقسمة حقل العرض (FOV) على عدد وحدات البكسل. على سبيل المثال، سوف يعطي FOV 25 ميكرومتر بحجم صورة 2048x2048 بكسل 12.2 نانومتر لكل بكسل. ولذلك يجب أن لا يزيد حجم البقعة عن 12.2 نانومتر. ويبين الشكل 4 كيف ترتبط HV، BI وحجم بقعة.
- مسافة العمل (WD) - مع تصوير الوجه الكتلي، لا يمكن ضبط مسافة العمل. إنه ببساطة عامل تركيز. وسوف تكون متطابقة تقريبا لجميع الكتل المصورة. على الرغم من أن مسافة العمل غير قابلة للتعديل، إلا أنها تلعب دورا حاسما في دقة الصورة الملتقطة. ومع انخفاض مسافة العمل، يزداد الحد الأقصى للدقة على الصور الملتقطة. في بعض الحالات قد يكون من الممكن تقليل مسافة العمل عن طريق إجراء تعديلات داخل غرفة التصوير ، ولكن يجب إجراء هذه التعديلات وفقا لتقدير المستخدم. من أجل تقليل مسافة العمل وزيادة دقة الصورة ، قمنا بتخفيف مسامير جبل الباب microtome وإعادة وضع microtome بحيث يستريح ~ 2 ملم أقرب إلى كاشف الحزمة بعد إعادة إحكام البراغي.
- الدقة - باستخدام الإعدادات أعلاه، يمكن استخدام دقة x وy التي يصل ارتفاعها إلى 3.8 نانومتر. من المهم ملاحظة أن الدقة محدودة بحجم بقعة الحزمة بالإضافة إلى دقة البكسل لالتقاط الصورة (على سبيل المثال، حقل رؤية 20 ميكرومتر تم التقاطه في صورة بكسل 2048x2048 بدقة بكسل 9.8 نانومتر، حتى لو تم استخدام حجم بقعة 3.8 نانومتر). دقة الصورة في الطائرة z يعتمد على سمك المقطع، نجد أن 100-200 نانومتر يعمل بشكل جيد مع هذا البروتوكول.
النتائج
ماوس كورنيا
تم تطبيق هذا البروتوكول بشكل مكثف على قرنية الماوس. باستخدام التصوير SBF-SEM شبكة من حزم الألياف الدقيقة الخالية من الإيلاستين (EFMBs) تبين أن تكون موجودة داخل القرنية الماوس الكبار. وكان يعتقد في السابق أن هذه الشبكة لم تكن موجودة إلا أثناء النمو الجنيني والمبكر بعد الولادة. كشفت SBF-SEM عن شبكة EFMB واسعة النطاق في جميع أنحاء القرنية ، مع ألياف فردية تبين أن قطرها يتراوح بين 100-200 نانومتر عند قياسها في المقطع العرضي. كما وجد أن شبكة EFMB هذه تم تنظيمها في طبقات متميزة ، مع ألياف مرتبطة ارتباطا وثيقا بالخلايا القرنية ، حتى أنها تقع داخل الشقوق الضحلة على سطح القرنية(الشكل 5). أدى اكتشاف ألياف EFMB في القرنية البالغة إلى المجهر الإلكتروني لانتقال العلامات المناعية (TEM) والدراسات الفلورية والكونفوجكال لزيادة فهم طبيعة هذه الشبكة23.
أدى تطبيق هذا البروتوكول إلى اكتشاف مجموعة غير معروفة من الأعصاب القرنية المركزية التي تنصهر مع الخلايا الظهارية القاعدية عند الحدود الظهارية السترومال (الشكل 6). في السابق ، كان يعتقد أن جميع الأعصاب التي تتفاعل مع الظهارة على هذه الحدود اخترقت ظهارة القرنية وراميد إنتاج البليكسي تحت القاعدي والظهاري. في هذه الدراسة، خضع ~45٪ من الأعصاب المركزية التي تتفاعل مع الظهارة القاعدية لاختراق الخلية الخلية بدلا من اختراق بسيط. باستخدام الأساليب المخططة المطبقة على مجموعات بيانات SBF-SEM ، كان من الممكن إظهار أن هذه النسبة الجديدة للأعصاب لديها نسبة سطح إلى حجم ما يقرب من نصف نسبة اختراق الأعصاب ، بما يتفق مع مظهرها "المتورم" (Nerve Fusion - 3.32±0.25 ، اختراق الأعصاب - 1.39±0.14 ، ص ≤ 0.05). تم إنشاء عمليات إعادة بناء ثلاثية الأبعاد لاختراق ودمج حزم الأعصاب والميتوكوندريا الخاصة بها ، مما يسلط الضوء على عدم وجود الميتوكوندريا في أجزاء تنصهر من حزم الأعصاب. اكتشاف الخلايا العصبية الظهارية الانصهار باستخدام SBF-SEM أدى إلى دراسات مضان التحقق من استمرارية الغشاء بين الخلايا تنصهراثنين 21.
القرنية المركزية هي نسيج الأوعية الدموية ، وعلى هذا النحو فإن الأوعية الدموية الطرفية ذات أهمية خاصة للصحة العامة للقرنية. العلاقات بين الخلية والخلية وبنية فائقة من هذه المنطقة معقدة; ومع ذلك ، فإن القدرة على تقدير هذه التفاعلات بين الخلية والخلية والاتصالات فائقة البنية كانت محدودة في دراسات TEM الفلورية والقسم الواحد. لهذا السبب تم تقسيم مكدس صور SBF-SEM يحتوي على الأوعية الدموية الحوفية ، وحزم الأعصاب ، والخلايا المرتبطة بها يدويا لإعادة الإعمار ثلاثي الأبعاد(الشكل 7). في هذه الصورة يمكن رؤية الارتباط الوثيق بين التقاطعات البطانية الوعائية والبيريسيت المتراكب ، والحبيبات الفردية لخلية سارية المحيط بالأوعية الدموية ، والنواة والحافة الرائدة للجميل العدلي الزاحف على طول السطح الخارجي لجدار الأوعية الدموية ، بالإضافة إلى حزمة عصبية عابرة.
إذا ما أخذت معا، وهذا الجسم من العمل يدل على قدرة هذا البروتوكول لإنتاج عالية الجودة مجموعات بيانات المجهر الإلكتروني 3D في الأنسجة الغنية في مصفوفة خارج الخلية والظهارة، فضلا عن الأوعية الدموية والخلايا المرتبطة بها.
أعلى ترتيب الرئيسيات الشبكية - الضفيرة العصبية وشبكة الأوعية الدموية
تحتوي طبقة الألياف العصبية الشبكية (RNFL) من الرئيسيات ذات الترتيب الأعلى وتعتمد على شبكة واسعة من الأوعية الدموية. غالبا ما تتضمن أمراض الشبكية تغيرات في كل من معلمات طبقة الألياف العصبية الشبكية وكذلك الأوعية الدموية الموجودة داخلها. فهم العلاقة بين RNFL وشبكتها الوعائية في الأنسجة السليمة وغير المرضية هو الخطوة الأولى لفهم أي تغييرات قد تحدث نتيجة للمرض. من أجل فهم أفضل لهذه العلاقة، تم تطبيق بروتوكول SBF-SEM على شبكية العين الرئيسيات العادية أعلى ترتيبا وتم تنفيذ إعادة بناء شبكة الأوعية الدموية واستخراج البيانات الحجمية من هذا الإعمار(الشكل 8). هذه المنطقة 4,642,307 ميكرومتر3 من RNFL تحتوي على سرير الأوعية الدموية 1.207x10-4 ميكرولتر في الحجم، تشكل 2.6٪ من إجمالي حجم RNFL. هذا العمل يدل على قدرة هذا البروتوكول لإنتاج عالية الجودة مجموعات بيانات المجهر الإلكتروني 3D في الأنسجة العصبية الكثيفة.
حمار وحشي والقلب دانيو العملاقة - العضلات المخططة وتطوير الأوعية الدموية
كل من حمار وحشي ودانيو العملاقة هي نماذج هامة لتطوير القلب وتجديد. تاريخيا، يعتبر قلب حمار وحشي تتكون من اثنين من شرائح عضلة القلب متميزة تشريحيا تعمل معا لدعم المطالب الفسيولوجية للسمك الحمار الوحشي. ومع ذلك، لم تكن الواجهة بين هاتين الطبقتين البطينيتين مفهومة جيدا. باستخدام هذا البروتوكول، تم اكتشاف منطقة تقاطع غير معروفة مسبقا تتكون من ورقة رقيقة من الخلايا الليفية. ووجد أن فتحات داخل هذه الورقة سمحت اثنين من شرائح عضلة القلب منفصلة لتأتي في اتصال وتشكيل تقاطعات التصاقات المعقدة بما في ذلك desmosomes واللفافة adherens22.
وقد استخدم هذا البروتوكول في مزيد من العمل دراسة شبكة الأوعية الدموية من القلب دانيو العملاقة النامية(الشكل 9). تسمح هذه الطريقة بالتقدير ثلاثي الأبعاد لشبكة الخلايا العضلية القلبية النامية وعلاقتها بتطوير الخلايا المجهرية. إذا ما أخذ هذا العمل معا، فإن هذا العمل يوضح قدرة هذا البروتوكول على إنتاج مجموعات عالية الجودة من بيانات المجهر الإلكتروني ثلاثي الأبعاد في الأنسجة العضلية والأوعية الدموية العالية.
إعدادات الصورة والشحن والدقة
في حين أن التثبيت المناسب وتلطيخ المعادن الثقيلة ضروري للتصوير عالي الجودة SBF-SEM ، فإن المهم بنفس القدر هو استخدام الراتنج التوصيلي وإعدادات التصوير المناسبة للأسئلة التي يتم تناولها. في هذا البروتوكول ، يتم استخدام أسود الكربون من أجل زيادة الموصلية من كتلة العينة وتوفير قناة إلى دبوس تصاعد لإزالة الإلكترونات الثانوية من كتلة الوجه. وقد أثبت هذا فعاليته في مكافحة شحن الأنسجة التي غالبا ما تحط من جودة الصورة في الأنسجة غير المعدة مع أسود الكربون16. بالإضافة إلى ذلك ، يوفر الطلاء الفضي وتخثر الذهب المطبق على الكتلة مسارا للتبد لتراكم الإلكترون. بعض الأجهزة تسمح بإضافة تعويض الشحنة البؤرية ، مما يقلل من الشحن عن طريق تطبيق نفخة من النيتروجين على وجه الكتلة ، ومع ذلك فقد حققنا نجاحا مماثلا مع استخدام أسود الكربون وتطبيق الطلاء الفضي والذهب على الكتلة15. عدم وجود الموصلية عينة يمكن أن يؤدي إلى تراكم الإلكترون مرئية كما شحن الأنسجة (الشكل 1)، فضلا عن التفريغ التي هي مرئية كما تحول الصورة المفاجئة وتشوه التي تقلل بشكل كبير من جودة الصورة (الشكل 10B و F). يسمح استخدام أسود الكربون بالتصوير تحت فراغ عالي واستخدام إعدادات الصورة التي تؤدي إلى ارتفاع نسبة الإشارة إلى الضوضاء وتحسين دقة الصورة. أحد هذه الإعدادات التي تؤدي إلى تحسين جودة الصورة هو وقت البكسل. تتضمن عملية التصوير SBF-SEM المسح النقطي لشعاع إلكترون عبر سطح العينة لتوليد الإلكترونات المكثرة التي يمكن للكاشف المجهر جمعها وتفسيرها على أنها إشارة. طول الوقت المسموح به هذا الشعاع يسكن داخل مساحة كل بكسل يؤدي إلى قيمة بكسل أكثر دقة يتم تعيينها إلى كل موقع بكسل (الشكل 3A و B)2. هناك توازن يجب أن يكون بين زيادة إشارة إلى الضوضاء، والقرار والضرر التعامل مع كتلة الوجه ومع ذلك. شعاع تشعيديه بشكل فعال كتلة الوجه مع الإلكترونات عالية الطاقة التي يمكن أن تنهار وتليين الراتنج مما أدى إلى تدهور الصورة وقطع مضاعفات (الشكل 10)28. كلما كانت الدقة z المطلوبة أرق، كلما أصبح من الصعب الحفاظ على التصوير عالي الدقة. نحن عموما استخدام z-الخطوات من 100-200 نانومتر, ولكن Z-الخطوة أحجام 25-50 نانومتر وقد أبلغ5,29,30,31. مع الخطوات z من هذا الحجم، وكسر وتليين الراتنج بسبب تلف شعاع يمكن أن يؤدي إلى إما ضغط الراتنج مما تسبب في السكين أن تفوت قطع أو قطع كتلة الوجه ولكن مع "الثرثرة" حيث يتخطى السكين عبر سطح الكتلة خلق تموجات والعصابات13. في حين أن الخطوات الصغيرة z هي احتمال جذاب ، فمن المهم أن نضع مسألة البحث المحددة في الاعتبار عند اختيار خطوة z المناسبة. ويمكن أن يؤدي الإفراط في أخذ العينات إلى اعتبارات كبيرة لتخزين البيانات فضلا عن زيادة الوقت اللازم لإنتاج عمليات إعادة بناء ثلاثية الأبعاد.
تثبيت الأنسجة وتلطيخها
قبل حضانة المعادن الثقيلة ، يجب إصلاح الأنسجة في الجلوتارالدهيد. في حين نوصي بشدة تثبيت الميكروويف تحت فراغ للحفاظ على الأنسجة ultrastructure27، إذا كان مختبر الصف الميكروويف غير متوفرة الميكروويف العاكس التجارية مع القوة الكهربائية المتغيرة يمكن استبدال32،33،34،35. إذا تم ذلك، ينبغي استخدام عناية إضافية لضمان عدم حدوث تشوه الأنسجة. تثبيت الأنسجة غير السليم يمكن أن يؤدي إلى تغيير مورفولوجيا الأنسجة كما يمكن أن نرى في الشكل 10E. هذا البروتوكول، مثل معظم بروتوكولات تلطيخ SBF-SEM الحديثة، وقد تم تكييفها من إجراءات تلطيخ التي أوجزها Deerinck في عام 201017،استنادا إلى البقع osmium-thiocarbohydrazide-osmium التي أنشأتها ويلينغهام ورذرفورد في عام 198436. المعادن الثقيلة المستخدمة في هذا البروتوكول إضافة التباين إلى الهياكل الخلوية داخل عينة الأنسجة(الشكل 1). يحدث حضانة الأوسميوم الأولية مع انخفاض الأوسميوم الذي يرتبط بروابط C = C في الدهون غير المشبعة مما يؤدي إلى تلطيخ الغشاء والدهون37،38. يتم تقليل أوسميوم بواسطة فيروكيانيد البوتاسيوم، مما يساعد في تلطيخ الدهون المشبعة ويعمل أيضا على استقرار فوسفوليبيدات39،40. يضاف Thiocarbohydrazide في وقت لاحق كموردن يرتبط بالأوسميوم من الحضانة الأولى ، ويعمل كجسر يرتبط به المزيد من الأوسميوم في مرحلة لاحقة في البروتوكول41. خلات أورانيل، وهو ملح اليورانيوم، هو عامل متناقض فعال للدهون والأحماض النووية والبروتينات، في حين يعزز سترات الرصاص تباين البروتينات وال جليكوجينات. تقارب متفاوتة من هذه العوامل للمكونات الخلوية يعزز التباين العام داخل الأنسجة فوق وفوق حضانات أوسميوم42.
تصوير الوجه الكتلي
الشكل 11، الشكل 12، الشكل 13 توضح الآثار مجتمعة من الجهد ، بكسل يسكن الوقت وكثافة شعاع. تشير الممارسة التقليدية إلى أن الجمع بين الجهد المنخفض ووقت الإقامة القصير وكثافة الحزمة المنخفضة ضروري للتصوير الأمثل ومنع تلف الحزمة إلى كتلة العينة. خلافا لهذه الإعدادات، الشكل 11، الشكل 12، الشكل 13 توضح أن الفولتية العالية (على سبيل المثال، 7 كيلو فولت)، أطول يسكن مرات (32 ميكروس/بكسل) وكثافة شعاع أعلى (وضع 6 في حالتنا) يمكن أن تنتج جودة صورة متفوقة على الإعدادات التقليدية.
SBF-SEM يسمح لجمع صور المجهر الإلكتروني المسلسل التي يمكن جمعها على شكل مجموعة بيانات ثلاثية الأبعاد تتألف من voxels. في حين أن هذا هو استخدام قوي بشكل لا يصدق من SBF-SEM، وهذا الأسلوب يسمح أيضا للتصوير السريع والتكرار للأحداث البيولوجية النادرة أو الخلايا. يمكن مراقبة الحصول على الصور باستخدام SBF-SEM للأحداث النادرة ، وتوقف التصوير مؤقتا من أجل جمع صور أعلى من التكبير / الدقة لهذه الأحداث. وعلاوة على ذلك، يمكن إزالة الكتلة من غرفة المجهر وكتلة الوجه مقطعة لنقل المجهر الإلكتروني (TEM) التصوير. وبهذه الطريقة يمكن جمع مجموعات بيانات كبيرة من الأحداث النادرة باستخدام SBF-SEM وكذلك تقديرها على مقياس angstrom باستخدام TEM.

الشكل 1: SBF-SEM و TEM المقارنات في خطوات مختلفة في البروتوكول. يحتوي هذا البروتوكول على خطوات متعددة يتم فيها تلطيخ نسيج العينة بالمعادن الثقيلة. وهذا لا يؤثر فقط على تباين الأنسجة وتقدير الهياكل الخلوية والعضيات ، ولكن أيضا على مستويات الشحن التي تحدث عندما يتم تصوير الأنسجة. يحتوي هذا الشكل على ثلاث وجهات نظر متميزة للأنسجة المعدة: منظر منخفض التكبير(A و D و G)، وعرض تكبير عالي(B و E و H)، ومقارنة TEM لقرنيا الماوس المعدة (C و F و I). ويمكن ملاحظة أن صور التكبير الأعلى يمكن أن تؤدي إلى زيادة شحن الأنسجة ، حيث يتركز شعاع الإلكترون في منطقة أصغر من الأنسجة. الصف العلوي(A-C)هو عينة تمثيلية من الأنسجة المعالجة من خلال الانتهاء من الخطوة 1.8 ، وتم تلقيحها مع فيروكسيانايد البوتاسيوم ، التيتروكسيد الأوسميوم ، وثيوكاربوهيدرازايد. تظهر الأسهم في العمودين الأولين الواجهة الظهارية-السترومال كنقطة مرجعية. لاحظ مستوى التباين المنخفض مقارنة بالصفوف السفلية، بالإضافة إلى زيادة مستويات شحن الأنسجة. تمت معالجة العينة في الصف الأوسط(D-F)من خلال الانتهاء من الخطوة 1.10 ويستفيد من خطوة إضافية من tetroxide osmium ، وهو واضح أكثر تباينا من العينة في الصف العلوي. في حين أن الهياكل الخلوية يمكن تمييزها ، إلا أن الشحن لا يزال موجودا. العينة في الصف السفلي(G-I)يستفيد من بروتوكول تلطيخ كامل ولديه الحد الأدنى من شحن الأنسجة. يكشف التصوير TEM مستويات تباين الأنسجة التي نقلتها المعادن الثقيلة الموجودة في كل خطوة (العمود الأيمن): العضيات في بطانة الرحم القرنية (*) هي أكثر تباينا ووضوحا مع استمرار معالجة الأنسجة من خلال البروتوكول. بالإضافة إلى ذلك، تصبح تفاصيل الكولاجين والفيبريلين أكثر وضوحا (رأس السهم) مع اكتمال البروتوكول. لوحة A، D & G مقياس شريط = 50 ميكرومتر. لوحة B، E & H مقياس شريط = 10 ميكرومتر. لوحة C، F وأنا مقياس شريط = 1 ميكرومتر. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: التخطيطي من كتلة الأنسجة المضمنة، دبوس عينة، وإعداد النهائي. (أ) يجب وضع الأنسجة في اتجاه معروف في غيض جدا من قالب الراتنج والثلث العلوي من القالب مليئة الكربون الأسود المشبعة الراتنج. يجب أن تظل منطقة القالب الأبعد عن الأنسجة واضحة بحيث يمكن رؤية تسمية التجربة بوضوح. (ب)يجب خدش سطح دبوس عينة لإنتاج نمط الشبكة، وهذا يسمح لمنطقة أكبر من الاتصال لالغراء سيانواكريلات لتصلب بين كتلة عينة أعدت ودبوس. (ج) يجب أن يجعل الراتنج المشبع الأسود الكربوني منطقة واسعة من الاتصال برأس دبوس العينة ، ولكن يجب ألا تزيد المنطقة التي يتم قطعها بسكين الماس عن 1x1 مم. من الجيد تفتق الكتلة نحو الطرف. وهذا يقلل من قوى القطع على سكين الماس ومن خلال وجود قاعدة أوسع ، فإن الكتلة أكثر مقاومة للانفصال عن الدبوس أثناء المقطع. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
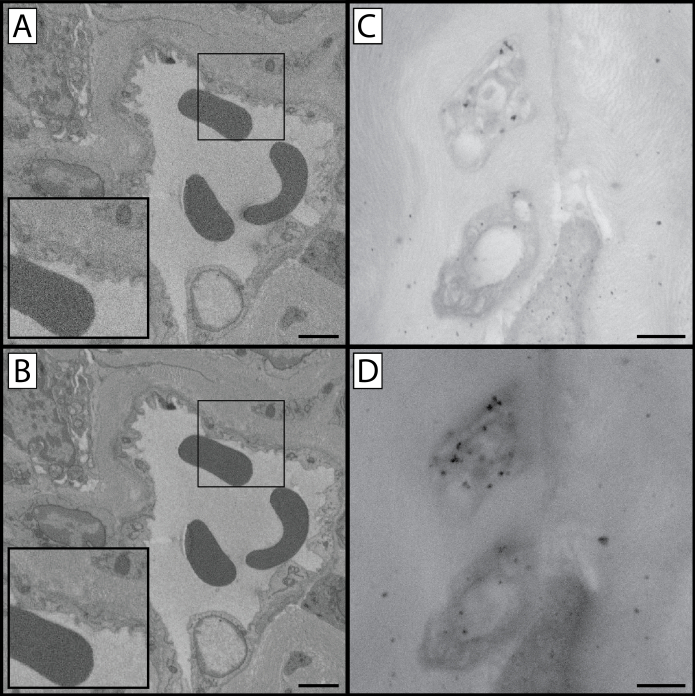
الشكل 3: مقارنة إعدادات التقاط الصور. ( A وB) لوحات A و B مقارنة جودة الصورة والقرار كدالة من الوقت يسكن بكسل. تم إنشاء لوحة A باستخدام 32 ميكروس / بكسل يسكن الوقت في 4 كيلو فولت ويعاني من انخفاض نسبة الإشارة إلى الضوضاء كما هو واضح في مظهر "محبب" من inset الموسع. تم إنشاء اللوحة B باستخدام 100 ميكروجرام /بكسل في وقت الإسهاب عند 4 كيلو فولت. زيادة الوقت يسكن بكسل يزيد من نسبة الإشارة إلى الضوضاء ويكشف عن مستوى متزايد من التفاصيل الخلوية، ولكن زيادة الوقت بكسل يسكن لديه القدرة على أن يؤدي إلى شحن الأنسجة و / أو تراكم الحرارة التي تخفف من كتلة ويدخل قطع القطع الأثرية (الثرثرة) عند تقسيم. تقارن اللوحتان C وD الصور الملتقطة في ظل ظروف تعرض متماثلة ولكن بقيمتين مختلفتين لشعاع kV. تم تلقيح الأنسجة في هذه الألواح بجسيمات نانوغولد منغم الذهب لإحداث اختلافات في أعماق اختراق الحزمة أكثر وضوحا. تم التقاط لوحة C في 9 كيلو فولت في حين تم القبض على لوحة D في 21 كيلو فولت. زيادة كيلو فولت لديه ميزة زيادة التباين (D)، ولكن يتم فقدان التفاصيل نتيجة لجمع الإلكترونات من عمق أكبر من الأنسجة (C). ونتيجة لأخذ عينات من مقطع عرضي أكبر، تظهر أعداد أكبر من جزيئات المناعة المحددة ل GAP 43 في حين تظل الوسم غير المحددة كما هي مما يؤدي إلى زيادة نسبة الإشارة إلى الضوضاء. لوحة A و B مقياس شريط = 2 ميكرومتر. لوحة C وD شريط مقياس = 1 ميكرومتر. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4:كثافة الحزمة، kV وحجم البقعة. (A)عند الاتصال بعينة الأنسجة، ينتج شعاع الإلكترون (الأزرق الفاتح) حجم تفاعل على شكل دمعة، يتم من خلاله إنتاج أشكال مختلفة من الطاقة من التفاعل بين إلكترونات الحزمة وعينة الأنسجة. شكل الدمعة هو وظيفة كثافة الأنسجة وتلطيخ المعادن الثقيلة جنبا إلى جنب مع طاقة الحزمة، وزاوية الميل من شعاع الإلكترون43. في حين يتم إنتاج الأشعة السينية والإلكترونات auger والإلكترونات الثالثة أثناء التصوير SBF-SEM ، فإن الشاغل الرئيسي هو مع الإلكترونات (الأزرق الداكن) والثانوية(الخضراء) 13. يتم إنتاج الصورة المنتجة مع التصوير SBF-SEM عن طريق جمع الإلكترونات المكثرة. تنشأ هذه الإلكترونات من التفاعلات المرنة بين الحزمة والعينة ، وتعتمد الإشارة التي تم جمعها بشكل كبير على العدد الذري للذرات التي تتفاعل معها - وبالتالي الحاجة إلى تلطيخ المعادن الثقيلة44. تنشأ الإلكترونات الثانوية من التفاعلات غير المواناة بين الحزمة والعينة ويعتمد الكشف عن إشارتها بشكل كبير على اتجاه السطح. لأن كتلة الوجه هو شقة في SBF-SEM، الإلكترونات الثانوية لا تسهم بشكل مفيد في إشارة جمعها13. في الواقع ، يمكن أن يكون تراكم الإلكترون الثانوي على سطح الكتلة مصدرا رئيسيا للشحن ويكون له تأثير ضار على جودة الصورة2. (ب)يوضح هذا الرسم البياني العلاقة بين كثافة الحزمة، وشعاع kV، وحجم البقعة. حجم البقعة هو الدقة المكانية للشعاع ، ويحدد الحد الأقصى دقة الصور التي يتم إنتاجها. خفض كيلو فولت يزيد من حجم البقعة، ولكن أيضا يقلل من عمق التصوير مما يسمح لتقدير أدق من التفاصيل. وهذا له تأثير تقليل إشارة يمكن الكشف عنها كذلك. زيادة كثافة الحزمة يوفر تحسنا أوليا على حجم بقعة والكشف عن إشارة، ولكن بسرعة يزيد من مستويات شحن الأنسجة. وفي نهاية المطاف، تعتمد كثافة الحزم وقيم kV المختارة على العينة وأفضل تحديد تجريبيا فيما يتعلق بالمسألة العلمية المطروحة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: شبكة حزمة الألياف الدقيقة الخالية من الإيلاستين في قرنية الفأرة. إعادة بناء ثلاثية الأبعاد للألياف الدقيقة (بيضاء) مرتبطة ارتباطا وثيقا بالخلايا القرنية (الأصفر والبرتقالي والأخضر) داخل ستروما القرنية. يمكن رؤية الألياف الدقيقة المجاورة ، وفي بعض الحالات داخل الأخاد الضحلة في ، الخلايا القرنية (السهام) (A). يتم تنظيم هذه الشبكة من الألياف الدقيقة الخالية من الإيلاستين في طبقات متميزة داخل ستروما القرنية (B). شريط المقياس = 2 ميكرومتر. كتلة الصورة المعاد بناؤها هي 45x45 ميكرومتر في محور س و ص، و 30 ميكرومتر في محور z مع voxel دقة 22x22x100 نانومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6:إعادة بناء الأعصاب القرنية التي تمر عبر الصفيحة القاعدية عند الحدود الظهارية السترومالية. ويمكن رؤية هذا العصب لتشعب قبل الاختراق. بعد اختراق الظهارة ، خضع كلا الفرعين العصبيين لتشعب. الميتوكوندريا (الأصفر) مرئية في الأجزاء السترومالية والظهارية من حزمة الأعصاب. شريط المقياس = 2.5 ميكرومتر. كتلة الصورة المعاد بناؤها هي 25x25 ميكرومتر في محور س و ص، و 14 ميكرومتر في محور z مع دقة voxel من 12x12x100 نانومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 7:الأوعية الدموية الأطراف والخلايا المرتبطة بها في القرنية الماوس الطرفية. يمكن رؤية صورة واحدة(A)من كتلة صورة ثلاثية الأبعاد(B)تنتقل من خلالها السفينة والحزمة العصبية والخلايا المرتبطة بها. تظهر اللوحة C وعاء أعيد بناؤه (أحمر) مع بيريسيت مرتبط (رمادي) ملفوف حوله يغطي تقاطعات الخلايا البطانية. حزمة الأعصاب (الأزرق) bifurcates على مقربة من هذه السفينة لأنها تنتقل من خلال الأنسجة. يمكن رؤية العدلات (الصفراء) بالتوازي مع المحور الطويل للوعاء ، مع نواته متعددة الأشكال المرئية داخل جسم الخلية والوروبود الزائد المرئي كبروز نحو يمين الصورة. خلية سارية (أرجواني) مرئية على الجانب السفلي من السفينة. لوحة D يعزل هذه الخلية الصاري، حيث حبيبات لها (الأخضر) يمكن أن ينظر إليه بسهولة أكبر تراكب النواة (الأرجواني) داخل الخلية. يسلط الفريق E الضوء على الهياكل الخلوية المتراكبة على عمليات إعادة البناء الخلوية ، مع وجود نواة بطانة البطانية يشار إليها باللون الأزرق ، والجسيمات الدقيقة الملتصقة مرئية في تجويف السفينة (البرتقالي). تظهر الأسهم حدود الخلية الخلية بين الخلايا البطانية، والتي يمكن أن ينظر إليها على أنها التلال التي أثيرت تمتد على طول الخلايا على الجانب الإنارة من السفينة. لوحة شريط مقياس = 2 ميكرومتر. كتلة الصورة المستخدمة لإعادة بناء هذه الخلايا هي 30x30 ميكرومتر في محور س و ص، و 42.5 ميكرومتر في محور z مع دقة voxel من 14.6x14.6x100 نانومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 8:شبكة الأوعية الدموية المعاد بناؤها من طبقة الألياف العصبية غير البشرية في شبكية العين. (أ) صورة 200x200 ميكرومتر SBF-SEM من شبكية العين الرئيسيات التي اتخذت في 8192x8192 بكسل. الموقع عينة ~ 500 ميكرون من هامش الحافة الزمنية السفلية للعين صحية مع عدم وجود علم الأمراض. تم التقاط سلسلة الصور التي أعيد بناؤها في لوحات C &؛ D في 2048x2048 بكسل ، مع توقف التصوير مؤقتا بحيث يمكن تصوير المناطق المهتمة على 8192x8192 بكسل. لوحة B هي المنطقة المشقوقة من لوحة A، مأخوذة مباشرة من الصورة الأصلية. لاحظ العدد الكبير من المحاور والميتوكوندريا الخاصة بهم. (C) قسم Orthoslice من خلال حجم الأنسجة 200x200x200 ميكرومتر من العين التحكم أدنى طبقة الألياف العصبية الزمنية، مع الأوعية الدموية مجزأة. (D) Z-الإسقاط من الألياف العصبية طبقة الأوعية الدموية. توضح هذه السلسلة الدقة الممكنة في حقل كبير باستخدام هذه المنهجية. لوحة شريط مقياس = 20 ميكرومتر. صورة سلسلة voxel القرار هو 97.6x97.6x500 نانومتر. دقة بكسل المنطقة ذات الفائدة هي 24.4x24.4 نانومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
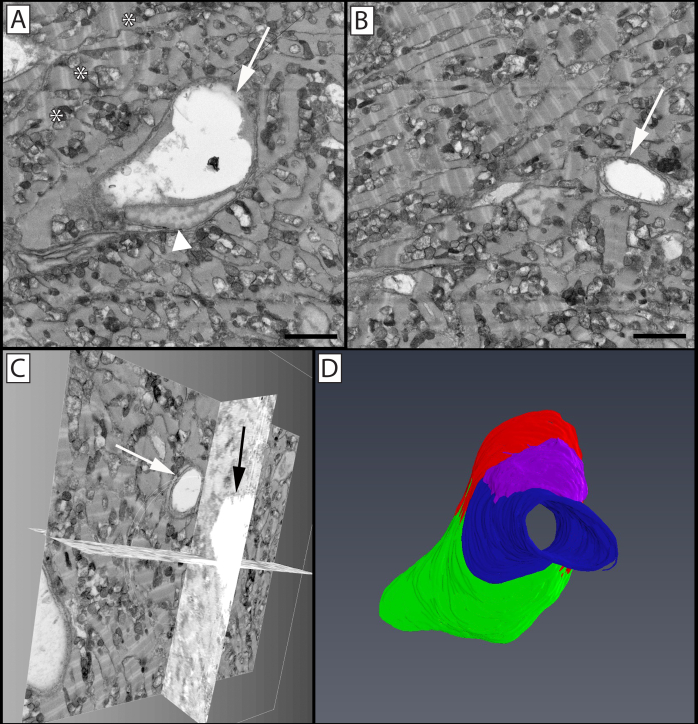
الشكل 9: تجزئة وتقديم حجم 3D من الأوعية في دانيو العملاقة(Devario malabaricus)قلب مضغوط. (A) ميكروجراف ثنائي الأبعاد في كومة صورة، مما يدل على ملامح وعاء مركزي بحجم venular (السهم) ونواة البطانية (رأس السهم)، مع الخلايا العضلية القلبية المحيطة الغنية في الميتوكوندريا وساركوميرس منظم تنظيما جيدا (*). (ب) ميكروجراف ثنائي الأبعاد لمكدس الصور مع وعاء ذو حجم شعري (سهم). (ج) الإسقاطات البيولوجية للكومة ميكروجراف تظهر الشعرية في لوحة B المتوقعة من خلال شريحة متعامدة واحدة. (D) تقديم 3D من الخلايا البطانية مجزأة بطانة السفينة المعاد بناؤها. يتضح في الأخضر والأحمر والأزرق والأرجواني هي أربع خلايا بطانة منفصلة; يمكن رؤية الخلية البطانية المصورة باللون الأزرق في المقطع العرضي في اللوحة B (السهم) ، في حين أن الخلايا البطانية المصورة باللون الأحمر (السهم) والأخضر (رأس السهم) تظهر في المقطع العرضي في لوحة A. لوحات A و B شريط مقياس = 2 ميكرومتر. كتلة الصورة المعاد بناؤها هي 30x30 ميكرومتر في محور س و ص، و 16 ميكرومتر في محور z بدقة voxel من 14.6x14.6x100 نانومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
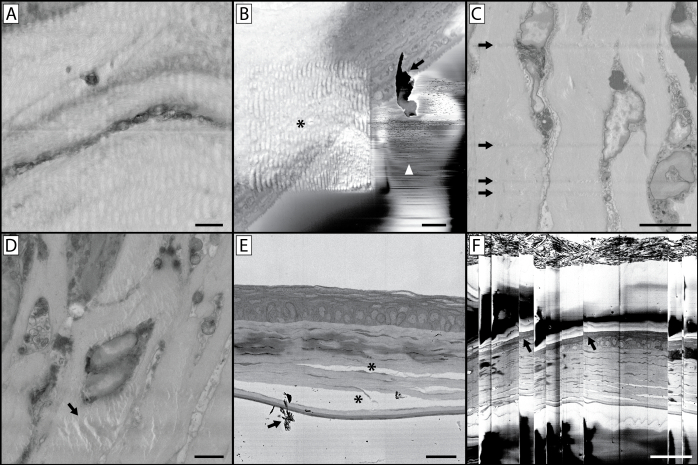
الشكل 10: مضاعفات التصوير والتحف. (أ) الطبيعة المتموجة والمشوهة لهذه الصورة هي نتيجة للتصوير باستخدام وقت البكسل الذي هو طويل جدا. هذا يسخن كتلة الراتنج، وترك وجه كتلة لينة ومطاطية مما يؤدي إلى صورة مشوهة عند القطع. (ب)تحتوي هذه الصورة على مجموعة من القطع الأثرية. تشير النجمة إلى تشوه متموج ناجم عن التصوير المسبق عند تكبير أعلى وعلى غرار اللوحة A، وقد خفف تركيز الحزمة على منطقة أصغر مع وقت أطول للبكسل من الراتنج في هذه المنطقة المثيرة للاهتمام. وفي حين أن صورة التكبير الأعلى التي تم جمعها كانت خالية من القطع الأثرية، فإن هذا يمكن أن يؤدي إلى سلسلة لاحقة من الصور حيث تبدو العينة الكامنة وراء منطقة الاهتمام مشوهة. توضح هذه اللوحة أيضا مسألة تراكم الحطام على وجه الكتلة (السهم) أثناء التصوير ، ويشار إليه أيضا بالسهم في اللوحة E. إذا أصبح هذا مشكلة التصوير المستمر، سيكون من الضروري لكسر الفراغ، وفتح الغرفة وتفجير الحطام المتراكمة على سكين الماس وحول العينة. يمكن أن تؤدي التصريفات الصغيرة للإلكترونات من وجه الكتلة إلى تغيرات التباين السريع والخطوط التي يشير إليها رأس السهم الأبيض. (ج)توضح هذه الصورة خدوش السكين على وجه الكتلة. يمكن أن يحدث هذا بسبب سكين التالفة، أو تراكم الحطام على حافة السكين. (د)القطعة الأثرية المشار إليها (السهم) هو نتيجة شعاع الإلكترون تركز على (دون تقسيم) وجه كتلة لفترة طويلة من الزمن مع العينة لا تزال في غرفة التصوير. (ه) التثبيت غير السليم للأنسجة يمكن أن يؤدي إلى فصل الهياكل الخلوية والأنسجة الضامة (*). (F) إذا كان هناك كمية كبيرة من الشحن يحدث في كتلة الأنسجة أو الراتنج الخاص بك، يمكن أن يحدث تراكم والتفريغ اللاحقة مما يؤدي إلى صورة "تخطي" كما هو رأينا في هذه الصورة. لاحظ تشويه النسيج في الصورة عند نقاط التخطي هذه (الأسهم). لوحة شريط مقياس = 1 ميكرومتر. لوح ب مقياس شريط = 2 ميكرومتر. لوحة C شريط مقياس = 5 ميكرومتر. لوحة D مقياس شريط = 2 ميكرومتر. لوحة E مقياس شريط = 25 um. شريط مقياس لوحة F = 50 um. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 11:تصوير الأنسجة في 3 كيلو فولت باستخدام مختلف الأوقات يسكن بكسل وكثافة شعاع. كانت جميع الصور تتجمع باستخدام شعاع 3 كيلو فولت ، وكثافة الحزمة على مقياس خاص بجهاز يتراوح بين 1 و 20. المجال المصور هو من التجويف الأوعية الدموية التي تحتوي على خلايا الدم البيضاء والحمراء. في هذا كيلوفولت منخفضة من الصعب أن نقدر التفاصيل الخلوية. زيادة الوقت يسكن بكسل كان تأثير يذكر. زيادة كثافة الحزمة إلى 6 تباين محسن للصورة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
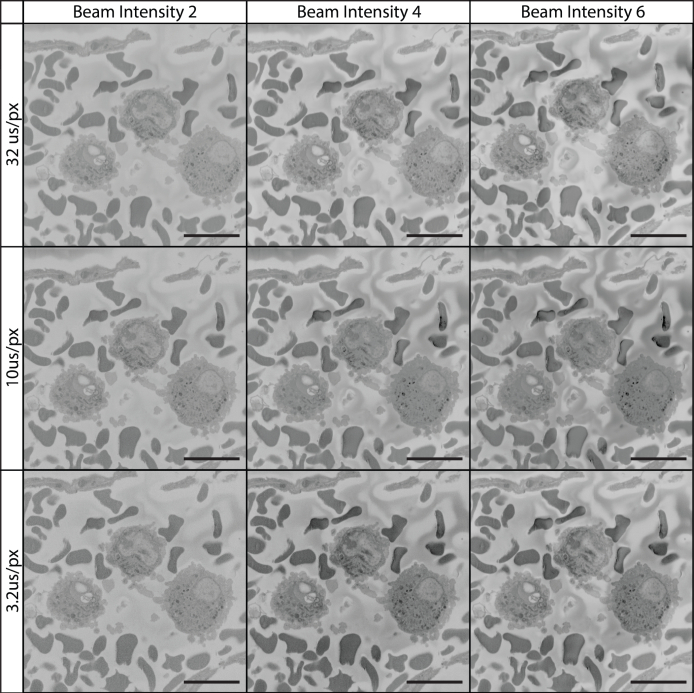
الشكل 12: تصوير الأنسجة في 7 كيلو فولت باستخدام مختلف بكسل يسكن مرات وكثافة شعاع. تم جمع جميع الصور باستخدام شعاع 7 كيلو فولت ، وكثافة الحزمة على مقياس خاص بجهاز يتراوح بين 1 و 20. المجال المصور هو من التجويف الأوعية الدموية التي تحتوي على خلايا الدم البيضاء والحمراء. في 7 كيلو فولت، ساهمت زيادة كثافة الحزم ووقت البكسل في التصوير عالي الجودة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 13:تصوير الأنسجة في 12 كيلو فولت باستخدام مختلف بكسل يسكن مرات وكثافة شعاع. تم جمع جميع الصور باستخدام شعاع 12 كيلو فولت ، وكثافة الحزمة على مقياس خاص بجهاز يتراوح بين 1 و 20. المجال المصور هو من التجويف الأوعية الدموية التي تحتوي على خلايا الدم البيضاء والحمراء. عند 12 كيلو فولت، يتم تحسين التصوير من خلال ضبط وقت البكسل وكثافة الحزمة. يتم تقليل الشحن / غيابه في أوقات أقصر للبكسل بينما تكون التفاصيل الخلوية وتباين الصورة أفضل مع وقت أطول للبكسل وكثافة شعاع أعلى. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
الغرض من ورقة الأساليب هذه هو تسليط الضوء على منهجية إعداد الأنسجة والتصوير التي سمحت لمختبرنا بالتقاط صور المجهر الإلكتروني التسلسلي عالية الدقة بشكل موثوق ، والإشارة إلى الخطوات الحاسمة التي تؤدي إلى هذه النتيجة وكذلك المزالق المحتملة التي يمكن أن تحدث عند إجراء التصوير SBF-SEM. النجاح باستخدام هذا البروتوكول يتطلب التثبيت السليم للأنسجة، وتلقيح المعادن الثقيلة في العينة، وتعديلات من الراتنج تضمين للحد من الشحن، فضلا عن فهم المجهر وإعدادات التصوير المستخدمة لجمع الصور. مقولة ، "الجودة في ، والجودة" هو بديهية مناسبة للتصوير SBF - SEM. وبما أن الهدف من SBF-SEM غالبا ما يكون تقدير أو تحديد كمية التفاصيل فوق الهيكلية ، يجب إيلاء مزيد من الحذر لاستراتيجية التثبيت من أجل ضمان عدم حدوث تشوه الأنسجة. إذا أصبحت الأنسجة مشوهة في أي وقت في إعداد العينات (أي، يخضع لتورم، تقلص، أو تعطيل مورفولوجيا الخلوية)، ثم إعادة بناء الأنسجة وتكميم لن تسفر عن بيانات دقيقة. علاوة على ذلك، يمكن أن يؤدي استخدام إعدادات التصوير غير الصحيحة إلى فقدان البيانات التي لا يمكن استعادتها لأن التصوير SBF-SEM عملية مدمرة. بالإضافة إلى ذلك، يجب استخدام العناية عند تحميل عينة من الأنسجة حيث يمكن أن تتلف سكين الماس الحساسة عن طريق إعداد عينة متسرعة أو غير صحيحة. وهذا يمكن أن يؤدي إلى رقائق أو فواصل في السكين، والتي يمكن أن تترك علامات الصفر مرئية في الصور(الشكل 10C). يمكن أيضا أن تتلف سكين الماس من قبل هياكل متكلسة، حبيبات الصلبة، أو الزجاج جزءا لا يتجزأ بطريق الخطأ (على سبيل المثال، من الكواشف).
في حين أن غالبية الأدب SBF-SEM حتى الآن يستخدم الجهد تسارع شعاع في نطاق 1 إلى 3 كيلو فولت جنبا إلى جنب مع بكسل يسكن مرات أقرب إلى 1-5 ميكروس / بكسل (الشكل 11)45,46,47,48,49، يستخدم البروتوكول الحالي فولتية تسارع من 7-12 كيلو فولت ووقت بيكسل يسكن 12 ميكروس / بكسل للتصوير التسلسلي و 32 ميكروجرام / بكسل للمناطق التي تهم التصوير (أرقام 12 و 13). هذه الإعدادات، إلى جانب سمك شريحة من 100-200 نانومتر يسمح للتصوير عالية الجودة وعالية الدقة من مجموعة واسعة من الأنسجة البيولوجية. زيادة الجهد تسارع يسمح لزيادة في التباين، والقرار، فضلا عن نسبة الإشارة إلى الضوضاء. زيادة وقت الإقامة يزيد من الدقة ونسبة الإشارة إلى الضوضاء ، في حين أن زيادة سمك الشريحة تؤدي إلى انخفاض الشحن على سطح الكتلة أثناء القسمة وتحارب الضرر الناجم عن الحزمة في الصور اللاحقة14. في حين أن طريقة التصوير هذه قد تختلف عن الاتفاقية ، فإن الصور ومجموعات البيانات المنتجة تتحدث عن نفسها. إذا كان علينا التكهن حول سبب هذا النجاح ، فمن الممكن أنه نتيجة لمزيجنا الفريد من قيم kV العالية ، وأوقات أطول للبكسل ، وإعداد الكتلة. تؤدي زيادة التصوير kV إلى زيادة حجم التفاعل بين شعاع الإلكترون والعينة. حجم التفاعل هذا هو أعمق وكذلك أوسع مما أدى إلى زيادة نظرية في عدد الإلكترونات المكتشفة التي تنشأ من أعمق داخل كتلة العينة، أو من مقطع عرضي أوسع من الأنسجة مع زيادة قطر قطر قطر قطر حجم البقعة. وبما أن SBF-SEM مهتم بالتفاصيل السطحية للكتلة ، فإن هذا يؤدي إلى انخفاض نظري في نسبة الإشارة إلى الضوضاء. ومع ذلك ، فإن الزيادة في kV تدفع أيضا الإلكترونات إلى عمق العينة حيث تكون أقل عرضة للهروب من الكتلة والمساهمة في الإلكترونات التي يجمعها الكاشف. مع الفائدة المضافة لزيادة الإشارة عبر فترات أطول للبكسل وكثافة شعاع أعلى ، فمن الممكن أن تؤدي طريقة التصوير هذه إلى زيادة أكبر في الإشارة من سطح العينة فيما يتعلق بالضوضاء الناشئة داخل حجم التفاعل. بالإضافة إلى ذلك ، تساعد زيادة توصيل العينة المقدمة مع طلاء أسود الكربون وكذلك الفضة والذهب على تحسين تراكم الشحنة الذي يحدث الآن أعمق داخل الكتلة وأبعد من وجه الكتلة. في الحقيقة الشكل 11, الشكل 12, الشكل 13 تبين أنه كما kV هو زيادة شحن العينة يبدأ في الانخفاض كما أنه من المحتمل أن تدفع أعمق في كتلة. يمكن التقاط العينات المصورة عند التكبير المنخفض بتباين كاف باستخدام الإعدادات التقليدية ، ولكن هذه الصور غالبا ما تفتقر إلى التفاصيل عند الفحص الدقيق. تظهر بياناتنا بوضوح أنه عند استخدام تكبير عالي نسبيا حيث يكون الهدف هو التفاصيل الخلوية ، فإن زيادة الإعدادات التقليدية يمكن أن تسفر عن نتائج استثنائية. مقالة عام 2020 من قبل P. Goggin، وآخرون توفر جدولا مفيدا يحدد تأثير تغيير إعدادات التصوير على جودة الصورة النهائية، وهي إشارة مفيدة للتشاور إذا أصبح تحسين البروتوكول للأنسجة الجديدة ضروريا14. سمك شريحة 100-200 نانومتر الموصى بها في هذا البروتوكول له فائدة إضافية من السماح لجمع مجموعات البيانات SBF-SEM كبيرة بمعدل سريع. أثناء جمع الصور في 12μs/px على سبيل المثال، التصوير من خلال عمق 100 ميكرومتر في 2048x2048 بكسل يتطلب ~ 14 ساعة في حين تقسيم في 100nm/section ولكن يتطلب ~ 56 ساعة إذا قسمت في 25nm / القسم. بينما يبقى الدقة x,y دون تغيير نتيجة لسمك المقطع، لا تمثل القدرة المضافة على الصورة باستخدام قيم kV أعلى وأوقات البكسل التي تأتي مع أقسام أكبر، من المهم ملاحظة أن الدقة على طول المحور z تعاني. فقدان الدقة z هو اعتبار مهم وينبغي التفكير عند اتخاذ قرار حول كيفية توجيه الأنسجة في كتلة الراتنج وفيما يتعلق بجو التصوير ، ولديه القدرة على منع دراسة ميزات الخلايا الصغيرة أو التفاعلات (على سبيل المثال ، التشنجات المتشابكة أو السمات داخل الخلايا على مقياس عشرات النانومترات). ومع ذلك ، بالإضافة إلى وقت التصوير السريع ، فإن هذا البروتوكول له فوائد إضافية إضافية من حيث أنه ينتج بسرعة مجموعات بيانات مثالية للتحليل stereological وكذلك دراسة الأحداث أو الخلايا البيولوجية النادرة. كما يمكن أن يساعد سمك القسم الأكبر في إعادة البناء اليدوي ثلاثي الأبعاد، حيث أن منطقة مساحتها 100 ميكرومتر مقسمة إلى 100 نانومتر/مقطع تتطلب تقسيما يدويا ل 1000 صورة في حين أن نفس المنطقة المقسمة إلى 25 نانومتر/مقطع تتطلب تقسيما يدويا ل 4000 صورة.
SBF-SEM لديه فائدة من توليد مجموعات بيانات كبيرة في فترة قصيرة نسبيا. في حين يمكن إجراء تحليل البيانات باستخدام أساليب كمية مثل الستيريوولوجيا ، والتي سيتم مناقشتها أدناه ، يمكن أن يكون في كثير من الأحيان مفيدة لإنشاء عمليات إعادة بناء ثلاثية الأبعاد عن طريق تجزئة الصور. يمكن اعتبار كومة الصور التي تم إنشاؤها باستخدام SBF-SEM على أنها مجموعة من voxels ، في حين أن التقسيم هو عملية تعيين هذه voxels إلى كائنات معرفة من قبل المستخدم وبالتالي إنشاء تمثيلات ثلاثية الأبعاد لهياكل الأنسجة. هذه إعادة الإعمار غالبا ما توفر منظورا غير مرئي حتى الآن على البنية الفوقية الأنسجة والتفاعل الخلية الخلية (الشكل 5، الشكل 6، الشكل 7، الشكل 8، الشكل 9). وعلاوة على ذلك، بمجرد إنشاء عمليات إعادة الإعمار، يمكن استخدام البيانات المتأصلة في عمليات إعادة الإعمار لاستخراج ثروة من المعلومات من الأنسجة المجزأة. المعلمات التي تتراوح بين مساحة السطح والحجم والطول والمسافة ، فضلا عن البيانات الزاوي كلها متاحة بسهولة بمجرد إنشاء إعادة الإعمار50،51. في حين أن هذا يمكن أن يكون مفيدا بشكل لا يصدق ، خاصة عندما يقترن بمقاطع الفيديو والصور التي يتم سحبها من مجموعات البيانات المعاد بناؤها ، فإن الوقت اللازم للتجزئة اليدوية هو اعتبار مهم عند محاولة استقراء البيانات من مجموعات بيانات SBF-SEM. هناك حاليا مجموعة من البرامج المجانية والاشترائية المتاحة للتجزئة اليدوية وشبه اليدوية لمداخن الصور SBF-SEM. خيار واحد مجاني لبرنامج إعادة الإعمار هو حزمة معالجة الصور فيجي ل ImageJ، وهو برنامج معالجة الصور مفتوحة المصدر، والذي يحتوي على البرنامج المساعد محرر تجزئة التي تسمح للتجزئةاليدوية 52،53. بالإضافة إلى ذلك ، يقدم برنامج إعادة البناء خيار تجزئة حرة بديلة54 (الشكل 8). في حين يحتمل أن تكون مكلفة، وخيارات قابلة للشراء غالبا ما تحتوي على مجموعات ميزات أكثر قوة، مثل عمليات التقسيم شبه الآلي أو مجموعات إنشاء الأفلام والصور. وقد استخدم أحد هذه الخيارات لإنشاء عمليات إعادة الإعمار الموجودة في الشكل 5والشكل 6 والشكل 7 والشكل 9 (التفاصيل المتاحة في جدول المواد). بالإضافة إلى ذلك ، تتوفر أدوات لإنشاء وتحليل وتقديم عمليات إعادة الإعمار ثلاثية الأبعاد المستندة إلى التباين باستخدام الواقع الافتراضي مع إمكانية تسريع عملية إعادة الإعمار بشكل كبير20و55. في حين لا تتوفر دائما لجميع التطبيقات، ومجموعة من أدوات البرمجيات المتاحة للتجزئة اليدوي بمساعدة الكمبيوتر التي لديها القدرة على تقليل كبير في الوقت اللازم للتجزئة56،57،58. وبغض النظر عن البرمجيات المستخدمة، فإن التفكير المسبق وفهم السؤال الذي تتم الإجابة عليه، أو الفجوة في المعرفة التي يتعين سدها، من خلال عمليات إعادة الإعمار المتسلسلة ينبغي أن تسبق التقسيم، لأن العملية شاقة وتكد الوقت.
إنتاج إعادة الإعمار 3D يأتي مع الاعتبارات الخاصة بها. مع أكبر مجموعات البيانات معالجة السلطة يمكن أن يكون عاملا مقيدا ، وذلك الاستفادة المثلى من استخدام موارد النظام يمكن أن تكون حاسمة للحفاظ على سير العمل المنتجة وتسريع عملية إعادة الإعمار وتقديم. عند تقديم إعادة بناء ثلاثية الأبعاد ، يقوم معظم البرامج بتحويل أكوام الصور المجزأة إلى سطح يتألف من مثلثات مترابطة. إذا كان مشروع إعادة الإعمار كبيرا أو معقدا ، فإن تقديم هذه المثلثات قد يتطلب قدرا كبيرا من قوة الحوسبة. أثناء العمل على إعادة بناء ثلاثية الأبعاد ، يمكن أن يكون من المفيد الحد من عدد المثلثات التي يمكن لبرنامج إعادة الإعمار استخدامها لتحويل الصور المجزأة إلى أسطح أعيد بناؤها. يمكن أن يكون هذا مفيدا في رصد التقدم المحرز في إعادة الإعمار ثلاثي الأبعاد أثناء عملية التقسيم. بمجرد اكتمال التقسيم ، يمكن إزالة حد المثلث قبل عرض الصور أو مقاطع الفيديو الخاصة بإعادة الإعمار. بدلا من ذلك ، وإذا كان برنامج إعادة الإعمار يسمح لذلك ، وجدنا النجاح في رصد التقدم المحرز في إعادة الإعمار باستخدام تقديم حجم بدلا من توليد السطح. حجم التقديم ، في حين لا تكون مناسبة للصور أو أشرطة الفيديو المخصصة للنشر أو العرض ، ويتطلب أقل بكثير من قوة المعالجة ، وعلى هذا النحو يمكن أن تكون مفيدة في توفير تجربة سلسة عند إعادة بناء وإعداد الصور وأشرطة الفيديو من عمليات إعادة الإعمار. بالإضافة إلى ذلك، فمن الأفضل عند تقسيم مجموعة بيانات SBF-SEM يدويا لتعريف كل كائن لإعادة بنائه بمعرف فريد خاص به. إذا كان حقل من الخلايا الظهارية يجري إعادة بناء على سبيل المثال، بدلا من تعيين جميع الخلايا الظهارية إلى مجموعة voxel بعنوان "ظهارة"، ينبغي تعيين كل خلية الظهارية اللقب الخاصة بها (أي، Epi1، Epi2، Epi3، الخ). وهذا يتيح حرية أكبر عند اكتمال إعادة الإعمار، حيث يمكن تضمين كل خلية أو استبعادها من التقديم النهائي، أو تعيين ألوان أو شفافيات مختلفة، أو إزالتها أو إدخالها بشكل فردي إذا تم إنتاج فيديو. علاوة على ذلك، يسمح هذا المقاييس مثل المساحة السطحية أو وحدة التخزين التي سيتم جمعها من كل كائن المعاد بناؤه بدلا من مجموعة الكائنات ككل.
أداة أخرى قوية بشكل لا يصدق لاستخراج البيانات الكمية من مداخن الصور SBF-SEM هي ممارسة التجسم. كما يستفيد علم المجسمات من العلاقات الرياضية المتأصلة بين الأجسام ثلاثية الأبعاد وتمثيلاتها ثنائية الأبعاد (أي مجهر الإلكترون). مجموعات بيانات SBF-SEM مثالية لتطبيق الستيريوولوجيا ، حيث أن هذه الطريقة لاستخراج المعلومات ثلاثية الأبعاد من مجموعات البيانات الكبيرة أقل كثافة في الوقت والعمالة بالمقارنة مع إعادة الإعمار المجزأة. تتكون التجسيمات بشكل عام من تطبيق الشبكات الهندسية على الصور العشوائية ، التي تم أخذ عينات منها بشكل موحد ، وقد استخدمت على نطاق واسع على مدى السنوات ال 50 الماضية من أجل إنتاج تقديرات دقيقة وغير متحيزة لعدد الخلايا / العضيات ، والطول ، والمساحة السطحية ، والحجم21،59،60،61،62،63. في حين أن عمليات إعادة الإعمار ثلاثية الأبعاد يمكن أن تكون مثيرة للإعجاب وتوفر منظورا جديدا للأنسجة البيولوجية ، إلا أنها غالبا ما تكون أسرع وأكثر دقة وقابلية للاستنساخ ، وتؤدي إلى استخدام أحجام عينات كبيرة نهجا ستيريولوجيا لاستخراج البيانات. في حين أن هناك العديد من الأوراق التي تناقش التطبيق العملي للجسم64،65،66، فإن عددا من الكتب المدرسية تقدم لمحات عامة مفيدة ومتعمقة للمنهجية بالإضافة إلى توفير عدد من الشبكات الستيريولوجية التي يمكن تطبيقها على دراسة البنية الفوقية للأنسجة67و68و69.
SBF-SEM هو وسيلة تصوير قوية تسمح بالتقدير ثلاثي الأبعاد للبنية فوق البنية التحتية للأنسجة. في حين أن القدرة على إنشاء مجموعات بيانات ثلاثية الأبعاد بدقة SEM تضع الأسئلة التي لم يتم الرد عليها من قبل في متناول أيدينا ، فإن إعداد الأنسجة السليم وفهم التصوير SBF-SEM أمر بالغ الأهمية لنجاح الدراسات التي تستخدم طريقة الفحص المجهري هذه. ويحدونا الأمل في أن يؤدي تطبيق هذا البروتوكول على الدراسات المستقبلية إلى مزيد من التبصر في الأسرار البيولوجية التي تحيط بنا، وأن يواصل دفعنا إلى آفاق المعرفة الإنسانية.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
ونود أن نشكر الدكتور سام هانلون وإيفلين براون ومارغريت غوندو على مساعدتهم التقنية الممتازة. تم دعم هذا البحث جزئيا من قبل المعاهد الوطنية للصحة (NIH) R01 EY-018239 و P30 EY007551 (المعهد الوطني للعيون) ، جزئيا من قبل مؤسسة الأسد للبصر ، وجزؤا من قبل NIH 1R15 HD084262-01 (المعهد الوطني لصحة الطفل والتنمية البشرية).
Materials
| Name | Company | Catalog Number | Comments |
| 1/16 x 3/8 Aluminum Rivets | Industrial Rivet & Fastener Co. | 6N37RFLAP/1100 | Used as specimen pins. |
| 2.5mm Flathead Screwdriver | Wiha Quality Tools | 27225 | |
| Acetone | Electron Microscopy Sciences | RT 10000 | Used to dilute silver paint. |
| Aspartic Acid | Sigma-Aldrich | A8949 | |
| Calcium Chloride | FisherScientific | C79-500 | |
| Conductive Silver Paint | Ted Pella | 16062 | |
| Denton Desk-II Vacuum Sputtering Device equipped with standard gold foil target | Denton Vacuum | N/A | This is the gold-sputtering device used by the authors, alternates are acceptable. |
| Double-edged Razors | Fisher Scientific | 50-949-411 | |
| Embed 812 | Electron Microscopy Sciences | 14120 | |
| Gatan 3View2 mounted in a Tescan Mira3 Field emission SEM | Gatan & Tescan | N/A | This is the SBF-SEM device used by the authors, alternates are acceptable. |
| Glass Shell Vials, 0.5 DRAM (1.8 ml) | Electron Microscopy Sciences | 72630-05 | |
| Gluteraldehyde | Electron Microscopy Sciences | 16320 | |
| Gorilla Super Glue - Impact Tough | NA | NA | Refered to as cyanoacrylate glue in text. |
| Ketjen Black | HM Royal | EC-600JD | Refered to as carbon black in text. |
| KOH | FisherScientific | 18-605-593 | |
| Lead Nitrate | Fisher Scientific | L62-100 | |
| Microwave | Pelco | BioWave Pro | This is the microwave used by the authors, alternates are acceptable. |
| Osmium Tetroxide | Sigma-Aldrich | 201030 | |
| Potassium Ferrocyanide | Sigma-Aldrich | P9387 | |
| Silicone Embedding Mold | Ted Pella | 10504 | |
| Sodium Cacodylate Trihydrate | Electron Microscopy Sciences | 12300 | |
| Samco Transfer Pipette | ThermoFisher Scientific | 202 | Used to make specimen pin storage tubes. |
| Swiss Pattern Needle Files | Electron Microscopy Sciences | 62115 | |
| Thiocarbohydrazide | Sigma-Aldrich | 223220 | |
| Uranyl Acetate | Polysciences, Inc. | 21447-25 | |
| Reconstruction Software | |||
| Amira Software | Thermo Scientific | N/A | Used to create the reconstructions found in figures 5-7 and 9. |
| Fiji (Fiji is Just ImageJ) | ImageJ.net | N/A | TrakEM2 can be added to Fiji to asist in manual segmentation. |
| Microscopy Image Browser (MIB) | University of Helsinki, Institute of Biotechnology | N/A | |
| Reconstuct Software | Neural Systems Lab | N/A | |
| SuRVoS Workbench | Diamond Light Source & The University of Nottingham | N/A | |
| SyGlass | IstoVisio, Inc. | N/A | Allows for reconstruction in virtual reality and histogram-based reconstruction methods. |
References
- Leighton, S. B. SEM images of block faces, cut by a miniature microtome within the SEM - a technical note. Scanning Electron Microscopy. , 73-76 (1981).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three-dimensional tissue nanostructure. PLOS Biology. 2 (11), 329 (2004).
- He, Q., Hsueh, M., Zhang, G., Joy, D. C., Leapman, R. D. Biological serial block face scanning electron microscopy at improved z-resolution based on Monte Carlo model. Scientific Reports. 8 (1), 12985 (2018).
- Zankel, A., Wagner, J., Poelt, P. Serial sectioning methods for 3D investigations in materials science. Micron. 62, 66-78 (2014).
- Titze, B., Genoud, C. Volume scanning electron microscopy for imaging biological ultrastructure. Biology of the Cell. 108 (11), 307-323 (2016).
- Ohta, K., et al. Beam deceleration for block-face scanning electron microscopy of embedded biological tissue. Micron. 43 (5), 612-620 (2012).
- Bouwer, J. C., et al. Deceleration of probe beam by stage bias potential improves resolution of serial block-face scanning electron microscopic images. Advanced Structural and Chemical Imaging. 2 (1), 11 (2017).
- Kizilyaprak, C., Longo, G., Daraspe, J., Humbel, B. M. Investigation of resins suitable for the preparation of biological sample for 3-D electron microscopy. Journal of Structural Biology. 189 (2), 135-146 (2015).
- Kittelmann, M., Hawes, C., Hughes, L. Serial block face scanning electron microscopy and the reconstruction of plant cell membrane systems. Journal of Microscopy. 263 (2), 200-211 (2016).
- Biazik, J., Vihinen, H., Anwar, T., Jokitalo, E., Eskelinen, E. L. The versatile electron microscope: an ultrastructural overview of autophagy. Methods. 75, 44-53 (2015).
- Peddie, C. J., Collinson, L. M. Exploring the third dimension: Volume electron microscopy comes of age. Micron. 61, 9-19 (2014).
- Piňos, J., Mikmeková, &. #. 3. 5. 2. ;., Frank, L. About the information depth of backscattered electron imaging. Journal of Microscopy. 266 (3), 335-342 (2017).
- Smith, D., Starborg, T. Serial block face scanning electron microscopy in cell biology: Applications and technology. Tissue Cell. 57, 111-122 (2019).
- Goggin, P., et al. Development of protocols for the first serial block-face scanning electron microscopy (SBF SEM) studies of bone tissue. Bone. 131, 115107 (2020).
- Deerinck, T. J., et al. High-performance serial block-face SEM of nonconductive biological samples enabled by focal gas injection-based charge compensation. Journal of Microscopy. 270 (2), 142-149 (2018).
- Nguyen, H. B., et al. Conductive resins improve charging and resolution of acquired images in electron microscopic volume imaging. Scientific Reports. 6, 23721 (2016).
- Deerinck, T. J., Bushong, E. A., Thor, A., Ellisman, M. H. NCMIR methods for 3D EM: a new protocol for preparation of biological specimens for serial block face scanning electron microscopy. National Center for Microscopy and Imaging Research. 6 (8), (2010).
- Deerinck, T. J., et al. Enhancing Serial Block-Face Scanning Electron Microscopy to Enable High Resolution 3-D Nanohistology of Cells and Tissues. Microscopy and Microanalysis. 16, 1138-1139 (2010).
- Kubota, Y. New developments in electron microscopy for serial image acquisition of neuronal profiles. Microscopy (Oxf). 64 (1), 27-36 (2015).
- Courson, J. A., et al. Serial block-face scanning electron microscopy: A provocative technique to define 3-dimensional ultrastructure of microvascular thrombosis. Thrombosis Research. 196, 519-522 (2020).
- Courson, J. A., et al. Serial block-face scanning electron microscopy reveals neuronal-epithelial cell fusion in the mouse cornea. PLoS One. 14 (11), 0224434 (2019).
- Lafontant, P. J., et al. Cardiac Myocyte Diversity and a Fibroblast Network in the Junctional Region of the Zebrafish Heart Revealed by Transmission and Serial Block-Face Scanning Electron Microscopy. PLoS One. 8 (8), 72388 (2013).
- Hanlon, S. D., Behzad, A. R., Sakai, L. Y., Burns, A. R. Corneal stroma microfibrils. Experimental Eye Research. 132, 198-207 (2015).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Davenport, A. T., Grant, K. A., Szeliga, K. T., Friedman, D. P., Daunais, J. B. Standardized method for the harvest of nonhuman primate tissue optimized for multiple modes of analyses. Cell Tissue Bank. 15 (1), 99-110 (2014).
- Schuster, A., et al. An isolated perfused pig heart model for the development, validation and translation of novel cardiovascular magnetic resonance techniques. Journal of Cardiovascular Magnetic Resonance. 12 (1), 53 (2010).
- Hanlon, S. D., Patel, N. B., Burns, A. R. Assessment of postnatal corneal development in the C57BL/6 mouse using spectral domain optical coherence tomography and microwave-assisted histology. Experimental Eye Research. 93 (4), 363-370 (2011).
- Longiéras, N., Sebban, M., Palmas, P., Rivaton, A., Gardette, J. L. Multiscale approach to investigate the radiochemical degradation of epoxy resins under high-energy electron-beam irradiation. Journal of Polymer Science Part A: Polymer Chemistry. 44 (2), 865-887 (2006).
- Hashimoto, T., Thompson, G. E., Zhou, X., Withers, P. J. 3D imaging by serial block face scanning electron microscopy for materials science using ultramicrotomy. Ultramicroscopy. 163, 6-18 (2016).
- Rouquette, J., et al. Revealing the high-resolution three-dimensional network of chromatin and interchromatin space: A novel electron-microscopic approach to reconstructing nuclear architecture. Chromosome Research. 17 (6), 801 (2009).
- Briggman, K. L., Helmstaedter, M., Denk, W. Wiring specificity in the direction-selectivity circuit of the retina. Nature. 471 (7337), 183-188 (2011).
- Katoh, K. Microwave-Assisted Tissue Preparation for Rapid Fixation, Decalcification, Antigen Retrieval, Cryosectioning, and Immunostaining. International Journal of Biochemistry & Cell Biology. 2016, 7076910 (2016).
- Login, G. R., Dvorak, A. M. A review of rapid microwave fixation technology: its expanding niche in morphologic studies. Scanning. 15 (2), 58-66 (1993).
- Jamur, M. C., Faraco, C. D., Lunardi, L. O., Siraganian, R. P., Oliver, C. Microwave fixation improves antigenicity of glutaraldehyde-sensitive antigens while preserving ultrastructural detail. Journal of Histochemistry and Cytochemistry. 43 (3), 307-311 (1995).
- Leong, A. S., Sormunen, R. T. Microwave procedures for electron microscopy and resin-embedded sections. Micron. 29 (5), 397-409 (1998).
- Willingham, M. C., Rutherford, A. V. The use of osmium-thiocarbohydrazide-osmium (OTO) and ferrocyanide-reduced osmium methods to enhance membrane contrast and preservation in cultured cells. Journal of Histochemistry and Cytochemistry. 32 (4), 455-460 (1984).
- Khan, A. A., Riemersma, J. C., Booij, H. L. The reactions of osmium tetroxide with lipids and other compounds. Journal of Histochemistry and Cytochemistry. 9, 560-563 (1961).
- Belazi, D., Solé-Domènech, S., Johansson, B., Schalling, M., Sjövall, P. Chemical analysis of osmium tetroxide staining in adipose tissue using imaging ToF-SIMS. Histochemistry and Cell Biology. 132 (1), 105-115 (2009).
- Rivlin, P. K., Raymond, P. A. Use of osmium tetroxide-potassium ferricyanide in reconstructing cells from serial ultrathin sections. Journal of Neuroscience Methods. 20 (1), 23-33 (1987).
- Aguas, A. P. The use of osmium tetroxide-potassium ferrocyanide as an extracellular tracer in electron microscopy. Stain Technology. 57 (2), 69-73 (1982).
- Seligman, A. M., Wasserkrug, H. L., Hanker, J. S. A new staining method (OTO) for enhancing contrast of lipid--containing membranes and droplets in osmium tetroxide--fixed tissue with osmiophilic thiocarbohydrazide(TCH). Journal of Cell Biology. 30 (2), 424-432 (1966).
- Watson, M. L. Staining of tissue sections for electron microscopy with heavy metals. II. Application of solutions containing lead and barium. Journal of Biophysical and Biochemical Cytology. 4 (6), 727-730 (1958).
- Zhou, W., Apkarian, R., Wang, Z., Joy, D. Fundamentals of Scanning Electron Microscopy. Scanning Microscopy in Nanotechnology. , 1-40 (2006).
- Tapia, J. C., et al. High-contrast en bloc staining of neuronal tissue for field emission scanning electron microscopy. Nature Protocols. 7 (2), 193-206 (2012).
- Buchacker, T., et al. Assessment of the Alveolar Capillary Network in the Postnatal Mouse Lung in 3D Using Serial Block-Face Scanning Electron Microscopy. Frontiers in Physiology. 10, 1357 (2019).
- Keeling, E., et al. 3D-Reconstructed Retinal Pigment Epithelial Cells Provide Insights into the Anatomy of the Outer Retina. International Journal of Molecular Sciences. 21 (21), (2020).
- Shang, P., et al. Chronic Alcohol Exposure Induces Aberrant Mitochondrial Morphology and Inhibits Respiratory Capacity in the Medial Prefrontal Cortex of Mice. Frontiers in Neuroscience. 14, 561173 (2020).
- Pfeifer, C. R., et al. Quantitative analysis of mouse pancreatic islet architecture by serial block-face SEM. Journal of Structural Biology. 189 (1), 44-52 (2015).
- Wilke, S. A., et al. Deconstructing complexity: serial block-face electron microscopic analysis of the hippocampal mossy fiber synapse. Journal of Neuroscience. 33 (2), 507-522 (2013).
- Cocks, E., Taggart, M., Rind, F. C., White, K. A guide to analysis and reconstruction of serial block face scanning electron microscopy data. Journal of Microscopy. 270 (2), 217-234 (2018).
- Borrett, S., Hughes, L. Reporting methods for processing and analysis of data from serial block face scanning electron microscopy. Journal of Microscopy. 263 (1), 3-9 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529 (2017).
- Fiala, J. C. Reconstruct: a free editor for serial section microscopy. Journal of Microscopy. 218, 52-61 (2005).
- Pidhorskyi, S., Morehead, M., Jones, Q., Spirou, G., Doretto, G. syGlass: interactive exploration of multidimensional images using virtual reality Head-mounted displays. arXiv . , (2018).
- Cardona, A., et al. TrakEM2 software for neural circuit reconstruction. PLoS One. 7 (6), 38011 (2012).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy Image Browser: A Platform for Segmentation and Analysis of Multidimensional Datasets. PLOS Biology. 14 (1), 1002340 (2016).
- Luengo, I., et al. SuRVoS: Super-Region Volume Segmentation workbench. Journal of Structural Biology. 198 (1), 43-53 (2017).
- Anderson, H. R., Stitt, A. W., Gardiner, T. A., Archer, D. B. Estimation of the surface area and volume of the retinal capillary basement membrane using the stereologic method of vertical sections. Analytical & Quantitative Cytology & Histology. 16 (4), 253-260 (1994).
- Gibbons, C. H., Illigens, B. M., Wang, N., Freeman, R. Quantification of sweat gland innervation: a clinical-pathologic correlation. Neurology. 72 (17), 1479-1486 (2009).
- Knust, J., Ochs, M., Gundersen, H. J., Nyengaard, J. R. Stereological estimates of alveolar number and size and capillary length and surface area in mice lungs. Anat Rec. 292 (1), 113-122 (2009).
- Mahon, G. J., et al. Chloroquine causes lysosomal dysfunction in neural retina and RPE: implications for retinopathy. Current Eye Research. 28 (4), 277-284 (2004).
- Michel, R. P., Cruz-Orive, L. M. Application of the Cavalieri principle and vertical sections method to lung: estimation of volume and pleural surface area. Journal of Microscopy. 150, 117-136 (1988).
- Weibel, E. R. Stereological methods in cell biology: where are we--where are we going. Journal of Histochemistry and Cytochemistry. 29 (9), 1043-1052 (1981).
- Schmitz, C., Hof, P. R. Design-based stereology in neuroscience. Neuroscience. 130 (4), 813-831 (2005).
- Kristiansen, S. L., Nyengaard, J. R. Digital stereology in neuropathology. Apmis. 120 (4), 327-340 (2012).
- Howard, C. V., Reed, M. G. . Unbiased Stereology. 2nd edn. , (2005).
- Reith, A., Mayhew, T. M. . Stereology and Morphometry in Electron Microscopy: Problems and Solutions. , (1988).
- Mouton, P. R. . Principles and practices of unbiased stereology: an introduction for bioscientists. , (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved