Method Article
Microscopía Electrónica De Barrido Bloque-Cara Serial (SBF-SEM) De Muestras De Tejido Biológico
En este artículo
Resumen
Este protocolo delinea un método rutinario para usar la microscopia electrónica serial de la exploración de la bloque-cara (SBF-SEM), una técnica de proyección de imagen 3D potente. El uso acertado de SBF-SEM depende de técnicas apropiadas de la fijación y de la coloración del tejido, así como de la consideración cuidadosa de los ajustes de la proyección de imagen. Este protocolo contiene consideraciones prácticas para la totalidad de este proceso.
Resumen
La microscopia electrónica serial de la bloque-cara de la exploración (SBF-SEM) permite la colección de centenares a millares de imágenes ultraestructurales en serie-registradas, ofreciendo una vista tridimensional sin precedentes del tejido microanatomy. Mientras que SBF-SEM ha visto un aumento exponencial en uso estos últimos años, los aspectos técnicos tales como preparación apropiada del tejido y parámetros de la proyección de imagen son supremos para el éxito de esta modalidad de la proyección de imagen. Este sistema de imágenes se beneficia de la naturaleza automatizada del dispositivo, lo que permite dejar el microscopio desatendido durante el proceso de obtención de imágenes, con la recopilación automatizada de cientos de imágenes posibles en un solo día. Sin embargo, sin la preparación apropiada del tejido la ultraestructura celular se puede alterar de una manera tal que las conclusiones incorrectas o engañosas pudieran ser dibujadas. Además, las imágenes se generan escaneando la cara de bloque de una muestra biológica incrustada en resina y esto a menudo presenta desafíos y consideraciones que deben abordarse. La acumulación de electrones dentro del bloque durante la proyección de imagen, conocida como "carga del tejido," puede llevar a una pérdida de contraste y a una inhabilidad de apreciar la estructura celular. Además, si bien el aumento de la intensidad/voltaje del haz de electrones o la disminución de la velocidad de escaneo del haz pueden aumentar la resolución de la imagen, esto también puede tener el desafortunado efecto secundario de dañar el bloque de resina y distorsionar las imágenes posteriores en la serie de imágenes. Aquí presentamos un protocolo de rutina para la preparación de muestras de tejido biológico que preserva la ultraestructura celular y disminuye la carga tisular. También proporcionamos las consideraciones de la proyección de imagen para la adquisición rápida de serial-imágenes de alta calidad con daño mínimo al bloque del tejido.
Introducción
La microscopía electrónica de barrido facial de bloques en serie (SBF-SEM) fue descrita por primera vez por Leighton en 1981, donde creó un microscopio electrónico de barrido aumentado con un microtomo incorporado que podía cortar e imaginar secciones delgadas de tejido incrustadas en resina. Desafortunadamente, las limitaciones técnicas restringieron su uso a muestras conductoras, ya que las muestras no conductoras, como el tejido biológico, acumularon niveles inaceptables de carga (acumulación de electrones dentro de la muestra de tejido)1. Si bien el recubrimiento de la cara de bloque entre cortes con carbono evaporado redujo la carga de tejido, esto aumentó en gran medida el tiempo de adquisición de imágenes y el almacenamiento de imágenes siguió siendo un problema, ya que la tecnología informática en ese momento era insuficiente para administrar los grandes tamaños de archivo creados por el dispositivo. Esta metodología fue revisada por Denk y Horstmann en 2004 utilizando un SBF-SEM equipado con una cámara de presión variable2. Esto permitió la introducción de vapor de agua a la cámara de imágenes, lo que reduce la carga dentro de la muestra, haciendo que las imágenes de muestras no conductoras sean viables, aunque con una pérdida de resolución de imagen. Las mejoras adicionales en la preparación del tejido y los métodos de la proyección de imagen ahora permiten la proyección de imagen usando el alto vacío, y la proyección de imagen de SBF-SEM confía no más en el vapor de agua para disipar la carga3,4,5,6,7,8,9. Mientras que SBF-SEM ha visto un aumento exponencial en uso estos últimos años, los aspectos técnicos tales como preparación apropiada del tejido y parámetros de la proyección de imagen son supremos para el éxito de esta modalidad de la proyección de imagen.
SBF-SEM permite la recolección automatizada de miles de imágenes de microscopía electrónica registradas en serie, con una resolución plana tan pequeña como 3-5 nm10,11. El tejido, impregnado con metales pesados e incrustado en resina, se coloca dentro de un microscopio electrónico de barrido (SEM) que contiene un ultramicrotomo equipado con un cuchillo de diamante. Una superficie plana se corta con el cuchillo de diamante, el cuchillo se retrae y la superficie del bloque se escanea en un patrón ráster con un haz de electrones para crear una imagen de ultraestructura de tejido. A continuación, el bloque se eleva una cantidad especificada (por ejemplo, 100 nm) en el eje z, conocido como "paso z", y se corta una nueva superficie antes de que se repita el proceso. De esta manera se produce un bloque de imágenes de 3 dimensiones (3D) a medida que se corta el tejido. Este sistema de imágenes se beneficia aún más de la naturaleza automatizada del dispositivo, lo que permite dejar el microscopio desatendido durante el proceso de obtención de imágenes, con la recopilación automatizada de cientos de imágenes posibles en un solo día.
Mientras que las imágenes SBF-SEM utilizan principalmente electrones retrosperdicionados para formar una imagen de la cara de bloque, los electrones secundarios se generan durante el proceso de obtención de imágenes12. Los electrones secundarios pueden acumularse, junto con los electrones retrospersión y de haz primario que no escapan del bloque, y producen "carga de tejido", lo que puede conducir a un campo electrostático localizado en la cara del bloque. Esta acumulación de electrones puede distorsionar la imagen o hacer que los electrones sean expulsados del bloque y contribuir a la señal recogida por el detector de retrospersión, disminuyendo la relación señal/ruido13. Mientras que el nivel de carga del tejido puede disminuirse reduciendo el voltaje o la intensidad del haz de electrones, o reduciendo el tiempo de permanencia del haz, esto resulta en una relación señal/ruido disminuida14. Cuando se utiliza un haz de electrones de menor voltaje o intensidad, o el haz solo puede habitar dentro de cada espacio de píxeles durante un período de tiempo más corto, menos electrones retrodispersión son expulsados del tejido y capturados por el detector de electrones, lo que resulta en una señal más débil. Denk y Horstmann abordaron este problema introduciendo vapor de agua en la cámara, reduciendo así la carga en la cámara y en la cara del bloque a costa de la resolución de la imagen. Con una presión de cámara de 10-100 Pa, una parte del haz de electrones se dispersa contribuyendo al ruido de la imagen y una pérdida de resolución, sin embargo, esto también produce iones en la cámara de la muestra que neutraliza la carga dentro del bloque de muestra2. Los métodos más recientes para neutralizar la carga dentro del bloque de muestra utilizan la inyección focal de gas de nitrógeno sobre la cara del bloque durante la toma de imágenes, o la introducción de voltaje negativo en la etapa SBF-SEM para disminuir la energía de la sonda-haz-lading y aumentar la señal recogida6,7,15. En lugar de introducir sesgo de etapa, presión de cámara o inyección localizada de nitrógeno para disminuir la acumulación de carga en la superficie del bloque, también es posible aumentar la conductividad de la resina mediante la introducción de carbono en la mezcla de resina, lo que permite ajustes de imagen más agresivos16. El siguiente protocolo general es una adaptación del protocolo de Deerinck et al. publicado en 2010 y cubre las modificaciones en la preparación de tejidos y las metodologías de imagen que encontramos útiles para minimizar la carga de tejidos mientras se mantiene la adquisición de imágenes de alta resolución3,17,18,19. Mientras que el protocolo previamente mencionado se centró en el proceso del tejido y la impregnación del metal pesado, este protocolo proporciona la penetración en la proyección de imagen, el análisis de datos, y el flujo de trabajo de la reconstrucción inherentes a los estudios de SBF-SEM. En nuestro laboratorio, este protocolo se ha aplicado con éxito y reproduciblemente a una amplia variedad de tejidos, incluyendo córnea y estructuras del segmento anterior, párpado, glándula lagrimal y harderiana, retina y nervio óptico, corazón, pulmón y vía aérea, riñón, hígado, músculo cremaster y corteza cerebral / médula, y en una variedad de especies que incluyen ratón, rata, conejo, conejillo de Indias, peces, monocapa y cultivos celulares estratificados, cerdo, primate no humano, así como humanos20,21,22,23. Mientras que los pequeños cambios pueden valer la pena para tejidos y aplicaciones específicos, este protocolo general ha demostrado ser altamente reproducible y útil en el contexto de nuestra instalación de imágenes principales.
Protocolo
Todos los animales fueron manejados de acuerdo con las pautas descritas en la Declaración de manejo de animales para el uso de animales en la visión y la investigación oftálmica de la Universidad de Houston y la Facultad de Optometría de la Universidad de Houston. Todos los procedimientos de animales fueron aprobados por las instituciones en las que se manejaron: los procedimientos de ratón, rata, conejo, conejillo de Indias y primates no humanos fueron aprobados por el Comité de Cuidado y Uso de Animales de la Universidad de Houston, los procedimientos de pez cebra fueron aprobados por el Comité de Cuidado y Uso de Animales de la Universidad de DePauw, y los procedimientos de cerdos fueron aprobados por el Comité de Cuidado y Uso de Animales de baylor College of Medicine. Todos los tejidos humanos se manipularon de conformidad con la Declaración de Helsinki relativa a la investigación sobre tejidos humanos y se obtuvo la aprobación de la junta de revisión institucional apropiada.
1. Procesamiento de tejidos
- Prepare una solución común de tampón de cacodilato de sodio de 0,4 M mezclando polvo de cacodilato de sodio en ddH2O. Mezcle bien el tampón y el pH ajuste la solución a 7.3. Este tampón se utiliza para hacer fijativo (composición que se describe a continuación en el paso 1.3), tampón de lavado, así como soluciones de ferrocianuro de osmio y potasio.
NOTA: La fijación de la perfusión es a menudo el mejor método de fijación para los estudios de SBF-SEM, pues la fijación ocurre rápidamente y en el cuerpo. Si la fijación de perfusión no es posible dentro del diseño del estudio, vaya al paso 1.3. - Realizar la fijación de perfusión con la presión fisiológica adecuada para el modelo animal24,25,26. Esto se hace vía la perfusión secuencial transcardial con la solución salina heparinized seguida por el fijador, cada uno colocado en una altura específica (e.g., 100 cm) sobre el organismo (apropiado a la presión fisiológica del sistema vascular en el modelo animal), con el fijador que fluye en el ventrículo izquierdo, y saliendo de una incisión hecha en el atrio derecho. El tejido de interés se volverá pálido a medida que la sangre se reemplace con fijador, si todo o una parte de su tejido no se blanquea, entonces el tejido puede no fijarse adecuadamente y la ultraestructura puede no preservarse.
- Use una cuchilla de afeitar o un bisturí afilado para recortar las muestras de tejido en bloques no mayores de 2 mm x 2 mm x 2 mm. Si se omitió el paso 1.2, hágalo rápidamente para que el tejido pueda fijarse por inmersión lo más rápido posible.
- Alternativamente, diseccione el tejido bajo fijador y transfiera al fijador fresco para completar el proceso de inmersión. La composición final del fijador consiste en un tampón de cacodilato de sodio de 0,1 M que contiene glutaraldehído al 2,5% y cloruro de calcio de 2 mM. Deje que la fijación proceda durante un mínimo de 2 horas a temperatura ambiente y un máximo de noche a 4 °C. Si es posible, utilice un balancín/placa basculante para agitar suavemente las muestras mientras se fijan.
- Alternativamente, si un microondas inversor está disponible, fijar el tejido en el fijador antes mencionado bajo vacío a 150 vatios durante 4 ciclos de 1 minuto en, 1 minuto de descuento. La fijación por microondas es el método preferido para el paso 1.3, ya que fija rápidamente el tejido y preserva la ultraestructura del tejido27.
NOTA: Nunca se debe permitir que el tejido se seque durante este protocolo, se debe tener cuidado de transferir tejido rápidamente de una solución a la siguiente.
- Lavar el tejido fijo 5 veces durante 3 minutos cada uno (15 minutos en total) a temperatura ambiente en tampón de cacodilato de sodio de 0,1 M que contenga cloruro de calcio de 2 mM.
- Haga fresca la siguiente solución de ferrocianuro de osmio, preferiblemente durante los pasos de lavado anteriores. Combine una solución de tetróxido de osmio al 4% (preparada en ddH2O) con un volumen igual de ferrocianuro de potasio al 3% en tampón de cacodilato de 0,2 M con cloruro de calcio de 4 mM. Después del paso de lavado anterior, coloque el tejido en esta solución durante 1 hora sobre hielo en la oscuridad y en la campana extractora de humos.
NOTA: El tetróxido de osmio es una sustancia cristalina amarilla que viene en una ampolla. Para crear la solución de tetróxido de osmio, abra la ampolla, agregue ddH2O y sonice durante 3-4 horas en la oscuridad hasta que los cristales se disuelvan por completo. La solución de tetróxido de osmio es una solución de color amarillo claro, si la solución es negra, el osmio se ha reducido y ya no debe usarse. - Mientras el tejido está incubando en la solución de ferrocianuro de osmio, comience a preparar la solución de tiocarbohidrazida (TCH). Prepare esta solución fresca y tenga fácilmente disponible al final del período de fijación de ferrocianuro de osmio de 1 hora. Combinar 0,1 g de tiocarbohidrazda con 10 mL de ddH2O y colocar esta solución en un horno de 60 °C durante 1 hora. Para asegurarse de que la solución se disuelva, gire suavemente cada 10 minutos. Antes de su uso, filtre esta solución a través de un filtro de jeringa de 0,22 μm.
- Antes de incubar en TCH, lave el tejido con temperatura ambiente ddH2O 5x durante 3 minutos cada uno (15 minutos en total).
- Colocar el tejido en la solución TCH filtrada durante un total de 20 minutos a temperatura ambiente (Figura 1A-C).
- Después de la incubación en TCH, lavar el tejido 5x durante 3 minutos cada uno (15 minutos en total) a temperatura ambiente ddH2O.
- Colocar el tejido en ddH2O que contenga tetróxido de osmio al 2% (no diósmico reducido con ferrocianuro de potasio) durante 30 minutos a temperatura ambiente. Esto debe hacerse en el capó de humos y en la oscuridad, ya que el osmio puede reducirse con luz (por ejemplo, bajo papel de aluminio)(Figura 1D-F).
- Después de la incubación del tetróxido de osmio, lave el tejido 5x durante 3 minutos cada uno (15 minutos en total) a temperatura ambiente ddH2O.
- Coloque el tejido en acetato de uranilo acuoso al 1% (acetato de uranilo en polvo mezclado en ddH2O) durante la noche en un refrigerador a 4 °C.
- Justo antes de retirar el tejido del refrigerador, prepare la solución fresca de aspartato de plomo de Walton. Comience disolviendo 0.066 g de nitrato de plomo en 10 mL de solución de ácido aspártico de 0.03 M (0.04 g de ácido aspártico en 10 mL de agua destilada) y ajuste el pH a 5.5 con 1 N KOH (0.5611 g en 10 mL de agua destilada).
PRECAUCIÓN: Se puede formar un precipitado al ajustar el pH. Esto no es aceptable.- Usando una barra de agitación, agregue lentamente el 1 N KOH gota a gota mientras monitorea el pH. Precalentar la solución de aspartato de plomo transparente terminada en un horno de 60 °C durante 30 minutos. Si se forma un precipitado, la solución no se puede usar y se debe preparar otra solución.
- Retire el pañuelo desechable del refrigerador y lave 5 veces durante 3 minutos cada uno (15 minutos en total) a temperatura ambiente ddH2O.
- Después del lavado, coloque el tejido en la solución de aspartato de plomo de Walton calentada durante 30 minutos mientras mantiene la temperatura a 60 °C.
- Después de la incubación en aspartato de plomo de Walton, lavar el tejido 5x durante 3 minutos cada uno (15 minutos en total) a temperatura ambiente ddH2O (Figura 1G-I).
- Deshidratar el tejido a través de una serie de acetona helada (30%, 50%, 70%, 95%, 95%, 100%, 100% y 100% de acetona (en ddH2O cuando corresponda) permitiendo 10 minutos para cada paso de la serie.
- Después de la serie de deshidratación helada, coloque el tejido en acetona a temperatura ambiente durante 10 minutos.
- Durante este tiempo, formule la resina Embed 812 ACM. Utilice la receta de "mezcla dura", ya que es más resistente al daño de la viga. Mezcle la resina a fondo y coloque el tejido en Embed 812:acetone (1:3 mix) durante 4 horas, seguido de Embed 812:acetone (1:1 mix) durante 8 horas o durante la noche, y finalmente Embed 812:acetone (3:1 mix) durante la noche. Realice estos pasos de infiltración de resina a temperatura ambiente.
- Al día siguiente, coloque el tejido en 100% Embed 812 durante 4-8 horas, luego en fresco 100% Embed 812 durante la noche, y finalmente en fresco 100% Embed 812 durante 4 horas. Realice estos pasos de infiltración de resina a temperatura ambiente.
- Justo antes de incrustar, coloque una pequeña cantidad de resina en un recipiente de mezcla y mezcle lentamente (se puede usar un palo de madera para remover) en polvo negro de carbón hasta que la resina esté saturada con el polvo, pero todavía sea fluida y no se vuelva granulada. Debe parecerse a la tinta gruesa y ser capaz de gotear lentamente desde el palo de madera sin grupos visibles.
- Oriente las muestras de tejido en un molde de caucho de silicona y tome una foto para que la orientación de la muestra dentro del bloque de resina se registre y se pueda hacer referencia a ella. Cubra las muestras en resina saturada de negro de carbón en la punta del molde de silicona y coloque el molde en un horno durante ~ 1 hora a 65 ° C.
- Coloque el molde en una inclinación para contener la resina en la punta del molde donde cubre la muestra de tejido. Coloque una etiqueta con un identificador de muestra de experimento/tejido en el molde en el extremo opuesto de la resina (Figura 2A).
- Retire el molde de silicona del horno y llene el resto del molde con resina transparente (sin negro de carbón) asegurándose de que la etiqueta permanezca visible. Cure la resina infundida con negro de carbón lo suficiente como para no mezclarse fácilmente con la resina transparente.
- Preparar un pozo extra dentro del molde que no contenga tejido. Comenzando con el pozo extra, llene el resto del molde con resina transparente.
- Si la resina infundida de negro de carbón comienza a sangrar en la resina transparente, coloque el molde de silicona de nuevo en el horno por tiempo adicional (por ejemplo, 15 minutos).
- Una vez que todas las muestras de tejido se hayan rematado con resina transparente, coloque el molde de silicona de nuevo en el horno (plano, sin inclinación) a 65 °C durante 48 horas para completar el proceso de curado.
2. Preparación de bloques
Nota : el método dependerá de cómo se orienta el ejemplo en el bloque y cómo se va a realizar la sección. Sin embargo, la orientación más común del tejido encuentra el tejido centrado en la punta del bloque de resina, perpendicular al extremo largo del bloque de resina.
- En la mayoría de los casos, primero recorte el extremo del bloque para localizar el tejido colocando el bloque de la muestra en el mandril del microtomo con el extremo cónico que sobresale aproximadamente 5-6 mm del mandril. Bloquee en su lugar con el tornillo de ajuste y colóquelo debajo de una lámpara de calor.
- Después de varios minutos, el bloque será maleable y fácil de recortar. Coloque el mandril en el soporte del estereomicroscopio y use una nueva cuchilla de afeitar de doble filo para hacer secciones delgadas paralelas a la cara del bloque hasta que el tejido sea visible. Esto se ve mejor mediante la pesca con caña de luz a través de la cara del bloque, la muestra de tejido será menos reflectante y granular en comparación con las porciones de la resina que están desprovistas de tejido. Consulte la fotografía tomada de muestras de tejido antes de la introducción de resina saturada de negro de carbono para tener una idea de cómo y dónde se encuentra el tejido.
- Reserve un soporte de pasador de muestra para fines de recorte. Este soporte de pasador nunca se coloca en la cámara SEM y, por lo tanto, se puede manipular sin guantes, esto se denominará soporte de pasador de recorte. Cualquier soporte de muestra destinado a ser colocado en la cámara de imágenes nunca debe ser tocado sin guantes. Esto evita la introducción de grasa y aceite en la cámara del microscopio.
- Coloque un pasador de aluminio en el soporte del pasador de recorte y apriete ligeramente el tornillo de ajuste con la cara (superficie plana) del pasador sostenido 3-4 mm por encima del soporte del pasador.
- Haga varios arañazos profundos y entrecruzados en la cara del pasador para proporcionar un área de superficie más grande para el pegamento utilizado para mantener la muestra en su lugar. Si se utiliza un pasador de aluminio, se recomienda un pequeño destornillador de cabeza plana de acero para este paso (Figura 2B).
- Coloque el mandril que contiene la muestra de tejido de nuevo debajo de la lámpara de calor hasta que la resina se vuelva suave y maleable, luego colócalo en el receptáculo del mandril debajo del estereomicroscopio.
- Usar una cuchilla de afeitar de doble filo para recortar el exceso de resina de la porción del bloque de resina que contiene la muestra de tejido. En última instancia, el tamaño del bloque de tejido unido al pasador será de aproximadamente 3 mm de diámetro y 2-3 mm de altura.
- Empuje cuidadosamente la maquinilla de afeitar hacia abajo en el bloque de resina aproximadamente 1-2 mm, luego empuje cuidadosamente la maquinilla de afeitar horizontalmente en el bloque de resina a una profundidad igual al corte anterior. Haga esto lentamente y con mucho cuidado, ya que es posible dañar o cortar la parte del bloque que contiene la muestra de tejido. A medida que los dos cortes se encuentran, el exceso de resina se separará del bloque. Continúe eliminando la resina hasta que solo quede un área elevada de 3 mm x 3 mm.
- Después de este recorte inicial, coloque el bloque (todavía en el mandril) debajo de la lámpara de calor durante varios minutos.
- Una vez que la resina se vuelve suave y maleable, coloque el bloque de nuevo debajo del estereomicroscopio. Usando una nueva cuchilla de afeitar de doble filo, corte la parte superior del bloque de resina, aproximadamente 1 mm por debajo de la porción recortada, con un solo corte liso. Una superficie plana es preferible, ya que esta se pegará al pasador de la muestra. Tenga cuidado de no permitir que la muestra se pierda, ya que este paso requiere cierta fuerza que puede transferirse a la parte eliminada del bloque y hacer que se aleje volando. Coloque la muestra cortada y recortada a un lado.
- Coloque el soporte del pasador de recorte que contiene el pasador de aluminio cortado en el receptáculo del estereomicroscopio. Aplique una capa delgada de pegamento de cianocrilato a la cara del alfiler de tal manera que cubra completamente el alfiler sin formar un menisco visible. Recoja la pieza recortada del bloque de tejido con fórceps y colótela en la cara del pasador. Centre la muestra de tejido en el pasador de la muestra. Empúrtelo hacia abajo y mantenlo presionado durante varios segundos. Deje que el pegamento se establezca durante varios minutos.
- Cuando el pegamento esté completamente seco, coloque el soporte del pasador de recorte de nuevo debajo del estereomicroscopio. Usando un archivo fino, archivar el exceso de resina para que ninguna resina sobresalga del pasador. La forma de la resina debe parecerse a la cabeza circular del perno.
- Localice el tejido en la porción elevada de su bloque de resina, la iluminación oblicua es útil para esto. Utilizando una maquinilla de afeitar de doble filo, la parte elevada de la resina que contiene la muestra de tejido deberá recortarse a una superficie no superior a 1 mm2. Si es posible, la cara del bloque se puede recortar aún más pequeño, esto reducirá el estrés en el cuchillo de diamante y mejorará su longevidad.
- Retire la mayor cantidad posible de resina sobrante, dejando el bloque ligeramente más largo en una dimensión. Esto se hace lentamente y con cuidado, ya que es posible que la resina que contiene la muestra de tejido se rompa si se aplica demasiada fuerza. Aunque se recomienda una maquinilla de afeitar, se puede usar un archivo de metal fino para este paso.
- Con un ángulo de archivo de metal fino el exceso de resina, en el área fuera de la porción elevada que contiene la muestra de tejido, hacia abajo hacia el borde del pasador (Figura 2C).
- Retire las partículas de resina y el polvo de la muestra preparada antes de aplicar pintura de plata seguida de pulverización de oro. Mezcle la plata con acetona para que sea un líquido fácilmente untable, similar al esmalte de uñas (pero no tan delgado que gotea del aplicador) y aplique una capa delgada a toda la superficie del bloque de muestra. La acetona se evapora rápidamente, por lo que puede ser necesario agregar acetona adicional a medida que la pintura plateada comienza a espesar.
- Deje que la pintura de plata se seque durante la noche antes de cargarla en el microscopio.
NOTA: Esta capa de plata debe ser delgada para evitar expandir la cara del bloque más allá de 1 mm x 1 mm, y aunque la pintura de plata nunca ha dañado el cuchillo de diamante, todavía se recomiendan caras de bloque más pequeñas para preservar la longevidad del cuchillo de diamante. La acetona mezclada con la plata debe evaporarse por completo antes de pulverizar el oro o cargar la muestra en el microscopio para evitar la introducción de vapor de acetona en la cámara de imágenes. - Después de la aplicación de pintura de plata, aplique una capa delgada de oro al bloque de muestra. Utilizando un dispositivo de pulverización al vacío estándar equipado con un objetivo de lámina de oro estándar, una presión de cámara de 200 miliTorr (gas argón) y 40 miliamperios que se ejecutan durante 2 minutos dará como resultado un recubrimiento de oro de 20 nm de espesor.
- Deje que la pintura de plata se seque durante la noche antes de cargarla en el microscopio.
- Después del recubrimiento, coloque el bloque montado y recortado en un tubo con la etiqueta de experimento apropiada adjunta. Cree tubos personalizados utilizando pipetas de transferencia desechables.
- Corte la pipeta de transferencia justo debajo de la bombilla, dejando una breve porción del tubo de la pipeta de transferencia conectada debajo del extremo bulboso. Acorte la porción tubular que se cortó y corte la punta de la pipeta lo suficiente como para que el pasador de la muestra de aluminio se pueda empujar acurrucar dentro de ella.
- Coloque el extremo que contiene el pasador de la muestra de aluminio dentro del extremo bulboso de la pipeta de transferencia modificada.
- Antes de cargar un bloque de tejido preparado, recorte cuidadosamente el exceso de pintura de plata de la superficie de la cara del bloque.
3. Configuración de SEM para obtener imágenes de la cara de bloque
NOTA: Los ajustes de imagen que siguen se produjeron en el dispositivo utilizado por los autores, que se enumera en la Tabla de materiales proporcionados. Si bien este dispositivo es capaz de obtener imágenes de presión variable, los mejores resultados se capturaron bajo alto vacío.
- Tiempo de permanencia: Usa 12 μs/px durante el seccionamiento en serie. Cuando se ha identificado una región de interés, se puede adquirir una imagen de mayor resolución a 32 μs/px.
- Configuración de vacío: Utilice una presión de la pistola de 9e-008 Pa, una presión de columna de 1.1e-004 Pa y una presión de cámara de 9.5e-002 Pa.
- Tiempo de captura: Con la configuración anterior, captura una pila de imágenes de 2048x2048 px a una velocidad de 50 segundos por imagen. Las imágenes de mayor resolución de las regiones de interés se pueden capturar a 4096x4096 px a poco menos de 9 minutos por imagen.
- Espesor de la sección: Utilice 100-200 nm. Menos es posible, pero puede requerir menor voltaje del haz, intensidad o tiempo de permanencia.
- Alto voltaje (HV): Utilice 7-12 kV. Si bien el aumento del voltaje reduce el tamaño del punto y aumenta la resolución, introduce más posibilidades de daño del haz. Un kV más alto aumenta la penetración del haz, lo que resulta en la pérdida de detalles. Sin embargo, bajar el kV degrada la relación señal/ruido(Figura 3)14.
- Intensidad del haz (BI): El dispositivo SBF-SEM del autor ofrece una escala de intensidad de haz que oscila entre 1 y 20. En esta escala, los valores de 5-7 dan imágenes de calidad sin carga excesiva y daños en el haz. Cuanto mayor sea el BI mayor será la resolución sin embargo, hay más posibilidades de carga y daño del haz14.
- Tamaño de punto y ampliación de la imagen: Determine el tamaño del punto por la intensidad del haz y el nivel de voltaje. Idealmente, el tamaño de punto no debe ser mayor que el tamaño de píxel utilizado. El tamaño de píxel se determina dividiendo el campo de visión (FOV) por el número de píxeles. Por ejemplo, un campo de servicio de 25 μm con un tamaño de imagen de 2048x2048 px daría 12,2 nm por píxel. Por lo tanto, el tamaño del punto no debe ser superior a 12,2 nm. La Figura 4 muestra cómo se relacionan el HV, bi y el tamaño del punto.
- Distancia de trabajo (WD) - Con la proyección de imagen de la cara del bloque la distancia de trabajo no es ajustable. Es simplemente un factor de enfoque. Será casi idéntico para todos los bloques con imágenes. Si bien la distancia de trabajo no es ajustable, juega un papel crítico en la resolución de la imagen capturada. A medida que disminuye la distancia de trabajo, aumenta el límite de resolución de las imágenes capturadas. En algunos casos puede ser posible disminuir la distancia de trabajo haciendo modificaciones dentro de la cámara de imágenes, sin embargo, estas modificaciones deben hacerse a discreción del usuario. Con el fin de disminuir la distancia de trabajo y aumentar la resolución de la imagen, aflojamos los tornillos del microtome de montaje de la puerta y reposicionamos el microtome para que descansara ~ 2 mm más cerca del detector de haz después de volver a apretar los tornillos.
- Resolución : con la configuración anterior, es posible una resolución x & y tan alta como 3.8 nm. Es importante tener en cuenta que la resolución está limitada por el tamaño del punto del haz, así como por la resolución de píxeles de las capturas de imagen (por ejemplo, un campo de visión de 20 μm capturado en una imagen de píxeles de 2048x2048 tiene una resolución de píxeles de 9,8 nm, incluso si se utilizó un tamaño de punto de 3,8 nm). La resolución de la imagen en el plano z depende del espesor de seccionamiento, encontramos que 100-200 nm funciona bien con este protocolo.
Resultados
Córnea del ratón
Este protocolo se ha aplicado extensivamente a la córnea del ratón. Usando proyección de imagen de SBF-SEM una red de paquetes elastino-libres de la microfibrrilla (EFMBs) fue mostrado para estar presente dentro de la córnea adulta del ratón. Se creía previamente que esta red sólo estaba presente durante el desarrollo embrionario y postnatal temprano. SBF-SEM reveló una extensa red EFMB en toda la córnea, con fibras individuales encontradas para ser 100-200 nanómetro de diámetro cuando está medido en la sección representativa. También se encontró que esta red EFMB estaba organizada en distintas capas, con fibras estrechamente asociadas con los queratocitos, incluso dentro de invaginaciones superficiales en la superficie del queratocitos(Figura 5). El descubrimiento de fibras EFMB en la córnea adulta llevó a la microscopía electrónica de transmisión (TEM) de etiquetado inmunogold, fluorescencia y estudios confocales para comprender mejor la naturaleza de esta red23.
La aplicación adicional de este protocolo llevó al descubrimiento de una población previamente desconocida de nervios corneales centrales que se fusionan con las células epiteliales basales en el borde estromal-epitelial(Figura 6). Anteriormente, se creía que todos los nervios que interactuaba con el epitelio en esta frontera penetraban en el epitelio corneal y se ramificaban produciendo la plexxi subbasal y epitelial. En este estudio, el ~45% de los nervios centrales que obraban recíprocamente con el epitelio básico experimentaron la fusión de la célula-célula bastante que la penetración simple. Usando los métodos estereológicos aplicados a los conjuntos de datos de SBF-SEM, era posible demostrar que esta población nueva del nervio tenía un cociente de la superficie-a-volumen áspero mitad que de nervios penetrantes, constante con su aspecto "hinchado" (fusión del nervio - 3.32±0.25, penetración del nervio - 1.39±0.14, p ≤ 0.05). Se crearon reconstrucciones 3D de haces nerviosos penetrantes y fusionantes y sus mitocondrias, destacando la falta de mitocondrias en porciones fusionadas de los haces nerviosos. El descubrimiento de la fusión de células neuronales-epiteliales utilizando SBF-SEM llevó a estudios de fluorescencia que verificaron la continuidad de la membrana entre las dos células fusionadas21.
La córnea central es un tejido avascular, y como tal la vasculatura limbal periférica es de particular importancia para la salud general de la córnea. Las relaciones célula-célula y la ultraestructura de esta región son complejas; sin embargo, la capacidad de apreciar estas interacciones célula-célula y conexiones ultraestructurales se ha limitado en estudios de la fluorescencia y de la sola sección TEM. Por esta razón, una pila de imágenes SBF-SEM que contiene vasculatura limbal, haces nerviosos y células asociadas se segmentó manualmente para la reconstrucción 3D(Figura 7). En esta imagen la asociación cercana entre las ensambladuras endoteliales vasculares y un pericyte que se superpone, los gránulos individuales de una célula de mástil perivascularia, el núcleo y el borde de ataque de un neutrófilo que se arrastra a lo largo de la superficie externa de la pared del vaso sanguíneo, así como un paquete del nervio que pasa puede ser visto.
En conjunto, este cuerpo de trabajo demuestra la capacidad de este protocolo para producir conjuntos de datos de microscopía electrónica 3D de alta calidad en tejidos ricos en matriz extracelular y epitelio, así como vasculatura y células asociadas.
Retina de primates de orden superior - Plexo nervioso y red vascular
La capa de fibra nerviosa retiniana (RNFL) de los primates de orden superior contiene y depende de una extensa red vascular. A menudo, las enfermedades de la retina implican cambios en ambos parámetros de la capa de fibra nerviosa de la retina, así como la vasculatura que se encuentra dentro de ella. La comprensión de la relación entre el RNFL y su red vascular en tejido sano, no patológico es el primer paso para entender cualquier cambio que pueda ocurrir como resultado de enfermedad. Para comprender mejor esta relación, se aplicó el protocolo SBF-SEM a la retina normal de primates de orden superior y se realizó la reconstrucción de la red vascular y se extrajeron datos volumétricos de esta reconstrucción (Figura 8). Esta región de 4.642.307 μm3 de la RNFL contenía un lecho vascular de 1,207x10-4 μL de volumen, lo que suman el 2,6% del volumen total de la RNFL. Este trabajo demuestra la capacidad de este protocolo para producir conjuntos de datos de microscopía electrónica 3D de alta calidad en tejido neurológico denso.
Pez cebra y corazón gigante de Danio - Músculo estriado y vasculatura en desarrollo
Tanto el pez cebra como el danio gigante son modelos importantes para el desarrollo y la regeneración del corazón. Históricamente, se considera que el corazón del pez cebra consiste en dos segmentos miocárdicos anatómicamente distintos que funcionan juntos en apoyo de las demandas fisiológicas del pez cebra. Sin embargo, la interfaz entre estas dos capas ventriculares no era bien entendida. Usando este protocolo, una región junctional previamente desconocida fue descubierta consistiendo en una hoja fina de fibroblastos. Se encontró que las aberturas dentro de esta hoja permitieron que dos segmentos miocárdicos separados entraran en contacto y formaras complejas uniones de adhesión incluyendo desmosomas y adherentes de fascia22.
Este protocolo ha sido utilizado en trabajos posteriores de examen de la red vascular del corazón de danio gigante en desarrollo(Figura 9). Este método permite la apreciación 3D de la red de miocitos cardíacos en desarrollo y su relación con el desarrollo de la microvasculatura. En conjunto, este trabajo demuestra la capacidad de este protocolo para producir conjuntos de datos de microscopía electrónica 3D de alta calidad en músculos y tejidos altamente vascularizados.
Configuración de imagen, carga y resolución
Mientras que la fijación apropiada y la coloración del metal pesado son necesarias para la proyección de imagen de la calidad de SBF-SEM, igualmente importante es el uso de la resina conductora y de las configuraciones apropiadas de la proyección de imagen para las preguntas que son tratadas. En este protocolo, el uso de negro de carbón se emplea con el fin de aumentar la conductividad del bloque de muestra y proporcionar un conducto al pasador de montaje para la separación de electrones secundarios de la cara del bloque. Esto ha demostrado ser eficaz en la lucha contra la carga de tejidos que a menudo degrada la calidad de imagen en tejidos no preparados con negro de carbón16. Además, la pintura de plata y el sputtering de oro aplicados al bloque proporcionan una vía de disipación para la acumulación de electrones. Algunos dispositivos permiten la adición de un compensador de carga focal, que reduce la carga mediante la aplicación de una bocanada de nitrógeno sobre la cara del bloque, sin embargo, hemos tenido un éxito similar con el uso de negro de carbón y la aplicación de pintura de plata y pulverización de oro al bloque15. La falta de conductividad de la muestra puede conducir a la acumulación de electrones visible como carga de tejido (Figura 1), así como descargas que son visibles como desplazamiento brusco de la imagen y deformación que disminuyen drásticamente la calidad de la imagen (Figura 10B &F). El uso de negro de carbón permite la obtención de imágenes en alto vacío y el uso de ajustes de imagen que dan como resultado una alta relación señal-ruido y una resolución de imagen mejorada. Uno de estos ajustes que conduce a una mejor calidad de imagen es el tiempo de permanencia de píxeles. El proceso de imagen SBF-SEM implica el escaneo ráster de un haz de electrones a través de la superficie de la muestra para generar electrones retrospersión que el detector de microscopio puede recopilar e interpretar como señal. El tiempo que se permite que este haz habite dentro del espacio de cada píxel conduce a un valor de píxel más preciso que se asigna a cada ubicación de píxel (Figura 3A &B)2. Sin embargo, hay un equilibrio que debe lograrse entre el aumento de la señal a ruido, la resolución y el daño infligido a la cara del bloque. El haz irradia eficazmente la cara del bloque con electrones de alta energía que pueden descomponer y suavizar la resina, lo que resulta en la degradación de la imagen y las complicaciones de corte (Figura 10)28. Cuanto más delgada sea la resolución z requerida, más difícil será mantener imágenes de alta resolución. Generalmente usamos pasos z de 100-200 nm, sin embargo, se han reportado tamaños de pasos z de 25-50 nm5,29,30,31. Con pasos z de este tamaño, la descompresión y ablandamiento de la resina debido al daño del haz puede conducir a la compresión de la resina haciendo que el cuchillo pierda un corte o corte la cara del bloque, pero con "charla" donde el cuchillo salta a través de la superficie del bloque creando ondulaciones y bandas13. Si bien los pequeños pasos z son una perspectiva atractiva, es importante tener en cuenta la pregunta de investigación específica al elegir un paso z apropiado. El exceso de muestreo puede dar lugar a consideraciones sustanciales de almacenamiento de datos, así como a un aumento en el tiempo necesario para producir reconstrucciones 3D.
Fijación y tinción tisular
Antes de la incubación de metales pesados, los tejidos deben fijarse en glutaraldehído. Si bien recomendamos encarecidamente la fijación de microondas al vacío para la preservación de la ultraestructura detejidos 27,si un microondas de grado de laboratorio no está disponible, se puede sustituir un microondas inversor comercial con potencia variable32,33,34,35. Si esto se hace, el cuidado adicional se debe emplear para asegurarse de que la distorsión del tejido no ocurra. La fijación inadecuada del tejido puede resultar en una morfología tisular alterada como se puede ver en la Figura 10E. Este protocolo, al igual que la mayoría de los protocolos modernos de tinción SBF-SEM, ha sido adaptado del procedimiento de tinción descrito por Deerinck en2010 17,basado en las manchas de osmio-tiocarbohidrazida-osmio creadas por Willingham y Rutherford en 198436. Los metales pesados utilizados en este protocolo añaden contraste a las estructuras celulares dentro de una muestra de tejido (Figura 1). La incubación inicial de osmio ocurre con osmio reducido que se une a los enlaces C = C en grasas insaturadas que conducen a la tinción de membranas y lípidos37,38. El osmio se reduce por el ferrocianuro de potasio, que ayuda en la tinción de lípidos saturados y también actúa para estabilizar los fosfolípidos39,40. La tiocarbohidrazída se añade posteriormente como un mordiente que se une al osmio desde la primera incubación, actuando como un puente sobre el que se une más osmio en una etapa posterior en el protocolo41. El acetato de uranilo, que es una sal de uranio, es un agente de contraste eficaz para lípidos, ácidos nucleicos y proteínas, mientras que el citrato de plomo mejora el contraste de proteínas y glucógenos. Las afinidades variables de estos agentes por los componentes celulares aumentan aún más el contraste general dentro de los tejidos más allá de las incubaciones de osmio42.
Imágenes de la cara de bloque
La Figura 11, la Figura 12,la Figura 13 ilustran los efectos combinados del voltaje, el tiempo de permanencia de los píxeles y la intensidad del haz. La práctica convencional sugiere que una combinación de bajo voltaje, tiempo de permanencia corto y baja intensidad de haz son necesarios para obtener imágenes óptimas y prevenir el daño del haz al bloque de muestra. Contrariamente a estos ajustes, la Figura 11, la Figura 12, la Figura 13 ilustran que los voltajes más altos (por ejemplo, 7 kV), los tiempos de permanencia más largos (32 μs /px) y las intensidades de haz más altas (ajuste 6 en nuestro caso) pueden producir una calidad de imagen superior a la configuración convencional.
SBF-SEM permite la recopilación de imágenes de microscopía electrónica en serie que se pueden recopilar como un conjunto de datos 3D compuesto por vóxes. Si bien este es un uso increíblemente poderoso de SBF-SEM, este método también permite la obtención de imágenes rápidas y repetibles de eventos biológicos o células raras. La adquisición de imágenes mediante SBF-SEM se puede supervisar en busca de eventos raros y se pueden pausar las imágenes para recopilar imágenes de mayor ampliación/resolución de estos eventos. Además, el bloque se puede quitar de la cámara del microscopio y la bloque-cara seccionado para la proyección de imagen de la microscopia electrónica de transmisión (TEM). De esta manera, se pueden recopilar grandes conjuntos de datos de eventos raros utilizando SBF-SEM, así como apreciarse a escala de angstrom utilizando TEM.

Figura 1:Comparaciones SBF-SEM y TEM en varios pasos del protocolo. Este protocolo contiene múltiples pasos en los que el tejido de la muestra se tiñe con metales pesados. Esto afecta no solo al contraste tisular y a la apreciación de las estructuras celulares y los orgánulos, sino también a los niveles de carga que se producen cuando se toma una imagen del tejido. Esta figura contiene tres vistas distintas del tejido preparado: una vista de bajo aumento(A, D &G),una vista de gran aumento(B, E &H),y una comparación TEM de la córnea de ratón preparada(C, F &I). Se puede observar que las imágenes de mayor aumento pueden resultar en un aumento de la carga de tejido, ya que el haz de electrones se concentra en una región más pequeña de tejido. La fila superior(A-C)es una muestra representativa del tejido procesado hasta la finalización del paso 1.8, y ha sido impregnada con ferrocianuro de potasio, tetróxido de osmio y tiocarbohidrazida. Las flechas en las dos primeras columnas muestran la interfaz epitelial-estrofa como punto de referencia. Tenga en cuenta el bajo nivel de contraste en comparación con las dos filas inferiores, así como el aumento de los niveles de carga de tejido. La muestra en la fila central(D-F)se procesó hasta la finalización del paso 1.10 y se beneficia de un paso adicional de tetróxido de osmio, y está visiblemente más contrastada que la muestra en la fila superior. Si bien las estructuras celulares son discernibles, la carga todavía está presente. La muestra en la fila inferior(G-I)se beneficia del protocolo de tinción completo y tiene una carga mínima de tejido. Las imágenes TEM revelan los niveles de contraste tisular impartidos por los metales pesados presentes en cada paso (columna derecha): los orgánulos en el endotelio corneal (*) son más contrastados y evidentes a medida que el procesamiento de tejidos continúa a través del protocolo. Además, los detalles del colágeno y la fibrilina del estroma se vuelven más visibles (punta de flecha) a medida que se completa el protocolo. Panel A, D & G barra de escala = 50 μm. Panel B, E & H barra de escala = 10 μm. Panel C, F & I barra de escala = 1 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2:Esquema del bloque de tejido embebido, el pasador de la muestra y la preparación final. (A) El tejido debe colocarse en una orientación conocida en la punta misma del molde de resina y el tercio superior del molde lleno de resina saturada de negro de carbón. La región del molde más alejada del tejido debe permanecer clara para que la etiqueta del experimento se pueda ver claramente. (B)La superficie del pasador de la muestra debe rayarse para producir un patrón de rejilla, esto permite una mayor área de contacto para que el pegamento de cianocrilato se endurezca entre el bloque de la muestra preparada y el pasador. (C)La resina saturada de negro de carbono debe hacer una amplia área de contacto con la cabeza del pasador de la muestra, sin embargo, la región que se corta con el cuchillo de diamante no debe ser mayor que 1x1 mm. Es una buena práctica para disminuir el bloque hacia la punta. Esto minimiza las fuerzas de corte en el cuchillo de diamante y al tener una base más ancha, el bloque es más resistente a la separación del pasador durante el seccionamiento. Haga clic aquí para ver una versión más amplia de esta figura.
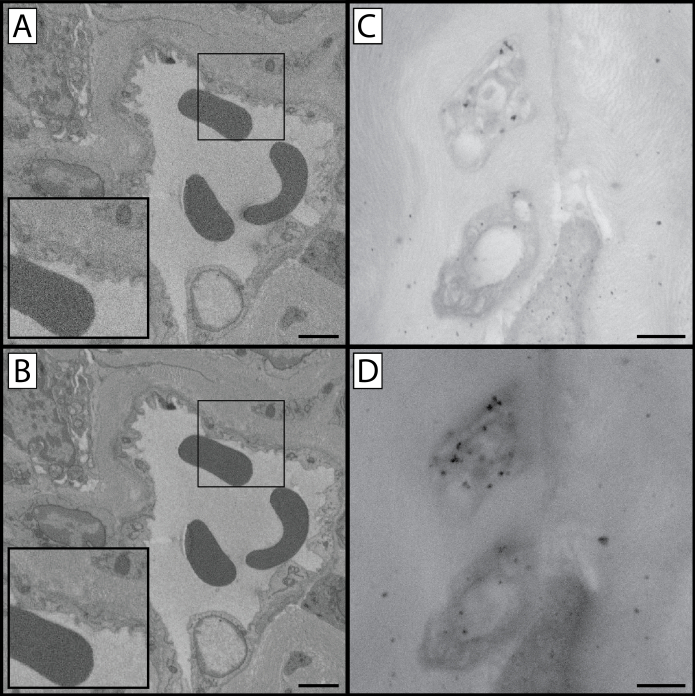
Figura 3:Comparación de la configuración de captura de imagen. ( A &B) Los paneles A y B comparan la calidad y la resolución de la imagen en función del tiempo de permanencia de píxeles. El panel A se creó utilizando un tiempo de permanencia de 32 μs/píxel a 4 kV y sufre de una disminución de la relación señal/ruido, como es evidente en la apariencia "granulada" del recuadro ampliado. El panel B se creó utilizando un tiempo de permanencia de 100 μs/píxel a 4 kV. El aumento del tiempo de permanencia de píxeles aumenta la relación señal/ruido y revela un mayor nivel de detalle celular, sin embargo, el aumento del tiempo de permanencia de píxeles tiene el potencial de conducir a la carga de tejido y / o acumulación de calor que suaviza el bloque e introduce artefactos de corte (charla) al seccionar. Los paneles C y D comparan las imágenes capturadas en condiciones de exposición idénticas pero con dos valores de kV de haz diferentes. El tejido en estos paneles fue impregnado con partículas de nanogold en tonos dorados para hacer más evidentes las diferencias en las profundidades de penetración del haz. El panel C fue capturado a 9 kV, mientras que el panel D fue capturado a 21 kV. El aumento de kV tiene la ventaja de un mayor contraste(D),sin embargo, los detalles se pierden como resultado de la recolección de electrones de una mayor profundidad del tejido(C). Como resultado del muestreo de una sección transversal más grande, un mayor número de partículas de inmunogold específicas para GAP 43 son visibles, mientras que el etiquetado no específico sigue siendo el mismo, lo que resulta en una mayor relación señal-ruido. Panel A & B barra de escala = 2 μm. Panel C & D barra de escala = 1 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Intensidad del haz, kV y tamaño del punto. (A) Al contactar con la muestra de tejido, el haz de electrones (azul claro) produce un volumen de interacción en forma de lágrima, a partir del cual se producen diferentes formas de energía a partir de la interacción entre los electrones del haz y la muestra de tejido. La forma de lágrima es una función de la densidad del tejido y la tinción de metales pesados junto con la energía del haz, y el ángulo de inclinación del haz de electrones43. Mientras que los rayos X, los electrones sinfín y los electrones terciarios se producen durante las imágenes SBF-SEM, la principal preocupación es con los electrones retroscapersión (azul oscuro) y secundarios (verde)13. La imagen producida con imágenes SBF-SEM se produce mediante la recolección de electrones retrospersión. Estos electrones se originan a partir de interacciones elásticas entre el haz y la muestra, y la señal recogida es altamente dependiente del número atómico de átomos con los que interactúan , de ahí la necesidad de tinción de metales pesados44. Los electrones secundarios se originan a partir de interacciones inelásticas entre el haz y la muestra y la detección de su señal depende en gran medida de la orientación de la superficie. Debido a que la cara de bloque es plana en SBF-SEM, los electrones secundarios no contribuyen significativamente a la señal recogida13. De hecho, la acumulación secundaria de electrones en la superficie del bloque puede ser una fuente importante de carga y tiene un efecto perjudicial en la calidad de la imagen2. (B) Este gráfico muestra la relación entre la intensidad del haz, la kV del haz y el tamaño del punto. El tamaño del punto es la resolución espacial del haz y determina el límite de resolución de las imágenes que se producen. La reducción de kV aumenta el tamaño del punto, pero también disminuye la profundidad de la imagen, lo que permite una apreciación más fina del detalle. Esto tiene el efecto de disminuir la señal detectable también. El aumento de la intensidad del haz ofrece una mejora inicial en el tamaño del punto y la detección de señales, pero aumenta rápidamente los niveles de carga de tejido. En última instancia, la intensidad del haz y los valores de kV elegidos dependen de la muestra y se determinan mejor empíricamente en relación con la pregunta científica que se hace. Haga clic aquí para ver una versión más amplia de esta figura.

Figura 5:Red de haz de microfibrillas sin elastina en la córnea del ratón. Reconstrucción 3D de microfibrillas (blancas) estrechamente asociadas con queratocitos (amarillo, naranja y verde) dentro del estroma corneal. Las microfibrillas se pueden ver adyacentes a, y en algunos casos dentro de surcos poco profundos en, queratocitos corneales (flechas) (A). Esta red de microfibrillas sin elastina se organizan en distintas capas dentro del estroma corneal(B). Barra de escala = 2 μm. El bloque de imagen reconstruido es de 45x45 μm en el eje x & y, y de 30 μm en el eje z con voxel una resolución de 22x22x100 nm. Haga clic aquí para ver una versión más amplia de esta figura.

Figura 6: Reconstrucción de los nervios corneales que pasan a través de la lámina basal en el borde estromal-epitelial. Reconstrucción 3D de un nervio penetrante (púrpura) a su paso a través de la lámina basal (verde). Este nervio se puede ver para bifurcar antes de la penetración. Después de penetrar en el epitelio, ambas ramas del nervio experimentaron la ramificación. Las mitocondrias (amarillas) son visibles en las porciones stromal y epitelial del haz nervioso. Barra de escala = 2,5 μm. El bloque de imagen reconstruido es de 25x25 μm en el eje x & y, y 14 μm en el eje z con una resolución de vóxel de 12x12x100 nm. Haga clic aquí para ver una versión más amplia de esta figura.

Figura 7:Vasculatura limbal y células asociadas en la córnea periférica del ratón. Se puede ver una sola imagen(A)de un bloque de imágenes 3D(B)a través de la cual viajan un vaso, un haz nervioso y células asociadas. El panel C muestra un vaso reconstruido (rojo) con un pericito asociado (gris) envuelto a su alrededor que cubre las uniones celulares endoteliales. Un haz nervioso (azul) se bifurca muy cerca de este vaso a medida que viaja a través del tejido. Un neutrófilo (amarillo) se puede ver paralelo al eje largo del vaso, con su núcleo polimórfico visible dentro de su cuerpo celular y el urópodo final visible como una protuberancia hacia la derecha de la imagen. Un mastocitos (magenta) es visible en la parte inferior del recipiente. El panel D aísla este mastocitos, donde sus gránulos (verdes) se pueden ver más fácilmente superponiendo el núcleo (púrpura) dentro de la célula. El panel E destaca las estructuras celulares superpuestas en las reconstrucciones celulares, con núcleos endoteliales denotados en azul, y micropartículas adherentes visibles en la luz del vaso (naranja). Las flechas muestran las fronteras célula-célula entre las células endoteliales, que se pueden ver más a fondo como crestas elevadas que se extienden a lo largo de las células en el lado luminal del recipiente. Barra de escala del panel A = 2 μm. El bloque de imagen utilizado para reconstruir estas celdas es de 30x30 μm en el eje x & y de 42,5 μm en el eje z con una resolución de vóxel de 14,6x14,6x100 nm. Haga clic aquí para ver una versión más amplia de esta figura.

Figura 8: Red vascular reconstruida de la capa de fibra nerviosa retiniana de primates no humanos. (A) Una imagen SBF-SEM de 200x200 μm de la retina del primate tomada a 8192x8192 px. La ubicación muestreada es de ~ 500 micras del margen del borde temporal inferior de un ojo sano sin patología. Las series de imágenes reconstruidas en los paneles C &D fueron capturadas a 2048x2048 px, con imágenes pausadas para que las regiones de interés pudieran ser fotovidas a 8192x8192 px. El panel B es la región retrasada del panel A,tomada directamente de la imagen original. Nótese el gran número de axones y sus mitocondrias. (C)Sección orthoslice a través de un volumen de tejido de 200x200x200 μm de una capa de fibra nerviosa temporal inferior del ojo de control, con vasculatura segmentada. (D) Z-proyección de la vasculatura de la capa de fibra nerviosa. Esta serie ilustra la resolución posible en un campo grande utilizando esta metodología. Barra de escala del panel A = 20 μm. Barra de escala del panel B = 2 μm. La resolución voxel de la serie de imágenes es de 97.6x97.6x500 nm. La resolución de píxeles de la región de interés es de 24,4 x 24,4 nm. Haga clic aquí para ver una versión más amplia de esta figura.
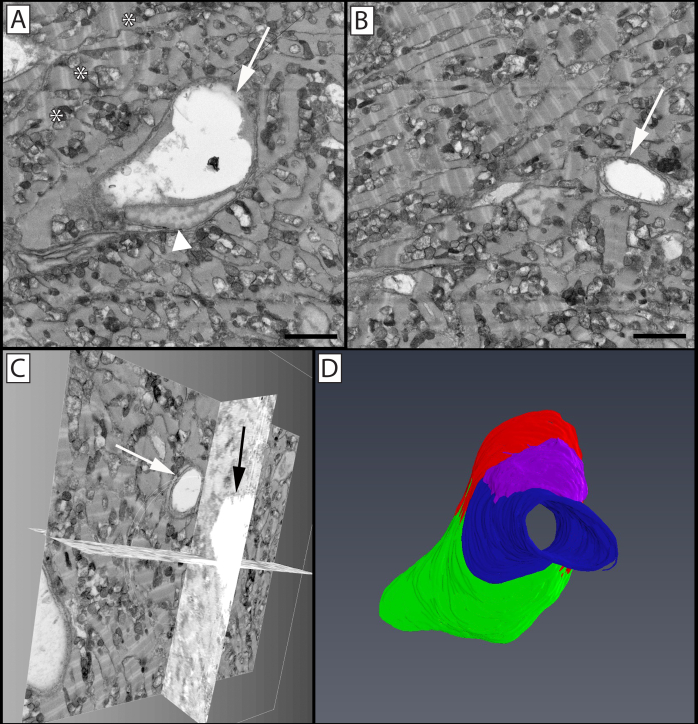
Figura 9: Segmentación y representación en volumen 3D de vasos en el danio gigante (Devario malabaricus) corazón compacto. (A) Micrografía bidimensional en una pila de imágenes, que muestra el perfil de un vaso central de tamaño venular (flecha) y un núcleo endotelial (punta de flecha), con miocitos cardíacos circundantes ricos en mitocondrias y sarcómeros bien organizados (*). (B) Micrografía bidimensional de la pila de imágenes con un recipiente de tamaño capilar (flecha). (C)Proyecciones biorthogonales de la pila de micrografías que muestran el capilar en el panel B proyectado a través de una rebanada ortogonal. (D) representación 3D de células endoteliales segmentadas que recubren el vaso reconstruido. Ilustradas en verde, rojo, azul y púrpura hay cuatro células endoteliales separadas; la celda endotelial representada en azul se puede ver en la sección transversal en el panel B (flecha), mientras que las celdas endoteliales representadas en rojo (flecha) y verde (punta de flecha) se ven en la sección transversal en el panel A. Paneles A & B barra de escala = 2 μm. El bloque de imagen reconstruido es de 30x30 μm en el eje x & y, y de 16 μm en el eje z con una resolución de vóxel de 14.6x14.6x100 nm. Haga clic aquí para ver una versión más amplia de esta figura.
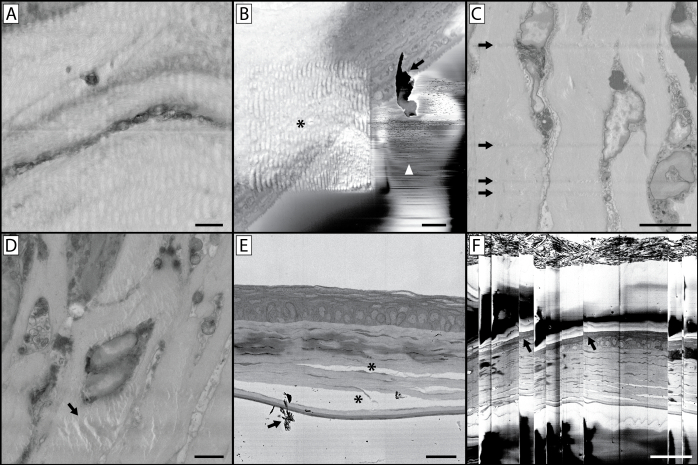
Figura 10:Complicaciones y artefactos de las imágenes. (A) La naturaleza ondulada y distorsionada de esta imagen es el resultado de la obtención de imágenes que utilizan un tiempo de permanencia de píxeles que es demasiado largo. Esto calienta el bloque de resina, dejando la cara del bloque suave y gomosa, lo que resulta en una imagen distorsionada al cortar. (B) Esta imagen contiene una gran cantidad de artefactos. El asterisco indica una distorsión ondulada causada por imágenes previas a un aumento más alto y similar al panel A,la concentración del haz en una región más pequeña con un tiempo de permanencia de píxeles más largo ha suavizado la resina en esta región de interés. Si bien la imagen de mayor aumento recopilada estaba libre de artefactos, esto puede conducir a una serie posterior de imágenes donde la muestra subyacente a la región de interés parece distorsionada. Este panel también ilustra el problema de la acumulación de escombros en la cara del bloque (flecha) durante la toma de imágenes, también denotado por la flecha en el panel E. Si esto se convierte en un problema de imagen persistente, será necesario romper el vacío, abrir la cámara y soplar los escombros acumulados en el cuchillo de diamante y alrededor de la muestra. Pequeñas descargas de electrones de la cara del bloque pueden conducir a los rápidos cambios de contraste y líneas denotadas por la punta de flecha blanca. (C) Esta imagen ilustra arañazos de cuchillo en la cara del bloque. Esto puede ocurrir debido a un cuchillo dañado, o la acumulación de escombros en el borde del cuchillo. (D) El artefacto denotado (flecha) es el resultado del haz de electrones enfocado en (sin seccionar) la cara del bloque durante un período prolongado de tiempo con la muestra todavía en la cámara de imágenes. (E) La fijación inadecuada del tejido puede conducir a la separación de las estructuras celulares y el tejido conectivo (*). (F)Si se produce una gran cantidad de carga en su bloque de tejido o resina, puede ocurrir una acumulación y descarga posterior que lleva a que la imagen "se salte" como se ve en esta imagen. Tenga en cuenta la distorsión del tejido en la imagen en estos puntos de omisión (flechas). Barra de escala del panel A = 1 μm. Barra de escala del panel B = 2 μm. Barra de escala del panel C = 5 μm. Barra de escala del panel D = 2 μm. Barra de escala del panel E = 25 um. Barra de escala del panel F = 50 um. Haga clic aquí para ver una versión más amplia de esta figura.

Figura 11:Tejido de imagen a 3 kV utilizando varios tiempos de permanencia de píxeles e intensidades de haz. Todas las imágenes se estaban recopilando utilizando un haz de 3 kV, la intensidad del haz está en una escala específica del dispositivo que va de 1 a 20. El campo que se imagen es de la luz vascular que contiene glóbulos blancos y rojos. En esta baja kV es difícil apreciar el detalle celular. El aumento del tiempo de permanencia de píxeles tuvo poco efecto. Aumento de la intensidad del haz a 6 mejoró el contraste de la imagen. Haga clic aquí para ver una versión más amplia de esta figura.
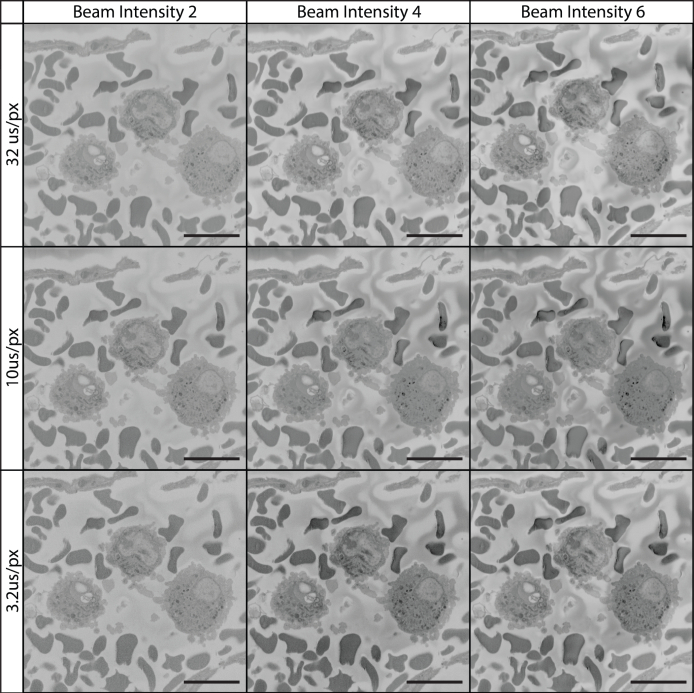
Figura 12:Tejido de imagen a 7 kV utilizando varios tiempos de permanencia de píxeles e intensidades de haz. Todas las imágenes se recopilaron utilizando un haz de 7 kV, la intensidad del haz está en una escala específica del dispositivo que oscila entre 1 y 20. El campo que se imagen es de la luz vascular que contiene glóbulos blancos y rojos. A 7 kV, el aumento de la intensidad del haz y el tiempo de permanencia de píxeles contribuyeron a obtener imágenes de mayor calidad. Haga clic aquí para ver una versión más amplia de esta figura.

Figura 13:Tejido de imagen a 12 kV utilizando varios tiempos de permanencia de píxeles e intensidades de haz. Todas las imágenes se recopilaron utilizando un haz de 12 kV, la intensidad del haz está en una escala específica del dispositivo que oscila entre 1 y 20. El campo que se imagen es de la luz vascular que contiene glóbulos blancos y rojos. A 12 kV, las imágenes se optimizan ajustando el tiempo de permanencia de los píxeles y la intensidad del haz. La carga se reduce/está ausente en tiempos de permanencia de píxeles más cortos, mientras que el detalle celular y el contraste de imagen son mejores con un tiempo de permanencia de píxeles más largo y una mayor intensidad del haz. Haga clic aquí para ver una versión más amplia de esta figura.
Discusión
El propósito de este papel de los métodos es destacar la preparación del tejido y la metodología de la proyección de imagen que ha permitido que nuestro laboratorio capture confiablemente imágenes seriales de alta resolución de la microscopia electrónica, y señalar los pasos críticos que llevan a este resultado así como las trampas potenciales que pueden ocurrir al conducir proyección de imagen de SBF-SEM. El éxito en el uso de este protocolo requiere la fijación adecuada del tejido, la impregnación de metales pesados en la muestra, modificaciones de la resina de incrustación para reducir la carga, así como una comprensión del microscopio y los ajustes de imagen utilizados para recopilar imágenes. La máxima, "calidad adentro, calidad hacia fuera" es un axioma apropiado para la proyección de imagen de SBF-SEM. Pues la meta de SBF-SEM es a menudo el aprecio o la cuantificación del detalle ultraestructural, el cuidado adicional se debe dar a la estrategia de la fijación para asegurarse de que la distorsión del tejido no ocurre. Si el tejido se distorsiona en cualquier momento de la preparación de las muestras (es decir, sufre hinchazón, encogimiento o interrupción de la morfología celular), entonces la reconstrucción y cuantización del tejido no producirá datos precisos. Además, el uso de configuraciones incorrectas de la proyección de imagen puede llevar a la pérdida de datos que no se pueden recapturar pues la proyección de imagen de SBF-SEM es un proceso destructivo. Además, se debe tener cuidado al cargar una muestra de tejido, ya que el delicado cuchillo de diamante puede dañarse por una preparación de muestra apresurada o incorrecta. Esto puede resultar en virutas o roturas en el cuchillo, lo que puede dejar marcas visibles de arañazos en las imágenes (Figura 10C). El cuchillo de diamante también puede ser dañado por estructuras calcificadas, gránulos duros o vidrio incrustado accidentalmente (por ejemplo, de ampollas de reactivos).
Mientras que la mayoría de la literatura SBF-SEM hasta la fecha utiliza voltajes de aceleración de haz en el rango de 1 a 3 kV junto con tiempos de permanencia de píxeles más cercanos a 1-5 μs / px (Figura 11)45,46,47,48,49, el protocolo actual utiliza tensiones de aceleración de 7-12 kV y un tiempo de permanencia de píxeles de 12 μs/px para imágenes en serie y de 32 μs/px para las regiones de interés de las imágenes (Figuras 12 & 13). Estos ajustes, junto con un espesor de rebanada de 100-200 nm, permiten obtener imágenes de alta calidad y alta resolución de una amplia gama de tejido biológico. El aumento del voltaje de aceleración permite un aumento en el contraste, la resolución, así como la relación señal-ruido. El aumento del tiempo de permanencia aumenta aún más la resolución y la relación señal/ruido, mientras que el aumento del grosor de la rebanada conduce a una disminución de la carga en la superficie del bloque durante el seccionamiento y combate el daño inducido por el haz en imágenes posteriores14. Si bien este método de imágenes puede diferir de la convención, las imágenes y los conjuntos de datos producidos hablan por sí solos. Si tuviéramos que especular sobre la razón de este éxito, es posible que sea el resultado de nuestra combinación única de altos valores de kV, tiempos de permanencia de píxeles más largos y preparación de bloques. El aumento de la imagen kV da lugar a un volumen creciente de la interacción entre el haz de electrones y la muestra. Este volumen de interacción es tanto más profundo como más amplio, lo que resulta en un aumento teórico en el número de electrones detectados que se originan en lo más profundo dentro del bloque de muestra, o en una sección transversal más amplia del tejido a medida que el tamaño del punto de lágrima aumenta de diámetro. Como SBF-SEM está interesado en el detalle de la superficie del bloque, esto resulta en una disminución teórica en la relación señal-ruido. Sin embargo, el aumento en kV también empuja a los electrones más profundamente en la muestra, donde es menos probable que escapen del bloque y contribuyan a los electrones recogidos por el detector. Con el beneficio adicional de un aumento de la señal a través de tiempos de permanencia de píxeles más largos y una mayor intensidad del haz, es posible que este método de obtención de imágenes resulte en un mayor aumento de la señal de la superficie de la muestra en relación con el ruido que se origina dentro del volumen de interacción. Además, el aumento de la conductividad de la muestra introducido con el negro de humo, así como el recubrimiento de plata y oro, ayuda a mejorar la acumulación de carga que ahora se produce más profundamente dentro del bloque y más lejos de la cara del bloque. en efecto Figura 11, Figura 12, Figura 13 muestran que a medida que se incrementa el kV, la carga de la muestra comienza a disminuir, ya que potencialmente se empuja más profundamente en el bloque. Las muestras con imágenes de bajo aumento se pueden capturar con un contraste adecuado utilizando los ajustes convencionales, sin embargo, estas imágenes a menudo carecen de detalles tras una inspección minuciosa. Nuestros datos muestran claramente que cuando se utiliza un aumento relativamente alto donde el objetivo es el detalle celular, el aumento de la configuración convencional puede producir resultados excepcionales. El artículo de 2020 de P. Goggin, et al proporciona una tabla útil que describe el efecto de cambiar la configuración de imágenes en la calidad de imagen final, y es una referencia útil para consultar si se hace necesario optimizar el protocolo para nuevos tejidos.14. El espesor de la rebanada de 100-200 nm recomendado en este protocolo tiene la ventaja adicional de permitir la recopilación de grandes conjuntos de datos SBF-SEM a un ritmo rápido. Mientras se recopilan imágenes a 12μs/px, por ejemplo, las imágenes a través de una profundidad de 100 μm a 2048x2048 px requieren ~ 14 horas mientras se seccionan a 100nm / sección, pero requerirían ~ 56 horas si se seccionan a 25nm / sección. Si bien la resolución x,y permanece sin cambios como resultado del grosor de la sección, sin tener en cuenta la capacidad adicional de imagen utilizando valores de kV más altos y tiempos de permanencia de píxeles que vienen con secciones más grandes, es importante tener en cuenta que la resolución a lo largo del eje z se ve afectada. La pérdida de resolución z es una consideración importante y debe contemplarse al decidir cómo se debe orientar el tejido en el bloque de resina y en relación con el plano de imagen, y tiene el potencial de impedir el estudio de características o interacciones celulares más pequeñas (por ejemplo, invaginaciones sinápticas o características intracelulares en la escala de decenas de nanómetros). Sin embargo, además del tiempo de imagen rápido, este protocolo tiene beneficios adicionales en el sentido de que produce rápidamente conjuntos de datos ideales para el análisis estereológico, así como el estudio de eventos biológicos o células raras. Un espesor de sección más grande también puede ayudar en la reconstrucción manual en 3D, ya que una región de 100 μm seccionado a 100 nm / sección requeriría la segmentación manual de 1.000 imágenes, mientras que la misma región seccionado a 25 nm / sección requeriría la segmentación manual de 4.000 imágenes.
SBF-SEM tiene la ventaja de generar grandes conjuntos de datos en un período relativamente corto. Si bien el análisis de datos se puede realizar utilizando métodos cuantitativos como la estereología, que se discutirán a continuación, a menudo puede ser informativo crear reconstrucciones 3D a través de la segmentación de imágenes. Una pila de imágenes creada usando SBF-SEM se puede considerar como una colección de vóxeles, mientras que la segmentación es el proceso de asignar estos vóxeles a objetos definidos por el usuario, creando así representaciones 3D de estructuras de tejido. Estas reconstrucciones a menudo proporcionan una perspectiva hasta ahora no vista sobre la ultraestructura tisular y la interacción célula-célula(Figura 5, Figura 6, Figura 7, Figura 8, Figura 9). Además, una vez creadas las reconstrucciones es posible utilizar los datos inherentes a las reconstrucciones para extraer una gran cantidad de información del tejido segmentado. Los parámetros que van desde el área de superficie, el volumen, la longitud y la distancia, así como los datos angulares, están disponibles una vez que se ha creado una reconstrucción50,51. Si bien esto puede ser increíblemente útil, especialmente cuando se combina con videos e imágenes extraídos de conjuntos de datos reconstruidos, el tiempo necesario para la segmentación manual es una consideración importante al intentar extrapolar datos de conjuntos de datos SBF-SEM. Actualmente hay una gran cantidad de software libre y adquirible disponible para la segmentación manual y semi-manual de pilas de imágenes SBF-SEM. Una opción gratuita para el software de reconstrucción es el paquete de procesamiento de imágenes Fiji para ImageJ, un programa de procesamiento de imágenes de código abierto, que contiene un complemento de editor de segmentación que permite la segmentación manual52,53. Adicionalmente, el software Reconstruct ofrece una opción alternativa de segmentación libre54 (Figura 8). Aunque son potencialmente costosas, las opciones adquiribles a menudo contienen conjuntos de características más sólidos, como procesos de segmentación semiautomatizado o conjuntos de creación de películas e imágenes. Una de estas opciones se utilizó para crear las reconstrucciones que se encuentran en la Figura 5, figura 6, figura 7 y figura 9 (detalles disponibles en la tabla de materiales). Además, hay herramientas disponibles para la creación, análisis y renderizado de reconstrucciones 3D basadas en contraste utilizando realidad virtual con el potencial de acelerar en gran medida el proceso de reconstrucción20,55. Aunque no siempre están disponibles para todas las aplicaciones, una gran cantidad de herramientas de software están disponibles para la segmentación manual asistida por computadora que tienen el potencial de disminuir en gran medida el tiempo requerido para la segmentación56,57,58. Independientemente del software utilizado, la previsión considerable y la comprensión de la pregunta que se responde, o el vacío en el conocimiento que se debe llenar, mediante reconstrucciones en serie deben preceder a la segmentación, ya que el proceso es laborioso y requiere mucho tiempo.
La producción de reconstrucciones 3D viene con sus propias consideraciones. Con conjuntos de datos más grandes, la potencia de procesamiento puede ser un factor limitante, por lo que optimizar el uso de los recursos del sistema puede ser fundamental para mantener un flujo de trabajo productivo y acelerar el proceso de reconstrucción y representación. Al renderizar una reconstrucción 3D, la mayoría del software convierte las pilas de imágenes segmentadas en una superficie compuesta de triángulos interconectados. Si un proyecto de reconstrucción es grande o intrincado, la representación de estos triángulos puede requerir una gran cantidad de potencia de cálculo. Mientras se trabaja en una reconstrucción 3D, puede ser útil limitar el número de triángulos que el software de reconstrucción puede utilizar para convertir las imágenes segmentadas en superficies reconstruidas. Esto puede ser útil para monitorear el progreso de una reconstrucción 3D durante el proceso de segmentación. Una vez completada la segmentación, el límite de triángulos se puede eliminar antes de representar imágenes o videos de reconstrucciones. Alternativamente, y si el software de reconstrucción lo permite, hemos encontrado éxito monitoreando el progreso de una reconstrucción utilizando la representación de volumen en lugar de la generación de superficie. La representación de volúmenes, si bien no es tan adecuada para imágenes o videos destinados a la publicación o presentación, requiere mucha menos potencia de procesamiento y, como tal, puede ser útil para proporcionar una experiencia fluida al reconstruir y preparar imágenes y videos de reconstrucciones. Además, se recomienda segmentar manualmente un conjunto de datos SBF-SEM para definir cada objeto que se va a reconstruir con su propio identificador único. Si un campo de células epiteliales se está reconstruyendo por ejemplo, en lugar de asignar todas las células epiteliales a un grupo de vóxeles titulado "epitelio", a cada célula epitelial se le debe asignar su propio apodo (es decir, Epi1, Epi2, Epi3, etc.). Esto proporciona una mayor libertad cuando se completa la reconstrucción, ya que cada celda puede ser incluida o excluida de la representación final, asignada a diferentes colores o transparencias, o eliminada o introducida individualmente si se está produciendo un video. Además, esto permite recopilar métricas como el área expuesta o el volumen de cada objeto reconstruido en lugar del grupo de objetos en su conjunto.
Otra herramienta increíblemente poderosa para extraer datos cuantitativos de las pilas de imágenes SBF-SEM es la práctica de la estereología. La estereología aprovecha las relaciones matemáticas inherentes entre los objetos tridimensionales y sus representaciones bidimensionales (es decir, micrografías electrónicas). Los conjuntos de datos SBF-SEM son ideales para la aplicación de la estereología, ya que este método para extraer información 3D de grandes conjuntos de datos requiere considerablemente menos tiempo y trabajo en comparación con la reconstrucción segmentada. La estereología generalmente consiste en aplicar cuadrículas geométricas a imágenes aleatorias y uniformemente muestreadas y se ha utilizado ampliamente en los últimos 50 años para producir estimaciones precisas e imparciales del número de células / orgánulos, la longitud, el área de superficie y el volumen21,59,60,61,62,63. Si bien las reconstrucciones 3D pueden ser impresionantes y proporcionar una perspectiva novedosa sobre los tejidos biológicos, a menudo es más rápido, más preciso, reproducible y propicio para que los grandes tamaños de muestra utilicen un enfoque estereológico para la extracción de datos. Si bien hay muchos documentos que discuten la aplicación práctica de la estereología64,65,66,una serie de libros de texto proporcionan una visión general útil y en profundidad de la metodología, así como proporcionan una serie de cuadrículas estereológicas que se pueden aplicar al estudio de la ultraestructura tisular67,68,69.
SBF-SEM es un método potente de la proyección de imagen que permite el aprecio tridimensional de la ultraestructura del tejido. Si bien la capacidad de crear conjuntos de datos 3D con resolución SEM pone preguntas previamente sin respuesta a nuestro alcance, la preparación adecuada de los tejidos y la comprensión de las imágenes SBF-SEM son primordiales para el éxito de los estudios que utilizan este método de microscopía. Esperamos que la aplicación de este protocolo a futuros estudios conduzca a una comprensión cada vez mayor de los misterios biológicos que nos rodean, y continúe empujándonos más hacia las fronteras del conocimiento humano.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Nos gustaría agradecer al Dr. Sam Hanlon, Evelyn Brown y Margaret Gondo por su excelente asistencia técnica. Esta investigación fue apoyada en parte por los Institutos Nacionales de la Salud (NIH) R01 EY-018239 y P30 EY007551 (Instituto Nacional del Ojo), en parte por la Fundación del León para la Vista, y en parte por nih 1R15 HD084262-01 (Instituto Nacional de Salud Infantil y Desarrollo Humano).
Materiales
| Name | Company | Catalog Number | Comments |
| 1/16 x 3/8 Aluminum Rivets | Industrial Rivet & Fastener Co. | 6N37RFLAP/1100 | Used as specimen pins. |
| 2.5mm Flathead Screwdriver | Wiha Quality Tools | 27225 | |
| Acetone | Electron Microscopy Sciences | RT 10000 | Used to dilute silver paint. |
| Aspartic Acid | Sigma-Aldrich | A8949 | |
| Calcium Chloride | FisherScientific | C79-500 | |
| Conductive Silver Paint | Ted Pella | 16062 | |
| Denton Desk-II Vacuum Sputtering Device equipped with standard gold foil target | Denton Vacuum | N/A | This is the gold-sputtering device used by the authors, alternates are acceptable. |
| Double-edged Razors | Fisher Scientific | 50-949-411 | |
| Embed 812 | Electron Microscopy Sciences | 14120 | |
| Gatan 3View2 mounted in a Tescan Mira3 Field emission SEM | Gatan & Tescan | N/A | This is the SBF-SEM device used by the authors, alternates are acceptable. |
| Glass Shell Vials, 0.5 DRAM (1.8 ml) | Electron Microscopy Sciences | 72630-05 | |
| Gluteraldehyde | Electron Microscopy Sciences | 16320 | |
| Gorilla Super Glue - Impact Tough | NA | NA | Refered to as cyanoacrylate glue in text. |
| Ketjen Black | HM Royal | EC-600JD | Refered to as carbon black in text. |
| KOH | FisherScientific | 18-605-593 | |
| Lead Nitrate | Fisher Scientific | L62-100 | |
| Microwave | Pelco | BioWave Pro | This is the microwave used by the authors, alternates are acceptable. |
| Osmium Tetroxide | Sigma-Aldrich | 201030 | |
| Potassium Ferrocyanide | Sigma-Aldrich | P9387 | |
| Silicone Embedding Mold | Ted Pella | 10504 | |
| Sodium Cacodylate Trihydrate | Electron Microscopy Sciences | 12300 | |
| Samco Transfer Pipette | ThermoFisher Scientific | 202 | Used to make specimen pin storage tubes. |
| Swiss Pattern Needle Files | Electron Microscopy Sciences | 62115 | |
| Thiocarbohydrazide | Sigma-Aldrich | 223220 | |
| Uranyl Acetate | Polysciences, Inc. | 21447-25 | |
| Reconstruction Software | |||
| Amira Software | Thermo Scientific | N/A | Used to create the reconstructions found in figures 5-7 and 9. |
| Fiji (Fiji is Just ImageJ) | ImageJ.net | N/A | TrakEM2 can be added to Fiji to asist in manual segmentation. |
| Microscopy Image Browser (MIB) | University of Helsinki, Institute of Biotechnology | N/A | |
| Reconstuct Software | Neural Systems Lab | N/A | |
| SuRVoS Workbench | Diamond Light Source & The University of Nottingham | N/A | |
| SyGlass | IstoVisio, Inc. | N/A | Allows for reconstruction in virtual reality and histogram-based reconstruction methods. |
Referencias
- Leighton, S. B. SEM images of block faces, cut by a miniature microtome within the SEM - a technical note. Scanning Electron Microscopy. , Pt 2 73-76 (1981).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three-dimensional tissue nanostructure. PLOS Biology. 2 (11), 329(2004).
- He, Q., Hsueh, M., Zhang, G., Joy, D. C., Leapman, R. D. Biological serial block face scanning electron microscopy at improved z-resolution based on Monte Carlo model. Scientific Reports. 8 (1), 12985(2018).
- Zankel, A., Wagner, J., Poelt, P. Serial sectioning methods for 3D investigations in materials science. Micron. 62, 66-78 (2014).
- Titze, B., Genoud, C. Volume scanning electron microscopy for imaging biological ultrastructure. Biology of the Cell. 108 (11), 307-323 (2016).
- Ohta, K., et al. Beam deceleration for block-face scanning electron microscopy of embedded biological tissue. Micron. 43 (5), 612-620 (2012).
- Bouwer, J. C., et al. Deceleration of probe beam by stage bias potential improves resolution of serial block-face scanning electron microscopic images. Advanced Structural and Chemical Imaging. 2 (1), 11(2017).
- Kizilyaprak, C., Longo, G., Daraspe, J., Humbel, B. M. Investigation of resins suitable for the preparation of biological sample for 3-D electron microscopy. Journal of Structural Biology. 189 (2), 135-146 (2015).
- Kittelmann, M., Hawes, C., Hughes, L. Serial block face scanning electron microscopy and the reconstruction of plant cell membrane systems. Journal of Microscopy. 263 (2), 200-211 (2016).
- Biazik, J., Vihinen, H., Anwar, T., Jokitalo, E., Eskelinen, E. L. The versatile electron microscope: an ultrastructural overview of autophagy. Methods. 75, 44-53 (2015).
- Peddie, C. J., Collinson, L. M. Exploring the third dimension: Volume electron microscopy comes of age. Micron. 61, 9-19 (2014).
- Piňos, J., Mikmeková, Š, Frank, L. About the information depth of backscattered electron imaging. Journal of Microscopy. 266 (3), 335-342 (2017).
- Smith, D., Starborg, T. Serial block face scanning electron microscopy in cell biology: Applications and technology. Tissue Cell. 57, 111-122 (2019).
- Goggin, P., et al. Development of protocols for the first serial block-face scanning electron microscopy (SBF SEM) studies of bone tissue. Bone. 131, 115107(2020).
- Deerinck, T. J., et al. High-performance serial block-face SEM of nonconductive biological samples enabled by focal gas injection-based charge compensation. Journal of Microscopy. 270 (2), 142-149 (2018).
- Nguyen, H. B., et al. Conductive resins improve charging and resolution of acquired images in electron microscopic volume imaging. Scientific Reports. 6, 23721(2016).
- Deerinck, T. J., Bushong, E. A., Thor, A., Ellisman, M. H. NCMIR methods for 3D EM: a new protocol for preparation of biological specimens for serial block face scanning electron microscopy. National Center for Microscopy and Imaging Research. 6 (8), (2010).
- Deerinck, T. J., et al. Enhancing Serial Block-Face Scanning Electron Microscopy to Enable High Resolution 3-D Nanohistology of Cells and Tissues. Microscopy and Microanalysis. 16, 1138-1139 (2010).
- Kubota, Y. New developments in electron microscopy for serial image acquisition of neuronal profiles. Microscopy (Oxf). 64 (1), 27-36 (2015).
- Courson, J. A., et al. Serial block-face scanning electron microscopy: A provocative technique to define 3-dimensional ultrastructure of microvascular thrombosis. Thrombosis Research. 196, 519-522 (2020).
- Courson, J. A., et al. Serial block-face scanning electron microscopy reveals neuronal-epithelial cell fusion in the mouse cornea. PLoS One. 14 (11), 0224434(2019).
- Lafontant, P. J., et al. Cardiac Myocyte Diversity and a Fibroblast Network in the Junctional Region of the Zebrafish Heart Revealed by Transmission and Serial Block-Face Scanning Electron Microscopy. PLoS One. 8 (8), 72388(2013).
- Hanlon, S. D., Behzad, A. R., Sakai, L. Y., Burns, A. R. Corneal stroma microfibrils. Experimental Eye Research. 132, 198-207 (2015).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- Davenport, A. T., Grant, K. A., Szeliga, K. T., Friedman, D. P., Daunais, J. B. Standardized method for the harvest of nonhuman primate tissue optimized for multiple modes of analyses. Cell Tissue Bank. 15 (1), 99-110 (2014).
- Schuster, A., et al. An isolated perfused pig heart model for the development, validation and translation of novel cardiovascular magnetic resonance techniques. Journal of Cardiovascular Magnetic Resonance. 12 (1), 53(2010).
- Hanlon, S. D., Patel, N. B., Burns, A. R. Assessment of postnatal corneal development in the C57BL/6 mouse using spectral domain optical coherence tomography and microwave-assisted histology. Experimental Eye Research. 93 (4), 363-370 (2011).
- Longiéras, N., Sebban, M., Palmas, P., Rivaton, A., Gardette, J. L. Multiscale approach to investigate the radiochemical degradation of epoxy resins under high-energy electron-beam irradiation. Journal of Polymer Science Part A: Polymer Chemistry. 44 (2), 865-887 (2006).
- Hashimoto, T., Thompson, G. E., Zhou, X., Withers, P. J. 3D imaging by serial block face scanning electron microscopy for materials science using ultramicrotomy. Ultramicroscopy. 163, 6-18 (2016).
- Rouquette, J., et al. Revealing the high-resolution three-dimensional network of chromatin and interchromatin space: A novel electron-microscopic approach to reconstructing nuclear architecture. Chromosome Research. 17 (6), 801(2009).
- Briggman, K. L., Helmstaedter, M., Denk, W. Wiring specificity in the direction-selectivity circuit of the retina. Nature. 471 (7337), 183-188 (2011).
- Katoh, K. Microwave-Assisted Tissue Preparation for Rapid Fixation, Decalcification, Antigen Retrieval, Cryosectioning, and Immunostaining. International Journal of Biochemistry & Cell Biology. 2016, 7076910(2016).
- Login, G. R., Dvorak, A. M. A review of rapid microwave fixation technology: its expanding niche in morphologic studies. Scanning. 15 (2), 58-66 (1993).
- Jamur, M. C., Faraco, C. D., Lunardi, L. O., Siraganian, R. P., Oliver, C. Microwave fixation improves antigenicity of glutaraldehyde-sensitive antigens while preserving ultrastructural detail. Journal of Histochemistry and Cytochemistry. 43 (3), 307-311 (1995).
- Leong, A. S., Sormunen, R. T. Microwave procedures for electron microscopy and resin-embedded sections. Micron. 29 (5), 397-409 (1998).
- Willingham, M. C., Rutherford, A. V. The use of osmium-thiocarbohydrazide-osmium (OTO) and ferrocyanide-reduced osmium methods to enhance membrane contrast and preservation in cultured cells. Journal of Histochemistry and Cytochemistry. 32 (4), 455-460 (1984).
- Khan, A. A., Riemersma, J. C., Booij, H. L. The reactions of osmium tetroxide with lipids and other compounds. Journal of Histochemistry and Cytochemistry. 9, 560-563 (1961).
- Belazi, D., Solé-Domènech, S., Johansson, B., Schalling, M., Sjövall, P. Chemical analysis of osmium tetroxide staining in adipose tissue using imaging ToF-SIMS. Histochemistry and Cell Biology. 132 (1), 105-115 (2009).
- Rivlin, P. K., Raymond, P. A. Use of osmium tetroxide-potassium ferricyanide in reconstructing cells from serial ultrathin sections. Journal of Neuroscience Methods. 20 (1), 23-33 (1987).
- Aguas, A. P. The use of osmium tetroxide-potassium ferrocyanide as an extracellular tracer in electron microscopy. Stain Technology. 57 (2), 69-73 (1982).
- Seligman, A. M., Wasserkrug, H. L., Hanker, J. S. A new staining method (OTO) for enhancing contrast of lipid--containing membranes and droplets in osmium tetroxide--fixed tissue with osmiophilic thiocarbohydrazide(TCH). Journal of Cell Biology. 30 (2), 424-432 (1966).
- Watson, M. L. Staining of tissue sections for electron microscopy with heavy metals. II. Application of solutions containing lead and barium. Journal of Biophysical and Biochemical Cytology. 4 (6), 727-730 (1958).
- Zhou, W., Apkarian, R., Wang, Z., Joy, D. Fundamentals of Scanning Electron Microscopy. Scanning Microscopy in Nanotechnology. , 1-40 (2006).
- Tapia, J. C., et al. High-contrast en bloc staining of neuronal tissue for field emission scanning electron microscopy. Nature Protocols. 7 (2), 193-206 (2012).
- Buchacker, T., et al. Assessment of the Alveolar Capillary Network in the Postnatal Mouse Lung in 3D Using Serial Block-Face Scanning Electron Microscopy. Frontiers in Physiology. 10, 1357(2019).
- Keeling, E., et al. 3D-Reconstructed Retinal Pigment Epithelial Cells Provide Insights into the Anatomy of the Outer Retina. International Journal of Molecular Sciences. 21 (21), (2020).
- Shang, P., et al. Chronic Alcohol Exposure Induces Aberrant Mitochondrial Morphology and Inhibits Respiratory Capacity in the Medial Prefrontal Cortex of Mice. Frontiers in Neuroscience. 14, 561173(2020).
- Pfeifer, C. R., et al. Quantitative analysis of mouse pancreatic islet architecture by serial block-face SEM. Journal of Structural Biology. 189 (1), 44-52 (2015).
- Wilke, S. A., et al. Deconstructing complexity: serial block-face electron microscopic analysis of the hippocampal mossy fiber synapse. Journal of Neuroscience. 33 (2), 507-522 (2013).
- Cocks, E., Taggart, M., Rind, F. C., White, K. A guide to analysis and reconstruction of serial block face scanning electron microscopy data. Journal of Microscopy. 270 (2), 217-234 (2018).
- Borrett, S., Hughes, L. Reporting methods for processing and analysis of data from serial block face scanning electron microscopy. Journal of Microscopy. 263 (1), 3-9 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529(2017).
- Fiala, J. C. Reconstruct: a free editor for serial section microscopy. Journal of Microscopy. 218, Pt 1 52-61 (2005).
- Pidhorskyi, S., Morehead, M., Jones, Q., Spirou, G., Doretto, G. syGlass: interactive exploration of multidimensional images using virtual reality Head-mounted displays. arXiv . , arXiv:1804.08197 (2018).
- Cardona, A., et al. TrakEM2 software for neural circuit reconstruction. PLoS One. 7 (6), 38011(2012).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy Image Browser: A Platform for Segmentation and Analysis of Multidimensional Datasets. PLOS Biology. 14 (1), 1002340(2016).
- Luengo, I., et al. SuRVoS: Super-Region Volume Segmentation workbench. Journal of Structural Biology. 198 (1), 43-53 (2017).
- Anderson, H. R., Stitt, A. W., Gardiner, T. A., Archer, D. B. Estimation of the surface area and volume of the retinal capillary basement membrane using the stereologic method of vertical sections. Analytical & Quantitative Cytology & Histology. 16 (4), 253-260 (1994).
- Gibbons, C. H., Illigens, B. M., Wang, N., Freeman, R. Quantification of sweat gland innervation: a clinical-pathologic correlation. Neurology. 72 (17), 1479-1486 (2009).
- Knust, J., Ochs, M., Gundersen, H. J., Nyengaard, J. R. Stereological estimates of alveolar number and size and capillary length and surface area in mice lungs. Anat Rec. 292 (1), Hoboken. 113-122 (2009).
- Mahon, G. J., et al. Chloroquine causes lysosomal dysfunction in neural retina and RPE: implications for retinopathy. Current Eye Research. 28 (4), 277-284 (2004).
- Michel, R. P., Cruz-Orive, L. M. Application of the Cavalieri principle and vertical sections method to lung: estimation of volume and pleural surface area. Journal of Microscopy. 150, Pt 2 117-136 (1988).
- Weibel, E. R. Stereological methods in cell biology: where are we--where are we going. Journal of Histochemistry and Cytochemistry. 29 (9), 1043-1052 (1981).
- Schmitz, C., Hof, P. R. Design-based stereology in neuroscience. Neuroscience. 130 (4), 813-831 (2005).
- Kristiansen, S. L., Nyengaard, J. R. Digital stereology in neuropathology. Apmis. 120 (4), 327-340 (2012).
- Howard, C. V., Reed, M. G. Unbiased Stereology. 2nd edn. , Garland Science/BIOS Scientific Publishers. (2005).
- Reith, A., Mayhew, T. M. Stereology and Morphometry in Electron Microscopy: Problems and Solutions. , Hemisphere Publishing Corporation. (1988).
- Mouton, P. R. Principles and practices of unbiased stereology: an introduction for bioscientists. , Johns Hopkins University Press. (2002).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados