Method Article
Microscopia eletrônica de varredura de blocos de bloco serial (SBF-SEM) de amostras de tecido biológico
Neste Artigo
Resumo
Este protocolo descreve um método de rotina para o uso de microscopia eletrônica de varredura em bloco serial (SBF-SEM), uma poderosa técnica de imagem 3D. A aplicação bem sucedida do SBF-SEM depende de técnicas adequadas de fixação e coloração de tecidos, bem como cuidadosa consideração das configurações de imagem. Este protocolo contém considerações práticas para a totalidade deste processo.
Resumo
A microscopia eletrônica de varredura em bloco serial (SBF-SEM) permite a coleta de centenas a milhares de imagens ultraestruturais registradas em série, oferecendo uma visão tridimensional sem precedentes da microanato tecidual. Embora a SBF-SEM tenha visto um aumento exponencial no uso nos últimos anos, aspectos técnicos como a preparação adequada do tecido e parâmetros de imagem são primordiais para o sucesso dessa modalidade de imagem. Este sistema de imagem se beneficia da natureza automatizada do dispositivo, permitindo que se deixe o microscópio desacompanhado durante o processo de imagem, com a coleta automatizada de centenas de imagens possíveis em um único dia. No entanto, sem a preparação adequada da ultraestrutura celular de preparação tecidual pode ser alterada de tal forma que conclusões incorretas ou enganosas possam ser tiradas. Além disso, as imagens são geradas pela varredura da face do bloco de uma amostra biológica incorporada à resina e isso muitas vezes apresenta desafios e considerações que devem ser abordadas. O acúmulo de elétrons dentro do bloco durante a imagem, conhecido como "carregamento de tecido", pode levar a uma perda de contraste e uma incapacidade de apreciar a estrutura celular. Além disso, enquanto o aumento da intensidade/tensão do feixe de elétrons ou a diminuição da velocidade de varredura do feixe pode aumentar a resolução da imagem, isso também pode ter o infeliz efeito colateral de danificar o bloco de resina e distorcer imagens subsequentes na série de imagens. Aqui apresentamos um protocolo de rotina para a preparação de amostras de tecido biológico que preserva a ultraestrutura celular e diminui o carregamento de tecidos. Também fornecemos considerações de imagem para a rápida aquisição de imagens seriais de alta qualidade com danos mínimos ao bloco tecidual.
Introdução
A microscopia eletrônica de varredura facial de blocos seriais (SBF-SEM) foi descrita pela primeira vez por Leighton em 1981, onde ele criou um microscópio eletrônico de varredura aumentado com um microtome embutido que poderia cortar e imagem fina seções de tecido embutido na resina. Infelizmente, limitações técnicas restringiram seu uso a amostras condutoras, pois amostras não condutoras como tecido biológico acumularam níveis inaceitáveis de carregamento (acúmulo de elétrons dentro da amostra de tecido)1. Embora o revestimento da face do bloco entre os cortes com o carregamento de tecido reduzido de carbono evaporado, este tempo de aquisição de imagens muito maior e o armazenamento de imagens permaneceu um problema, pois a tecnologia de computador na época era insuficiente para gerenciar os grandes tamanhos de arquivos criados pelo dispositivo. Esta metodologia foi revisitada por Denk e Horstmann em 2004 usando um SBF-SEM equipado com uma câmara de pressão variável2. Isso permitiu a introdução de vapor de água na câmara de imagem que reduz o carregamento dentro da amostra, tornando viável a imagem de amostras não condutoras, embora com perda de resolução de imagem. Melhorias adicionais nos métodos de preparação e imagem de tecidos agora permitem imagens usando alto vácuo, e a imagem SBF-SEM não depende mais de vapor de água para dissipar o carregamento3,4,5,6,7,8,9. Embora a SBF-SEM tenha visto um aumento exponencial no uso nos últimos anos, aspectos técnicos como a preparação adequada do tecido e parâmetros de imagem são primordiais para o sucesso dessa modalidade de imagem.
O SBF-SEM permite a coleta automatizada de milhares de imagens de microscopia eletrônica registradas em série, com resolução planar tão pequena quanto 3-5 nm10,11. O tecido, impregnado com metais pesados e embutido em resina, é colocado dentro de um microscópio eletrônico de varredura (SEM) contendo um ultramicrotome equipado com uma faca de diamante. Uma superfície plana é cortada com a faca de diamante, a faca é retraída, e a superfície do bloco é escaneada em um padrão raster com um feixe de elétrons para criar uma imagem de ultraestrutura tecidual. O bloco é então levantado uma quantidade especificada (por exemplo, 100 nm) no eixo z, conhecido como "passo z", e uma nova superfície é cortada antes que o processo seja repetido. Desta forma, um bloco de imagens tridimensionais (3D) é produzido à medida que o tecido é cortado. Este sistema de imagem beneficia ainda mais a natureza automatizada do dispositivo, permitindo que se deixe o microscópio desacompanhado durante o processo de imagem, com a coleta automatizada de centenas de imagens possíveis em um único dia.
Enquanto a imagem SBF-SEM usa principalmente elétrons encarnicados para formar uma imagem do rosto do bloco, elétrons secundários são gerados durante o processo de imagem12. Elétrons secundários podem se acumular, ao lado de elétrons de feixe primário e requesque-a-pena que não escapam do bloco, e produzem "carregamento de tecido", o que pode levar a um campo eletrostático localizado na face do bloco. Esse acúmulo de elétrons pode distorcer a imagem ou fazer com que os elétrons sejam ejetados do bloco e contribuam para o sinal coletado pelo detector de backscatter, diminuindo a relação sinal-ruído13. Embora o nível de carga tecidual possa ser diminuído reduzindo a tensão ou intensidade do feixe de elétrons, ou reduzindo o tempo de moradia do feixe, isso resulta em uma diminuição da relação sinal-ruído14. Quando um feixe de elétrons de menor tensão ou intensidade é usado, ou o feixe só é permitido habitar dentro de cada espaço de pixel por um período mais curto de tempo, elétrons menos encalulados são ejetados do tecido e capturados pelo detector de elétrons resultando em um sinal mais fraco. Denk e Horstmann lidaram com esse problema introduzindo vapor de água na câmara, reduzindo assim a carga na câmara e na face do bloco ao custo da resolução de imagem. Com uma pressão de câmara de 10-100 Pa, uma porção do feixe de elétrons é espalhada contribuindo para o ruído da imagem e uma perda de resolução, porém isso também produz íons na câmara de espécimes que neutraliza a carga dentro do bloco de amostra2. Métodos mais recentes para neutralizar a carga dentro do bloco de amostra usam injeção de gás focal de nitrogênio sobre a face do bloco durante a imagem, ou introduzindo tensão negativa ao estágio SBF-SEM para diminuir a energia de embarque de feixes de sonda e aumentar o sinal coletado6,7,15. Em vez de introduzir viés de palco, pressão de câmara ou injeção de nitrogênio localizada para diminuir o acúmulo de carga na superfície do bloco, também é possível aumentar a condutividade da resina introduzindo carbono na mistura de resina permitindo configurações de imagem mais agressivas16. O protocolo geral a seguir é uma adaptação do protocolo Deerinck et al. publicado em 2010 e abrange modificações nas metodologias de preparação e imagem de tecidos que consideramos úteis para minimizar o carregamento de tecidos, mantendo a aquisição de imagens de alta resolução3,17,18,19. Embora o protocolo mencionado anteriormente tenha focado no processamento de tecidos e na impregnação de metais pesados, este protocolo fornece uma visão sobre o fluxo de trabalho de imagem, análise de dados e reconstrução inerente aos estudos da SBF-SEM. Em nosso laboratório, este protocolo tem sido aplicado com sucesso e reprodutivelmente a uma grande variedade de tecidos, incluindo córneas e estruturas de segmentos anteriores, pálpebras, glândulas lacrimais e mais duras, retina e nervo óptico, coração, pulmão e vias aéreas, rim, fígado, músculo cremaster e córtex cerebral/medula, e em uma variedade de espécies incluindo rato, rato, coelho, cobaia, peixe, monocamada e culturas celulares estratificadas, porco, primata não humano, bem como humano20,21,22,23. Embora pequenas mudanças possam valer a pena para tecidos e aplicações específicas, este protocolo geral tem se mostrado altamente reprodutível e útil no contexto de nossa instalação de imagem principal.
Protocolo
Todos os animais foram manuseados de acordo com as diretrizes descritas na Declaração de Visão e Oftalmologia da Associação de Pesquisa em Visão e Oftalmologia para o Uso de Animais em Visão e Pesquisa Oftalmológica e nas diretrizes de manejo animal da Faculdade de Optometria da Universidade de Houston. Todos os procedimentos de animais foram aprovados pelas instituições em que foram tratados: procedimentos de rato, rato, coelho, cobaia e primatas não humanos foram aprovados pelo Comitê de Cuidados e Uso de Animais da Universidade de Houston, procedimentos de zebrafish foram aprovados pelo Comitê de Cuidados e Uso de Animais da Universidade de DePauw, e procedimentos de suínos foram aprovados pelo Comitê de Cuidados e Uso de Animais da Faculdade de Medicina da Baylor. Todo o tecido humano foi tratado de acordo com a Declaração de Helsinque sobre pesquisas sobre tecido humano e aprovação do conselho de revisão institucional apropriada foi obtida.
1. Processamento de tecidos
- Prepare uma solução de estoque de tampão de cacodilato de sódio de 0,4 M misturando pó de cacodilato de sódio em ddH2O. Misture completamente o tampão e o pH ajuste a solução para 7,3. Este buffer é usado para tornar fixativo (composição descrita abaixo na etapa 1.3), tampão de lavagem, bem como soluções de ferrocineto de ósmio e potássio.
NOTA: A fixação por perfusão é frequentemente o melhor método de fixação para estudos SBF-SEM, pois a fixação ocorre rapidamente e em todo o corpo. Se a fixação por perfusão não for possível dentro do seu projeto de estudo, pule para a etapa 1.3. - Realizar fixação de perfusão com a pressão fisiológica adequada para o modelo animal24,25,26. Isso é feito via perfusão sequencial transcárdica com soro fisiológico heparinizado seguido de fixação, cada um colocado em uma altura específica (por exemplo, 100 cm) acima do organismo (adequado à pressão fisiológica do sistema vascular no modelo animal), com fluxo fixativo para o ventrículo esquerdo, e saindo de uma incisão feita no átrio direito. O tecido de interesse ficará pálido à medida que o sangue for substituído por fixador, se toda ou uma parte do seu tecido não branquear, então o tecido pode não ser adequadamente fixado e a ultraestrutura pode não ser preservada.
- Use uma lâmina de barbear ou bisturi afiado para aparar amostras de tecido em blocos não maiores que 2 mm x 2 mm x 2 mm. Se o passo 1.2 foi ignorado, faça isso rapidamente para que o tecido possa ser corrigido o mais rápido possível.
- Alternativamente, dissecar tecido sob fixação e transferir para fixação fresca para completar o processo de imersão. A composição final do fixador consiste em 0,1 M tampão de cacodilato de sódio contendo 2,5% de glutaraldeído e cloreto de cálcio de 2 mM. A previsão é de que a fixação prossiga por uma mínima de 2 horas em temperatura ambiente e máxima de durante a noite a 4 °C. Se possível, use uma placa de roqueiro/inclinação para agitar suavemente as amostras durante a fixação.
- Alternativamente, se um micro-ondas inversor estiver disponível, fixe o tecido no fixador acima mencionado sob vácuo a 150 watts durante 4 ciclos de 1 minuto, 1 minuto de folga. A fixação do micro-ondas é o método preferido para o passo 1.3, pois fixa rapidamente o tecido e preserva a ultraestrutura tecidual27.
NOTA: O tecido nunca deve ser permitido secar durante este protocolo, deve-se tomar cuidado para transferir tecido rapidamente de uma solução para outra.
- Lave o tecido fixo 5x por 3 minutos cada (15 minutos no total) à temperatura ambiente em 0,1 M tampão de cacodilato de sódio contendo cloreto de cálcio de 2 mM.
- Torne a seguinte solução de ferrocianida de ósmio fresco, de preferência durante as etapas anteriores de lavagem. Combine uma solução de tetroxida de 4% de ósmio (preparada em ddH2O) com um volume igual de ferrocianida de potássio de 3% em tampão de cacodilato de 0,2 M com cloreto de cálcio de 4 mM. Após a etapa anterior de lavagem, coloque o tecido nesta solução por 1 hora no gelo no escuro, e no capô da fumaça.
NOTA: O tetroxida de ósmio é uma substância cristalina amarela que vem em uma ampola. Para criar a solução de tetroxida de ósmio, abra a ampola, adicione ddH2O e sonicar por 3-4 horas no escuro até que os cristais sejam completamente dissolvidos. A solução de tetroxida de ósmio é uma solução amarela clara, se a solução for preta o ósmio foi reduzido e não deve mais ser usado. - Enquanto o tecido está incubando na solução de ferrocianida de ósmio, comece a preparar a solução de tiocarbohydrazida (TCH). Prepare esta solução fresca e tenha-a prontamente disponível no final do período de fixação de ferrocisídio de 1 hora. Combine 0,1 g de tiocarbohydrazida com 10 mL de ddH2O e coloque esta solução em um forno de 60 °C por 1 hora. Para garantir que a solução seja dissolvida, gire suavemente a cada 10 minutos. Antes de usar, filtre esta solução através de um filtro de seringa de 0,22 μm.
- Antes de incubar em TCH, lave o tecido com temperatura ambiente ddH2O 5x por 3 minutos cada (15 minutos no total).
- Coloque o tecido na solução TCH filtrada por um total de 20 minutos à temperatura ambiente(Figura 1A-C).
- Após a incubação em TCH, lave o tecido 5x por 3 minutos cada (15 minutos no total) em temperatura ambiente ddH2O.
- Coloque tecido em ddH2O contendo 2% de tetroxida de ósmio (não osmium reduzido com ferrocida de potássio) por 30 minutos à temperatura ambiente. Isso deve ser feito no capô da fumaça e no escuro, pois o ósmio pode ser reduzido pela luz (por exemplo, sob papel alumínio)(Figura 1D-F).
- Após a incubação do tetroxida de ósmio, lave o tecido 5x por 3 minutos cada (15 minutos no total) em temperatura ambiente ddH2O.
- Coloque tecido em acetato de urânyl 1% aquoso (pó de acetato de urântil misturado em ddH2O) durante a noite em uma geladeira a 4 °C.
- Pouco antes de remover tecido da geladeira, prepare a solução de aspartato de chumbo de Walton fresco. Comece dissolvendo 0,066 g de nitrato de chumbo em 10 mL de solução de ácido aspartic de 0,03 M (0,04 g ácido aspartico em 10 mL de água destilada) e ajuste pH para 5,5 com 1 N KOH (0,5611 g em 10 mL de água destilada).
ATENÇÃO: Um precipitado pode se formar ao ajustar o pH. Isso não é aceitável.- Usando uma barra de mexida, adicione lentamente o 1 N KOH dropwise durante o monitoramento do pH. Pré-aqueça a solução de aspartato de chumbo claro acabado em um forno de 60 °C por 30 minutos. Se um precipitado for a solução não pode ser usada e outra solução deve ser preparada.
- Retire o tecido da geladeira e lave 5x por 3 minutos cada (15 minutos no total) em temperatura ambiente ddH2O.
- Após a lavagem, coloque o tecido na solução de aspartato de chumbo de Walton aquecida por 30 minutos, mantendo a temperatura a 60 °C.
- Após a incubação no aspartato de chumbo de Walton, lave o tecido 5x por 3 minutos cada (15 minutos no total) em temperatura ambiente ddH2O(Figura 1G-I).
- Desidratar o tecido através de uma série de acetona gelada (30%, 50%, 70%, 95%, 95%, 100%, 100% e acetona 100% (em ddH2O, quando aplicável) permitindo 10 minutos para cada passo da série.
- Seguindo a série de desidratação gelada, coloque tecido em acetona de temperatura ambiente por 10 minutos.
- Durante este período, formular a resina Abed 812 ACM. Use a receita "hard mix", pois é mais resistente ao dano do feixe. Misture bem a resina e coloque o tecido em Incorporar 812:acetona (1:3 mix) por 4 horas, seguido por Embed 812:acetona (1:1 mix) por 8 horas ou durante a noite, e finalmente Incorporar 812:acetona (3:1 mix) durante a noite. Realize estas etapas de infiltração de resina à temperatura ambiente.
- No dia seguinte, coloque o tecido em 100% Incorporar 812 por 4-8 horas, depois em 100% fresco incorporar 812 durante a noite, e finalmente em 100% fresco Incorporar 812 por 4 horas. Realize estas etapas de infiltração de resina à temperatura ambiente.
- Pouco antes de incorporar, coloque uma pequena quantidade de resina em um recipiente de mistura e misture lentamente (uma vara de madeira pode ser usada para mexer) em pó preto carbono até que a resina esteja saturada com o pó, mas ainda é fluida e não se torna granulada. Deve se assemelhar a tinta grossa e ser capaz de gotejar lentamente da vara de madeira sem aglomerados visíveis.
- Oriente as amostras de tecido em um molde de borracha de silicone e tire uma foto para que a orientação da amostra dentro do bloco de resina seja registrada e possa ser referenciada. Cubra as amostras em resina saturada preta de carbono na ponta do molde de silicone e coloque o molde em um forno por ~1 hora a 65 °C.
- Coloque o molde em uma inclinação para conter a resina na ponta do molde onde cobre a amostra de tecido. Coloque um rótulo com um identificador de amostra de experimento/tecido no molde na extremidade oposta da resina (Figura 2A).
- Retire o molde de silicone do forno e encha o restante do molde com resina clara (sem preto carbono) certificando-se de que o rótulo permaneça visível. Cure a resina infundida com carbono preto o suficiente para não se misturar prontamente com a resina clara.
- Prepare um poço extra dentro do molde que não contenha tecido. Começando com o poço extra, encha o restante do molde com resina clara.
- Se a resina infundida preta de carbono começar a sangrar na resina clara, coloque o molde de silicone de volta no forno por mais tempo (por exemplo, 15 minutos).
- Uma vez que todas as amostras de tecido tenham sido cobertas com resina clara, coloque o molde de silicone de volta no forno (plano, sem inclinação) a 65 °C por 48 horas para completar o processo de cura.
2. Preparação do bloco
NOTA: O método dependerá de como a amostra é orientada no bloco e como a secção deve ocorrer. No entanto, a orientação tecidual mais comum encontra o tecido centrado na ponta do bloco de resina, perpendicular à extremidade longa do bloco de resina.
- Na maioria dos casos, primeiro corte a extremidade do bloco para localizar o tecido colocando o bloco de espécime no mandril de microtoma com a extremidade afilada furando aproximadamente 5-6 mm para fora do mandril. Coloque-o no lugar com o parafuso definido e coloque-o sob uma lâmpada de calor.
- Após alguns minutos, o bloco será maleável e fácil de aparar. Coloque o mandril no suporte do estereomicroscope e use uma nova lâmina de barbear de duas bordas para fazer seções finas paralelas com a face do bloco até que o tecido esteja visível. Isso é melhor visto pela luz de angling através da face do bloco, a amostra de tecido será menos reflexiva e granular em comparação com as porções da resina que são desprovidas de tecido. Consulte a fotografia tirada de amostras de tecido antes da introdução de resina saturada preta de carbono para uma ideia de como e onde o tecido está localizado.
- Coloque um suporte de pino de amostra de lado para fins de corte. Este suporte de pinos nunca é colocado na câmara SEM e, portanto, pode ser manuseado sem luvas, este será referido como o suporte de pino de corte. Qualquer porta-espécimes destinado a ser colocado na câmara de imagem nunca deve ser tocado sem luvas. Isso evita introduzir graxa e óleo na câmara de microscópio.
- Coloque um pino de alumínio no suporte do pino de corte e aperte ligeiramente o parafuso do conjunto com a face (superfície plana) do pino 3-4mm acima do suporte do pino.
- Faça vários arranhões profundos e cruzados na face do pino para fornecer uma área de superfície maior para a cola usada para manter o espécime no lugar. Se um pino de alumínio for usado, uma pequena chave de fenda de aço é recomendada para esta etapa(Figura 2B).
- Coloque o mandril contendo a amostra de tecido de volta sob a lâmpada de calor até que a resina fique macia e maleável, em seguida, coloque-a no recipiente de mandril sob o estereóscópio.
- Usando uma lâmina de barbear de dois gumes para cortar o excesso de resina da porção do bloco de resina contendo a amostra de tecido. Em última análise, o tamanho do bloco de tecido ligado ao pino terá aproximadamente 3 mm de diâmetro e 2-3 mm de altura.
- Empurre cuidadosamente a navalha para baixo no bloco de resina cerca de 1-2 mm, em seguida, empurre cuidadosamente a navalha horizontalmente para o bloco de resina a uma profundidade igual ao corte anterior. Faça isso devagar e com muito cuidado, pois é possível danificar ou cortar a porção do bloco que contém a amostra de tecido. À medida que os dois cortes se encontram, o excesso de resina se separará do bloco. Continue a remover a resina até que apenas uma área elevada de 3 mm x 3 mm permaneça.
- Após este corte inicial, coloque o bloco (ainda no mandril) sob a lâmpada de calor por vários minutos.
- Uma vez que a resina se torne macia e maleável, coloque o bloco de volta sob o estereóscópio. Usando uma nova lâmina de barbear de dois gumes, corte a parte superior do bloco de resina, cerca de 1 mm abaixo da porção aparada, com um único corte suave. Uma superfície plana é preferível, pois esta será colada ao pino do espécime. Tenha cuidado para não permitir que a amostra se perca, pois esta etapa requer alguma força que possa ser transferida para a parte removida do bloco e fazê-la voar para longe. Coloque a amostra cortada e aparada de lado.
- Coloque o suporte do pino de corte contendo o pino de alumínio cortado no recipiente estereomicroscope. Aplique uma fina camada de cola cianoacrilato no rosto do pino de tal forma que cubra completamente o pino sem formar um menisco visível. Pegue o pedaço aparado do bloco de tecido com fórceps e coloque na cara do pino. Centralizar a amostra de tecido no pino da amostra. Empurre-o para baixo e segure-o por vários segundos. Deixe a cola definida por vários minutos.
- Quando a cola estiver completamente seca, coloque o suporte do pino de corte de volta sob o estereomicroscópio. Usando um arquivo fino, arquive o excesso de resina para que nenhuma resina esteja sobrecarregando o pino. A forma de resina deve se assemelhar à cabeça do pino circular.
- Localize o tecido na parte levantada do seu bloco de resina, a iluminação oblíqua é útil para isso. Utilizando uma navalha de duas bordas, a porção elevada da resina contendo a amostra de tecido deve ser aparada a uma área não maior que 1 mm2. Se possível, o face do bloco pode ser aparado ainda menor, isso reduzirá o estresse na faca de diamante e melhorará sua longevidade.
- Remova o máximo de excesso de resina possível, deixando o bloco um pouco mais longo em uma dimensão. Isso é feito lentamente e com cuidado, pois é possível que a resina contendo a amostra de tecido se rompam se muita força for aplicada. Enquanto uma navalha é recomendada, um arquivo de metal fino pode ser usado para esta etapa.
- Com um ângulo de arquivo metálico fino o excesso de resina, na área fora da porção levantada contendo a amostra de tecido, até a borda do pino(Figura 2C).
- Remova partículas de resina e poeira da amostra preparada antes de aplicar tinta prateada seguida de sputtering de ouro. Misture a prata com acetona de modo que seja um líquido facilmente difundido, semelhante ao esmalte (mas não tão fino que escorre do aplicador) e aplique uma camada fina em toda a superfície do bloco de amostra. A acetona evapora rapidamente, por isso pode ser necessário adicionar acetona adicional à medida que a tinta prateada começa a engrossar.
- Deixe a tinta prateada secar durante a noite antes de carregar no microscópio.
NOTA: Esta camada de prata deve ser fina para evitar a expansão da face do bloco para além de 1 mm x 1 mm, e embora a tinta prateada nunca tenha danificado a faca de diamante, rostos de blocos menores ainda são recomendados para preservar a longevidade da faca de diamante. A acetona misturada com a prata deve evaporar completamente antes de sputtering de ouro ou carregar a amostra no microscópio para evitar a introdução de vapor de acetona na câmara de imagem. - Após a aplicação da tinta prateada, aplique uma fina camada de ouro no bloco de amostra. Usando um dispositivo padrão de espiar a vácuo equipado com um alvo de folha de ouro padrão, uma pressão de câmara de 200 militor (gás Argon) e 40 miliamperes funcionando por 2 minutos resultará em um revestimento dourado de 20 nm de espessura.
- Deixe a tinta prateada secar durante a noite antes de carregar no microscópio.
- Após o revestimento, coloque o bloco montado e aparado em um tubo com o rótulo de experimento apropriado anexado. Crie tubos personalizados usando pipetas de transferência descartáveis.
- Corte a pipeta de transferência logo abaixo da lâmpada, deixando uma pequena parte do tubo de pipeta de transferência preso abaixo da extremidade bulbosa. Encurte a porção tubular que foi cortada, e corte a ponta da pipeta para trás o suficiente para que o pino da amostra de alumínio possa ser empurrado aconchegantemente dentro dele.
- Coloque a extremidade contendo o pino da amostra de alumínio dentro da extremidade bulbosa da pipeta de transferência modificada.
- Antes de carregar um bloco de tecido preparado, corte cuidadosamente o excesso de tinta prateada da superfície da face do bloco.
3. Configurações SEM para imagem da face do bloco
NOTA: As configurações de imagem que se seguem foram produzidas no dispositivo utilizado pelos autores, que está listado na Tabela de Materiais fornecidas. Embora este dispositivo seja capaz de imagens de pressão variável, os melhores resultados foram capturados sob alto vácuo.
- Tempo de moradia: Use 12 μs/px durante a seção serial. Quando uma região de interesse foi identificada, uma imagem de maior resolução pode ser adquirida a 32 μs/px.
- Configurações de vácuo: Use uma pressão de arma de 9e-008 Pa, uma pressão de coluna de 1.1e-004 Pa, e uma pressão de câmara de 9.5e-002 Pa.
- Tempo de captura: Com as configurações acima, capture uma pilha de imagens 2048x2048 px a uma taxa de 50 segundos por imagem. Imagens de maior resolução de regiões de interesse podem ser capturadas em 4096x4096 px a pouco menos de 9 minutos por imagem.
- Espessura da seção: Use 100-200 nm. Menos é possível, mas pode exigir menor tensão do feixe, intensidade ou tempo de moradia.
- Alta Tensão (HV): Use 7-12 kV. Embora o aumento da tensão reduza o tamanho da mancha e aumente a resolução, ele introduz mais possibilidade de danos nos raios. KV mais alto aumenta a penetração do feixe, o que resulta em perda de detalhes. No entanto, a redução do kV degrada a relação sinal para ruído(Figura 3)14.
- Intensidade do feixe (BI): O dispositivo SBF-SEM do autor oferece uma escala de intensidade de feixe que varia de 1 a 20. Nesta escala, os valores de 5-7 dão imagens de qualidade sem carregamento excessivo e danos na viga. Quanto maior o BI, maior a resolução, porém, há mais chance de cobrança e dano de feixe14.
- Tamanho do ponto e ampliação da imagem: Determine o tamanho da mancha pelo nível de intensidade e tensão do feixe. Idealmente, o tamanho do spot não deve ser maior do que o tamanho do pixel usado. O tamanho do pixel é determinado dividindo o campo de visão (FOV) pelo número de pixels. Por exemplo, um FOV de 25 μm com um tamanho de imagem de 2048x2048 px daria 12,2 nm por pixel. Portanto, o tamanho da mancha não deve ser superior a 12,2 nm. A Figura 4 mostra como hv, BI e tamanho da mancha estão relacionados.
- Distância de Trabalho (WD) - Com a imagem do rosto do bloco, a distância de trabalho não é ajustável. É simplesmente um fator de foco. Será quase idêntico para todos os blocos retratados. Embora a distância de trabalho não seja ajustável, ela desempenha um papel crítico na resolução da imagem capturada. À medida que a distância de trabalho diminui, o limite de resolução das imagens capturadas aumenta. Em alguns casos, pode ser possível diminuir a distância de trabalho fazendo modificações dentro da câmara de imagem, porém essas modificações devem ser feitas a critério do usuário. A fim de diminuir a distância de trabalho e aumentar a resolução da imagem, afrouxamos os parafusos de microtómeo do suporte da porta e reposicionamos o microtómeo para que ele descansasse ~2 mm mais perto do detector de feixe depois de reposicionar os parafusos.
- Resolução - Utilizando as configurações acima, é possível a resolução x & y de até 3,8 nm. É importante notar que a resolução é limitada pelo tamanho do ponto do feixe, bem como a resolução de pixels das capturas de imagem (por exemplo, um campo de visão de 20 μm capturado em uma imagem de 2048x2048 pixel tem uma resolução de pixel de 9,8 nm, mesmo que um tamanho de ponto de 3,8 nm tenha sido usado). A resolução de imagem no z-plane depende da espessura de secção, descobrimos que 100-200 nm funciona bem com este protocolo.
Resultados
Córnea-de-rato
Este protocolo foi aplicado extensivamente à córnea do rato. Utilizando imagens SBF-SEM, uma rede de pacotes de microfibril sem elastina (EFMBs) mostrou-se presente dentro da córnea do rato adulto. Acreditava-se anteriormente que essa rede só estava presente durante o desenvolvimento pós-natal embrionário e precoce. A SBF-SEM revelou uma extensa rede EFMB em toda a córnea, com fibras individuais encontradas com 100-200 nm de diâmetro quando medidas em seção transversal. Verificou-se também que esta rede EFMB foi organizada em camadas distintas, com fibras intimamente associadas a ceratocitos, mesmo situadas em invaginações rasas na superfície do ceratocito(Figura 5). A descoberta de fibras EFMB na córnea adulta levou à microscopia eletrônica de transmissão de imunogold (TEM), fluorescência e estudos confocal para entender melhor a natureza desta rede23.
A aplicação adicional deste protocolo levou à descoberta de uma população até então desconhecida de nervos córneas centrais que se fundem com células epiteliais basais na fronteira estromal-epitelial(Figura 6). Anteriormente, acreditava-se que todos os nervos interagindo com o epitélio nesta fronteira penetraram no epitélio córnea e ramificaram produzindo os plexi subbásal e epitelial. Neste estudo, ~45% dos nervos centrais interagindo com o epitélio basal sofreram fusão celular-célula em vez de uma simples penetração. Utilizando métodos eserológicos aplicados aos conjuntos de dados SBF-SEM, foi possível mostrar que essa nova população nervosa tinha uma relação superfície-volume aproximadamente metade da dos nervos penetrantes, consistente com sua aparência "inchada" (Nerve Fusion - 3.32±0.25, Penetração nervosa - 1,39±0,14, p ≤ 0,05). Reconstruções 3D de feixes nervosos penetrantes e fundidos e suas mitocôndrias foram criadas, destacando a falta de mitocôndrias em porções fundidas dos feixes nervosos. A descoberta da fusão das células neuronais-epiteliais usando SBF-SEM levou a estudos de fluorescência verificando a continuidade da membrana entre as duas células fundidas21.
A córnea central é um tecido avascular, e como tal a vasculatura periférica é de particular importância para a saúde geral da córnea. As relações célula-células e a ultraestrutura dessa região são complexas; no entanto, a capacidade de apreciar essas interações célula-célula e conexões ultraestruturais tem sido limitada em estudos de fluorescência e seção única. Por essa razão, uma pilha de imagens SBF-SEM contendo vasculatura limbal, feixes nervosos e células associadas foi segmentada manualmente para reconstrução 3D(Figura 7). Nesta imagem, a estreita associação entre as junções endoteliais vasculares e um pericyte sobreposto, os grânulos individuais de uma célula de mastro perivascular, o núcleo e a borda principal de um neutrófilo rastejando ao longo da superfície externa da parede dos vasos sanguíneos, bem como um feixe nervoso que passa pode ser visto.
Juntos, este conjunto de trabalho demonstra a capacidade deste protocolo de produzir conjuntos de dados de microscopia eletrônica 3D de alta qualidade em tecidos ricos em matriz extracelular e epitélio, bem como vasculatura e células associadas.
Retina primata de ordem superior - Plexo nervoso e Rede Vascular
A camada de fibra nervosa da retina (RNFL) de primatas de ordem superior contém e depende de uma extensa rede vascular. Muitas vezes, as doenças da retina envolvem alterações tanto nos parâmetros da camada de fibra nervosa da retina quanto na vasculatura encontrada dentro dela. Compreender a relação entre a RNFL e sua rede vascular em tecido saudável e não patológico é o primeiro passo para entender quaisquer alterações que possam ocorrer em decorrência da doença. Para melhor compreender essa relação, o protocolo SBF-SEM foi aplicado à retina normal de primatas de ordem superior e a reconstrução da rede vascular foi realizada e dados volumosos extraídos dessa reconstrução (Figura 8). Esta região de 4.642.307 μm3 da RNFL continha um leito vascular 1.207x10-4 μL em volume, totalizando 2,6% do volume total da RNFL. Este trabalho demonstra a capacidade deste protocolo de produzir conjuntos de dados de microscopia eletrônica 3D de alta qualidade em tecido neurológico denso.
Zebrafish e Coração Gigante de Danio - Músculo Estriado e Vasculatura em Desenvolvimento
Tanto o zebrafish quanto o danio gigante são modelos importantes para o desenvolvimento e regeneração do coração. Historicamente, o coração de zebrafish é considerado composto por dois segmentos miocárdios anatomicamente distintos funcionando juntos em apoio às demandas fisiológicas do zebrafish. No entanto, a interface entre essas duas camadas ventriculares não foi bem compreendida. Usando este protocolo, uma região juncional não reconhecida anteriormente foi descoberta consistindo de uma fina folha de fibroblastos. Verificou-se que as aberturas dentro desta folha permitiram que dois segmentos do miocárdio separado entrassem em contato e formassem junções complexas de adesões, incluindo desmossomos e adesões à fáscia22.
Este protocolo tem sido utilizado em outros trabalhos examinando a rede vascular do coração gigante de danio em desenvolvimento (Figura 9). Este método permite a valorização 3D da rede de miócitos cardíacos em desenvolvimento e sua relação com o desenvolvimento da microvasculatura. Em conjunto, este trabalho demonstra a capacidade deste protocolo de produzir conjuntos de dados de microscopia eletrônica 3D de alta qualidade em tecidos musculares e altamente vascularizados.
Configurações de imagem, carregamento e resolução
Embora a fixação adequada e a coloração de metais pesados sejam necessárias para a qualidade da imagem SBF-SEM, igualmente importante é o uso de resina condutiva e configurações de imagem adequadas para as questões que estão sendo abordadas. Neste protocolo, o uso de preto carbono é empregado a fim de aumentar a condutividade do bloco amostral e fornecer um conduíte para o pino de montagem para a liberação de elétrons secundários da face do bloco. Isso tem se mostrado eficaz no combate ao carregamento de tecidos que muitas vezes degrada a qualidade da imagem em tecidos não preparados com preto carbono16. Além disso, a tinta prateada e a sputtering de ouro aplicada ao bloco fornecem uma via de dissipação para o acúmulo de elétrons. Alguns dispositivos permitem a adição de um compensador de carga focal, que reduz o carregamento aplicando um sopro de nitrogênio sobre o bloco-face, porém tivemos sucesso semelhante com o uso de preto carbono e a aplicação de tinta prateada e sputtering de ouro para o bloco15. A falta de condutividade amostral pode levar ao acúmulo de elétrons visível como carregamento tecidual(Figura 1),bem como descargas que são visíveis como mudança abrupta de imagem e deformação que diminuem drasticamente a qualidade da imagem(Figura 10B & F). O uso de preto carbono permite a imagem sob alto vácuo e o uso de configurações de imagem que resultam em alta relação sinal-ruído e resolução melhorada de imagem. Uma dessas configurações que leva a uma melhor qualidade de imagem é o tempo de moradia dos pixels. O processo de imagem SBF-SEM envolve a varredura rasteral de um feixe de elétrons através da superfície da amostra para gerar elétrons recattered que o detector de microscópio pode coletar e interpretar como sinal. O tempo que este feixe é permitido para habitar dentro do espaço de cada pixel leva a um valor de pixel mais preciso sendo atribuído a cada localização de pixel(Figura 3A & B)2. Há, no entanto, um equilíbrio que deve ser atingido entre o aumento do sinal ao ruído, resolução e danos causados ao bloqueio face. O feixe irradia efetivamente a face do bloco com elétrons de alta energia que podem quebrar e suavizar a resina resultando em degradação da imagem e complicações de corte(Figura 10)28. Quanto mais fina a resolução z necessária, mais difícil fica a manutenção de imagens de alta resolução. Geralmente usamos passos z de 100-200 nm, porém os tamanhos de passo z de 25-50 nm foram relatados5,29,30,31. Com z-steps deste tamanho, a quebra e o amolecimento da resina devido ao dano no feixe podem levar à compressão da resina fazendo com que a faca perca um corte ou corte a face do bloco, mas com "conversa" onde a faca pula pela superfície do bloco criando ondulações e bandas13. Embora os pequenos passos z sejam uma perspectiva atraente, é importante manter a questão específica da pesquisa em mente ao escolher um passo z apropriado. A super amostragem pode levar a considerações substanciais de armazenamento de dados, bem como um aumento no tempo necessário para produzir reconstruções 3D.
Fixação e coloração de tecidos
Antes da incubação de metais pesados, os tecidos devem ser fixados em glutaraldeído. Embora recomendemos a fixação de micro-ondas sob vácuo para a preservação da ultraestrutura tecidual27,se um micro-ondas de grau laboratorial não estiver disponível, um micro-ondas de inversor comercial com wattagem variável pode ser substituído32,33,34,35. Se isso for feito, deve-se utilizar um cuidado extra para garantir que a distorção tecidual não ocorra. A fixação inadequada do tecido pode resultar em morfologia de tecido alterada, como pode ser visto na Figura 10E. Este protocolo, como a maioria dos protocolos modernos de coloração SBF-SEM, foi adaptado do procedimento de coloração delineado pela Deerinck em 201017, baseado nas manchas de osmium-thiocarbohydrazide-osmium criadas por Willingham e Rutherford em 198436. Os metais pesados utilizados neste protocolo adicionam contraste às estruturas celulares dentro de uma amostra de tecido(Figura 1). A incubação inicial do mossmium ocorre com o ómio reduzido que se liga a ligações C=C em gorduras insaturadas que levam à membrana e coloração lipídica37,38. O ósmio é reduzido por ferrocianida de potássio, que auxilia na coloração de lipídios saturados e também atua para estabilizar os fosfolipídios39,40. A tiocarbohydrazida é posteriormente adicionada como um mordente que se liga ao osmium desde a primeira incubação, atuando como uma ponte na qual mais osmium é vinculado em um estágio posterior no protocolo41. O acetato deuranyl, que é um sal de urânio, é um agente contrastante eficaz para lipídios, ácidos nucleicos e proteínas, enquanto o citrato de chumbo aumenta o contraste de proteínas e glicogênios. As diferentes afinidades desses agentes para componentes celulares aumentam ainda mais o contraste geral dentro dos tecidos acima e acima das incubações de ósmio42.
Imagem do Block-Face
Figura 11, Figura 12, Figura 13 ilustram os efeitos combinados da tensão, do tempo de moradia dos pixels e da intensidade do feixe. A prática convencional sugere que uma combinação de baixa tensão, tempo de moradia curto e baixa intensidade do feixe são necessárias para uma imagem ideal e prevenção de danos no feixe ao bloco amostral. Ao contrário dessas configurações, a Figura 11, Figura 12, Figura 13 ilustram que tensões mais altas (por exemplo, 7 kV), tempos de moradia mais longos (32 μs/px) e maiores intensidades de feixe (configuração 6 em nosso caso) podem produzir qualidade de imagem superior em relação às configurações convencionais.
O SBF-SEM permite a coleta de imagens de microscopia eletrônica serial que podem ser coletadas como um conjunto de dados 3D composto por voxels. Embora este seja um uso incrivelmente poderoso do SBF-SEM, este método também permite a imagem rápida e repetível de eventos biológicos raros ou células. A aquisição de imagens usando o SBF-SEM pode ser monitorada para eventos raros e a imagem pausada para coletar imagens de ampliação/resolução mais altas desses eventos. Além disso, o bloco pode ser removido da câmara de microscópio e da face do bloco seção para imagens de microscopia eletrônica de transmissão (TEM). Desta forma, grandes conjuntos de dados de eventos raros podem ser coletados usando o SBF-SEM, bem como apreciados na escala de angstrom usando TEM.

Figura 1: Comparações SBF-SEM e TEM em várias etapas do protocolo. Este protocolo contém várias etapas em que o tecido amostral é manchado com metais pesados. Isso afeta não só o contraste tecidual e a apreciação das estruturas celulares e organelas, mas também os níveis de carga que ocorrem quando o tecido é imageado. Esta figura contém três visões distintas do tecido preparado: uma visão de baixa ampliação(A, D & G),uma visão de alta ampliação(B, E & H),e uma comparação TEM de córnea de rato preparada(C, F & I). Pode-se notar que imagens de ampliação mais altas podem resultar em aumento do carregamento tecidual, já que o feixe de elétrons está concentrado em uma região menor de tecido. A linha superior (A-C) é uma amostra representativa do tecido processado até a conclusão da etapa 1.8, e foi impregnada com ferrocida de potássio, tetroxida de osmium e tiocarbohydrazida. As setas nas duas primeiras colunas mostram a interface epitelial-estromal como ponto de referência. Observe o baixo nível de contraste em comparação com as duas linhas inferiores, bem como os níveis aumentados de carregamento tecidual. A amostra na linha do meio (D-F) foi processada através da conclusão da etapa 1.10 e beneficia-se de uma etapa adicional de tetroxida de ósmio, e é visivelmente mais contrastada do que a amostra na linha superior. Enquanto as estruturas celulares são perceptíveis, o carregamento ainda está presente. A amostra na linha inferior(G-I) beneficia-sedo protocolo completo de coloração e tem carregamento mínimo de tecido. A imagem TEM revela que os níveis de contraste tecidual transmitidos pelos metais pesados presentes em cada etapa (coluna direita): as organelas no endotélio córnea (*) são mais contrastadas e aparentes à medida que o processamento tecidual continua através do protocolo. Além disso, os detalhes do colágeno e fibrillina estrobomais se tornam mais visíveis (ponta de flecha) à medida que o protocolo é concluído. Painel A, barra de escala D & G = 50 μm. Painel B, Barra de escala E & H = 10 μm. Barra de escala painel C, F & I = 1 μm. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2: Esquema de bloco de tecido incorporado, pino de amostra e preparação final. (A) O tecido deve ser colocado em uma orientação conhecida na ponta do molde de resina e o terço superior do molde preenchido com resina saturada preta de carbono. A região do molde mais distante do tecido deve permanecer clara para que o rótulo do experimento possa ser claramente visto. (B) A superfície do pino de amostra deve ser arranhada para produzir um padrão de grade, isso permite uma maior área de contato para que a cola cianoacrilato endureça entre o bloco de espécime preparado e o pino. (C) A resina saturada preta de carbono deve fazer uma ampla área de contato com a cabeça do pino da amostra, porém a região que é cortada pela faca de diamante não deve ser superior a 1x1 mm. É uma boa prática afunilar o bloco em direção à ponta. Isso minimiza as forças de corte na faca de diamante e, tendo uma base mais ampla, o bloco é mais resistente à separação do pino durante a secção. Clique aqui para ver uma versão maior desta figura.
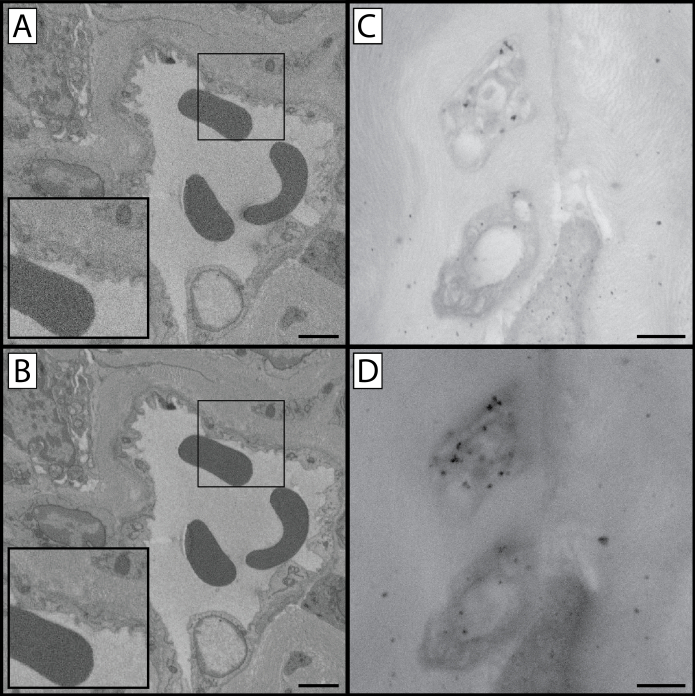
Figura 3: Comparação das configurações de captura de imagem. ( A &B) Painéis A e B comparam qualidade e resolução de imagem em função do tempo de moradia dos pixels. O painel A foi criado usando um tempo de moradia de 32 μs/pixel a 4 kV e sofre de uma diminuição da relação sinal/ruído, como é aparente no aparecimento "granulado" do início ampliado. O painel B foi criado usando um tempo de 100 μs/pixel de moradia a 4 kV. O aumento do tempo de consumo de pixels aumenta a relação sinal-ruído e revela um aumento do nível de detalhes celulares, porém o aumento do tempo de consumo de pixels tem o potencial de levar ao carregamento de tecido e/ou acúmulo de calor que suaviza o bloco e introduz artefatos de corte (conversa) ao se seccionar. Os painéis C e D comparam imagens capturadas em condições de exposição idênticas, mas com dois valores diferentes de kV de feixe. O tecido nesses painéis foi impregnado com partículas de nanogold em tons de ouro para tornar as diferenças nas profundidades de penetração de feixes mais aparentes. O painel C foi capturado a 9 kV enquanto o painel D foi capturado a 21 kV. O aumento do kV tem a vantagem do aumento do contraste(D),porém os detalhes são perdidos como resultado da coleta de elétrons de uma maior profundidade de tecido (C). Como resultado da amostragem de uma seção transversal maior, um número maior de partículas de imunogold específicas para gap 43 são visíveis, enquanto a rotulagem não específica permanece a mesma resultando em uma maior relação sinal-ruído. Painel A & B barra de escala = 2 μm. Painel C & D barra de escala = 1 μm. Clique aqui para ver uma versão maior desta figura.

Figura 4: Intensidade do feixe, kV e tamanho da mancha. (A) Ao entrar em contato com a amostra de tecido, o feixe de elétrons (azul claro) produz um volume de interação em forma de lágrima, a partir do qual diferentes formas de energia são produzidas a partir da interação entre elétrons de feixe e a amostra de tecido. A forma de lágrima é uma função da densidade tecidual e da coloração de metais pesados, juntamente com a energia do feixe, e o ângulo de inclinação do feixe deelétrons 43. Enquanto raios-x, elétrons auger e elétrons terciários são produzidos durante a imagem SBF-SEM, a preocupação primária é com elétrons backscattered (azul escuro) e secundário (verde)13. A imagem produzida com imagens SBF-SEM é produzida pela coleta de elétrons recattered. Esses elétrons se originam de interações elásticas entre o feixe e a amostra, e o sinal coletado é altamente dependente do número atômico de átomos interagidos - daí a necessidade de coloração de metais pesados44. Elétrons secundários originários de interações inelásticas entre o feixe e a amostra e detecção de seu sinal é altamente dependente da orientação superficial. Como o bloco-face é plano no SBF-SEM, os elétrons secundários não contribuem significativamente para o sinal coletado13. De fato, o acúmulo secundário de elétrons na superfície do bloco pode ser uma grande fonte de carregamento e tem um efeito deletério na qualidade da imagem2. (B) Este gráfico mostra a relação entre intensidade do feixe, kV do feixe e tamanho da mancha. O tamanho da mancha é a resolução espacial do feixe, e determina o limite de resolução das imagens que estão sendo produzidas. Baixar kV aumenta o tamanho da mancha, mas também diminui a profundidade de imagem permitindo uma melhor apreciação dos detalhes. Isso também tem o efeito de diminuir o sinal detectável. O aumento da intensidade do feixe oferece uma melhora inicial no tamanho do local e na detecção de sinais, mas aumenta rapidamente os níveis de carregamento de tecido. Em última análise, a intensidade do feixe e os valores de kV escolhidos são dependentes da amostra e melhor determinados empiricamente em relação à questão científica que está sendo feita. Clique aqui para ver uma versão maior desta figura.

Figura 5: Rede de feixe de microfibril livre de elastina na córnea do camundongo. Reconstrução 3D de microfibrilas (brancas) intimamente associadas com queratócitos (amarelo, laranja & verde) dentro do estroma córnea. As microfibrilas podem ser vistas adjacentes e, em alguns casos, dentro de sulcos rasos, ceratocitos de córnea (setas)(A). Esta rede de microfibrilas sem elastina está organizada em camadas distintas dentro do estroma córnea(B). Barra de escala = 2 μm. O bloco de imagem reconstruído é de 45x45 μm no eixo x & y, e 30 μm no eixo z com voxel uma resolução de 22x22x100 nm. Clique aqui para ver uma versão maior desta figura.

Figura 6: Reconstrução dos nervos da córnea que passam pela lamina basal na fronteira estromal-epitelial. Reconstrução 3D de um nervo penetrante (roxo) à medida que passa pela lamina basal (verde). Este nervo pode ser visto para bifurcar antes da penetração. Depois de penetrar no epitélio, ambos os ramos nervosos sofreram ramificação. Mitocôndrias (amarelas) são visíveis nas porções estrobomal e epitelial do feixe nervoso. Barra de escala = 2,5 μm. O bloco de imagem reconstruído é de 25x25 μm no eixo x & y, e 14 μm no eixo z com resolução voxel de 12x12x100 nm. Clique aqui para ver uma versão maior desta figura.

Figura 7: Vasculatura limbal e células associadas na córnea periférica do rato. Uma única imagem (A) de um bloco de imagem 3D (B) pode ser vista através da qual um vaso, feixe de nervos e células associadas viajam. O painel C mostra um vaso reconstruído (vermelho) com um pericíte associado (cinza) enrolado ao seu redor cobrindo as junções celulares endoteliais. Um feixe de nervo (azul) bifurca nas proximidades deste vaso enquanto ele viaja através do tecido. Um neutrófilo (amarelo) pode ser visto paralelo ao longo eixo do vaso, com seu núcleo polimórfico visível dentro de seu corpo celular e o uropod arrastado visível como uma saliência em direção à direita da imagem. Uma célula de mastro (magenta) é visível na parte inferior do vaso. O painel D isola esta célula de mastro, onde seus grânulos (verde) podem ser mais facilmente vistos sobrepondo o núcleo (roxo) dentro da célula. O Painel E destaca as estruturas celulares sobrepostas nas reconstruções celulares, com núcleos endoteliais denotados em azul, e micropartículas aderentes visíveis no lúmen vaso (laranja). As setas mostram bordas de células celulares entre células endoteliais, que podem ser vistas ainda mais como cumes elevados que se estendem ao longo das células no lado luminal da nave. Painel Uma barra de escala = 2 μm. O bloco de imagem usado para reconstruir essas células é de 30x30 μm no eixo x & y, e 42,5 μm no eixo z com resolução voxel de 14,6x14,6x100 nm. Clique aqui para ver uma versão maior desta figura.

Figura 8: Rede vascular reconstruída da camada de fibra nervosa de primata não-humana. (A) Uma imagem SBF-SEM de 200x200 μm da retina primata tirada em 8192x8192 px. O local amostrado é de ~500 mícrons da margem inferior da borda temporal de um olho saudável sem patologia. A série de imagens reconstruída nos painéis C & D foi capturada em 2048x2048 px, com imagens pausadas para que as regiões interessadas pudessem ser imagens em 8192x8192 px. O painel B é a região incrustado do painel A,extraído diretamente da imagem original. Note o grande número de axônios e suas mitocôndrias. (C) Seção ortoslice através de um volume de tecido 200x200x200 μm de uma camada de fibra nervosa temporal inferior do olho de controle, com vasculatura segmentada. (D) Projeção Z da vasculatura da camada de fibra nervosa. Esta série ilustra a resolução possível em um grande campo usando essa metodologia. Painel Uma barra de escala = 20 μm. Barra de escala do painel B = 2 μm. A resolução voxel da série de imagens é de 97.6x97.6x500 nm. A região de resolução de pixels de interesse é de 24,4x24,4 nm. Clique aqui para ver uma versão maior desta figura.
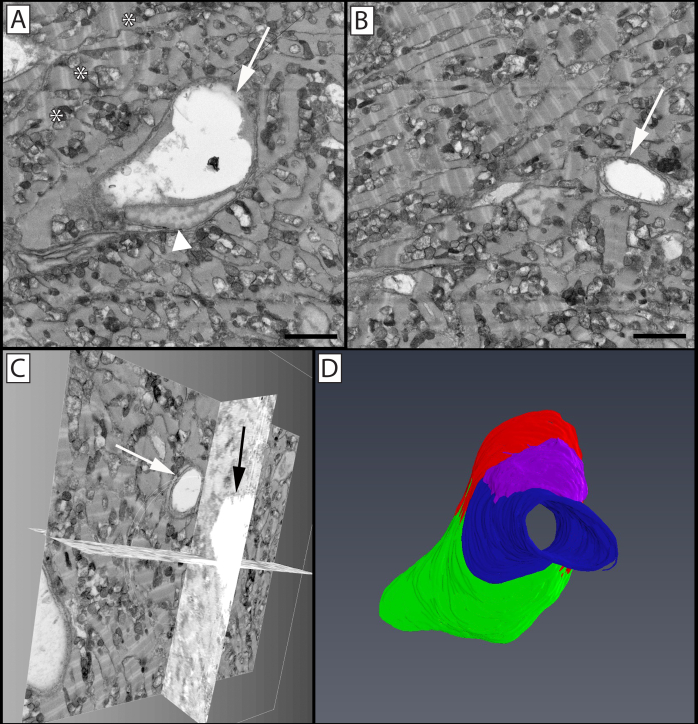
Figura 9: Segmentação e renderização de volume 3D de vasos no danio gigante (Devario malabaricus) coração compacto. (A) Micrografia bidimensional em uma pilha de imagens, mostrando o perfil de um vaso de tamanho venular central (seta) e um núcleo endotelial (ponta de flecha), com miócitos cardíacos circundantes ricos em mitocôndrias e sarcomeres bem organizados (*). (B) Micrografia bidimensional da pilha de imagens com um vaso de tamanho capilar (seta). (C) Projeções biorthogonais da pilha de micrografia mostrando o capilar no painel B projetado através de uma fatia ortogonal. (D) renderização 3D de células endoteliais segmentadas que revestem o vaso reconstruído. Ilustrados em verde, vermelho, azul e roxo são quatro células endoteliais separadas; a célula endotelial retratada em azul pode ser vista na seção transversal no painel B (seta), enquanto as células endoteliais retratadas em vermelho (seta) e verde (ponta de flecha) são vistas em seção cruzada no painel A. Painéis A & B barra de escala = 2 μm. O bloco de imagem reconstruído é de 30x30 μm no eixo x & y, e 16 μm no eixo z com resolução voxel de 14,6x14.6x100 nm. Clique aqui para ver uma versão maior desta figura.
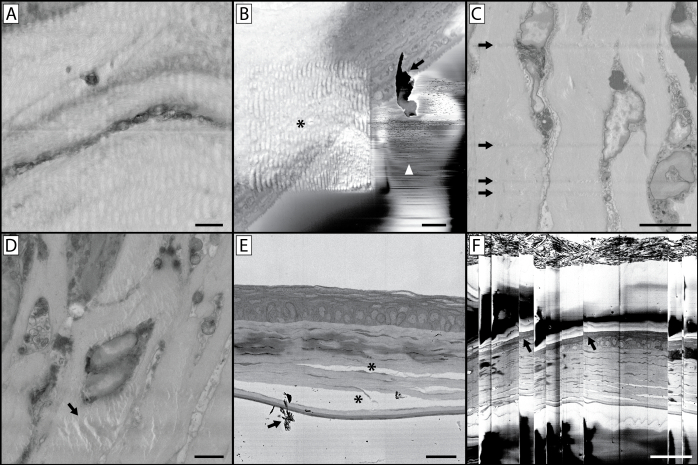
Figura 10: Complicações de imagem e artefatos. (A) A natureza ondulada e distorcida desta imagem é o resultado de imagens usando um tempo de moradia de pixels que é muito longo. Isso aquece o bloco de resina, deixando a face do bloco macia e emborrachada, o que resulta em uma imagem distorcida ao cortar. (B) Esta imagem contém uma série de artefatos. O asterisco indica uma distorção ondulada causada por imagens anteriores em uma ampliação mais alta e semelhante ao painel A,concentrando o feixe em uma região menor com um tempo de moradia de pixels mais longos suavizou a resina nesta região de interesse. Embora a imagem de ampliação mais alta coletada estivesse livre de artefatos, isso pode levar a uma série subsequente de imagens onde a amostra subjacente à região de interesse parece distorcida. Este painel também ilustra a questão do acúmulo de detritos na face do bloco (seta) durante a imagem, também denotada pela seta no painel E. Se isso se tornar um problema de imagem persistente, será necessário quebrar o vácuo, abrir a câmara e soprar detritos acumulados na faca de diamante e ao redor da amostra. Pequenas descargas de elétrons da face do bloco podem levar às rápidas mudanças de contraste e linhas denotadas pela ponta da seta branca. (C) Esta imagem ilustra arranhões de faca na face do bloco. Isso pode ocorrer devido a uma faca danificada, ou acúmulo de detritos na borda da faca. (D) O artefato denotado (seta) é um resultado do feixe de elétrons focado (sem secção) na face do bloco por um longo período de tempo com a amostra ainda na câmara de imagem. (E) A fixação inadequada do tecido pode levar à separação de estruturas celulares e tecido conjuntivo (*). (F) Se uma grande quantidade de carga ocorrer em seu tecido ou bloco de resina, pode ocorrer acúmulo e descarga subsequentes que leva à imagem "pulando" como é visto nesta imagem. Observe a distorção do tecido na imagem nesses pontos de salto (setas). Painel Uma barra de escala = 1 μm. Barra de escala do painel B = 2 μm. Barra de escala do painel C = 5 μm. Barra de escala do painel D = 2 μm. Barra de escala do painel E = 25 hum. Barra de escala do painel F = 50 hum. Clique aqui para ver uma versão maior desta figura.

Figura 11: Tecido de imagem a 3 kV usando vários tempos de moradia de pixels e intensidades de feixe. Todas as imagens foram coletados usando um feixe de 3 kV, a intensidade do feixe está em uma escala específica do dispositivo que varia de 1 a 20. A imagem de campo é do lúmen vascular contendo glóbulos brancos e vermelhos. Neste kV baixo é difícil apreciar detalhes celulares. O aumento do tempo de pixel teve pouco efeito. Aumentando a intensidade do feixe para 6 contraste de imagem melhorado. Clique aqui para ver uma versão maior desta figura.
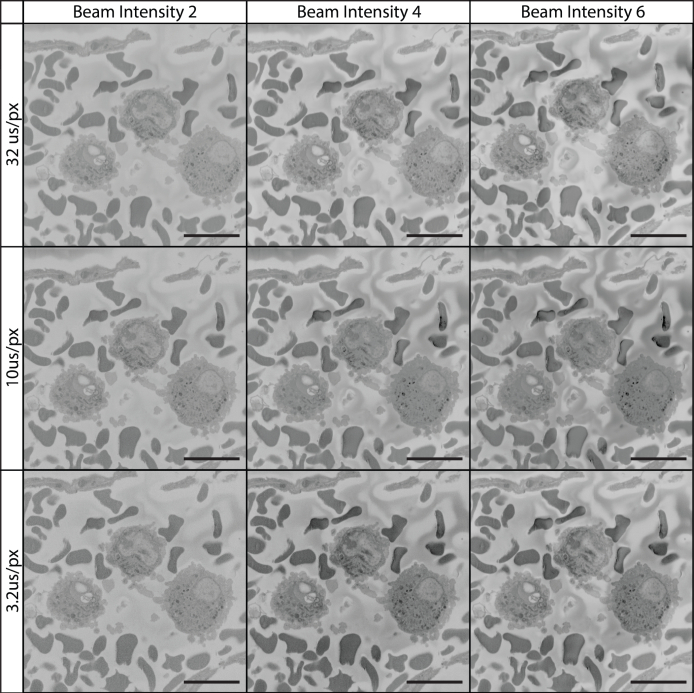
Figura 12: Tecido de imagem a 7 kV usando vários tempos de moradia de pixels e intensidades de feixe. Todas as imagens foram coletadas usando um feixe de 7 kV, a intensidade do feixe está em uma escala específica do dispositivo que varia de 1 a 20. A imagem de campo é do lúmen vascular contendo glóbulos brancos e vermelhos. A 7 kV, o aumento da intensidade do feixe e o tempo de moradia dos pixels contribuíram para uma imagem de maior qualidade. Clique aqui para ver uma versão maior desta figura.

Figura 13: Tecido de imagem a 12 kV usando vários tempos de moradia de pixels e intensidades de feixe. Todas as imagens foram coletadas usando um feixe de 12 kV, a intensidade do feixe está em uma escala específica do dispositivo que varia de 1 a 20. A imagem de campo é do lúmen vascular contendo glóbulos brancos e vermelhos. A 12 kV, a imagem é otimizada ajustando o tempo de moradia dos pixels e a intensidade do feixe. O carregamento é reduzido/ausente em tempos mais curtos de consumo de pixels, enquanto os detalhes celulares e o contraste de imagem são melhores com um tempo de consumo de pixels mais longo e maior intensidade do feixe. Clique aqui para ver uma versão maior desta figura.
Discussão
O objetivo deste artigo de métodos é destacar a metodologia de preparação e imagem de tecidos que permitiu ao nosso laboratório capturar de forma confiável imagens de microscopia eletrônica serial de alta resolução, e apontar passos críticos que levam a esse resultado, bem como potenciais armadilhas que podem ocorrer ao realizar imagens SBF-SEM. O sucesso com este protocolo requer fixação adequada do tecido, impregnação de metais pesados na amostra, modificações da resina de incorporação para reduzir o carregamento, bem como uma compreensão das configurações de microscópio e imagem usadas para coletar imagens. A máxima, "qualidade dentro, qualidade fora" é um axioma apropriado para imagens SBF-SEM. Como o objetivo da SBF-SEM muitas vezes é a apreciação ou quantificação de detalhes ultraestruturais, deve-se dar um cuidado extra à estratégia de fixação, a fim de garantir que a distorção tecidual não ocorra. Se o tecido ficar distorcido em qualquer momento na preparação das amostras (ou seja, sofrer inchaço, encolhimento ou interrupção da morfologia celular), então a reconstrução e a quantização de tecidos não produzirão dados precisos. Além disso, o uso de configurações de imagem incorretas pode levar à perda de dados que não podem ser recapturados, pois a imagem SBF-SEM é um processo destrutivo. Além disso, deve-se ter cuidado ao carregar uma amostra de tecido, pois a delicada faca de diamante pode ser danificada por preparação apressado ou incorreta da amostra. Isso pode resultar em chips ou quebras na faca, que podem deixar marcas de arranhões visíveis nas imagens(Figura 10C). A faca de diamante também pode ser danificada por estruturas calcificadas, grânulos duros ou vidro acidentalmente incorporado (por exemplo, de ampolas de reagente).
Enquanto a maioria da literatura SBF-SEM até o momento usa tensões de aceleração de feixe na faixa de 1 a 3 kV ao lado de pixels mais próximos de 1-5 μs/px (Figura 11)45,46,47,48,49, o protocolo atual utiliza tensões de aceleração de 7-12 kV e um tempo de moradia de pixels de 12 μs/px para imagem serial e 32 μs/px para regiões de imagem de interesse (Figuras 12 e 13). Essas configurações, juntamente com uma espessura de fatia de 100-200 nm permite imagens de alta qualidade e alta resolução de uma ampla gama de tecido biológico. O aumento da tensão de aceleração permite um aumento no contraste, resolução, bem como relação sinal-ruído. O aumento do tempo de moradia aumenta ainda mais a resolução e a relação sinal-ruído, enquanto o aumento da espessura da fatia leva à diminuição do carregamento na superfície do bloco durante a secção e combate danos induzidos pelo feixe em imagens subsequentes14. Embora este método de imagem possa diferir da convenção, as imagens e conjuntos de dados produzidos falam por si mesmos. Se tivéssemos que especular sobre a razão desse sucesso, é possível que ele seja o resultado de nossa combinação única de altos valores kV, tempos mais longos de moradia de pixels e preparação de blocos. O aumento da imagem kV resulta em um aumento do volume de interação entre o feixe de elétrons e a amostra. Este volume de interação é tanto mais profundo quanto mais amplo, resultando em um aumento teórico no número de elétrons detectados que se originam de mais profundo dentro do bloco amostral, ou de uma seção transversal mais ampla do tecido à medida que o tamanho da mancha aumenta o diâmetro. Como a SBF-SEM está interessada no detalhe superficial do bloco, isso resulta em uma diminuição teórica na relação sinal-ruído. No entanto, o aumento do kV também empurra os elétrons para a amostra onde eles são menos propensos a escapar do bloco e contribuir para os elétrons coletados pelo detector. Com o benefício adicional de um sinal aumentado através de tempos de moradia mais longos e maior intensidade do feixe, é possível que este método de imagem resulte em um maior aumento do sinal da superfície da amostra em relação ao ruído originário dentro do volume de interação. Além disso, o aumento da condutividade amostral introduzido com o preto carbono, bem como o revestimento de prata e ouro, ajuda a amenizar o acúmulo de carga que agora ocorre mais profundamente dentro do bloco e mais longe do bloco-face. realmente Figura 11, Figura 12, Figura 13 mostram que à medida que o kV é aumentado o carregamento de amostras começa a diminuir à medida que é potencialmente empurrado para dentro do bloco. Amostras imagens com baixa ampliação podem ser capturadas com contraste adequado usando as configurações convencionais, no entanto, muitas vezes essas imagens não possuem detalhes após uma inspeção minuciosa. Nossos dados mostram claramente que ao usar ampliação relativamente alta onde o objetivo é o detalhe celular, o aumento das configurações convencionais pode produzir resultados excepcionais. O artigo de 2020 de P. Goggin, et al fornece uma tabela útil delineando o efeito da mudança das configurações de imagem sobre a qualidade final da imagem, e é uma referência útil para consultar se a otimização do protocolo para novos tecidos se torna necessária14. A espessura da fatia de 100-200 nm recomendada neste protocolo tem o benefício adicional de permitir a coleta de grandes conjuntos de dados SBF-SEM a uma taxa rápida. Ao coletar imagens a 12μs/px, por exemplo, a imagem através de uma profundidade de 100 μm em 2048x2048 px requer ~14 horas durante a seção em 100nm/seção, mas exigiria ~56 horas se seccionada a 25nm/seção. Embora a resolução x,y permaneça inalterada como resultado da espessura da seção, não contabilizando a capacidade adicional de imagem usando valores kV mais altos e tempos de moradia de pixels que vêm com seções maiores, é importante notar que a resolução ao longo do eixo z sofre. A perda da resolução z é uma consideração importante e deve ser contemplada ao decidir como o tecido deve ser orientado no bloco de resina e em relação ao plano de imagem, e tem o potencial de impedir o estudo de características ou interações celulares menores (por exemplo, invaginações sinápticas ou características intracelulares na escala de dezenas de nanômetros). No entanto, além do rápido tempo de imagem, este protocolo tem benefícios adicionais adicionais, pois produz rapidamente conjuntos de dados ideais para análise stereológica, bem como o estudo de eventos biológicos raros ou células. A espessura maior da seção também pode auxiliar na reconstrução 3D manual, uma vez que uma região de 100 μm seccionada a 100 nm/seção exigiria segmentação manual de 1.000 imagens, enquanto a mesma região seccionada a 25 nm/seção exigiria segmentação manual de 4.000 imagens.
O SBF-SEM tem o benefício de gerar grandes conjuntos de dados em um período relativamente curto. Embora a análise de dados possa ser realizada usando métodos quantitativos, como estereologia, que serão discutidos abaixo, muitas vezes pode ser informativo criar reconstruções 3D através da segmentação de imagens. Uma pilha de imagens criada usando o SBF-SEM pode ser considerada como uma coleção de voxels, enquanto a segmentação é o processo de atribuir esses voxels a objetos definidos pelo usuário, criando representações 3D de estruturas teciduais. Essas reconstruções muitas vezes fornecem uma perspectiva até então invisível sobre a ultraestrutura tecidual e a interação célula-celular(Figura 5, Figura 6, Figura 7, Figura 8, Figura 9). Além disso, uma vez criadas reconstruções, é possível utilizar dados inerentes às reconstruções para extrair uma riqueza de informações de tecido segmentado. Parâmetros que variam de área de superfície, volume, comprimento e distância, bem como dados angulares estão prontamente disponíveis uma vez que uma reconstrução tenha sido criada50,51. Embora isso possa ser incrivelmente útil, especialmente quando emparelhado com vídeos e imagens extraídos de conjuntos de dados reconstruídos, o tempo necessário para a segmentação manual é uma consideração importante na tentativa de extrapolar dados dos conjuntos de dados SBF-SEM. Atualmente, existem uma série de softwares gratuitos e compráveis disponíveis para a segmentação manual e semi-manual das pilhas de imagens SBF-SEM. Uma opção gratuita para software de reconstrução é o pacote de processamento de imagens Fiji for ImageJ, um programa de processamento de imagens de código aberto, que contém um plugin de editor de segmentação que permite a segmentação manual52,53. Além disso, o software Reconstruct oferece uma opção alternativa de segmentação gratuita54 (Figura 8). Embora potencialmente caras, as opções compráveis geralmente contêm conjuntos de recursos mais robustos, como processos de segmentação semi-automatizados ou suítes de criação de filmes e imagens. Uma dessas opções foi utilizada para criar as reconstruções encontradas na Figura 5, Figura 6, Figura 7 e Figura 9 (Detalhes disponíveis na Tabela de Materiais). Além disso, estão disponíveis ferramentas para a criação, análise e renderização de reconstruções 3D baseadas em contraste usando realidade virtual com potencial para acelerar muito o processo de reconstrução20,55. Embora nem sempre esteja disponível para todos os aplicativos, uma série de ferramentas de software estão disponíveis para segmentação manual assistida por computador que têm o potencial de diminuir consideravelmente o tempo necessário para a segmentação56,57,58. Independentemente do software utilizado, premeditação considerável e uma compreensão da pergunta que está sendo respondida, ou lacuna de conhecimento a ser preenchida, por reconstruções seriais devem preceder a segmentação, uma vez que o processo é trabalhoso e demorado.
A produção de reconstruções 3D vem com suas próprias considerações. Com conjuntos de dados maiores, o poder de processamento pode ser um fator limitante e, portanto, otimizar o uso dos recursos do sistema pode ser fundamental para manter um fluxo de trabalho produtivo e acelerar o processo de reconstrução e renderização. Ao renderizar uma reconstrução 3D, a maioria dos softwares converte pilhas de imagens segmentadas em uma superfície composta de triângulos interconectados. Se um projeto de reconstrução for grande ou intrincado, a renderização desses triângulos pode exigir uma grande quantidade de poder computacional. Ao trabalhar em uma reconstrução 3D, pode ser útil limitar o número de triângulos que o software de reconstrução pode usar para converter as imagens segmentadas em superfícies reconstruídas. Isso pode ser útil para monitorar o progresso de uma reconstrução 3D durante o processo de segmentação. Uma vez que a segmentação esteja completa, o limite do triângulo pode ser removido antes de renderizar imagens ou vídeos de reconstruções. Alternativamente, e se o software de reconstrução permitir isso, encontramos sucesso monitorando o progresso de uma reconstrução usando renderização de volume em vez de geração de superfície. A renderização de volume, embora não seja tão adequada para imagens ou vídeos destinados à publicação ou apresentação, requer muito menos poder de processamento e, como tal, pode ser útil para proporcionar uma experiência suave ao reconstruir e preparar imagens e vídeos de reconstruções. Além disso, é a melhor prática ao segmentar manualmente um conjunto de dados SBF-SEM para definir cada objeto a ser reconstruído com seu próprio identificador exclusivo. Se um campo de células epiteliais está sendo reconstruído, por exemplo, em vez de atribuir todas as células epiteliais a um grupo voxel intitulado "epitélio", cada célula epitelial deve ser atribuída ao seu próprio apelido (ou seja, Epi1, Epi2, Epi3, etc.). Isso proporciona maior liberdade quando a reconstrução é concluída, pois cada célula pode ser incluída ou excluída da renderização final, atribuída cores ou transparências diferentes, ou removida ou introduzida individualmente se um vídeo estiver sendo produzido. Além disso, isso permite que métricas como área de superfície ou volume sejam coletadas de cada objeto reconstruído em vez do grupo de objetos como um todo.
Outra ferramenta incrivelmente poderosa para extrair dados quantitativos de pilhas de imagens SBF-SEM é a prática de estereologia. A estereologia aproveita as relações matemáticas inerentes entre objetos tridimensionais e suas representações bidimensionais (ou seja, micrografos eletrônicos). Os conjuntos de dados SBF-SEM são ideais para a aplicação de estereologia, pois este método para extrair informações 3D de grandes conjuntos de dados é consideravelmente menos tempo e trabalhoso quando comparado à reconstrução segmentada. A estereologia geralmente consiste na aplicação de grades geométricas em imagens aleatórias e uniformemente amostradas e tem sido usada extensivamente ao longo dos últimos 50 anos para produzir estimativas precisas e imparciales do número de célula/organela, comprimento, área de superfície e volume21,59,60,61,62,63. Embora as reconstruções 3D possam ser impressionantes e fornecer uma nova perspectiva sobre tecidos biológicos, muitas vezes é mais rápida, mais precisa, reproduzível e propícia para grandes tamanhos de amostra para usar uma abordagem esterológica para extração de dados. Embora existam muitos artigos que discutem a aplicação prática da estereologia64,65,66, uma série de livros didáticos fornecem visões gerais úteis e aprofundadas da metodologia, bem como fornecem uma série de grades esterológicas que podem ser aplicadas ao estudo da ultraestrutura tecidual67,68,69.
SBF-SEM é um poderoso método de imagem que permite a apreciação tridimensional da ultraestrutura tecidual. Embora a capacidade de criar conjuntos de dados 3D com resolução SEM coloque perguntas anteriormente irrespondíveis ao nosso alcance, a preparação adequada do tecido e a compreensão da imagem SBF-SEM são primordiais para o sucesso de estudos que utilizam esse método de microscopia. Esperamos que a aplicação deste protocolo a estudos futuros leve a uma visão cada vez maior dos mistérios biológicos que nos cercam, e continuem nos empurrando ainda mais para as fronteiras do conhecimento humano.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Gostaríamos de agradecer ao Dr. Sam Hanlon, Evelyn Brown e Margaret Gondo por sua excelente assistência técnica. Esta pesquisa foi apoiada em parte pelos Institutos Nacionais de Saúde (NIH) R01 EY-018239 e P30 EY007551 (National Eye Institute), em parte pela Lion's Foundation for Sight, e em parte pelo NIH 1R15 HD084262-01 (Instituto Nacional de Saúde Infantil & Desenvolvimento Humano).
Materiais
| Name | Company | Catalog Number | Comments |
| 1/16 x 3/8 Aluminum Rivets | Industrial Rivet & Fastener Co. | 6N37RFLAP/1100 | Used as specimen pins. |
| 2.5mm Flathead Screwdriver | Wiha Quality Tools | 27225 | |
| Acetone | Electron Microscopy Sciences | RT 10000 | Used to dilute silver paint. |
| Aspartic Acid | Sigma-Aldrich | A8949 | |
| Calcium Chloride | FisherScientific | C79-500 | |
| Conductive Silver Paint | Ted Pella | 16062 | |
| Denton Desk-II Vacuum Sputtering Device equipped with standard gold foil target | Denton Vacuum | N/A | This is the gold-sputtering device used by the authors, alternates are acceptable. |
| Double-edged Razors | Fisher Scientific | 50-949-411 | |
| Embed 812 | Electron Microscopy Sciences | 14120 | |
| Gatan 3View2 mounted in a Tescan Mira3 Field emission SEM | Gatan & Tescan | N/A | This is the SBF-SEM device used by the authors, alternates are acceptable. |
| Glass Shell Vials, 0.5 DRAM (1.8 ml) | Electron Microscopy Sciences | 72630-05 | |
| Gluteraldehyde | Electron Microscopy Sciences | 16320 | |
| Gorilla Super Glue - Impact Tough | NA | NA | Refered to as cyanoacrylate glue in text. |
| Ketjen Black | HM Royal | EC-600JD | Refered to as carbon black in text. |
| KOH | FisherScientific | 18-605-593 | |
| Lead Nitrate | Fisher Scientific | L62-100 | |
| Microwave | Pelco | BioWave Pro | This is the microwave used by the authors, alternates are acceptable. |
| Osmium Tetroxide | Sigma-Aldrich | 201030 | |
| Potassium Ferrocyanide | Sigma-Aldrich | P9387 | |
| Silicone Embedding Mold | Ted Pella | 10504 | |
| Sodium Cacodylate Trihydrate | Electron Microscopy Sciences | 12300 | |
| Samco Transfer Pipette | ThermoFisher Scientific | 202 | Used to make specimen pin storage tubes. |
| Swiss Pattern Needle Files | Electron Microscopy Sciences | 62115 | |
| Thiocarbohydrazide | Sigma-Aldrich | 223220 | |
| Uranyl Acetate | Polysciences, Inc. | 21447-25 | |
| Reconstruction Software | |||
| Amira Software | Thermo Scientific | N/A | Used to create the reconstructions found in figures 5-7 and 9. |
| Fiji (Fiji is Just ImageJ) | ImageJ.net | N/A | TrakEM2 can be added to Fiji to asist in manual segmentation. |
| Microscopy Image Browser (MIB) | University of Helsinki, Institute of Biotechnology | N/A | |
| Reconstuct Software | Neural Systems Lab | N/A | |
| SuRVoS Workbench | Diamond Light Source & The University of Nottingham | N/A | |
| SyGlass | IstoVisio, Inc. | N/A | Allows for reconstruction in virtual reality and histogram-based reconstruction methods. |
Referências
- Leighton, S. B. SEM images of block faces, cut by a miniature microtome within the SEM - a technical note. Scanning Electron Microscopy. , Pt 2 73-76 (1981).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three-dimensional tissue nanostructure. PLOS Biology. 2 (11), 329(2004).
- He, Q., Hsueh, M., Zhang, G., Joy, D. C., Leapman, R. D. Biological serial block face scanning electron microscopy at improved z-resolution based on Monte Carlo model. Scientific Reports. 8 (1), 12985(2018).
- Zankel, A., Wagner, J., Poelt, P. Serial sectioning methods for 3D investigations in materials science. Micron. 62, 66-78 (2014).
- Titze, B., Genoud, C. Volume scanning electron microscopy for imaging biological ultrastructure. Biology of the Cell. 108 (11), 307-323 (2016).
- Ohta, K., et al. Beam deceleration for block-face scanning electron microscopy of embedded biological tissue. Micron. 43 (5), 612-620 (2012).
- Bouwer, J. C., et al. Deceleration of probe beam by stage bias potential improves resolution of serial block-face scanning electron microscopic images. Advanced Structural and Chemical Imaging. 2 (1), 11(2017).
- Kizilyaprak, C., Longo, G., Daraspe, J., Humbel, B. M. Investigation of resins suitable for the preparation of biological sample for 3-D electron microscopy. Journal of Structural Biology. 189 (2), 135-146 (2015).
- Kittelmann, M., Hawes, C., Hughes, L. Serial block face scanning electron microscopy and the reconstruction of plant cell membrane systems. Journal of Microscopy. 263 (2), 200-211 (2016).
- Biazik, J., Vihinen, H., Anwar, T., Jokitalo, E., Eskelinen, E. L. The versatile electron microscope: an ultrastructural overview of autophagy. Methods. 75, 44-53 (2015).
- Peddie, C. J., Collinson, L. M. Exploring the third dimension: Volume electron microscopy comes of age. Micron. 61, 9-19 (2014).
- Piňos, J., Mikmeková, Š, Frank, L. About the information depth of backscattered electron imaging. Journal of Microscopy. 266 (3), 335-342 (2017).
- Smith, D., Starborg, T. Serial block face scanning electron microscopy in cell biology: Applications and technology. Tissue Cell. 57, 111-122 (2019).
- Goggin, P., et al. Development of protocols for the first serial block-face scanning electron microscopy (SBF SEM) studies of bone tissue. Bone. 131, 115107(2020).
- Deerinck, T. J., et al. High-performance serial block-face SEM of nonconductive biological samples enabled by focal gas injection-based charge compensation. Journal of Microscopy. 270 (2), 142-149 (2018).
- Nguyen, H. B., et al. Conductive resins improve charging and resolution of acquired images in electron microscopic volume imaging. Scientific Reports. 6, 23721(2016).
- Deerinck, T. J., Bushong, E. A., Thor, A., Ellisman, M. H. NCMIR methods for 3D EM: a new protocol for preparation of biological specimens for serial block face scanning electron microscopy. National Center for Microscopy and Imaging Research. 6 (8), (2010).
- Deerinck, T. J., et al. Enhancing Serial Block-Face Scanning Electron Microscopy to Enable High Resolution 3-D Nanohistology of Cells and Tissues. Microscopy and Microanalysis. 16, 1138-1139 (2010).
- Kubota, Y. New developments in electron microscopy for serial image acquisition of neuronal profiles. Microscopy (Oxf). 64 (1), 27-36 (2015).
- Courson, J. A., et al. Serial block-face scanning electron microscopy: A provocative technique to define 3-dimensional ultrastructure of microvascular thrombosis. Thrombosis Research. 196, 519-522 (2020).
- Courson, J. A., et al. Serial block-face scanning electron microscopy reveals neuronal-epithelial cell fusion in the mouse cornea. PLoS One. 14 (11), 0224434(2019).
- Lafontant, P. J., et al. Cardiac Myocyte Diversity and a Fibroblast Network in the Junctional Region of the Zebrafish Heart Revealed by Transmission and Serial Block-Face Scanning Electron Microscopy. PLoS One. 8 (8), 72388(2013).
- Hanlon, S. D., Behzad, A. R., Sakai, L. Y., Burns, A. R. Corneal stroma microfibrils. Experimental Eye Research. 132, 198-207 (2015).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- Davenport, A. T., Grant, K. A., Szeliga, K. T., Friedman, D. P., Daunais, J. B. Standardized method for the harvest of nonhuman primate tissue optimized for multiple modes of analyses. Cell Tissue Bank. 15 (1), 99-110 (2014).
- Schuster, A., et al. An isolated perfused pig heart model for the development, validation and translation of novel cardiovascular magnetic resonance techniques. Journal of Cardiovascular Magnetic Resonance. 12 (1), 53(2010).
- Hanlon, S. D., Patel, N. B., Burns, A. R. Assessment of postnatal corneal development in the C57BL/6 mouse using spectral domain optical coherence tomography and microwave-assisted histology. Experimental Eye Research. 93 (4), 363-370 (2011).
- Longiéras, N., Sebban, M., Palmas, P., Rivaton, A., Gardette, J. L. Multiscale approach to investigate the radiochemical degradation of epoxy resins under high-energy electron-beam irradiation. Journal of Polymer Science Part A: Polymer Chemistry. 44 (2), 865-887 (2006).
- Hashimoto, T., Thompson, G. E., Zhou, X., Withers, P. J. 3D imaging by serial block face scanning electron microscopy for materials science using ultramicrotomy. Ultramicroscopy. 163, 6-18 (2016).
- Rouquette, J., et al. Revealing the high-resolution three-dimensional network of chromatin and interchromatin space: A novel electron-microscopic approach to reconstructing nuclear architecture. Chromosome Research. 17 (6), 801(2009).
- Briggman, K. L., Helmstaedter, M., Denk, W. Wiring specificity in the direction-selectivity circuit of the retina. Nature. 471 (7337), 183-188 (2011).
- Katoh, K. Microwave-Assisted Tissue Preparation for Rapid Fixation, Decalcification, Antigen Retrieval, Cryosectioning, and Immunostaining. International Journal of Biochemistry & Cell Biology. 2016, 7076910(2016).
- Login, G. R., Dvorak, A. M. A review of rapid microwave fixation technology: its expanding niche in morphologic studies. Scanning. 15 (2), 58-66 (1993).
- Jamur, M. C., Faraco, C. D., Lunardi, L. O., Siraganian, R. P., Oliver, C. Microwave fixation improves antigenicity of glutaraldehyde-sensitive antigens while preserving ultrastructural detail. Journal of Histochemistry and Cytochemistry. 43 (3), 307-311 (1995).
- Leong, A. S., Sormunen, R. T. Microwave procedures for electron microscopy and resin-embedded sections. Micron. 29 (5), 397-409 (1998).
- Willingham, M. C., Rutherford, A. V. The use of osmium-thiocarbohydrazide-osmium (OTO) and ferrocyanide-reduced osmium methods to enhance membrane contrast and preservation in cultured cells. Journal of Histochemistry and Cytochemistry. 32 (4), 455-460 (1984).
- Khan, A. A., Riemersma, J. C., Booij, H. L. The reactions of osmium tetroxide with lipids and other compounds. Journal of Histochemistry and Cytochemistry. 9, 560-563 (1961).
- Belazi, D., Solé-Domènech, S., Johansson, B., Schalling, M., Sjövall, P. Chemical analysis of osmium tetroxide staining in adipose tissue using imaging ToF-SIMS. Histochemistry and Cell Biology. 132 (1), 105-115 (2009).
- Rivlin, P. K., Raymond, P. A. Use of osmium tetroxide-potassium ferricyanide in reconstructing cells from serial ultrathin sections. Journal of Neuroscience Methods. 20 (1), 23-33 (1987).
- Aguas, A. P. The use of osmium tetroxide-potassium ferrocyanide as an extracellular tracer in electron microscopy. Stain Technology. 57 (2), 69-73 (1982).
- Seligman, A. M., Wasserkrug, H. L., Hanker, J. S. A new staining method (OTO) for enhancing contrast of lipid--containing membranes and droplets in osmium tetroxide--fixed tissue with osmiophilic thiocarbohydrazide(TCH). Journal of Cell Biology. 30 (2), 424-432 (1966).
- Watson, M. L. Staining of tissue sections for electron microscopy with heavy metals. II. Application of solutions containing lead and barium. Journal of Biophysical and Biochemical Cytology. 4 (6), 727-730 (1958).
- Zhou, W., Apkarian, R., Wang, Z., Joy, D. Fundamentals of Scanning Electron Microscopy. Scanning Microscopy in Nanotechnology. , 1-40 (2006).
- Tapia, J. C., et al. High-contrast en bloc staining of neuronal tissue for field emission scanning electron microscopy. Nature Protocols. 7 (2), 193-206 (2012).
- Buchacker, T., et al. Assessment of the Alveolar Capillary Network in the Postnatal Mouse Lung in 3D Using Serial Block-Face Scanning Electron Microscopy. Frontiers in Physiology. 10, 1357(2019).
- Keeling, E., et al. 3D-Reconstructed Retinal Pigment Epithelial Cells Provide Insights into the Anatomy of the Outer Retina. International Journal of Molecular Sciences. 21 (21), (2020).
- Shang, P., et al. Chronic Alcohol Exposure Induces Aberrant Mitochondrial Morphology and Inhibits Respiratory Capacity in the Medial Prefrontal Cortex of Mice. Frontiers in Neuroscience. 14, 561173(2020).
- Pfeifer, C. R., et al. Quantitative analysis of mouse pancreatic islet architecture by serial block-face SEM. Journal of Structural Biology. 189 (1), 44-52 (2015).
- Wilke, S. A., et al. Deconstructing complexity: serial block-face electron microscopic analysis of the hippocampal mossy fiber synapse. Journal of Neuroscience. 33 (2), 507-522 (2013).
- Cocks, E., Taggart, M., Rind, F. C., White, K. A guide to analysis and reconstruction of serial block face scanning electron microscopy data. Journal of Microscopy. 270 (2), 217-234 (2018).
- Borrett, S., Hughes, L. Reporting methods for processing and analysis of data from serial block face scanning electron microscopy. Journal of Microscopy. 263 (1), 3-9 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529(2017).
- Fiala, J. C. Reconstruct: a free editor for serial section microscopy. Journal of Microscopy. 218, Pt 1 52-61 (2005).
- Pidhorskyi, S., Morehead, M., Jones, Q., Spirou, G., Doretto, G. syGlass: interactive exploration of multidimensional images using virtual reality Head-mounted displays. arXiv . , arXiv:1804.08197 (2018).
- Cardona, A., et al. TrakEM2 software for neural circuit reconstruction. PLoS One. 7 (6), 38011(2012).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy Image Browser: A Platform for Segmentation and Analysis of Multidimensional Datasets. PLOS Biology. 14 (1), 1002340(2016).
- Luengo, I., et al. SuRVoS: Super-Region Volume Segmentation workbench. Journal of Structural Biology. 198 (1), 43-53 (2017).
- Anderson, H. R., Stitt, A. W., Gardiner, T. A., Archer, D. B. Estimation of the surface area and volume of the retinal capillary basement membrane using the stereologic method of vertical sections. Analytical & Quantitative Cytology & Histology. 16 (4), 253-260 (1994).
- Gibbons, C. H., Illigens, B. M., Wang, N., Freeman, R. Quantification of sweat gland innervation: a clinical-pathologic correlation. Neurology. 72 (17), 1479-1486 (2009).
- Knust, J., Ochs, M., Gundersen, H. J., Nyengaard, J. R. Stereological estimates of alveolar number and size and capillary length and surface area in mice lungs. Anat Rec. 292 (1), Hoboken. 113-122 (2009).
- Mahon, G. J., et al. Chloroquine causes lysosomal dysfunction in neural retina and RPE: implications for retinopathy. Current Eye Research. 28 (4), 277-284 (2004).
- Michel, R. P., Cruz-Orive, L. M. Application of the Cavalieri principle and vertical sections method to lung: estimation of volume and pleural surface area. Journal of Microscopy. 150, Pt 2 117-136 (1988).
- Weibel, E. R. Stereological methods in cell biology: where are we--where are we going. Journal of Histochemistry and Cytochemistry. 29 (9), 1043-1052 (1981).
- Schmitz, C., Hof, P. R. Design-based stereology in neuroscience. Neuroscience. 130 (4), 813-831 (2005).
- Kristiansen, S. L., Nyengaard, J. R. Digital stereology in neuropathology. Apmis. 120 (4), 327-340 (2012).
- Howard, C. V., Reed, M. G. Unbiased Stereology. 2nd edn. , Garland Science/BIOS Scientific Publishers. (2005).
- Reith, A., Mayhew, T. M. Stereology and Morphometry in Electron Microscopy: Problems and Solutions. , Hemisphere Publishing Corporation. (1988).
- Mouton, P. R. Principles and practices of unbiased stereology: an introduction for bioscientists. , Johns Hopkins University Press. (2002).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados