Method Article
생물학적 조직 샘플의 직렬 블록-얼굴 스캐닝 전자 현미경 검사(SBF-SEM)
요약
이 프로토콜은 강력한 3D 이미징 기술인 직렬 블록-페이스 스캐닝 전자 현미경 검사(SBF-SEM)를 사용하는 일상적인 방법을 간략하게 설명합니다. SBF-SEM의 성공적인 적용은 적절한 고정 및 조직 염색 기술뿐만 아니라 이미징 설정을 신중하게 고려합니다. 이 프로토콜에는 이 프로세스 전체에 대한 실용적인 고려 사항이 포함되어 있습니다.
초록
직렬 블록-얼굴 스캐닝 전자 현미경 검사(SBF-SEM)는 수백~수천 개의 연속 등록 초구조 이미지를 수집하여 조직 미세 해부학의 전례 없는 3차원 뷰를 제공합니다. SBF-SEM은 최근 몇 년 동안 사용이 기하급수적으로 증가하는 반면, 적절한 조직 준비 및 이미징 매개 변수와 같은 기술적 측면은 이 이미징 양식의 성공을 위해 가장 중요합니다. 이 이미징 시스템은 장치의 자동화된 특성의 이점을 통해 이미징 프로세스 중에 현미경을 방치하고 하루에 수백 개의 이미지를 자동화하여 수집할 수 있습니다. 그러나, 적절 한 조직 준비 없이 세포 울트라 구조 잘못 되 거나 오해의 소지가 결론 그려질 수 있습니다 같은 방식으로 변경할 수 있습니다. 또한 수지 임베디드 생물학적 샘플의 블록 페이스를 스캔하여 이미지가 생성되며, 이는 종종 해결해야 할 과제와 고려 사항을 제시합니다. "조직 충전"으로 알려진 이미징 중 블록 내의 전자가 축적되면 대비가 상실되고 세포 구조를 감상할 수 없습니다. 더욱이, 전자 빔 강도/전압을 증가하거나 빔 스캐닝 속도가 감소하면 이미지 해상도를 높일 수 있지만, 이는 또한 수지 블록을 손상시키고 이미징 시리즈에서 후속 이미지를 왜곡하는 불행한 부작용을 가질 수 있다. 여기서 우리는 세포 초구조를 보존하고 조직 충전을 감소시키는 생물학적 조직 샘플의 준비를 위한 일상적인 프로토콜을 제시합니다. 또한 티슈 블록에 최소한의 손상을 입히면서 고품질 의 시리얼 이미지를 빠르게 획득하기 위한 이미징 고려 사항을 제공합니다.
서문
직렬 블록 얼굴 스캐닝 전자 현미경 검사 (SBF-SEM)는 1981 년 레이튼에 의해 처음 설명되었으며 수지에 내장 된 조직의 얇은 섹션을 절단하고 이미지 할 수있는 내장 된 마이크로 토메로 보강 된 스캐닝 전자 현미경을 만들었습니다. 불행하게도, 기술적 제한은 생물학적 조직과 같은 비전도성 샘플이 허용 할 수없는 수준의 충전 (조직 샘플 내의 전자 축적)을 축적함에 따라 전도성 샘플에 의한 사용을제한하였다. 증발된 탄소 감소 조직 충전으로 컷 사이에 블록 페이스를 코팅하는 동안, 이 크게 증가된 이미징 수집 시간과 이미지 저장은 당시 컴퓨터 기술이 장치에 의해 생성된 큰 파일 크기를 관리하기에 충분하지 못했기 때문에 문제가 남아 있었다. 이 방법론은 2004년 덴크와 호르스트만이 가변 압력 챔버2를장착한 SBF-SEM을 사용하여 재검토되었다. 이를 통해 시료 내의 충전을 줄이는 이미징 챔버에 수증기를 도입하여 이미지 해상도의 손실에도 불구하고 비전도성 시료의 이미징을 실현할 수 있었습니다. 조직 제제 및 이미징 방법의 추가 개선은 이제 높은 진공을 사용하여 이미징을 허용하고, SBF-SEM 이미징은 더 이상 충전3,4,5,6,7,8,9를방출하기 위해 수증기에 의존하지 않는다. SBF-SEM은 최근 몇 년 동안 사용이 기하급수적으로 증가하는 반면, 적절한 조직 준비 및 이미징 매개 변수와 같은 기술적 측면은 이 이미징 양식의 성공을 위해 가장 중요합니다.
SBF-SEM은 3-5 nm10,11의작은 평면 해상도로 수천 개의 연속 등록 전자 현미경 이미지의 자동화 된 컬렉션을 허용합니다. 중금속으로 함침되고 수지에 내장된 조직은 다이아몬드 나이프가 장착된 초미세토메를 함유한 주사 전자 현미경(SEM) 내에 배치됩니다. 평평한 표면은 다이아몬드 칼로 절단되고, 칼은 후퇴하고, 블록의 표면은 조직 울트라 구조의 이미지를 만들기 위해 전자 빔이있는 래스터 패턴으로 스캔됩니다. 그런 다음 블록은 z축에서 지정된 양(예: 100 nm)을 제기하고"z-step"이라고 하며 프로세스가 반복되기 전에 새 표면이 절단됩니다. 이러한 방식으로 조직의 절단으로 3차원(3D) 이미지 블록이 생성된다. 이 이미징 시스템은 장치의 자동화된 특성으로부터 더 많은 이점을 누릴 수 있으므로 이미징 프로세스 중에 현미경을 방치하고 하루 만에 수백 개의 이미지를 자동화하여 수집할 수 있습니다.
SBF-SEM 이미징은 주로 백산전자를 사용하여 블록 페이스의 이미지를 형성하지만, 이차 전자는 이미징프로세스(12)중에 생성된다. 이차 전자는 블록을 탈출하지 않는 백산및 1차 빔 전자와 함께 축적될 수 있으며 블록 페이스에서 국소화된 정전기장으로 이어질 수 있는 "조직 충전"을 생성할 수 있습니다. 이러한 전자 축적은 영상을 왜곡하거나 전자가 블록으로부터 배출되는 원인이 되며 백스캐터 검출기에 의해 수집된 신호에 기여하여 신호 대 잡음비(13)를감소시킬 수 있다. 조직 충전의 수준은 전자 빔 전압 또는 강도를 감소시켜 감소 할 수 있지만, 빔 거주 시간을 감소, 이 감소 신호 대 잡음 비율(14)발생. 저전압 또는 강도의 전자 빔이 사용되거나, 빔이 짧은 시간 동안 각 픽셀 공간 내에만 거주할 수 있는 경우, 백산전자가 조직에서 배출되어 전자 검출기에 의해 포획되어 신호가 약해진다. 덴크와 호르스트만은 챔버에 수증기를 도입하여 이 문제를 처리하여 심실과 블록 페이스의 전하를 이미지 해상도로 줄였습니다. 10-100 Pa의 챔버 압력으로, 전자 빔의 일부가 이미지 잡음 및 해상도 의 손실에 기여하는 산란되지만, 이것은 또한 샘플 블록2내의 전하를 중화시 챔버에서 이온을 생성한다. 시료 블록 내에서 전하를 중화하는 방법은 이미징 중에 블록 페이스에 질소의 초점 가스 주입을 사용하거나, SBF-SEM 단계에 음수 전압을 도입하여 프로브 빔-라딩 에너지를 감소시키고 수집된 신호수집 6,7,15를증가시킵니다. 블록 표면에 전하 축적을 감소시키기 위해 단계 바이어스, 챔버 압력 또는 국소화질소 주입을 도입하는 대신, 수지 믹스에 탄소를 도입하여 수지의 전도도를 높일 수 있어 더욱 공격적인 이미징설정(16)이가능하다. 다음 일반적인 프로토콜은 2010년에 발표된 Deerinck 외 프로토콜의 적응이며, 고해상도 이미지 수집3,17,18,19를 유지하면서 조직 충전을 최소화하는 데 유용하다고 판단한 조직 제제 및 이미징 방법론에 대한수정을다룹니다. 이전에 언급된 프로토콜은 조직 처리 및 중금속 함침에 초점을 맞추고 있지만, 이 프로토콜은 SBF-SEM 연구에 내재된 이미징, 데이터 분석 및 재구성 워크플로우에 대한 통찰력을 제공합니다. 우리의 실험실에서, 이 프로토콜은 성공적으로 및 각막 및 전방 세그먼트 구조를 포함하여 조직의 다양한에 성공적으로 재현적으로 적용되었습니다, 눈꺼풀, 홍엽 및 하심자 동맥, 망막 및 시신경, 심장, 폐 및 기도, 신장, 간, 크레마스터 근육, 대뇌 피질/수질, 마우스, 쥐, 토끼, 기니 피그, 물고기, 단층 및 계층화된 세포 배양, 돼지, 비인간 영장류, 인간20,21,23,23. 사소한 변화는 특정 조직 및 응용 프로그램에 가치가있을 수 있지만,이 일반적인 프로토콜은 우리의 핵심 이미징 시설의 맥락에서 매우 재현하고 유용 입증했다.
프로토콜
모든 동물은 비전과 안과 연구에서 동물의 사용을위한 비전 및 안과 성명서와 휴스턴 대학 의 안과 동물 취급 지침에 따라 연구 협회에 설명 된 지침에 따라 처리되었습니다. 모든 동물 절차는 처리된 기관에 의해 승인되었습니다: 마우스, 쥐, 토끼, 기니 피그 및 비인간 영장류 절차는 휴스턴 동물 관리 및 사용 위원회의 대학에 의해 승인되었습니다, 제브라피시 절차는 DePauw 대학 동물 관리 및 사용 위원회에 의해 승인되고, 돼지 절차는 의학 동물 관리 및 사용위원회의 베일러 대학에 의해 승인되었습니다. 모든 인간 조직은 인간 조직에 대한 연구에 관한 헬싱키 선언에 따라 처리되었으며 적절한 제도적 검토 보드 승인을 획득하였다.
1. 조직 처리
- ddH2O.에 나트륨 코코디레이트 분말을 혼합하여 0.4M 나트륨 코코디레이트 버퍼의 스톡 용액을 준비하였으며, pH는 용액을 7.3으로 조절한다. 이 버퍼는 고정(1.3단계에서 아래에 설명된 조성), 세척 완충제, 오스뮴 및 페로시아니드 용액을 만드는 데 사용됩니다.
참고: 관류 고정은 종종 SBF-SEM 연구에 대 한 고정의 가장 좋은 방법, 고정 신속 하 게 발생 하 고 몸 전체에. 학습 설계 내에서 관류 고정이 불가능한 경우 1.3단계로 건너뜁니다. - 동물모델(24,25,26)에적합한 생리적 압력으로 관류 고정을 수행한다. 이는 경전 순차적 관류를 통해 처리된 식염수, 각각 유기체(예를 들어, 100cm) 위에 배치된 특정 높이(예: 동물 모델의 혈관 시스템의 생리적 압력에 적합), 좌심실로 고정이 흐르고 오른쪽 에서 이루어진 절개에서 빠져나옵니다. 혈액이 고정으로 대체되기 때문에 관심의 조직은 창백해질 것입니다, 조직의 전부 또는 일부가 희미하지 않는 경우에 그 때 조직은 적당하게 고정되지 않을 수 있고 초구조는 보존되지 않을 수 있습니다.
- 면도날이나 날카로운 메스를 사용하여 조직 샘플을 2mm x 2mm x 2mm 이하블록으로 다듬습니다. 1.2단계를 건너뛰면 조직이 가능한 한 빨리 고정될 수 있도록 신속하게 이 작업을 수행하십시오.
- 또는, 고정 하에 조직을 해부하고 침지 과정을 완료하기 위해 신선한 고정으로 전달. 고정제의 최종 조성물은 2.5% 글루타랄데히드 및 2mM 칼슘 염화물을 함유한 0.1M 나트륨 코코디레이트 버퍼로 구성된다. 실온에서 최소 2시간, 최대 4°C에서 고정을 진행할 수 있습니다. 가능하면 로커/틸트 플레이트를 사용하여 수정하는 동안 샘플을 부드럽게 교반합니다.
- 또는 인버터 전자레인지를 사용할 수 있는 경우 1분 동안 1분 동안 150와트의 진공 상태에서 전술한 고정 상태에서 조직을 수정합니다. 전자레인지 고정은 조직을 빠르게 고정하고 조직초구조(27)를보존하기 때문에 1.3단계에 바람직한 방법이다.
참고 : 조직은이 프로토콜 동안 건조 할 수 없습니다, 다음 하나의 솔루션에서 신속하게 조직을 전송하기 위해주의해야한다.
- 고정 조직을 실온에서 각각 3분(총 15분)씩 세척하여 2mM 칼슘 염화칼슘을 함유한 0.1M 나트륨 카코딜레이트 버퍼로 세척합니다.
- 다음 osmium 페로시아니드 용액을 신선하게 만드십시오. 4mm 의 아스트란화물 용액(ddH2O로제조)을 0.2M 카코딜레이트 버퍼에 3% 칼륨 페로시니드의 동일한 부피와 4mM 칼슘 염화칼슘을 결합합니다. 이전 세척 단계 후, 어둠 속에서 얼음에 1 시간 동안이 용액에 조직을 배치하고, 연기 후드에.
참고: 오스뮴 테트리옥사이드는 앰프에 나오는 노란색 결정성 물질입니다. 오스뮴 테트산화물 용액을 만들려면 앰필을 열고 ddH2O를 추가하고 결정이 완전히 용해 될 때까지 어둠 속에서 3-4 시간 동안 초음파 처리하십시오. 오스뮴 테트산화물 용액은 명확한 노란색 용액으로, 용액이 검은색이라면 osmium이 감소되어 더 이상 사용되지 않아야 합니다. - 조직이 오스뮴 페로시니드 용액에서 배양하는 동안 티오카르보히드라지드(TCH) 용액을 준비하기 시작합니다. 이 솔루션을 신선하게 준비하고 1시간 의 오시움 페로시아니드 고정 기간이 끝날 때 쉽게 사용할 수 있습니다. 티오카르보히드라지드 0.1g과 ddH2O10mL를 결합하여 이 용액을 60°C 오븐에 1시간 동안 넣습니다. 용액이 용해되도록 10분마다 부드럽게 소용돌이치기. 사용하기 전에 0.22 μm 주사기 필터를 통해 이 솔루션을 필터링합니다.
- TCH에서 인큐베이팅하기 전에 실온 ddH2O 5x로 티슈를 3분(총 15분)씩 세척합니다.
- 차분을 여과된 TCH 용액에 실온(그림1A-C)에서총 20분간 배치한다.
- TCH에서 배양후, 실온 ddH2O에서 각 (총 15분)에 대해 조직 5배(총 15분)를 세척한다.
- 실온에서 30분 동안 2% 오스뮴 테트산화물(칼륨 페로시니데로 감소되지 않음)를 함유한 조직을 ddH2O에 배치합니다. 이것은 연기 후드와 어둠 속에서 osmium을 빛으로 줄일 수 있습니다 (예를 들어, 알루미늄 호일 아래)(그림 1D-F)에서수행해야합니다.
- 오스뮴 테트산화물 인큐베이션에 이어, 실온 ddH2O에서각 3분(총 15분)에 5배씩 세척한다.
- 4°C의 냉장고에 1% 수성 우라일 아세테이트(ddH2O로혼합된 우라일 아세테이트 파우더)에 티슈를 배치합니다.
- 냉장고에서 티슈를 제거하기 직전에 신선한 월튼의 납 인산 용액을 준비하십시오. 0.03M 산용액(증류수 10mL의 0.04 g 인산산)의 10mL에서 납 질산0.066 g를 용해하고 pH를 1N KOH(증류수 10mL에서 0.5611g)로 조정한다.
주의: pH를 조정할 때 침전제가 형성될 수 있습니다. 이것은 허용되지 않습니다.- 교반바를 사용하여 pH를 모니터링하는 동안 1 N KOH 드롭와이즈를 천천히 추가합니다. 완성 된 클리어 리드 아스파트에 용액을 60 °C 오븐에서 30 분 동안 예열하십시오. 침전물 형태로 솔루션을 사용할 수 없으며 다른 솔루션을 준비해야 합니다.
- 냉장고에서 티슈를 제거하고 실온 ddH2O에서 각 (총 15 분)에 대해 5 배 (총 15 분)를 세척하십시오.
- 세척 후, 60 °C에서 온도를 유지하면서 30 분 동안 따뜻하게 된 월튼의 납 인산 용액에 조직을 놓습니다.
- 월튼의 납 아파르트에 인큐베이션 후, 실온 ddH2O(그림 1G-I)에서각 3 분 (총 15 분)에 대해 조직5x를세척하십시오.
- 얼음 차가운 아세톤 시리즈(30%, 50%, 70%, 95%, 95%, 100%, 100%, 100%, 아세톤100% 아세톤)를 통해 조직을 탈수하여 시리즈의 각 단계에 대해 10분 동안 허용합니다.
- 얼음 차가운 탈수 계열에 따라 티슈를 실온 아세톤에 10분간 배치합니다.
- 이 기간 동안 812 ACM 수지를 공식화합니다. 빔 손상에 더 저항하기 때문에 "하드 믹스"레시피를 사용합니다. 수지를 철저히 섞고, 조직을 포함 812:아세톤(1:3 믹스)에 4시간 동안 넣고 8시간 동안 812:아세톤(1:1 믹스)을 포함하고, 마침내 하룻밤 사이에 812:아세톤(3:1 믹스)을 포함시한다. 실온에서 이러한 수지 침투 단계를 수행합니다.
- 다음 날, 4-8 시간 동안 100 % 포함 812에 조직을 배치 한 다음 신선한 100 % 포함 812 하룻밤, 마지막으로 신선한에 812 4 시간 동안 포함. 실온에서 이러한 수지 침투 단계를 수행합니다.
- 포함 직전에 소량의 수지를 혼합 용기에 넣고 수지가 분말로 포화 될 때까지 카본 블랙 파우더에 천천히 혼합 (나무 막대기를 교반하는 데 사용할 수 있음)을 천천히 혼합하지만 여전히 유체이며 거칠지 않습니다. 그것은 두꺼운 잉크를 닮은 눈에 보이는 덩어리없이 나무 막대기에서 천천히 물방울 수 있어야합니다.
- 실리콘 고무 금형에 조직 샘플을 방향을 지정하고 수지 블록 내의 샘플 방향이 기록되고 참조할 수 있도록 사진을 찍습니다. 실리콘 몰드 의 끝에 탄소 검은 색 포화 수지에서 샘플을 덮고 65 °C에서 ~ 1 시간 동안 오븐에 금형을 놓습니다.
- 금형을 조직 샘플을 덮는 금형 끝에 수지를 포함하는 경사에 금형을 놓습니다. 수지의 반대쪽 끝에 금형에 실험/조직 샘플 식별자를 가진 라벨을 놓습니다(도2A).
- 오븐에서 실리콘 금형을 제거하고 라벨이 보이는 상태로 유지되도록 투명 수지 (카본 블랙 없음)로 금형의 나머지 부분을 채웁니다. 투명 수지와 쉽게 섞이지 않을 정도로 카본 블랙이 주입된 수지를 치료합니다.
- 조직을 포함하지 않는 금형 내에서 추가 우물을 준비하십시오. 여분의 우물로 시작하여 금형의 나머지 부분을 투명 수지로 채웁니다.
- 탄소 블랙 주입 된 수지는 투명 수지로 출혈하기 시작하면 실리콘 몰드를 추가 시간 (예 : 15 분)에 오븐에 다시 넣습니다.
- 모든 조직 샘플이 투명한 수지로 토핑되면 실리콘 몰드을 65°C에서 65°C로 다시 오븐에 넣고 경화 공정을 완료합니다.
2. 블록 준비
참고: 메서드는 샘플이 블록의 방향과 단면이 어떻게 수행되는지에 따라 달라집니다. 그러나, 가장 일반적인 조직 배향은 수지 블록의 끝에 중심을 두는 조직을 발견하며, 수지 블록의 긴 끝에 수직으로 수직이다.
- 대부분의 경우, 먼저 블록의 끝을 트림하여 척에서 약 5-6mm를 고집하는 테이퍼 엔드와 함께 미세토메 척에 표본 블록을 배치하여 조직을 찾습니다. 세트 나사로 제자리에 고정하고 열 램프 아래에 놓습니다.
- 몇 분 후 블록은 가단하고 손질하기 쉽습니다. 척을 스테레오현미경 홀더에 놓고 새로운 양면 면도날을 사용하여 조직이 보일 때까지 블록 페이스와 평행하게 얇은 섹션을 만듭니다. 이것은 블록 얼굴을 가로 질러 빛을 앵글링에 의해 가장 잘 볼 수 있으며, 조직 샘플은 조직이없는 수지의 그 부분에 비해 반사가 적고 세립적 일 것입니다. 조직이 어디에 있는지를 생각하려면 탄소 흑색 포화 수지의 도입 전에 조직 샘플촬영 사진을 참조하십시오.
- 트리밍 을 위해 시편 핀 홀더 1 개를 따로 둡니다. 이 핀 홀더는 SEM 챔버에 배치되지 않으므로 장갑없이 처리 할 수 있으므로 트리밍 핀 홀더라고합니다. 이미징 챔버에 배치 될 운명 모든 표본 홀더는 장갑없이 만져서는 안됩니다. 이것은 현미경 챔버에 그리스와 기름을 소개하는 것을 피합니다.
- 알루미늄 시편 핀을 트리밍 핀 홀더에 놓고 핀 홀더 위에 3-4mm 를 고정한 핀의 면(평평한 표면)으로 세트 나사를 약간 조입니다.
- 핀 의 얼굴에 여러 가지 깊은, 십자가 스크래치를 확인하여 장소에 표본을 유지하는 데 사용되는 접착제에 대한 더 큰 표면적을 제공합니다. 알루미늄 핀을 사용하는 경우 이 단계에서는 소형 강철 플랫헤드 스크루드라이버를 권장합니다(그림2B).
- 수지가 부드럽고 가단이 될 때까지 조직 샘플을 다시 열 램프 아래에 놓고 스테레오 현미경 아래 척 리셉터클에 놓습니다.
- 양날 면도날을 사용하여 조직 샘플을 포함하는 수지 블록의 부분에서 과도한 수지를 다듬습니다. 궁극적으로 핀에 부착 된 티슈 블록의 크기는 직경약 3mm와 높이 2-3mm입니다.
- 면도기를 약 1-2mm 정도의 수지 블록으로 조심스럽게 밀어 넣은 다음 면도기를 이전 절단과 동일한 깊이로 수지 블록에 수평으로 밀어 넣습니다. 조직 샘플을 포함하는 블록의 일부를 손상시키거나 잘라 낼 수 있으므로 천천히 세심한 주의를 기울여 이 작업을 수행하십시오. 두 컷이 만날 때, 초과 수지는 블록에서 분리됩니다. 3mm x 3mm 제기 영역이 남아있을 때까지 수지 제거를 계속합니다.
- 이 초기 트리밍 후 블록(여전히 척)을 몇 분 동안 열램프 아래에 놓습니다.
- 수지가 부드럽고 가단성이 되면 블록을 스테레오 현미경 아래에 다시 놓습니다. 새로운 더블 엣지 면도날을 사용하여 수지 블록의 상단을 잘라, 약 1mm 트림 부분 아래, 하나의 부드러운 절단. 평평한 표면은 시편 핀에 접착되기 때문에 바람직하다. 이 단계에서는 블록의 제거된 부분으로 옮겨 서 날아가버릴 수 있는 힘이 필요하기 때문에 샘플이 손실되는 것을 허용하지 않도록 주의하십시오. 잘라낸 샘플을 따로 놓습니다.
- 스테레오현미경 리셉터클에 절단 알루미늄 핀이 들어 있는 트리밍 핀 홀더를 배치합니다. 눈에 보이는 반월 상 연골을 형성하지 않고 완전히 핀을 덮을 수 있도록 핀 면에 시아노아크라일트 접착제의 얇은 층을 적용합니다. 집게로 티슈 블록의 손질된 조각을 집어 들고 핀 얼굴에 놓습니다. 시편 핀에 조직 샘플을 중심으로 합니다. 그것을 아래로 밀어 몇 초 동안 누군다. 접착제를 몇 분 동안 설정하도록 허용합니다.
- 접착제가 완전히 건조하면 트리밍 핀 홀더를 스테레오 현미경 아래에 다시 놓습니다. 미세 파일을 사용하여 수지가 핀을 돌출하지 않도록 과도한 수지를 파일로 제출합니다. 수지 모양은 원형 핀 헤드와 유사해야 합니다.
- 수지 블록의 제기 부분에 조직을 찾아, 경사 조명이 유용하다. 이중 면도기를 사용하여, 조직 샘플을 포함하는 수지의 제기 부분은 1mm2이하의 영역으로 손질되어야 한다. 가능하면 블록 페이스를 더 작게 다듬을 수 있으며 다이아몬드 나이프의 스트레스를 줄이고 장수를 향상시킵니다.
- 가능한 한 많은 초과 수지를 제거하여 블록을 한 차원으로 약간 더 길게 둡깁니다. 이것은 너무 많은 힘이 적용되는 경우에 떨어져 탈옥하는 조직 견본을 포함하는 수지에 대 한 가능 하기 때문에 천천히 하 고 주의 하 게 수행 됩니다. 면도기는 권장되지만 이 단계에는 미세 금속 파일을 사용할 수 있습니다.
- 미세 금속 파일 각도로 과잉 수지를 사용하여, 조직 샘플을 포함하는 제기 된 부분 외부 의 영역에서, 핀의 가장자리를 향해 아래로(도 2C).
- 실버 페인트를 바르고 금 스퍼터링을 적용하기 전에 준비된 시료에서 수지 입자와 먼지를 제거합니다. 은을 아세톤과 혼합하여 쉽게 퍼질 수 있는 액체로, 매니큐어(너무 얇지 않아 어플리케이터에서 떨어지지 않음)를 전체 샘플 블록 표면에 가늘게 발라줍니다. 아세톤은 빠르게 증발하므로 실버 페인트가 두꺼워지기 시작하면 아세톤을 추가해야 할 수도 있습니다.
- 은페인트가 현미경으로 적재하기 전에 밤새 건조되도록 합니다.
참고: 이 실버 레이어는 블록 페이스를 1mm x 1mm 이상으로 확장하지 않도록 얇아야 하며, 실버 페인트가 다이아몬드 나이프를 손상시키지 는 않았지만 다이아몬드 나이프의 수명을 보존하는 것이 좋습니다. 은과 혼합 된 아세톤은 이미징 챔버에 아세톤 증기를 도입하지 않도록 금 스퍼터링 또는 현미경으로 샘플을로드하기 전에 완전히 증발해야합니다. - 실버 페인트를 적용한 후 샘플 블록에 얇은 금층을 적용합니다. 표준 금 호일 대상을 갖춘 표준 진공 스퍼터링 장치를 사용하여 200 밀리토리(아르곤 가스)의 챔버 압력과 2분 동안 40밀리암페어를 달리면 20nm 두께의 금 코팅이 발생합니다.
- 은페인트가 현미경으로 적재하기 전에 밤새 건조되도록 합니다.
- 코팅 후 적절한 실험 라벨이 부착된 튜브에 장착 및 트리밍 블록을 배치합니다. 일회용 전송 파이펫을 사용하여 사용자 지정 튜브를 만듭니다.
- 전구 바로 아래에 전달 파이펫을 잘라 구근 끝 아래에 부착된 이송 파이펫 튜브의 짧은 부분을 남깁니다. 잘라낸 관 부분을 단축하고 파이펫 팁을 충분히 잘라 알루미늄 시편 핀을 안쪽으로 밀수 있게 합니다.
- 알루미늄 시편 핀을 포함하는 끝을 변형된 이송 파이펫의 구근 끝 내에 놓습니다.
- 준비된 티슈 블록을 적재하기 전에 블록 면 표면에서 과도한 실버 페인트를 조심스럽게 다듬습니다.
3. 블록 페이스 이미징을 위한 SEM 설정
참고: 다음 이미징 설정은 제공된 자료 표에 나열된 작성자가 사용하는 장치에서 생성되었습니다. 이 장치는 가변 압력 이미징을 할 수 있지만, 최상의 결과는 높은 진공 상태에서 캡처되었습니다.
- 거주 시간: 직렬 단면 중에 12 μs/px를 사용합니다. 관심 영역이 확인되면 32 μs/px에서 더 높은 해상도의 이미지를 얻을 수 있습니다.
- 진공 설정: 9e-008 Pa의 총 압력, 1.1e-004 Pa의 기둥 압력, 9.5e-002 Pa의 챔버 압력을 사용합니다.
- 캡처 시간: 위의 설정을 사용하면 이미지당 50초의 속도로 2048x2048 px 이미지 스택을 캡처합니다. 관심 지역의 고해상도 이미지는 이미지당 9분 이내에 4096x4096 px로 캡처할 수 있습니다.
- 단면 두께: 100-200 nm를 사용합니다. 적은 수 있지만, 낮은 빔 전압, 강도 또는 거주 시간이 필요할 수 있습니다.
- 고전압(HV): 7-12 kV를 사용합니다. 전압을 늘리면 스팟 크기가 줄어들고 해상도가 증가하지만 빔 손상 가능성이 높아집니다. kV가 높을수록 빔 침투가 증가하여 세부 정보가 손실됩니다. 그러나 kV를 낮추면 신호대 잡음비(도3)14가저하된다.
- 빔 강도(BI): 저자의 SBF-SEM 장치는 1-20에 이르는 빔 강도 척도를 제공합니다. 이 규모에서 5-7의 값은 과도한 충전 및 빔 손상없이 고품질의 이미지를 제공합니다. 그러나 BI가 높을수록 해상도가 클수록 충전 및 빔손상(14)이더 많아진다.
- 스팟 크기 및 이미지 확대: 빔 강도 및 전압 레벨별로 스팟 크기를 결정합니다. 이상적으로, 스팟 크기는 사용되는 픽셀 크기보다 크지 않아야합니다. 픽셀 크기는 뷰 필드(FOV)를 픽셀 수로 나누어 결정됩니다. 예를 들어 이미지 크기가 2048x2048 px인 25 μm FOV는 픽셀당 12.2nm를 제공합니다. 따라서 스팟 크기는 12.2 nm보다 크지 않아야 합니다. 그림 4는 HV, BI 및 스팟 크기와 어떻게 관련되어 있는지 를 보여줍니다.
- 작업 거리(WD) - 블록 페이스 이미징을 사용하면 작업 거리를 조정할 수 없습니다. 그것은 단순히 초점의 요인입니다. 이미지된 모든 블록에 대해 거의 동일합니다. 작업 거리를 조정할 수는 없지만 캡처된 이미지의 해상도에 중요한 역할을 합니다. 작업 거리가 감소하면 캡처된 이미지에 대한 해상도 제한이 증가합니다. 어떤 경우에는 이미징 챔버 내에서 수정하여 작업 거리를 줄일 수 있지만 이러한 수정은 사용자의 재량에 따라 이루어져야합니다. 작업 거리를 줄이고 이미지 해상도를 높이기 위해 도어 마운트 마이크로토메 나사를 느슨하게 하고 미세토메를 재배치하여 나사를 다시 조인한 후 빔 검출기에 2mm 가까이 휴식을 취했습니다.
- 해상도 - 위의 설정을 사용하여 3.8 nm의 높은 x 및 y 해상도가 가능합니다. 해상도는 빔 스팟 크기와 이미지 캡처의 픽셀 해상도에 의해 제한된다는 점에 유의하는 것이 중요합니다(예: 2048x2048 픽셀 이미지에서 캡처된 20 μm 시야는 3.8nm 스팟 크기가 사용되더라도 9.8nm의 픽셀 해상도를 갖는다). z-평면의 이미지 해상도는 단면 두께에 따라 달라지며, 100-200 nm가 이 프로토콜과 잘 어울린다는 것을 알 수 있습니다.
결과
마우스 각막
이 프로토콜은 마우스 각막에 광범위하게 적용되었습니다. SBF-SEM 이미징을 사용하여 엘라스틴이 없는 마이크로피브릴 번들(EFMBs)의 네트워크를 사용하여 성인용 마우스 각막 내에 존재하는 것으로 나타났다. 이전에는 이 네트워크가 배아와 조기 산후 발달 중에만 존재한다고 믿었습니다. SBF-SEM은 각막 전체에 걸쳐 광범위한 EFMB 네트워크를 공개했으며, 개별 섬유는 단면에서 측정할 때 직경이 100-200 nm인 것으로 나타났습니다. 또한 이 EFMB 네트워크는 각질 세포와 밀접하게 연관된 섬유와 함께 각질 세포표면(그림 5)의얕은 질 내로 구성된 것으로 나타났습니다. 성인 각막에서 EFMB 섬유의 발견은 면역금 표지 전송 전자 현미경 검사법 (TEM), 형광 및 공초점 연구를 주도하여 이네트워크(23)의특성을 더욱 이해하였다.
이 프로토콜의 추가 적용은 기질 상피 경계에서 기저 상피 세포와 융합중앙 각막 신경의 이전에 알려지지 않은 인구의 발견으로 이어졌다(도 6). 이전에는 이 국경에서 상피와 상호 작용하는 모든 신경이 각막 상피로 침투하여 서브바살과 상피 플렉시를 생산하는 것을 방해한다고 믿었습니다. 이 연구에서는, 기초 상피와 상호 작용하는 중앙 신경의 ~45%는 단순한 침투보다는 세포 세포 융합을 겪었습니다. SBF-SEM 데이터 세트에 적용된 입체적 방법을 사용하여, 이 새로운 신경 인구가 관통신경의 약 절반의 표면 대 부피 비율을 가지고 있음을 보여줄 수 있었으며, 그들의 "부은" 외관(신경 융합 - 3.32±0.25, 신경 침투 - 1.39±0.14, p ≤ 0.05). 신경 번들의 융합 부분에 미토콘드리아의 부족을 강조하여 신경 번들과 미토콘드리아를 관통하고 융합시키는 3D 재구성이 만들어졌습니다. SBF-SEM을 이용한 뉴런 상피 세포 융합의 발견은 두 융합된세포(21)사이의 막 연속성을 확인하는 형광 연구를 주도하였다.
중앙 각막은 혈관 조직이며, 이러한 말초 사지 혈관은 각막의 전반적인 건강에 특히 중요합니다. 이 영역의 세포 세포 관계 및 초구조는 복잡합니다. 그러나 이러한 세포 세포 상호 작용 및 초구조적 연결을 이해할 수 있는 능력은 형광 및 단일 섹션 TEM 연구에서 제한되었습니다. 이러한 이유로 사지 혈관을 포함하는 SBF-SEM 이미지 스택, 신경 번들 및 관련 세포는 3D 재구성을 위해 수동으로 분할되었다(도7). 이 이미지에서 혈관 내피 접합부와 오버레이 퍼사이클 사이의 밀접한 연관성, 혈관 벽의 외부 표면을 따라 크롤링하는 호중구의 핵 및 선행 가장자리의 개별 과립, 뿐만 아니라 통과 신경 번들을 볼 수 있다.
종합하면, 이 작업 본체는 세포외 매트릭스와 상피뿐만 아니라 혈관 및 관련 세포가 풍부한 조직에서 고품질3D 전자 현미경 데이터 세트를 생성하는 이 프로토콜의 능력을 보여줍니다.
높은 순서 영장류 망막 - 신경 신경 발공 및 혈관 네트워크
높은 순서 영장류의 망막 신경 섬유 층 (RNFL)은 광범위한 혈관 네트워크를 포함하고 의존합니다. 종종 망막의 질병은 망막 신경 섬유 층의 두 매개 변수뿐만 아니라 그 안에 있는 혈관에 변화를 포함합니다. 건강 한, 비 병 리 조직에서 RNFL와 그것의 혈관 네트워크 사이 관계를 이해 하는 것은 질병의 결과로 발생할 수 있는 어떤 변화를 이해 하는 첫 번째 단계. 이러한 관계를 더 잘 이해하기 위해, SBF-SEM 프로토콜은 정상적인 고주 영장류 망막에 적용되었고 혈관 네트워크의 재구성이 수행되었고 이 재구성으로부터 추출된 체적데이터(도 8). RNFL의 이 4,642,307 μm3 지역은 혈관 침대 1.207x10-4 μL을 함유하여 RNFL 의 총 부피의 2.6%를 차지했습니다. 이 작품은 조밀 한 신경 조직에서 고품질 3D 전자 현미경 데이터 세트를 생산하는이 프로토콜의 기능을 보여줍니다.
제브라피시와 자이언트 다네오 하트 - 근육과 혈관을 개발
제브라피쉬와 자이언트 다니오는 심장 발달과 재생을 위한 중요한 모델입니다. 역사적으로, 제브라피쉬 심장은 제브라피시의 생리적 요구를 지원하기 위해 함께 작동하는 두 개의 해부학적으로 뚜렷한 심근 분으로 구성된 것으로 간주됩니다. 그러나, 이 두 심실 층 사이의 인터페이스는 잘 이해되지 않았다. 이 프로토콜을 사용하여 이전에 인식되지 않았던 접합 영역이 얇은 섬유아세포 시트로 구성된 것으로 밝혀졌습니다. 이 시트 내의 개구부로 인해 두 개의 개별 심근 세그먼트가 접촉하고 탈모솜및 근막부착22를포함한 복잡한 접착 접합부를 형성할 수 있는 것으로 나타났다.
이 프로토콜은 개발 거대 다네오 심장의 혈관 네트워크를 검사하는 추가 작업에 활용되었습니다(도 9). 이 방법을 통해 개발 중인 심근세포 네트워크와 미생물 혈관 절제술과의 관계에 대한 3D 감사를 할 수 있습니다. 종합하면,이 작품은 근육과 고도로 혈관화 된 조직에서 고품질 3D 전자 현미경 데이터 세트를 생성하는이 프로토콜의 기능을 보여줍니다.
이미지 설정, 충전 및 해상도
품질 SBF-SEM 이미징에 적절한 고정 및 중금속 염색이 필요하지만, 마찬가지로 중요한 것은 전도성 수지및 해결되는 질문에 대한 적절한 이미징 설정을 사용하는 것입니다. 본 프로토콜에서, 카본 블랙의 사용은 샘플 블록의 전도도를 높이고 블록 페이스로부터 이차 전자의 클리어런스를 위한 장착 핀에 도관을 제공하기 위해 사용된다. 이것은 종종 탄소 블랙16으로준비되지 않은 조직에서 이미지 품질을 저하 조직 충전 퇴치에 효과적인 입증되었습니다. 또한 블록에 적용된 실버 페인트 및 골드 스퍼터링은 전자 축적을 위한 방출 경로를 제공합니다. 일부 장치는 블록 페이스에 질소퍼를 적용하여 충전을 줄이는 초점 충전 보상기를 추가 할 수 있지만, 우리는 카본 블랙의 사용과 블록(15)에실버 페인트및 금 스퍼터링의 적용과 유사한 성공을 거두었습니다. 시료 전도도의 부족은 조직충전(도 1)으로보이는 전자 축적뿐만 아니라 이미지 품질을 극적으로 감소시키는 갑작스러운 이미지 이동 및 뒤틀린 것으로 보이는 방전으로 이어질 수 있습니다(도10B 및 F). 카본 블랙을 사용하면 고진공 상태에서 이미징을 할 수 있으며 이미지 설정을 사용하여 높은 신호 대 잡음 비율과 향상된 이미지 해상도를 제공합니다. 향상된 이미지 품질로 이어지는 이러한 설정 중 하나는 픽셀 거주 시간입니다. SBF-SEM 이미징 프로세스는 현미경 검출기가 신호로 수집하고 해석할 수 있는 백산전자를 생성하기 위해 샘플 표면을 가로질러 전자 빔의 래스터 스캐닝을 포함한다. 이 빔이 각 픽셀의 공간 내에 거주할 수 있는 기간은 각 픽셀 위치(그림3A & B)2에할당되는 보다 정확한 픽셀 값으로 이어집니다. 그러나 차단면에 대한 신호 대 소음 증가, 해상도 및 손상 사이에 는 균형을 맞추어야 합니다. 빔은 수지분해 및 절단 합병증의 결과로 분해 및 절단 합병증의 결과로 수지를 부드럽게 할 수있는 높은 에너지 전자로 블록 면을 효과적으로 조사(도 10)28. z 해상도가 더 얇아지면 고해상도 이미징을 유지하기가 더 어려워집니다. 우리는 일반적으로 100-200 nm의 z 단계를 사용하지만, 25-50 nm의 z 단계 크기는5,29,30,31로보고되었습니다. 이 크기의 z-steps로 인해 빔 손상으로 인한 수지의 분해 및 연화는 칼이 절단을 놓치거나 블록 페이스를 자르는 원인이되는 수지의 압축으로 이어질 수 있지만, 칼이 블록의 표면을 가로 질러 건너 뛰는 "수다"로 인해 잔물결과 밴드(13)를만듭니다. 작은 z 단계는 매력적인 전망이지만 적절한 z 단계를 선택할 때 특정 연구 질문을 염두에 두는 것이 중요합니다. 과다 샘플링은 상당한 데이터 스토리지 고려 사항뿐만 아니라 3D 재구성을 생성하는 데 필요한 시간이 증가할 수 있습니다.
조직 고정 및 염색
중금속 배양 전에 조직은 글루타랄데히드에 고정되어야 합니다. 조직 울트라구조(27)의보존을 위해 진공 상태에서 전자레인지 고정을 적극 권장하지만, 실험실급 전자레인지가 제공되지 않는 경우 가변 와트가 있는 상업용 인버터 전자레인지를32,33,34,35로대체할 수 있다. 이 작업이 완료되면 조직 왜곡이 발생하지 않도록 추가 주의를 기울여야 합니다. 부적절한 조직 고정은 도 10E에서볼 수 있듯이 조직 형태가 변경될 수 있다. 이 프로토콜은 대부분의 현대 SBF-SEM 염색 프로토콜과 마찬가지로 1984년36년윌링엄과 러더포드가 만든 오스뮴 티오카르보히드라지데-오스뮴 얼룩을 기반으로201010년 17년디어린크가 설명한 염색 절차에서 채택되었다. 이 프로토콜에 활용되는 중금속은 조직 샘플 내의 세포 구조에 대비를 추가한다(도1). 초기 오스뮴 인큐베이션은 불포화 지방에서 C=C 결합을 결합하는 감소된 오스뮴으로 발생하며 막 및 지질 염색37,38로이어진다. 오스뮴은 포화 지질의 염색을 돕고 인지질39,40을안정시키는 작용을하는 칼륨 페로시아니드에 의해 감소된다. 티오카르보히드라지드는 이후 첫 번째 인큐베이션으로부터 오스뮴에 결합하는 모덴트로 첨가되어프로토콜(41)의후단계에서 더 많은 오스뮴이 결합되는 다리 역할을 한다. 우라늄 염인 우라일 아세테이트는 지질, 핵산 및 단백질을 위한 효과적인 대조제이며, 납 구연산은 단백질과 글리코겐의 대비를 향상시킵니다. 세포 구성 요소에 대한 이러한 에이전트의 다양한 친화성은 osmium인큐베이션(42)이상으로 조직 내의 전반적인 대비를 더욱 향상시킵니다.
블록 페이스 이미징
도 11, 도 12, 도 13은 전압, 픽셀 거주 시간 및 빔 강도의 결합된 효과를 도시한다. 종래의 관행은 최적의 이미징과 샘플 블록에 대한 빔 손상을 방지하기 위해 저전압, 짧은 거주 시간 및 낮은 빔 강도의 조합을 제안합니다. 이러한 설정과는 달리, 도 11, 도 12, 도 13은 더 높은 전압(예를 들어, 7kV), 더 긴 거주 시간(32 μs/px) 및 더 높은 빔 강도(당사의 경우 설정 6)가 기존 설정에 비해 우수한 이미지 품질을 생성할 수 있음을 보여줍니다.
SBF-SEM은 복셀로 구성된 3D 데이터 세트로 수집할 수 있는 직렬 전자 현미경 이미지의 수집을 허용합니다. 이것은 SBF-SEM의 믿을 수 없을만큼 강력한 사용이지만,이 방법은 희귀 한 생물학적 사건 이나 세포의 신속하고 반복 가능한 이미징을 허용합니다. SBF-SEM을 이용한 이미지 수집은 드문 이벤트에 대해 모니터링할 수 있으며 이러한 이벤트의 배율/해상도 이미지를 수집하기 위해 이미징이 일시 중지됩니다. 더욱이, 블록은 현미경 챔버및 전염 전자 현미경 (TEM) 이미징을 위해 단면된 블록 얼굴에서 제거될 수 있다. 이러한 방식으로 희귀 이벤트의 대규모 데이터 집합은 SBF-SEM을 사용하여 수집할 수 있을 뿐만 아니라 TEM을 사용하여 협스트롬 스케일에서 평가할 수 있습니다.

그림 1: 프로토콜의 다양한 단계에서 SBF-SEM 및 TEM 비교. 이 프로토콜에는 시료 조직이 중금속으로 염색되는 여러 단계가 포함되어 있습니다. 이것은 조직 대비 및 세포 구조 및 세포기관의 감사뿐만 아니라 조직이 이미지될 때 발생하는 충전 수준에도 영향을 미칩니다. 이 그림은 준비된 조직의 세 가지 뚜렷한 전망을 포함합니다: 낮은 배율 보기(A, D 및 G),높은 배율 보기(B, E 및 H),및 준비된 마우스 각막의 TEM 비교(C, F 및 I). 전자 빔이 조직의 작은 영역에 집중되기 때문에 배율 이 높은 배율 이미지가 증가된 조직 충전을 초래할 수 있음을 주목할 수 있습니다. 상부행(A-C)은1.8단계의 완성을 통해 처리된 조직으로부터의 대표적인 샘플이며, 칼륨 페로시니드, 오스뮴 테트록산화물 및 티오카르보히드라지드로 함침되었다. 처음 두 열의 화살표는 상피-기질 인터페이스를 기준점으로 표시합니다. 하단 두 행에 비해 대비의 낮은 수준뿐만 아니라 조직 충전의 증가 수준을 유의하십시오. 중간행(D-F)의샘플은 1.10단계의 완성을 통해 처리되었으며, 추가 오스뮴 테트옥사이드 단계로부터 이점을 제공하며, 상단 행의 샘플보다 눈에 띄게 대조된다. 세포 구조를 식별할 수 있지만 충전은 여전히 존재합니다. 하단 행의샘플(G-I)은전체 염색 프로토콜의 이점을 가지며 최소한의 조직 충전이 있습니다. TEM 이미징은 각 단계 (오른쪽 컬럼)에 존재하는 중금속에 의해 부여 된 조직 대비 수준을 보여줍니다 : 각막 내피 (*)의 세포기관은 프로토콜을 통해 조직 처리가 계속됨에 따라 더 대조적이고 명백합니다. 또한 프로토콜이 완료되면 기질 콜라겐과 피브릴린 세부 정보가 더 눈에 띄게 됩니다(화살표촉). 패널 A, D 및 G 스케일 바 = 50 μm. 패널 B, E 및 H 스케일 바 = 10 μm. 패널 C, F 및 I 스케일 바 = 1 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 2: 임베디드 조직 블록, 시편 핀 및 최종 제제의 회로도. (A)조직은 수지 몰드의 맨 끝에 공지된 방향으로 배치되어야 하며, 카본 블랙 포화 수지로 채워진 몰드의 상부 3분의 1을 배치해야 한다. 조직에서 가장 멀리 곰팡이의 영역은 실험 라벨을 명확하게 볼 수 있도록 명확하게 유지되어야한다. (B)시편 핀 표면은 그리드 패턴을 생성하기 위해 긁혀야 하며, 이는 제조된 시편 블록과 핀 사이에 경화하기 위해 시아노아크라일트 접착제에 대한 접촉 영역이 더 클 수 있다. (C)카본 블랙 포화 수지는 시편 핀 헤드와 접촉하는 넓은 영역을 만들어야하지만 다이아몬드 나이프에 의해 절단되는 영역은 1x1 mm 이상이어야한다. 블록을 팁쪽으로 테이퍼하는 것이 좋습니다. 이를 통해 다이아몬드 칼의 절삭력을 최소화하고 베이스가 넓어짐에 따라 단면 중에 핀과 분리하는 데 더 강합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
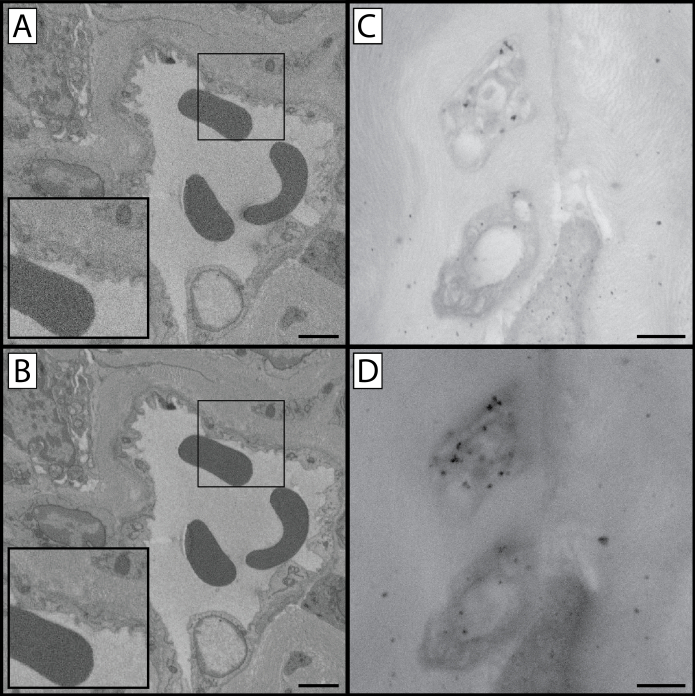
그림 3: 이미지 캡처 설정의 비교. (A & B)패널 A와 B는 픽셀 거주 시간의 함수로서 이미지 품질과 해상도를 비교합니다. 패널 A는 4kV에서 32 μs/픽셀 거주 시간을 사용하여 만들어졌으며 확대된 인셋의 "거친" 모양에서 명백히 나타나는 바와 같이 신호 대 잡음 비가 감소합니다. 패널 B는 4kV에서 100 μs/픽셀 거주 시간을 사용하여 만들어졌습니다. 픽셀 거주 시간을 증가하면 신호대 잡음 비율이 증가하고 셀룰러 세부 수준이 증가하지만 픽셀 거주 시간이 증가하여 블록을 부드럽게 하고 절삭 아티팩트(chatter)를 도입하는 조직 충전 및/또는 열 축적으로 이어질 가능성이 있습니다. 패널 C와 D는 동일한 노출 조건에서 캡처된 이미지를 비교하지만 두 개의 서로 다른 빔 kV 값과 비교합니다. 이 패널의 조직은 빔 침투 깊이의 차이를 더 분명하게 만들기 위해 금 톤 나노 골드 입자로 함침되었다. 패널 C는 9kV에서 캡처되었으며 패널 D는 21 kV에서 캡처되었습니다. 증가된 kV는 증가된대비(D)의장점을 가지지만,조직(C)의깊이에서 전자를 채집한 결과로 세부사항이 손실된다. 더 큰 단면을 샘플링한 결과 GAP 43에 특정한 면역금 입자의 수가 많을 수 있으며 비특이적 라벨링은 동일하게 유지되어 신호 대 잡음 비율이 증가합니다. 패널 A & B 스케일 바 = 2 μm. 패널 C 및 D 스케일 바 = 1 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 4: 빔 강도, kV 및 스팟 크기. (A)조직 샘플에 접촉하면 전자 빔 (밝은 파란색)은 눈물 방울 모양의 상호 작용 부피를 산출하며, 빔 전자와 조직 샘플 사이의 상호 작용에서 다양한 형태의 에너지가 생성됩니다. 눈물방울 형상은 빔 에너지와 함께 조직 밀도 및 중금속 염색기능이며,전자빔(43)의기울기 각이다. 엑스레이, 오거 전자 및 삼차 전자는 SBF-SEM 화상 진찰 도중 생성되는 동안, 주요 관심사는 백산재 (진한 파란색) 및 이차 (녹색) 전자13입니다. SBF-SEM 이미징으로 생성된 이미지는 백산전자를 수집하여 생성됩니다. 이러한 전자는 빔과 시료 사이의 탄성 상호 작용에서 유래하고, 수집된 신호는 상호 작용하는 원자의 원자 수에 크게 의존하여 중금속염색(44)의필요성에 크게 의존한다. 이차 전자는 빔과 샘플 사이의 비탄력적 상호 작용에서 유래하고 신호의 검출은 표면 방향에 크게 의존한다. 블록-페이스는 SBF-SEM에서 평평하기 때문에, 이차 전자는 수집된신호(13)에의미 있는 기여를 하지 않는다. 실제로 블록 표면에 이차 전자 축적은 충전의 주요 원인이 될 수 있으며 이미지 품질2에해로운 영향을 미칩니다. (B)이 그래프는 빔 강도, 빔 kV 및 스팟 크기 사이의 관계를 보여줍니다. 스팟 크기는 빔의 공간 해상도이며 생성되는 이미지의 해상도 제한을 결정합니다. kV를 낮추면 스팟 크기가 증가하지만 이미징 깊이를 줄여 세부 사항을 더 잘 인식할 수 있습니다. 이것은 또한 검출 가능한 신호를 감소시키는 효력이 있습니다. 빔 강도를 증가하면 스팟 크기와 신호 감지가 초기 개선되었지만 조직 충전 수준을 빠르게 증가시킵니다. 궁극적으로, 선택한 빔 강도 및 kV 값은 표본 의존적이고 가장 잘 묻는 과학적 질문과 관련하여 경험적으로 결정됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 각막 내의 각막 내의엘라스틴 프리 마이크로피브릴 번들 네트워크. 마이크로피브릴(흰색)의 3D 재구성(노란색, 주황색 및 녹색). 마이크로피브릴은 인접한 것으로 볼 수 있으며, 경우에 따라 얕은 홈 내에서 각막 각막 세포(arrows)(A). 엘라스틴이 없는 마이크로피브릴의 이 네트워크는 각막 기질(B)내의 뚜렷한 층으로 구성됩니다. 스케일 바 = 2 μm. 재구성된 이미지 블록은 x 및 y 축의 45x45 μm, 복셀이 있는 z 축의 30 μm으로 22x2x100 nm의 해상도입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 기질 상피 국경에서 기저 라미나를 통과하는 각막 신경의 재건. 이 신경침투 전에 분기볼 수 있습니다. 상피로 관통 한 후, 두 신경 가지는 파급 효과를 겪었다. 미토콘드리아(노란색)는 신경 번들의 기질 및 상피 부위에서 볼 수 있다. 스케일 바 = 2.5 μm. 재구성된 이미지 블록은 x 및 y 축에서 25x25 μm, 12x12x100 nm의 복셀 해상도로 z 축의 14 μm입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 7: 주변 마우스 각막내의 림발 혈관 및 관련 세포. 3D 이미지블록(B)으로부터단일이미지(A)를통해 혈관, 신경 번들 및 관련 세포가 이동하는 것을 볼 수 있다. 패널 C는 내피 세포 접합부를 덮고 있는 관련 pericyte(gray)를 포함하는 재구성된 용기(red)를 나타낸다. 신경 번들 (파란색) 조직을 통해 이동으로이 용기에 가까운 거리에서 분기. 호중구(yellow)는 혈관의 긴 축과 평행하게 볼 수 있으며, 다형성 핵은 세포 체 내에서 볼 수 있으며 후행 비뇨기개는 이미지의 오른쪽을 향한 돌출부로 볼 수 있습니다. 돛대 세포 (마젠타)는 혈관의 밑면에 볼 수 있습니다. 패널 D는 이 마스트 세포를 격리하여 과립(녹색)이 세포 내에서 핵(보라색)을 오버레이하는 것을 보다 쉽게 볼 수 있습니다. 패널 E는 내피 핵이 파란색으로 표시되고 혈관 루멘(주황색)에서 볼 수 있는 부착된 미세 입자와 함께 세포 재구성에 겹쳐진 세포 구조를 강조합니다. 화살표는 내피 세포 사이 세포 경계를 보여줍니다, 이는 더 혈관의 발광 측에 세포를 따라 확장 제기 능선으로 볼 수 있습니다. 패널 A 스케일 바 = 2 μm. 이러한 셀을 재구성하는 데 사용되는 이미지 블록은 x 및 y 축에서 30x30 μm, 14.6x14.6x100 nm의 복셀 해상도로 z 축의 42.5 μm입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 8: 비인간 영장류 망막 신경 섬유 층의 혈관 망을 재구성. (A)8192x8192 px에서 촬영한 영장류 망막의 200x200 μm SBF-SEM 이미지. 샘플링된 위치는 병리학없이 건강한 눈의 열등한 측두림 림 마진에서 ~500 미크론입니다. 패널 C & D로 재구성된 이미지 시리즈는 2048x2048 px로 캡처되었으며, 이미징이 일시 중지되어 관심 있는 영역을 8192x8192 px로 이미지화할 수 있습니다. 패널 B는 원래 이미지에서 직접 가져온 패널 A의인레이 영역입니다. 많은 수의 축산과 미토콘드리아를 기록합니다. (C)관교슬라이스 단면은 200x200x200 μm 의 조직 부피를 통해 대조군 눈열등 측두성 신경 섬유층, 혈관 분면이 세분화되어 있다. (D)신경 섬유층 혈관의 Z-프로젝션. 이 계열은 이 방법론을 사용하여 큰 필드에서 가능한 해상도를 보여 줍니다. 패널 A 스케일 바 = 20 μm. 패널 B 스케일 바 = 2 μm. 이미지 시리즈 복셀 해상도는 97.6x97.6x500 nm입니다. 관심 영역 픽셀 해상도는 24.4x24.4 nm입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
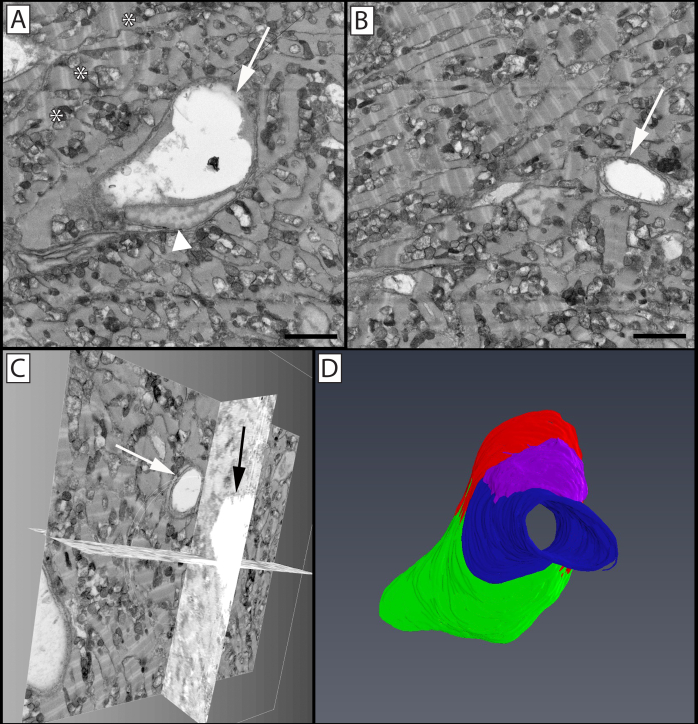
그림 9: 거대한 다니오(Devariomalabaricus)컴팩트 한 심장에서 선박의 분할 및 3D 부피 렌더링. (A)이미지 스택에서 2 차원 현미경 그래프, 중앙 정맥 크기의 용기 (화살표)와 내피 핵 (화살표 촉)의 프로파일을 보여주는, 미토콘드리아가 풍부한 주변 심장 심근 세포와 잘 조직 된 sarcomeres (*). (B)모세관 크기의 용기(arrow)를 가진 이미지 스택의 2차원 현미경 사진. (C)하나의 직교 슬라이스를 통해 투영된 패널 B에서 모세관을 나타내는 현미경 스택의 바이오트호고날 프로젝션. (D)재구성된 혈관을 일렬로 세우는 분할된 내피 세포의 3D 렌더링. 녹색, 빨간색, 파란색 및 보라색으로 도시된 네 개의 분리된 내피 세포; 파란색으로 묘사된 내피 세포는 패널 B(화살표)의 단면에서 볼 수 있으며, 빨간색(화살표) 및 녹색(arrowhead)으로 묘사된 내피 세포는 패널 A. 패널 A 및 B 스케일 바 = 2 μm의 단면에서 볼 수 있다. 재구성된 이미지 블록은 x 및 y 축에서 30x30 μm, 14.6x14.6x100 nm의 복셀 해상도로 z 축의 16 μm입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
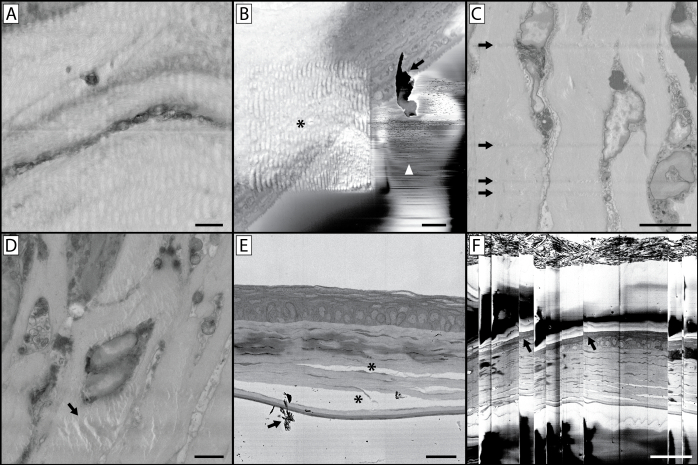
그림 10: 이미징 합병증 및 유물. (A)이 이미지의 물결 모양과 왜곡된 특성은 너무 긴 픽셀 거주 시간을 이용한 이미징의 결과입니다. 이렇게 하면 수지 블록을 가열하여 블록 면이 부드럽고 고무되어 절단 시 왜곡된 이미지가 생성됩니다. (B)이 이미지에는 다양한 유물이 포함되어 있습니다. 별표는 패널 A와 유사한 더 높은 배율및 패널 A에서이전 이미징으로 인한 물결 모양의 왜곡을 나타내며, 더 긴 픽셀 거주 시간으로 더 작은 영역에 빔을 집중시키는 것이 관심 영역에서 수지를 부드럽게 했다. 수집된 배율 이미지가 높을수록 아티팩트가 없지만 관심 영역의 기본 샘플이 왜곡된 것처럼 보이는 후속 일련의 이미지로 이어질 수 있습니다. 이 패널은 또한 이미징 중 블록 면(화살표)에 파편 축적 문제를 보여 주며 패널 E의화살표로 도표된다. 이것이 지속적인 이미징 문제가되면 진공을 부수고 챔버를 열고 다이아몬드 나이프와 샘플 주위에 축적 된 파편을 날려 버릴 필요가 있습니다. 블록 페이스에서 전자의 작은 방전은 흰색 화살촉에 의해 표시된 급속한 대비 변경 및 선으로 이어질 수 있습니다. (C)이 이미지는 블록 얼굴에 칼 스크래치를 보여줍니다. 이는 칼이 손상되거나 칼 가장자리에 파편이 축적되어 발생할 수 있습니다. (D)상기 유물(arrow)은 이미징 챔버에 있는 시료와 함께 장시간 블록 면에 초점을 맞춘 전자 빔의 결과입니다. (E)조직의 부적절한 고정은 세포 구조와 결합 조직의 분리로 이어질 수 있습니다 (*). (F)조직이나 수지 블록에서 다량의 충전이 발생하면, 후속 축적 및 방전이 발생하여 이 이미지에서 볼 수 있듯이 이미지 "건너뛰기"로 이어질 수 있습니다. 이러한 건너뛰는 점(화살표)에서 이미지에 있는 조직의 왜곡을 기록합니다. 패널 A 스케일 바 = 1 μm. 패널 B 스케일 바 = 2 μm. 패널 C 스케일 바 = 5 μm. 패널 D 스케일 바 = 2 μm. 패널 E 스케일 바 = 25 um. 패널 F 스케일 바 = 50 음. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 11: 다양한 픽셀 거주 시간과 빔 강도를 사용하여 3 kV에서 이미징 조직. 모든 이미지는 3kV 빔을 사용하여 수집되었고, 빔 강도는 1에서 20사이의 장치별 스케일에 있다. 이미지된 필드는 백색과 적혈구를 포함하는 혈관 루멘입니다. 이 낮은 kV에서 셀룰러 세부 사항을 감사하기 어렵다. 픽셀 거주 시간을 늘리는 것은 거의 효과가 없었습니다. 빔 강도를 6으로 증가시켜 이미지 대비가 향상되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
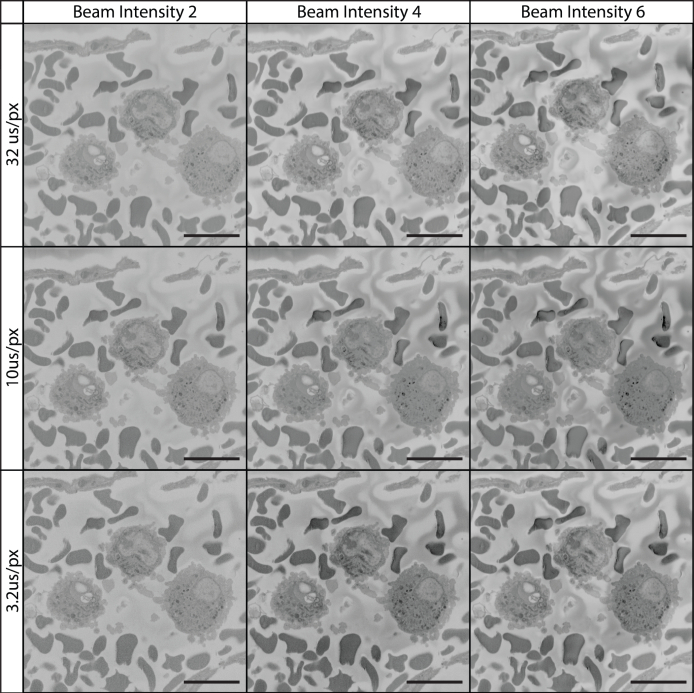
그림 12: 다양한 픽셀 거주 시간과 빔 강도를 사용하여 7 kV에서 이미징 조직. 모든 이미지는 7kV 빔을 사용하여 수집되었고, 빔 강도는 1에서 20사이의 장치별 스케일에 있다. 이미지된 필드는 백색과 적혈구를 포함하는 혈관 루멘입니다. 7 kV에서 빔 강도와 픽셀 거주 시간이 증가하면 고품질 이미징이 향상되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 13: 다양한 픽셀 거주 시간 및 빔 강도를 사용하여 12 kV에서 이미징 조직. 모든 이미지는 12kV 빔을 사용하여 수집되었으며, 빔 강도는 1에서 20사이의 장치별 스케일에 있다. 이미지된 필드는 백색과 적혈구를 포함하는 혈관 루멘입니다. 12kV에서 이미징은 픽셀 거주 시간과 빔 강도를 조정하여 최적화됩니다. 충전은 픽셀 이외 시간 동안 감소/부재 시간이 면불되며 셀룰러 디테일과 이미지 콘트라스트는 픽셀 거주 시간이 길고 빔 강도가 높아가장 좋습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 방법 논문의 목적은 우리의 실험실이 안정적으로 고해상도 직렬 전자 현미경 이미지를 캡처 할 수 있도록 조직 준비 및 이미징 방법론을 강조하고, SBF-SEM 이미징을 수행 할 때 발생할 수있는 잠재적 인 함정뿐만 아니라이 결과로 이어지는 중요한 단계를 지적하는 것입니다. 이 프로토콜을 사용하여 성공하려면 조직의 적절한 고정, 시료에 중금속의 함침, 충전을 줄이기 위한 포함 수지수정, 이미지를 수집하는 데 사용되는 현미경 및 이미징 설정에 대한 이해가 필요합니다. 격언, "품질, 품질 아웃"SBF-SEM 이미징에 적합한 공리입니다. SBF-SEM의 목표는 종종 초구조적 세부 사항의 감사 또는 정량화이기 때문에 조직 왜곡이 발생하지 않도록 고정 전략에 추가주의를 기울여야 합니다. 조직이 시료 준비의 어느 시점에서왜곡되는 경우 (즉, 팽창, 수축, 또는 세포 형태의 중단을 겪는다), 다음 조직 재구성 및 양자화는 정확한 데이터를 산출하지 않습니다. 또한 잘못된 이미징 설정을 사용하면 SBF-SEM 이미징이 파괴적인 과정이기 때문에 다시 캡처할 수 없는 데이터가 손실될 수 있습니다. 또한, 섬세한 다이아몬드 나이프는 성급하거나 잘못된 시료 준비에 의해 손상될 수 있기 때문에 티슈 샘플을 적재할 때주의를 기울여야 합니다. 이로 인해 칼에 칩이 나 파손되어 이미지에 눈에 보이는 스크래치 자국이 남을 수있습니다(그림 10C). 다이아몬드 나이프는 석회화 된 구조, 단단한 과립 또는 실수로 내장 된 유리 (예 : 시약 증폭기)에 의해 손상 될 수 있습니다.
현재까지 SBF-SEM 문헌의 대부분은 1~3kV 범위의 빔 가속 전압을 픽셀 거주 시간과 함께 1-5 μs/px에 가깝게 사용한다(그림 11)45,46,47,48,49, 현재 프로토콜은 7-12 kV의 가속 전압과 직렬 이미징을 위한 12 μs/px의 픽셀 거주 시간을 사용하고, 관심 있는 이미징 영역에 대해 32 μs/px를 사용합니다(그림 12 및 13). 이러한 설정은 100-200 nm의 슬라이스 두께와 결합되어 광범위한 생물학적 조직의 고품질 및 고해상도 이미징을 허용합니다. 가속 전압이 증가하면 대비, 해상도, 신호 대 잡음 비율이 증가합니다. 낙후 시간이 증가하면 해상도와 신호 대 잡음 비율이 증가하고 슬라이스 두께가 증가하면 단면이 저하되고 후속 이미지에서 빔으로 인한 손상을 방지합니다.14. 이 이미징 방법은 규칙과 다를 수 있지만 생성된 이미지와 데이터 집합은 스스로 말합니다. 이 성공 이유를 추측해야 한다면 높은 kV 값, 픽셀 거주 시간 및 블록 준비의 독특한 조합의 결과일 수 있습니다. 이미징 kV가 증가하면 전자 빔과 샘플 간의 상호 작용 부피가 증가합니다. 이러한 상호작용부피는 더 깊어질 뿐만 아니라 더 넓어 시료 블록 내에서 더 깊은 곳에서 유래되는 전자의 수또는 지름이 증가함에 따라 조직의 넓은 단면에서 발생하는 이론적 증가를 초래한다. SBF-SEM은 블록의 표면 세부 사항에 관심이 있기 때문에 신호 대 잡음 비율이 이론적으로 감소합니다. 그러나, kV의 증가는 또한 전자를 블록에서 벗어나 검출기에 의해 수집된 전자에 기여할 가능성이 적은 샘플로 깊숙이 밀어 넣는다. 더 긴 픽셀 거주 시간 및 높은 빔 강도를 통해 증가 된 신호의 추가 이점으로, 이 이미징 방법은 상호 작용 볼륨 내에서 발생하는 잡음과 관련하여 샘플 표면에서 신호의 큰 증가를 초래 할 수있다. 또한, 카본 블랙과 실버 및 골드 코팅으로 도입된 샘플 전도도가 증가하면 블록 내에서 더 깊고 블록 페이스에서 더 멀리 발생하는 전하 축적을 개선합니다. 참으로 그림 11, 그림 12, 그림 13 kV가 증가하면 샘플 충전이 증가하면 잠재적으로 블록 깊숙이 밀려나기 시작합니다. 낮은 배율로 이미지된 샘플은 기존 설정을 사용하여 적절한 대비로 캡처할 수 있지만 이러한 이미지는 면밀한 검사 시 세부 사항이 부족한 경우가 많습니다. 우리의 데이터는 목표가 셀룰러 세부 사항인 비교적 높은 배율을 사용할 때 기존의 설정을 늘리면 탁월한 결과를 얻을 수 있음을 분명히 보여줍니다. P. Goggin에 의해 2020 기사, 등 은 최종 이미지 품질에 이미징 설정을 변경의 효과를 요약하는 유용한 테이블을 제공하고, 새로운 조직에 대한 프로토콜을 최적화하는 것이 필요하게되면 상담하는 것이 유용한 참조입니다14. 이 프로토콜에 권장되는 100-200 nm 슬라이스 두께는 빠른 속도로 대형 SBF-SEM 데이터 세트를 수집할 수 있는 추가이 있습니다. 예를 들어 12μs/px에서 이미지를 수집하는 동안 2048x2048 px에서 100 μm 깊이를 이미징하는 동안 100nm/섹션에서 단면하는 동안 ~14시간이 필요하지만 25nm/단면에서 단면화하면 ~56시간이 소요됩니다. x,y 해상도는 섹션 두께의 결과로 변경되지 않고 더 큰 섹션과 함께 제공되는 더 높은 kV 값과 픽셀 거주 시간을 사용하여 이미지할 수 있는 추가 기능을 고려하지 않지만 z축을 따라 해상도가 저하되는 것이 중요합니다. z-해상도의 손실은 중요한 고려 사항이며 조직이 수지 블록과 이미징 평면과 관련하여 어떻게 지향되어야하는지 결정할 때 고려해야하며, 더 작은 세포 특징 또는 상호 작용 (예를 들어, 수십 나노미터의 규모에 대한 시냅스 질 또는 세포 내 특징)의 연구를 배제 할 가능성이 있습니다. 그러나, 급속한 화상 진찰 시간 이외에, 이 프로토콜은 희소한 생물학 사건 또는 세포의 연구 결과 뿐만 아니라 입체 분석을 위한 이상적인 데이터 세트를 급속하게 생성한다는 점에서 추가적인 추가 이득이 있습니다. 더 큰 단면 두께는 또한 수동 3D 재구성에 도움이 될 수 있습니다, 100 nm / 섹션에서 섹션으로 섹션100 μm 영역은 1,000 이미지의 수동 세분화가 필요하고 동일한 영역은 25 nm / 섹션에서 단면 4,000 이미지의 수동 세분화가 필요합니다.
SBF-SEM은 비교적 짧은 기간에 대규모 데이터 집합을 생성하는 이점이 있습니다. 데이터 분석은 아래 설명할 입체학과 같은 정량적 방법을 사용하여 수행 될 수 있지만 이미지 세분화를 통해 3D 재구성을 만드는 것이 유익할 수 있습니다. SBF-SEM을 사용하여 생성된 이미지 스택은 복셀 컬렉션으로 생각할 수 있으며, 세분화는 이러한 복셀을 사용자 정의 개체에 할당하여 조직 구조의 3D 표현을 생성하는 과정입니다. 이러한 재구성은 종종 조직 초구조및 세포 세포 상호작용에 대한 본보기가 없는 원근을제공한다(도 5, 도 6, 도 7, 도 8, 도 9). 더욱이, 일단 재건이 만들어지면 재건에 내재된 데이터를 사용하여 분할된 조직에서 풍부한 정보를 추출할 수 있다. 표면적, 볼륨, 길이 및 거리뿐만 아니라 각별 데이터에 이르기까지 매개 변수는 모두재구성이 50,51을생성하면 쉽게 사용할 수 있습니다. 특히 재구성된 데이터 세트에서 가져온 비디오 및 이미지와 결합하면 매우 유용할 수 있지만, SBF-SEM 데이터 집합의 데이터를 추정하려고 할 때 수동 세분화에 필요한 시간은 매우 중요합니다. 현재 SBF-SEM 이미지 스택의 수동 및 반수동 세분화에 사용할 수 있는 무료 소프트웨어와 사용 가능한 소프트웨어가 많이 있습니다. 재건 소프트웨어에 대한 하나의 무료 옵션은 이미지 처리 패키지 피지 포 ImageJ, 오픈 소스 이미지 처리 프로그램, 수동 세분화를 허용하는 세분화 편집기 플러그인을 포함52,53. 또한 소프트웨어 재구성은 대체 무료 세분화 옵션54(그림 8)를제공합니다. 잠재적으로 비용이 많이 드는 사용 가능한 옵션에는 반자동 세분화 프로세스 또는 영화 및 이미지 생성 제품군과 같은 보다 강력한 기능 집합이 포함되어 있는 경우가 많습니다. 이러한 옵션 중 하나는 그림 5, 그림6, 그림 7 및 그림 9 (재료 표에서사용할 수있는 세부 정보)에서 발견 된 재구성을 만드는 데 사용되었습니다. 또한 가상 현실을 사용하여 대비 기반 3D 재구성의 생성, 분석 및 렌더링을 위해 공구를 사용할 수 있으며, 이는 재건 프로세스의 속도를 크게 높일 수있다 20,55. 항상 모든 응용 프로그램에서 사용할 수 있지만, 소프트웨어 도구의 호스트는 크게 세그먼트에 필요한 시간을 줄일 수있는 컴퓨터 지원 수동 세분화에 사용할 수있습니다 56,57,58. 사용 된 소프트웨어에 관계없이, 상당한 사전 생각과 응답되는 질문에 대한 이해, 또는 연속 재구성에 의해 채워질 지식의 격차는 프로세스가 힘들고 시간 집약적이기 때문에 세분화를 선행해야합니다.
3D 재건의 생산은 자체 고려 사항과 함께 제공됩니다. 더 큰 데이터 세트를 사용하면 처리 능력이 제한 요소일 수 있으므로 시스템 리소스의 사용을 최적화하는 것은 생산적인 워크플로우를 유지하고 재구성 및 렌더링 프로세스를 가속화하는 데 매우 중요합니다. 3D 재구성을 렌더링할 때 대부분의 소프트웨어는 분할된 이미지 스택을 상호 연결된 삼각형으로 구성된 표면으로 변환합니다. 재구성 프로젝트가 크거나 복잡하면 이러한 삼각형렌더링에는 많은 컴퓨팅 성능이 필요할 수 있습니다. 3D 재구성 작업을 하는 동안 재구성 소프트웨어가 분할된 이미지를 재구성된 표면으로 변환하는 데 사용할 수 있는 삼각형 수를 제한하는 것이 유용할 수 있습니다. 이는 세분화 과정에서 3D 재구성의 진행 상황을 모니터링하는 데 유용할 수 있습니다. 세분화가 완료되면 재구성의 이미지 또는 비디오를 렌더링하기 전에 삼각형 제한을 제거할 수 있습니다. 또는, 재구성 소프트웨어가 허용하는 경우, 우리는 표면 생성보다는 볼륨 렌더링을 사용하여 재건의 진행 상황을 모니터링 하는 성공을 발견했다. 볼륨 렌더링은 게시 또는 프레젠테이션을 위한 이미지 나 비디오에 적합하지 는 않지만 처리 능력이 훨씬 적기 때문에 재구성의 이미지와 비디오를 재구성하고 준비할 때 원활한 경험을 제공하는 데 도움이 될 수 있습니다. 또한 SBF-SEM 데이터 집합을 수동으로 분할하여 자체 고유 식별자로 재구성할 모든 개체를 정의하는 것이 좋습니다. 상피 세포의 필드가 예를 들어 재구성되는 경우, "상피"라는 제목의 복셀 그룹에 모든 상피 세포를 할당하는 대신, 각 상피 세포는 자신의 모니커 (즉, Epi1, Epi2, Epi3 등)를 할당해야합니다. 이는 각 셀이 최종 렌더링에서 포함되거나 제외되거나, 서로 다른 색상이나 투명도가 할당되거나, 비디오가 생성되는 경우 개별적으로 제거하거나 도입할 수 있으므로 재구성이 완료되면 더 큰 자유를 누릴 수 있습니다. 또한 이렇게 하면 오브젝트 그룹 전체가 아닌 각 재구성된 개체에서 표면적 또는 볼륨과 같은 메트릭을 수집할 수 있습니다.
SBF-SEM 이미지 스택에서 정량적 데이터를 추출하기 위한 또 다른 매우 강력한 도구는 입체학의 관행입니다. 입체학은 3차원 개체와 2차원 표현(즉, 전자 현미경 사진)의 고유한 수학적 관계를 활용합니다. SBF-SEM 데이터 세트는 세분화된 재구성과 비교할 때 대량 데이터 집합에서 3D 정보를 추출하는 이 방법은 시간 및 노동 집약적시간이 상당히 적기 때문에 입체학의 적용에 이상적입니다. 입체학은 일반적으로 임의, 균일하게 샘플링 된 이미지에 기하학적 그리드를 적용하는 것으로 구성되며 셀 / 세포 기관 수, 길이, 표면 적 및부피21,59,60,61,62, 63의정확하고 공정한 추정을 생성하기 위해 지난 50 년 동안 광범위하게 사용되어 왔다. 3D 재구성은 인상적이고 생물학적 조직에 대한 새로운 관점을 제공할 수 있지만, 데이터 추출에 대한 입체적 접근 방식을 사용하는 것이 더 빠르고 정확하며 재현 가능하며 도움이 됩니다. 입체64,65,66의실용적 적용을 논의하는 논문이 많지만, 다수의 교과서는 방법론에 대한 유용하고 심층적인 개요를 제공할 뿐만 아니라 조직초구조67,68,69의연구에 적용될 수 있는 다수의 입체그리드를 제공한다.
SBF-SEM은 조직 초구조의 3차원 감사를 허용하는 강력한 이미징 방법입니다. SEM 해상도로 3D 데이터 세트를 만드는 능력은 이전에 는 대답할 수 없는 질문을 우리의 도달 범위 내에 두고 있지만, 적절한 조직 준비와 SBF-SEM 이미징에 대한 이해는 이 현미경 법을 활용하는 연구의 성공에 가장 중요합니다. 이 프로토콜을 미래 연구에 적용하면 우리를 둘러싼 생물학적 신비에 대한 더 크고 더 큰 통찰력으로 이어지고, 인간 지식의 국경으로 우리를 계속 밀어 붙일 수 있기를 바랍니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
샘 핸런 박사, 에블린 브라운, 마가렛 곤도 박사의 뛰어난 기술 지원에 감사드립니다. 이 연구는 국립 보건원 (NIH) R01 EY-018239 및 P30 EY007551 (국립 안과 연구소)에 의해 부분적으로 지원되었으며, 부분적으로 NIH 1R15 HD084262-01 (국립 아동 건강 및 인간 발달 연구소)에 의해 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1/16 x 3/8 Aluminum Rivets | Industrial Rivet & Fastener Co. | 6N37RFLAP/1100 | Used as specimen pins. |
| 2.5mm Flathead Screwdriver | Wiha Quality Tools | 27225 | |
| Acetone | Electron Microscopy Sciences | RT 10000 | Used to dilute silver paint. |
| Aspartic Acid | Sigma-Aldrich | A8949 | |
| Calcium Chloride | FisherScientific | C79-500 | |
| Conductive Silver Paint | Ted Pella | 16062 | |
| Denton Desk-II Vacuum Sputtering Device equipped with standard gold foil target | Denton Vacuum | N/A | This is the gold-sputtering device used by the authors, alternates are acceptable. |
| Double-edged Razors | Fisher Scientific | 50-949-411 | |
| Embed 812 | Electron Microscopy Sciences | 14120 | |
| Gatan 3View2 mounted in a Tescan Mira3 Field emission SEM | Gatan & Tescan | N/A | This is the SBF-SEM device used by the authors, alternates are acceptable. |
| Glass Shell Vials, 0.5 DRAM (1.8 ml) | Electron Microscopy Sciences | 72630-05 | |
| Gluteraldehyde | Electron Microscopy Sciences | 16320 | |
| Gorilla Super Glue - Impact Tough | NA | NA | Refered to as cyanoacrylate glue in text. |
| Ketjen Black | HM Royal | EC-600JD | Refered to as carbon black in text. |
| KOH | FisherScientific | 18-605-593 | |
| Lead Nitrate | Fisher Scientific | L62-100 | |
| Microwave | Pelco | BioWave Pro | This is the microwave used by the authors, alternates are acceptable. |
| Osmium Tetroxide | Sigma-Aldrich | 201030 | |
| Potassium Ferrocyanide | Sigma-Aldrich | P9387 | |
| Silicone Embedding Mold | Ted Pella | 10504 | |
| Sodium Cacodylate Trihydrate | Electron Microscopy Sciences | 12300 | |
| Samco Transfer Pipette | ThermoFisher Scientific | 202 | Used to make specimen pin storage tubes. |
| Swiss Pattern Needle Files | Electron Microscopy Sciences | 62115 | |
| Thiocarbohydrazide | Sigma-Aldrich | 223220 | |
| Uranyl Acetate | Polysciences, Inc. | 21447-25 | |
| Reconstruction Software | |||
| Amira Software | Thermo Scientific | N/A | Used to create the reconstructions found in figures 5-7 and 9. |
| Fiji (Fiji is Just ImageJ) | ImageJ.net | N/A | TrakEM2 can be added to Fiji to asist in manual segmentation. |
| Microscopy Image Browser (MIB) | University of Helsinki, Institute of Biotechnology | N/A | |
| Reconstuct Software | Neural Systems Lab | N/A | |
| SuRVoS Workbench | Diamond Light Source & The University of Nottingham | N/A | |
| SyGlass | IstoVisio, Inc. | N/A | Allows for reconstruction in virtual reality and histogram-based reconstruction methods. |
참고문헌
- Leighton, S. B. SEM images of block faces, cut by a miniature microtome within the SEM - a technical note. Scanning Electron Microscopy. , Pt 2 73-76 (1981).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three-dimensional tissue nanostructure. PLOS Biology. 2 (11), 329(2004).
- He, Q., Hsueh, M., Zhang, G., Joy, D. C., Leapman, R. D. Biological serial block face scanning electron microscopy at improved z-resolution based on Monte Carlo model. Scientific Reports. 8 (1), 12985(2018).
- Zankel, A., Wagner, J., Poelt, P. Serial sectioning methods for 3D investigations in materials science. Micron. 62, 66-78 (2014).
- Titze, B., Genoud, C. Volume scanning electron microscopy for imaging biological ultrastructure. Biology of the Cell. 108 (11), 307-323 (2016).
- Ohta, K., et al. Beam deceleration for block-face scanning electron microscopy of embedded biological tissue. Micron. 43 (5), 612-620 (2012).
- Bouwer, J. C., et al. Deceleration of probe beam by stage bias potential improves resolution of serial block-face scanning electron microscopic images. Advanced Structural and Chemical Imaging. 2 (1), 11(2017).
- Kizilyaprak, C., Longo, G., Daraspe, J., Humbel, B. M. Investigation of resins suitable for the preparation of biological sample for 3-D electron microscopy. Journal of Structural Biology. 189 (2), 135-146 (2015).
- Kittelmann, M., Hawes, C., Hughes, L. Serial block face scanning electron microscopy and the reconstruction of plant cell membrane systems. Journal of Microscopy. 263 (2), 200-211 (2016).
- Biazik, J., Vihinen, H., Anwar, T., Jokitalo, E., Eskelinen, E. L. The versatile electron microscope: an ultrastructural overview of autophagy. Methods. 75, 44-53 (2015).
- Peddie, C. J., Collinson, L. M. Exploring the third dimension: Volume electron microscopy comes of age. Micron. 61, 9-19 (2014).
- Piňos, J., Mikmeková, Š, Frank, L. About the information depth of backscattered electron imaging. Journal of Microscopy. 266 (3), 335-342 (2017).
- Smith, D., Starborg, T. Serial block face scanning electron microscopy in cell biology: Applications and technology. Tissue Cell. 57, 111-122 (2019).
- Goggin, P., et al. Development of protocols for the first serial block-face scanning electron microscopy (SBF SEM) studies of bone tissue. Bone. 131, 115107(2020).
- Deerinck, T. J., et al. High-performance serial block-face SEM of nonconductive biological samples enabled by focal gas injection-based charge compensation. Journal of Microscopy. 270 (2), 142-149 (2018).
- Nguyen, H. B., et al. Conductive resins improve charging and resolution of acquired images in electron microscopic volume imaging. Scientific Reports. 6, 23721(2016).
- Deerinck, T. J., Bushong, E. A., Thor, A., Ellisman, M. H. NCMIR methods for 3D EM: a new protocol for preparation of biological specimens for serial block face scanning electron microscopy. National Center for Microscopy and Imaging Research. 6 (8), (2010).
- Deerinck, T. J., et al. Enhancing Serial Block-Face Scanning Electron Microscopy to Enable High Resolution 3-D Nanohistology of Cells and Tissues. Microscopy and Microanalysis. 16, 1138-1139 (2010).
- Kubota, Y. New developments in electron microscopy for serial image acquisition of neuronal profiles. Microscopy (Oxf). 64 (1), 27-36 (2015).
- Courson, J. A., et al. Serial block-face scanning electron microscopy: A provocative technique to define 3-dimensional ultrastructure of microvascular thrombosis. Thrombosis Research. 196, 519-522 (2020).
- Courson, J. A., et al. Serial block-face scanning electron microscopy reveals neuronal-epithelial cell fusion in the mouse cornea. PLoS One. 14 (11), 0224434(2019).
- Lafontant, P. J., et al. Cardiac Myocyte Diversity and a Fibroblast Network in the Junctional Region of the Zebrafish Heart Revealed by Transmission and Serial Block-Face Scanning Electron Microscopy. PLoS One. 8 (8), 72388(2013).
- Hanlon, S. D., Behzad, A. R., Sakai, L. Y., Burns, A. R. Corneal stroma microfibrils. Experimental Eye Research. 132, 198-207 (2015).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- Davenport, A. T., Grant, K. A., Szeliga, K. T., Friedman, D. P., Daunais, J. B. Standardized method for the harvest of nonhuman primate tissue optimized for multiple modes of analyses. Cell Tissue Bank. 15 (1), 99-110 (2014).
- Schuster, A., et al. An isolated perfused pig heart model for the development, validation and translation of novel cardiovascular magnetic resonance techniques. Journal of Cardiovascular Magnetic Resonance. 12 (1), 53(2010).
- Hanlon, S. D., Patel, N. B., Burns, A. R. Assessment of postnatal corneal development in the C57BL/6 mouse using spectral domain optical coherence tomography and microwave-assisted histology. Experimental Eye Research. 93 (4), 363-370 (2011).
- Longiéras, N., Sebban, M., Palmas, P., Rivaton, A., Gardette, J. L. Multiscale approach to investigate the radiochemical degradation of epoxy resins under high-energy electron-beam irradiation. Journal of Polymer Science Part A: Polymer Chemistry. 44 (2), 865-887 (2006).
- Hashimoto, T., Thompson, G. E., Zhou, X., Withers, P. J. 3D imaging by serial block face scanning electron microscopy for materials science using ultramicrotomy. Ultramicroscopy. 163, 6-18 (2016).
- Rouquette, J., et al. Revealing the high-resolution three-dimensional network of chromatin and interchromatin space: A novel electron-microscopic approach to reconstructing nuclear architecture. Chromosome Research. 17 (6), 801(2009).
- Briggman, K. L., Helmstaedter, M., Denk, W. Wiring specificity in the direction-selectivity circuit of the retina. Nature. 471 (7337), 183-188 (2011).
- Katoh, K. Microwave-Assisted Tissue Preparation for Rapid Fixation, Decalcification, Antigen Retrieval, Cryosectioning, and Immunostaining. International Journal of Biochemistry & Cell Biology. 2016, 7076910(2016).
- Login, G. R., Dvorak, A. M. A review of rapid microwave fixation technology: its expanding niche in morphologic studies. Scanning. 15 (2), 58-66 (1993).
- Jamur, M. C., Faraco, C. D., Lunardi, L. O., Siraganian, R. P., Oliver, C. Microwave fixation improves antigenicity of glutaraldehyde-sensitive antigens while preserving ultrastructural detail. Journal of Histochemistry and Cytochemistry. 43 (3), 307-311 (1995).
- Leong, A. S., Sormunen, R. T. Microwave procedures for electron microscopy and resin-embedded sections. Micron. 29 (5), 397-409 (1998).
- Willingham, M. C., Rutherford, A. V. The use of osmium-thiocarbohydrazide-osmium (OTO) and ferrocyanide-reduced osmium methods to enhance membrane contrast and preservation in cultured cells. Journal of Histochemistry and Cytochemistry. 32 (4), 455-460 (1984).
- Khan, A. A., Riemersma, J. C., Booij, H. L. The reactions of osmium tetroxide with lipids and other compounds. Journal of Histochemistry and Cytochemistry. 9, 560-563 (1961).
- Belazi, D., Solé-Domènech, S., Johansson, B., Schalling, M., Sjövall, P. Chemical analysis of osmium tetroxide staining in adipose tissue using imaging ToF-SIMS. Histochemistry and Cell Biology. 132 (1), 105-115 (2009).
- Rivlin, P. K., Raymond, P. A. Use of osmium tetroxide-potassium ferricyanide in reconstructing cells from serial ultrathin sections. Journal of Neuroscience Methods. 20 (1), 23-33 (1987).
- Aguas, A. P. The use of osmium tetroxide-potassium ferrocyanide as an extracellular tracer in electron microscopy. Stain Technology. 57 (2), 69-73 (1982).
- Seligman, A. M., Wasserkrug, H. L., Hanker, J. S. A new staining method (OTO) for enhancing contrast of lipid--containing membranes and droplets in osmium tetroxide--fixed tissue with osmiophilic thiocarbohydrazide(TCH). Journal of Cell Biology. 30 (2), 424-432 (1966).
- Watson, M. L. Staining of tissue sections for electron microscopy with heavy metals. II. Application of solutions containing lead and barium. Journal of Biophysical and Biochemical Cytology. 4 (6), 727-730 (1958).
- Zhou, W., Apkarian, R., Wang, Z., Joy, D. Fundamentals of Scanning Electron Microscopy. Scanning Microscopy in Nanotechnology. , 1-40 (2006).
- Tapia, J. C., et al. High-contrast en bloc staining of neuronal tissue for field emission scanning electron microscopy. Nature Protocols. 7 (2), 193-206 (2012).
- Buchacker, T., et al. Assessment of the Alveolar Capillary Network in the Postnatal Mouse Lung in 3D Using Serial Block-Face Scanning Electron Microscopy. Frontiers in Physiology. 10, 1357(2019).
- Keeling, E., et al. 3D-Reconstructed Retinal Pigment Epithelial Cells Provide Insights into the Anatomy of the Outer Retina. International Journal of Molecular Sciences. 21 (21), (2020).
- Shang, P., et al. Chronic Alcohol Exposure Induces Aberrant Mitochondrial Morphology and Inhibits Respiratory Capacity in the Medial Prefrontal Cortex of Mice. Frontiers in Neuroscience. 14, 561173(2020).
- Pfeifer, C. R., et al. Quantitative analysis of mouse pancreatic islet architecture by serial block-face SEM. Journal of Structural Biology. 189 (1), 44-52 (2015).
- Wilke, S. A., et al. Deconstructing complexity: serial block-face electron microscopic analysis of the hippocampal mossy fiber synapse. Journal of Neuroscience. 33 (2), 507-522 (2013).
- Cocks, E., Taggart, M., Rind, F. C., White, K. A guide to analysis and reconstruction of serial block face scanning electron microscopy data. Journal of Microscopy. 270 (2), 217-234 (2018).
- Borrett, S., Hughes, L. Reporting methods for processing and analysis of data from serial block face scanning electron microscopy. Journal of Microscopy. 263 (1), 3-9 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529(2017).
- Fiala, J. C. Reconstruct: a free editor for serial section microscopy. Journal of Microscopy. 218, Pt 1 52-61 (2005).
- Pidhorskyi, S., Morehead, M., Jones, Q., Spirou, G., Doretto, G. syGlass: interactive exploration of multidimensional images using virtual reality Head-mounted displays. arXiv . , arXiv:1804.08197 (2018).
- Cardona, A., et al. TrakEM2 software for neural circuit reconstruction. PLoS One. 7 (6), 38011(2012).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy Image Browser: A Platform for Segmentation and Analysis of Multidimensional Datasets. PLOS Biology. 14 (1), 1002340(2016).
- Luengo, I., et al. SuRVoS: Super-Region Volume Segmentation workbench. Journal of Structural Biology. 198 (1), 43-53 (2017).
- Anderson, H. R., Stitt, A. W., Gardiner, T. A., Archer, D. B. Estimation of the surface area and volume of the retinal capillary basement membrane using the stereologic method of vertical sections. Analytical & Quantitative Cytology & Histology. 16 (4), 253-260 (1994).
- Gibbons, C. H., Illigens, B. M., Wang, N., Freeman, R. Quantification of sweat gland innervation: a clinical-pathologic correlation. Neurology. 72 (17), 1479-1486 (2009).
- Knust, J., Ochs, M., Gundersen, H. J., Nyengaard, J. R. Stereological estimates of alveolar number and size and capillary length and surface area in mice lungs. Anat Rec. 292 (1), Hoboken. 113-122 (2009).
- Mahon, G. J., et al. Chloroquine causes lysosomal dysfunction in neural retina and RPE: implications for retinopathy. Current Eye Research. 28 (4), 277-284 (2004).
- Michel, R. P., Cruz-Orive, L. M. Application of the Cavalieri principle and vertical sections method to lung: estimation of volume and pleural surface area. Journal of Microscopy. 150, Pt 2 117-136 (1988).
- Weibel, E. R. Stereological methods in cell biology: where are we--where are we going. Journal of Histochemistry and Cytochemistry. 29 (9), 1043-1052 (1981).
- Schmitz, C., Hof, P. R. Design-based stereology in neuroscience. Neuroscience. 130 (4), 813-831 (2005).
- Kristiansen, S. L., Nyengaard, J. R. Digital stereology in neuropathology. Apmis. 120 (4), 327-340 (2012).
- Howard, C. V., Reed, M. G. Unbiased Stereology. 2nd edn. , Garland Science/BIOS Scientific Publishers. (2005).
- Reith, A., Mayhew, T. M. Stereology and Morphometry in Electron Microscopy: Problems and Solutions. , Hemisphere Publishing Corporation. (1988).
- Mouton, P. R. Principles and practices of unbiased stereology: an introduction for bioscientists. , Johns Hopkins University Press. (2002).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유
당사 웹 사이트에서는 사용자의 경험을 향상시키기 위해 쿠키를 사용합니다.
당사 웹 사이트를 계속 사용하거나 '계속'을 클릭하는 것은 당사 쿠키 수락에 동의하는 것을 의미합니다.