Method Article
Одновременное циклометрическое использование потока нескольких типов клеток, извлеченных из мозга мыши / спинного мозга с помощью различных методов гомогенизации
В этой статье
Резюме
Мы представляем метод цитометрии потока для идентификации одновременно различных типов клеток, извлеченных из мозга мыши или спинного мозга. Этот метод может быть использован для изоляции или характеристики чистых популяций клеток при нейродегенеративных заболеваниях или для количественной оценки степени ориентации клеток на in vivo вирусных векторов или наночастиц.
Аннотация
Недавние достижения в области вирусного вектора и наноматериальных наук открыли путь для новых передовых подходов к исследованию или манипулированию центральной нервной системой (ЦНС). Однако дальнейшая оптимизация этих технологий будет способствовать методам, позволяющим быстро и упорядочить определение степени ЦНС и клеточного таргетинга при приеме вирусных векторов или наночастиц в организме. Здесь мы представляем протокол, который использует высокую пропускную способность и мультиплексирование возможности цитометрии потока, чтобы позволить простой количественной оценки различных подтипов клеток, изолированных от мозга мыши или спинного мозга, а именно микроглии / макрофагов, лимфоцитов, астроцитов, олигодендроцитов, нейронов и эндотелиальных клеток. Мы применяем этот подход, чтобы подчеркнуть критические различия между двумя методами гомогенизации тканей с точки зрения урожайности клеток, жизнеспособности и состава. Это может поручить пользователю выбрать лучший метод в зависимости от типа ячейки (ы) интереса и конкретного приложения. Этот метод не подходит для анализа анатомического распределения, так как ткань гомогенизирована для создания одноклеточной суспензии. Тем не менее, это позволяет работать с жизнеспособными клетками и может быть объединена с клеточной сортировкой, открывая путь для нескольких приложений, которые могли бы расширить репертуар инструментов в руках нейробиолога, начиная от создания первичных культур, полученных из чистоклеточных популяций, до анализа генной экспрессии и биохимических или функциональных анализов на четко определенных подтипах клеток в контексте нейрогенеративных заболеваний, на фармакологическом лечении или генной терапии.
Введение
Технологии доставки генов и лекарств (таких как вирусные векторы и наночастицы) стали мощным инструментом, который может быть применен, чтобы получить лучшее представление о конкретных молекулярных путей, измененных в нейродегенеративных заболеваний и для развития инновационных терапевтических подходов1,2,3. Оптимизация этих инструментов основывается на количественной оценке: (1) степень проникновения в ЦНС на различных путях управления и (2) ориентации на конкретные популяции ячеек. Гистологические анализы обычно применяются для визуализации флуоресцентных генов репортера или флуоресцентно помеченных наночастиц в различных областях ЦНС и в различных типах клеток, выявленных иммуномаркировкой для конкретных маркеров клеток4,5. Несмотря на то, что этот подход предоставляет ценную информацию о биораспределении вводимых генов или инструментов доставки лекарств, этот метод может быть трудоемким и трудоемким, поскольку он требует: (1) фиксации тканей, криоконсервации или встраивания парафина и нарезки; (2) окрашивание для конкретных клеточных маркеров, иногда требующих поиска антигена; (3) приобретение флуоресценции микроскопии, которая обычно позволяет анализ ограниченного числа различных маркеров в рамках одного и того же эксперимента; (4) обработка изображений, чтобы обеспечить надлежащую количественную оценку сигнала интереса.
Цитометрия потока стала широко используемой техникой, которая использует очень специфические флуоресцентные маркеры, позволяющие не только быстрой количественной оценки различных клеточных фенотипов в клеточных суспензиях, основанных на экспрессии поверхностных или внутриклеточных антигенов, но и функциональных измерений (например, скорость апоптоза, пролиферания, анализ клеточного цикла и т.д.). Возможна также физическая изоляция клеток через флуоресцентную активированную сортировку клеток, что позволяет дополнительно приступить к применению ниже по течению (например, клеточная культура, РНК, биохимический анализ и т.д.) 6,7,8.
Ткань гомогенизации является критическим шагом, необходимым для получения одной подвески клеток, чтобы надежные и воспроизводимые вниз по течению потока цитометрических оценок. Различные методы были описаны для взрослых гомогенизации мозговой ткани, в основном с целью изоляции микроглии клеток9,10,11; они могут быть классифицированы в целом в двух основных категориях: (1) механическая диссоциация, которая использует шлифовальные или сдвига силы через Dounce гомогенизатор (DH), чтобы разорвать клетки из своих ниш и образуют относительно гомогенизированные одной клетки подвески, и (2) ферментативное пищеварение, которое опирается на инкубацию измельченных тканей куски при 37 градусов по Цельсию в присутствии протеолитических ферментов, таких как трипсин или папаин, в пользу деградации внеклеточной матрицы для создания довольно однородной клеточной суспензии12.
Независимо от того, какой метод используется, шаг очистки рекомендуется после гомогенизации тканей, чтобы удалить миелин через центрифугирование на градиент плотности или магнитным отбором9,12, перед переходом к приложениям вниз по течению.
Здесь мы описываем метод обработки тканей на основе пищеварения папанов (PD), а затем очищение на градиент плотности, оптимизированы для получения жизнеспособных неоднородных клеточных суспензий из мозга мыши или спинного мозга в чувствительных к времени образом и подходит для потока цитометрии. Кроме того, мы описываем 9-цветной цитометрии потока панели и gating стратегии мы приняли в лаборатории, чтобы позволить одновременной дискриминации различных популяций ЦНС, живых / мертвых клеток или положительность для флуоресцентных репортеров, таких как зеленый флуоресцентный белок или родамина красителя. Применяя этот цитометрический анализ потока, мы можем сравнить различные методы обработки тканей, т.е. PD против DH, с точки зрения сохранения жизнеспособности клеток и урожайности различных типов клеток.
Детали, которые мы предоставляем в данном проекте, могут поручить решение о протоколе гомогенизации и комбинации антител для использования в панели цитометрии потока, основанной на конкретном типе клеток (ы) интереса и анализе вниз по течению (например, чувствительных к температуре применения, отслеживание конкретных флуоресцентных маркеров, культура in vitro, функциональный анализ).
протокол
Все методы, описанные здесь, были одобрены Институциональным комитетом по уходу и использованию животных (IACUC) Института рака Даны Фарбер (протокол No 16-024).
1. Подготовка решений, необходимых для эксперимента
- Приготовьте сбалансированный солевой раствор 1x Hank (HBSS), разбавив 10x HBSS стерильной водой. Предварительно охладите раствор на льду. Для каждого образца требуется не менее 25 мл раствора.
- Подготовка изотонического решения Percoll (IPS) путем смешивания 10x стерильных HBSS 1:10 со средой градиента плотности (т.е. Percoll). Предварительно охладить на льду.
ПРИМЕЧАНИЕ: IPS может храниться до 30 дней при 4 градусах Цельсия. - Подготовка потока цитометрии (FACS) блокирование (BL) решение (1% бычьей сыворотки альбумина (BSA), 5% плода крупного рогатого скота сыворотки (FBS) в фосфат-буферный солен (PBS). Предварительно охладить на льду.
2. Эвтаназия животных путем внутрисердечной перфузии и рассечения тканей
ПРИМЕЧАНИЕ: Восьминедельные мыши C57BL/6J, обоий пол, были использованы в экспериментах. Перфузия с раствором PBS выполняется для устранения загрязнения крови из органов, прежде чем приступить к пищеварению тканей.
- Анестезия мыши с помощью смеси кетамина / ксилазина (90-200 мг/кг кетамина, 10 мг/кг ксилазина). Поместите мышь на спину и ленты каждой конечности до поддержки. Проверьте адекватную глубину анестезии, проверяя рефлекс вывода.
- Сделайте разрез кожи средней линии на уровне грудного впуска, чтобы разоблачить грудину. Используйте щипцы, чтобы схватить кончик грудины, а затем сделать один 1 см разрез на каждой стороне грудной клетки. Наконец прорезать диафрагму и открыть грудину достаточно широко, чтобы визуализировать сердце.
- Используйте щипцвы, чтобы аккуратно ухватить сердце за правый желудочек и поднять его к средней линии и слегка из груди.
- Вставьте 23 G бабочки иглы в кончик левого желудочка, к аорте и крепко держать.
- Начните перфузию с 1x PBS. Прокол через правый ушной раковины с помощью ножниц, чтобы perfusate выйти из циркуляции. Установите скорость потока PBS на 3 мл/мин. Perfuse с по крайней мере 15 мл 1x PBS для обеспечения тканей ясно.
ПРИМЕЧАНИЕ: Бланширование печени и мезентерических кровеносных сосудов являются признаками хорошей перфузии. При необходимости объем предфуза может быть увеличен до тех пор, пока жидкость, выходящий из сердца, не очистится от крови, после чего флеш-линия может быть остановлена. - После перфузии, разорвать мозг от спинного мозга и удалить мозг из черепа с ножницами и щипками. Удалите мех, чтобы увеличить видимость и контроль во время вскрытия и, чтобы избежать переноса волос загрязняющих веществ. Промыть спинной мозг из своей колонки с помощью 3 мл шприц заполнен pbS.
- Перенесите каждую ткань в колодец из 6-колодца с несколькими колодцами пластины предварительно заполнены 2 мл ледяной 1x HBSS и держать на льду до пищеварения.
- Разделите мозг и спинной мозг на две половины, вдоль продольной линии.
ПРИМЕЧАНИЕ: Половина каждой ткани гомогенизирована (см. разделы ниже), чтобы циклометрический анализ потока; другая половина может быть назначена на различную обработку для альтернативного анализа (например, смоченной в параформальдегидном фиксаторном растворе для гистологии).
3. Ферментативное пищеварение головного и спинного мозга
ПРИМЕЧАНИЕ: Объемы, описанные в этом разделе, достаточны для пищеварения половины мозга или спинного мозга.
- Используйте ножницы, чтобы разрубить ткани на части толщиной 1–2 мм.
- Вырежьте кончик 1000-й пипетки ножницами, чтобы сделать его достаточно большим, чтобы позволить сбор частей ткани. Предварительно промыть кончик пипетки с 1x HBSS. Затем используйте пипетку для переноса 2 мл раствора HBSS, содержащего измельченные ткани, в коническую трубку 15 мл.
ПРИМЕЧАНИЕ: Предварительное промывание наконечника пипетки важно для предотвращения липкости тканей части внутри кончика. - Вымойте скважину дополнительными 2 мл ледяного 1x HBSS и перенесите раствор на соответствующую коническую трубку 15 мл, содержащую кусочки ткани.
- Центрифуга каждый образец в течение 5 мин при 250 х г при 4 градусах По цельсию.
- Подготовьте ферментную смесь 1 из комплекта диссоциации нервной ткани (NTDK; Таблица материалов) путем смешивания 50 зл фермента P с 1900 л буфера X на образец. Теплый фермент смешать 1 при 37 градусов по Цельсию в водяной бане. Инкубировать фермент ную 1 при 37 градусах По Цельсию в течение по крайней мере 10 мин перед использованием, чтобы обеспечить полную активацию фермента.
- Аспирировать супернатант из 15 мл конической трубки и добавить 1,95 мл ферментной смеси 1 к каждому образцу. Аккуратно вихрь, чтобы убедиться, что гранулы повторно.
- Инкубировать образцы на колесе или шейкере в течение 15 мин при 37 градусах Цельсия.
- В то же время, подготовить фермент смесь 2 NTDK путем смешивания 10 зл/ фермента А с 20 зл буфера Y в образец; предварительно разогреть раствор при 37 градусах По Цельсию на водяной бане.
- В конце инкубации с ферментной смесью 1, добавить 30 зл энзимной смеси 2 к каждому образцу.
- Аккуратно смешайте образцы, поднимая трубку вверх и вниз с 1000-м наконечником пипетки, предварительно промытых 1x HBSS.
- Инкубировать образец на колесе или шейкере в течение 15 мин при 37 градусах Цельсия.
- После инкубации добавьте 10 мл ледяного 1x HBSS к каждой трубке, чтобы инактивировать ферментную смесь 1 и ферментную смесь 2.
- Центрифуга каждый образец в течение 10 мин при 320 х г при 4 градусах По цельсию.
- Отбросить супернатант; добавить ледяной 1x HBSS к каждой трубке до окончательного объема 7 мл и осторожно resuspend гранулы путем вихря.
- Продолжить раздел 5 для удаления мусора.
4. Механическая гомогенизация головного и спинного мозга
ПРИМЕЧАНИЕ: Объемы, описанные в этом разделе, достаточны для гомогенизации половины головного или спинного мозга. Протокол, описанный в этом разделе, может быть использован в качестве альтернативы методу, описанному в разделе 3, в зависимости от потребности пользователя, как описано ниже.
- Предварительно охладить стеклянный ступку измельчитель ткани Dounce (Таблица материалов) установлен на льду.
- Добавьте 3 мл предварительно охлажденных 1x HBSS в ступку.
- Передача ткани (мозг или спинной мозг) из колодца 6-ну пластины в стеклянный раствор убедившись, что он окунается в 1x HBSS и сидит в нижней части раствора.
- Аккуратно разбить ткани с 10 ударов пестика, а затем 10 ударов пестика B. Передача гомогенизированной смеси в новый 15 мл конической трубки.
- Заполните трубку до конечного объема 10 мл, используя предварительно охлажденный 1x HBSS и центрифугу в течение 10 минут при 320 х г при 4 градусах По Цельсию.
- Усилите супернатант и добавьте ледяной 1x HBSS к каждой трубке до конечного объема 7 мл и аккуратно переплетайте гранулы путем вихря.
- Продолжить раздел 5 для удаления мусора.
5. Удаление мусора
ПРИМЕЧАНИЕ: Удаление мусора, состоящего в основном из непереваренных тканей и миелиновых оболочек, является важным шагом, позволяющим эффективно окрашивать ткани гомогената для последующего цитометрического анализа потока.
- Фильтр каждого образца через 70 мкм ячейки ситечко, чтобы удалить любой непереваренной ткани кусок. Этот шаг особенно важен, особенно при работе с тканями спинного мозга, так как эти образцы с большей вероятностью содержат непереваренные фрагменты нерва или обезвреженные, которые могут повлиять на последующие шаги.
- Убедитесь, что конечный объем составляет 7 мл в каждой пробной трубке. Если нет, заполните ледяной 1x HBSS до 7 мл.
- Добавьте 3 мл предварительно охлажденных IPS в каждый образец, чтобы сделать окончательный объем 10 мл раствора, содержащего среду градиента плотности при 30% конечной концентрации. Аккуратно вихрь образцы, чтобы убедиться, что они однородны смешиваются.
- Образцы центрифуги в течение 15 мин при 700 х г при 18 градусах По Цельсию, убедившись, что установить ускорение центрифуги до 7 и тормоза до 0.
ПРИМЕЧАНИЕ: Центрифугация должна занять около 30 минут. - Деликатно удалите образцы из центрифуги.
ПРИМЕЧАНИЕ: беловатый диск, состоящий из мусора и миелина, должен быть виден плавающим на поверхности раствора. Гранулы (содержащие клетки интереса) должны быть видны в нижней части трубки. - Тщательно аспирировать все беловатый диск мусора, а затем остальная часть supernatant убедившись, что не выбить гранулы. Оставьте около 100 л раствора на верхней части клеточной гранулы, чтобы избежать риска непреднамеренно выбить его.
- Добавьте 1 мл FACS BL, приостановите гранулы, протянув вверх и вниз с наконечником пипетки 1000 л и перенесите образцы в трубки 1,5 мл.
- Центрифуга в течение 5 мин при температуре 450 х г при комнатной температуре (RT).
- Аккуратно аспирируйте супернатант и повторно приостанавливайте гранулы в соответствующем буфере, совместимом с анализами вниз по течению (см. раздел 6 для протокола, используемого для цитометрической оценки потока нескольких типов клеток).
6. Окрашивание для цитометрической оценки потока нескольких типов клеток
- Отрептируйте гранулы, полученные в шаге 5.9 с 350 л FACS BL. Добавить fc-block к каждому образцу при конечной концентрации 5 мкг/мл.
ПРИМЕЧАНИЕ: По крайней мере 100 л образца должны быть использованы для одного окрашивания, чтобы убедиться, что для обработки достаточноклеток, чтобы надежный анализ. - Инкубировать образец в течение 10 минут при 4 градусах Цельсия, прежде чем приступить к окрашиванию.
- Подготовка смесь антител в соответствии с таблицей 1.
- Добавьте смесь антител к каждой трубке, вихрь на 5 с и инкубировать образцы в течение 15 минут при 4 градусах Цельсия в темноте.
- Добавьте 1 мл PBS к каждой трубке, вихрь и центрифуги в течение 5 минут при 450 х г на RT.
- Между тем подготовить стрептавидин смесь в соответствии с таблицей 1.
- Откажитесь от супернатанта и отрептите гранулы в стрептавидинской смеси, приготовленной в шаге 6.6. Для каждого образца используйте тот же объем, что и тот, который используется для окрашивания в шаге 6.4.
- Vortex в течение 5 с и инкубировать образцы в течение 10 минут при 4 градусах Цельсия в темноте.
- Добавьте 1 мл PBS к каждой трубке, вихрь и центрифуги в течение 5 минут при 450 х г на RT.
- Откажитесь от супернатанта и приостановите гранулы в FACS BL. Используйте 300 л FACS BL на каждые 100 л окрашенных образцов.
- Добавьте в каждый образец 7-амино-актиномицин D (7-AAD). Используйте 5 ЗЛ 7-AAD для каждого 300 зЛ образца, подготовленного в шаге 6.10.
- Храните образцы при 4 градусах По итвне в темноте до цитофториметрического анализа. Выполните анализ в течение 16 ч от подготовки образца, чтобы гарантировать жизнеспособность клеток.
Результаты
Мы сравнили два различных метода гомогенизации (DH против PD), применяемых к мозгу мыши и спинному мозгу, чтобы проверить эффективность в извлечении различных жизнеспособных типов клеток, пригодных для применения ниже по течению. Для этого мы использовали 9-цветную цитометрию потока панели, предназначенные для характеристики, в том же образце, различные типы клеток ЦНС, включая микроглии, лимфоциты, нейроны, астроциты, олигодендроциты и эндотелий.
Ткани мозга и спинного мозга были извлечены из различных мышей (n No 6), разделены на две половины продольно, взвешены и обработаны параллельно, применяя либо механические нарушения с помощью Dounce гомогенизатор (метод DH) или мягко фарш и переваривается ферментативно с помощью коммерческих NTDK на основе папаина (метод PD) (Рисунок 1A). После удаления мусора, клетки из мозга или спинного мозга были разбавлены 1/10 или 1/2'1/5, соответственно, в Трипан синий, чтобы определить выход клеток и жизнеспособность с камерой Neubauer (Рисунок 1B, C). Метод DH в целом произвел более высокую урожайность клеток как от головного мозга, так и от спинного мозга. Тем не менее, большинство извлеченных клеток были мертвы, в результате чего только 13,8% и 3,3% жизнеспособных клеток в головном мозге и 10,5% и 1,5% в спинном мозге (Рисунок 1B). Многие из мертвых клеток образуют агрегаты(рисунок 1C); это явление может быть связано с наличием высоко взаимосвязанных сотовых сетей (например, эндотелиальных и глиальных клеток, выстилающих сосуды ЦНС), которые не могут быть дезагрегированы силой стрижки, применяемой с DH. Эти агрегаты клеток смерти, вероятно, не были удалены градиентом плотности и оказались в конечной клетке, используемой для цитофториметрического анализа. Напротив, метод PD определил общее лучшее сохранение клеточной жизнеспособности (90,6% и 0,6% в головном мозге и 85,2% и 2,8% в спинном мозге). Папаин способен эффективно переваривать внеклеточные матрицы и клеточные соединения, что приводит к более равномерной одноклеточной суспензии. Некоторые из клеток, которые умирают во время процесса измельчения может быть дополнительно переваривается папаин приводит к образованию клеточного мусора, которые более эффективно разделены через градиент плотности. В целом, это, вероятно, определяется лучшее сохранение жизнеспособности клеток с методом PD, несмотря на несколько более низкую урожайность клеток по сравнению с методом DH.
Аликвот 100 QL из мозга и спинного мозга клеток суспензии был окрашен в смесь антител (Таблица 1) и проанализированы поток цитометрии с 9-цветной панели. На рисунке 2А показана стратегия gating, используемая для определения различных типов клеток из мозга и спинного мозга. Кратко, первые ворота определяют общую популяцию в соответствии с передним рассеянием (FSC) и боком рассеяния (SSC), исключая мелкие обломки клеток. Затем идентифицируются живые (7-AAD-) клетки. В общей численности живых клеток выделены клетки CD45 и CD45. В пределах ворот CD45,' идентифицируются микроглии/макрофаги CD45-CD11b- лимфоциты. В пределах CD45- ворот, клетки дискриминируются в соответствии с положительностью для ACSA2 (астроцитов) или O4 (олигодендроциты). Клетки CD45-ACS2-O4- дополнительно подразделяются в зависимости от положительности для Thy1 (нейроны) или CD31 (эндотелий). Оставшиеся клетки Thy1-CD31 классифицируются как "другие типы клеток", не учтенные нашей смесью антител.
Как показано на рисунке 2B, с методом DH около 38% жизнеспособных клеток, извлеченных из мозга и около 32% жизнеспособных клеток, извлеченных из спинного мозга были гематопозетического происхождения (CD45 ). С другой стороны, метод PD позволил получить значительно высокий выход жизнеспособных клеток в обеих тканях, с очень большой долей, представленной негематоиэтичными КЛЕТКами CD45 (около 82% в головном мозге и 92% в спинном мозге). Примечательно, что микроглия/макрофаги CD45-CD11b представляют собой наиболее распространенную жизнеспособную клеточную фракцию с методом DH(рисунок 2C). Тем не менее, метод PD произвел более неоднородное представление типов клеток, в том числе астроцитов ACSA, Олигодендроцитов O4, CD31 "эндотелиальных клеток и Thy1" нейронов (Рисунок 2C). Интересно, что жизнеспособные нейроны и эндотелиальные клетки вряд ли обнаруживались методом DH.
Метод DH опирается на механическую шлифовку ткани между стеклянным пестиком и раствором гомогенизатора Dounce для получения гомогенизации тканей. Это может вызвать некоторые сдвига стресс, который, скорее всего, повреждения и влияют на жизнеспособность больших или очень чувствительных клеток, таких как нейроны или клетки нейроваскулярной. Мы оценили жизнеспособность клеток (процент 7-AAD-клеток) в каждой клетке субпопуляции определены через антитела панели(рисунок 3). Гематопоиэтиные клетки (CD45) выделены из головного и спинного мозга, в том числе микроглии/ макрофаги (CD45-CD11b) и других немиелоидных клеток (CD45-Cd11b-), отображается очень высокая жизнеспособность независимо от метода гомогенизации, который был использован(рисунок 3A). Напротив, метод DH определил значительное снижение жизнеспособности популяций CD45 (Рисунок 3B),в то время как метод PD определил широкое сохранение различных типов клеток ЦНС. В деталях, нейроны и эндотелиальные клетки были субпопуляции наиболее значительно пострадавших от DH и сохраняется методом PD.
Схематическая презентация критических шагов, необходимых для надлежащей подготовки образцов и эффективного удаления мусора, обобщена на рисунке 4.
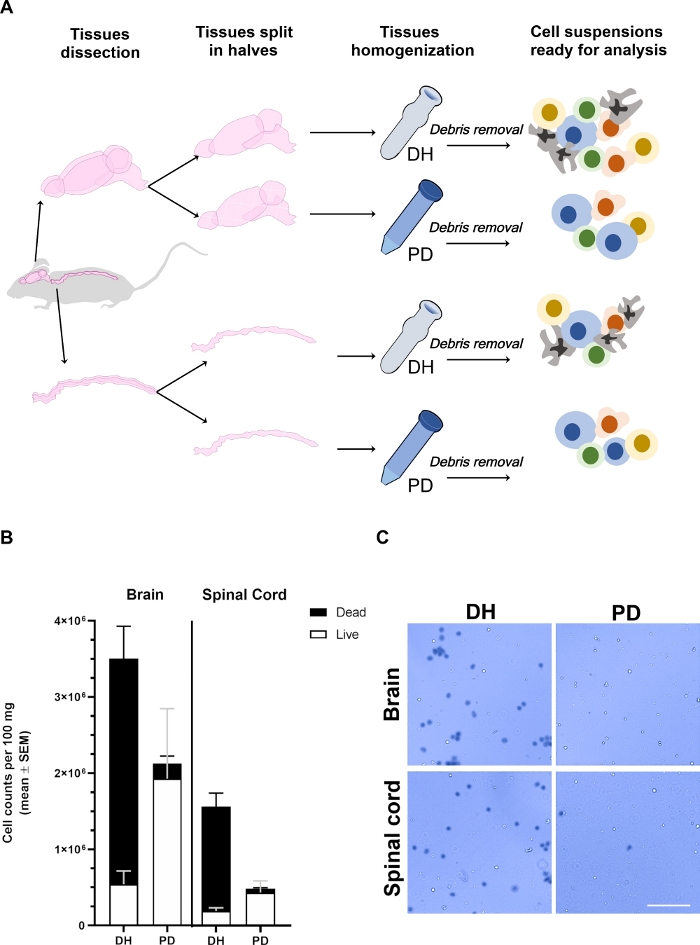
Рисунок 1: Выход клеток, извлеченных из головного и спинного мозга, зависит от метода гомогенизации.
(A) Экспериментальный план. Мыши были обезыпеваны и внутрисердечно проникнуты PBS для удаления внутрисосудистых циркулирующих клеток крови. Мозг и спинной мозг были тщательно расчленены и разделены на две половинки продольно. Ткани были однородны с использованием либо Dounce гомогенизатор (DH) или папаин пищеварения (PD), как подробно описано в основном тексте. Миелин и ткани мусора были затем удалены центрифугирования в 30% плотности градиент среднего решения в результате чего неоднородная суспензия клеток, содержащих различные типы клеток, которые могут быть проанализированы с помощью цитометрии потока. (B) Гистограммы, показывающие выход клеток, извлеченных из мозга или спинного мозга при гомогенизации тканей с методом DH или PD. Представленсредний SEM, не менее 6 животных на одно состояние. (C) Представитель яркий микроскоп фотомикрографы Трипан синий положительный (мертвый) и отрицательные (живые) клетки, извлеченные из головного или спинного мозга двумя методами. Шкала бар 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Относительные пропорции различных типов клеток, извлеченных из ЦНС, зависят от метода гомогенизации тканей.
(A) Представитель потока цитометрии участков, показывающих gating стратегии для выявления различных клеточных субпопуляций в клеточных препаратов, полученных из головного или спинного мозга: популяция клеток закрыто на FSC и SSC физические параметры, а затем выбор для 7-AAD- живые клетки; затем клетки дискриминируются в соответствии с положительностью для маркера CD45; микроглии / макрофагов идентифицируются как КЛЕТКи CD11b в пределах фракции CD45 "в то время как лимфоциты CD11b-. Астроциты, олигодендроциты, эндотелиальные и нейрональные клетки идентифицируются как клетки ACSA2, O4, CD31 или Thy1 в пределах CD45- соответственно. (B) Гистограммы, показывающие процент CD45 и CD45- клеток в общей живой или мертвой популяции клеток, в головном или спинном мозге при гомогенизации с методом DH или PD. Статистический анализ результатов, показанных на графиках, представлен в таблице 2. (C) Pie диаграммы, показывающие процент различных жизнеспособных подтипов клеток в общей популяции клеток, в головном или спинном мозге при гомогенизации с методом DH или PD. Сообщается также о процентном соотношении общего числа мертвых клеток. N No 6. CD45-CD11b - микроглия/макрофаг; CD45-CD11b- - лимфоциты/не миелоидные клетки; CD45-ACSA2 - астроциты; CD45-O4 - олигодендроциты; CD45-Thy1 - нейроны; CD45-CD31 - эндотелиальные клетки; Другие ячейки, отрицательные для всех вышеупомянутых маркеров. Статистический анализ результатов, показанных на графиках, представлен в таблице 2. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
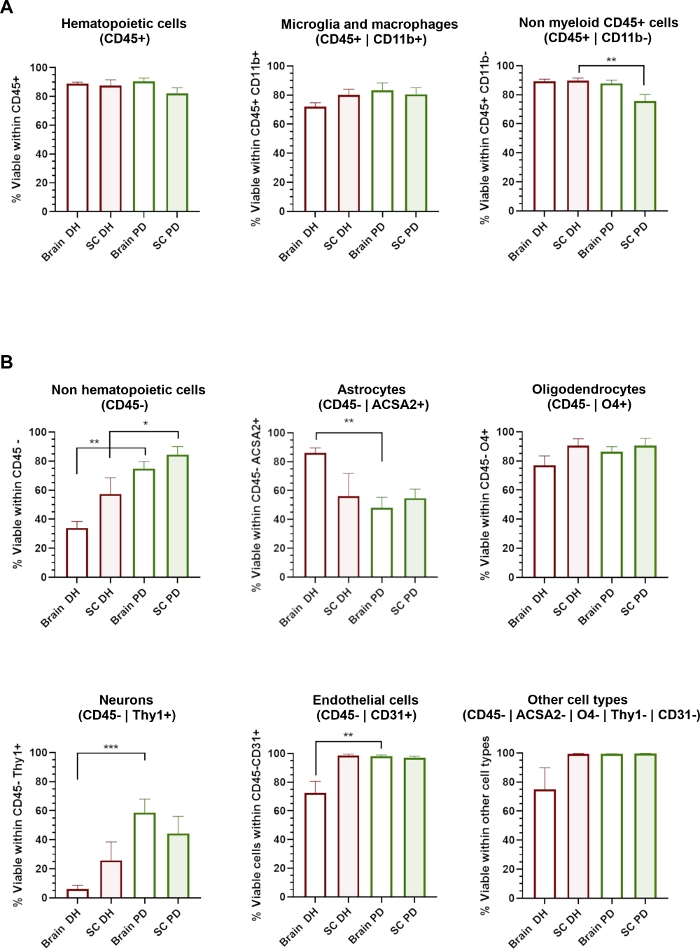
Рисунок 3: Клеточная жизнеспособность различных типов клеток ЦНС зависит от применяемого метода гомогенизации.
()Гистограммы, показывающие процент 7-AAD-живых клеток в CD45 "гематопоиетических популяций, включая CD11b" микроглии / макрофаги и CD11b- не миелоидных клеток. (B) Гистограммы, показывающие процент 7-AAD-живых клеток в CD45- негематопоиедных популяций, включая астроциты, олигодендроциты, нейроны, эндотелиальные и другие типы клеток. Р-эт-н- 0,05, п.л.; 0,01, Манн-Уитни между DH и PD. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4: Схематическое представление критических шагов, необходимых для правильной обработки тканей.
Показан список наиболее важных шагов, необходимых для правильной обработки тканей и эффективного удаления мусора. Важно правильно определить диск мусора (черная стрелка) и клеточные гранулы (голубая стрелка), образующиеся после центрифугации образцов на градиенте 30% плотности. Диск мусора, вместе с остальной частью супернатанта, должны быть тщательно удалены путем устремления, не выбивая клетки гранулы, чтобы избежать потери образца. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Смесь антител | Первоначальная концентрация (мкг/мл) | Окончательная концентрация (мкг/мл) | Коэффициент разбавления |
| анти CD45/BV510 | 200 | 2 | 100 |
| анти CD11b/APC.780 | 200 | 2 | 100 |
| анти CD31/BV421 | 200 | 2 | 100 |
| анти ACSA2/APC | 150 | 0.75 | 200 |
| анти O4/биотин | Na | Na | 40 |
| анти CD90.2/PE. Cy7 | 200 | 2 | 100 |
| Стрептавидин микс | Первоначальная концентрация (мкг/мл) | Окончательная концентрация (мкг/мл) | Коэффициент разбавления |
| Стрептавидин/Алекса 680 | 1000 | 1 | 1000 |
Таблица 1: Рецепт для приготовления смесей для окрашивания цитометрии потока. В таблице описаны оптимальные концентрации антител и стрептавидина, используемые для обеспечения цитометрического анализа нескольких клеток. Пожалуйста, обратитесь к таблице материалов для получения подробной информации о номерах каталогов каждого реагента, упомянутых в таблице.
| Статистика по рисунку 2B | ||||||||||
| BRAIN (% клеток) | ||||||||||
| CD45 | CD45- | |||||||||
| Жить | Мертвых | Жить | Мертвых | |||||||
| Метод | Означает | СЕМ | Означает | СЕМ | Означает | СЕМ | Означает | СЕМ | ||
| Dh | 15.20 | No 2,32 евро | 1.90 | 0,30 евро | 24.78 | 4,045 евро | 51.58 | 6,033 евро | ||
| Pd | 15.20 | 2,65 евро | 2.33 | No 1,10 | 68.53 | 3,618 евро | 13.93 | 2,180 евро | ||
| Манн-Уитни | Ns | Ns | *** | ** | ||||||
| р-значение | 0.9989 | 0.738 | 0.0006 | 0.0015 | ||||||
| SPINAL CORD (% клетки) | ||||||||||
| CD45 | CD45- | |||||||||
| Жить | Мертвых | Жить | Мертвых | |||||||
| Метод | Означает | СЕМ | Означает | СЕМ | Означает | СЕМ | Означает | СЕМ | ||
| Dh | 15.00 | 8,21 евро | 1.41 | 0,11 евро | 31.64 | 8,21 евро | 51.95 | No 16,52 евро | ||
| Pd | 7.49 | No 4,99 | 1.15 | 0,68 евро | 84.27 | No 9,39 евро | 7.09 | 3,75 евро | ||
| Манн-Уитни | Ns | Ns | * | Ns | ||||||
| р-значение | 0.5548 | 0.7236 | 0.0438 | 0.1144 | ||||||
| Статистика по рисунку 2C | |||||||||||||||||
| BRAIN (% клеток) | |||||||||||||||||
| CD45 | CD45- | ||||||||||||||||
| CD11б | CD11b- | ACSA2 | O4 | Thy1 | CD31 | Других | Мертвых | ||||||||||
| Метод | Означает | СЕМ | Означает | СЕМ | Означает | СЕМ | Означает | СЕМ | Означает | СЕМ | Означает | СЕМ | Означает | СЕМ | Означает | СЕМ | |
| Dh | 19.32 | 3,88 евро | 1.17 | 0,27 евро | 9.52 | 2,68 евро | 3.41 | No 1,01 | 1.39 | 0,77 евро | 0.48 | 0,29 евро | 10.52 | No 4.49 | 53.83 | 5,79 евро | |
| Pd | 10.88 | 2,03 евро | 1.65 | 0,48 евро | 8.17 | 2,66 евро | 6.54 | 0,76 евро | 6.37 | 1,76 евро | 8.27 | 1,25 евро | 33.28 | No 6,34 евро | 23.72 | 5,31 евро | |
| Манн-Уитни | Ns | Ns | Ns | * | ** | *** | ** | ** | |||||||||
| р-значение | 0.1206 | 0.4819 | 0.5894 | 0.0264 | 0.0093 | 0.0003 | 0.0084 | 0.0022 | |||||||||
| SPINAL CORD (% клетки) | |||||||||||||||||
| CD45 | CD45- | ||||||||||||||||
| CD11б | CD11b- | ACSA2 | O4 | Thy1 | CD31 | Других | Мертвых | ||||||||||
| Метод | Означает | СЕМ | Означает | СЕМ | Означает | СЕМ | Означает | СЕМ | Означает | СЕМ | Означает | СЕМ | Означает | СЕМ | Означает | СЕМ | |
| Dh | 21.23 | 6,25 евро | 2.51 | 0,57 евро | 4.26 | No 2,34 евро | 9.40 | No 1,89 евро | 2.82 | No 1,51 | 0.97 | 0,50 евро | 22.74 | No 9,04 евро | 35.28 | No 1,89 евро | |
| Pd | 9.63 | 1,67 евро | 2.77 | 0,48 евро | 4.23 | No 1,59 евро | 28.62 | 3,57 евро | 1.26 | 0,49 евро | 6.94 | No 2,14 евро | 26.39 | 8,17 евро | 19.09 | 4,76 евро | |
| Манн-Уитни | Ns | Ns | Ns | * | Ns | * | Ns | Ns | |||||||||
| р-значение | 0.1905 | 0,9999 | 0.7302 | 0.0159 | 0.7302 | 0.0317 | 0.7302 | 0.1111 | |||||||||
Таблица 2: Статистический анализ различных групп населения, извлеченных с помощью метода DH или PD. В таблице описаны статистические данные по графикам, показанным на рисунке 2B и рисунке 2C. Представленсредний и SEM, по крайней мере шесть независимых образцов представлены. Также сообщается о значении p и сведениях о статистическом тесте, применяемом для каждого сравнения.
Обсуждение
В этом мы описываем протокол для совместного очищения и одновременного цитометрического анализа потока некоторых из наиболее релевантных клеток ЦНС из мозга мыши и спинного мозга. Традиционно, гистологические анализы были применены для описания распределения наночастиц или трансдукционной эффективности вирусных векторов в ЦНС5,13, или для получения информации о морфологических и молекулярных изменений, происходящих в конкретных типах клеток во время патологии или на фармакологическое лечение14. Тем не менее, гистология не хватает процессуности и не позволяет всестороннее изучение нескольких функций в тех же гистологических образцов, из-за ограниченного числа маркеров, которые могут быть одновременно проанализированы. Наш подход может дополнять традиционный гистологический анализ и может быть соединен с несколькими приложениями вниз по течению (сортировка, первичный анализ культуры, биохимических или секвенирующих анализов следующего поколения) для расширения компиляции информации, которую можно получить из отдельных образцов. Однако некоторые ключевые факторы, перечисленные ниже, должны быть рассмотрены, поскольку они могут критически повлиять на успех этого подхода:
- Количество стартовой ткани. Мы оптимизировали разделение клеток, чтобы начать с всего лишь половины спинного мозга или половины мозга. По нашему опыту, обработка половины головного или полуспинного мозга от взрослой 8-недельной мыши методом PD дает 1'6 х 106 жизнеспособных клеток из мозга и около 0,1 х 0,5 х 106 жизнеспособных клеток из спинного мозга после плотности градиента шаг. Мы не измерили выход клеток после применения метода PD на ткани новорожденных или мышей моложе 8 недель. Однако, в наших руках, результат пропорционален весу стартовой ткани. Таким образом, для более молодых животных (например, 10-дневных щенков) весь мозг или спинной мозг должен быть обработан, чтобы гарантировать хороший выход клеток для надежного анализа вниз по течению. При необходимости объединение тканей от нескольких животных поможет увеличить урожайность клеток. По нашему опыту, этот протокол также может быть применен без изменений для изоляции клеток из головного или спинного мозга крыс, насколько доля реагентов, используемых на вес стартовой ткани соблюдается. Для тканей более 250 мг веса, масштабирование реагентов вверх или расщепление ткани в нескольких образцах (каждый взвешивания lt;250 мг) предлагается.
- Удаление овеществок / остаточных фрагментов ткани до градиента плотности. По нашему опыту, метод PD настоящим описан не в состоянии переварить эффективно обезвреживания или очень высоко миелинированных тканей, таких как нервы и нервные корни, возникающие из спинного мозга. Когда эти ткани присутствуют, некоторые непереваренные липкие куски могут оставаться в клеточной подвеске, извлеченной после ферментативных шагов пищеварения, до удаления мусора. Удаление этих кусков путем фильтрации раствора через 70 мкм ячейки ситечко (как это предлагается в шаге 5.1) имеет решающее значение для успешной подготовки клеток. В самом деле, если не удалить, олении или ткани штук будет препятствовать эффективной плотности градиент апартирования в результате чего плохие выходы клеток.
- Сроки, температура и бесплодие. Очень важно своевременно выполнять все шаги, используя правильные температурные настройки и инкубации, как это предлагается. Это имеет решающее значение для обеспечения высокой жизнеспособности и целостности образца. В зависимости от применения вниз по течению, может потребоваться выполнение всех шагов под стерильным капотом и со стерильными реагентами (например, создание первичных клеточных культур). Расширенная инкубация в ферментативном пищеварительном растворе сверх предложенного времени (раздел 3) может привести к падению жизнеспособности клеток. Эпитопы некоторых поверхностных антигенов могут быть чувствительны к папаин, что приводит к потере сигнала при цитометрии потока. Для конкретных приложений, требующих дополнительных маркеров, помимо описанных в этой статье, перед началом эксперимента рекомендуется проверить производительность различных клонов антител. Было сообщено, что плотность градиента среды может содержать некоторые следы эндотоксинов, которые могут вызвать активацию иммунных клеток (микроглии / макрофагов). Соответствующие внутренние меры всегда должны быть добавлены в экспериментах всякий раз, когда эти популяции анализируются, чтобы исключить возможные эффекты, вызванные процедурой. Вставлять с предложенными температурами и мытьем градиента плотности средние остатки немедленно после шага удаления твердых частиц обычно достаточно для того чтобы во избежание откровененная активация иммунных клеток. Однако, в случае, если приложения вниз по течению (например, RNAseq или функциональный анализ) затронуты этим шагом, пользователь должен перейти на низкоэндотоксин плотности градиент агитатора среднего препарата (предлагается в таблице материалов).
- Антитела И машина FACS. Протокол окрашивания цитометрии потока настоящим представляет использует концентрации антител и цветовых спряжений, которые лучше всего работали с выходами клеток, извлеченными в нашем лабораторном опыте и с машинами FACS, доступными в нашем институте. Пользователь должен титр антитела в его / ее руки, прежде чем начать новый эксперимент, как концентрация, возможно, потребуется слегка скорректированы. Кроме того, мы рекомендуем всегда использовать одноразовые элементы управления окрашиванием в каждом эксперименте, чтобы убедиться, что все антитела и настройка компенсации машины FACS работает адекватно. Следует отметить, что антиген CD90 (Thy), используемый для обнаружения нейронов, существует в двух различных изотипах, а именно CD90.2 или CD90.1 в зависимости от штамма мыши: наиболее часто используемые штаммы мыши, такие как C57BL6/J Express CD90.2; мыши штаммов, таких как AKR / J, PL, и FVB / N экспресс CD90.1. Таким образом, пользователь должен тщательно проверить штамм мыши и выбрать соответствующие анти-CD90 антитела (как предлагается в таблице материалов) перед началом экспериментов.
Таким образом, протокол здесь представлены использует нежный ферментативного пищеварения следуют 9-цветные окрашивания позволяет эффективной одновременной цитометрической оценки потока различных типов клеток из мозга мыши и спинного мозга. Протокол может быть использован для более рационального и всестороннего мониторинга эффективности таргетинга клеток наночастицами или вирусными вектором, управляемых в ЦНС15. Кроме того, протокол может быть легко принят для очень деликатного применения вниз по течению, таких как сортировка клеток, субкультура ex vivo, одноклеточный РНК, что имеет первостепенное значение не только для доклинической оценки клеточной таргетинга терапевтическими препаратами, но и для углубленной характеристики патологических процессов при нейродегенеративных заболеваниях.
Доля всей популяции клеток ЦНС не дискриминируется этим протоколом (см. "другие" типы клеток на рисунке 2); это может быть объяснено наличием других подтипов клеток, которые присутствуют в ЦНС, но не захвачены антителами, которые мы использовали. В наших предварительных анализах, около 14% "других клеток" фракция является положительным для CD73, мезенхимальный маркер клеток, обогащенных в нейроваскулярности и участвует в нескольких нейровоспалительных процессов16,17. Кроме того, мы предполагаем, что "другие клетки" фракция может также состоять из менее дифференцированных клеток, как потомки-предшественники на разных стадиях созревания, такие как nestin' нервных стволовых клеток, nestin' vimentin' радиальных глия потомков, двойных корторователей нейронных потомок, NG2 " oligodendrocyte прекурсоров клеток, среди других. Эти клетки подтипов может быть легко исследованы путем применения нашего потока цитометрии протокол, так как мы выбрали конфигурацию флуоресцентных красителей, что позволяет разместить до двух дополнительных маркеров ячейки сопряжены с либо флуоресцеин изотиоциозана (FITC) или фторофоров фикоритрин (PE) флюорофоров.
В целом, наш подход мог бы стать новым инструментом для более всеобъемлющих исследований в контексте ЦНС (в области здравоохранения и болезней), пользуясь хорошо консолидированной технологией, позволяющей проводить как качественные, так и высокопроизводительные количественные оценки таких как цитометрия потока.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование было профинансировано Бостонской детской больницы стартовых средств для A.B., ALSA грант nr. 17-IIP-343 в М.П., и Управление помощника министра обороны по вопросам здравоохранения через амиотрофический боковой склероз исследовательской программы в соответствии с премией No. W81XWH-17-1-0036 до M.P. Мы признаем DFCI Flow Cytometry Core за техническую поддержку.
Материалы
| Name | Company | Catalog Number | Comments |
| 10X HBSS (Calcium, Magnesium chloride, and Magnesium Sulfate-free) | Gibco | 14185-052 | |
| 70 mm Cell Strainer | Corning | 431751 | |
| ACSA/ACSA2 anti-mouse antibody | Miltenyi Biotec | 130-117-535 | APC conjugated |
| Bovine Serum Albumin | Sigma Aldrich | A9647-1KG | |
| CD11b rat anti-mouse antibody | Invitrogen | 47-0112-82 | APC-eFluor 780 conjugated |
| CD31 rat anti-mouse antibody | BD Bioscience | 562939 | BV421 conjugated |
| CD45 rat anti-mouse antibody | Biolegend | 103138 | Brilliant Violet 510 conjugated |
| CD90.1/Thy1.1 rat anti-mouse antibody | Biolegend | 202518 | PE/Cy7 conjugated |
| CD90.2/Thy1.2 rat anti-mouse antibody | Biolegend | 1005325 | PE/Cy7 conjugated |
| Conical Tubes (15 mL) | CellTreat | 229411 | |
| Conical Tubes (50 mL) | CellTreat | 229422 | |
| Dounce Tissue Grinder set (Includes Mortar as well as Pestles A and B) | Sigma-Aldrich | D9063-1SET | |
| Fc (CD16/CD32) Block rat anti-mouse antibody | BD Pharmingen | 553142 | |
| Fetal Bovine Serum | Benchmark | 100-106 | |
| Neural Tissue Dissociation Kit (P) | Miltenyi Biotec | 130-092-628 | |
| O4 anti mouse/rat/human antibody | Miltenyi Biotec | 130-095-895 | Biotin conjugated |
| Percoll | GE Healthcare | 10266569 | sold as not sterile reagent |
| Percoll | Sigma | 65455529 | sterile reagent (to be used for applications requiring sterility) |
| Percoll PLUS | Sigma | GE17-5445-01 | reagent containing very low traces of endotoxin |
| Streptavidin | Invitrogen | S3258 | Alexa Fluor 680 conjugated |
Ссылки
- Deverman, B. E., Ravina, B. M., Bankiewicz, K. S., Paul, S. M., Sah, D. W. Y. Gene therapy for neurological disorders: progress and prospects. Nature Reviews Drug Discovery. 17 (9), 641-659 (2018).
- Teleanu, D., Negut, I., Grumezescu, V., Grumezescu, A., Teleanu, R. Nanomaterials for Drug Delivery to the Central Nervous System. Nanomaterials. 9 (3), 371(2019).
- Chen, S., et al. Recombinant Viral Vectors as Neuroscience Tools. Current Protocols in Neuroscience. 87 (1), 67(2019).
- Alves, S., et al. Ultramicroscopy as a novel tool to unravel the tropism of AAV gene therapy vectors in the brain. Scientific Reports. 6 (1), 28272(2016).
- Peviani, M., et al. Lentiviral vectors carrying enhancer elements of Hb9 promoter drive selective transgene expression in mouse spinal cord motor neurons. Journal of Neuroscience Methods. 205 (1), 139-147 (2012).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. Journal of Immunological Methods. 243 (1-2), 77-97 (2000).
- Sykora, M. M., Reschke, M. Immunophenotyping of Tissue Samples Using Multicolor Flow Cytometry. Methods in Molecular Biology. 1953, 253-268 (2019).
- Legroux, L., et al. An optimized method to process mouse CNS to simultaneously analyze neural cells and leukocytes by flow cytometry. Journal of Neuroscience Methods. 247, 23-31 (2015).
- Lee, J. K., Tansey, M. G. Microglia Isolation from Adult Mouse Brain. Methods in Molecular Biology. 1041, 17-23 (2013).
- Grabert, K., McColl, B. W. Isolation and Phenotyping of Adult Mouse Microglial Cells. Methods in Molecular Biology. 1784, 77-86 (2018).
- Nikodemova, M., Watters, J. J. Efficient isolation of live microglia with preserved phenotypes from adult mouse brain. Journal of Neuroinflammation. 9 (1), 635(2012).
- Garcia, J. A., Cardona, S. M., Cardona, A. E. Isolation and analysis of mouse microglial cells. Current Protocols in Immunology. 104 (1), 1-15 (2014).
- Papa, S., et al. Selective Nanovector Mediated Treatment of Activated Proinflammatory Microglia/Macrophages in Spinal Cord Injury. ACS Nano. 7 (11), 9881-9895 (2013).
- Peviani, M., et al. Neuroprotective effects of the Sigma-1 receptor (S1R) agonist PRE-084, in a mouse model of motor neuron disease not linked to SOD1 mutation. Neurobiology of Disease. 62, 218-232 (2014).
- Peviani, M., et al. Biodegradable polymeric nanoparticles administered in the cerebrospinal fluid: Brain biodistribution, preferential internalization in microglia and implications for cell-selective drug release. Biomaterials. 209, 25-40 (2019).
- Meng, F., et al. CD73-derived adenosine controls inflammation and neurodegeneration by modulating dopamine signalling. Brain. 142 (3), 700-718 (2019).
- Nedeljkovic, N. Complex regulation of ecto-5'-nucleotidase/CD73 and A2AR-mediated adenosine signaling at neurovascular unit: A link between acute and chronic neuroinflammation. Pharmacological Research. 144, 99-115 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены