Method Article
Caratterizzazione citometrica a flusso simultaneo di più tipi di cellule recuperate dal cervello del mouse/cavo spinale attraverso diversi metodi di omogeneizzazione
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Vi presentiamo un metodo di citometria di flusso per identificare contemporaneamente diversi tipi di cellule recuperate dal cervello del topo o dal midollo spinale. Questo metodo potrebbe essere sfruttato per isolare o caratterizzare le popolazioni di cellule pure nelle malattie neurodegenerative o per quantificare l'estensione del targeting cellulare sulla somministrazione in vivo di vettori virali o nanoparticelle.
Abstract
I recenti progressi nelle scienze dei vettori virali e dei nanomateriali hanno aperto la strada a nuovi approcci all'avanguardia per studiare o manipolare il sistema nervoso centrale (SNC). Tuttavia, un'ulteriore ottimizzazione di queste tecnologie trarrebbe vantaggio da metodi che consentano una rapida determinazione e una snellimento della portata del SNC e del targeting specifico per le cellule sulla somministrazione di vettori virali o nanoparticelle nel corpo. Qui, presentiamo un protocollo che sfrutta l'alta produttività e le capacità multiplexing della citometria di flusso per consentire una semplice quantificazione di diversi sottotipi di cellule isolati dal cervello del topo o dal midollo spinale, vale a dire microglia/macrofagi, linfociti, astrociti, oligodendrociti, neuroni e cellule endoteliali. Applichiamo questo approccio per evidenziare le differenze critiche tra due metodi di omogeneizzazione dei tessuti in termini di resa cellulare, vitalità e composizione. Questo potrebbe istruire l'utente a scegliere il metodo migliore a seconda del tipo di cella o dei tipi di cella di interesse e dell'applicazione specifica. Questo metodo non è adatto per l'analisi della distribuzione anatomica, poiché il tessuto è omogeneizzato per generare una sospensione a cella singola. Tuttavia, permette di lavorare con cellule vitali e può essere combinato con lo smistamento cellulare, aprendo la strada a diverse applicazioni che potrebbero espandere il repertorio di strumenti nelle mani del neuroscienziato, che vanno dall'istituzione di colture primarie derivate da popolazioni di cellule pure, ad analisi gene-expression e saggi biochimici o funzionali su sottotipi cellulari ben definiti nel contesto di malattie neurodegenerative, sul trattamento farmacologico o sulla terapia genica.
Introduzione
Le tecnologie di somministrazione di geni e farmaci (come vettori virali e nanoparticelle) sono diventate un potente strumento che può essere applicato per ottenere migliori informazioni su percorsi molecolari specifici alterati nelle malattie neurodegenerative e per lo sviluppo di approcci terapeutici innovativi1,2,3. L'ottimizzazione di questi strumenti si basa sulla quantificazione di: (1) l'entità della penetrazione nel SNC su diverse vie di somministrazione e (2) targeting di specifiche popolazioni cellulari. Le analisi istologiche sono di solito applicate per visualizzare geni reporter fluorescenti o nanoparticelle fluorescenti in diverse aree del SNC e in diversi tipi di cellule, identificate dall'immunostaining per specifici marcatori cellulari4,5. Anche se questo approccio fornisce informazioni preziose sulla biodistribuzione degli strumenti di parto genico o di somministrazione di farmaci somministrati, la tecnica può richiedere molto tempo e un'intensa attività perché richiede: (1) fissazione dei tessuti, crioconservazione o pastura-incorporazione e affettatura; (2) colorazione per marcatori cellulari specifici che a volte richiedono il recupero dell'antigene; (3) acquisizione mediante microscopia a fluorescenza, che di solito consente l'analisi di un numero limitato di marcatori diversi all'interno dello stesso esperimento; (4) l'elaborazione delle immagini per consentire una corretta quantificazione del segnale di interesse.
La citometria di flusso è diventata una tecnica ampiamente utilizzata che sfrutta marcatori fluorescenti molto specifici per consentire non solo una rapida valutazione quantitativa di diversi fenotipi cellulari nelle sospensioni cellulari, basata sull'espressione di antigeni superficiali o intracellulari, ma anche misurazioni funzionali (ad esempio, tasso di apoptosi, proliferazione, analisi del ciclo cellulare, ecc.). È inoltre possibile l'isolamento fisico delle cellule attraverso lo smistamento fluorescente delle cellule attivate, consentendo ulteriori applicazioni a valle (ad esempio, coltura cellulare, RNA, analisi biochimiche, ecc.) 6,7,8.
L'omogeneizzazione dei tessuti è un passo fondamentale necessario per ottenere una sospensione a singola cella per consentire valutazioni citometriche a flusso a valle affidabili e riproducibili. Sono stati descritti diversi metodi per l'omogeneizzazione del tessuto cerebrale adulto, principalmente con l'obiettivo di isolare le cellule di microglia9,10,11; possono essere classificati complessivamente in due categorie principali: (1) dissociazione meccanica, che utilizza la forza di macinazione o di taglio attraverso un omogeneizzatore Dounce (DH) per strappare le cellule dalle loro nicchie e formare una sospensione a singola cella relativamente omogenea, e (2) digestione enzimatica, che si basa sull'incubazione di pezzi di tessuto macinato a 37 gradi centigradi in presenza di enzimi proteolitici, come la prova o la papaina, favorendo la degradazione della matrice extracellulare per creare una sospensione cellulare abbastanza omogenea12.
Indipendentemente dal metodo utilizzato, si raccomanda una fase di purificazione dopo l'omogeneizzazione dei tessuti per rimuovere la mielina attraverso la centrifugazione su un gradiente di densità o per selezione magnetica9,12, prima di passare alle applicazioni a valle.
Qui, descriviamo un metodo di lavorazione dei tessuti basato sulla digestione della papaina (PD) seguito dalla purificazione su un gradiente di densità, ottimizzato per ottenere sospensioni cellulari eterogenee praticabili dal cervello del topo o dal midollo spinale in modo sensibile al tempo e adatto per la citometria di flusso. Inoltre, descriviamo un pannello di citometria a flusso a 9 colori e la strategia di gating che abbiamo adottato in laboratorio per consentire la discriminazione simultanea di diverse popolazioni di SNC, cellule vive /morte o positività per giornalisti fluorescenti come proteine fluorescenti verdi o coloranti di rodamina. Applicando questa analisi citometrica del flusso, possiamo confrontare diversi metodi di lavorazione dei tessuti, cioè PD contro DH, in termini di conservazione della vitalità cellulare e rendimenti di diversi tipi di cellule.
I dettagli che forniamo nel presente documento possono istruire la decisione sul protocollo di omogeneizzazione e sulla combinazione di anticorpi da utilizzare nel pannello della citometria di flusso, in base al tipo o alle specifiche cellule di interesse e alle analisi a valle (ad esempio, sensibili alla temperatura applicazioni, tracciamento di specifici marcatori fluorescenti, cultura in vitro, analisi funzionali).
Protocollo
Tutti i metodi qui descritti sono stati approvati dall'Institutional Animal Care and Use Committee (IACUC) del Dana Farber Cancer Institute (numero di protocollo 16-024).
1. Preparazione delle soluzioni necessarie per l'esperimento
- Preparare 1x soluzione di sale equilibrato di Hank (HBSS) diluindo 10x HBSS con acqua sterile. Pre-raffreddare la soluzione sul ghiaccio. Per ogni campione sono necessari almeno 25 mL di soluzione.
- Preparare la soluzione ISotonica Percoll (IPS) mescolando 10x sterile HBSS 1:10 con grado di gradiente di densità (cioè Percoll). Pre-freddo sul ghiaccio.
NOTA: l'IPS può essere conservato per un massimo di 30 giorni a 4 gradi centigradi. - Preparare la soluzione di blocco della citometria a flusso (FACS) (1% di albumin del siero bovino [BSA], il siero bovino fetale 5% [FBS] in salina tampina tamponata da fosfati [PBS]). Pre-freddo sul ghiaccio.
2. Eutanasia animale per perfusione intracardiaca e dissezione tissutale
NOTA: negli esperimenti sono stati utilizzati topi C57BL/6J di otto settimane, entrambi sessuali. La perfusione con soluzione PBS viene eseguita per eliminare la contaminazione del sangue dagli organi, prima di procedere con la digestione tissutale.
- Anestesizzare il topo utilizzando una miscela di ketamina/xylazina (90-200 mg/kg di ketamina, 10 mg/kg di xilanina). Posizionare il mouse sulla schiena e nastro ogni arto verso il basso per il supporto. Verificare un'adeguata profondità di anestesia controllando il riflesso di prelievo.
- Fare un'incisione cutanea midline a livello dell'isolotto toracico per esporre lo sterno. Utilizzare le pinze per afferrare la punta dello sterno, quindi fare un'incisione di 1 cm su ciascun lato della gabbia toracica. Infine tagliare il diaframma e aprire lo sterno abbastanza ampiamente per visualizzare il cuore.
- Utilizzare le pinze per afferrare delicatamente il cuore dal ventricolo destro e sollevarlo alla linea mediana e leggermente fuori dal petto.
- Inserire un ago di 23 G farfalla nella punta del ventricolo sinistro, verso l'aorta e tenere saldamente.
- Avviare la perfusione con 1x PBS. Pierce attraverso l'auricolare destro utilizzando le forbici per permettere al perfusate di uscire dalla circolazione. Impostare la portata di PBS a 3 mL/min. Perfuse con almeno 15 mL di 1x PBS per garantire che i tessuti siano chiari.
NOTA: Sbiancamento del fegato e vasi sanguigni mesenteerici sono segni di buona perfusione. Se necessario, il volume di prefusione può essere aumentato fino a quando il fluido che esce dal cuore è libero dal sangue, a quel punto la linea di scarico può essere fermata. - Dopo la perfusione, recidere il cervello dal midollo spinale e rimuovere il cervello dal cranio con forbici e pinze. Rimuovere la pelliccia per aumentare la visibilità e il controllo durante la dissezione ed evitare di portare sopra i contaminanti dei capelli. Svuotare il midollo spinale dalla sua colonna utilizzando una siringa da 3 mL riempita con PBS.
- Trasferire ogni tessuto in un pozzo di una piastra multi-bene di 6 pozze preriempito con 2 mL di ghiaccio 1x HBSS e tenere sul ghiaccio fino alla digestione.
- Dividere il cervello e il midollo spinale in due metà, lungo la linea longitudinale.
NOTA: La metà di ogni tessuto è omogeneizzata (vedi sezioni sotto) per consentire analisi citometriche di flusso; l'altra metà può essere assegnata a diverse elaborazioni per analisi alternative (ad esempio, immersa in soluzione fixativa paraformaldeide per l'istologia).
3. Digestione ezimatica del cervello e del midollo spinale
NOTA: I volumi descritti in questa sezione sono sufficienti per la digestione di metà del cervello o del midollo spinale.
- Usa un paio di forbici per macinare i tessuti in pezzi spessi 1,2 mm.
- Tagliare la punta di una pipetta da 1000 gradi con un paio di forbici per renderla sufficientemente grande da consentire la raccolta dei pezzi di tessuto. Pre-risciacquare la punta della pipetta con 1x HBSS. Quindi utilizzare la pipetta per trasferire la soluzione di 2 mL di HBSS contenente il tessuto macinato in un tubo conico da 15 mL.
NOTA: Il pre-risciacquo della punta della pipetta è importante per evitare la viscosità dei pezzi di tessuto all'interno della punta. - Lavare il pozzo con ulteriori 2 mL di ghiaccio-freddo 1x HBSS e trasferire la soluzione al corrispondente tubo conico 15 mL contenente i pezzi di tessuto.
- Centrifugare ogni campione per 5 min a 250 x g a 4 gradi centigradi.
- Preparare il mix di enzimi 1 del kit di dissociazione del tessuto neurale (NTDK; Tabella dei materiali) mescolando 50 l di enzima P con 1900 l di tampone X per campione. Miscela di enzimi caldi 1 a 37 gradi centigradi in un bagno d'acqua. Miscela di enzimi incubazione 1 a 37 gradi centigradi per almeno 10 min prima dell'uso al fine di consentire la piena attivazione dell'enzima.
- Aspirare il supernatante dal tubo conico da 15 mL e aggiungere 1,95 mL di mix di enzimi 1 ad ogni campione. Vortice delicatamente per assicurarsi che il pellet sia risospeso.
- Incubare i campioni su una ruota o shaker per 15 min a 37 gradi centigradi.
- Nel frattempo, preparare il mix enzimatico 2 dell'NTDK mescolando 10 : L di enzima A con 20 : L di tampone Y per campione; pre-riscaldare la soluzione a 37 gradi centigradi in un bagno d'acqua.
- Alla fine dell'incubazione con mix di enzimi 1, aggiungere 30 gradi di mix di enzimi 2 ad ogni campione.
- Mescolare delicatamente i campioni convogliando su e giù con una punta di pipetta da 1000 luna pre-risciacquata con 1x HBSS.
- Incubare il campione su una ruota o shaker per 15 min a 37 gradi centigradi.
- Dopo l'incubazione, aggiungere 10 mL di ghiaccio-freddo 1x HBSS per ogni tubo per inattivare il mix enzimatico 1 e mix enzima 2.
- Centrifugare ogni campione per 10 min a 320 x g a 4 gradi centigradi.
- Scartare il super-natante; aggiungere ghiaccio freddo 1x HBSS ad ogni tubo fino a un volume finale di 7 mL e respendere delicatamente il pellet vortice.
- Continuare fino alla sezione 5 per la rimozione dei detriti.
4. omogeneizzazione meccanica del cervello e del midollo spinale
NOTA: I volumi descritti in questa sezione sono sufficienti per l'omogeneizzazione di metà del cervello o del midollo spinale. Il protocollo descritto in questa sezione può essere utilizzato come metodo alternativo a quello descritto nella sezione 3, a seconda delle esigenze dell'utente, come descritto di seguito.
- Pre-freddo la malta di vetro della smerigliatrice di tessuto Dounce (Tabella dei materiali) impostata sul ghiaccio.
- Aggiungere 3 mL di HBSS pre-raffreddato alla malta.
- Trasferire il tessuto (cervello o midollo spinale) dal pozzo della piastra 6-well nel mortaio di vetro assicurandosi che sia immerso in 1x HBSS e si siede nella parte inferiore del mortaio.
- Distruggere delicatamente il tessuto con 10 colpi di pestello A seguiti da 10 colpi di pestello B. Trasferire il mix omogeneizzato in un nuovo tubo conico da 15 mL.
- Riempire il tubo fino a un volume finale di 10 mL utilizzando 1x HBSS pre-raffreddato e centrifugare per 10 min a 320 x g a 4 gradi centigradi.
- Aspirare il supernatante e aggiungere ghiaccio-freddo 1x HBSS per ogni tubo fino a un volume finale di 7 mL e respendere delicatamente il pellet vortice.
- Continuare fino alla sezione 5 per la rimozione dei detriti.
5. Rimozione dei detriti
NOTA: la rimozione dei detriti, composta principalmente da guaine di tessuto non digerito e mielina, è un passo fondamentale per consentire una colorazione efficiente del tessuto omogeneo per le successive analisi citometriche del flusso.
- Filtrare ogni campione attraverso un colino cellulare di 70 m per rimuovere qualsiasi pezzo di tessuto non digerito. Questo passaggio è particolarmente importante soprattutto quando si lavora con i tessuti del midollo spinale poiché questi campioni sono più propensi a contenere frammenti nervosi non digeriti o meningi che potrebbero influenzare i passaggi successivi.
- Assicurarsi che il volume finale sia di 7 mL in ogni tubo campione. In caso contrario, riempire con ghiaccio-freddo 1x HBSS fino a 7 mL.
- Aggiungere 3 mL di IPS pre-raffreddato ad ogni campione per creare un volume finale di 10 mL di una soluzione contenente un mezzo di sfumatura di densità al 30% di concentrazione finale. Vorticare delicatamente i campioni per assicurarsi che siano mescolati omogeneamente.
- Campioni di centrifuga per 15 min a 700 x g a 18 gradi centigradi assicurandosi di impostare l'accelerazione della centrifuga su 7 e il freno a 0.
NOTA: La centrifugazione dovrebbe richiedere circa 30 min. - Rimuovere delicatamente i campioni dalla centrifuga.
NOTA: Un disco biancastro composto da detriti e mielina dovrebbe essere visibile galleggiante sulla superficie della soluzione. Un pellet (contenente le cellule di interesse) dovrebbe essere visibile nella parte inferiore del tubo. - Attentamente aspirare tutto il disco biancastro di detriti e poi il resto del supernatante facendo in modo di non spostare il pellet. Lasciare circa 100 l di soluzione sopra il pellet cellulare per evitare il rischio di slovagliarlo inavvertitamente.
- Aggiungere 1 mL di FACS BL, risospendere il pellet conilando su e giù con una punta di pipetta da 1000 l'l e trasferire i campioni a tubi da 1,5 mL.
- Centrifuga per 5 min a 450 x g a temperatura ambiente (RT).
- Aspirare delicatamente il supernatante e sospendere nuovamente il pellet in un buffer appropriato compatibile con le analisi a valle (vedere la sezione 6 per il protocollo utilizzato per la valutazione citometrica del flusso di più tipi di cellule).
6. Colorazione per la valutazione citometrica del flusso di più tipi di cellule
- Risospendere il pellet ottenuto al punto 5,9 con 350 l di FACS BL. Aggiungere il blocco di fc ad ogni campione ad una concentrazione finale di 5 g/mL.
NOTA: Per una colorazione, è necessario utilizzare almeno 100 l di l del campione, per assicurarsi di elaborare un numero sufficiente di cellule per consentire analisi affidabili. - Incubare il campione per 10 min a 4 gradi centigradi prima di procedere con la colorazione.
- Preparare una miscela di anticorpi secondo la Tabella 1.
- Aggiungere la miscela di anticorpi ad ogni tubo, vortice per 5 s e incubare i campioni per 15 min a 4 gradi centigradi al buio.
- Aggiungere 1 mL di PBS ad ogni tubo, vortice e centrifuga per 5 min a 450 x g a RT.
- Nel frattempo preparare streptavidin mix secondo la tabella 1.
- Scartare il supernatante e sospendere nuovamente il pellet nella miscela di streptavidin preparata al passaggio 6.6. Per ogni campione, utilizzare lo stesso volume utilizzato per la colorazione nel passaggio 6.4.
- Vortice per 5 s e incubare i campioni per 10 min a 4 gradi centigradi al buio.
- Aggiungere 1 mL di PBS ad ogni tubo, vortice e centrifuga per 5 min a 450 x g a RT.
- Scartare il supernatante e risospendere nuovamente il pellet in FACS BL. Utilizzare 300 l of FACS BL per ogni 100 l l di campione macchiato.
- Aggiungere 7-amino-actinomycin D (7-AAD) soluzione per ogni campione. Utilizzare 5 L di 7-AAD per ogni 300 - L di campione preparato nel passaggio 6.10.
- Conservare i campioni a 4 gradi centigradi al buio fino all'analisi citofluorimetrica. Eseguire l'analisi entro 16 h dalla preparazione del campione, per garantire >60% di vitalità cellulare.
Risultati
Abbiamo confrontato due diversi metodi di omogeneizzazione (DH contro PD) applicati al cervello del topo e al midollo spinale, per testare l'efficienza nel recupero di diversi tipi di cellule vitali adatti per applicazioni a valle. Per farlo, abbiamo sfruttato un pannello di citometria a flusso a 9 colori progettato per caratterizzare, nello stesso campione, diversi tipi di cellule SNC tra cui microglia, linfociti, neuroni, astrociti, oligodendrociti ed endotelio.
I tessuti cerebrali e del midollo spinale sono stati recuperati da diversi topi (n - 6), divisi in due metà longitudinalmente, pesati ed elaborati in parallelo applicando una interruzione meccanica utilizzando l'omogeneizzatore Dounce (metodo DH) o delicatamente minciati e digeriti ennzimaticamente utilizzando il NTDK commerciale basato sulla papaina (metodo) (Figura 1A). Dopo la rimozione dei detriti, le cellule del cervello o del midollo spinale sono state diluite rispettivamente 1/10 o 1/2/5, in blu Trypan per determinare la resa cellulare e la vitalità con una camera Neubauer(Figura 1B,C). Il metodo DH nel complesso ha prodotto un maggiore rendimento cellulare sia dal cervello che dal midollo spinale. Tuttavia, la maggior parte delle cellule recuperate erano morte, con il risultato che solo il 13,8% - 3,3% delle cellule vitali nel cervello e il 10,5% - 1,5% nel midollo spinale (Figura 1B). Molte delle cellule morte formavano aggregati (Figura 1C); questo fenomeno potrebbe essere dovuto alla presenza di reti cellulari altamente interconnesse (come le cellule endoteliali e gliali che rivestono la vascolatura del SNC) che non potevano essere disaggregate dalla forza di tosatura applicata con il DH. Questi aggregati di cellule morte probabilmente non sono stati rimossi dal gradiente di densità e sono finiti nel pellet cellulare finale utilizzato per l'analisi citofluorimetrica. Al contrario, il metodo PD ha determinato una migliore conservazione complessiva della vitalità cellulare (90,6% - 0,6% nel cervello e 85,2% - 2,8% nel midollo spinale). Papain è in grado di digerire la matrice extracellulare e le giunzioni da cellula a cellula in modo efficiente, portando ad una sospensione a cella singola più uniforme. Alcune delle cellule che muoiono durante il processo di macinazione potrebbero essere ulteriormente digerite dalla papaina che porta alla formazione di detriti cellulari che sono separati in modo più efficiente attraverso il gradiente di densità. Nel complesso, questo probabilmente ha determinato una migliore conservazione della vitalità cellulare con il metodo PD, nonostante un rendimento cellulare leggermente inferiore rispetto al metodo DH.
Un'aliquota di 100 l dal cervello e le sospensioni della colonna vertebrale è stata macchiata con la miscela di anticorpi (Tabella 1) e analizzata dalla citometria di flusso con un pannello a 9 colori. Figura 2A mostra la strategia di gating utilizzata per identificare i diversi tipi di cellule dal cervello e sospensioni della cellula del midollo spinale. In breve, la prima porta identifica la popolazione generale in base alla dispersione in avanti (FSC) e alla dispersione laterale (SSC), esclusi i piccoli detriti cellulari. Quindi vengono identificate le cellule vive (7-AAD-). All'interno della popolazione totale di cellule vive, vengono evidenziate le celle CD45 e CD45. All'interno del cancello CD45, vengono identificati microglia/macrofagi CD45,CD11b e linfociti CD45-CD11b. All'interno di CD45- gate, le cellule sono discriminate in base alla positività per ACSA2 (astrociti) o O4 (oligodendrociti). Le cellule CD45-ACS2-O4- sono ulteriormente suddivise in base alla positività per Thy1 (neuroni) o CD31 (endotelio). Le cellule rimanenti Thy1-CD31 sono classificate come "altri tipi di cellule", non considerate dal nostro mix di anticorpi.
Come mostrato nella Figura 2B, con il metodo DH circa il 38% delle cellule vitali recuperate dal cervello e circa il 32% delle cellule vitali recuperate dal midollo spinale erano di origine ematopoietica (CD45). D'altra parte, il metodo PD ha permesso di recuperare una resa significativamente elevata di cellule vitali in entrambi i tessuti, con una frazione molto grande rappresentata da cellule CD45- non ematopoietiche (circa l'82% nel cervello e il 92% nel midollo spinale). Sorprendentemente, microglia/macrofagi CD45-CD11b rappresentavano la frazione cellulare praticabile più abbondante con il metodo DH (Figura 2C). Tuttavia, il metodo PD ha prodotto una rappresentazione più eterogenea dei tipi di cellule, tra cui gli astrociti ACSA, gli oligodendrociti O4, le cellule endoteliche CD31 e i neuroni Thy1 (Figura 2C). È interessante notare che i neuroni vitali e le cellule endoteliali erano difficilmente rilevabili con il metodo DH.
Il metodo DH si basa sulla macinazione meccanica del tessuto tra il pestello di vetro e malta dell'omogeneizzatore Dounce per ottenere l'omogeneizzazione dei tessuti. Questo potrebbe causare qualche stress di taglio che probabilmente danneggerà e influenzare la vitalità di cellule grandi o molto sensibili come neuroni o cellule della neurovascolatura. Abbiamo valutato la vitalità cellulare (percentuale di 7-cellule AAD) all'interno di ogni sottopopolazione cellulare identificata attraverso il pannello anticorpale (Figura 3). Le cellule ematopoietiche (CD45) isolate dal cervello e dal midollo spinale, compresi i microglia/macrofagi (CD45-CD11b) e altre cellule non mieloidi (CD45-Cd11b-), mostravano una redditività molto elevata indipendentemente dal metodo di omogeneizzazione utilizzato(Figura 3A). Al contrario, il metodo DH ha determinato una significativa riduzione della redditività delle popolazioni CD45 (Figura 3B), mentre il metodo PD ha determinato un'ampia conservazione di diversi tipi di cellule CNS. Nel dettaglio, i neuroni e le cellule endoteliali sono stati i sottopopolazioni più significativamente influenzati dalla DH e conservati con il metodo PD.
Una presentazione schematica dei passaggi critici necessari per una corretta preparazione del campione e la rimozione efficiente dei detriti sono riepilogati nella Figura 4.
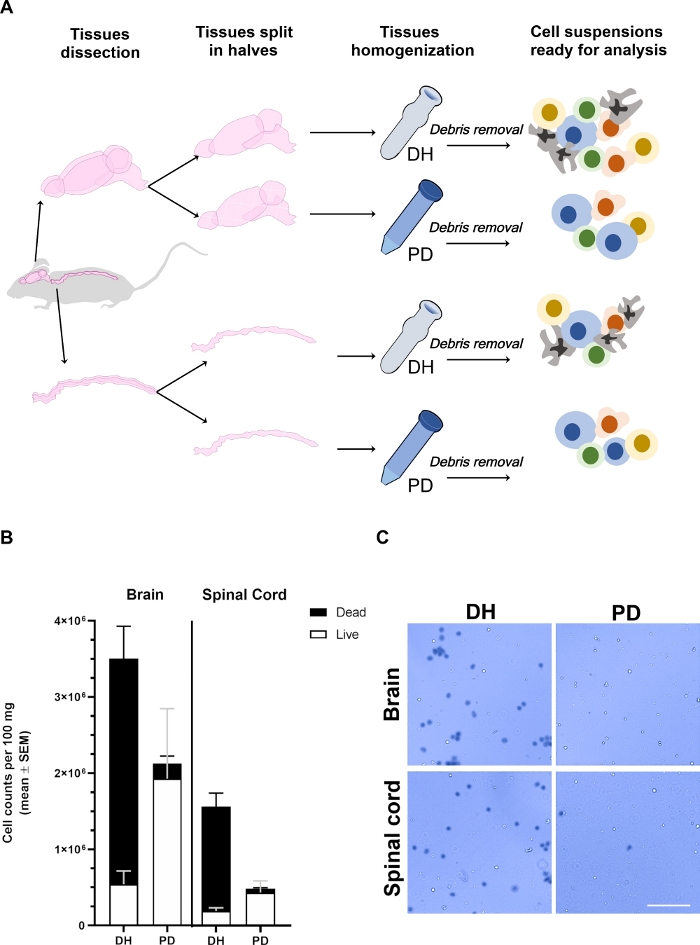
Figura 1: Il rendimento delle cellule recuperate dal cervello e dal midollo spinale è influenzato dal metodo di omogeneizzazione.
(A) Struttura sperimentale. I topi erano anestesi e intracardiacamente persi con PBS per rimuovere le cellule del sangue circolanti intra-vascolari. Il cervello e il midollo spinale sono stati accuratamente sezionati e divisi in due metà longitudinalmente. I tessuti sono stati omogeneizzati usando omogenizer Dounce (DH) o la digestione papaina (PD) come descritto nel testo principale. La mielina e i detriti tissutali sono stati poi rimossi dalla centrifugazione in una soluzione media di gradiente di densità del 30% risultante in una sospensione cellulare eterogenea contenente diversi tipi di cellule che potrebbero essere analizzate dalla citometria di flusso. (B) Istogrammi che mostrano la resa delle cellule recuperate dal cervello o dal midollo spinale dopo l'omogeneizzazione dei tessuti con il metodo DH o PD. È rappresentata la media SEM di almeno 6 animali per condizione. (C) Metafori a campo luminoso rappresentativi delle cellule positive (morte) e negative (vive) recuperate dal cervello o dal midollo spinale con i due metodi. Barra di scala: 100 m. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Le proporzioni relative dei diversi tipi di cellule recuperate dal SNC sono influenzate dal metodo di omogeneizzazione dei tessuti.
(A) Grafici di citometria di flusso rappresentativi che mostrano la strategia di gating per identificare diversi sottopopolamenti cellulari all'interno di preparazioni cellulari ottenute dal cervello o dal midollo spinale: la popolazione cellulare è accompagnata da parametri fisici FSC e SSC, seguita dalla selezione per le cellule vive 7-AAD; allora le cellule sono discriminate in base alla positività del marcatore CD45; I microglia/macrofagi sono identificati come cellule CD11b all'interno della frazione CD45, mentre i linfociti sono CD11b-. Gli astrociti, gli oligodendrociti, le cellule endoteliali e neuronali sono identificati rispettivamente come cellule ACSA2, O4, CD31 o Thy1 all'interno di CD45-. (B) Istogrammi che mostrano la percentuale di cellule CD45 e CD45 all'interno delle popolazioni totali di cellule vive o morte, nel cervello o nel midollo spinale dopo l'omogeneizzazione con il metodo DH o PD. L'analisi statistica dei risultati riportati nei grafici è riportata nella tabella 2. (C) Grafici a torta che mostrano la percentuale di diversi sottotipi di cellule vitali all'interno della popolazione totale delle cellule, nel cervello o nel midollo spinale dopo l'omogeneizzazione con il metodo DH o PD. Viene riportata anche la percentuale di cellule morte totali. N n. 6. CD45-CD11b à microglia/macrofagi; CD45-CD11b- - linfociti/cellule non mieloidi; CD45-ACSA2 - astrociti; CD45-O4: oligodendrociti; CD45-Thy1 - neuroni; CD45-CD31 - cellule endoteliali; Altro: celle negative per tutti i marcatori sopra menzionati. L'analisi statistica dei risultati riportati nei grafici è riportata nella tabella 2. Fare clic qui per visualizzare una versione più grande di questa figura.
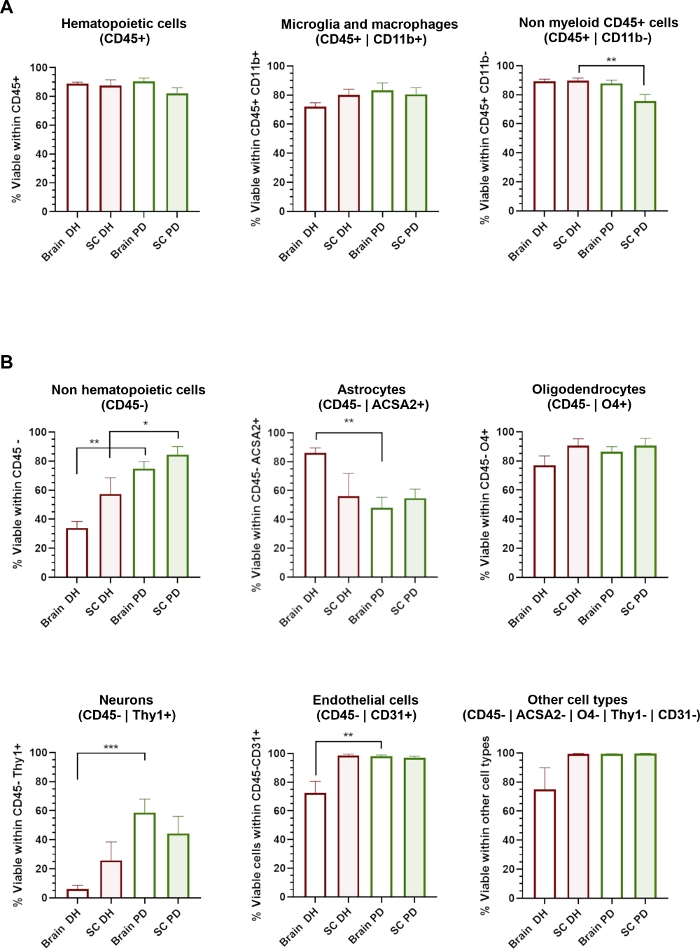
Figura 3: La fattibilità cellulare di diversi tipi di cellule CNS è influenzata dal metodo di omogeneizzazione applicato.
(A) Istogrammi che mostrano la percentuale di 7-AAD- cellule vive all'interno di popolazioni ematopoietiche CD45, tra cui microglia/macrofagi CD11b e cellule CD11b- non mieloidi. (B) Istogrammi che mostrano la percentuale di 7-AAD- cellule vive all'interno di popolazioni CD45- non ematopoietiche tra cui astrociti, oligodendrociti, neuroni, tipi di cellule endoteliali e di altro tipo di cellule. : p < 0,05, s< 0,01, Mann-Whitney tra DH e PD.

Figura 4: Rappresentazione schematica dei passaggi critici necessari per una corretta elaborazione dei tessuti.
Viene visualizzato un elenco dei passaggi più critici necessari per una corretta elaborazione dei tessuti e una rimozione efficiente dei detriti. È importante identificare correttamente il disco di detriti (freccia nera) e il pellet della cellula (freccia blu) formato dopo la centrifugazione dei campioni sul gradiente di densità del 30%. Il disco di detriti, insieme al resto del supernatante, deve essere accuratamente rimosso per aspirazione senza dislocare il pellet cellulare per evitare la perdita del campione. Fare clic qui per visualizzare una versione più grande di questa figura.
| Miscela di anticorpi | Concentrazione iniziale (g/mL) | Concentrazione finale (g/mL) | Fattore di diluizione |
| anti CD45/BV510 | 200 | 2 | 100 |
| anti CD11b/APC.780 | 200 | 2 | 100 |
| anti CD31/BV421 | 200 | 2 | 100 |
| anti ACSA2/APC | 150 | 0.75 | 200 |
| anti O4/biotina | Na | Na | 40 |
| anti CD90.2/PE. Ci7 | 200 | 2 | 100 |
| Miscela Streptavidin | Concentrazione iniziale (g/mL) | Concentrazione finale (g/mL) | Fattore di diluizione |
| Streptavidin/Alexa 680 | 1000 | 1 | 1000 |
Tabella 1: Ricetta per la preparazione di miscele per la colorazione della citometria di flusso. La tabella descrive le concentrazioni ottimali di anticorpi e streptavidina utilizzati per consentire analisi citometriche di flusso di più tipi di cellule. Si prega di fare riferimento alla Tabella dei Materiali per i dettagli sui numeri di catalogo di ogni reagente menzionato nella tabella.
| Statistiche per la figura 2B | ||||||||||
| BRAIN (% cellule) | ||||||||||
| CD45 | CD45- | |||||||||
| vivere | Morto | vivere | Morto | |||||||
| Metodo | Significare | SEM | Significare | SEM | Significare | SEM | Significare | SEM | ||
| Dh | 15.20 | 2,32 USD (in formato 2,32) | 1.90 | 0,30 USD | 24.78 | 4.045 USD | 51.58 | 6.033 USD | ||
| Pd | 15.20 | 2,65 USD (in inglese) | 2.33 | 1,10 USD (1,10) | 68.53 | 3,618 USD | 13.93 | 2.180 USD | ||
| Mann-Whitney | Ns | Ns | *** | ** | ||||||
| valore p | 0.9989 | 0.738 | 0.0006 | 0.0015 | ||||||
| CORD CER-OSA (% cellule) | ||||||||||
| CD45 | CD45- | |||||||||
| vivere | Morto | vivere | Morto | |||||||
| Metodo | Significare | SEM | Significare | SEM | Significare | SEM | Significare | SEM | ||
| Dh | 15.00 | 8,21 USD | 1.41 | 0,11 USD | 31.64 | 8,21 USD | 51.95 | 16,52 USD (16,52) | ||
| Pd | 7.49 | 4,99 USD | 1.15 | 0,68 USD | 84.27 | 9,39 USD (in linguaggio 9,39) | 7.09 | 3,75 USD | ||
| Mann-Whitney | Ns | Ns | * | Ns | ||||||
| valore p | 0.5548 | 0.7236 | 0.0438 | 0.1144 | ||||||
| Statistiche per la figura 2C | |||||||||||||||||
| BRAIN (% cellule) | |||||||||||||||||
| CD45 | CD45- | ||||||||||||||||
| CD11b | CD11b- | ACSA2 | O4 | Tuo1 | CD31 (in formato CD31) | Altro | Morto | ||||||||||
| Metodo | Significare | SEM | Significare | SEM | Significare | SEM | Significare | SEM | Significare | SEM | Significare | SEM | Significare | SEM | Significare | SEM | |
| Dh | 19.32 | 3,88 USD | 1.17 | 0,27 USD | 9.52 | 2,68 USD (in inglese) | 3.41 | 1,01 USD (in linguaggio 1,01) | 1.39 | 0,77 USD | 0.48 | - 0,29 USD | 10.52 | 4,49 USD | 53.83 | 5,79 USD | |
| Pd | 10.88 | 2,03 USD | 1.65 | 0,48 USD | 8.17 | 2,66 USD (in inglese) | 6.54 | 0,76 USD | 6.37 | 1,76 USD (1,76) | 8.27 | 1,25 USD (1,25) | 33.28 | 6,34 USD | 23.72 | 5,31 USD | |
| Mann-Whitney | Ns | Ns | Ns | * | ** | *** | ** | ** | |||||||||
| valore p | 0.1206 | 0.4819 | 0.5894 | 0.0264 | 0.0093 | 0.0003 | 0.0084 | 0.0022 | |||||||||
| CORD CER-OSA (% cellule) | |||||||||||||||||
| CD45 | CD45- | ||||||||||||||||
| CD11b | CD11b- | ACSA2 | O4 | Tuo1 | CD31 (in formato CD31) | Altro | Morto | ||||||||||
| Metodo | Significare | SEM | Significare | SEM | Significare | SEM | Significare | SEM | Significare | SEM | Significare | SEM | Significare | SEM | Significare | SEM | |
| Dh | 21.23 | 6,25 USD | 2.51 | 0,57 USD | 4.26 | 2,34 USD (in formato 2,34) | 9.40 | 1,89 USD (1,89) | 2.82 | 1,51 USD (1,51) | 0.97 | 0,50 USD | 22.74 | 9,04 USD | 35.28 | 1,89 USD (1,89) | |
| Pd | 9.63 | 1,67 USD (1,67) | 2.77 | 0,48 USD | 4.23 | 1,59 USD (1,59) | 28.62 | 3,57 USD | 1.26 | - 0,49 USD | 6.94 | 2,14 USD (in linguaggio 2,14) | 26.39 | 8,17 USD (in linguaggio 8,17) | 19.09 | 4,76 USD | |
| Mann-Whitney | Ns | Ns | Ns | * | Ns | * | Ns | Ns | |||||||||
| valore p | 0.1905 | >0.9999 | 0.7302 | 0.0159 | 0.7302 | 0.0317 | 0.7302 | 0.1111 | |||||||||
Tabella 2: Analisi statistica delle diverse popolazioni recuperate applicando il metodo DH o PD. La tabella descrive le statistiche per i grafici illustrati nella figura 2B e nella figura 2C. La media e il SEM di almeno sei campioni indipendenti sono rappresentati. Vengono inoltre riportati il valore p e i dettagli sul test statistico applicato per ogni confronto.
Discussione
Qui descriviamo un protocollo per la co-purificazione e l'analisi citometrica del flusso simultaneo di alcune delle cellule CNS più rilevanti dal cervello del topo e dal midollo spinale. Tradizionalmente, le analisi istologiche sono state applicate per descrivere la distribuzione delle nanoparticelle o l'efficienza di trasduzione dei vettori virali nel CNS5,13, o per fornire informazioni sui cambiamenti morfologici e molecolari che si verificano in specifici tipi di cellule durante una patologia o durante il trattamento farmacologico14. Tuttavia, l'istologia manca di processività e non consente un esame completo di più caratteristiche negli stessi campioni istologici, a causa del numero limitato di marcatori che possono essere analizzati contemporaneamente. Il nostro approccio può essere complementare alle analisi storiche tradizionali e può essere accoppiato a diverse applicazioni a valle (ordinamento, cultura primaria, analisi biochimiche o di prossima generazione) per espandere la raccolta di informazioni che possono essere ottenute da singoli campioni. Tuttavia, è necessario considerare alcuni fattori chiave elencati di seguito in quanto possono avere un impatto critico sul successo di questo approccio:However, some key factors listed below must be considered as they can critically impact the success of this approach:
- Quantità di tessuto iniziale. Abbiamo ottimizzato la separazione cellulare per iniziare con appena la metà del midollo spinale o del mezzo cervello. Nell'esperienza nostra, l'elaborazione di metà cervello o mezzo midollo spinale da un topo adulto di 8 settimane con il metodo PD produce 1,6 x 106 cellule vitali dal cervello e circa 0,1 x 0,5 x 106 cellule vitali dal midollo spinale dopo la fase di sfumatura di densità. Non abbiamo misurato la resa delle cellule dopo aver applicato il metodo PD sui tessuti di neonati o topi di età inferiore a 8 settimane. Tuttavia, nelle nostre mani, il risultato è proporzionale al peso del tessuto di partenza. Pertanto, per gli animali più giovani (ad esempio, cuccioli di 10 giorni) l'intero cervello o il midollo spinale dovrebbero essere elaborati per garantire una buona resa cellulare per analisi a valle affidabili. Se necessario, raggruppare i tessuti di più animali aiuterebbe ad aumentare la resa cellulare. Nella nostra esperienza, questo protocollo può anche essere applicato senza modifiche per isolare le cellule dal cervello o dal midollo spinale dei ratti, per quanto riguarda la proporzione di reagenti utilizzati per peso del tessuto iniziale è rispettata. Per i tessuti più di 250 mg di peso, si consiglia di scalare i reagenti o dividere il tessuto in più campioni (ogni ponderazione <250 mg).
- Rimozione di meningi/blocchi di tessuto residuo prima del gradiente di densità. Nella nostra esperienza, il metodo PD descritto non è in grado di digerire in modo efficiente meningi o tessuti molto altamente mielinati come i nervi e le radici nervose che emergono dal midollo spinale. Quando questi tessuti sono presenti, alcuni pezzi appiccicosi non digeriti possono rimanere nella sospensione cellulare recuperata dopo i passaggi di digestione ezimatica, prima della rimozione dei detriti. La rimozione di questi blocchi filtrando la soluzione attraverso un colino cellulari di 70 m (come suggerito nel passaggio 5.1) è fondamentale per una preparazione cellulare di successo. Infatti, se non rimosse, le meningi o i pezzi di tessuto ostacoleranno una efficiente separazione del gradiente di densità con conseguente scarsa resa cellulare.
- Tempismo, temperatura e sterilità. È molto importante eseguire tutti i passaggi in modo tempestivo utilizzando le giuste impostazioni di temperatura e incubazioni come suggerito. Questo è fondamentale per garantire un'elevata vitalità cellulare e l'integrità del campione. A seconda dell'applicazione a valle, potrebbe essere necessario eseguire tutti i passaggi sotto una cappa sterile e con reagenti sterili (ad esempio, stabilire le impostazioni cultura delle cellule primarie). L'incubazione estesa nella soluzione digestiva ezimatica oltre il tempo suggerito (sezione 3) potrebbe provocare una goccia di vitalità cellulare. Gli epitopi di alcuni antigeni di superficie potrebbero essere sensibili alla papaina con conseguente perdita di segnale alla citometria di flusso. Per applicazioni specifiche che richiedono marcatori aggiuntivi diversi da quelli descritti in questo articolo, è consigliabile testare le prestazioni di diversi cloni di anticorpi prima di avviare l'esperimento. È stato riferito che il mezzo di gradiente di densità potrebbe contenere alcune tracce di endotossine che possono innescare l'attivazione di cellule immunitarie (microglia/macrofagi). Gli esperimenti dovrebbero sempre essere aggiunti adeguati controlli interni ogni volta che queste popolazioni vengono analizzate, per escludere i possibili effetti indotti dalla procedura. Attaccare con le temperature suggerite e la densità di lavaggio gradiente medio avanzi immediatamente dopo la fase di rimozione dei detriti è di solito sufficiente per evitare l'attivazione di cellule immunitarie sospetti. Tuttavia, nel caso in cui le applicazioni a valle (ad esempio, RNAseq o analisi funzionali) siano interessate da questo passaggio, l'utente deve passare a una preparazione media del gradiente a bassa densità di endotossina (suggerita nella Tabella dei materiali).
- anticorpi FACS e macchina. Il protocollo di colorazione della citometria a flusso presentato fa uso di concentrazioni di anticorpi e coniugazioni di colore che funzionavano meglio con le rese cellulari recuperate nella nostra esperienza di laboratorio e con le macchine FACS disponibili nel nostro istituto. L'utente deve tettarellare gli anticorpi nelle sue mani prima di iniziare un nuovo esperimento, in quanto la concentrazione potrebbe dover essere leggermente regolata. Inoltre, incoraggiamo a utilizzare sempre controlli di colorazione monocolore in ogni esperimento per verificare che tutti gli anticorpi e la configurazione della macchina FACS funzionino in modo adeguato. Va notato che l'antigene CD90 (Thy) utilizzato per rilevare i neuroni esiste in due diversi isotipi, vale a dire CD90.2 o CD90.1 a seconda del ceppo del topo: i ceppi murini più comunemente utilizzati, come C57BL6/J express CD90.2; ceppi di mouse come AKR/J, PL e FVB/N express CD90.1. Pertanto, l'utente deve verificare attentamente la deformazione del mouse e scegliere l'anticorpo anti-CD90 appropriato (come suggerito nella Tabella dei materiali) prima di iniziare gli esperimenti.
In sintesi, il protocollo qui presentato sfrutta una digestione ezimatica delicata seguita da una colorazione a 9 colori che consente un'efficiente valutazione citometrica a flusso simultaneo di diversi tipi di cellule dal cervello del topo e dal midollo spinale. Il protocollo potrebbe essere sfruttato per monitorare in modo semplice e completo l'efficienza del targeting cellulare da nanoparticelle o vettori virali somministrati nel CNS15. Inoltre, il protocollo potrebbe essere facilmente adottato per applicazioni a valle molto delicate, come lo smistamento cellulare, la sottocoltura ex vivo, l'RNAseq a singola cellula, risultando della massima importanza non solo per la valutazione preclinica del targeting cellulare mediante terapie, ma anche per una caratterizzazione approfondita dei processi patologici nelle malattie neurodegenerative.
Una frazione dell'intera popolazione di cellule CNS non è discriminata da questo protocollo (vedere "altri" tipi di cellule nella figura 2); questo può essere spiegato dalla presenza di altri sottotipi cellulari che sono presenti nel SNC ma non sono catturati dagli anticorpi che abbiamo usato. Nelle nostre analisi preliminari, circa il 14% della frazione "altre cellule" è positiva per CD73, un marcatore cellulare mesenchymal arricchito nella neurovascolatura e coinvolto in diversi processi neuroinfiammatori16,17. Inoltre, ipotizziamo che la frazione "altre cellule" potrebbe comprendere anche cellule meno differenziate, come i progenitori in diverse fasi della maturazione, come le cellule staminali neurali nestin, i progenitori radiali gliatori nestin, i "leoni" radiali, i progenitori neurali a doppiocortino, le cellule precursori dell'oligodendrocito NG2, tra gli altri. Questi sottotipi cellulari potrebbero essere facilmente studiati applicando il nostro protocollo di citometria di flusso, poiché abbiamo scelto una configurazione di coloranti fluorescenti che permette di ospitare fino a due marcatori cellulari aggiuntivi coniugati con l'isototoniamina fluoresceina (FITC) o i phycoerythrin (PE).
Nel complesso, il nostro approccio potrebbe fornire un nuovo strumento per indagini più complete nel contesto del SNC (in salute e malattia) che sfruttano una tecnologia ben consolidata che consenta valutazioni quantitative sia qualitative che ad alta produttività come la citometria di flusso.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo studio è stato finanziato dai fondi di start-up del Boston Children's Hospital ad A.B., ALSA grant nr. 17-IIP-343 a M.P., e l'Ufficio dell'Assistente Segretario della Difesa per gli Affari Sanitari attraverso il Programma di Ricerca Sulla Sclerosi Laterale Amiotrofica sotto il Premio n. da W81XWH-17-1-0036 a M.P. Riconosciamo DFCI Flow Cytometry Core per il supporto tecnico.
Materiali
| Name | Company | Catalog Number | Comments |
| 10X HBSS (Calcium, Magnesium chloride, and Magnesium Sulfate-free) | Gibco | 14185-052 | |
| 70 mm Cell Strainer | Corning | 431751 | |
| ACSA/ACSA2 anti-mouse antibody | Miltenyi Biotec | 130-117-535 | APC conjugated |
| Bovine Serum Albumin | Sigma Aldrich | A9647-1KG | |
| CD11b rat anti-mouse antibody | Invitrogen | 47-0112-82 | APC-eFluor 780 conjugated |
| CD31 rat anti-mouse antibody | BD Bioscience | 562939 | BV421 conjugated |
| CD45 rat anti-mouse antibody | Biolegend | 103138 | Brilliant Violet 510 conjugated |
| CD90.1/Thy1.1 rat anti-mouse antibody | Biolegend | 202518 | PE/Cy7 conjugated |
| CD90.2/Thy1.2 rat anti-mouse antibody | Biolegend | 1005325 | PE/Cy7 conjugated |
| Conical Tubes (15 mL) | CellTreat | 229411 | |
| Conical Tubes (50 mL) | CellTreat | 229422 | |
| Dounce Tissue Grinder set (Includes Mortar as well as Pestles A and B) | Sigma-Aldrich | D9063-1SET | |
| Fc (CD16/CD32) Block rat anti-mouse antibody | BD Pharmingen | 553142 | |
| Fetal Bovine Serum | Benchmark | 100-106 | |
| Neural Tissue Dissociation Kit (P) | Miltenyi Biotec | 130-092-628 | |
| O4 anti mouse/rat/human antibody | Miltenyi Biotec | 130-095-895 | Biotin conjugated |
| Percoll | GE Healthcare | 10266569 | sold as not sterile reagent |
| Percoll | Sigma | 65455529 | sterile reagent (to be used for applications requiring sterility) |
| Percoll PLUS | Sigma | GE17-5445-01 | reagent containing very low traces of endotoxin |
| Streptavidin | Invitrogen | S3258 | Alexa Fluor 680 conjugated |
Riferimenti
- Deverman, B. E., Ravina, B. M., Bankiewicz, K. S., Paul, S. M., Sah, D. W. Y. Gene therapy for neurological disorders: progress and prospects. Nature Reviews Drug Discovery. 17 (9), 641-659 (2018).
- Teleanu, D., Negut, I., Grumezescu, V., Grumezescu, A., Teleanu, R. Nanomaterials for Drug Delivery to the Central Nervous System. Nanomaterials. 9 (3), 371 (2019).
- Chen, S., et al. Recombinant Viral Vectors as Neuroscience Tools. Current Protocols in Neuroscience. 87 (1), 67 (2019).
- Alves, S., et al. Ultramicroscopy as a novel tool to unravel the tropism of AAV gene therapy vectors in the brain. Scientific Reports. 6 (1), 28272 (2016).
- Peviani, M., et al. Lentiviral vectors carrying enhancer elements of Hb9 promoter drive selective transgene expression in mouse spinal cord motor neurons. Journal of Neuroscience Methods. 205 (1), 139-147 (2012).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. Journal of Immunological Methods. 243 (1-2), 77-97 (2000).
- Sykora, M. M., Reschke, M. Immunophenotyping of Tissue Samples Using Multicolor Flow Cytometry. Methods in Molecular Biology. 1953, 253-268 (2019).
- Legroux, L., et al. An optimized method to process mouse CNS to simultaneously analyze neural cells and leukocytes by flow cytometry. Journal of Neuroscience Methods. 247, 23-31 (2015).
- Lee, J. K., Tansey, M. G. Microglia Isolation from Adult Mouse Brain. Methods in Molecular Biology. 1041, 17-23 (2013).
- Grabert, K., McColl, B. W. Isolation and Phenotyping of Adult Mouse Microglial Cells. Methods in Molecular Biology. 1784, 77-86 (2018).
- Nikodemova, M., Watters, J. J. Efficient isolation of live microglia with preserved phenotypes from adult mouse brain. Journal of Neuroinflammation. 9 (1), 635 (2012).
- Garcia, J. A., Cardona, S. M., Cardona, A. E. Isolation and analysis of mouse microglial cells. Current Protocols in Immunology. 104 (1), 1-15 (2014).
- Papa, S., et al. Selective Nanovector Mediated Treatment of Activated Proinflammatory Microglia/Macrophages in Spinal Cord Injury. ACS Nano. 7 (11), 9881-9895 (2013).
- Peviani, M., et al. Neuroprotective effects of the Sigma-1 receptor (S1R) agonist PRE-084, in a mouse model of motor neuron disease not linked to SOD1 mutation. Neurobiology of Disease. 62, 218-232 (2014).
- Peviani, M., et al. Biodegradable polymeric nanoparticles administered in the cerebrospinal fluid: Brain biodistribution, preferential internalization in microglia and implications for cell-selective drug release. Biomaterials. 209, 25-40 (2019).
- Meng, F., et al. CD73-derived adenosine controls inflammation and neurodegeneration by modulating dopamine signalling. Brain. 142 (3), 700-718 (2019).
- Nedeljkovic, N. Complex regulation of ecto-5'-nucleotidase/CD73 and A2AR-mediated adenosine signaling at neurovascular unit: A link between acute and chronic neuroinflammation. Pharmacological Research. 144, 99-115 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon