Method Article
אפיון מרובה של סוגי תאים שאוחזרו ממוח העכבר/חוט השדרה דרך שיטות הומוקות שונות
In This Article
Summary
אנו מציגים שיטת הזרמה cy, כדי לזהות בו סוגי תאים שונים שאוחזרו ממוח העכבר או חוט השדרה. שיטה זו יכול להיות מנוצל כדי לבודד או לאפיין אוכלוסיות תאים טהורה במחלות ניווניות או לכמת את היקף המיקוד של התא על vivo ניהול של וקטורים ויראליות או חלקיקים.
Abstract
ההתקדמות האחרונה ב וקטורים וקטוריים ומדעי הננו פתחו את הדרך לגישות חדשניות לקידום החקירה או לטיפול במערכת העצבים המרכזית (CN). עם זאת, אופטימיזציה נוספת של טכנולוגיות אלה היה להפיק תועלת מהשיטות המאפשרות מהירה ולייעל את היקף מידת המיקוד הספציפי לתא על ניהול של וקטורים ויראליות או חלקיקים בגוף. כאן, אנו מציגים פרוטוקול אשר מנצל את התפוקה הגבוהה ואת יכולות ריבוב של זרימה cy, נסה לאפשר כימות ישירה של תת תאים שונים מבודדים ממוח העכבר או חוט השדרה, כלומר microglia/מקרופאגים, לימפוציטים, astrocytes, oligodendrocytes הפוך, נוירונים ותאי אנדותל. אנו מיישמים גישה זו כדי להדגיש הבדלים קריטיים בין שתי שיטות הומוקות רקמות במונחים של התשואה התא, הכדאיות והקומפוזיציה. הדבר יכול להורות למשתמש לבחור את השיטה הטובה ביותר בהתאם לסוג התא (ים) של עניין וליישום הספציפי. שיטה זו אינה מתאימה לניתוח של התפלגות אנטומית, שכן הרקמה היא הומוגניים כדי ליצור השעיה תא בודד. עם זאת, הוא מאפשר לעבוד עם תאים קיימא והוא יכול להיות משולב עם מיון תאים, פתיחת הדרך עבור מספר יישומים שיכולים להרחיב את הרפרטואר של כלים בידיים של נוירומדען, החל הקמת התרבויות הראשיות נגזר אוכלוסיות תאים טהורים, לניתוח גנים ביטוי ביוכימיים או פונקציונלי מוגדר על תת-מוגדרים היטב תאים בהקשר של מחלות ניווניות, על טיפול תרופתי או טיפול גנטי.
Introduction
ג'ין וטכנולוגיות משלוח התרופה (כגון וקטורים וקטורי חלקיקים) הפכו כלי רב עוצמה שניתן להחיל כדי להשיג תובנות טובות יותר על מסלולים מולקולריים ספציפיים שונה במחלות ניווניות ולפיתוח גישות טיפוליות חדשניות1,2,3. אופטימיזציה של כלים אלה מסתמך על כימות של: (1) את היקף החדירה בתוך ה-CN על נתיבי שונים של ניהול ו (2) פילוח של אוכלוסיות תאים ספציפיות. ניתוחים היסטלוגיים מוחלים בדרך כלל על הדמיה של הכתב הפלורסנט גנים או fluorescently אופן מתויג חלקיקים באזורים שונים של המרכז העצמי ועל פני סוגי תאים שונים, מזוהה על ידי כתמים חיסוני עבור סמנים תא ספציפיים4,5. למרות גישה זו מספקת מידע רב ערך על ההתפלגות הביומלית של הגן המנוהל או כלי משלוח התרופות, הטכניקה יכולה להיות גוזלת זמן עבודה אינטנסיבית מאז שהוא דורש: (1) קיבוע רקמות, הקפאה או פרפין-הטבעה וחותך; (2) כתמים עבור סמנים סלולריים ספציפיים לעתים דורשים אחזור אנטיגן; (3) רכישה של מיקרוסקופ הקרינה הפלואורסצנטית, אשר בדרך כלל מאפשר ניתוח של מספר מוגבל של סמנים שונים בתוך אותו ניסוי; (4) עיבוד תמונה כדי לאפשר קוונפיקציה נאותה של אות הריבית.
הפכה cy, להיות טכניקה בשימוש נרחב אשר מנצל סמני פלורסנט ספציפיים מאוד כדי לאפשר לא רק הערכה כמותית מהירה של פנוטיפים תא שונים בשעיות התא, מבוסס על הביטוי של אנטיגנים או משטחים, אלא גם מדידות תפקודית (g., שיעור של אפופטוזיס, התפשטות, ניתוח מחזור התא, וכו '). בידוד פיזי של תאים באמצעות פלורסנט מופעל מיון התא אפשרי גם, המאפשר במורד הזרם יישומים (למשל, תרבות התא, RNAseq, ניתוחים ביוכימיים וכו ') . שש,שבע,שמונה
המגון רקמה היא צעד קריטי הכרחי כדי לקבל השעיית תא בודד כדי לאפשר אמין ומלא להזרים הערכות בזרם הסייטומטרימטרי. שיטות שונות תוארו עבור למבוגרים רקמת המוח המגון, בעיקר עם המטרה לבודד תאים מיקרוגלייה9,10,11; הם יכולים להיות מסווגים באופן כללי בשתי קטגוריות עיקריות: (1) דיסוציאציה מכנית, אשר משתמשת שחיקה או הטיית כוח באמצעות הומוגניד Dounce (DH) כדי לקרוע את התאים מתוך נישות שלהם וליצור הבולם הומוגניים באופן יחסי הולם התא היחיד, ו (2) העיכול האנזימטי, המסתמך על דגירה של נתחי רקמות טחון ב-37 ° c בנוכחות אנזימים בעלי חרדה, כגון טריפסין או פאפאין, העדפה על השפלה של המטריצה המגמטית ליצור השעיית תאים הומוגניים למדי12.
ללא קשר לשיטה מנוצל, צעד טיהור מומלץ לאחר המגון רקמות להסיר את המיאלין דרך צנטריפוגה על הדרגתי צפיפות או על ידי בחירה מגנטית9,12, לפני המעבר יישומים במורד הזרם.
כאן, אנו מתארים שיטת עיבוד רקמות מבוסס על העיכול פפאין (PD) ואחריו טיהור על הדרגתי צפיפות, אופטימיזציה כדי להשיג השעיות תא הטרוגנית קיימא ממוח העכבר או חוט השדרה באופן רגיש זמן ומתאים לזרימה cy, try. יתר על כן, אנו מתארים 9-צבע הפאנל cy, לנסות את האסטרטגיה שאימצנו במעבדה כדי לאפשר את האפליה הסימולטני של אוכלוסיות שונות של ה-CN, חי/מת תאים או חיוביות עבור כתבים פלורסנט כגון חלבון פלורסנט ירוק או צבע rhodamine. על-ידי החלת ניתוח זה של הזרימה, אנו יכולים להשוות שיטות שונות של עיבוד רקמות, כלומר, PD מול DH, מבחינת שימור הכדאיות התאית ותשואות של סוגי תאים שונים.
הפרטים שאנו מספקים במסמך זה יכולים להורות על החלטה על פרוטוקול המגון ושילוב הנוגדן לשימוש בלוח הזרימה cy, מבוסס על סוג תא (ים) מסוים של עניין וניתוח במורד הזרם (g., רגישות לטמפרטורה יישומים, מעקב אחר סמני פלורסנט ספציפיים, בתרבות חוץ גופית, ניתוחים פונקציונליים).
Protocol
כל השיטות המתוארות כאן אושרו על ידי הוועדה לטיפול בבעלי חיים מוסדיים (IACUC) של דנה פרבר סרטן המכון (פרוטוקול מספר 16-024).
1. הכנת הפתרונות הדרושים לניסוי
- הכינו את פתרון המלח המאוזן של האנק (HBSS) על ידי דילול של 10 x HBSS עם מים סטריליים. . לפני שתרגיע את הפתרון בקרח לפחות 25 מ ל של פתרון נחוצים עבור כל דוגמה.
- להכין את התמיסה הפרסואלי של חלחול (IPS) על ידי ערבוב של 10x 1:10 HBSS סטרילי עם צפיפות מעבר בינונית (כלומר, חלחול). . לפני הצינה בקרח
הערה: IPS ניתן לאחסן עד 30 יום ב -4 ° c. - להכין את הזרימה cy, לחסום את התמיסה (BL) פתרון (1% בסרום פרה אלבומין [BSA], 5% סרום של שור העובר [FBS] ב מלוחים מואגור פוספט [PBS]). . לפני הצינה בקרח
2. המתת חסד של בעלי חיים על-ידי הפרזיה וניתוח רקמות
הערה: עכברים C57BL/6J בני שמונה שבועות, או מין, שימשו בניסויים. Perfusion עם פתרון PBS מבוצע כדי למנוע זיהום דם מאיברים, לפני שתמשיך בעיכול רקמות.
- באמצעות תערובת של קטמין/xylazine (90-200 מ"ג/ק ג קטמין, 10 מ"ג/ק"ג xylazine). הנח את העכבר על גבו והדבק כל איבר עד לתמיכה. אמת עומק מתאים של הרדמה על ידי בדיקת רפלקס הנסיגה.
- בצע חתך העור באמצע קו ברמה של כניסת הבית החזה כדי לחשוף את עצם החזה. מלקחיים להשתמש כדי לתפוס את הקצה של עצם החזה, ואז לעשות חתך אחד 1 ס מ על כל צד של כלוב הצלעות. לבסוף לחתוך את הסרעפת ולפתוח את עצם החזה באופן נרחב מספיק כדי לדמיין את הלב.
- השתמש מלקחיים כדי לתפוס בעדינות את הלב על ידי החדר הימני ולהרים אותו לקו האמצע וקצת מחוץ לחזה.
- הכנס מחט פרפר 23 G לקצה החדר השמאלי, לכיוון העורקים ולהחזיק בחוזקה.
- התחל את המיזוג עם 1x PBS. פירס דרך האוריקל הימני באמצעות מספריים כדי לאפשר את המאפשר לצאת מהמחזור. הגדר את קצב הזרימה של ה-PBS ב-3 mL/min. מבשם עם לפחות 15 מ ל של PBS 1 x כדי להבטיח את הרקמות הן ברורות.
הערה: חולצ'ינג של הכבד וכלי דם מצע הם סימנים של perfusion טוב. במידת הצורך, ניתן להגדיל את נפח הפרזיה עד שהנוזל יוצא מהלב הוא ברור מדם, ובנקודה זו ניתן לעצור את קו הריקון. - לאחר הפרזיה, לנתק את המוח מחוט השדרה ולהסיר את המוח מהגולגולת עם מספריים ומלקחיים. הסירו את הפרווה כדי להגביר את הניראות והשליטה במהלך הניתוח ולהימנע מנשיאת מזהמים בשיער. ריקון חוט השדרה מתוך הטור שלה באמצעות מזרק 3 מ ל ממולא PBS.
- העבר כל רקמה בבאר של 6-באר רב היטב צלחת מלאה עם 2 מ ל של קרח קר 1x HBSS ולשמור על קרח עד העיכול.
- מחלקים את המוח ואת חוט השדרה לשני חצאים, לאורך קו האורך.
הערה: חלק אחד של כל רקמה הוא הומוגניים (ראה סעיפים להלן) כדי לאפשר ניתוח ציטומטלי זרימה; החצי השני יכול להיות מוקצה עיבוד שונה עבור ניתוחים חלופיים (למשל, טבל הפתרון הקבע של היסטולוגיה).
3. העיכול האנזימטי של המוח וחוט השדרה
הערה: אמצעי האחסון המתוארים בסעיף זה מספיקים לעיכול של חצי מוח או חוט שדרה.
- השתמש בזוג מספריים כדי להפוך את הרקמות ל 1-2 מ"מ חתיכות עבות.
- חותכים את הקצה של 1000 μL עם זוג מספריים כדי להפוך אותו לגדול מספיק כדי לאפשר את האוסף של חתיכות הרקמה. לשטוף מראש את הטיפ עם HBSS 1x. לאחר מכן השתמש בפיפטה כדי להעביר את 2 mL של פתרון HBSS המכיל את הרקמה הקצוצה ל 15 מ"ל צינור חרוט.
הערה: שטיפה מראש של טיפ הפיפטה חשוב למנוע דביקות של חתיכות הרקמה בתוך הקצה. - לשטוף את הבאר עם תוספת 2 מ ל של ice-קר 1x HBSS ולהעביר את הפתרון המקביל 15 mL הצינור המכיל את חתיכות הרקמה.
- צנטריפוגה כל דוגמה עבור 5 דקות ב 250 x g ב 4 ° c.
- הכינו את תערובת האנזים 1 של ערכת הדיסוציאציה של רקמת העצבים (NTDK; רשימת חומרים) על ידי ערבוב 50 μL של אנזים P עם 1900 μL של מאגר X לכל מדגם. שילוב אנזים חם 1 ב 37 ° c באמבט מים. שילוב האנזים של דגירה 1 ב 37 ° c עבור לפחות 10 דקות לפני השימוש כדי לאפשר את ההפעלה המלאה של האנזים.
- מתיף את סופרנטאנט מצינור 15 מ"ל ולהוסיף 1.95 mL של ערבוב אנזימים 1 לכל מדגם. מערבולת עדינה כדי לוודא. שהגלולה מושעית מחדש
- מודקון את הדגימות על הגלגל או שייקר במשך 15 דקות ב 37 ° c.
- בינתיים, להכין את האנזים לערבב 2 של NTDK על ידי ערבוב 10 μL של אנזים A עם 20 μL של מאגר Y לכל מדגם; חמם את התמיסה מראש ב-37 ° c באמבט מים.
- בסוף הדגירה עם שילוב אנזים 1, להוסיף 30 μL של ערבוב אנזים 2 לכל מדגם.
- בעדינות לערבב את הדגימות על ידי ליטוף למעלה ולמטה עם טיפ 1000 μL הצינורות מראש שוטפים עם 1x HBSS.
- מודאת המדגם על גלגל או שייקר במשך 15 דקות ב 37 ° c.
- לאחר הדגירה, להוסיף 10 מ ל של קרח קר 1x HBSS לכל צינור כדי להשבית את האנזים מיקס 1 ו האנזים לערבב 2.
- צנטריפוגה כל דוגמה עבור 10 דקות ב 320 x g ב 4 ° c.
- השמט את הסופרנטאנט; להוסיף קרח קר 1x HBSS לכל צינור עד הכרך הסופי של 7 mL ולהשעות בעדינות את הגלולה על ידי vortexing.
- המשך לסעיף 5 להסרת פסולת.
4. הומוגון מכני של המוח וחוט השדרה
הערה: אמצעי האחסון המתוארים בסעיף זה מספיקים לצורך הומוגון של מוח במחצית או חוט השדרה. הפרוטוקול המתואר בסעיף זה יכול לשמש כחלופה לשיטה המתוארת בסעיף 3, בהתאם לצורך המשתמש כפי שמתואר להלן.
- השקה מראש את מרגמה הזכוכית של מטחנת הרקמה הדיאונקיית (טבלת חומרים) שנקבעה על הקרח.
- הוסיפו 3 מ ל לחומר המליטה מקורר מצוננים של 1x HBSS.
- העבר את הרקמה (המוח או חוט השדרה) מן הבאר של 6-הצלחת הלוח לתוך מרגמה הזכוכית מוודא שהוא טבל ב 1x HBSS יושב בתחתית המרגמה.
- לרסק בעדינות את הרקמה עם 10 משיכות של כתש ואחריו 10 משיכות של כתש B. להעביר את התערובת הומוגניים לתוך צינור חדש 15 mL.
- למלא את הצינור לנפח הסופי של 10 מ ל באמצעות מקורר 1x HBSS ו צנטריפוגה עבור 10 דקות ב 320 x g ב 4 ° c.
- משף את הסופרנטאנט ומוסיפים את הקרח הקר 1x HBSS לכל צינור עד לנפח סופי של 7 מ ל ומחדש בעדינות את הגלולה על ידי vortexing.
- המשך לסעיף 5 להסרת פסולת.
5. הסרת פסולת
הערה: הסרת פסולת, המורכבת בעיקר של רקמה בלתי מתעכלת ומעילי מיאלין, הוא צעד קריטי כדי לאפשר כתמים יעילים של רקמת העור לניתוחים הבאים לצורך זרימה.
- לסנן כל מדגם דרך מסננת תא 70 יקרומטר כדי להסיר קטע רקמות לא מתעכל. שלב זה חשוב במיוחד במיוחד כאשר עובדים עם רקמות חוט השדרה מאז דגימות אלה נוטים יותר להכיל שברי עצב מתעכל או קרומי שינה שיכול להשפיע על הצעדים הבאים.
- ודא שאמצעי האחסון הסופי הוא 7 mL בכל צינור לדוגמה. אם לא, למלא עם קרח קר 1x HBSS עד 7 מ ל.
- הוסף 3 מ ל של מקורר לפני כל מדגם כדי להפוך את הנפח הסופי של 10 מ ל של פתרון המכיל צפיפות בינונית הדרגתי ב 30% הריכוז הסופי. בעדינות מערבולת הדגימות כדי לוודא שהם מעורבים הומובאופן מאוד.
- דגימות צנטריפוגה עבור 15 דקות ב 700 x g ב 18 ° c ודאו להגדיר את האצת הצנטריפוגה ל 7 ואת בלם ל 0.
הערה: צנטריפוגה אמור להימשך כ -30 דקות. - . הסר בעדינות את הדגימות מהצנטריפוגה
הערה: דיסק לבנבן המורכב מפסולת ומיאלין צריך להיות גלוי צף על פני השטח של הפתרון. גלולה (המכילה את תאי העניין) צריכה להיות גלויה בתחתית הצינורית. - בזהירות לחלק את כל הדיסק לבנבן של פסולת ולאחר מכן את שאר הסופרנט מוודא לא להוציא את הגלולה. השאירו כ 100 μL של הפתרון על גבי הגלולה התא כדי למנוע את הסיכון של חוסר בשוגג אותו.
- להוסיף 1 מ ל של FACS BL, להשעות מחדש את הגלולה על ידי ליטוף למעלה ולמטה עם טיפ 1000 μL הצינורות ודגימות להעביר כדי 1.5 mL צינורות.
- צנטריפוגה עבור 5 דקות ב 450 x g בטמפרטורת החדר (RT).
- השתמש בעדינות את הסופרנט והשהה מחדש את הגלולה במאגר המתאים התואם לניתוחי במורד הזרם (ראה סעיף 6 עבור הפרוטוקול המשמש להערכת הערכה של מספר סוגי תאים).
6. צביעת להערכת הערכת הציטוטומטריות בסוגי תאים מרובים
- השהה מחדש את הגלולה שהושגה בשלב 5.9 עם 350 μL של FACS BL. הוסף לחסום את Fc-בלוק לכל מדגם בריכוז הסופי של 5 μg/mL.
הערה: לפחות 100 μL של המדגם יש להשתמש עבור כתמים אחד, כדי להבטיח לעבד מספיק תאים כדי לאפשר ניתוחים אמינים. - מודאת המדגם עבור 10 דקות ב 4 ° צ' לפני שתמשיך עם ההכתמים.
- הכינו מיקס נוגדן לפי שולחן 1.
- הוסף שילוב נוגדן לכל צינור, מערבולת עבור 5 s ו-מודטה דגימות עבור 15 דקות ב 4 ° c בחושך.
- הוסף 1 mL של PBS לכל צינור, מערבולת וצנטריפוגה עבור 5 דקות ב 450 x g ב RT.
- בינתיים להכין streptavidin mix לפי שולחן 1.
- להיפטר supernatant ולהשעות מחדש את הגלולה בתערובת streptavidin מוכן בשלב 6.6. עבור כל דוגמה, השתמש באותו אמצעי אחסון כמו זה ששימש את ההכתמים בשלב 6.4.
- מערבולת עבור 5 s ו מודות את הדגימות עבור 10 דקות ב 4 ° c בחושך.
- הוסף 1 mL של PBS לכל צינור, מערבולת וצנטריפוגה עבור 5 דקות ב 450 x g ב RT.
- להיפטר supernatant ולהשעות את הגלולה ב-FACS BL. השתמש ב-300 μL של FACS BL עבור כל 100 μL של דגימת מוכתם.
- הוסף פתרון 7-אמינו-אקטינומיצין D (7-עמ מ) לכל דוגמה. השתמש 5 μL של 7 עמ מ עבור כל 300 μL של מדגם שהוכן בשלב 6.10.
- החנות דגימות ב 4 ° c בחושך עד בדיקה ציטופלוורימטרית. בצע את הניתוח בתוך 16 h מהכנה למדגם, כדי להבטיח > 60% הכדאיות תא.
תוצאות
השוונו שתי שיטות שונות של הומוגון (DH נגד PD) להחיל על המוח העכבר ואת חוט השדרה, כדי לבדוק את היעילות באחזור סוגי תאים שונים קיימא מתאים ליישומי מטה. כדי לעשות זאת, אנו מנצלים 9-צבע הפאנל cy, לנסות לאפיין, במדגם זהה, סוגים שונים של תאי ה-CN הכוללים microglia, לימפוציטים, נוירונים, astrocytes, oligodendrocytes הפוך ו אנדותל.
המוח ורקמות חוט השדרה אוחזרו מעכברים שונים (n ≥ 6), פיצול בשני חצאים longitudinally, שקלה ומעובד במקביל על ידי החלת שיבוש מכני או באמצעות הומוגניד (שיטת DH) או טחון בעדינות מתעכל באמצעות ntdk מסחרי מבוסס על פפאין (שיטת PD) (איור 1א). לאחר הסרת פסולת, תאים מהמוח או חוט השדרה היו מדולל 1/10 או 1/2 על 1/5, בהתאמה, ב טרילאן כחול כדי לקבוע את תפוקת התאים ואת הכדאיות עם תא נויבאואר (איור 1ב, ג). שיטת DH הכוללת תפוקת תאים גבוהה יותר מן המוח וחוט השדרה. עם זאת, רוב התאים שאוחזרו היו מתים, וכתוצאה מכך רק 13.8% ± 3.3% של תאים קיימא במוח ו 10.5% ± 1.5% בחוט השדרה (איור 1B). רבים מהתאים המתים יצרו אגרגטים (איור 1ג); תופעה זו יכולה להיות עקב הימצאות של רשתות תאים מחוברים במיוחד (כמו התאים האנדותל והגליאל הבטנה את ה-CN) שלא ניתן לקטוע על ידי כוח החיתוך המוחל עם DH. אלה מצרפים של תאים מוות סביר להניח שלא הוסרו על ידי הדרגתי צפיפות ובסופו של דבר בתוך הגלולה התא הסופי המשמש ניתוח ציטופלואורימטרי. להיפך, השיטה PD קבעה שימור הכולל טוב יותר של הכדאיות התאית (90.6% ± 0.6% במוח ו 85.2% ± 2.8% בחוט השדרה). Papain הוא מסוגל לעכל את מטריצה החילוץ תא אל התא הצמתים ביעילות, המוביל הבולם יותר אחיד התא יחיד. חלק מהתאים המתים במהלך תהליך מינ, יכול להיות מתעכל נוספת על ידי פפאין המוביל היווצרות של פסולת תא כי הם מופרדים ביעילות רבה יותר דרך הדרגתי צפיפות. באופן כללי, סביר להניח שהיא קבעה שימור טוב יותר של הכדאיות בתאים עם שיטת PD, למרות התשואה הנמוכה יותר של התא לעומת שיטת DH.
סדרת מחלקים של 100 μl מהמוח וחוט השדרה השעיות התא היה מוכתם בתמהיל הנוגדן (שולחן 1) ונותחו על ידי הזרימה cy, try עם פאנל 9-צבע. איור 2A מראה את האסטרטגיה של האתר המשמש לזיהוי סוגי תאים שונים מתוך המוח והשעיות התא בחוט השדרה. בקצרה, השער הראשון מזהה את האוכלוסיה הכללית בהתאם לפיזור הקדמי (FSC) ופיזור צדדי (מע), למעט פסולת תא קטנה. לאחר מכן, התאים החיים (7-עמ-) מזוהים. בתוך אוכלוסיה של תאים חיים בשידור חי, CD45 + ו-CD45-תאים מודגשים. בתוך CD45 + שער, CD45 + CD11b + microglia/מקרופאגים ו CD45 + CD11b-לימפוציטים מזוהים. בתוך CD45-gate, תאים מפלים בהתאם לחיוביות עבור ACSA2 (אסטרוציטים) או O4 (oligodendrocytes הפוך). CD45-ACS2-O4-תאים מחולקת ליותר על פי חיוביות עבור Thy1 (נוירונים) או CD31 (אנדותל). הנותרים Thy1-CD31-תאים מסווגים "סוגי תא אחרים", לא מתומחר על ידי שילוב הנוגדן שלנו.
כפי שמוצג באיור 2ב', עם שיטת DH כ-38% מהתאים הקיימא שאוחזרו מהמוח וכ32% מהתאים הניתנים לאחזור מתוך חוט השדרה היו ממקור המטפי (CD45 +). מצד שני, שיטת PD מותר לאחזר תשואה גבוהה באופן משמעותי של תאים קיימא בשתי הרקמות, עם שבר גדול מאוד מיוצג על ידי לא המטפאות CD45-תאים (כ 82% במוח ו 92% בחוט השדרה). להפליא, CD45 + CD11b + microglia/מקרופאגים ייצגו את שבר התא הנפוץ ביותר עם שיטת DH (איור 2ג). עם זאת, שיטת PD הפיק ייצוג הטרוגנית יותר של סוגי תאים, כולל ACSA + astrocytes, O4 + oligodendrocytes הפוך, CD31 + בתאי האנדותל ו Thy1 + נוירונים (איור 2ג). מעניין, נוירונים קיימא ותאי האנדותל לא הניתנים לזיהוי עם שיטת DH.
שיטת DH מסתמכת על שיוף מכני של הרקמה בין מכתש הזכוכית לבין חומר המליטה של הומוגניד להשגת המגון רקמות. זה יכול לגרום לקצת מתח הטיה שסביר להניח נזק ולהשפיע על הכדאיות של תאים גדולים או רגישים מאוד כגון נוירונים או תאים של נוירובלטורה. אנו העריכו את הכדאיות התאית (אחוז של 7-עמ ' תאים) בתוך כל תת האוכלוסיה המזוהה דרך פאנל הנוגדן (איור 3). תאים (CD45 +) מבודדים מן המוח וחוט השדרה, כולל microglia/מקרופאגים (CD45 + CD11b +) ותאים אחרים שאינם מיאלואידים (CD45 + Cd11b-), הציגו הכדאיות הגבוהה ביותר בנפרד משיטת ההעצמה שהיתה בשימוש (איור 3א). להיפך, שיטת DH קבעה הפחתה משמעותית של הכדאיות של CD45-אוכלוסיות (איור 3ב) ואילו שיטת המשטרה קבעה שימור מקיף של סוגי תאי ה-cn השונים. בפרוטרוט, נוירונים ותאי האנדותל היו אוכלוסיות המשנה שהושפעו באופן משמעותי מהDH ונשמרו על ידי שיטת PD.
מצגת סכמטית של הצעדים הקריטיים הדרושים להכנה לדוגמה נאותה והסרת פסולת יעילה מסוכמים באיור 4.
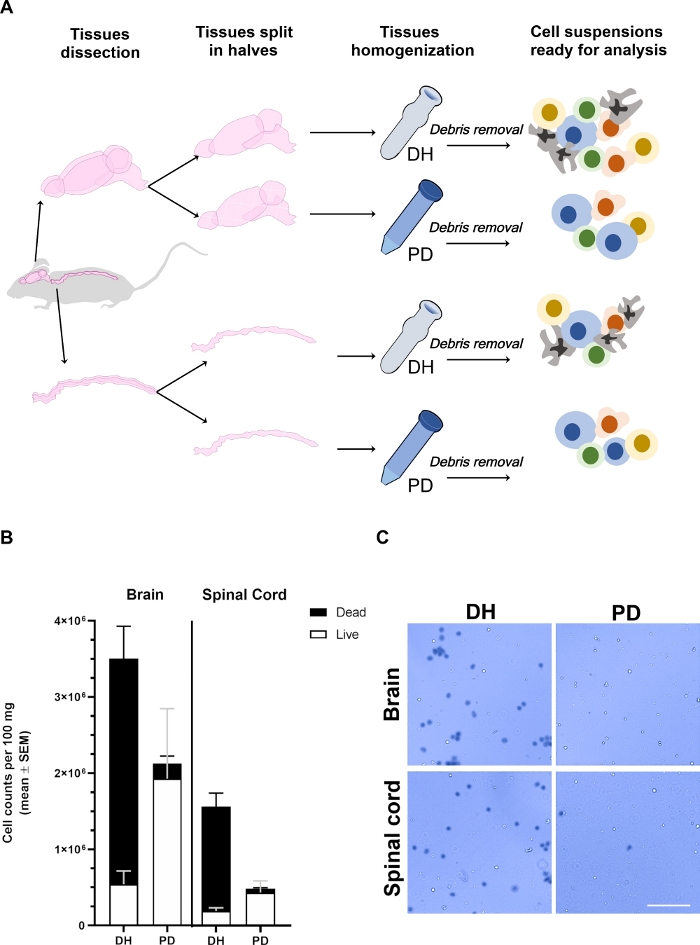
איור 1: התשואה של תאים שאוחזרו מהמוח ומחוט השדרה מושפע משיטת ההעצמה.
(A) ניסיוני מיתאר. כדי להסיר תאי דם. מחזורי במחזור הדם המוח וחוט השדרה היו גזור בקפידה והתפצל שני חצאים longitudinally. הרקמות היו הומוגניים באמצעות או הומוגנידצר (DH) או העיכול פפאין (PD) כפי שמפורט בטקסט הראשי. המיאלין ופסולת רקמות הוסרו לאחר מכן על ידי הצנטריפוגה בפתרון בינוני של 30% צפיפות מעבר הצבע וכתוצאה מכך הבולם התא הטרוגנית המכיל סוגי תאים שונים, כי ניתן לנתח על ידי הזרמת cy, לנסות. (ב) היסטגרמות מראה את התשואה של תאים שאוחזרו מן המוח או חוט השדרה על המגון הרקמה עם השיטה DH או PD. הממוצע ± SEM של לפחות 6 בעלי חיים לכל תנאי מיוצג. (ג) נציג ברייטפילד, מיקרוסקופ משני התאים הכחולים (המתים) והשלילי (החיים), המאוחזר מן המוח או חוט השדרה בשתי השיטות. סרגל בקנה מידה = 100 μm. נא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: הפרופורציות היחסיות של סוגי תאים שונים שאוחזרו מתוך ה-CN מושפעות משיטת ההמגון של הרקמה.
(א) זרם מייצג Cy, מגרשיםהמראים את אסטרטגיית האיתור כדי לזהות תת-שונים של תאים בתוך ההכנות לתא המתקבלים מהמוח או חוט השדרה: אוכלוסיית התאים מגודרת על הפרמטרים fsc ו-הסוכנות למען הציבור, ואחריו בחירה עבור 7-עמ ' תאים לחיות; לאחר מכן, תאים מפלים בהתאם לחיוביות עבור CD45 marker; microglia/מקרופאגים מזוהים כמו CD11b + תאים בתוך השבר CD45 + בעוד לימפוציטים הם CD11b-. האסטרוציטים, הoligodendrocytes הפוך, תאים אנדותל ועצבי מזוהים כמו ACSA2 +, O4 +, CD31 + או Thy1 + תאים בתוך CD45-, בהתאמה. (ב) היסטגרמות מציג את אחוזי CD45 + ו-CD45-cell בתוך אוכלוסיות של כולל חיים או מתים, במוח או בחוט השדרה על-ידי הומוקות עם השיטה DH או PD. הניתוח הסטטיסטי של התוצאות המוצגות בגרפים מדווח בטבלה 2. (ג) תרשימי עוגה המציגים את אחוז סוגי המשנה השונים של התא הקיימא בתוך אוכלוסיית תאים מוחלטת, במוח או בחוט השדרה על-ידי הומוקות עם השיטה DH או PD. האחוז של תאים מתים כולל מדווח גם כן. N ≥ 6. CD45 + CD11b + = microglia/מקרופאגים; CD45 + CD11b-= לימפוציטים/תאים שאינם מיאלואידים; CD45-ACSA2 + = האסטרוציטים; CD45-O4 + = oligodendrocytes הפוך; CD45-Thy1 + = נוירונים; CD45-CD31 + = תאים אנדותל; אחר = תאים שליליים עבור כל סמנים הנ ל. הניתוח הסטטיסטי של התוצאות המוצגות בגרפים מדווח בטבלה 2. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
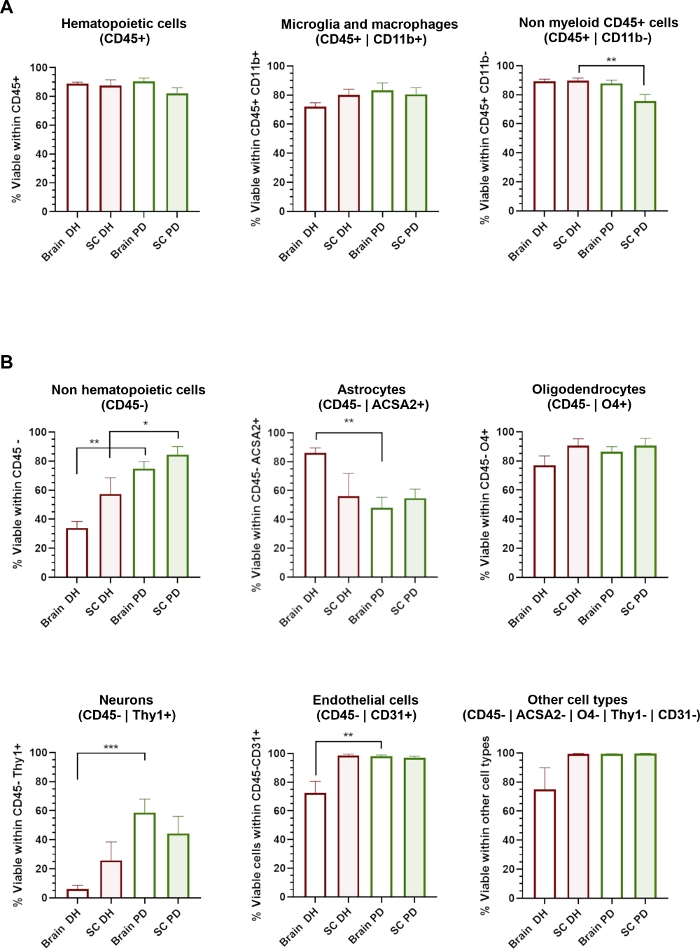
איור 3: הכדאיות התאית של סוגי תאי ה-CN השונים מושפעת משיטת המאבל.
(א) היסטגרמות מציג את אחוז התאים 7 עמ מ-חי בתוך CD45 + המטפאות אוכלוסיות כולל CD11b + microglia/מקרופאגים ו CD11b-מיאלואידית תאים שאינם מיאלואידים. (ב) היסטגרמות מציג את אחוז התאים 7-עמ מ-חיים בתוך CD45-non-המטפאות אוכלוסיות כולל אסטרוציטים, oligodendrocytes הפוך, נוירונים, אנדותל וסוגי תאים אחרים. * = p < 0.05, * * = p < 0.01, מאן-ויטני בין DH ו PD. נא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: ייצוג סכמטי של הצעדים הקריטיים הדרושים לעיבוד רקמות נאות.
רשימה של הצעדים הקריטיים ביותר הדרושים עיבוד רקמות נאות והסרה יעילה של פסולת מוצג. חשוב לזהות כראוי את הדיסק הפסולת (חץ שחור) ואת הגלולה תא (חץ כחול) נוצר לאחר צנטריפוגה של דגימות על הדרגתי בצפיפות 30%. את הדיסק פסולת, יחד עם שאר הסופרנטאנט, יש להסיר בזהירות על ידי השאיפה מבלי לקטוע את הגלולה התא כדי למנוע אובדן לדוגמה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| נוגדן ערבוב | ריכוז ראשוני (μg/mL) | ריכוז סופי (μg/mL) | גורם דילול |
| anti CD45/BV510 | 200 | 2 | 100 |
| anti CD11b/APC. 780 | 200 | 2 | 100 |
| anti CD31/BV421 | 200 | 2 | 100 |
| anti ACSA2/APC | 150 | 0.75 | 200 |
| אנטי O4/ביוטין | נה | נה | 40 |
| anti CD 90.2/PE. Cy7 | 200 | 2 | 100 |
| מיקס Streptavidin | ריכוז ראשוני (μg/mL) | ריכוז סופי (μg/mL) | גורם דילול |
| Streptavidin/אלקסה 680 | 1000 | 1 | 1000 |
טבלה 1: מתכון להכנת תערובות עבור כתמים זרם cy, לנסות. הטבלה מתארת את הריכוזים האופטימליים של נוגדנים וstreptavidin המשמשים לאפשר ניתוח ציטומטלי זרימה של סוגי תאים מרובים. נא לעיין ברשימת החומרים לפרטים על קטלוג מספרים של כל מגיב מוזכר בטבלה.
| נתונים סטטיסטיים עבור איור 2B | ||||||||||
| מוח (% תאים) | ||||||||||
| CD45 + | CD45- | |||||||||
| חיות | מת | חיות | מת | |||||||
| שיטה | תכוון | ± SEM | תכוון | ± SEM | תכוון | ± SEM | תכוון | ± SEM | ||
| DH | 15.20 | 2.32 ± | 1.90 | 0.30 ± | 24.78 | 4.045 ± | 51.58 | 6.033 ± | ||
| שטרת | 15.20 | 2.65 ± | 2.33 | 1.10 ± | 68.53 | 3.618 ± | 13.93 | 2.180 ± | ||
| מאן-ויטני | ns | ns | *** | ** | ||||||
| ערך פי | 0.9989 | 0.738 | 0.0006 | 0.0015 | ||||||
| חוט שדרה (% תאים) | ||||||||||
| CD45 + | CD45- | |||||||||
| חיות | מת | חיות | מת | |||||||
| שיטה | תכוון | ± SEM | תכוון | ± SEM | תכוון | ± SEM | תכוון | ± SEM | ||
| DH | 15.00 | 8.21 ± | 1.41 | 0.11 ± | 31.64 | 8.21 ± | 51.95 | 16.52 ± | ||
| שטרת | 7.49 | 4.99 ± | 1.15 | 0.68 ± | 84.27 | 9.39 ± | 7.09 | 3.75 ± | ||
| מאן-ויטני | ns | ns | * | ns | ||||||
| ערך פי | 0.5548 | 0.7236 | 0.0438 | 0.1144 | ||||||
| נתונים סטטיסטיים עבור איור 2C | |||||||||||||||||
| מוח (% תאים) | |||||||||||||||||
| CD45 + | CD45- | ||||||||||||||||
| CD11b + | CD11b- | ACSA2 | O4 | Thy1 | CD31 | אחרים | מת | ||||||||||
| שיטה | תכוון | ± SEM | תכוון | ± SEM | תכוון | ± SEM | תכוון | ± SEM | תכוון | ± SEM | תכוון | ± SEM | תכוון | ± SEM | תכוון | ± SEM | |
| DH | 19.32 | 3.88 ± | 1.17 | 0.27 ± | 9.52 | 2.68 ± | 3.41 | 1.01 ± | 1.39 | 0.77 ± | 0.48 | 0.29 ± | 10.52 | 4.49 ± | 53.83 | 5.79 ± | |
| שטרת | 10.88 | 2.03 ± | 1.65 | 0.48 ± | 8.17 | 2.66 ± | 6.54 | 0.76 ± | 6.37 | 1.76 ± | 8.27 | 1.25 ± | 33.28 | 6.34 ± | 23.72 | 5.31 ± | |
| מאן-ויטני | ns | ns | ns | * | ** | *** | ** | ** | |||||||||
| ערך פי | 0.1206 | 0.4819 | 0.5894 | 0.0264 | 0.0093 | 0.0003 | 0.0084 | 0.0022 | |||||||||
| חוט שדרה (% תאים) | |||||||||||||||||
| CD45 + | CD45- | ||||||||||||||||
| CD11b + | CD11b- | ACSA2 | O4 | Thy1 | CD31 | אחרים | מת | ||||||||||
| שיטה | תכוון | ± SEM | תכוון | ± SEM | תכוון | ± SEM | תכוון | ± SEM | תכוון | ± SEM | תכוון | ± SEM | תכוון | ± SEM | תכוון | ± SEM | |
| DH | 21.23 | 6.25 ± | 2.51 | 0.57 ± | 4.26 | 2.34 ± | 9.40 | 1.89 ± | 2.82 | 1.51 ± | 0.97 | 0.50 ± | 22.74 | 9.04 ± | 35.28 | 1.89 ± | |
| שטרת | 9.63 | 1.67 ± | 2.77 | 0.48 ± | 4.23 | 1.59 ± | 28.62 | 3.57 ± | 1.26 | 0.49 ± | 6.94 | 2.14 ± | 26.39 | 8.17 ± | 19.09 | 4.76 ± | |
| מאן-ויטני | ns | ns | ns | * | ns | * | ns | ns | |||||||||
| ערך פי | 0.1905 | > 0.9999 | 0.7302 | 0.0159 | 0.7302 | 0.0317 | 0.7302 | 0.1111 | |||||||||
טבלה 2: ניתוח סטטיסטי של אוכלוסיות שונות שאוחזרו על-ידי החלת שיטת DH או PD. הטבלה מתארת את הסטטיסטיקות של הגרפים המוצגים באיור 2ב ואיור 2ג. הממוצע ו-SEM של לפחות שישה דגימות עצמאיות מיוצגים. הערך p והפרטים על הבדיקה הסטטיסטית שהוחלו עבור כל השוואה ידווחו גם הם.
Discussion
כאן אנו מתארים פרוטוקול לניתוח שיתוף טיהור וזרימה במקביל של חלק מתאי ה-CN הרלוונטיים ממוח העכבר וחוט השדרה. באופן מסורתי, ניתוחים היסטולוגיים הוחלו כדי לתאר את התפלגות חלקיקים או את היעילות התמרה של וקטורים ויראליות ב-cn5,13, או כדי לספק תובנות על שינויים מורפולוגיים ומולקולריים המתרחשים סוגי תאים ספציפיים במהלך פתולוגיה או על טיפול תרופתי14. עם זאת, היסטולוגיה חסר מעבד והוא אינו מאפשר בדיקה מקיפה של תכונות מרובות באותם דגימות היסטולוגית, בשל מספר מוגבל של סמנים שניתן לנתח בו. הגישה שלנו יכולה להיות משלימה ניתוחים היסטולוגיים המסורתית וזה יכול להיות ביחד עם מספר יישומים במורד הזרם (מיון, התרבות הראשית, ביוכימיים או הדור הבא-רצפי ניתוח) כדי להרחיב את האוסף של מידע שניתן להשיג מדגימות בודדות. עם זאת, מספר גורמים מרכזיים המפורטים להלן חייבים להיחשב כשהם יכולים להשפיע באופן ביקורתי על הצלחת הגישה:
- כמות הרקמה ההתחלתית. יש לנו אופטימיזציה של הפרדת התא כדי להתחיל עם מעט כמו חצי חוט השדרה או חצי מוח. בניסיון שלנו, עיבוד חצי המוח או חצי חוט השדרה מן העכבר המבוגר בן 8 שבועות עם התשואות שיטת PD 1 על 6 x 106 תאים קיימא מהמוח ו כ 0.1-0.5 x 106 תאים קיימא מחוט השדרה לאחר שלב צפיפות הדרגתי. לא מדדנו תאים תשואה לאחר החלת שיטת PD על רקמות מיילוד או עכברים צעירים יותר 8 שבועות. עם זאת, בידינו, התוצאה היא פרופורציונלית למשקל של הרקמה ההתחלתית. לפיכך, עבור בעלי חיים צעירים יותר (למשל, כלבלבים בני 10 ימים) את המוח כולו או חוט השדרה צריך להיות מעובד כדי להבטיח תשואה תא טוב עבור ניתוח המטה אמין. במקרה הצורך, לאגירת רקמות ממספר בעלי חיים יעזור להגדיל את התשואות התאים. בניסיון שלנו, פרוטוקול זה יכול להיות גם להחיל ללא שינויים לבידוד תאים מהמוח או חוט השדרה של חולדות, ככל שיעור של ריאגנטים בשימוש לכל משקל של רקמת ההתחלה מכובד. עבור רקמות יותר מ 250 מ ג של משקל, שינוי קנה מידה של ריאגנטים או פיצול רקמות בדגימות מרובות (כל משקל < 250 מ"ג) הוא הציע.
- הסרת קרומי שאריות של קרום העור לפני הצפיפות. מניסיוננו, שיטת ה-PD המתוארת בזאת אינה מסוגלת לעכל ביעילות מנתחי קרום או רקמות מיאלואידית מאוד מאוד כגון העצבים ושורשי העצבים המתעוררים מחוט השדרה. כאשר הרקמות האלה קיימות, כמה חתיכות דביק מתעכל עשוי להישאר בתא ההשעיה המאוחזרים לאחר שלבי העיכול אנזימטי, לפני הסרת הפסולת. הסרת גושים אלה על-ידי סינון הפתרון באמצעות מסננת תא 70 יקרומטר (כפי שהוצע בשלב 5.1) הוא קריטי להכנה של תא מוצלח. למעשה, אם לא הוסרו, הקרום או חתיכות רקמות יהיה לעכב צפיפות יעילה הפרדה מעבר הדרגתי וכתוצאה מכך התשואות תאים עניים.
- . תזמון, טמפרטורה ועקרות חשוב מאוד לבצע את כל השלבים בצורה מבעוד מועד באמצעות הגדרות הטמפרטורה הנכונה incubations כפי שהוצע. הדבר קריטי כדי להבטיח את הכדאיות והתקינות של התא הגבוה של המדגם. בהתאם ליישום במורד הזרם, ביצוע כל השלבים תחת מכסה סטרילי, עם ריאגנטים סטרילי עשוי להיות נחוץ (למשל, הקמת תרבויות התא הראשי). דגירה המורחבת בפתרון העיכול האנזימטי מעבר לזמן המוצע (סעיף 3) עלולה לגרום לירידה של יכולת הקיום של התא. האפיציתים של אנטיגנים משטח מסוימים יכול להיות רגיש פפאין וכתוצאה מכך אובדן של אות בתוך הזרימה cy, לנסות. עבור יישומים ספציפיים הדורשים סמנים נוספים מלבד אלה המתוארים במאמר זה, בדיקת הביצועים של שיבוטים נוגדנים שונים מומלץ לפני תחילת הניסוי. זה דווח כי המדיום צפיפות מעבר הצבע יכול להכיל כמה שרידים של אנטוקסינים שעלולים להפעיל הפעלה של תאים חיסוניים (microglia/מקרופאגים). יש להוסיף את הפקדים הפנימיים המתאימים תמיד לניסויים בכל פעם שאוכלוסיות אלה מנותחות, כדי שלא לכלול תופעות אפשריות שנובעות מההליך. הדבקה בטמפרטורות המוצעות ובדחיסות שטיפת מעבר הצבע בינונית מיד לאחר ששלב הסרת הפסולת הוא בדרך כלל מספיק כדי למנוע הפעלה גלויה של תאים חיסוניים. עם זאת, במקרה של יישומים במורד הזרם (למשל, RNAseq או ניתוחים פונקציונליים) מושפעים בשלב זה, המשתמש צריך לעבור בצפיפות נמוכה אנדוטוקסין בינונית הכנה (המוצעים בלוח חומרים).
- . נוגדנים ומכונות הזרם cy, לנסות כתמים הפרוטוקול הציג בזאת עושה שימוש בריכוזי נוגדנים ומצובי צבע שעבדו היטב עם תשואות תאים שאוחזרו בניסיון המעבדה שלנו עם מכונות FACS זמין במכון שלנו. על המשתמש להפעיל את הנוגדנים בידיו לפני תחילת הניסוי החדש, מאחר שייתכן שריכוז צריך להיות מותאם מעט. מלבד זאת, אנו מעודדים להשתמש תמיד בפקדים בעלי צבע יחיד חד-צבעי בכל ניסוי כדי לוודא שכל הנוגדנים והגדרת הפיצוי של מכונת ה-FACS פועלים בצורה מספקת. יש לשים לב כי CD90 (שלך) אנטיגן המשמש לזיהוי נוירונים קיימים בשני איזוסוגים שונים, כלומר CD 90.2 או CD 90.1 בהתאם למתח העכבר: זנים העכבר הנפוץ ביותר, כגון C57BL6/J express תקליטור 90.2; זנים של העכבר כגון AKR/J, PL, ו-FVB/N express CD 90.1. כך, המשתמש צריך בזהירות לאמת את הלחץ על העכבר ולבחור את הנוגדן anti-CD90 המתאים (כפי שהוצע בטבלה של חומרים) לפני תחילת הניסויים.
לסיכום, הפרוטוקול המוצג כאן מנצל את היעילות של העיכול אנזימטי עדין ולאחריו מכתים 9-צבעים המאפשר הערכה יעילה של זרימה בו של סוגי תאים שונים ממוח העכבר וחוט השדרה. ניתן לנצל את הפרוטוקול כדי לפקח באופן מפשט ומקיף את היעילות של המיקוד של התא על ידי חלקיקים או וקטורים נגיפי מנוהל ב-CN15. יתר על כן, הפרוטוקול יכול להיות מאומץ בקלות עבור יישומים עדינים מאוד במורד הזרם, כגון מיון התא, vivo תת-תרבות לשעבר, תא יחיד RNAseq, והתוצאה היא חשיבות עליונה לא רק להערכת טרום קליני של תא פילוח על ידי therapeutics אלא גם לאפיון מעמיק של תהליכים פתולוגיים מחלות ניווניות.
חלק מכלל האוכלוסיה בתאי ה-CN אינו מופלים על-ידי פרוטוקול זה (ראה סוגי תאים אחרים באיור 2); זה יכול להיות מוסבר על ידי נוכחות של תת תאים אחרים הנמצאים בתוך ה-CN, אבל הם לא נתפסו על ידי נוגדנים השתמשנו. בניתוחים הראשוניים שלנו, כ -14% מתוך השבר "תאים אחרים" הוא חיובי עבור CD73, סמן תא mesenchymal מועשר בנוירוסקובלטורה ומעורב במספר תהליכים נוירודלקתיים16,17. יתר על כן, אנו ההשערה כי "תאים אחרים" שבר יכול גם להוות תאים הבדיל פחות, כמו ושלתי בשלבים שונים של התבגרות, כגון nestin + תאי גזע עצביים, nestin + vimentin + רדיאלי glia ושלתי, doublecortin + ושלתי עצביים, NG2 + אוליגודנדרוציטים תאים מקודמי, בין היתר. אלה תת תא סוגי יכול להיות נחקר בקלות על ידי החלת הפרוטוקול שלנו cy, הזרימה שלנו, מאז בחרנו את התצורה של צבעי פלורסנט המאפשר להכיל עד שני סמנים תא נוספים מבתרים עם fluorescein isothiocyanate (PE) או phycoerythrin (פה) fluorophores.
באופן כללי, הגישה שלנו יכולה לספק כלי חדש לחקירות מקיפות יותר בהקשר של ה-CN (בבריאות ובמחלות) ניצול טכנולוגיה מאוחדת המאפשרת הן הערכות כמותית ואיכותית ובעלת תפוקה גבוהה כגון זרם cy, לנסות.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
מחקר זה מומן על ידי כספי הסטארט-up של בית החולים לילדים של בוסטון א יהושע, ALSA גרנט nr. 17-IIP-343 כדי לעשות זאת, והמשרד של עוזר מזכיר ההגנה לענייני בריאות באמצעות תוכנית המחקר טרשת לרוחב Amyotrophic תחת הפרס לא. W81XWH-17-1-0036 ל-שוטרים אנו מכירים DFCI זרימה Cysupport ליבה לתמיכה טכנית.
Materials
| Name | Company | Catalog Number | Comments |
| 10X HBSS (Calcium, Magnesium chloride, and Magnesium Sulfate-free) | Gibco | 14185-052 | |
| 70 mm Cell Strainer | Corning | 431751 | |
| ACSA/ACSA2 anti-mouse antibody | Miltenyi Biotec | 130-117-535 | APC conjugated |
| Bovine Serum Albumin | Sigma Aldrich | A9647-1KG | |
| CD11b rat anti-mouse antibody | Invitrogen | 47-0112-82 | APC-eFluor 780 conjugated |
| CD31 rat anti-mouse antibody | BD Bioscience | 562939 | BV421 conjugated |
| CD45 rat anti-mouse antibody | Biolegend | 103138 | Brilliant Violet 510 conjugated |
| CD90.1/Thy1.1 rat anti-mouse antibody | Biolegend | 202518 | PE/Cy7 conjugated |
| CD90.2/Thy1.2 rat anti-mouse antibody | Biolegend | 1005325 | PE/Cy7 conjugated |
| Conical Tubes (15 mL) | CellTreat | 229411 | |
| Conical Tubes (50 mL) | CellTreat | 229422 | |
| Dounce Tissue Grinder set (Includes Mortar as well as Pestles A and B) | Sigma-Aldrich | D9063-1SET | |
| Fc (CD16/CD32) Block rat anti-mouse antibody | BD Pharmingen | 553142 | |
| Fetal Bovine Serum | Benchmark | 100-106 | |
| Neural Tissue Dissociation Kit (P) | Miltenyi Biotec | 130-092-628 | |
| O4 anti mouse/rat/human antibody | Miltenyi Biotec | 130-095-895 | Biotin conjugated |
| Percoll | GE Healthcare | 10266569 | sold as not sterile reagent |
| Percoll | Sigma | 65455529 | sterile reagent (to be used for applications requiring sterility) |
| Percoll PLUS | Sigma | GE17-5445-01 | reagent containing very low traces of endotoxin |
| Streptavidin | Invitrogen | S3258 | Alexa Fluor 680 conjugated |
References
- Deverman, B. E., Ravina, B. M., Bankiewicz, K. S., Paul, S. M., Sah, D. W. Y. Gene therapy for neurological disorders: progress and prospects. Nature Reviews Drug Discovery. 17 (9), 641-659 (2018).
- Teleanu, D., Negut, I., Grumezescu, V., Grumezescu, A., Teleanu, R. Nanomaterials for Drug Delivery to the Central Nervous System. Nanomaterials. 9 (3), 371(2019).
- Chen, S., et al. Recombinant Viral Vectors as Neuroscience Tools. Current Protocols in Neuroscience. 87 (1), 67(2019).
- Alves, S., et al. Ultramicroscopy as a novel tool to unravel the tropism of AAV gene therapy vectors in the brain. Scientific Reports. 6 (1), 28272(2016).
- Peviani, M., et al. Lentiviral vectors carrying enhancer elements of Hb9 promoter drive selective transgene expression in mouse spinal cord motor neurons. Journal of Neuroscience Methods. 205 (1), 139-147 (2012).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. Journal of Immunological Methods. 243 (1-2), 77-97 (2000).
- Sykora, M. M., Reschke, M. Immunophenotyping of Tissue Samples Using Multicolor Flow Cytometry. Methods in Molecular Biology. 1953, 253-268 (2019).
- Legroux, L., et al. An optimized method to process mouse CNS to simultaneously analyze neural cells and leukocytes by flow cytometry. Journal of Neuroscience Methods. 247, 23-31 (2015).
- Lee, J. K., Tansey, M. G. Microglia Isolation from Adult Mouse Brain. Methods in Molecular Biology. 1041, 17-23 (2013).
- Grabert, K., McColl, B. W. Isolation and Phenotyping of Adult Mouse Microglial Cells. Methods in Molecular Biology. 1784, 77-86 (2018).
- Nikodemova, M., Watters, J. J. Efficient isolation of live microglia with preserved phenotypes from adult mouse brain. Journal of Neuroinflammation. 9 (1), 635(2012).
- Garcia, J. A., Cardona, S. M., Cardona, A. E. Isolation and analysis of mouse microglial cells. Current Protocols in Immunology. 104 (1), 1-15 (2014).
- Papa, S., et al. Selective Nanovector Mediated Treatment of Activated Proinflammatory Microglia/Macrophages in Spinal Cord Injury. ACS Nano. 7 (11), 9881-9895 (2013).
- Peviani, M., et al. Neuroprotective effects of the Sigma-1 receptor (S1R) agonist PRE-084, in a mouse model of motor neuron disease not linked to SOD1 mutation. Neurobiology of Disease. 62, 218-232 (2014).
- Peviani, M., et al. Biodegradable polymeric nanoparticles administered in the cerebrospinal fluid: Brain biodistribution, preferential internalization in microglia and implications for cell-selective drug release. Biomaterials. 209, 25-40 (2019).
- Meng, F., et al. CD73-derived adenosine controls inflammation and neurodegeneration by modulating dopamine signalling. Brain. 142 (3), 700-718 (2019).
- Nedeljkovic, N. Complex regulation of ecto-5'-nucleotidase/CD73 and A2AR-mediated adenosine signaling at neurovascular unit: A link between acute and chronic neuroinflammation. Pharmacological Research. 144, 99-115 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved