Method Article
توصيف التدفق الخلوي المتزامن لأنواع الخلايا المتعددة التي تم استردادها من الدماغ/الحبل الشوكي من خلال أساليب تجانس مختلفه
In This Article
Summary
نقدم طريقه قياس التدفق الخلوي للتعرف علي أنواع مختلفه من الخلايا التي يتم استردادها من دماغ الماوس أو الحبل الشوكي في نفس الوقت. ويمكن استغلال هذه الطريقة لعزل أو توصيف مجموعات الخلايا النقية في الامراض التنكسية العصبية أو لقياس مدي استهداف الخلايا في الاداره المجرية لنواقل أو جسيمات نانويه فيروسية.
Abstract
وقد فتحت التطورات الاخيره في مجال النواقل الفيروسية والعلوم النانوماتيرياله الطريق امام نهج متطورة جديده للتحقيق في الجهاز العصبي المركزي أو التلاعب به (CNS). ومع ذلك ، فان الاستفادة المثلي من هذه التكنولوجيات ستستفيد من الأساليب التي تسمح بالتحديد السريع والمبسط لمدي التركيز العصبي الخلوي والاستهداف الخاص بالخلايا علي أداره النواقل الفيروسية أو الجسيمات النانويه في الجسم. هنا ، نقدم البروتوكول الذي يستفيد من الانتاجيه العالية وقدرات الإرسال المتعدد لقياس التدفق الخلوي للسماح بالتحديد الكمي المباشر للأنواع الفرعية المختلفة من الخلايا المعزولة عن دماغ الماوس أو الحبل الشوكي ، اي الخلايا الصغيرة/الضامة ، اللمفاويات ، استروسينتيس نحن نطبق هذا النهج لتسليط الضوء علي الاختلافات الحاسمة بين طريقتين تجانس الانسجه من حيث الغلة الخلية ، والقدرة علي البقاء والتكوين. وهذا يمكن ان يرشد المستخدم لاختيار أفضل طريقه اعتمادا علي نوع (s) الخلية من الفائدة وتطبيق معين. هذا الأسلوب غير مناسب لتحليل التوزيع التشريحي ، لان النسيج متجانس لتوليد تعليق خليه واحده. ومع ذلك ، فانه يسمح للعمل مع خلايا قابله للحياة وانه يمكن الجمع بين الخلية الفرز ، فتح الطريق امام العديد من التطبيقات التي يمكن ان توسع ذخيرة الاداات في ايدي الأعصاب ، بدءا من إنشاء الثقافات الاوليه المستمدة من الخلايا النقية ، إلى تحليلات التعبير الجيني والاختبارات البيوكيميائية أو الوظيفية علي الأنواع الفرعية المحددة جيدا في سياق امراض الأعصاب
Introduction
أصبحت تقنيات توصيل الجينات والادويه (مثل النواقل الفيروسية والجسيمات النانويه) أداه قويه يمكن تطبيقها للحصول علي رؤى أفضل حول المسارات الجزيئية المحددة التي تم تغييرها في امراض الأعصاب ولتطوير الطرق العلاجية المبتكرة1،2،3. وتعتمد الاستفادة المثلي من هذه الاداات علي القياس الكمي لما يلي: (1) مدي التغلغل في الجهاز العصبي العام عند طرق الاداره المختلفة و (2) استهداف فئات معينه من الخلايا. وعاده ما يتم تطبيق التحليلات النسيجية لتصور الجينات مراسل الفلورسنت أو فلوريسسينتلي الموسومة النانويه في مختلف المناطق العصبية وعبر أنواع الخلايا المختلفة ، التي حددتها المناعية لعلامات خليه محدده4،5. وعلي الرغم من ان هذا النهج يوفر معلومات قيمه عن التوزيع الإحيائي للجينات التي تدار بالجينات أو أدوات تسليم المخدرات ، فان هذه التقنية يمكن ان تستغرق وقتا طويلا وتكون كثيفه العمالة لأنها تتطلب: (1) تثبيت الانسجه ، أو الحفظ بالتبريد ، أو تضمين البارافين وتقطيعها ؛ (2) تلطيخ لعلامات خلوية محدده تتطلب أحيانا استرجاع مستضد ؛ (3) الاستحواذ عن طريق المجهر الفلوري ، الذي يسمح عاده بتحليل عدد محدود من العلامات المختلفة في نفس التجربة ؛ (4) معالجه الصور للسماح بالتحديد الكمي المناسب لاشاره الفائدة.
وقد أصبح التدفق الخلوي تقنيه تستخدم علي نطاق واسع والتي تستفيد من علامات الفلورسنت محدده جدا للسماح ليس فقط التقييم الكمي السريع لمختلف الظواهر الخلوية في تعليق الخلية ، استنادا إلى التعبير عن المستضدات السطحية أو داخل الخلايا ، ولكن أيضا قياسات وظيفية (مثل معدل المبرمج ، والانتشار ومن الممكن أيضا العزل المادي للخلايا من خلال فرز خلايا الفلورسنت المنشطة ، مما يسمح بالمزيد من التطبيقات النهائية (علي سبيل المثال ، ثقافة الخلايا ، RNAseq ، التحاليل البيوكيميائية الخ) 6،7،8.
تجانس الانسجه هو خطوه حاسمه ضرورية للحصول علي تعليق خليه واحده للسماح موثوق بها وقابله للتكرار التقييمات الخلوية تدفق المصب. وقد وصفت طرق مختلفه لتجانس انسجه المخ الكبار ، وذلك أساسا بهدف عزل الخلايا الدقيقة الصغرى9،10،11؛ ويمكن تصنيفها بشكل عام في فئتين رئيسيتين: (1) التفكك الميكانيكي ، الذي يستخدم الطحن أو القص القوه من خلال الخالط Dounce (DH) لتمزيق الخلايا من منافذها وتشكيل تعليق خليه واحده متجانسة نسبيا ، و (2) الهضم الانزيمي ، الذي يعتمد علي احتضان قطع الانسجه المفرومة في 37 درجه مئوية في وجود الانزيمات البروتينية ، مثل التريبسين أو بابين ، لصالح تدهور المصفوفة خارج الخلية لإنشاء تعليق خليه متجانسة إلى حد ما12.
بغض الفضل عن الطريقة التي يتم استخدامها ، ينصح خطوه تنقيه بعد تجانس الانسجه لأزاله الميلين من خلال طرد علي التدرج الكثافة أو عن طريق اختيار المغناطيسي9،12، قبل الانتقال إلى التطبيقات المصب.
هنا ، ونحن وصف طريقه معالجه الانسجه علي أساس الهضم بابين (PD) تليها تنقيه علي التدرج الكثافة ، الأمثل للحصول علي تعليق الخلايا غير المتجانسة قابله للحياة من الدماغ الماوس أو الحبل الشوكي في طريقه حساسة للوقت ومناسبه لقياس التدفق الخلوي. وعلاوة علي ذلك ، فاننا وصف لوحه التدفق الخلوي 9 لون واستراتيجية النابضة التي اعتمدناها في المختبر للسماح التمييز في وقت واحد من مختلف السكان CNS ، والخلايا الحية/الميتة أو الايجابيه للصحفيين الفلورسنت مثل البروتين الفلوري الأخضر أو صبغ الرومين. من خلال تطبيق هذا التحليل الخلوي التدفق ، يمكننا مقارنه الطرق المختلفة لمعالجه الانسجه ، اي PD مقابل DH ، من حيث الحفاظ علي القدرة الخلوية والغلة من أنواع الخلايا المختلفة.
التفاصيل التي نقدمها هنا يمكن ان توعز قرار بشان بروتوكول التجانس وتركيبه الأجسام المضادة لاستخدامها في لوحه تدفق الخلوي ، استنادا إلى نوع الخلية المحددة (ق) من الفائدة والتحليلات المصب (علي سبيل المثال ، حساسة لدرجه الحرارة التطبيقات ، وتتبع علامات الفلورسنت محدده ، في المختبر الثقافة ، والتحليلات الوظيفية).
Protocol
تمت الموافقة علي جميع الطرق الموصوفة هنا من قبل اللجنة المؤسسية لرعاية واستخدام الماشية (IACUC) في معهد دانا فاربر للسرطان (البروتوكول رقم 16-024).
1-اعداد الحلول اللازمة للتجربة
- أعد 1x محلول الملح المتوازن من هانك (HBSS) عن طريق تمييع 10x HBSS بالماء المعقم. قبل البرد الحل علي الجليد. هناك حاجه إلى 25 مل علي الأقل من الحل لكل عينه.
- اعداد محلول Percoll متساوي النظائر (IPS) عن طريق خلط 10x العقيمة HBSS 1:10 مع الكثافة التدرج المتوسط (اي Percoll). قبل البرد علي الجليد.
ملاحظه: يمكن تخزين IPS لمده تصل إلى 30 يوما في 4 درجه مئوية. - اعداد محلول التدفق الخلوي (FACS) حجب (BL) الحل (1 ٪ الزلال المصل البقري [جيش الصرب البوسنيين] ، 5 ٪ مصل الأبقار الجنينية في الفوسفات-مخزنه المالحة [تلفزيوني]). قبل البرد علي الجليد.
2. القتل الرحيم الحيواني من خلال التروية الدماغية وتشريح الانسجه
ملاحظه: تم استخدام الفئران C57BL/6J القديمة ثمانيه أسابيع ، اما الجنس ، في التجارب. يتم تنفيذ perfusion مع حل تلفزيوني للقضاء علي تلوث الدم من الأعضاء ، قبل المضي قدما في هضم الانسجه.
- تخدير الماوس باستخدام خليط من الكيتامين/اكسيليازين (90 − 200 مغ/كغ الكيتامين ، 10 مغ/كغ اكسيليازين). ضع الماوس علي ظهره والشريط كل طرف وصولا إلى الدعم. تحقق من عمق كاف من التخدير عن طريق التحقق من منعكس الانسحاب.
- جعل شق الجلد الخط الأوسط علي مستوي مدخل الصدر لفضح القص. استخدام ملقط لفهم غيض من عظم القص ، ثم جعل واحده شق 1 سم علي كل جانب من القفص الصدري. وأخيرا قطع من خلال الحجاب الحاجز وفتح القص علي نطاق واسع بما يكفي لتصور القلب.
- استخدم الملقط لامساك القلب برفق بالبطين الأيمن ورفعه إلى الخط الوسطي والخروج قليلا من الصدر.
- ادخل ابره فراشه 23 غ في طرف البطين الأيسر ، نحو الشريان الابهر وتمسك بثبات.
- بدء ترويه مع 1x تلفزيوني. يخترق من خلال الأذين الأيمن باستخدام مقص للسماح perfusate للخروج من الدورة الدموية. تعيين معدل تدفق تلفزيوني في 3 مل/دقيقه. Perfuse مع ما لا يقل عن 15 مل من 1x تلفزيوني لضمان الانسجه واضحة.
ملاحظه: الابيضاض من الكبد والاوعيه الدموية المساريقي علامات التروية جيده. إذا لزم الأمر ، يمكن زيادة حجم ما قبل الانصهار حتى السائل الخروج من القلب واضح من الدم ، وعند هذه النقطة يمكن إيقاف خط دافق. - بعد الانصهار ، قطع الدماغ من الحبل الشوكي وأزاله الدماغ من الجمجمة مع مقص وملقط. أزاله الفراء لزيادة الرؤية والسيطرة خلال تشريح وتجنب حمل أكثر من ملوثات الشعر. مسح الحبل الشوكي من العمود الخاص به باستخدام حقنه 3 مل مليئه بالتلفزيونية.
- نقل كل الانسجه في بئر من 6-بئر متعددة حسنا لوحه معباه مع 2 مل من الجليد الباردة 1x HBSS والحفاظ علي الجليد حتى الهضم.
- يقسم الدماغ والحبل الشوكي إلى نصفين ، علي طول الخط الطولي.
ملاحظه: يتم تجانس نصف كل نسيج (انظر الأقسام أدناه) للسماح بتحليلات التدفق الخلوي ؛ ويمكن تعيين النصف الآخر لمعالجه مختلفه للتحليلات البديلة (علي سبيل المثال ، انخفض في محلول مثبت بارافورماليتيف لأنسجه النسيج).
3. الهضم الانزيمي للدماغ والحبل الشوكي
ملاحظه: وحدات التخزين الموصوفة في هذا القسم كافيه لهضم نصف الدماغ أو الحبل الشوكي.
- استخدمي مقصا لفرم الانسجه في قطعه واحده سميكه بسماكة 1 − 2 مم.
- قطع غيض من ماصه 1000 μL مع زوج من مقص لجعلها كبيره بما فيه الكفاية للسماح لجمع قطع الانسجه. قبل شطف طرف الماصة باستخدام 1x HBSS. ثم استخدم الماصة لنقل 2 مل من محلول HBSS الذي يحتوي علي النسيج المفروم إلى أنبوب مخروطي بحجم 15 مل.
ملاحظه: الشطف المسبق لطرف الماصة مهم لمنع التصاق قطع الانسجه داخل الطرف. - اغسل البئر مع 2 مل إضافي من الثلج البارد 1x HBSS ونقل الحل إلى أنبوب مخروطي 15 مل المقابلة التي تحتوي علي قطع الانسجه.
- الطرد المركزي كل عينه لمده 5 دقائق في 250 x g في 4 ° c.
- اعداد مزيج الانزيم 1 من مجموعه التفكك الانسجه العصبية (NTDK; جدول المواد) عن طريق خلط 50 μL من انزيم P مع 1900 μL من المخزن المؤقت X لكل عينه. مزيج الانزيم الدافئ 1 عند 37 درجه مئوية في حمام مائي. احتضان مزيج انزيم 1 في 37 درجه مئوية لمده 10 دقائق علي الأقل قبل الاستخدام من أجل السماح للتنشيط الكامل لانزيم.
- يستنشق ماده طافي من أنبوب مخروطي 15 مل وأضافه 1.95 مل من مزيج انزيم 1 لكل عينه. دوامه بلطف للتاكد من أعاده تعليق بيليه.
- احتضان العينات علي عجله أو شاكر لمده 15 دقيقه في 37 درجه مئوية.
- في هذه الاثناء ، واعداد مزيج انزيم 2 من NTDK عن طريق خلط 10 μL من الانزيم A مع 20 μL من العازلة Y لكل عينه ؛ قبل الحارة الحل عند 37 درجه مئوية في حمام مائي.
- في نهاية الحضانة مع مزيج انزيم 1 ، أضافه 30 μL من مزيج الانزيم 2 لكل عينه.
- امزج العينات برفق عن طريق الشطف لاعلي ولأسفل باستخدام طرف ماصه بسعة 1000 μL مع 1 × HBSS.
- احتضان العينة علي عجله أو شاكر لمده 15 دقيقه في 37 درجه مئوية.
- بعد الحضانة ، أضافه 10 مل من البرد الجليدي 1x HBSS لكل أنبوب لتنشيط مزيج انزيم 1 ومزيج الانزيم 2.
- الطرد المركزي كل عينه لمده 10 دقيقه في 320 x g في 4 ° c.
- تجاهل سوبرناتانت. أضافه الجليد الباردة 1x HBSS لكل أنبوب يصل إلى حجم النهائي من 7 مل وأعاده التعليق بلطف بيليه بواسطة vortexing.
- الاستمرار في القسم 5 لأزاله الحطام.
4. التجانس الميكانيكي للدماغ والحبل الشوكي
ملاحظه: وحدات التخزين الموصوفة في هذا القسم كافيه لتجانس نصف الدماغ أو الحبل الشوكي. يمكن استخدام البروتوكول الموصوف في هذا القسم كطريقه بديله للطريقة الموصوفة في القسم 3 ، حسب حاجه المستخدم كما هو موضح أدناه.
- قبل البرد الزجاج هاون من طاحونة الانسجه داونصه (جدول المواد) تعيين علي الجليد.
- أضافه 3 مل من قبل المبردة 1x HBSS إلى هاون.
- نقل الانسجه (الدماغ أو الحبل الشوكي) من بئر 6-بئر لوحه في هاون الزجاج التاكد من انها انخفضت في 1x HBSS ويجلس في الجزء السفلي من هاون.
- سحق بلطف الانسجه مع 10 السكتات الدماغية من مدقه A تليها 10 السكتات الدماغية من مدقه b. نقل مزيج متجانسة إلى أنبوب مخروطي جديد 15 مل.
- ملء أنبوب لحجم النهائي من 10 مل باستخدام قبل المبردة 1x HBSS وأجهزه الطرد المركزي لمده 10 دقيقه في 320 x g في 4 ° c.
- يستنشق ماده طافي وأضافه الجليد الباردة 1x hbss لكل أنبوب يصل إلى حجم النهائي من 7 مل وأعاده التعليق بلطف بيليه بواسطة vortexing.
- الاستمرار في القسم 5 لأزاله الحطام.
5-أزاله الأنقاض
ملاحظه: أزاله الأنقاض ، التي تتكون أساسا من الانسجه غير المهضومة والمروج المايلين ، هي خطوه حاسمه للسماح تلطيخ فعاله من الانسجه المتجانسة للتحليلات الخلوية تدفق اللاحقة.
- تصفيه كل عينه من خلال مصفاه الخلية 70 μm لأزاله اي قطعه الانسجه غير مهضوم. هذه الخطوة مهمة بشكل خاص عند العمل مع انسجه الحبل الشوكي لان هذه العينات هي أكثر عرضه لاحتواء شظايا العصب غير مهضوم أو السحايا التي يمكن ان تؤثر علي الخطوات اللاحقة.
- تاكد من ان حجم النهائي هو 7 مل في كل أنبوب عينه. ان لم يكن ، وملء مع الجليد الباردة 1x HBSS تصل إلى 7 مل.
- أضافه 3 مل من IPS قبل المبردة لكل عينه لجعل حجم النهائي من 10 مل من محلول يحتوي علي متوسط التدرج الكثافة في 30% تركيز نهائي. دوامه بلطف العينات للتاكد من انها مختلطة متجانسة.
- عينات الطرد المركزي لمده 15 دقيقه في 700 x g في 18 °c التاكد من تعيين تسارع الطرد المركزي إلى 7 والفرامل إلى 0.
ملاحظه: يجب ان يستغرق طرد حوالي 30 دقيقه. - أزاله العينات بدقه من جهاز الطرد المركزي.
ملاحظه: يجب ان يكون القرص الأبيض المكون من الحطام والميالين مرئيا عائما علي سطح المحلول. بيليه (التي تحتوي علي خلايا الفائدة) يجب ان تكون مرئية في الجزء السفلي من الأنبوب. - يستنشق بعناية كل القرص الأبيض من الحطام ومن ثم بقية ماده طافي التاكد من عدم أزاحه بيليه. ترك حوالي 100 μL من الحل علي راس بيليه الخلية لتجنب خطر التفكك عن غير قصد.
- أضافه 1 مل من FACS BL ، أعاده تعليق بيليه عن طريق التنضيد صعودا وهبوطا مع غيض ماصه 1000 μL ونقل عينات إلى أنابيب 1.5 mL.
- الطرد المركزي لمده 5 دقائق في 450 x g في درجه حرارة الغرفة (RT).
- يستنشق بلطف ماده طافي وأعاده تعليق بيليه في المخزن المؤقت المناسب متوافق مع التحليلات المصب (انظر القسم 6 للبروتوكول المستخدمة لتقييم تدفق الخلوية من أنواع متعددة من الخلايا).
6. تلطيخ لتقييم تدفق الخلوي لأنواع متعددة من الخلايا
- أعاده تعليق بيليه الحصول عليها في الخطوة 5.9 مع 350 μL من FACS BL. أضافه Fc-بلوك لكل عينه في تركيز نهائي من 5 ميكروغرام/مل.
ملاحظه: يجب استخدام ما لا يقل عن 100 μL من العينة لتلطيخ واحد ، للتاكد من معالجه ما يكفي من الخلايا للسماح تحليلات موثوق بها. - احتضان العينة لمده 10 دقيقه في 4 درجه مئوية قبل المضي قدما في تلطيخ.
- اعداد مزيج الأجسام المضادة وفقا للجدول 1.
- أضافه مزيج الأجسام المضادة لكل أنبوب ، دوامه ل 5 ليالي واحتضان العينات لمده 15 دقيقه في 4 درجه مئوية في الظلام.
- أضافه 1 مل من تلفزيوني لكل أنبوب ، دوامه والطرد المركزي لمده 5 دقائق في 450 x g في RT.
- وفي الوقت نفسه اعداد العقديات مزيج وفقا للجدول 1.
- تجاهل ماده طافي وأعاده تعليق بيليه في مزيج العقديات التي أعدت في الخطوة 6.6. لكل عينه ، استخدم نفس وحده التخزين كواحده المستخدمة لتلطيخ في الخطوة 6.4.
- دوامه لمده 5 ليالي واحتضان عينات لمده 10 دقيقه في 4 درجه مئوية في الظلام.
- أضافه 1 مل من تلفزيوني لكل أنبوب ، دوامه والطرد المركزي لمده 5 دقائق في 450 x g في RT.
- تجاهل ماده طافي وأعاده تعليق بيليه في facs bl. استخدام 300 μl من facs bl لكل 100 μl من عينه ملطخه.
- أضافه 7-امينو-اكتيمومايسين D (7-عاد) حل لكل عينه. استخدام 5 μL من 7-عاد لكل 300 μL من عينه أعدت في الخطوة 6.10.
- يخزن العينات عند درجه حرارة 4 درجات مئوية في الظلام حتى التحليل الخلوي. اجراء التحليل في غضون 16 ساعة من اعداد العينة ، لضمان بقاء الخلية > 60 ٪.
النتائج
قارننا طريقتين تجانس مختلفه (DH مقابل PD) تطبيقها علي الدماغ الماوس والحبل الشوكي ، لاختبار الكفاءة في استرداد أنواع الخلايا القابلة للحياة مختلفه مناسبه للتطبيقات المصب. للقيام بذلك ، قمنا باستغلال 9-لون تدفق لوحه الخلوي مصممه لتوصيف ، في نفس العينة ، وأنواع مختلفه من الخلايا العصبية بما في ذلك الكريات الصغيرة ، والخلايا الليمفاوية ، والخلايا العصبية ، astrocytes ، oligodendrocytes و بطانة.
تم استرداد انسجه المخ والنخاع الشوكي من فئران مختلفه (ن ≥ 6) ، وانقسمت في طولياين نصفيتين ، ووزنت وعولجت بالتوازي من خلال تطبيق اما التعطيل الميكانيكي باستخدام الخالط المتجانس (DH method) أو المفروم والمهضومبرفقانزيمي باستخدام ntdk التجاري استنادا إلى بابين(طريقهPD) بعد أزاله الأنقاض ، تم تخفيف الخلايا من الدماغ أو الحبل الشوكي 1/10 أو 1/2 − 1/5 ، علي التوالي ، في التركان الأزرق لتحديد محصول الخلية والقدرة علي البقاء مع غرفه نيوبوير (الشكل 1ب ، ج). وقد أنتجت طريقه DH بشكل عام عائدا اعلي للخلايا من كل من الدماغ والحبل الشوكي. ومع ذلك ، كانت غالبيه الخلايا المستردة ميتة ، مما ادي فقط 13.8 ٪ ± 3.3 ٪ من الخلايا القابلة للحياة في الدماغ و 10.5 ٪ ± 1.5 ٪ في الحبل الشوكي (الشكل 1ب). وشكلت العديد من الخلايا الميتة مجاميع (الشكل 1ج) ؛ يمكن ان تكون هذه الظاهرة بسبب وجود شبكات الخلايا المترابطة للغاية (مثل الخلايا البطانية والجلالي بطانة الاوعيه الدموية العصبية) التي لا يمكن تصنيفها بواسطة قوه القص المطبقة مع DH. ومن المرجح ان هذه المجاميع من خلايا الموت لم تتم ازالتها بواسطة معامل الكثافة وانتهي بها الأمر في الخلية النهائية بيليه المستخدمة للتحليل الخلوي المتري. علي العكس من ذلك ، فان طريقه PD تحديد عموما أفضل الحفاظ علي القدرة علي البقاء الخلوية (90.6 ٪ ± 0.6 ٪ في الدماغ و 85.2 ٪ ± 2.8 ٪ في الحبل الشوكي). Papain قادره علي هضم مصفوفة خارج الخلية والوصلات بين الخلايا بكفاءة ، مما يؤدي إلى تعليق خليه واحده أكثر موحده. بعض الخلايا التي تموت اثناء عمليه الفرم يمكن ان تكون أكثر هضما من قبل بابين مما يؤدي إلى تشكيل الحطام الخلية التي يتم فصلها بشكل أكثر كفاءه من خلال التدرج كثافة. عموما ، وهذا علي الأرجح تحديد أفضل الحفاظ علي سلامه الخلية مع طريقه PD ، علي الرغم من انخفاض العائد الخلية قليلا بالمقارنة مع طريقه DH.
وكانت الكريات من 100 μL من الدماغ وتعليق خليه الحبل الشوكي ملطخه مع مزيج الأجسام المضادة (الجدول 1) وتحليلها من قبل تدفق الخلوي مع لوحه 9 لون. يظهر الشكل 2ا استراتيجية النابض المستخدمة لتحديد أنواع الخلايا المختلفة من تعليقات خلايا المخ والنخاع الشوكي. وباختصار ، تحدد البوابة الاولي السكان عموما وفقا لمبعثر إلى الامام (FSC) ومبعثر الجانب (SSC) ، باستثناء الحطام الخلية الصغيرة. ثم يتم التعرف علي الخلايا الحية (7-عاد). ضمن إجمالي عدد الخلايا الحية ، يتم تمييز CD45 + و CD45. ضمن البوابة CD45 + ، يتم تحديد CD45 + CD11b + الخلايا الصغيرة/الضامة و CD45 + CD11b الخلايا الليمفاوية. داخل [CD45-غت], ميزت خلايا وفقا ل ايجابيه ل ACSA2 ([استروستس]) أو O4 ([اوليجوندروسايتس]). CD45-ACS2-O4-وتنقسم الخلايا أيضا وفقا لايجابيه لThy1 (الخلايا العصبية) أو CD31 (بطانة). وتصنف الخلايا المتبقية Thy1-CD31 علي انها "أنواع الخلايا الأخرى" ، وليس حسابها من قبل مزيج الأجسام المضادة لدينا.
كما هو مبين في الشكل 2ب، مع طريقه DH حوالي 38 ٪ من الخلايا القابلة للحياة التي تم استردادها من الدماغ وحوالي 32 ٪ من الخلايا القابلة للحياة التي تم استردادها من النخاع الشوكي كانت من أصل الدم (CD45 +). ومن ناحية أخرى ، سمحت طريقه PD لاسترداد الغلة عاليه بشكل كبير من الخلايا القابلة للحياة في كل من الانسجه ، مع جزء كبير جدا تمثله الخلايا غير الCD45ه للدم (حوالي 82 ٪ في الدماغ و 92 ٪ في الحبل الشوكي). ومن اللافت للانتباه ان CD45 + CD11b + الأجزاء الصغيرة/الضامة تمثل الجزء الأكثر وفره من الخلايا القابلة للاستمرار مع أسلوب DH (الشكل 2ج). ومع ذلك ، أنتجت طريقه PD تمثيل أكثر تجانسا من أنواع الخلايا ، بما في ذلك ACSA + astrocytes ، O4 + oligodendrocytes ، CD31 + الخلايا البطانية و Thy1 + العصبية (الشكل 2ج). ومن المثير للاهتمام ان الخلايا العصبية القابلة للحياة والانسجه البطانية لا يمكن كشفها بطريقه DH.
تعتمد طريقه DH علي الطحن الميكانيكي للانسجه بين مدقه الزجاج ومدفع هاون الخالط المتجانس للحصول علي تجانس الانسجه. وهذا يمكن ان يسبب بعض الإجهاد القص التي من المحتمل ان تلحق الضرر وتؤثر علي صلاحيه الخلايا الكبيرة أو الحساسة جدا مثل الخلايا العصبية أو خليه من الاوعيه الدموية العصبية. قيمنا القدرة الخلوية (النسبة المئوية للخلايا 7-عاد) داخل كل خليه السكان الفرعية التي تم تحديدها من خلال لوحه الأجسام المضادة (الشكل 3). الخلايا التي تكون الدم (CD45 +) معزولة عن الدماغ والحبل الشوكي ، بما في ذلك الخلايا الصغيرة/الضامة (CD45 + CD11b +) وغيرها من الكريات غير النخاعية (CD45 + Cd11b-) ، تظهر قابليه عاليه جدابشكلمستقل عن طريقه التجانس التي تم استخدامها (الشكل 3 وعلي العكس من ذلك ، حددت طريقه DH تخفيضا كبيرا في قدره السكان علي البقاء CD45 (الشكل 3ب) في حين ان طريقه PD تحدد الحفاظ علي العديد من أنواع الخلايا العصبية المختلفة. التفصيل ، كانت الخلايا العصبية والغشائية هي الفئات الفرعية الأكثر تاثرا بالدرهم والتي حافظت عليها طريقه PD.
ويلخص الشكل 4عرضا تخطيطيا للخطوات الحاسمة اللازمة للاعداد السليم للعينه وأزاله الحطام بكفاءة.
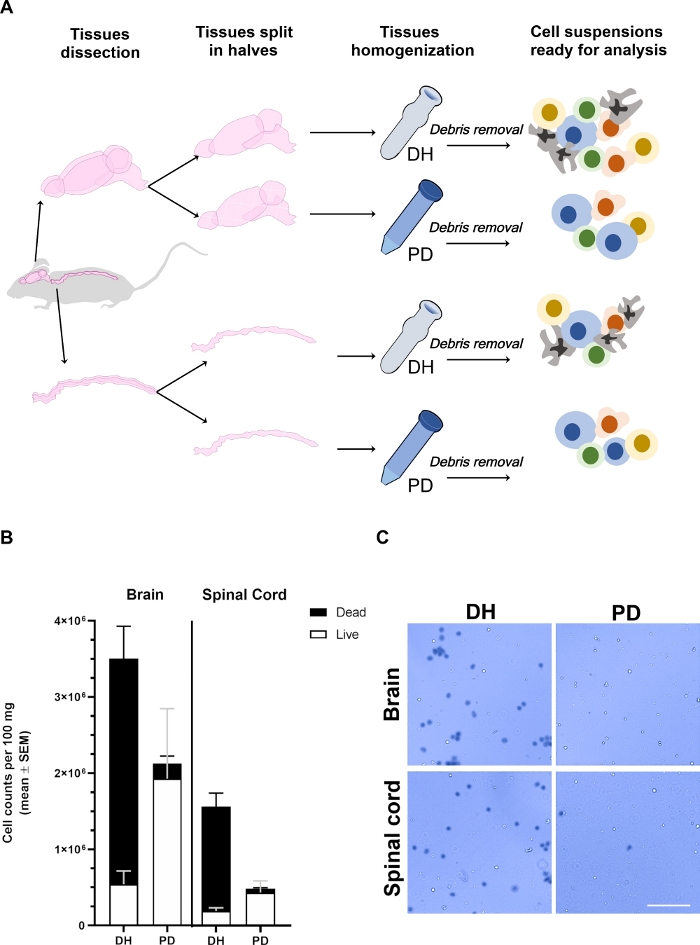
الشكل 1: يتاثر محصول الخلايا المستخرجة من الدماغ والحبل الشوكي بطريقه التجانس.
(ا) المخطط التجريبي. وقد تم تخدير الفئران والاستخدام الداخلي مع الاجهزه التلفزيونية لأزاله خلايا الدم المتداولة داخل الاوعيه الدموية. تم تشريح الدماغ والحبل الشوكي بعناية وانقسم في نصفين طوليا. وكانت الانسجه متجانسة باستخدام اما الخالط المتجانس (DH) أو الهضم بالبابين (PD) كما هو مفصل في النص الرئيسي. ثم تمت أزاله الميلين وحطام الانسجه من قبل طرد في محلول متوسط التدرج الكثافة 30 ٪ مما ادي إلى تعليق خليه غير متجانسة تحتوي علي أنواع مختلفه من الخلايا التي يمكن تحليلها عن طريق التدفق الخلوي. (ب) الرسوم البيانية التي تبين غله الخلايا المستخرجة من المخ أو الحبل الشوكي عند تجانس الانسجه مع طريقه DH أو PD. المتوسطة ± [سم] من علي الأقل 6 الماشية لكل شرط يكون مثلت. (ج) ممثل المجهر الضوئي المجهري لخلايا التريكان الزرقاء الموجبة (الميتة) والسلبية (الحية) المستخرجة من الدماغ أو الحبل الشوكي بواسطة الطريقتين. شريط مقياس = 100 μm. الرجاء النقر هنا لعرض نسخه أكبر من هذا الرقم.

الشكل 2: تتاثر النسب النسبية للأنواع المختلفة من الخلايا المستخرجة من الوحدة العصبية الخاصة بطريقه تجانس الانسجه.
(ا) المخططات التمثيلية للتدفقات الخلوية التي تبين استراتيجية التشغيل لتحديد الفئات الفرعية للخلايا المختلفة داخل المستحضرات الخلوية التي يتم الحصول عليها من الدماغ أو الحبل الشوكي: يتم بوابات الخلايا علي المعلمات الفيزيائية FSC و SSC ، تليها اختيار للخلايا ثم يتم التمييز الخلايا وفقا لايجابيه لعلامة CD45; يتم التعرف علي الخلايا الصغيرة/الضامة علي انها CD11b + خليه داخل CD45 + الجزء بينما اللمفاويات CD11b-. يتم تحديد الخلايا الفلكية ، اوليغوداندروسايتس ، البطانة والخلية العصبية كما ACSA2 + ، O4 + ، CD31 + أو Thy1 + الخلايا داخل CD45-، علي التوالي. (ب) الرسوم البيانية التي تبين النسبة المئوية لCD45 + و CD45 داخل مجموع الخلايا الحية أو الميتة ، في المخ أو الحبل الشوكي عند التجانس مع طريقه DH أو PD. وترد في الجدول 2التحليل الإحصائي للنتائج المبينة في الرسوم البيانية. (ج) المخططات الدائرية التي تبين النسبة المئوية للأنواع الفرعية المختلفة للخلايا القابلة للاستمرار في مجموع عدد الخلايا ، في المخ أو الحبل الشوكي عند التجانس مع طريقه DH أو PD. ويبلغ أيضا عن النسبة المئوية لمجموع الخلايا الميتة. N ≥ 6. CD45 + CD11b + = ميكروليا/الضامة; CD45 + CD11b-= الخلايا اللمفاوية/غير النخاعية; CD45-ACSA2 + = astrocytes; CD45-O4 + = oligodendrocytes; CD45-Thy1 + = الخلايا العصبية; CD45-CD31 + = الخلايا البطانية; أخرى = الخلايا السلبية لجميع علامات المذكورة أعلاه. وترد في الجدول 2التحليل الإحصائي للنتائج المبينة في الرسوم البيانية. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
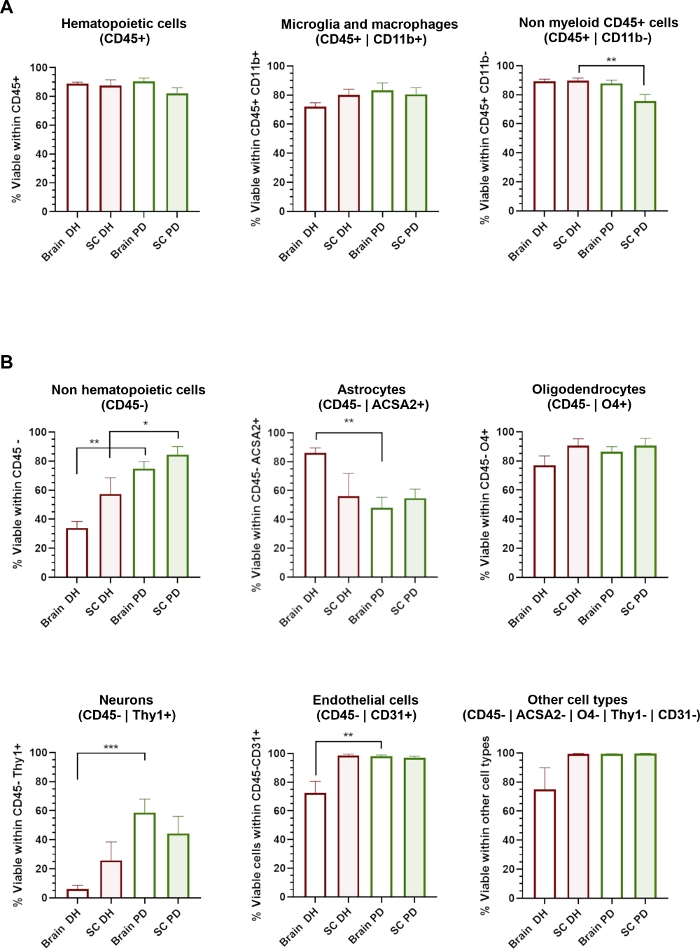
الشكل 3: يتاثر السلامة الخلوية لمختلف أنواع الخلايا العصبية الحيوية بطريقه التجانس المطبقة.
(ا) الرسوم البيانية التي تبين النسبة المئوية للخلايا 7-عاد-الحية داخل CD45 + السكان التي تكون الدم بما في ذلك CD11b + الميكروليا/الضامة والخلايا CD11b غير النخاعي. (ب) الرسوم البيانية التي تبين النسبة المئوية للخلايا 7-عاد-الحية داخل CD45-السكان غير الغذائية بما في ذلك astrocytes ، oligodendrocytes ، الخلايا العصبية ، وأنواع الخلايا البطانية وغيرها. * = p < 0.05 ، * * = p < 0.01 ، مان ويتني بين DH و PD. الرجاء النقر هنا لعرض نسخه أكبر من هذا الرقم.

الشكل 4: التمثيل التخطيطي للخطوات الحاسمة اللازمة للمعالجة السليمة للانسجه.
تظهر قائمه بالخطوات الأكثر اهميه المطلوبة للمعالجة السليمة للانسجه وأزاله الحطام بكفاءة. من المهم ان تحدد بشكل صحيح القرص الحطام (السهم الأسود) والخلية بيليه (السهم الأزرق) شكلت بعد طرد من العينات علي التدرج الكثافة 30 ٪. ويجب أزاله القرص الحطام ، مع بقية supernatant ، بعناية عن طريق الطموح دون التخلص من بيليه الخلية لتجنب فقدان العينة. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
| مزيج الأجسام المضادة | التركيز الاولي (ميكروغرام/مل) | التركيز النهائي (ميكروغرام/مل) | عامل التخفيف |
| مكافحه CD45/BV510 | 200 | 2 | 100 |
| المضادة لCD11b/APC. 780 | 200 | 2 | 100 |
| مكافحه CD31/BV421 | 200 | 2 | 100 |
| مكافحه ACSA2/APC | 150 | 0.75 | 200 |
| مكافحه O4/البيوتين | Na | Na | 40 |
| مكافحه مؤتمر نزع السلاح 90.2/PE. Cy7 | 200 | 2 | 100 |
| مزيج العقديات | التركيز الاولي (ميكروغرام/مل) | التركيز النهائي (ميكروغرام/مل) | عامل التخفيف |
| سترستريافالدين/اليكسا 680 | 1000 | 1 | 1000 |
الجدول 1: وصفه لاعداد يمزج لتلطيخ تدفق الخلوي. يصف الجدول التركيزات المثلي للأجسام المضادة والعقديه المستخدمة للسماح بتحليلات التدفق الخلوي لأنواع خلايا متعددة. يرجى الرجوع إلى جدول المواد للحصول علي تفاصيل عن أرقام الكتالوج لكل كاشف المذكورة في الجدول.
| إحصائيات الشكل 2 ب | ||||||||||
| الدماغ (% الخلايا) | ||||||||||
| CD45 + | CD45- | |||||||||
| العيش | ميت | العيش | ميت | |||||||
| الاسلوب | يعني | ± SEM | يعني | ± SEM | يعني | ± SEM | يعني | ± SEM | ||
| درهم | 15.20 | ± 2.32 | 1.90 | ± 0.30 | 24.78 | ± 4.045 | 51.58 | ± 6.033 | ||
| شرطه | 15.20 | ± 2.65 | 2.33 | ± 1.10 | 68.53 | ± 3.618 | 13.93 | ± 2.180 | ||
| مان-ويتني | Ns | Ns | *** | ** | ||||||
| ف-القيمة | 0.9989 | 0.738 | 0.0006 | 0.0015 | ||||||
| الحبل الشوكي (% الخلايا) | ||||||||||
| CD45 + | CD45- | |||||||||
| العيش | ميت | العيش | ميت | |||||||
| الاسلوب | يعني | ± SEM | يعني | ± SEM | يعني | ± SEM | يعني | ± SEM | ||
| درهم | 15.00 | ± 8.21 | 1.41 | ± 0.11 | 31.64 | ± 8.21 | 51.95 | ± 16.52 | ||
| شرطه | 7.49 | ± 4.99 | 1.15 | ± 0.68 | 84.27 | ± 9.39 | 7.09 | ± 3.75 | ||
| مان-ويتني | Ns | Ns | * | Ns | ||||||
| ف-القيمة | 0.5548 | 0.7236 | 0.0438 | 0.1144 | ||||||
| إحصائيات الشكل 2C | |||||||||||||||||
| الدماغ (% الخلايا) | |||||||||||||||||
| CD45 + | CD45- | ||||||||||||||||
| CD11b + | CD11b- | ACSA2 | O4 | Thy1 | CD31 | الاخري | ميت | ||||||||||
| الاسلوب | يعني | ± SEM | يعني | ± SEM | يعني | ± SEM | يعني | ± SEM | يعني | ± SEM | يعني | ± SEM | يعني | ± SEM | يعني | ± SEM | |
| درهم | 19.32 | ± 3.88 | 1.17 | ± 0.27 | 9.52 | ± 2.68 | 3.41 | ± 1.01 | 1.39 | ± 0.77 | 0.48 | ± 0.29 | 10.52 | ± 4.49 | 53.83 | ± 5.79 | |
| شرطه | 10.88 | ± 2.03 | 1.65 | ± 0.48 | 8.17 | ± 2.66 | 6.54 | ± 0.76 | 6.37 | ± 1.76 | 8.27 | ± 1.25 | 33.28 | ± 6.34 | 23.72 | ± 5.31 | |
| مان-ويتني | Ns | Ns | Ns | * | ** | *** | ** | ** | |||||||||
| ف-القيمة | 0.1206 | 0.4819 | 0.5894 | 0.0264 | 0.0093 | 0.0003 | 0.0084 | 0.0022 | |||||||||
| الحبل الشوكي (% الخلايا) | |||||||||||||||||
| CD45 + | CD45- | ||||||||||||||||
| CD11b + | CD11b- | ACSA2 | O4 | Thy1 | CD31 | الاخري | ميت | ||||||||||
| الاسلوب | يعني | ± SEM | يعني | ± SEM | يعني | ± SEM | يعني | ± SEM | يعني | ± SEM | يعني | ± SEM | يعني | ± SEM | يعني | ± SEM | |
| درهم | 21.23 | ± 6.25 | 2.51 | ± 0.57 | 4.26 | ± 2.34 | 9.40 | ± 1.89 | 2.82 | ± 1.51 | 0.97 | ± 0.50 | 22.74 | ± 9.04 | 35.28 | ± 1.89 | |
| شرطه | 9.63 | ± 1.67 | 2.77 | ± 0.48 | 4.23 | ± 1.59 | 28.62 | ± 3.57 | 1.26 | ± 0.49 | 6.94 | ± 2.14 | 26.39 | ± 8.17 | 19.09 | ± 4.76 | |
| مان-ويتني | Ns | Ns | Ns | * | Ns | * | Ns | Ns | |||||||||
| ف-القيمة | 0.1905 | > 0.9999 | 0.7302 | 0.0159 | 0.7302 | 0.0317 | 0.7302 | 0.1111 | |||||||||
الجدول 2: التحليل الإحصائي للفئات السكانية المختلفة المستردة بتطبيق طريقه DH أو PD. ويصف الجدول الإحصاءات المتعلقة بالرسوم البيانية المبينة في الشكل 2باء والشكل 2جيم. مثلت المعدل و [سم] من علي الأقل سته عينات مستقله. ويبلغ أيضا عن القيمة p والتفاصيل المتعلقة بالاختبار الإحصائي المطبق لكل مقارنه.
Discussion
هنا نحن وصف بروتوكول لتنقيه المشتركة والمتزامنة تحليل التدفق الخلوي لبعض الخلايا العصبية الأكثر صله من الدماغ الماوس والحبل الشوكي. تقليديا ، تم تطبيق التحليلات النسيجية لوصف توزيع الجسيمات النانويه أو كفاءه المحولات الفيروسية في CNS5،13، أو لتوفير رؤى حول التغيرات المورفولوجية والجزيئية التي تحدث في أنواع خلايا معينه خلال الامراض أو علي العلاج الدوائي14. ومع ذلك ، فان الانسجه تفتقر إلى التنظير ولا تسمح بالفحص الشامل لميزات متعددة في نفس العينات النسيجية ، نظرا للعدد المحدود من العلامات التي يمكن تحليلها بشكل متزامن. ويمكن ان يكون نهجنا مكملا للتحليلات النسيجية التقليدية ويمكن ان يقترن بالعديد من التطبيقات النهائية (الفرز ، والثقافة الاوليه ، والكيمياء الحيوية أو الجيل التالي من التحليلات) لتوسيع تجميع المعلومات التي يمكن الحصول عليها من العينات الفردية. ومع ذلك ، يجب النظر في بعض العوامل الرئيسية المذكورة أدناه لأنها يمكن ان تؤثر بشكل حاسم علي نجاح هذا النهج:
- كميه الانسجه المنطلقة. لقد قمنا بتحسين فصل الخلايا للبدء بأقل قدر من نصف النخاع الشوكي أو نصف الدماغ. في تجربتنا ، ومعالجه نصف الدماغ أو نصف الحبل الشوكي من الفار البالغ من العمر 8 أسابيع مع طريقه PD غله 1 − 6 × 106 خلايا قابله للحياة من الدماغ وحوالي 0.1 − 0.5 x 106 خلايا قابله للحياة من الحبل الشوكي بعد خطوه التدرج كثافة. لم نقيس الخلايا العائد بعد تطبيق طريقه PD علي الانسجه من حديثي الولادة أو الفئران الذين تقل أعمارهم عن 8 أسابيع. ومع ذلك ، في ايدينا ، والنتيجة هي متناسبة مع وزن النسيج البداية. التالي ، بالنسبة للحيوانات الأصغر سنا (علي سبيل المثال ، الجراء البالغة من العمر 10 أيام) ، ينبغي معالجه المخ أو الحبل الشوكي بأكمله لضمان إنتاجيه خلايا جيده للتحليلات النهائية الموثوقه. إذا لزم الأمر ، فان تجميع الانسجه من العديد من الكائنات سيساعد علي زيادة غله الخلايا. في تجربتنا ، ويمكن تطبيق هذا البروتوكول أيضا دون تعديلات لعزل الخلايا من الدماغ أو الحبل الشوكي من الفئران ، بقدر ما يتم احترام نسبه المواد الكاشفة المستخدمة في وزن الانسجه بدءا. للانسجه أكثر من 250 ملغ من الوزن ، والتحجيم الكواشف حتى أو تقسيم الانسجه في عينات متعددة (كل الترجيح < 250 ملغ) ويقترح.
- أزاله السحايا/قطع الانسجه المتبقية قبل التدرج الكثافة. في تجربتنا ، طريقه PD وصفها ببموجب هذا ليست قادره علي هضم كفاءه السحايا أو الانسجه النخاعية جدا مثل الأعصاب والجذور العصبية الناشئة من الحبل الشوكي. عندما تكون هذه الانسجه موجودة ، قد تبقي بعض القطع اللزجة غير المهضومة في تعليق الخلية المستردة بعد خطوات الهضم الانزيميه ، قبل أزاله الحطام. أزاله هذه القطع عن طريق تصفيه الحل من خلال مصفاه خليه 70 μm (كما هو مقترح في الخطوة 5.1) أمر بالغ الاهميه لاعداد خليه ناجحه. وفي الواقع ، إذا لم تتم ازالتها ، فان السحايا أو قطع الانسجه ستعيق الفصل الفعال لتدرج الكثافة مما يؤدي إلى ضعف غله الخلايا.
- التوقيت ودرجه الحرارة والعقم. من المهم جدا لتنفيذ جميع الخطوات في الوقت المناسب باستخدام إعدادات درجه الحرارة المناسبة والاحتضان كما هو مقترح. هذا أمر بالغ الاهميه لضمان سلامه الخلايا العالية وتكامل العينة. اعتمادا علي التطبيق المصب ، وتنفيذ جميع الخطوات تحت غطاء محرك العقيمة ومع الكواشف العقيمة قد تكون ضرورية (علي سبيل المثال ، إنشاء الثقافات الخلية الاوليه). الحاضنة الموسعة في المحلول الهضمي الانزيمي بعد الوقت المقترح (القسم 3) يمكن ان يؤدي إلى قطره من بقاء الخلية. قد تكون المرفه لبعض المستضدات السطحية حساسة لبابين مما يؤدي إلى فقدان الاشاره في قياس التدفق الخلوي. بالنسبة للتطبيقات المحددة التي تتطلب علامات اضافيه غير تلك الموصوفة في هذه المقالة ، ينصح باختبار أداء نسخ الأجسام المضادة المختلفة قبل بدء التجربة. وقد أفيد ان متوسط التدرج الكثافة يمكن ان تحتوي علي بعض اثار السموم المعوية التي قد تؤدي إلى تنشيط الخلايا المناعية (ميكروليا/الضامة). وينبغي دائما أضافه الضوابط الداخلية المناسبة في التجارب كلما تم تحليل هذه الفئات السكانية ، لاستبعاد الآثار المحتملة الناجمة عن الاجراء. التصاق مع درجات الحرارة المقترحة والغسيل كثافة التدرج بقايا المتوسطة مباشره بعد خطوه أزاله الحطام عاده ما يكفي لتجنب تنشيط الخلايا المناعية العلنية. ومع ذلك ، في حاله تاثر التطبيقات المتلقية للمعلومات (علي سبيل المثال ، RNAseq أو التحليلات الوظيفية) بهذه الخطوة ، يجب علي المستخدم التبديل إلى الاعداد المتوسطة الانحدار المنخفضة السمية السمية (المقترحة في جدول المواد).
- الأجسام المضادة وآلات FACS. بروتوكول تلطيخ التدفق الخلوي المعروض ببموجب هذا يجعل استخدام تركيزات الأجسام المضادة واقتران اللون التي عملت بشكل أفضل مع عوائد الخلايا المستردة في تجربتنا المختبرية ومع آلات FACS المتاحة في معهدنا. وينبغي ان المستخدم عيار الأجسام المضادة في يديه/لها قبل البدء في تجربه جديده ، والتركيز قد تحتاج إلى تعديل طفيف. إلى جانب ذلك ، ونحن نشجع علي استخدام دائما أحاديه اللون تلطيخ الضوابط في كل تجربه للتحقق من ان جميع الأجسام المضادة والتعويض إنشاء الجهاز FACS يعمل بشكل كاف. فانه يجب ان يكون لاحظت ان CD90 (خاصتك) مستضد المستخدمة للكشف عن الخلايا العصبية موجود في اثنين من الأنماط المختلفة ، وهي CD 90.2 أو CD 90.1 اعتمادا علي سلاله الماوس: سلالات الماوس الأكثر استخداما ، مثل C57BL6/J اكسبرس CD 90.2 ؛ سلالات الماوس مثل AKR/J ، PL ، و FVB/N express CD 90.1. التالي ، يجب علي المستخدم التحقق بعناية من سلاله الماوس واختيار المضادة المناسبة لمكافحه CD90 (كما هو مقترح في جدول المواد) قبل البدء في التجارب.
باختصار ، البروتوكول هنا يقدم الاستفادة من الهضم الانزيمي لطيف تليها تلطيخ 9-اللون السماح كفاءه تقييم التدفق الخلوي في وقت واحد من أنواع مختلفه من الخلايا من الدماغ الماوس والحبل الشوكي. ويمكن استغلال البروتوكول لرصد كفاءه استهداف الخلايا بواسطة الجسيمات النانويه أو النواقل الفيروسية التي تدار في الجهاز العصبي العام15بطريقه مبسطه وشامله. وعلاوة علي ذلك ، يمكن اعتماد البروتوكول بسهوله للتطبيقات المصب حساسة جدا ، مثل فرز الخلايا ، والثقافة الفرعية السابقة المجرية ، خليه واحده RNAseq ، مما ادي إلى اهميه قصوى ليس فقط لتقييم ما قبل السريرية لاستهداف الخلايا عن طريق التداوي ولكن أيضا لتوصيف متعمق للعمليات المرضية في امراض الأعصاب.
ولا يميز هذا البروتوكول عن جزء من مجموع الخلايا التابعة للجهاز العصبي العام بأكمله (انظر أنواع الخلايا "الأخرى" في الشكل 2) ؛ ويمكن تفسير ذلك بوجود أنواع فرعيه أخرى من الخلايا موجودة في الوحدة العصبية العامة ولكن لا يتم التقاطها بواسطة الأجسام المضادة التي استخدمناها. في تحليلاتنا الاوليه ، حوالي 14 ٪ من الجزء "الخلايا الأخرى" هو إيجابي بالنسبة لCD73 ، وهو علامة خليه مسسبي المخصب في الاوعيه العصبية وتشارك في العديد من العمليات التهابيه العصبية16،17. وعلاوة علي ذلك ، فاننا نفترض ان كسر "الخلايا الأخرى" يمكن ان تضم أيضا خلايا اقل تمايزا ، مثل الأسلاف في مراحل مختلفه من النضج ، مثل النستين + الخلايا الجذعية العصبية ، نيسستين + فيمنتينتين + شعاعي المولدات الخلوية ، doublecortin + الأسلاف العصبية ، NG2 ويمكن التحقيق في هذه الأنواع الفرعية الخلية بسهوله عن طريق تطبيق لدينا بروتوكول التدفق الخلوي ، منذ اخترنا تكوين الاصباغ الفلورية التي تسمح لاستيعاب ما يصل إلى اثنين من علامات الخلية اضافيه مترافق مع اما فلوريسئين ايزوثيسيانات (FITC) أو فيكوريميثرين (PE) فلوروبيورس.
وبوجه عام ، يمكن ان يوفر نهجنا أداه جديده لاجراء تحقيقات اشمل في سياق الحالة الصحية والامراض التي تستفيد من التكنولوجيا الموحدة التي تتيح التقييمات الكمية النوعية والعالية الانتاجيه علي حد سواء. مثل تدفق الخلوي.
Disclosures
وليس لدي المؤلفين ما يفصحون عنه.
Acknowledgements
تم تمويل هذه الدراسة من قبل مستشفي الأطفال بوسطن لبدء الأموال إلى A.B., ALSA منحه nr. IIP-343 إلى عضو البرلمان ، ومكتب مساعد وزير الدفاع للشؤون الصحية من خلال برنامج بحوث التصلب الجانبي الضموري تحت الجائزة رقم W81XWH-17-1-0036 إلى عضو البرلمان ونحن نعترف DFCI تدفق الخلوية الاساسيه للدعم التقني.
Materials
| Name | Company | Catalog Number | Comments |
| 10X HBSS (Calcium, Magnesium chloride, and Magnesium Sulfate-free) | Gibco | 14185-052 | |
| 70 mm Cell Strainer | Corning | 431751 | |
| ACSA/ACSA2 anti-mouse antibody | Miltenyi Biotec | 130-117-535 | APC conjugated |
| Bovine Serum Albumin | Sigma Aldrich | A9647-1KG | |
| CD11b rat anti-mouse antibody | Invitrogen | 47-0112-82 | APC-eFluor 780 conjugated |
| CD31 rat anti-mouse antibody | BD Bioscience | 562939 | BV421 conjugated |
| CD45 rat anti-mouse antibody | Biolegend | 103138 | Brilliant Violet 510 conjugated |
| CD90.1/Thy1.1 rat anti-mouse antibody | Biolegend | 202518 | PE/Cy7 conjugated |
| CD90.2/Thy1.2 rat anti-mouse antibody | Biolegend | 1005325 | PE/Cy7 conjugated |
| Conical Tubes (15 mL) | CellTreat | 229411 | |
| Conical Tubes (50 mL) | CellTreat | 229422 | |
| Dounce Tissue Grinder set (Includes Mortar as well as Pestles A and B) | Sigma-Aldrich | D9063-1SET | |
| Fc (CD16/CD32) Block rat anti-mouse antibody | BD Pharmingen | 553142 | |
| Fetal Bovine Serum | Benchmark | 100-106 | |
| Neural Tissue Dissociation Kit (P) | Miltenyi Biotec | 130-092-628 | |
| O4 anti mouse/rat/human antibody | Miltenyi Biotec | 130-095-895 | Biotin conjugated |
| Percoll | GE Healthcare | 10266569 | sold as not sterile reagent |
| Percoll | Sigma | 65455529 | sterile reagent (to be used for applications requiring sterility) |
| Percoll PLUS | Sigma | GE17-5445-01 | reagent containing very low traces of endotoxin |
| Streptavidin | Invitrogen | S3258 | Alexa Fluor 680 conjugated |
References
- Deverman, B. E., Ravina, B. M., Bankiewicz, K. S., Paul, S. M., Sah, D. W. Y. Gene therapy for neurological disorders: progress and prospects. Nature Reviews Drug Discovery. 17 (9), 641-659 (2018).
- Teleanu, D., Negut, I., Grumezescu, V., Grumezescu, A., Teleanu, R. Nanomaterials for Drug Delivery to the Central Nervous System. Nanomaterials. 9 (3), 371 (2019).
- Chen, S., et al. Recombinant Viral Vectors as Neuroscience Tools. Current Protocols in Neuroscience. 87 (1), 67 (2019).
- Alves, S., et al. Ultramicroscopy as a novel tool to unravel the tropism of AAV gene therapy vectors in the brain. Scientific Reports. 6 (1), 28272 (2016).
- Peviani, M., et al. Lentiviral vectors carrying enhancer elements of Hb9 promoter drive selective transgene expression in mouse spinal cord motor neurons. Journal of Neuroscience Methods. 205 (1), 139-147 (2012).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. Journal of Immunological Methods. 243 (1-2), 77-97 (2000).
- Sykora, M. M., Reschke, M. Immunophenotyping of Tissue Samples Using Multicolor Flow Cytometry. Methods in Molecular Biology. 1953, 253-268 (2019).
- Legroux, L., et al. An optimized method to process mouse CNS to simultaneously analyze neural cells and leukocytes by flow cytometry. Journal of Neuroscience Methods. 247, 23-31 (2015).
- Lee, J. K., Tansey, M. G. Microglia Isolation from Adult Mouse Brain. Methods in Molecular Biology. 1041, 17-23 (2013).
- Grabert, K., McColl, B. W. Isolation and Phenotyping of Adult Mouse Microglial Cells. Methods in Molecular Biology. 1784, 77-86 (2018).
- Nikodemova, M., Watters, J. J. Efficient isolation of live microglia with preserved phenotypes from adult mouse brain. Journal of Neuroinflammation. 9 (1), 635 (2012).
- Garcia, J. A., Cardona, S. M., Cardona, A. E. Isolation and analysis of mouse microglial cells. Current Protocols in Immunology. 104 (1), 1-15 (2014).
- Papa, S., et al. Selective Nanovector Mediated Treatment of Activated Proinflammatory Microglia/Macrophages in Spinal Cord Injury. ACS Nano. 7 (11), 9881-9895 (2013).
- Peviani, M., et al. Neuroprotective effects of the Sigma-1 receptor (S1R) agonist PRE-084, in a mouse model of motor neuron disease not linked to SOD1 mutation. Neurobiology of Disease. 62, 218-232 (2014).
- Peviani, M., et al. Biodegradable polymeric nanoparticles administered in the cerebrospinal fluid: Brain biodistribution, preferential internalization in microglia and implications for cell-selective drug release. Biomaterials. 209, 25-40 (2019).
- Meng, F., et al. CD73-derived adenosine controls inflammation and neurodegeneration by modulating dopamine signalling. Brain. 142 (3), 700-718 (2019).
- Nedeljkovic, N. Complex regulation of ecto-5'-nucleotidase/CD73 and A2AR-mediated adenosine signaling at neurovascular unit: A link between acute and chronic neuroinflammation. Pharmacological Research. 144, 99-115 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved