Method Article
Caracterização citométrica de fluxo simultâneo de múltiplos tipos de células recuperadas do cérebro do camundongo/medula espinhal através de diferentes métodos de homogeneização
Neste Artigo
Resumo
Apresentamos um método de citometria de fluxo para identificar simultaneamente diferentes tipos de células recuperadas do cérebro do rato ou da medula espinhal. Este método poderia ser explorado para isolar ou caracterizar populações de células puras em doenças neurodegenerativas ou para quantificar a extensão das células que visam a administração in vivo de vetores virais ou nanopartículas.
Resumo
Os recentes avanços nas ciências viral de vetores e nanomateriais abriram caminho para novas abordagens de ponta para investigar ou manipular o sistema nervoso central (SNC). No entanto, uma maior otimização dessas tecnologias se beneficiaria de métodos que permitam a determinação rápida e simplificada da extensão do SNC e da segmentação específica das células sobre a administração de vetores virais ou nanopartículas no corpo. Aqui, apresentamos um protocolo que aproveita as capacidades de alta produtividade e multiplexing da citometria de fluxo para permitir uma quantificação direta de diferentes subtipos celulares isolados do cérebro do rato ou da medula espinhal, ou seja, microglia / macrófagos, linfócitos, astrócitos, oligodendrócitos, neurônios e células endotélias. Aplicamos essa abordagem para destacar diferenças críticas entre dois métodos de homogeneização de tecidos em termos de rendimento celular, viabilidade e composição. Isso poderia instruir o usuário a escolher o melhor método, dependendo do tipo de célula (s) de interesse e da aplicação específica. Este método não é adequado para análise da distribuição anatômica, uma vez que o tecido é homogeneizado para gerar uma suspensão unicelular. No entanto, ele permite trabalhar com células viáveis e pode ser combinado com a classificação celular, abrindo o caminho para várias aplicações que poderiam expandir o repertório de ferramentas nas mãos do neurocientista, que vão desde o estabelecimento de culturas primárias derivadas de populações de células puras, a análises de expressão gênica e ensaios bioquímicos ou funcionais sobre subtipos celulares bem definidos no contexto de doenças neurodegenerativas, sobre o tratamento farmacológico ou terapia gênica.
Introdução
Tecnologias de entrega de genes e medicamentos (como vetores virais e nanopartículas) tornaram-se uma ferramenta poderosa que pode ser aplicada para obter melhores insights sobre vias moleculares específicas alteradas em doenças neurodegenerativas e para o desenvolvimento de abordagens terapêuticas inovadoras1,2,3. A otimização dessas ferramentas depende da quantificação de: (1) a extensão da penetração no SNC sobre diferentes rotas de administração e (2) direcionamento de populações celulares específicas. Análises histológicas são geralmente aplicadas para visualizar genes de repórter fluorescente ou nanopartículas marcadas fluorescentemente em diferentes áreas do SNC e em diferentes tipos de células, identificadas pela imunomancha para marcadores celulares específicos4,5. Mesmo que essa abordagem forneça informações valiosas sobre a biodistribuição das ferramentas administradas de gene ou entrega de drogas, a técnica pode ser demorada e intensa em termos de trabalho, pois requer: (1) fixação de tecidos, criopreservação ou parafina emindamento e corte; (2) coloração para marcadores celulares específicos, por vezes, exigindo recuperação de antígenos; (3) aquisição por microscopia de fluorescência, que geralmente permite a análise de um número limitado de marcadores diferentes dentro do mesmo experimento; (4) processamento de imagem para permitir a quantificação adequada do sinal de interesse.
A citometria do fluxo tornou-se uma técnica amplamente utilizada que aproveita marcadores fluorescentes muito específicos para permitir não apenas uma rápida avaliação quantitativa de diferentes fenótipos celulares em suspensões celulares, com base na expressão de antígenos superficiais ou intracelulares, mas também medições funcionais (por exemplo, taxa de apoptose, proliferação, análise do ciclo celular, etc.). O isolamento físico das células através da triagem de células ativadas fluorescentes também é possível, permitindo novas aplicações a jusante (por exemplo, cultura celular, RNAseq, análises bioquímicas etc.) 6,7,8.
A homogeneização do tecido é um passo crítico necessário para obter uma suspensão de célula única para permitir avaliações citométricas confiáveis e reprodutíveis de fluxo a jusante. Diferentes métodos têm sido descritos para homogeneização cérebro-tecido adulto, principalmente com o objetivo de isolar as células microglia9,10,11; eles podem ser classificados globalmente em duas categorias principais: (1) dissociação mecânica, que utiliza força de moagem ou corte através de um homogeneizador Dounce (DH) para rasgar as células de seus nichos e formar uma suspensão celular relativamente homogeneizada única, e (2) digestão enzimática, que depende da incubação de pedaços de tecido picado em 37 °C na presença de enzimas proteolíticas, como trippsina ou papaina, favorecendo a degradação da matriz extracelular para criar uma suspensão de células homogeneizadas12.
Independentemente de qual método é utilizado, uma etapa de purificação é recomendada após a homogeneização do tecido para remover a mielina através da centrífuga em um gradiente de densidade ou por seleção magnética9,12,antes de passar para as aplicações a jusante.
Aqui, descrevemos um método de processamento de tecidos baseado na digestão da papana (DP), seguido de purificação em um gradiente de densidade, otimizado para obter suspensões de células heterogêneas viáveis do cérebro do rato ou da medula espinhal de forma sensível ao tempo e adequada para citometria de fluxo. Além disso, descrevemos um painel de citometria de fluxo de 9 cores e a estratégia de gating que adotamos em laboratório para permitir a discriminação simultânea de diferentes populações do SNC, células vivas/mortas ou positividade para repórteres fluorescentes, como proteína fluorescente verde ou corante da rodamina. Ao aplicar esse fluxo de análise citométrica, podemos comparar diferentes métodos de processamento de tecidos, ou seja, PD versus DH, em termos de preservação da viabilidade celular e rendimentos de diferentes tipos de células.
Os detalhes que fornecemos aqui podem instruir a decisão sobre o protocolo de homogeneização e a combinação de anticorpos a usar no painel de citometria de fluxo, com base no tipo específico de interesse celular e nas análises a jusante (por exemplo, sensível à temperatura aplicações, rastreamento de marcadores fluorescentes específicos, cultura in vitro, análises funcionais).
Protocolo
Todos os métodos aqui descritos foram aprovados pelo Institutional Animal Care and Use Committee (IACUC) do Dana Farber Cancer Institute (protocolo número 16-024).
1. Preparação de soluções necessárias para o experimento
- Prepare a solução de sal equilibrado (HBSS) da 1x Hank diluindo 10x HBSS com água estéril. Pré-chill a solução no gelo. Pelo menos 25 mL de solução são necessários para cada amostra.
- Prepare a solução isotônica percoll (IPS) misturando 10x estéril HBSS 1:10 com gradiente médio de densidade (ou seja, Percoll). Pré-frio no gelo.
NOTA: Ips pode ser armazenado por até 30 dias a 4 °C. - Prepare a solução de bloqueio de citometria de fluxo (FACS) (1% de soro bovino [BSA], 5% de soro bovino fetal [FBS] em soro soro amortecida com fosfato [PBS]). Pré-frio no gelo.
2. Eutanásia animal por perfusão intracardíaca e dissecção de tecido
NOTA: Camundongos C57BL/6J de oito semanas de idade, qualquer sexo, foram usados nos experimentos. A perfusão com a solução pbs é realizada para eliminar a contaminação do sangue dos órgãos, antes de prosseguir com a digestão do tecido.
- Anestesite o rato usando uma mistura de cetamina/xilázine (90-200 mg/kg de cetamina, 10 mg/kg xilazine). Coloque o mouse em suas costas e fita de cada membro até o suporte. Verifique a profundidade adequada da anestesia, verificando o reflexo de retirada.
- Faça uma incisão de pele média ao nível da inseto torácica para expor o esterno. Use fórceps para agarrar a ponta do esterno, em seguida, fazer uma incisão de 1 cm em cada lado da caixa torácica. Finalmente cortar o diafragma e abrir o esterno amplamente o suficiente para visualizar o coração.
- Use fórceps para agarrar suavemente o coração pelo ventrículo direito e levantá-lo para a linha média e ligeiramente fora do peito.
- Insira uma agulha de borboleta 23 G na ponta do ventrículo esquerdo, em direção à aorta e segure firmemente.
- Comece a perfusão com 1x PBS. Perfure através da auricle direita usando tesouras para permitir que o perfusate saia da circulação. Defina a taxa de fluxo de PBS em 3 mL/min. Perfuse com pelo menos 15 mL de 1x PBS para garantir que os tecidos sejam claros.
NOTA: Branqueamento do fígado e vasos sanguíneos mesentéricos são sinais de boa perfusão. Se necessário, o volume de pré-fusão pode ser aumentado até que o fluido que sai do coração esteja livre de sangue, momento em que a linha de descarga pode ser interrompida. - Após a perfusão, cortar o cérebro da medula espinhal e remover o cérebro do crânio com tesoura e fórceps. Retire a pele para aumentar a visibilidade e controle durante a dissecação e para evitar o transporte de contaminantes do cabelo. Lave a medula espinhal fora de sua coluna usando uma seringa de 3 mL cheia de PBS.
- Transfira cada tecido em um poço de uma placa multi-poço de 6 poços pré-preenchido com 2 mL de HBSS gelado 1x e mantenha-se no gelo até a digestão.
- Divida o cérebro e a medula espinhal em duas metades, ao longo da linha longitudinal.
NOTA: Metade de cada tecido é homogeneizado (ver seções abaixo) para permitir análises citométricas de fluxo; a outra metade pode ser atribuída a diferentes processamentos para análises alternativas (por exemplo, mergulhada em solução fixativa de paraformaldeído para histologia).
3. Digestão enzimática do cérebro e da medula espinhal
NOTA: Volumes descritos nesta seção são suficientes para a digestão de um cérebro e meia ou medula espinhal.
- Use um par de tesouras para picar os tecidos em pedaços de 1-2 mm de espessura.
- Corte a ponta de uma pipeta de 1000 μL com um par de tesouras para torná-la suficientemente grande para permitir a coleta dos pedaços de tecido. Pré-enxaguar a ponta da pipeta com 1x HBSS. Em seguida, use a pipeta para transferir os 2 mL da solução HBSS contendo o tecido picado para um tubo cônico de 15 mL.
NOTA: Pré-lavagem da ponta da pipeta é importante para evitar a viscosidade dos pedaços de tecido dentro da ponta. - Lave o poço com 2 mL adicionais de 1x HBSS gelado e transfira a solução para o tubo cônico correspondente de 15 mL contendo os pedaços de tecido.
- Centrífuga cada amostra por 5 min a 250 x g a 4 °C.
- Prepare a mistura enzimática 1 do kit de dissociação do tecido neural (NTDK; Tabela de Materiais) misturando 50 μL de enzima P com 1900 μL de buffer X por amostra. Mistura de enzimas quentes 1 a 37 °C em um banho de água. Incubar a mistura enzimática 1 a 37 °C por pelo menos 10 min antes de usar, a fim de permitir a ativação completa da enzima.
- Aspirar o supernatant do tubo cônico de 15 mL e adicionar 1,95 mL de mistura de enzimas 1 para cada amostra. Vórtice suavemente para garantir que a pelota seja resuspensa.
- Incubar as amostras em uma roda ou coqueteleira por 15 min a 37 °C.
- Enquanto isso, prepare a mistura enzimática 2 do NTDK misturando 10 μL de enzima A com 20 μL de buffer Y por amostra; pré-aqueça a solução a 37 °C em um banho de água.
- Ao final da incubação com mistura enzimática 1, adicione 30 μL de mistura enzimática 2 a cada amostra.
- Misture delicadamente as amostras tubulação para cima e para baixo com uma ponta pipette 1000 μL pré-lavado com 1x HBSS.
- Incubar a amostra em uma roda ou coqueteleira por 15 min a 37 °C.
- Após a incubação, adicione 10 mL de gelo-frio 1x HBSS para cada tubo para inativar a mistura enzimática 1 e mistura de enzimas 2.
- Centrífuga cada amostra por 10 min a 320 x g a 4 °C.
- Descarte o supernatant; adicionar gelo-frio 1x HBSS para cada tubo até um volume final de 7 mL e resuspender suavemente a pelota por vórtice.
- Continue a seção 5 para remoção de detritos.
4. Homogeneização mecânica do cérebro e da medula espinhal
NOTA: Os volumes descritos nesta seção são suficientes para homogeneização de metade do cérebro ou medula espinhal. O protocolo descrito nesta seção pode ser usado como uma alternativa de método à descrita na seção 3, dependendo da necessidade do usuário, conforme discutido abaixo.
- Pré-chill a argamassa de vidro do moedor de tecido Dounce(Mesa de Materiais)definido no gelo.
- Adicione 3 mL de 1x HBSS pré-refrigerados à argamassa.
- Transfira o tecido (cérebro ou medula espinhal) do poço da placa de 6 poços para a argamassa de vidro certificando-se de que ele é mergulhado em 1x HBSS e fica na parte inferior da argamassa.
- Esmague suavemente o tecido com 10 traços de pilão A seguidos por 10 traços de pilão B. Transfira a mistura homogeneizada em um novo tubo cônico de 15 mL.
- Encha o tubo a um volume final de 10 mL usando 1x HBSS e centrífuga pré-refrigeradas por 10 min a 320 x g a 4 °C.
- Ascute o supernatant e adicione hbss s 1x gelado a cada tubo até um volume final de 7 mL e resuspenda delicadamente a pelota vórtice.
- Continue a seção 5 para remoção de detritos.
5. Remoção de detritos
NOTA: A remoção de detritos, composto principalmente de tecido não digerido e bainhas de mielina, é um passo crítico para permitir a coloração eficiente do tecido homogeneado para análises citométricas de fluxo subseqüentes.
- Filtre cada amostra através de um filtro de células de 70 μm para remover qualquer pedaço de tecido não digerido. Esta etapa é particular importante especial ao trabalhar com tecidos da medula espinal desde que estas amostras são mais prováveis conter fragmentos ou meninges não digeridos do nervo que poderiam afetar as etapas subseqüentes.
- Certifique-se de que o volume final é de 7 mL em cada tubo de amostra. Se não, preencha com gelo frio 1x HBSS até 7 mL.
- Adicione 3 mL de IPS pré-refrigerado a cada amostra para fazer um volume final de 10 mL de uma solução contendo meio de gradiente de densidade em 30% de concentração final. Delicadamente vórtice as amostras para se certificar de que eles são homogêneos misturados.
- Amostras de centrífugas para 15 min a 700 x g a 18 °C certificando-se de definir a aceleração da centrífuga para 7 e o freio para 0.
NOTA: Centrifugação deve levar cerca de 30 min. - Retire delicadamente as amostras da centrífuga.
NOTA: Um disco esbranquiçado composto de detritos e mielina deve ser visível flutuando na superfície da solução. Uma pelota (contendo as células de interesse) deve ser visível na parte inferior do tubo. - Cuidadosamente aspirar todo o disco esbranquiçado de detritos e, em seguida, o resto do supernatant certificando-se de não desalojar a pelota. Deixe cerca de 100 μL de solução em cima da pelota de células para evitar o risco de inadvertidamente desalojá-lo.
- Adicione 1 mL de FACS BL, resuspende a pelota por pipetting para cima e para baixo com uma ponta pipette 1000 μL e amostras de transferência para tubos de 1,5 mL.
- Centrífuga por 5 min a 450 x g à temperatura ambiente (RT).
- Assine suavemente o supernatant e resuspenda a pelota em buffer apropriado compatível com análises a jusante (veja a seção 6 para o protocolo usado para avaliação citométrica de fluxo de vários tipos de células).
6. Coloração para avaliação citométrica de fluxo de vários tipos de células
- Resuspenda a pelota obtida na etapa 5.9 com 350 μL de FACS BL. Adicione o Fc-bloco a cada amostra em uma concentração final de 5 μg/mL.
NOTA: Pelo menos 100 μL da amostra devem ser usados para uma coloração, para certificar-se de processar células suficientes para permitir análises confiáveis. - Incubar a amostra por 10 min a 4 °C antes de prosseguir com a coloração.
- Prepare uma mistura de anticorpos de acordo com a Tabela 1.
- Adicione a mistura do anticorpo a cada tubo, vortex para 5 s e incuba as amostras para 15 min em 4 °C na obscuridade.
- Adicione 1 mL de PBS a cada tubo, vórtice e centrífuga por 5 min a 450 x g na RT.
- Enquanto isso, prepare a mistura de streptavidin de acordo com a Tabela 1.
- Descarte o supernatant e resuspenda a pelota na mistura do streptavidin preparada na etapa 6.6. Para cada amostra, use o mesmo volume que o utilizado para a coloração na etapa 6.4.
- Vórtice para 5 s e incubar as amostras por 10 min a 4 °C no escuro.
- Adicione 1 mL de PBS a cada tubo, vórtice e centrífuga por 5 min a 450 x g na RT.
- Descarte o supernatant e resuspenda a pelota em FACS BL. Use 300 μL de FACS BL para cada 100 μL de amostra manchada.
- Adicione a solução 7-amino-actinomicina D (7-AAD) para cada amostra. Use 5 μL de 7-AAD para cada 300 μL de amostra preparada na etapa 6.10.
- Armazenar amostras a 4 °C no escuro até a análise citofluorimétrica. Realize a análise dentro de 16 h da preparação da amostra, para garantir a viabilidade da pilha >60%.
Resultados
Comparamos dois métodos diferentes de homogeneização (DH versus DP) aplicados ao cérebro do camundongo e à medula espinhal, para testar a eficiência na recuperação de diferentes tipos de células viáveis adequados para aplicações a jusante. Para isso, exploramos um painel de citometria de fluxo de 9 cores projetado para caracterizar, na mesma amostra, diferentes tipos de células do SNC, incluindo microglia, linfócitos, neurônios, astrócitos, oligodendrócitos e endotélio.
Os tecidos do cérebro e da medula espinhal foram recuperados de diferentes camundongos (n ≥ 6), divididos em duas metades longitudinalmente, pesados e processados em paralelo, aplicando qualquer interrupção mecânica usando o homogeneizador Dounce (método DH) ou levemente picado sacada e digerida enzimáticausando o NTDK comercial baseado em papain (método pd) (Figura 1A). Após a remoção de detritos, as células do cérebro ou da medula espinhal foram diluídas 1/10 ou 1/2-1/5, respectivamente, em trypan azul para determinar o rendimento celular e viabilidade com uma câmara de Neubauer (Figura 1B,C). O método DH em geral produziu um maior rendimento celular do cérebro e da medula espinhal. No entanto, a maioria das células recuperadas estava morta, resultando em apenas 13,8% ± 3,3% das células viáveis no cérebro e 10,5% ± 1,5% na medula espinhal (Figura 1B). Muitas das células mortas formaram agregados (Figura 1C); este fenômeno pode ser devido à presença de redes celulares altamente interconectadas (como as células endotélias e gliais que revestem a vasculatura do SNC) que não poderiam ser desagregadas pela força de corte aplicada ao DH. Estes agregados das células da morte provavelmente não foram removidos pelo gradiente de densidade e acabaram na pelota de célulafinal usada para análise citofluorimétrica. Pelo contrário, o método pd determinou uma melhor preservação geral da viabilidade celular (90,6% ± 0,6% no cérebro e 85,2% ± 2,8% na medula espinhal). Papain é capaz de digerir a matriz extracelular e junções célula-célula de forma eficiente, levando a uma suspensão de célula única mais uniforme. Algumas das células que morrem durante o processo de picar poderia ser ainda mais digerido por papain levando à formação de detritos celulares que são mais eficientemente separados através do gradiente de densidade. No geral, isso provavelmente determinou uma melhor preservação da viabilidade celular com o método de DP, apesar de um rendimento celular ligeiramente menor em comparação com o método DH.
Um alibamento de 100 μL das suspensões de células cerebrais e da medula espinhal foi manchado com a mistura de anticorpos(Tabela 1)e analisado por citometria de fluxo com um painel de 9 cores. A figura 2A mostra a estratégia de gating usada para identificar os tipos diferentes da pilha das suspensões da pilha do cérebro e da medula espinal. Resumidamente, o primeiro portão identifica a população em geral de acordo com a dispersão para a frente (FSC) e dispersão lateral (SSC), excluindo detritos celulares pequenos. Em seguida, são identificadas células vivas (7-AAD). Dentro da população total de células vivas, cd45+ e cd45- células são destacadas. Dentro do portão CD45+, cd45+cd11b+ microglia/macrófagos e cd45+cd11b- linfócitos são identificados. Dentro do cd45- portão, as células são discriminadas de acordo com a positividade para ACSA2 (astrócitos) ou O4 (oligodendrócitos). As células CD45-ACS2-O4 são ainda subdivididas de acordo com a positividade para Thy1 (neurônios) ou CD31 (endotelio). As células Thy1-CD31 restantes são classificadas como "outros tipos de células", não contabilizadas pela nossa mistura de anticorpos.
Como mostrado na Figura 2B, com método DH cerca de 38% das células viáveis recuperadas do cérebro e cerca de 32% das células viáveis recuperadas da medula espinhal eram de origem hematopoiética (CD45+). Por outro lado, o método de DP permitiu recuperar um rendimento significativamente elevado de células viáveis em ambos os tecidos, com uma fração muito grande representada por células CD45 não hematopoiéticas (cerca de 82% no cérebro e 92% na medula espinhal). Notavelmente, CD45+CD11b+ microglia/macrófagos representou a fração de células viável mais abundante com o método DH (Figura 2C). No entanto, o método pd produziu uma representação mais heterogênea de tipos de células, incluindo astrócitos ACSA+, oligodendrócitos O4+, células endoteliais CD31+ e neurônios Thy1+ (Figura 2C). Curiosamente, neurônios viáveis e células endotélias dificilmente eram detectáveis com o método DH.
O método DH baseia-se na moagem mecânica do tecido entre o pilão de vidro e argamassa do homogeneizador Dounce para obter homogeneização do tecido. Isso pode causar algum estresse de cisalhamento que provavelmente irá danificar e afetar a viabilidade de células grandes ou muito sensíveis, como neurônios ou células da neurovasculatura. Avaliamos a viabilidade celular (porcentagem de células 7-AAD) dentro de cada subpopulação celular identificada através do painel de anticorpos(Figura 3). As células hematopoiéticas (CD45+) isoladas do cérebro e da medula espinhal, incluindo microglia/macrófagos (CD45+CD11b+) e outras células não mieloides (CD45+Cd11b-), apresentaram uma viabilidade muito alta independentemente do método de homogeneização que foi utilizado (Figura 3A). Pelo contrário, o método DH determinou uma redução significativa da viabilidade das populações CD45 (Figura 3B),enquanto o método pd determinou uma extensa preservação de diferentes tipos de células do SNC. Em detalhes, neurônios e células endotélias foram as subpopulações mais significativamente afetadas pelo DH e preservadas pelo método de DP.
Uma apresentação esquemática das etapas críticas necessárias para a preparação adequada da amostra e remoção eficiente de detritos são resumidas na Figura 4.
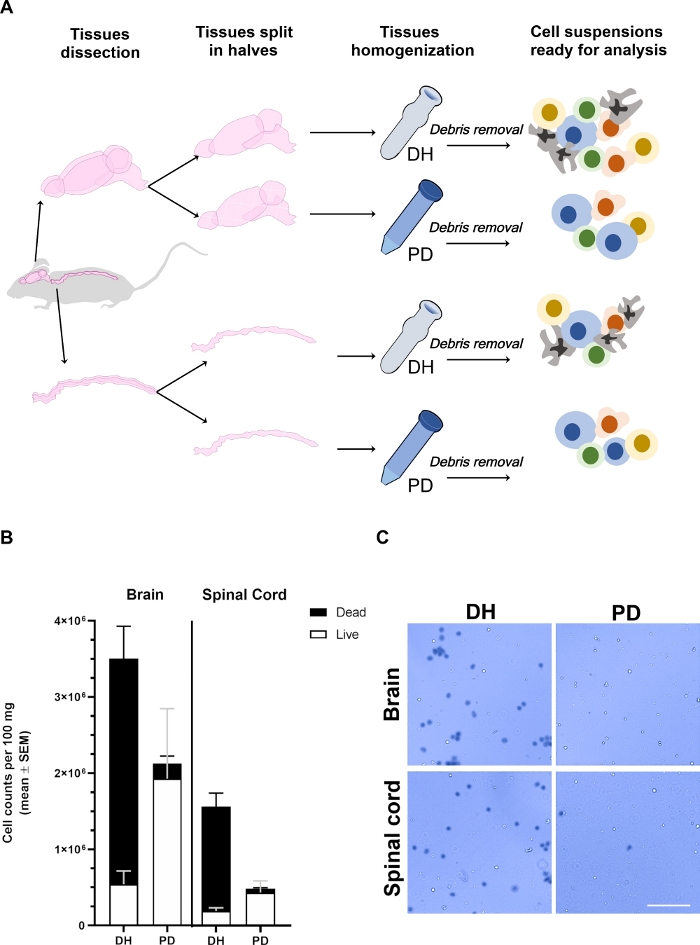
Figura 1: O rendimento das células recuperadas do cérebro e da medula espinhal é afetado pelo método de homogeneização.
(A)Contorno experimental. Camundongos foram anestesiados e intracardiacally perfundido com PBS para remover células sanguíneas circulantes intra-vasculares. O cérebro e a medula espinhal foram cuidadosamente dissecados e divididos em duas metades longitudinalmente. Os tecidos foram homogeneizados por meio de homogeneizador Dounce (DH) ou digestão de papaina (DP) conforme detalhado no texto principal. Os detritos da mielina e do tecido foram então removidos por centrífuga em uma solução média de gradiente de densidade de 30%, resultando em uma suspensão heterogênea de células contendo diferentes tipos de células que poderiam ser analisados por citometria de fluxo. (B) Histogramas mostrando o rendimento das células recuperadas do cérebro ou da medula espinhal após a homogeneização do tecido com o método DH ou PD. A média ± SEM de pelo menos 6 animais por condição está representada. (C) Fotomicrografias representativas de microscópio de campo brilhante de células positivas (mortas) e negativas (vivas) recuperadas do cérebro ou da medula espinhal pelos dois métodos. Barra de escala = 100 μm. Por favor, clique aqui para ver uma versão maior deste número.

Figura 2: Proporções relativas de diferentes tipos de células recuperadas do SNC são afetadas pelo método de homogeneização do tecido.
(A)Parcelas representativas da citometria do fluxo que mostram a estratégia gating para identificar a subpopulação diferente da pilha dentro das preparações da pilha obtidas do cérebro ou da medula espinal: a população da pilha é fechada em parâmetros físicos de FSC e de SSC, seguido pela seleção para 7-AAD- pilhas vivas; em seguida, as células são discriminadas de acordo com a positividade para marcador CD45; microglia/macrófagos são identificados como células CD11b+ dentro da fração CD45+, enquanto os linfócitos são CD11b-. Astrocitos, oligodendrócitos, células endotélias e neuronais são identificadas como ACSA2+, O4+, CD31+ ou Thy1+ células dentro de CD45-, respectivamente. (B) Histogramas mostrando a porcentagem de Células CD45+ e CD45- dentro de populações totais de células vivas ou mortas, no cérebro ou na medula espinhal após homogeneização com o método DH ou PD. A análise estatística dos resultados mostrados nos gráficos é relatada na Tabela 2. (C) Gráficos de pizza mostrando a porcentagem de diferentes subtipos de células viáveis dentro da população celular total, no cérebro ou na medula espinhal após homogeneização com o método DH ou PD. A porcentagem do total de células mortas também é relatada. N ≥ 6. CD45+CD11b+ = microglia/macrófagos; CD45+CD11b- = linfócitos/células não mieloides; CD45-ACSA2+ = astrócitos; CD45-O4+ = oligodendrócitos; CD45-Thy1+ = neurônios; CD45-CD31+ = células endotélias; Outras células = negativas para todos os marcadores acima mencionados. A análise estatística dos resultados mostrados nos gráficos é relatada na Tabela 2. Clique aqui para ver uma versão maior deste número.
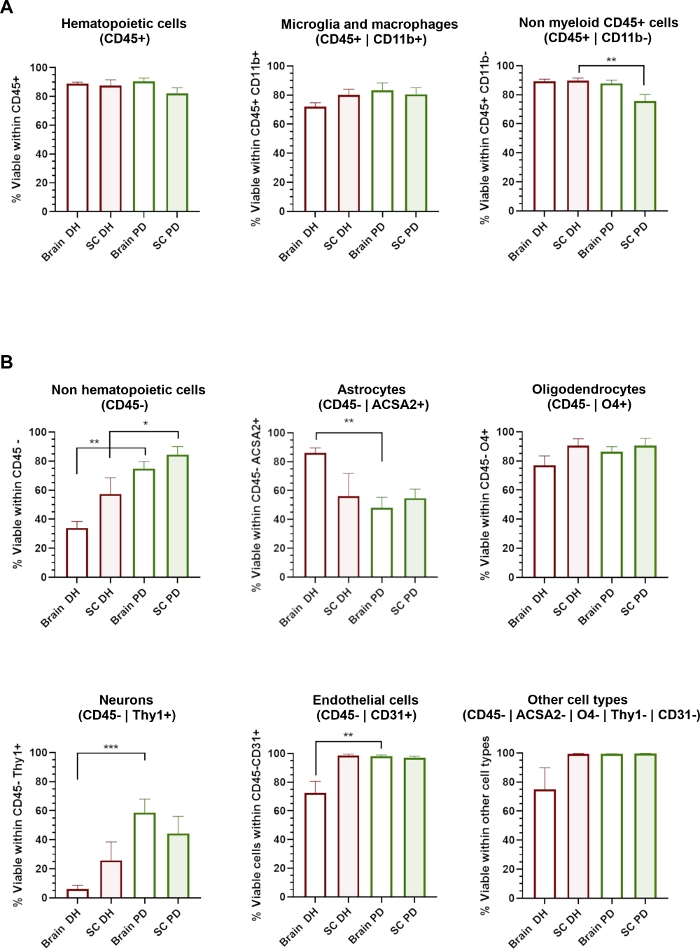
Figura 3: A viabilidade celular de diferentes tipos de células do SNC é afetada pelo método de homogeneização aplicado.
(A) Histogramas mostrando a porcentagem de células vivas de 7 AAD dentro das populações hematopoiéticas CD45+, incluindo microglia/macrófagos CD11b- células não mieloides. (B) Histogramas mostrando a porcentagem de células vivas de 7 AAD dentro de CD45- populações não hematopoiéticas, incluindo astrócitos, oligodendrócitos, neurônios, endotelial e outros tipos celulares. * = p < 0,05, ** = p < 0,01, Mann-Whitney entre DH e PD. Por favor, clique aqui para ver uma versão maior deste número.

Figura 4: Representação esquemática das etapas críticas necessárias para o processamento adequado de tecidos.
Uma lista das etapas as mais críticas exigidas para o processamento apropriado do tecido e a remoção eficiente dos restos é mostrada. É importante identificar corretamente o disco de detritos (seta preta) e a pelota celular (seta azul) formada após a centrífuga das amostras no gradiente de densidade de 30%. O disco de detritos, juntamente com o resto do supernatant, deve ser cuidadosamente removido por aspiração sem desalojar a pelota celular para evitar a perda da amostra. Clique aqui para ver uma versão maior deste número.
| Mistura de anticorpos | Concentração inicial (μg/mL) | Concentração final (μg/mL) | Fator de diluição |
| anti CD45/BV510 | 200 | 2 | 100 |
| anti CD11b/APC.780 | 200 | 2 | 100 |
| anti CD31/BV421 | 200 | 2 | 100 |
| anti ACSA2/APC | 150 | 0.75 | 200 |
| anti O4/biotina | na na | na na | 40 |
| anti CD90.2/PE. Cy7 Cy7 | 200 | 2 | 100 |
| Mistura de Streptavidin | Concentração inicial (μg/mL) | Concentração final (μg/mL) | Fator de diluição |
| Streptavidin/Alexa 680 Streptavidin / Alexa 680 | 1000 | 1 | 1000 |
Tabela 1: Receita para a preparação de misturas para coloração de citometria de fluxo. A tabela descreve as concentrações ideais de anticorpos e streptavidin usado para permitir análises citométricas de fluxo de vários tipos de células. Consulte a Tabela de Materiais para obter detalhes sobre os números de catálogo de cada reagente mencionado na tabela.
| Estatísticas para a Figura 2B | ||||||||||
| CÉREBRO (% de células) | ||||||||||
| CD45+ CD45+ | CD45- CD45- | |||||||||
| Viver | Morto | Viver | Morto | |||||||
| Método | média | ± SEM ( SEM ) | média | ± SEM ( SEM ) | média | ± SEM ( SEM ) | média | ± SEM ( SEM ) | ||
| Dh | 15.20 | ± 2,32 | 1.90 | ± 0,30 | 24.78 | ± 4.045 ± 4.045 | 51.58 | ± 6.033 ± 6.033 | ||
| Pd | 15.20 | ± 2,65 | 2.33 | ± 1,10 | 68.53 | ± 3.618 ± 3.618 | 13.93 | ± 2.180 ± 2.180 | ||
| Mann Whitney Mann-Whitney | Ns | Ns | *** | ** | ||||||
| p-valor | 0.9989 | 0.738 | 0.0006 | 0.0015 | ||||||
| MEDULA ESPINHAL (% de células) | ||||||||||
| CD45+ CD45+ | CD45- CD45- | |||||||||
| Viver | Morto | Viver | Morto | |||||||
| Método | média | ± SEM ( SEM ) | média | ± SEM ( SEM ) | média | ± SEM ( SEM ) | média | ± SEM ( SEM ) | ||
| Dh | 15.00 | ± 8,21 | 1.41 | ± 0,11 | 31.64 | ± 8,21 | 51.95 | ± 16,52 | ||
| Pd | 7.49 | ± 4,99 | 1.15 | ± 0,68 | 84.27 | ± 9,39 | 7.09 | ± 3,75 | ||
| Mann Whitney Mann-Whitney | Ns | Ns | * | Ns | ||||||
| p-valor | 0.5548 | 0.7236 | 0.0438 | 0.1144 | ||||||
| Estatísticas para a Figura 2C | |||||||||||||||||
| CÉREBRO (% de células) | |||||||||||||||||
| CD45+ CD45+ | CD45- CD45- | ||||||||||||||||
| CD11b+ CD11b+ | CD11b- CD11b- | ACSA2 ACSA2 | O4 O4 | Thy1 Thy1 Thy1 | CD31 CD31 | Outros | Morto | ||||||||||
| Método | média | ± SEM ( SEM ) | média | ± SEM ( SEM ) | média | ± SEM ( SEM ) | média | ± SEM ( SEM ) | média | ± SEM ( SEM ) | média | ± SEM ( SEM ) | média | ± SEM ( SEM ) | média | ± SEM ( SEM ) | |
| Dh | 19.32 | ± 3,88 | 1.17 | ± 0,27 | 9.52 | ± 2,68 | 3.41 | ± 1,01 | 1.39 | ± 0,77 | 0.48 | ± 0,29 | 10.52 | ± 4,49 | 53.83 | ± 5,79 | |
| Pd | 10.88 | ± 2,03 | 1.65 | ± 0,48 | 8.17 | ± 2,66 | 6.54 | ± 0,76 | 6.37 | ± 1,76 | 8.27 | ± 1,25 | 33.28 | ± 6,34 | 23.72 | ± 5,31 | |
| Mann Whitney Mann-Whitney | Ns | Ns | Ns | * | ** | *** | ** | ** | |||||||||
| p-valor | 0.1206 | 0.4819 | 0.5894 | 0.0264 | 0.0093 | 0.0003 | 0.0084 | 0.0022 | |||||||||
| MEDULA ESPINHAL (% de células) | |||||||||||||||||
| CD45+ CD45+ | CD45- CD45- | ||||||||||||||||
| CD11b+ CD11b+ | CD11b- CD11b- | ACSA2 ACSA2 | O4 O4 | Thy1 Thy1 Thy1 | CD31 CD31 | Outros | Morto | ||||||||||
| Método | média | ± SEM ( SEM ) | média | ± SEM ( SEM ) | média | ± SEM ( SEM ) | média | ± SEM ( SEM ) | média | ± SEM ( SEM ) | média | ± SEM ( SEM ) | média | ± SEM ( SEM ) | média | ± SEM ( SEM ) | |
| Dh | 21.23 | ± 6,25 | 2.51 | ± 0,57 | 4.26 | ± 2,34 | 9.40 | ± 1,89 | 2.82 | ± 1,51 | 0.97 | ± 0,50 | 22.74 | ± 9,04 | 35.28 | ± 1,89 | |
| Pd | 9.63 | ± 1,67 | 2.77 | ± 0,48 | 4.23 | ± 1,59 | 28.62 | ± 3,57 | 1.26 | ± 0,49 | 6.94 | ± 2,14 | 26.39 | ± 8,17 | 19.09 | ± 4,76 | |
| Mann Whitney Mann-Whitney | Ns | Ns | Ns | * | Ns | * | Ns | Ns | |||||||||
| p-valor | 0.1905 | >0.9999 >0.9999 | 0.7302 | 0.0159 | 0.7302 | 0.0317 | 0.7302 | 0.1111 | |||||||||
Tabela 2: Análise estatística de diferentes populações recuperadas aplicando o método DH ou PD. A tabela descreve as estatísticas para os gráficos mostrados na Figura 2B e Figura 2C. A média e o SEM de pelo menos seis amostras independentes estão representados. O valor p e detalhes sobre o teste estatístico aplicado para cada comparação também são relatados.
Discussão
Aqui descrevemos um protocolo para a co-purificação e análise citométrica de fluxo simultâneo de algumas das células CNS mais relevantes do cérebro do rato e da medula espinhal. Tradicionalmente, análises histológicas têm sido aplicadas para descrever a distribuição de nanopartículas ou a eficiência de transdução de vetores virais no SNC5,13,ou para fornecer insights sobre as alterações morfológicas e moleculares que ocorrem em tipos específicos de células durante uma patologia ou sobre o tratamento farmacológico14. No entanto, a histologia carece de processividade e não permite o exame abrangente de múltiplas características nas mesmas amostras histológicas, devido ao número limitado de marcadores que podem ser analisados simultaneamente. Nossa abordagem pode ser complementar às análises histológicas tradicionais e pode ser combinada com várias aplicações a jusante (classificação, cultura primária, análises bioquímicas ou de sequenciamento de próxima geração) para expandir a compilação de informações que podem ser obtidas a partir de amostras individuais. No entanto, alguns fatores-chave listados abaixo devem ser considerados, pois podem impactar criticamente o sucesso dessa abordagem:
- Quantidade de tecido inicial. Nós otimizamos a separação celular para começar com tão pouco quanto metade da medula espinhal ou metade do cérebro. Em nossa experiência, o processamento de metade do cérebro ou metade da medula espinhal de um rato adulto de 8 semanas de idade com o método pd produz 1-6 x 106 células viáveis do cérebro e cerca de 0,1-0,5 x 106 células viáveis da medula espinhal após o passo gradiente de densidade. Nós não medimos o rendimento das pilhas após ter aplicado o método do PD em tecidos do recém-nascido ou dos ratos mais novos de 8 semanas. No entanto, em nossas mãos, o resultado é proporcional ao peso do tecido inicial. Assim, para os animais mais jovens (por exemplo, filhotes de 10 dias de idade) todo o cérebro ou medula espinhal deve ser processado para garantir um bom rendimento celular para análises a jusante confiáveis. Se necessário, agrupar tecidos de vários animais ajudaria a aumentar a produtividade celular. Em nossa experiência, este protocolo também pode ser aplicado sem modificações para isolar as células do cérebro ou da medula espinhal de ratos, na medida em que a proporção de reagentes utilizados por peso do tecido inicial é respeitada. Para tecidos mais de 250 mg de peso, escalar reagentes ou dividir o tecido em várias amostras (cada ponderação <250 mg) é sugerido.
- Remoção de meninges/pedaços de tecido residual antes do gradiente de densidade. Em nossa experiência, o método de DP descrito por este meio não é capaz de digerir meninges eficientemente ou tecidos muito altamente mielinated como os nervos e raízes nervosas emergentes da medula espinhal. Quando estes tecidos estão atuais, algumas partes pegajosas não digeridas podem permanecer na suspensão da pilha recuperada após as etapas enzimáticas da digestão, antes da remoção dos restos. Remover estes pedaços filtrando a solução através de um filtro da pilha de 70 μm (como sugerido na etapa 5.1) é crítico para uma preparação bem sucedida da pilha. De facto, se não removido, as meninges ou as partes do tecido impedirão a separação eficiente do gradiente da densidade tendo por resultado rendimentos de pilha pobres.
- Tempo, temperatura e esterilidade. É muito importante executar todas as etapas em tempo hábil usando os ajustes e as incubações direitos da temperatura como sugerido. Isso é fundamental para garantir a alta viabilidade celular e integridade da amostra. Dependendo da aplicação a jusante, a realização de todas as etapas um capô estéril e com reagentes estéreis pode ser necessária (por exemplo, o estabelecimento de culturas de células primárias). A incubação prolongada na solução digestiva enzimática além do tempo sugerido (seção 3) pode resultar em uma queda de viabilidade celular. Os epítopos de alguns antígenos de superfície podem ser sensíveis à papana, resultando em perda de sinal na citometria de fluxo. Para aplicações específicas que exigem outros marcadores adicionais que não os descritos neste artigo, testar o desempenho de diferentes clones de anticorpos é recomendado antes de iniciar o experimento. Tem sido relatado que o meio de gradiente de densidade pode conter alguns traços de endotoxinas que podem desencadear a ativação de células imunes (microglia / macrófagos). Os controles internos apropriados devem sempre ser adicionados nas experiências sempre que estas populações são analisadas, para excluir os efeitos possíveis induzidos pelo procedimento. Furar com as temperaturas sugeridas e as sobras médias do gradiente da densidade de lavagem imediatamente depois que a etapa da restos-remoção é geralmente bastante para evitar a ativação evidente das pilhas imunes. No entanto, caso as aplicações a jusante (por exemplo, RNAseq ou análises funcionais) sejam afetadas por esta etapa, o usuário deve mudar para uma preparação média de gradiente de baixa densidade de endotoxina (sugerida na Tabela de Materiais).
- Anticorpos e máquina FACS. O protocolo de coloração de citometria de fluxo apresentado faz uso de concentrações de anticorpos e conjugações de cores que funcionaram melhor com rendimentos celulares recuperados em nossa experiência de laboratório e com máquinas FACS disponíveis em nosso instituto. O usuário deve excitar os anticorpos em suas mãos antes de iniciar um novo experimento, pois a concentração pode precisar ser ligeiramente ajustada. Além disso, incentivamos a usar sempre controles de coloração de cor única em cada experimento para verificar se todos os anticorpos e a configuração de compensação da máquina FACS estão funcionando adequadamente. Tem que ser notado que o antígeno CD90 (Thy) usado para detectar neurônios existe em dois isótipos diferentes, ou seja, CD90.2 ou CD90.1 dependendo da cepa do mouse: as cepas de camundongos mais comumente usadas, como C57BL6/J expresso CD90.2; cepas de mouse, como AKR/J, PL e FVB/N expressCD90.1. Assim, o usuário deve verificar cuidadosamente a cepa do mouse e escolher o anticorpo anti-CD90 apropriado (como sugerido na Tabela de Materiais)antes de iniciar os experimentos.
Em resumo, o protocolo aqui apresentado aproveita uma digestão enzimática suave seguida por uma coloração de 9 cores permitindo uma avaliação citométrica de fluxo simultâneo eficiente de diferentes tipos de células do cérebro do rato e da medula espinhal. O protocolo poderia ser explorado para monitorar de forma simplificada e abrangente a eficiência da segmentação celular por nanopartículas ou vetores virais administrados no CNS15. Além disso, o protocolo poderia ser facilmente adotado para aplicações a jusante muito delicadas, como classificação celular, subcultura ex vivo, RNAseq de célula única, resultando em extrema importância não apenas para a avaliação pré-clínica da segmentação celular por terapêutica, mas também para caracterização aprofundada de processos patológicos em doenças neurodegenerativas.
Uma fração de toda a população de células do SNC não é discriminada por este protocolo (ver "outros" tipos de células na Figura 2); Isso pode ser explicado pela presença de outros subtipos celulares que estão presentes no SNC, mas não são capturados pelos anticorpos que usamos. Em nossas análises preliminares, cerca de 14% da fração de "outras células" é positiva para CD73, um marcador de células mesenquímicaenriqueida na neurovasculatura e envolvido em vários processos neuroinflamatórios16,17. Além disso, nós supor que a fração de "outras células" também pode incluir células menos diferenciadas, como progenitores em diferentes estágios de maturação, como células-tronco neurais nestin+, vimentin+ vimentin+ progenitores radiais de glia, progenitores neurais doublecortin+, células precursoras oligodendrocyte NG2+, entre outras. Esses subtipos celulares poderiam ser facilmente investigados aplicando nosso protocolo de citometria de fluxo, uma vez que escolhemos uma configuração de corantes fluorescentes que permite acomodar até dois marcadores celulares adicionais conjugados com a fluorescenina isocianato (FITC) ou fluotófobas (PE).
Em geral, nossa abordagem poderia fornecer uma nova ferramenta para investigações mais abrangentes no contexto do SNC (na saúde e na doença) aproveitando uma tecnologia bem consolidada que permita avaliações quantitativas qualitativas e de alto rendimento tais como a citometria do fluxo.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Este estudo foi financiado por fundos start-up do Boston Children's Hospital para A.B., ALSA grant nr. 17-IIP-343 a M.P., e o Escritório do Secretário Adjunto de Defesa para Assuntos de Saúde através do Programa de Pesquisa de Esclerose Lateral Amiotrófica o Prêmio Nº. W81XWH-17-1-0036 a M.P. Reconhecemos o Núcleo de Citometria de Fluxo DFCI para suporte técnico.
Materiais
| Name | Company | Catalog Number | Comments |
| 10X HBSS (Calcium, Magnesium chloride, and Magnesium Sulfate-free) | Gibco | 14185-052 | |
| 70 mm Cell Strainer | Corning | 431751 | |
| ACSA/ACSA2 anti-mouse antibody | Miltenyi Biotec | 130-117-535 | APC conjugated |
| Bovine Serum Albumin | Sigma Aldrich | A9647-1KG | |
| CD11b rat anti-mouse antibody | Invitrogen | 47-0112-82 | APC-eFluor 780 conjugated |
| CD31 rat anti-mouse antibody | BD Bioscience | 562939 | BV421 conjugated |
| CD45 rat anti-mouse antibody | Biolegend | 103138 | Brilliant Violet 510 conjugated |
| CD90.1/Thy1.1 rat anti-mouse antibody | Biolegend | 202518 | PE/Cy7 conjugated |
| CD90.2/Thy1.2 rat anti-mouse antibody | Biolegend | 1005325 | PE/Cy7 conjugated |
| Conical Tubes (15 mL) | CellTreat | 229411 | |
| Conical Tubes (50 mL) | CellTreat | 229422 | |
| Dounce Tissue Grinder set (Includes Mortar as well as Pestles A and B) | Sigma-Aldrich | D9063-1SET | |
| Fc (CD16/CD32) Block rat anti-mouse antibody | BD Pharmingen | 553142 | |
| Fetal Bovine Serum | Benchmark | 100-106 | |
| Neural Tissue Dissociation Kit (P) | Miltenyi Biotec | 130-092-628 | |
| O4 anti mouse/rat/human antibody | Miltenyi Biotec | 130-095-895 | Biotin conjugated |
| Percoll | GE Healthcare | 10266569 | sold as not sterile reagent |
| Percoll | Sigma | 65455529 | sterile reagent (to be used for applications requiring sterility) |
| Percoll PLUS | Sigma | GE17-5445-01 | reagent containing very low traces of endotoxin |
| Streptavidin | Invitrogen | S3258 | Alexa Fluor 680 conjugated |
Referências
- Deverman, B. E., Ravina, B. M., Bankiewicz, K. S., Paul, S. M., Sah, D. W. Y. Gene therapy for neurological disorders: progress and prospects. Nature Reviews Drug Discovery. 17 (9), 641-659 (2018).
- Teleanu, D., Negut, I., Grumezescu, V., Grumezescu, A., Teleanu, R. Nanomaterials for Drug Delivery to the Central Nervous System. Nanomaterials. 9 (3), 371(2019).
- Chen, S., et al. Recombinant Viral Vectors as Neuroscience Tools. Current Protocols in Neuroscience. 87 (1), 67(2019).
- Alves, S., et al. Ultramicroscopy as a novel tool to unravel the tropism of AAV gene therapy vectors in the brain. Scientific Reports. 6 (1), 28272(2016).
- Peviani, M., et al. Lentiviral vectors carrying enhancer elements of Hb9 promoter drive selective transgene expression in mouse spinal cord motor neurons. Journal of Neuroscience Methods. 205 (1), 139-147 (2012).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. Journal of Immunological Methods. 243 (1-2), 77-97 (2000).
- Sykora, M. M., Reschke, M. Immunophenotyping of Tissue Samples Using Multicolor Flow Cytometry. Methods in Molecular Biology. 1953, 253-268 (2019).
- Legroux, L., et al. An optimized method to process mouse CNS to simultaneously analyze neural cells and leukocytes by flow cytometry. Journal of Neuroscience Methods. 247, 23-31 (2015).
- Lee, J. K., Tansey, M. G. Microglia Isolation from Adult Mouse Brain. Methods in Molecular Biology. 1041, 17-23 (2013).
- Grabert, K., McColl, B. W. Isolation and Phenotyping of Adult Mouse Microglial Cells. Methods in Molecular Biology. 1784, 77-86 (2018).
- Nikodemova, M., Watters, J. J. Efficient isolation of live microglia with preserved phenotypes from adult mouse brain. Journal of Neuroinflammation. 9 (1), 635(2012).
- Garcia, J. A., Cardona, S. M., Cardona, A. E. Isolation and analysis of mouse microglial cells. Current Protocols in Immunology. 104 (1), 1-15 (2014).
- Papa, S., et al. Selective Nanovector Mediated Treatment of Activated Proinflammatory Microglia/Macrophages in Spinal Cord Injury. ACS Nano. 7 (11), 9881-9895 (2013).
- Peviani, M., et al. Neuroprotective effects of the Sigma-1 receptor (S1R) agonist PRE-084, in a mouse model of motor neuron disease not linked to SOD1 mutation. Neurobiology of Disease. 62, 218-232 (2014).
- Peviani, M., et al. Biodegradable polymeric nanoparticles administered in the cerebrospinal fluid: Brain biodistribution, preferential internalization in microglia and implications for cell-selective drug release. Biomaterials. 209, 25-40 (2019).
- Meng, F., et al. CD73-derived adenosine controls inflammation and neurodegeneration by modulating dopamine signalling. Brain. 142 (3), 700-718 (2019).
- Nedeljkovic, N. Complex regulation of ecto-5'-nucleotidase/CD73 and A2AR-mediated adenosine signaling at neurovascular unit: A link between acute and chronic neuroinflammation. Pharmacological Research. 144, 99-115 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados