Method Article
Gleichzeitige zytometrische Charakterisierung mehrerer Zelltypen, die durch verschiedene Homogenisierungsmethoden aus dem Maushirn/Spinalcord abgerufen wurden
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Wir präsentieren eine Durchflusszytometrie-Methode, um gleichzeitig verschiedene Zelltypen zu identifizieren, die aus dem Gehirn oder Rückenmark der Maus abgerufen wurden. Diese Methode könnte genutzt werden, um reine Zellpopulationen bei neurodegenerativen Erkrankungen zu isolieren oder zu charakterisieren oder das Ausmaß der Zellausrichtung bei der In-vivo-Verabreichung von viralen Vektoren oder Nanopartikeln zu quantifizieren.
Zusammenfassung
Jüngste Fortschritte in den viralen Vektor- und Nanomaterialwissenschaften haben den Weg für neue innovative Ansätze zur Untersuchung oder Manipulation des Zentralnervensystems (ZNS) geebnet. Eine weitere Optimierung dieser Technologien würde jedoch von Methoden profitieren, die eine schnelle und schlanke Bestimmung des Ausmaßes von ZNS und zellspezifischem Targeting bei verabreichung von viralen Vektoren oder Nanopartikeln im Körper ermöglichen. Hier stellen wir ein Protokoll vor, das die hohen Durchsatz- und Multiplexing-Fähigkeiten der Durchflusszytometrie nutzt, um eine einfache Quantifizierung verschiedener Zellsubtypen zu ermöglichen, die aus dem Gehirn oder Rückenmark der Maus isoliert sind, nämlich Mikroglia/Makrophagen, Lymphozyten, Astrozyten, Oligodendrozyten, Neuronen und Endothelzellen. Wir wenden diesen Ansatz an, um kritische Unterschiede zwischen zwei Gewebehomogenisierungsmethoden in Bezug auf Zellausbeute, Lebensfähigkeit und Zusammensetzung hervorzuheben. Dies könnte den Benutzer anweisen, die beste Methode zu wählen, abhängig von den von Interesse sindden Zelltypen und der spezifischen Anwendung. Diese Methode eignet sich nicht für die Analyse der anatomischen Verteilung, da das Gewebe homogenisiert ist, um eine einzellige Suspension zu erzeugen. Es ermöglicht jedoch die Arbeit mit lebensfähigen Zellen und kann mit zellsortierung kombiniert werden, was den Weg für mehrere Anwendungen öffnet, die das Repertoire an Werkzeugen in den Händen des Neurowissenschaftlers erweitern könnten, von der Etablierung von Primärkulturen aus reinen Zellpopulationen bis hin zu Genexpressionsanalysen und biochemischen oder funktionellen Assays zu gut definierten Zellsubtypen im Kontext neurodegenerativer Erkrankungen, zur pharmakologischen Behandlung oder Gentherapie.
Einleitung
Gen- und Medikamentenabgabetechnologien (wie virale Vektoren und Nanopartikel) sind zu einem leistungsfähigen Werkzeug geworden, das angewendet werden kann, um bessere Einblicke in spezifische molekulare Pfade zu gewinnen, die bei neurodegenerativen Erkrankungen verändert wurden, und für die Entwicklung innovativer therapeutischer Ansätze1,2,3. Die Optimierung dieser Werkzeuge beruht auf der Quantifizierung von: (1) dem Ausmaß der Penetration im ZNS auf verschiedenen Verabreichungswegen und (2) der Ausrichtung auf bestimmte Zellpopulationen. Histologische Analysen werden in der Regel angewendet, um fluoreszierende Reportergene oder fluoreszierend markierte Nanopartikel in verschiedenen ZNS-Bereichen und über verschiedene Zelltypen hinweg zu visualisieren, die durch Immunfärbung für bestimmte Zellmarker identifiziert werden4,5. Obwohl dieser Ansatz wertvolle Informationen über die Bioverteilung des verabreichten Gens oder der Instrumente zur Medikamentenabgabe liefert, kann die Technik zeitaufwändig und arbeitsintensiv sein, da sie Folgendes erfordert: (1) Gewebefixierung, Kryokonservierung oder Paraffineinbettung und Schneiden; (2) Färbung für bestimmte zelluläre Marker, die manchmal Antigen-Retrieval erfordern; (3) Erfassung durch Fluoreszenzmikroskopie, die in der Regel die Analyse einer begrenzten Anzahl verschiedener Marker innerhalb desselben Experiments ermöglicht; (4) Bildverarbeitung, um eine ordnungsgemäße Quantifizierung des Interessensignals zu ermöglichen.
Die Durchflusszytometrie ist zu einer weit verbreiteten Technik geworden, die sehr spezifische Fluoreszenzmarker nutzt, um nicht nur eine schnelle quantitative Auswertung verschiedener Zellphänotypen in Zellsuspensionen zu ermöglichen, basierend auf der Expression von Oberflächen- oder intrazellulären Antigenen, sondern auch funktionelle Messungen (z. B. Apoptoserate, Proliferation, Zellzyklusanalyse usw.). Die physikalische Isolierung von Zellen durch fluoreszierende aktivierte Zellsortierung ist ebenfalls möglich, was weitere nachgelagerte Anwendungen (z.B. Zellkultur, RNAseq, biochemische Analysen usw.) ermöglicht. 6,7,8.
Die Gewebehomogenisierung ist ein kritischer Schritt, der notwendig ist, um eine Einzelzellsuspension zu erhalten, um zuverlässige und reproduzierbare zytometrische Auswertungen nachdemdurchzuermöglichen. Für die Homogenisierung des Gehirns und des Gehirngewebes wurden verschiedene Methoden beschrieben, hauptsächlich mit dem Ziel, Mikrogliazellen9,10,11zu isolieren; sie können insgesamt in zwei Hauptkategorien eingeteilt werden: (1) mechanische Dissoziation, die Schleif- oder Scherkraft durch einen Dounce Homogenisator (DH) verwendet, um Zellen aus ihren Nischen zu reißen und eine relativ homogenisierte Einzelzellsuspension zu bilden, und (2) enzymatische Verdauung, die auf inkubation von hackenden Gewebestücken bei 37 °C in Gegenwart von proteolytischen Enzymen wie Trypsin oder Papain beruht, was den Abbau der extrazellulären Matrix begünstigt, um eine fair homogeneZellezu erzeugen.
Unabhängig davon, welche Methode verwendet wird, wird nach der Gewebehomogenisierung ein Reinigungsschritt empfohlen, um Myelin durch Zentrifugation auf einem Dichtegradienten oder durch magnetische Selektion9,12zu entfernen, bevor man zu den nachgeschalteten Anwendungen übergeht.
Hier beschreiben wir ein Gewebeverarbeitungsverfahren auf Basis der Papainverdauung (PD), gefolgt von der Reinigung auf einem Dichtegradienten, optimiert, um lebensfähige heterogene Zellsuspensionen aus dem Maushirn oder Rückenmark zeitempfindlich und für die Durchflusszytometrie geeignet zu erhalten. Darüber hinaus beschreiben wir ein 9-farbene Strömungszytometrie-Panel und die Gating-Strategie, die wir im Labor angenommen haben, um die gleichzeitige Diskriminierung verschiedener ZNS-Populationen, lebender/toter Zellen oder Positivität für fluoreszierende Reporter wie grünes fluoreszierendes Protein oder Rhodaminfarbstoff zu ermöglichen. Durch die Anwendung dieser zytometrischen Durchflussanalyse können wir verschiedene Methoden der Gewebeverarbeitung, d.h. PD versus DH, in Bezug auf die Erhaltung der zellulären Lebensfähigkeit und der Erträge verschiedener Zelltypen vergleichen.
Die Details, die wir hierin angeben, können die Entscheidung über das Homogenisierungsprotokoll und die Antikörperkombination in der Durchflusszytometrie-Platte auf der Grundlage der spezifischen Zelltypen von Interesse und der nachgelagerten Analysen (z. B. temperaturempfindliche Anwendungen, Verfolgung spezifischer Fluoreszenzmarker, In-vitro-Kultur, funktionelle Analysen).
Protokoll
Alle hier beschriebenen Methoden wurden vom Institutional Animal Care and Use Committee (IACUC) des Dana Farber Cancer Institute (Protokollnummer 16-024) genehmigt.
1. Vorbereitung der für das Experiment erforderlichen Lösungen
- Bereiten Sie 1x Hanks ausgewogene Salzlösung (HBSS) vor, indem Sie 10x HBSS mit sterilem Wasser verdünnen. Die Lösung auf Eis vorkühlen. Für jede Probe werden mindestens 25 ml Lösung benötigt.
- Bereiten Sie isotonische Percoll-Lösung (IPS) durch Mischen von 10x sterilem HBSS 1:10 mit Dichtegradientenmedium (d.h. Percoll) vor. Vorchill auf Eis.
HINWEIS: IPS kann bis zu 30 Tage bei 4 °C gelagert werden. - Vorbereitung der Durchflusszytometrie (FACS) Blockierung (BL) Lösung (1% Rinderserumalbumin [BSA], 5% fetales Rinderserum [FBS] in phosphatgepufferter Kochsaline [PBS]). Vorchill auf Eis.
2. Tierische Euthanasie durch intrakardiale Perfusion und Gewebesektion
HINWEIS: Acht Wochen alte C57BL/6J-Mäuse, beide Geschlechtsmäuse, wurden in den Experimenten verwendet. Perfusion mit PBS-Lösung wird durchgeführt, um Blutkontamination von Organen zu beseitigen, bevor sie mit der Gewebeverdauung fortfährt.
- Anästhesisieren Sie die Maus mit einer Mischung aus Ketamin/Xylazin (90 x 200 mg/kg Ketamin, 10 mg/kg Xylazin). Legen Sie die Maus auf den Rücken und band jede Gliedmaße bis zur Stütze. Überprüfen Sie die angemessene Tiefe der Anästhesie, indem Sie den Entzugsreflex überprüfen.
- Machen Sie einen Mittellinien-Hautschnitt auf der Ebene des Brusteinlasses, um das Brustbein freizulegen. Verwenden Sie Zangen, um die Spitze des Brustbeins zu greifen, dann machen Sie einen 1 cm Schnitt auf jeder Seite des Rippenkäfigs. Schließlich durchschneiden Sie das Zwerchfell und öffnen Sie das Brustbein weit genug, um das Herz zu visualisieren.
- Verwenden Sie Zangen, um das Herz sanft durch den rechten Ventrikel zu greifen und heben Sie es auf die Mittellinie und leicht aus der Brust.
- Legen Sie eine 23 G Schmetterlingsnadel in die Spitze des linken Ventrikels in Richtung Aorta und halten Sie fest.
- Starten Sie die Perfusion mit 1x PBS. Pierce durch die rechte Ohrmuschel mit einer Schere, damit die Perfusate den Kreislauf verlassen kann. Stellen Sie den Durchfluss von PBS auf 3 ml/min. Perfuse mit mindestens 15 ml 1x PBS ein, um sicherzustellen, dass das Gewebe frei ist.
HINWEIS: Blanchieren der Leber und der mesenterischen Blutgefäße sind Anzeichen einer guten Durchblutung. Bei Bedarf kann das Volumen der Vorfusion erhöht werden, bis die Flüssigkeit, die das Herz austritt, blutfrei ist, an deren Stelle die Spüllinie gestoppt werden kann. - Nach der Perfusion, trennen Sie das Gehirn vom Rückenmark und entfernen Sie das Gehirn aus dem Schädel mit Schere und Zange. Entfernen Sie das Fell, um die Sichtbarkeit und Kontrolle während der Zerlegung zu erhöhen und um das Übertragen von Haarverunreinigungen zu vermeiden. Spülen Sie das Rückenmark aus seiner Säule, indem Sie eine 3 ml Spritze verwenden, die mit PBS gefüllt ist.
- Übertragen Sie jedes Gewebe in einem Brunnen einer 6-Well-Multi-Well-Platte, die mit 2 ml eiskaltem 1x HBSS vorgefüllt ist, und halten Sie bis zur Verdauung auf Eis.
- Teilen Sie das Gehirn und das Rückenmark in zwei Hälften, entlang der Längslinie.
ANMERKUNG: Die Hälfte jedes Gewebes ist homogenisiert (siehe Abschnitte unten), um zytometrische Durchflussanalysen zu ermöglichen; die andere Hälfte kann für alternative Analysen unterschiedlich verarbeitet werden (z.B. in paraformaldehydfixative Lösung für die Histologie getaucht).
3. Enzymatische Verdauung von Gehirn und Rückenmark
HINWEIS: Die in diesem Abschnitt beschriebenen Volumina reichen für die Verdauung von halb Gehirn oder Rückenmark aus.
- Verwenden Sie eine Schere, um das Gewebe in 1 x 2 mm dicke Stücke zu zerkleinern.
- Schneiden Sie die Spitze einer 1000-L-Pipette mit einer Schere, um sie so groß zu machen, dass die Gewebestücke aufgenommen werden können. Die Pipettenspitze mit 1x HBSS vorspülen. Dann verwenden Sie die Pipette, um die 2 ml HBSS-Lösung, die das gehackte Gewebe enthält, in ein 15 ml konisches Rohr zu übertragen.
HINWEIS: Das Vorspülen der Pipettenspitze ist wichtig, um eine Klebrigkeit der Gewebestücke in der Spitze zu verhindern. - Waschen Sie den Brunnen mit zusätzlichen 2 ml eiskaltem 1x HBSS und übertragen Sie die Lösung auf das entsprechende 15 ml konische Rohr, das die Gewebestücke enthält.
- Zentrifuge jede Probe für 5 min bei 250 x g bei 4 °C.
- Vorbereiten des Enzymmix1 des Neuronalgewebe-Dissoziationskits (NTDK; Materialtabelle) durch Mischen von 50 l Enzym P mit 1900 l Puffer X pro Probe. Warmes Enzym mix1 bei 37 °C in einem Wasserbad. Inkubat-Enzym-Mix 1 bei 37 °C für mindestens 10 min vor Gebrauch, um die vollständige Aktivierung des Enzyms zu ermöglichen.
- Aspirieren Sie den Überstand aus dem 15 ml konischen Rohr und fügen Sie 1,95 ml Enzymmischung 1 zu jeder Probe hinzu. Sanft wirbeln, um sicherzustellen, dass das Pellet resuspendiert wird.
- Die Proben auf einem Rad oder Shaker 15 min bei 37 °C inkubieren.
- In der Zwischenzeit bereiten Sie Enzymmix 2 des NTDK vor, indem Sie 10 l Enzym A mit 20 l Puffer Y pro Probe mischen; die Lösung bei 37 °C in einem Wasserbad vorwärmen.
- Am Ende der Inkubation mit Enzymmix 1, fügen Sie 30 l Enzymmischung 2 zu jeder Probe hinzu.
- Mischen Sie die Proben vorsichtig, indem Sie die Proben vorsichtig nach oben und unten mit einer 1000 l Pipettespitze vorspülen mit 1x HBSS.
- Die Probe 15 min bei 37 °C auf einem Rad oder Shaker bebrüten.
- Nach der Inkubation 10 ml eiskalte1x HBSS in jede Röhre geben, um Enzymmix 1 und Enzymmischung 2 zu inaktivieren.
- Zentrifuge jede Probe für 10 min bei 320 x g bei 4 °C.
- Entsorgen Sie den Überstand; Bis zu einem Endvolumen von 7 ml eiskalt 1x HBSS zu jeder Röhre geben und das Pellet durch Wirbeln vorsichtig wieder aufhängen.
- Fahren Sie mit Abschnitt 5 fort, um Denerzufuhr zu machen.
4. Mechanische Homogenisierung von Gehirn und Rückenmark
HINWEIS: Die in diesem Abschnitt beschriebenen Volumina reichen für die Homogenisierung von halb Hirn oder Rückenmark aus. Das in diesem Abschnitt beschriebene Protokoll kann je nach Benutzerbedarf als Alternative zu dem in Abschnitt 3 beschriebenen Verfahren verwendet werden, wie unten erläutert.
- Den Glasmörtel der Dounce-Gewebemühle(Stofftabelle) auf Eis stellen vorkühlen.
- 3 ml vorgekühlter 1x HBSS in den Mörtel geben.
- Übertragen Sie das Gewebe (Gehirn oder Rückenmark) aus dem Brunnen der 6-Well-Platte in den Glasmörtel, um sicherzustellen, dass es in 1x HBSS getaucht wird und am Boden des Mörsers sitzt.
- Zerkleinern Sie das Gewebe vorsichtig mit 10 Schlägen Pestle A gefolgt von 10 Schlägen Pestle B. Übertragen Sie die homogenisierte Mischung in ein neues 15 ml konisches Rohr.
- Füllen Sie das Rohr auf ein Endvolumen von 10 ml, indem Sie vorgekühlte 1x HBSS und Zentrifuge für 10 min bei 320 x g bei 4 °C verwenden.
- Den Überstand ansaugen und bis zu einem Endvolumen von 7 ml eiskalt 1x HBSS zu jeder Röhre hinzufügen und das Pellet durch Wirbeln vorsichtig wieder aufhängen.
- Fahren Sie mit Abschnitt 5 fort, um Denerzufuhr zu machen.
5. Trümmerentfernung
ANMERKUNG: Die Entfernung von Schmutz, die hauptsächlich aus unverdautem Gewebe und Myelinscheiden besteht, ist ein entscheidender Schritt, um eine effiziente Färbung des Gewebehomogenats für nachfolgende zytometrische Durchflussanalysen zu ermöglichen.
- Filtern Sie jede Probe durch ein 70-m-Zellsieb, um unverdaute Gewebestücke zu entfernen. Dieser Schritt ist besonders wichtig, vor allem bei der Arbeit mit Rückenmarksgewebe, da diese Proben eher unverdaute Nervenfragmente oder Hirnmen, die die nachfolgenden Schritte beeinflussen könnten enthalten.
- Stellen Sie sicher, dass das Endvolumen in jedem Probenröhrchen 7 ml beträgt. Wenn nicht, mit eiskalten 1x HBSS bis zu 7 ml füllen.
- Fügen Sie jeder Probe 3 ml vorgekühltes IPS hinzu, um ein Endvolumen von 10 ml einer Lösung herzustellen, die ein Dichtegradientenmedium bei einer Endkonzentration von 30 % enthält. Wirbeln Sie die Proben sanft, um sicherzustellen, dass sie homogen gemischt werden.
- Zentrifugenproben für 15 min bei 700 x g bei 18 °C und stellen sicher, dass die Beschleunigung der Zentrifuge auf 7 und die Bremse auf 0 eingestellt wird.
HINWEIS: Die Zentrifugation sollte ca. 30 min dauern. - Entfernen Sie die Proben zart aus der Zentrifuge.
HINWEIS: Eine weißliche Scheibe aus Schmutz und Myelin sollte sichtbar auf der Oberfläche der Lösung schwebend sein. Ein Pellet (das die Zellen enthält) sollte an der Unterseite des Rohres sichtbar sein. - Sorgfältig ansaugen alle weißlichen Scheibe von Schutt und dann der Rest des Überstandes sicherstellen, dass nicht das Pellet zu vertreiben. Lassen Sie ca. 100 l Lösung auf dem Zellpellet, um das Risiko zu vermeiden, dass es versehentlich abgelassen wird.
- 1 ml FACS BL hinzufügen, das Pellet durch Pipettieren mit einer 1000-L-Pipettenspitze wieder auf- und abhängen und Proben in 1,5 ml-Rohre übertragen.
- Zentrifuge für 5 min bei 450 x g bei Raumtemperatur (RT).
- Befangen Sie den Überstand vorsichtig ansaugen und das Pellet in einem geeigneten Puffer wieder aufsetzen, der mit nachgeschalteten Analysen kompatibel ist (siehe Abschnitt 6 für das Protokoll zur zytometrischen Durchflussbewertung mehrerer Zelltypen).
6. Färbung zur zytometrischen Durchflussbewertung mehrerer Zelltypen
- Setzen Sie das in Schritt 5.9 erhaltene Pellet mit 350 l FACS BL wieder auf. Fügen Sie jeder Probe einen Fc-Block bei einer Endkonzentration von 5 g/ml hinzu.
ANMERKUNG: Mindestens 100 l der Probe sollten für eine Färbung verwendet werden, um sicherzustellen, dass genügend Zellen verarbeitet werden, um zuverlässige Analysen zu ermöglichen. - Inkubieren Sie die Probe 10 min bei 4 °C, bevor Sie mit der Färbung fortfahren.
- Bereiten Sie eine Antikörpermischung gemäß Tabelle 1vor.
- Jedem Rohr Antikörpermischung hinzufügen, 5 s Wirbel geben und die Proben 15 min bei 4 °C im Dunkeln inkubieren.
- Fügen Sie 1 ml PBS zu jedem Röhrchen, Wirbel und Zentrifuge für 5 min bei 450 x g bei RT hinzu.
- In der Zwischenzeit vorbereiten Streptavidin Mischung nach Tabelle 1.
- Entsorgen Sie den Überstand und setzen Sie das Pellet in der in Schritt 6.6 zubereiteten Streptavidinmischung wieder auf. Verwenden Sie für jede Probe das gleiche Volumen wie für die Färbung in Schritt 6.4.
- Wirbel für 5 s und inkubieren Sie die Proben für 10 min bei 4 °C im Dunkeln.
- Fügen Sie 1 ml PBS zu jedem Röhrchen, Wirbel und Zentrifuge für 5 min bei 450 x g bei RT hinzu.
- Entsorgen Sie den Überstand und setzen Sie das Pellet in FACS BL wieder auf. Verwenden Sie 300 l FACS BL für jede 100 l der gebeizten Probe.
- Fügen Sie 7-Amino-Actinomycin D (7-AAD) Lösung zu jeder Probe. Verwenden Sie für jede in Schritt 6.10 erstellte Probe 300 l l 7-AAD.
- Proben bei 4 °C im Dunkeln bis zur zytofluorimetrischen Analyse lagern. Führen Sie die Analyse innerhalb von 16 h ab der Probenvorbereitung durch, um die Zelllebensfähigkeit von >60 % zu gewährleisten.
Ergebnisse
Wir verglichen zwei verschiedene Homogenisierungsmethoden (DH versus PD), die auf Das Maushirn und Rückenmark angewendet wurden, um die Effizienz beim Abrufen verschiedener lebensfähiger Zelltypen zu testen, die für nachgelagerte Anwendungen geeignet sind. Dazu nutzten wir ein 9-farbiges Flow-Zytometrie-Panel, das verschiedene ZNS-Zelltypen wie Mikroglia, Lymphozyten, Neuronen, Astrozyten, Oligodendrozyten und Endothel charakterisieren soll.
Hirn- und Rückenmarksgewebe wurden von verschiedenen Mäusen (n 6) entnommen, in zwei Hälften längs aufgeteilt, gewogen und parallel verarbeitet, indem entweder mechanische Störungen nach dem Dounce Homogenizer (DH-Methode) angewendet oder sanft gehackt und enzymatisch mit dem kommerziellen NTDK auf Basis von Papain (PD-Methode)(Abbildung 1A)verdaut und verdaut wurden. Nach der Entfernung von Schmutz wurden Zellen aus dem Gehirn oder dem Rückenmark in Trypan-Blau verdünnt, um die Zellausbeute und Lebensfähigkeit mit einer Neubauer-Kammer zu bestimmen (Abbildung 1B,C). Die DH-Methode produzierte insgesamt eine höhere Zellausbeute sowohl aus Gehirn als auch rückendem Mark. Die Mehrheit der entnommenen Zellen war jedoch tot, was nur zu 13,8 % bis 3,3 % der lebensfähigen Zellen im Gehirn und 10,5 % bis 1,5 % im Rückenmark führte (Abbildung 1B). Viele der abgestorbenen Zellen bildeten Aggregate (Abbildung 1C); Dieses Phänomen könnte auf das Vorhandensein von stark miteinander verbundenen Zellnetzwerken (wie die endotheliale und glial Zellen, die die ZNS-Vaskulatur auskleidung), zurückzuführen sein, die nicht durch die mit der DH aufgebrachte Scherkraft disaggregiert werden konnten. Diese Aggregate von Todeszellen wurden wahrscheinlich nicht durch den Dichtegradienten entfernt und landeten im endgültigen Zellpellet, das für die zytofluorimetrische Analyse verwendet wurde. Im Gegenteil, die PD-Methode bestimmt eine insgesamt bessere Erhaltung der zellulären Lebensfähigkeit (90,6 % bis 0,6 % im Gehirn und 85,2 % bis 2,8 % im Rückenmark). Papain ist in der Lage, die extrazelluläre Matrix und Zell-zu-Zell-Verbindungen effizient zu verdauen, was zu einer gleichmäßigeren einzelzelligen Suspension führt. Einige der Zellen, die während des Hackprozesses absterben, könnten durch Papain weiter verdaut werden, was zur Bildung von Zellablagerungen führt, die durch den Dichtegradienten effizienter getrennt werden. Insgesamt wurde dadurch wahrscheinlich eine bessere Erhaltung der Zelllebensfähigkeit mit DER PD-Methode bestimmt, trotz einer etwas geringeren Zellausbeute im Vergleich zur DH-Methode.
Ein Aliquot von 100 l aus den Suspensionen der Gehirn- und Rückenmarkszellen wurde mit dem Antikörpermix(Tabelle 1) gebeizt und durch Durchflusszytometrie mit einem 9-Farben-Panel analysiert. Abbildung 2A zeigt die Gating-Strategie, mit der die verschiedenen Zelltypen aus den Suspensionen des Gehirns und der Rückenmarkszellen identifiziert werden. Kurz gesagt, das erste Tor identifiziert die allgemeine Population nach Vorwärtsstreuung (FSC) und Seitenstreuung (SSC), ausgenommen Kleinzellablagerungen. Dann werden lebende (7-AAD-) Zellen identifiziert. Innerhalb der gesamten Lebendzellenpopulation werden CD45+ und CD45-Zellen hervorgehoben. Innerhalb des CD45+ Gates werden CD45+CD11b+ Mikroglia/Makrophagen und CD45+CD11b-Lymphozyten identifiziert. Innerhalb des CD45-Tors werden Zellen je nach Positivität für ACSA2 (Astrozyten) oder O4 (Oligodendrozyten) diskriminiert. CD45-ACS2-O4-Zellen werden nach Positivität für Thy1 (Neuronen) oder CD31 (Endothel) weiter unterteilt. Verbleibende Thy1-CD31-Zellen werden als "andere Zelltypen" klassifiziert, die nicht durch unseren Antikörpermix berücksichtigt werden.
Wie in Abbildung 2Bdargestellt, waren bei der DH-Methode etwa 38 % der aus dem Gehirn entnommenen lebensfähigen Zellen und etwa 32 % der aus dem Rückenmark entnommenen lebensfähigen Zellen hämatopoetischen Ursprungs (CD45+). Auf der anderen Seite erlaubte die PD-Methode, eine signifikant hohe Ausbeute an lebensfähigen Zellen in beiden Geweben abzurufen, wobei eine sehr große Fraktion durch nicht-hämatopoetische CD45-Zellen (etwa 82% im Gehirn und 92% im Rückenmark) repräsentiert wurde. Bemerkenswerterweise stellten CD45+CD11b+ Mikroglia/Makrophagen mit der DH-Methode die am häufigsten vorhandene lebensfähige Zellfraktion dar (Abbildung 2C). Die PD-Methode erzeugte jedoch eine heterogenere Darstellung von Zelltypen, einschließlich ACSA+-Astrozyten, O4+-Oligodendrozyten, CD31+-Endothelzellen und Thy1+-Neuronen (Abbildung 2C). Interessanterweise waren lebensfähige Neuronen und Endothelzellen mit der DH-Methode kaum nachweisbar.
Die DH-Methode beruht auf dem mechanischen Schleifen des Gewebes zwischen dem Glasstöße und dem Mörtel des Dounce Homogenisators, um eine Gewebehomogenisierung zu erhalten. Dies könnte einige Scherstress verursachen, die wahrscheinlich beschädigen und die Lebensfähigkeit von großen oder sehr empfindlichen Zellen wie Neuronen oder Zellen der Neurovaskulatur beeinträchtigen. Wir haben die zelluläre Lebensfähigkeit (Prozentsatz der 7-AAD-Zellen) innerhalb jeder Zellsubpopulation bewertet, die durch das Antikörperpanel identifiziert wurde (Abbildung 3). Hämatopoetische Zellen (CD45+), die aus Gehirn und Rückenmark isoliert sind, einschließlich Mikroglia/Makrophagen (CD45+CD11b+) und andere nicht-myeloische Zellen (CD45+Cd11b-), zeigten unabhängig von der verwendeten Homogenisierungsmethode eine sehr hohe Lebensfähigkeit (Abbildung 3A). Im Gegenteil, das DH-Verfahren bestimmt eine signifikante Verringerung der Lebensfähigkeit von CD45-Populationen (Abbildung 3B), während die PD-Methode eine umfassende Erhaltung verschiedener ZNS-Zelltypen bestimmt. Im Detail waren Neuronen und Endothelzellen die Subpopulationen, die am stärksten von DH betroffen waren und durch die PD-Methode konserviert wurden.
Abbildung 4ist eine schematische Darstellung der kritischen Schritte zusammengefasst, die für eine ordnungsgemäße Probenvorbereitung und effiziente Entfernung von Abfällen erforderlich sind.
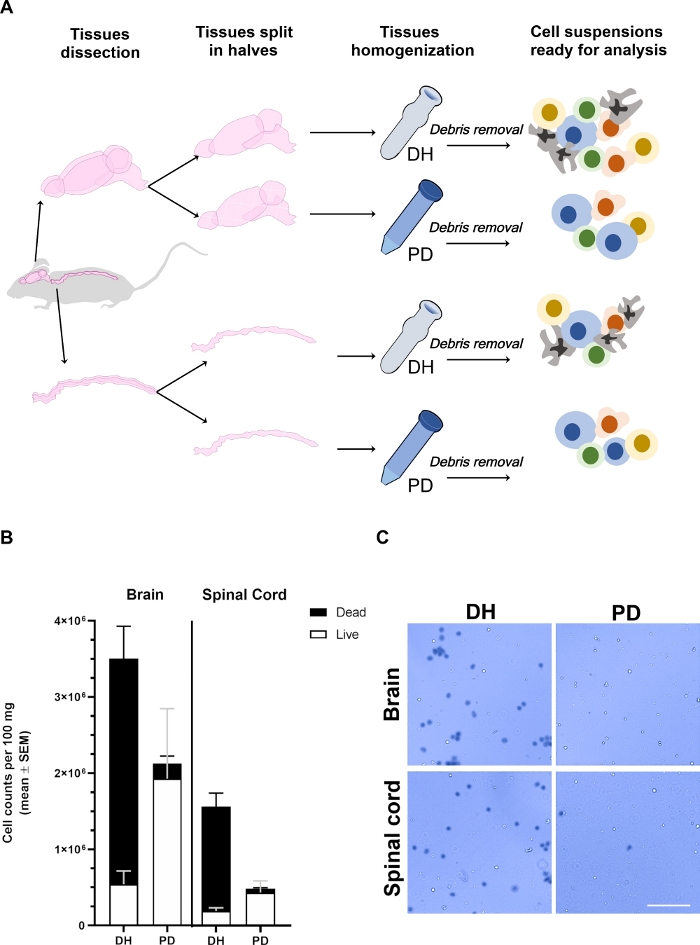
Abbildung 1: Die Ausbeute der aus Gehirn und Rückenmark entnommenen Zellen wird durch die Homogenisierungsmethode beeinflusst.
(A) Experimentelle Randlinie. Mäuse wurden anästhesisiert und intrakardial mit PBS durchdrungen, um intravaskuläre zirkulierende Blutzellen zu entfernen. Gehirn und Rückenmark wurden sorgfältig seziert und längs in zwei Hälften geteilt. Gewebe wurden entweder mit Dounce Homogenisator (DH) oder Papain-Verdauung (PD) homogenisiert, wie im Haupttext beschrieben. Myelin und Gewebeablagerungen wurden dann durch Zentrifugation in einer 30%igen Dichtegradienten-Mittellösung entfernt, was zu einer heterogenen Zellsuspension mit verschiedenen Zelltypen führte, die durch Durchflusszytometrie analysiert werden konnte. (B) Histogramme, die die Ausbeute von Zellen zeigen, die bei der Gewebehomogenisierung mit der DH- oder PD-Methode aus dem Gehirn oder dem Rückenmark entnommen wurden. Es wird der Mittelwert von mindestens 6 Tieren pro Zustand dargestellt. (C) Repräsentative Hellfeldmikroskop-Photomikroskope von Trypan-Blau-Positiven(tot) und negativen (lebenden) Zellen, die mit den beiden Methoden aus dem Gehirn oder Rückenmark entnommen wurden. Maßstabsleiste = 100 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Relative Anteile verschiedener Zelltypen, die aus dem ZNS abgerufen werden, werden von der Gewebehomogenisierungsmethode beeinflusst.
(A) Repräsentative Strömungszytometrie-Plots, die die Gating-Strategie zur Identifizierung verschiedener Zellsubpopulationen innerhalb von Zellpräparaten aus Gehirn oder Rückenmark zeigen: Die Zellpopulation wird nach physikalischen Parametern von FSC und SSC abgegrenzt, gefolgt von der Auswahl für 7-AAD-lebende Zellen; dann werden Zellen entsprechend der Positivität für CD45 Marker diskriminiert; Mikroglia/Makrophagen werden als CD11b+-Zellen innerhalb der CD45+-Fraktion identifiziert, während Lymphozyten CD11b-sind. Astrozyten, Oligodendrozyten, endotheliale und neuronale Zellen werden als ACSA2+, O4+, CD31+ oder Thy1+ Zellen innerhalb von CD45- bzw. identifiziert. (B) Histogramme, die den Prozentsatz der CD45+ und CD45-Zellen innerhalb der gesamten lebenden oder toten Zellpopulationen im Gehirn oder Rückenmark bei Homogenisierung mit der DH- oder PD-Methode zeigen. Die statistische Analyse der in den Schaubildern dargestellten Ergebnisse ist in Tabelle 2dargestellt. (C) Kreisdiagramme, die den Prozentsatz verschiedener lebensfähiger Zellsubtypen innerhalb der Gesamten Zellpopulation im Gehirn oder Rückenmark nach Homogenisierung mit der DH- oder PD-Methode zeigen. Der Prozentsatz der gesamten abgestorbenen Zellen wird ebenfalls gemeldet. N bis 6. CD45+CD11b+ = Mikroglia/Makrophagen; CD45+CD11b- = Lymphozyten/nicht-myeloische Zellen; CD45-ACSA2+ = Astrozyten; CD45-O4+ = Oligodendrozyten; CD45-Thy1+ = Neuronen; CD45-CD31+ = Endothelzellen; Andere = Zellen negativ für alle oben genannten Marker. Die statistische Analyse der in den Schaubildern dargestellten Ergebnisse ist in Tabelle 2dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
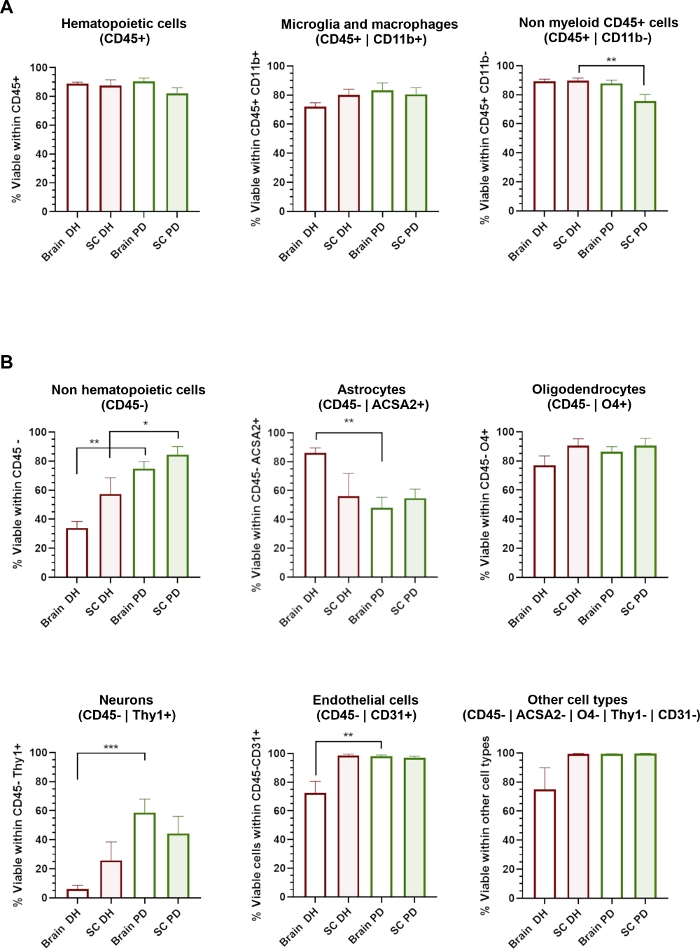
Abbildung 3: Die zelluläre Lebensfähigkeit verschiedener ZNS-Zelltypen wird durch die angewendete Homogenisierungsmethode beeinflusst.
(A) Histogramme, die den Prozentsatz von 7-AAD- Lebendzellen innerhalb von CD45+ hämatopoetischen Populationen einschließlich CD11b+ Mikroglia/Makrophagen und CD11b- nicht myeloischer Zellen zeigen. (B) Histogramme, die den Prozentsatz von 7-AAD-Lebendzellen innerhalb von CD45- nicht-hämatopoetischen Populationen einschließlich Astrozyten, Oligodendrozyten, Neuronen, Endothel und anderen Zelltypen zeigen. * = p < 0.05, ** = p < 0.01, Mann-Whitney zwischen DH und PD. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Schematische Darstellung der kritischen Schritte, die für die ordnungsgemäße Gewebeverarbeitung erforderlich sind.
Eine Liste der wichtigsten Schritte, die für die ordnungsgemäße Gewebeverarbeitung und effiziente Entfernung von Schmutz erforderlich sind, wird gezeigt. Es ist wichtig, die Trümmerscheibe (schwarzer Pfeil) und das Zellpellet (blauer Pfeil), das nach der Zentrifugation der Proben auf dem 30%igen Dichtegradienten gebildet wurde, richtig zu identifizieren. Die Trümmerscheibe muss zusammen mit dem Rest des Überstandes sorgfältig durch Aspiration entfernt werden, ohne das Zellpellet zu entfernen, um Probenverlust zu vermeiden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Antikörper-Mix | Anfangskonzentration (g/ml) | Endkonzentration (g/ml) | Verdünnungsfaktor |
| Anti CD45/BV510 | 200 | 2 | 100 |
| Anti CD11b/APC.780 | 200 | 2 | 100 |
| Anti CD31/BV421 | 200 | 2 | 100 |
| Anti ACSA2/APC | 150 | 0.75 | 200 |
| Anti O4/Biotin | Na | Na | 40 |
| Anti-CD90.2/PE. Cy7 | 200 | 2 | 100 |
| Streptavidin-Mischung | Anfangskonzentration (g/ml) | Endkonzentration (g/ml) | Verdünnungsfaktor |
| Streptavidin/Alexa 680 | 1000 | 1 | 1000 |
Tabelle 1: Rezept für die Herstellung von Mischungen für die Durchflusszytometriefärbung. Die Tabelle beschreibt die optimalen Konzentrationen von Antikörpern und Streptavidin, die verwendet werden, um zytometrische Flussanalysen mehrerer Zelltypen zu ermöglichen. Einzelheiten zu den Katalognummern der einzelnen in der Tabelle genannten Reagenzen finden Sie in der Tabelle.
| Statistiken für Abbildung 2B | ||||||||||
| BRAIN (% Zellen) | ||||||||||
| CD45+ | CD45- | |||||||||
| Live | Tot | Live | Tot | |||||||
| Methode | Bedeuten | • SEM | Bedeuten | • SEM | Bedeuten | • SEM | Bedeuten | • SEM | ||
| DH | 15.20 | € 2,32 | 1.90 | € 0,30 | 24.78 | € 4,045 | 51.58 | € 6,033 | ||
| Pd | 15.20 | € 2,65 | 2.33 | € 1,10 | 68.53 | € 3,618 | 13.93 | € 2,180 | ||
| Mann-Whitney | Ns | Ns | *** | ** | ||||||
| p-Wert | 0.9989 | 0.738 | 0.0006 | 0.0015 | ||||||
| SPINAL CORD (% Zellen) | ||||||||||
| CD45+ | CD45- | |||||||||
| Live | Tot | Live | Tot | |||||||
| Methode | Bedeuten | • SEM | Bedeuten | • SEM | Bedeuten | • SEM | Bedeuten | • SEM | ||
| DH | 15.00 | € 8,21 | 1.41 | € 0,11 | 31.64 | € 8,21 | 51.95 | € 16,52 | ||
| Pd | 7.49 | € 4,99 | 1.15 | € 0,68 | 84.27 | € 9,39 | 7.09 | € 3,75 | ||
| Mann-Whitney | Ns | Ns | * | Ns | ||||||
| p-Wert | 0.5548 | 0.7236 | 0.0438 | 0.1144 | ||||||
| Statistiken für Abbildung 2C | |||||||||||||||||
| BRAIN (% Zellen) | |||||||||||||||||
| CD45+ | CD45- | ||||||||||||||||
| CD11b+ | CD11b- | ACSA2 | O4 | Thy1 | CD31 | Andere | Tot | ||||||||||
| Methode | Bedeuten | • SEM | Bedeuten | • SEM | Bedeuten | • SEM | Bedeuten | • SEM | Bedeuten | • SEM | Bedeuten | • SEM | Bedeuten | • SEM | Bedeuten | • SEM | |
| DH | 19.32 | € 3,88 | 1.17 | € 0,27 | 9.52 | € 2,68 | 3.41 | € 1,01 | 1.39 | € 0,77 | 0.48 | € 0,29 | 10.52 | € 4,49 | 53.83 | € 5,79 | |
| Pd | 10.88 | € 2,03 | 1.65 | € 0,48 | 8.17 | € 2,66 | 6.54 | € 0,76 | 6.37 | € 1,76 | 8.27 | €1.25 | 33.28 | € 6,34 | 23.72 | € 5,31 | |
| Mann-Whitney | Ns | Ns | Ns | * | ** | *** | ** | ** | |||||||||
| p-Wert | 0.1206 | 0.4819 | 0.5894 | 0.0264 | 0.0093 | 0.0003 | 0.0084 | 0.0022 | |||||||||
| SPINAL CORD (% Zellen) | |||||||||||||||||
| CD45+ | CD45- | ||||||||||||||||
| CD11b+ | CD11b- | ACSA2 | O4 | Thy1 | CD31 | Andere | Tot | ||||||||||
| Methode | Bedeuten | • SEM | Bedeuten | • SEM | Bedeuten | • SEM | Bedeuten | • SEM | Bedeuten | • SEM | Bedeuten | • SEM | Bedeuten | • SEM | Bedeuten | • SEM | |
| DH | 21.23 | € 6,25 | 2.51 | € 0,57 | 4.26 | € 2,34 | 9.40 | € 1,89 | 2.82 | € 1,51 | 0.97 | € 0,50 | 22.74 | € 9,04 | 35.28 | € 1,89 | |
| Pd | 9.63 | € 1,67 | 2.77 | € 0,48 | 4.23 | € 1,59 | 28.62 | € 3,57 | 1.26 | € 0,49 | 6.94 | € 2,14 | 26.39 | € 8,17 | 19.09 | € 4,76 | |
| Mann-Whitney | Ns | Ns | Ns | * | Ns | * | Ns | Ns | |||||||||
| p-Wert | 0.1905 | >0,9999 | 0.7302 | 0.0159 | 0.7302 | 0.0317 | 0.7302 | 0.1111 | |||||||||
Tabelle 2: Statistische Analyse verschiedener Populationen, die unter Anwendung der DH- oder PD-Methode abgerufen werden. Die Tabelle beschreibt die Statistiken für die in Abbildung 2B und Abbildung 2Cdargestellten Diagramme. Der Durchschnitt und das SEM von mindestens sechs unabhängigen Stichproben sind dargestellt. Der p-Wert und die Angaben zu den statistischen Tests, die für jeden Vergleich angewendet werden, werden ebenfalls gemeldet.
Diskussion
Hierin beschreiben wir ein Protokoll zur Koreinigung und parallelen zytometrischen Analyse von einigen der relevantesten ZNS-Zellen aus Demhirn und Rückenmark. Traditionell wurden histologische Analysen durchgeführt, um die Verteilung von Nanopartikeln oder die Transduktionseffizienz viraler Vektoren im ZNS5,13zu beschreiben oder Um Erkenntnisse über morphologische und molekulare Veränderungen zu geben, die in bestimmten Zelltypen während einer Pathologie oder bei der pharmakologischen Behandlung auftreten14. Die Histologie mangelt jedoch an Prozessivität und erlaubt aufgrund der begrenzten Anzahl von Markern, die gleichzeitig analysiert werden können, keine umfassende Untersuchung mehrerer Merkmale in denselben histologischen Proben. Unser Ansatz kann die traditionellen histologischen Analysen ergänzen und mit mehreren nachgelagerten Anwendungen (Sortier-, Primärkultur-, biochemische oder Next-Generation-Sequenzierungsanalysen) gekoppelt werden, um die Zusammenstellung von Informationen zu erweitern, die aus einzelnen Proben gewonnen werden können. Einige der unten aufgeführten Schlüsselfaktoren müssen jedoch berücksichtigt werden, da sie den Erfolg dieses Ansatzes entscheidend beeinflussen können:
- Menge des Startgewebes. Wir haben die Zelltrennung optimiert, um mit nur einem halben Rückenmark oder einem halben Gehirn zu beginnen. Nach unserer Erfahrung ergibt die Verarbeitung des halben Gehirns oder des halben Rückenmarks von einer erwachsenen 8 Wochen alten Maus mit der PD-Methode 1-6 x 106 lebensfähige Zellen aus dem Gehirn und etwa 0,1 x 0,5 x 106 lebensfähige Zellen aus dem Rückenmark nach dem Dichtegradientenschritt. Wir haben die Zellausbeute nicht gemessen, nachdem wir die PD-Methode auf Gewebe von Neugeborenen oder Mäusen unter 8 Wochen angewendet haben. In unseren Händen ist das Ergebnis jedoch proportional zum Gewicht des Ausgangsgewebes. So sollte bei jüngeren Tieren (z.B. 10 Tage alten Welpen) das gesamte Gehirn oder Rückenmark verarbeitet werden, um eine gute Zellausbeute für zuverlässige nachgelagerte Analysen zu gewährleisten. Bei Bedarf würde das Bündeln von Geweben von mehreren Tieren dazu beitragen, die Zellerträge zu erhöhen. Unserer Erfahrung nach kann dieses Protokoll auch ohne Modifikationen angewendet werden, um Zellen aus dem Gehirn oder Rückenmark von Ratten zu isolieren, soweit der Anteil der reagenzien pro Gewicht des Ausgangsgewebes respektiert wird. Für Gewebe mit mehr als 250 mg Gewicht wird vorgeschlagen, Reagenzien zu skalieren oder das Gewebe in mehrere Proben aufzuteilen (jeweils gewichtung <250 mg).
- Entfernen von Meningen/Restgewebebrocken vor dem Dichtegradienten. Nach unserer Erfahrung ist die hiermit beschriebene PD-Methode nicht in der Lage, Hirnungen oder sehr stark myelinierte Gewebe wie die Nerven und Nervenwurzeln, die aus dem Rückenmark hervorgehen, effizient zu verdauen. Wenn diese Gewebe vorhanden sind, können einige unverdaute klebrige Stücke in der Zellsuspension verbleiben, die nach den enzymatischen Verdauungsschritten vor der Entfernung von Schmutz abgerufen wurde. Das Entfernen dieser Brocken durch Filtern der Lösung durch ein 70-m-Zellsieb (wie in Schritt 5.1 vorgeschlagen) ist entscheidend für eine erfolgreiche Zellvorbereitung. In der Tat, wenn nicht entfernt, Meninges oder Gewebestücke behindern effiziente Dichte Gradienten Trennung, was zu schlechten Zellerträgen.
- Timing, Temperatur und Sterilität. Es ist sehr wichtig, alle Schritte zeitnah mit den richtigen Temperatureinstellungen und Inkubationen durchzuführen, wie vorgeschlagen. Dies ist entscheidend, um eine hohe Zelllebensfähigkeit und Integrität der Probe zu gewährleisten. Je nach nachgeschalteter Anwendung kann es erforderlich sein, alle Schritte unter einer sterilen Haube und mit sterilen Reagenzien durchzuführen (z. B. die Etablierung von Primärzellkulturen). Eine erweiterte Inkubation in der enzymatischen Verdauungslösung über die vorgeschlagene Zeit hinaus (Abschnitt 3) könnte zu einem Rückgang der Zelllebensfähigkeit führen. Die Epitope einiger Oberflächenantigene könnten empfindlich auf Papain reagieren, was zu signalverlust bei der Durchflusszytometrie führt. Für bestimmte Anwendungen, für die andere als die in diesem Artikel beschriebenen Marker erforderlich sind, wird empfohlen, die Leistung verschiedener Antikörperklone zu testen, bevor Sie mit dem Experiment beginnen. Es wurde berichtet, dass das Dichtegradientenmedium einige Spuren von Endotoxinen enthalten könnte, die die Aktivierung von Immunzellen auslösen können (Mikroglia/Makrophagen). Bei jeder Analyse dieser Populationen sollten in den Experimenten immer geeignete interne Kontrollen hinzugefügt werden, um mögliche Auswirkungen, die durch das Verfahren induziert werden, auszuschließen. Das Festhalten an den vorgeschlagenen Temperaturen und dem Waschdichtegradienten mittlere Reste unmittelbar nach dem Abfallentfernungsschritt ist in der Regel ausreichend, um eine aktivierte Aktivierung der Immunzellen zu vermeiden. Falls jedoch die nachgelagerten Anwendungen (z. B. RNAseq oder Funktionsanalysen) von diesem Schritt betroffen sind, sollte der Anwender auf eine mittlere Vorbereitung mit niedriger Endotoxindichte (vorgeschlagen in Tabelle der Materialien)umstellen.
- FACS Antikörper und Maschine. Das hiervorgestellte Flusszytometrie-Färbeprotokoll nutzt Antikörperkonzentrationen und Farbkonjugationen, die am besten mit Zellerträgen aus unserer Laborerfahrung und mit FACS-Maschinen in unserem Institut funktionieren. Der Benutzer sollte die Antikörper in seinen Händen titern, bevor er ein neues Experiment startet, da die Konzentration möglicherweise leicht angepasst werden muss. Außerdem empfehlen wir, in jedem Experiment immer einfarbige Färbekontrollen zu verwenden, um zu überprüfen, ob alle Antikörper und die Kompensationseinrichtung der FACS-Maschine angemessen funktioniert. Es muss beachtet werden, dass das CD90 (Thy) Antigen, das zum Nachweis von Neuronen verwendet wird, in zwei verschiedenen Isotypen existiert, nämlich CD90.2 oder CD90.1, je nach Mausstamm: die am häufigsten verwendeten Mausstämme, wie C57BL6/J Express CD90.2; Mausstämme wie AKR/J, PL und FVB/N Express CD90.1. Daher sollte der Benutzer die Mausdehnung sorgfältig überprüfen und den geeigneten Anti-CD90-Antikörper (wie in Tabelle der Materialienvorgeschlagen) auswählen, bevor er mit den Experimenten beginnt.
Zusammenfassend lässt sich sagen, dass das hier vorgestellte Protokoll eine schonende enzymatische Verdauung nutzt, gefolgt von einer 9-farbenigen Färbung, die eine effiziente simultane zytometrische Auswertung verschiedener Zelltypen aus dem Gehirn und dem Rückenmark ermöglicht. Das Protokoll könnte genutzt werden, um die Effizienz des Zellziels durch Nanopartikel oder virale Vektoren, die im CNS15verabreicht werden, auf schlanke und umfassende Weise zu überwachen. Darüber hinaus könnte das Protokoll leicht für sehr empfindliche nachgelagerte Anwendungen wie Zellsortierung, Ex-vivo-Subkultur, Einzelzell-RNAseq übernommen werden, was nicht nur für die präklinische Bewertung von Zelltargeting durch Therapeutika, sondern auch für die tiefgehende Charakterisierung pathologischer Prozesse bei neurodegenerativen Erkrankungen von größter Bedeutung ist.
Ein Bruchteil der gesamten ZNS-Zellpopulation wird durch dieses Protokoll nicht diskriminiert (siehe "andere" Zelltypen in Abbildung 2); Dies kann durch das Vorhandensein anderer Zellsubtypen erklärt werden, die im ZNS vorhanden sind, aber nicht von den von uns verwendeten Antikörpern erfasst werden. In unseren vorläufigen Analysen sind etwa 14% der "anderen Zellen"-Fraktion positiv für CD73, einen mesenchymalen Zellmarker, der in der Neurovaskulatur angereichert ist und an mehreren neuroinflammatorischen Prozessen beteiligt ist16,17. Darüber hinaus gehen wir davon aus, dass die Fraktion "andere Zellen" auch weniger differenzierte Zellen umfassen könnte, wie Vorläufer in verschiedenen Reifestadien, wie z. B. nestin+ neuronale Stammzellen, nestin+ vimentin+ radiale Gliavorläufer, Doublecortin+ neuronale Vorläufer, NG2+ Oligodendrozyten-Vorläuferzellen, unter anderem. Diese Zelluntertypen könnten leicht durch Anwendung unseres Flow-Zytometrie-Protokolls untersucht werden, da wir eine Konfiguration von Fluoreszenzfarbstoffen gewählt haben, die es ermöglicht, bis zu zwei zusätzliche Zellmarker aufzunehmen, die entweder mit dem Fluoresceinisothiocyanat (FITC) oder Phycoerythrin (PE) Fluorophoren konjugiert sind.
Insgesamt könnte unser Ansatz ein neues Instrument für umfassendere Untersuchungen im Zusammenhang mit dem ZNS (in den Gesundheits- und Krankheitskrankheiten) bieten, das die Vorteile einer gut konsolidierten Technologie nutzt, die sowohl qualitative als auch quantitative Bewertungen mit hohem Durchsatz ermöglicht. wie Z.B. Durchflusszytometrie.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Studie wurde von Denbeinen des Boston Children es Hospital an A.B., ALSA-Stipendium nr. 17-IIP-343 an M.P., und das Büro des Stellvertretenden Verteidigungsministers für Gesundheitsangelegenheiten durch das Amyotrophe Lateral sklerose Forschungsprogramm unter Auszeichnung Nr. W81XWH-17-1-0036 zu M.P. Wir würdigen DFCI Flow Cytometry Core für technischen Support.
Materialien
| Name | Company | Catalog Number | Comments |
| 10X HBSS (Calcium, Magnesium chloride, and Magnesium Sulfate-free) | Gibco | 14185-052 | |
| 70 mm Cell Strainer | Corning | 431751 | |
| ACSA/ACSA2 anti-mouse antibody | Miltenyi Biotec | 130-117-535 | APC conjugated |
| Bovine Serum Albumin | Sigma Aldrich | A9647-1KG | |
| CD11b rat anti-mouse antibody | Invitrogen | 47-0112-82 | APC-eFluor 780 conjugated |
| CD31 rat anti-mouse antibody | BD Bioscience | 562939 | BV421 conjugated |
| CD45 rat anti-mouse antibody | Biolegend | 103138 | Brilliant Violet 510 conjugated |
| CD90.1/Thy1.1 rat anti-mouse antibody | Biolegend | 202518 | PE/Cy7 conjugated |
| CD90.2/Thy1.2 rat anti-mouse antibody | Biolegend | 1005325 | PE/Cy7 conjugated |
| Conical Tubes (15 mL) | CellTreat | 229411 | |
| Conical Tubes (50 mL) | CellTreat | 229422 | |
| Dounce Tissue Grinder set (Includes Mortar as well as Pestles A and B) | Sigma-Aldrich | D9063-1SET | |
| Fc (CD16/CD32) Block rat anti-mouse antibody | BD Pharmingen | 553142 | |
| Fetal Bovine Serum | Benchmark | 100-106 | |
| Neural Tissue Dissociation Kit (P) | Miltenyi Biotec | 130-092-628 | |
| O4 anti mouse/rat/human antibody | Miltenyi Biotec | 130-095-895 | Biotin conjugated |
| Percoll | GE Healthcare | 10266569 | sold as not sterile reagent |
| Percoll | Sigma | 65455529 | sterile reagent (to be used for applications requiring sterility) |
| Percoll PLUS | Sigma | GE17-5445-01 | reagent containing very low traces of endotoxin |
| Streptavidin | Invitrogen | S3258 | Alexa Fluor 680 conjugated |
Referenzen
- Deverman, B. E., Ravina, B. M., Bankiewicz, K. S., Paul, S. M., Sah, D. W. Y. Gene therapy for neurological disorders: progress and prospects. Nature Reviews Drug Discovery. 17 (9), 641-659 (2018).
- Teleanu, D., Negut, I., Grumezescu, V., Grumezescu, A., Teleanu, R. Nanomaterials for Drug Delivery to the Central Nervous System. Nanomaterials. 9 (3), 371(2019).
- Chen, S., et al. Recombinant Viral Vectors as Neuroscience Tools. Current Protocols in Neuroscience. 87 (1), 67(2019).
- Alves, S., et al. Ultramicroscopy as a novel tool to unravel the tropism of AAV gene therapy vectors in the brain. Scientific Reports. 6 (1), 28272(2016).
- Peviani, M., et al. Lentiviral vectors carrying enhancer elements of Hb9 promoter drive selective transgene expression in mouse spinal cord motor neurons. Journal of Neuroscience Methods. 205 (1), 139-147 (2012).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. Journal of Immunological Methods. 243 (1-2), 77-97 (2000).
- Sykora, M. M., Reschke, M. Immunophenotyping of Tissue Samples Using Multicolor Flow Cytometry. Methods in Molecular Biology. 1953, 253-268 (2019).
- Legroux, L., et al. An optimized method to process mouse CNS to simultaneously analyze neural cells and leukocytes by flow cytometry. Journal of Neuroscience Methods. 247, 23-31 (2015).
- Lee, J. K., Tansey, M. G. Microglia Isolation from Adult Mouse Brain. Methods in Molecular Biology. 1041, 17-23 (2013).
- Grabert, K., McColl, B. W. Isolation and Phenotyping of Adult Mouse Microglial Cells. Methods in Molecular Biology. 1784, 77-86 (2018).
- Nikodemova, M., Watters, J. J. Efficient isolation of live microglia with preserved phenotypes from adult mouse brain. Journal of Neuroinflammation. 9 (1), 635(2012).
- Garcia, J. A., Cardona, S. M., Cardona, A. E. Isolation and analysis of mouse microglial cells. Current Protocols in Immunology. 104 (1), 1-15 (2014).
- Papa, S., et al. Selective Nanovector Mediated Treatment of Activated Proinflammatory Microglia/Macrophages in Spinal Cord Injury. ACS Nano. 7 (11), 9881-9895 (2013).
- Peviani, M., et al. Neuroprotective effects of the Sigma-1 receptor (S1R) agonist PRE-084, in a mouse model of motor neuron disease not linked to SOD1 mutation. Neurobiology of Disease. 62, 218-232 (2014).
- Peviani, M., et al. Biodegradable polymeric nanoparticles administered in the cerebrospinal fluid: Brain biodistribution, preferential internalization in microglia and implications for cell-selective drug release. Biomaterials. 209, 25-40 (2019).
- Meng, F., et al. CD73-derived adenosine controls inflammation and neurodegeneration by modulating dopamine signalling. Brain. 142 (3), 700-718 (2019).
- Nedeljkovic, N. Complex regulation of ecto-5'-nucleotidase/CD73 and A2AR-mediated adenosine signaling at neurovascular unit: A link between acute and chronic neuroinflammation. Pharmacological Research. 144, 99-115 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten