Method Article
異なる均質化法を通じてマウス脳/脊髄から取り出された複数の細胞型の同時フロー細胞特性評価
要約
マウスの脳や脊髄から取り出した異なる細胞の種類を同時に同定するためのフローサイトメトリー法を提示する。この方法は、神経変性疾患における純粋な細胞集団を単離または特徴付けたり、ウイルスベクターまたはナノ粒子の生体内投与を標的とする細胞の程度を定量化するために利用され得る。
要約
ウイルスベクターおよびナノマテリアル科学の最近の進歩は、中枢神経系(CNS)を調査または操作するための新しい最先端のアプローチの道を開きました。しかし、これらの技術のさらなる最適化は、体内のウイルスベクターまたはナノ粒子の投与におけるCNSおよび細胞特異的ターゲティングの程度の迅速かつ合理化的な決定を可能にする方法から利益を得るであろう。ここでは、フローサイトメトリーの高スループットと多重化機能を利用して、マウス脳または脊髄から分離された異なる細胞サブタイプ、すなわちミクログリア/マクロファージ、リンパ球、アストロサイト、オリゴデンドロサイト、ニューロンおよび内皮細胞を簡単に定量することを可能にするプロトコルを提示する。このアプローチを適用して、細胞収率、生存率、組成の観点から2つの組織均質化方法間の重要な違いを強調する。これにより、対象のセルの種類と特定のアプリケーションに応じて最適な方法を選択するようにユーザーに指示できます。この方法は、組織が単細胞懸濁液を生成するために均質化されているので、解剖学的分布の分析には適さない。しかし、それは生存可能な細胞と組み合わせることができ、それは、純粋な細胞集団に由来する一次培養の確立から、神経変性疾患の文脈でよく定義された細胞サブタイプに対する遺伝子発現解析や生化学的または機能的アッセイに至るまで、神経科学者の手でツールのレパートリーを拡大することができるいくつかのアプリケーションのための道を開く、細胞ソートと組み合わせることができます。
概要
遺伝子および薬物送達技術(ウイルスベクターやナノ粒子など)は、神経変性疾患で変化した特定の分子経路に関するより良い洞察を得るために、および革新的な治療アプローチの開発のために適用することができる強力なツールとなっています。これらのツールの最適化は、定量化に依存します: (1) 管理の異なる経路上の CNS の浸透の程度と (2) 特定の細胞集団のターゲティング.組織学的解析は、通常、異なるCNS領域および異なる細胞型にわたって蛍光レポーター遺伝子または蛍光タグ付きナノ粒子を可視化するために適用され、特定の細胞マーカー4、5に対する免疫染色によって同定される。このアプローチは、投与された遺伝子または薬物送達ツールの生体分布に関する貴重な情報を提供しますが、(1)組織固定、凍結保存またはパラフィン埋め込みおよびスライスが必要なため、この技術は時間がかかり、手間がかかがあります。(2)特定の細胞マーカーの染色は、時には抗原検索を必要とする;(3)蛍光顕微鏡による取得は、通常、同じ実験内の限られた数の異なるマーカーの分析を可能にする。(4)画像処理により、目的の信号を適切に定量化できるようにする。
フローサイトメトリーは、非常に特異的な蛍光マーカーを利用して、表面または細胞内抗原の発現に基づいて細胞懸濁液中の異なる細胞表現型の迅速な定量的評価を可能にするだけでなく、機能的測定(例えば、アポトーシスの速度、増殖、細胞周期分析など)を可能にする広く使用されている技術となっています。蛍光活性化細胞選別による細胞の物理的分離も可能であり、さらなる下流用途(例えば、細胞培養、RNAseq、生化学的分析など)6、7、8。
組織均質化は、信頼性が高く再現性のある下流フローサイトメトリック評価を可能にするために、単一細胞懸濁液を得るために必要な重要なステップです。成人脳組織均質化には、主にミクログリア細胞9、10、11を単離することを目的として、異なる方法が記載されている。それらは、(1)ダウンスホモジナイザー(DH)を介して粉砕またはせん断力を使用してニッチから細胞を分離し、比較的均質化された単一細胞懸濁液を形成する機械的解離の2つの主要なカテゴリーに分類することができ、 (2)酵素消化は、トリプシンまたはパパインなどのタンパク質分解酵素の存在下で37°Cでのミンチ組織塊のインキュベーションに依存し、細胞外マトリックスの分解を支持し、かなり均質化された細胞懸濁液12を作成する。
どの方法が利用されているかに関係なく、組織均質化後に精製工程を行い、密度勾配の遠心分離を通してミエリンを除去するか、磁気選択9、12を経下流アプリケーションに移すことをお勧めします。
ここでは、パパイン消化(PD)に基づく組織処理方法を説明し、続いて密度勾配を精製し、マウス脳または脊髄から生存可能な異種細胞懸濁液を時間感受性の方法で得るように最適化し、フローサイトメトリーに適した。さらに、9色のフローサイトメトリーパネルと、我々は、異なるCNS集団、生死細胞または緑色蛍光タンパク質やロダミン色素などの蛍光レポーターのための陽性の同時判別を可能にするために実験室で採用したゲーティング戦略を説明します。このフローサイトメトリック分析を適用することにより、異なる細胞の生存率および異なる細胞タイプの収率の保存の観点から、組織処理の異なる方法、すなわちPD対DHを比較することができる。
本明細書で提供される詳細は、目的の特定の細胞タイプと下流分析(例えば、温度感受性)に基づいて、フローサイトメトリーパネルで使用する均質化プロトコルと抗体の組み合わせに関する決定を指示することができますアプリケーション、特定の蛍光マーカーの追跡、インビトロ培養、機能分析)。
プロトコル
ここで説明するすべての方法は、ダナ・ファーバー癌研究所(プロトコル番号16-024)の制度動物ケアと使用委員会(IACUC)によって承認されています。
1. 実験に必要なソリューションの準備
- 10x HBSSを滅菌水で希釈して、1xハンクのバランスのとれた塩溶液(HBSS)を調製します。氷の上で溶液を事前に冷やします。各サンプルには少なくとも25mLの溶液が必要です。
- 10x滅菌HBSS 1:10と密度勾配培地(すなわち、Percoll)を混合して等張性パーコール溶液(IPS)を調製します。氷の上で冷やす前に。
注:IPSは4 °Cで最大30日間保存することができます。 - フローサイトメトリー(FACS)ブロッキング(BL)溶液(1%ウシ血清アルブミン[BSA]、リン酸緩衝生理食塩水[PBS]中の5%ウシウシ血清[FBS])を調製する。氷の上で冷やす前に。
2. 心内灌流と組織解剖による動物安楽死
注:8週齢のC57BL/6Jマウスは、どちらかの性別で、実験に用いた。PBS溶液による灌流は、組織消化を進める前に、臓器からの血液汚染を排除するために行われる。
- ケタミン/キシラジン(90−200 mg/kgケタミン、10 mg/kgキシラジン)の混合物を使用してマウスを麻酔する。マウスを背面に置き、各四肢をサポートまでテープで留める。離脱反射を確認して、麻酔の十分な深さを確認します。
- 胸骨を露出させるために胸部入口のレベルで中線の皮膚切開を行う。鉗子を使用して胸骨の先端をつかみ、リブケージの両側に1cmの切開を行います。最後に横隔膜を切り取り、胸骨を広く開いて心臓を可視化します。
- 鉗子を使用して心臓を右心室で穏やかにつかみ、中線まで持ち上げて胸から少し出す。
- 左心室の先端、大直田に向かって23Gの蝶の針を挿入し、しっかりと保持します。
- 1x PBS で灌流を開始します。はさみを使用して右のオーリクルを貫通し、排煙が循環を終了できるようにします。PBS の流量を 3 mL/min に設定し、1x PBS の少なくとも 15 mL でパーフューズを設定して、組織が明確であることを確認します。
注:肝臓と腸間膜血管のブランチングは良好な灌流の兆候です。必要に応じて、心臓から出る体液が血液を取り除くまで、予備の体積を増やすことができ、その時点でフラッシュラインを停止できる。 - 灌流後、脊髄から脳を切り離し、はさみと鉗子で頭蓋骨から脳を取り除く。解剖中の可視性と制御を高め、毛髪汚染物質を持ち越さないようにするために毛皮を取り外します。PBSで満たされた3 mLシリンジを使用して、脊髄をカラムから洗い流します。
- 氷冷1x HBSSの2 mLをプレフィルした6ウェルマルチウェルプレートの井戸に各組織を移し、消化するまで氷の上に保ちます。
- 脳と脊髄を縦線に沿って2つの半分に分けます。
注:各組織の半分が均質化され(以下のセクションを参照)、フローサイトメトリック解析が可能です。残りの半分は、代替分析のための異なる処理に割り当てることができます(例えば、組織学のためのパラホルムアルデヒド固定溶液に浸漬)。
3. 脳と脊髄の酵素消化
注:このセクションで説明するボリュームは、半分の脳または脊髄の消化のために十分です。
- はさみを使用して、組織を1-2mmの厚さにミンチします。
- 1000°Lピペットの先端をはさみで切り、組織片の回収を可能にするのに十分な大きさにします。ピペットチップを1x HBSSで事前にすすします。次に、ピペットを使用して、15 mL円錐状チューブに細分化された組織を含むHBSS溶液の2 mLを移します。
メモ:ピペット先端の事前すすりは、先端の内側のティッシュピースの粘着性を防ぐために重要です。 - 氷冷1x HBSSの追加の2 mLで井戸を洗浄し、組織片を含む対応する15 mL円錐形チューブに溶液を移します。
- 各サンプルを4°Cで250 x gで5分間遠心分離します。
- 神経組織解離キットの酵素ミックス1を調製する(NTDK;材料表)酵素Pの50μLをサンプルあたり1900μLの緩衝液Xと混合することにより。温かい酵素は、水浴中の37°で1を混合する。酵素の完全な活性化を可能にするために、使用前に少なくとも10分間37°Cで酵素ミックス1をインキュベートする。
- 15mL円錐管から上清を吸引し、各サンプルに1.95mLの酵素ミックス1を加える。穏やかに渦をしてペレットが再懸濁していることを確認します。
- 37°Cで15分間、ホイールまたはシェーカーのサンプルをインキュベートします。
- 一方、10μLの酵素Aとサンプル当たり20μLの緩衝液Yを混合することにより、NTDKの酵素ミックス2を調製する。水浴中の37°Cで溶液を事前に温めます。
- 酵素ミックス1によるインキュベーションの終了時に、各試料に30μLの酵素ミックス2を加える。
- 1x HBSSでプリリンスされた1000 μLピペットチップで上下にピペットを取り込んでサンプルを軽く混ぜます。
- 37°Cで15分間、ホイールまたはシェーカーにサンプルをインキュベートします。
- インキュベーション後、各チューブに10mLの氷冷1x HBSSを加えて、酵素ミックス1と酵素ミックス2を不活性化します。
- 各サンプルを4°Cで320 x gで10分間遠心分離します。
- 上清を捨てる。氷冷1x HBSSを各チューブに7mLの最終容積まで加え、ボルテックスによってペレットを穏やかに再懸濁します。
- 破片の取り外しについては、セクション 5 に進みます。
4. 脳と脊髄の機械的均質化
注:このセクションで説明するボリュームは、半分の脳または脊髄の均質化に十分です。このセクションで説明するプロトコルは、以下で説明するユーザーのニーズに応じて、セクション 3 で説明する方法の代替方法として使用できます。
- 氷の上にセットされたDounceティッシュグラインダー(材料のテーブル)のガラスモルタルを事前に冷やします。
- モルタルに3mLの予冷済み1x HBSSを加えます。
- 6ウェルプレートのウェルからガラスモルタルに組織(脳または脊髄)を移し、1x HBSSに浸漬し、モルタルの底部に座っていることを確認します。
- 10ストロークの害虫Aで組織を穏やかに粉砕し、続いて10ストロークの害虫B.均質化ミックスを新しい15 mL円錐チューブに移します。
- 予め冷めた1x HBSSを使用してチューブを10mLの最終容積に充填し、4°Cで320 x gで10分間遠心分離機を使用します。
- 上清を吸引し、7 mLの最終容積まで各チューブに氷冷1x HBSSを加え、ボルテックスによってペレットを穏やかに再懸濁します。
- 破片の取り外しについては、セクション 5 に進みます。
5. デブリ除去
注:未消化組織とミエリン鞘を主成分とする破片の除去は、その後のフローサイトメトリック分析のために組織ホモジネートの効率的な染色を可能にする重要なステップです。
- 70μmの細胞ストレーナーを通して各サンプルを濾過し、未消化組織チャンクを除去します。これらのサンプルは、その後のステップに影響を与える可能性のある未消化神経断片または髄質を含む可能性が高いので、脊髄組織を扱う場合、このステップは特に重要です。
- 各サンプルチューブの最終体積が7mLであることを確認します。そうでない場合は、7 mLまでの氷冷1x HBSSで満たします。
- 各サンプルに3mLのプレチルドIPSを加え、最終濃度30%の密度勾配培地を含む溶液の最終体積を10mLにします。サンプルを穏やかに渦巻き、それらが均一に混合されていることを確認します。
- 18°Cで700 x gで15分間の遠心分離サンプルを行い、遠心分離機の加速度を7、ブレーキを0に設定します。
注:遠心分離には約30分かかります。 - 遠心分離機からサンプルを繊細に取り除く。
メモ:破片とミエリンで構成された白っぽいディスクは、溶液の表面に浮かんで見える必要があります。ペレット(目的の細胞を含む)は、チューブの下部に表示する必要があります。 - 慎重に破片のすべての白っぽいディスクを吸引し、その後、上清の残りの部分は、ペレットを外さないようにしてください。誤って解き放つリスクを避けるために、約100μLの溶液を細胞ペレットの上に置きます。
- FACS BLを1mL加え、1000 μLピペットチップで上下にピペットを取り替えてペレットを再サスペンドし、サンプルを1.5 mLチューブに移します。
- 室温(RT)で450 x gで5分間遠心分離機。
- 上清を穏やかに吸引し、下流解析と互換性のある適切なバッファーでペレットを再サスペンドします(複数の細胞タイプのフローサイトメトリック評価に使用されるプロトコルについてはセクション6を参照)。
6. 複数の細胞型のフローサイトメトリック評価のための染色
- FACS BLの350°Lでステップ5.9で得られたペレットを再サスペンドし、最終濃度5μg/mLで各サンプルにFcブロックを追加します。
注:サンプルの少なくとも100°Lは、信頼性の高い分析を可能にするために十分な細胞を処理するために、1つの染色に使用する必要があります。 - 染色を進める前に、4°Cで10分間サンプルをインキュベートします。
- 表1に記載の抗体ミックスを調製する。
- 各チューブに抗体ミックスを加え、5°の渦を加え、暗闇の中で4°Cで15分間サンプルをインキュベートします。
- 各チューブ、渦、遠心分離機に1mLのPBSを加え、RTで450 x gで5分間追加します。
- 一方、表1に従ってストレプトアビジンミックスを調製する。
- 上清を廃棄し、ステップ6.6で調製したストレプトアビジンミックスでペレットを再サスペンドする。各サンプルについて、ステップ6.4の染色に使用したものと同じボリュームを使用します。
- 5s用渦と暗闇の中で4°Cで10分間サンプルをインキュベートする。
- 各チューブ、渦、遠心分離機に1mLのPBSを加え、RTで450 x gで5分間追加します。
- 上清を廃棄し、FACS BLでペレットを再サスペンドします。
- 各サンプルに7-アミノ-アクチノマイシンD(7-AAD)溶液を加えます。ステップ6.10で調製したサンプルの300μLごとに、7-AADの5μLを使用します。
- 細胞フルオリメトリック分析まで、サンプルを暗闇の中で4°Cで保存します。サンプル調製から16時間以内に分析を行い、細胞生存率を60%保証します。
結果
マウスの脳と脊髄に適用される2つの異なる均質化方法(DH対PD)を比較し、下流のアプリケーションに適した異なる生存細胞タイプを取得する際の効率をテストしました。そのために、ミクログリア、リンパ球、ニューロン、アストロサイト、オリゴデンドロサイト、内皮を含む異なるCNS細胞型を特徴付けるように設計された9色フローサイトメトリーパネルを利用しました。
脳および脊髄組織を異なるマウスから取り出し(n≥6)、縦方向に2つの半分に分割し、Dounceホモジナイザー(DH法)を用いて機械的破壊を適用するか、またはパパイン(PD法)に基づく市販のNTDKを用いて穏やかにミンチおよび消化した酵素を用いて並行して処理した(図1A)。破片除去後、脳または脊髄からの細胞をそれぞれ1/10または1/2−1/5に希釈し、トリパンブルーでノイバウアーチャンバーで細胞収率および生存率を決定した(図1B,C)。DH法は、全体的に脳と脊髄の両方からより高い細胞収率を生成しました.しかし、取り出した細胞の大部分は死んでいたが、脳内の生細胞の13.8%±3.3%、脊髄の10.5%±1.5%しか生まれなかった(図1B)。死んだ細胞の多くは凝集体を形成した(図1C);。この現象は、DHに適用されるせん断力によって分解できなかった、高度に相互接続された細胞ネットワーク(CNS血管を覆う内皮およびグリア細胞など)の存在が原因である可能性があります。死細胞のこれらの凝集体は、密度勾配によって除去されなかった可能性が高く、細胞フルオリメトリック分析に使用される最終的な細胞ペレットに終わった。逆に、PD法は、細胞生存率の全体的な改善力を決定した(脳では90.6%±0.6%、脊髄では85.2%±2.8%)。パパインは細胞外マトリックスと細胞間接合を効率的に消化することができ、より均一な単一細胞懸濁液を導く。ミンチプロセス中に死ぬ細胞のいくつかは、密度勾配を介してより効率的に分離された細胞破片の形成につながるパパインによってさらに消化され得る。全体的に、これは、DH法と比較してわずかに低い細胞収率にもかかわらず、PD法による細胞生存率のより良い保存性を決定する可能性が高い。
脳および脊髄細胞懸濁液から100μLのアリコートを抗体ミックス(表1)で染色し、9色パネルでフローサイトメトリーにより分析した。図2Aは、脳および脊髄細胞懸濁液から異なる細胞型を同定するために使用されるゲーティング戦略を示す。簡単に言うと、最初のゲートは、小さな細胞の破片を除く前方散乱(FSC)と側散乱(SSC)に従って一般集団を識別します。次いで、生きた(7-AAD-)細胞が同定される。全生細胞集団内では、CD45+およびCD45-細胞が強調表示される。CD45+ゲート内では、CD45+CD11b+ミクログリア/マクロファージおよびCD45+CD11b-リンパ球が同定される。CD45-ゲート内では、細胞はACSA2(アストロサイト)またはO4(オリゴデンドロサイト)の陽性度に従って判別される。CD45-ACS2-O4-細胞は、Thy1(ニューロン)またはCD31(内皮)の陽性度に応じてさらに細分化される。残りのThy1-CD31-細胞は「他の細胞型」に分類され、抗体ミックスでは説明されない。
図2Bに示すように、脳から取り出した生存細胞の約38%、脊髄から取り出した生存細胞の約32%が造血起源(CD45+)であった。一方、PD法は、非造血CD45-細胞(脳では約82%、脊髄では92%)で表される非常に大きな画分で、両組織において生存細胞の有意に高い収率を取り出すことを可能にした。驚くべきことに、CD45+CD11b+ミクログリア/マクロファージは、DH法で最も豊富な生存細胞分率を表した(図2C)。しかし、PD法は、ACSA+アストロサイト、O4+オリゴデンドロサイト、CD31+内皮細胞およびThy1+ニューロンを含む細胞型のより異種表現を産生した(図2C)。興味深いことに、生存可能なニューロンおよび内皮細胞は、DH法ではほとんど検出できなかった。
DH法は、Dounceホモジナイザーのガラス害虫とモルタルとの間の組織の機械的粉砕に依存して、組織均質化を得る。これは、損傷を与える可能性があり、神経血管系のニューロンや細胞などの大きいまたは非常に敏感な細胞の生存率に影響を与える可能性のあるいくつかのせん断ストレスを引き起こす可能性があります。抗体パネルを介して同定された各細胞部分集団内の細胞生存率(7-AAD-細胞のパーセンテージ)を評価した(図3)。血球性細胞(CD45+)は、ミクログリア/マクロファージ(CD45+CD11b+)および他の非骨髄細胞(CD45+Cd11b-)を含む脳および脊髄から単離され、使用した均質化法とは独立して非常に高い生存率を示す(図3A)。逆に、DH法はCD45-集団(図3B)の生存率の有意な低下を決定したのに対し、PD法は異なるCNS細胞型の広範な保存を決定した。詳細には、ニューロンおよび内皮細胞は、DHによって最も有意に影響を受けた亜集団であり、PD法によって保存された。
適切なサンプル調製と効率的なデブリ除去に必要な重要なステップの概略図を図4にまとめます。
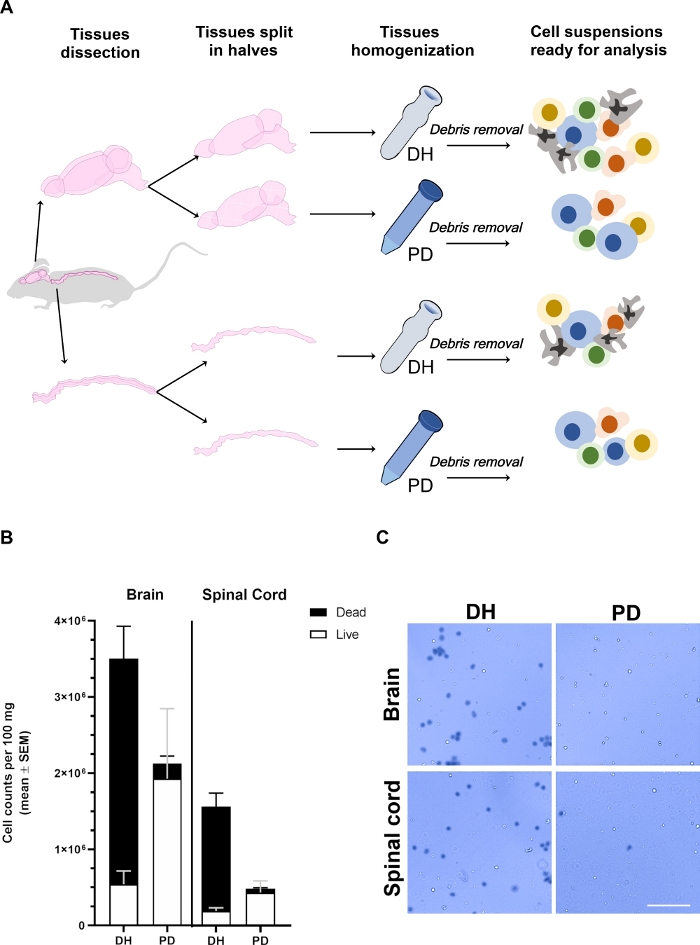
図1:脳および脊髄から取り出された細胞の収率は、均質化法の影響を受ける。
(A) 実験概要マウスを麻酔し、PBSで心内浸透させ、血管内循環血液細胞を除去した。脳と脊髄は慎重に解剖され、縦方向に2つの半分に分割された。組織は、本文に詳述されているように、Dounceホモジナイザー(DH)またはパパイン消化(PD)のいずれかを用いて均質化した。その後、ミエリンおよび組織残骸を30%密度勾配培地溶液中の遠心分離によって除去し、フローサイトメトリーによって分析できる異種細胞型を含む異種細胞懸濁液を生じた。(B)DHまたはPD法による組織均質化時に脳または脊髄から取り出された細胞の収率を示すヒストグラム。条件当たり少なくとも6匹の動物の平均±SEMが表される。(C)2つの方法により脳または脊髄から取り出したトリパンブルー陽性(デッド)およびネガティブ(ライブ)細胞の代表的な明視野顕微鏡顕微鏡写真。スケール バー = 100 μm.ここをクリックすると、この図の大きなバージョンが表示されます。

図2:CNSから取得された異なる細胞型の相対的な割合は、組織均質化法の影響を受ける。
(A)代表的なフローサイトメトリープロットは、脳または脊髄から得られた細胞製剤内の異なる細胞サブ集団を同定するためのゲーティング戦略を示す:細胞集団はFSCおよびSSC物理パラメータにゲートされ、続いて7-AAD-生細胞の選択;その後、細胞はCD45マーカーの陽性に従って判別される。ミクログリア/マクロファージはCD45+画分内のCD11b+細胞として同定され、リンパ球はCD11b-である。アストロサイト、オリゴデンドロサイト、内皮および神経細胞は、それぞれCD45-内のACSA2+、O4+、CD31+またはThy1+細胞として同定される。(B)DHまたはPD法による均質化時の脳または脊髄における総生細胞または死細胞集団内のCD45+およびCD45-細胞の割合を示すヒストグラム。グラフに示す結果の統計分析を表2に報告する。(C)DHまたはPD法による均質化時の脳または脊髄における全細胞集団内の異なる生存細胞サブタイプの割合を示す円グラフ。全死細胞の割合も報告されます。N ≥ 6.CD45+CD11b+ = ミクログリア/マクロファージ;CD45+CD11b- = リンパ球/非骨髄細胞;CD45-ACSA2+ = アストロサイト;CD45-O4+ = オリゴデンドロサイト;CD45-Thy1+ = ニューロン;CD45-CD31+ = 内皮細胞;その他 = 上記のすべてのマーカーに対して負のセル。グラフに示す結果の統計分析を表2に報告する。この図の大きなバージョンを表示するには、ここをクリックしてください。
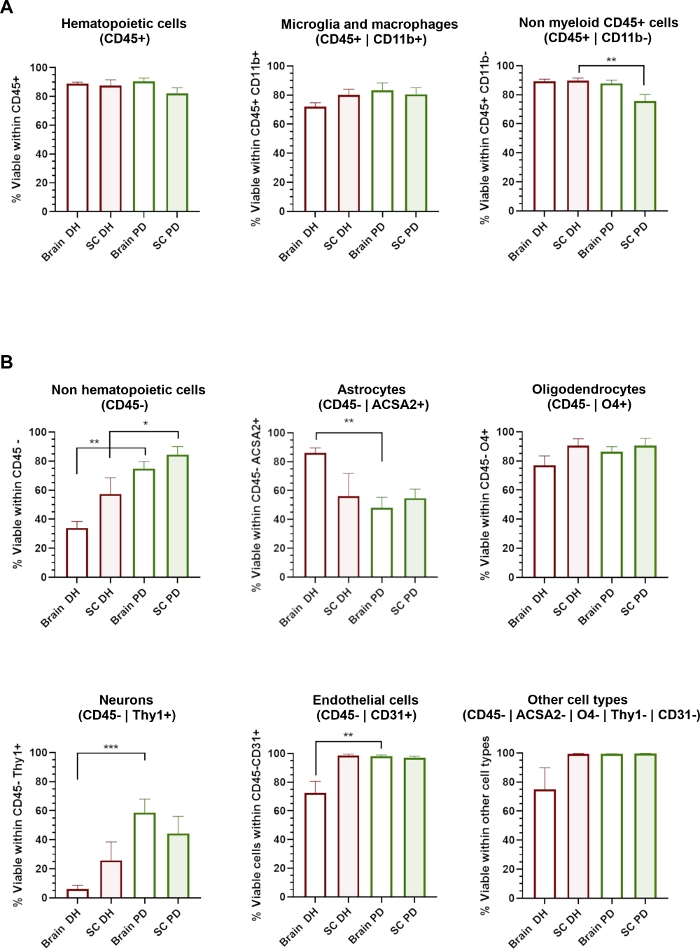
図3:異なるCNS細胞型の細胞生存率は、適用される均質化法の影響を受ける。
(A) CD11b+ミクログリア/マクロファージおよびCD11b-非骨髄ロイド細胞を含むCD45+造血集団内の7-AAD-生細胞の割合を示すヒストグラム。(B)アストロサイト、オリゴデンドロサイト、ニューロン、内皮および他の細胞型を含むCD45-非造血集団内の7-AAD-生細胞の割合を示すヒストグラム。* = p < 0.05, ** = p < 0.01, DH と PD の間のマン・ホイットニー.この図の大きなバージョンを表示するには、ここをクリックしてください。

図4:適切な組織処理に必要な重要なステップの概略表現
適切な組織処理と破片の効率的な除去に必要な最も重要なステップのリストを示します。30%密度勾配のサンプルの遠心分離後に形成される破片ディスク(黒い矢印)とセルペレット(青い矢印)を適切に識別することが重要です。破片ディスクは、上清の残りの部分と一緒に、サンプル損失を避けるために細胞ペレットを外れることなく吸引によって慎重に除去されなければならない。この図の大きなバージョンを表示するには、ここをクリックしてください。
| 抗体ミックス | 初期濃度(φグラム/mL) | 最終濃度(φグラム/mL) | 希釈係数 |
| アンチCD45 /BV510 | 200 | 2 | 100 |
| 抗CD11b/APC.780 | 200 | 2 | 100 |
| アンチCD31/BV421 | 200 | 2 | 100 |
| 抗 ACSA2/APC | 150 | 0.75 | 200 |
| 抗O4/ビオチン | Na | Na | 40 |
| アンチCD90.2 /PE.Cy7 | 200 | 2 | 100 |
| ストレプトアビジンミックス | 初期濃度(φグラム/mL) | 最終濃度(φグラム/mL) | 希釈係数 |
| ストレプトアビジン/アレクサ680 | 1000 | 1 | 1000 |
表1:フローサイトメトリー染色のためのミックスの調製のためのレシピ。この表は、複数の細胞型のフローサイトメトリック分析を可能にするために使用される抗体およびストレプトアビジンの最適濃度を示す。表に記載されている各試薬のカタログ番号については、材料表を参照してください。
| 図 2B の統計情報 | ||||||||||
| 脳 (% 細胞) | ||||||||||
| CD45+ | CD45- | |||||||||
| ライブ | 死んで | ライブ | 死んで | |||||||
| メソッド | 意味 | ± SEM | 意味 | ± SEM | 意味 | ± SEM | 意味 | ± SEM | ||
| Dh | 15.20 | ± 2.32 | 1.90 | ± 0.30 | 24.78 | ± 4.045 | 51.58 | ± 6.033 | ||
| Pd | 15.20 | ± 2.65 | 2.33 | ± 1.10 | 68.53 | ± 3.618 | 13.93 | ± 2.180 | ||
| マン・ホイットニー | Ns | Ns | *** | ** | ||||||
| p値 | 0.9989 | 0.738 | 0.0006 | 0.0015 | ||||||
| 脊髄(%細胞) | ||||||||||
| CD45+ | CD45- | |||||||||
| ライブ | 死んで | ライブ | 死んで | |||||||
| メソッド | 意味 | ± SEM | 意味 | ± SEM | 意味 | ± SEM | 意味 | ± SEM | ||
| Dh | 15.00 | ± 8.21 | 1.41 | ± 0.11 | 31.64 | ± 8.21 | 51.95 | ± 16.52 | ||
| Pd | 7.49 | ± 4.99 | 1.15 | ± 0.68 | 84.27 | ± 9.39 | 7.09 | ± 3.75 | ||
| マン・ホイットニー | Ns | Ns | * | Ns | ||||||
| p値 | 0.5548 | 0.7236 | 0.0438 | 0.1144 | ||||||
| 図 2C の統計情報 | |||||||||||||||||
| 脳 (% 細胞) | |||||||||||||||||
| CD45+ | CD45- | ||||||||||||||||
| CD11b+ | CD11b- | ACSA2 | O4 | Thy1 | CD31 | 他 | 死んで | ||||||||||
| メソッド | 意味 | ± SEM | 意味 | ± SEM | 意味 | ± SEM | 意味 | ± SEM | 意味 | ± SEM | 意味 | ± SEM | 意味 | ± SEM | 意味 | ± SEM | |
| Dh | 19.32 | ± 3.88 | 1.17 | ± 0.27 | 9.52 | ± 2.68 | 3.41 | ± 1.01 | 1.39 | ± 0.77 | 0.48 | ± 0.29 | 10.52 | ± 4.49 | 53.83 | ± 5.79 | |
| Pd | 10.88 | ± 2.03 | 1.65 | ± 0.48 | 8.17 | ± 2.66 | 6.54 | ± 0.76 | 6.37 | ± 1.76 | 8.27 | ± 1.25 | 33.28 | ± 6.34 | 23.72 | ± 5.31 | |
| マン・ホイットニー | Ns | Ns | Ns | * | ** | *** | ** | ** | |||||||||
| p値 | 0.1206 | 0.4819 | 0.5894 | 0.0264 | 0.0093 | 0.0003 | 0.0084 | 0.0022 | |||||||||
| 脊髄(%細胞) | |||||||||||||||||
| CD45+ | CD45- | ||||||||||||||||
| CD11b+ | CD11b- | ACSA2 | O4 | Thy1 | CD31 | 他 | 死んで | ||||||||||
| メソッド | 意味 | ± SEM | 意味 | ± SEM | 意味 | ± SEM | 意味 | ± SEM | 意味 | ± SEM | 意味 | ± SEM | 意味 | ± SEM | 意味 | ± SEM | |
| Dh | 21.23 | ± 6.25 | 2.51 | ± 0.57 | 4.26 | ± 2.34 | 9.40 | ± 1.89 | 2.82 | ± 1.51 | 0.97 | ± 0.50 | 22.74 | ± 9.04 | 35.28 | ± 1.89 | |
| Pd | 9.63 | ± 1.67 | 2.77 | ± 0.48 | 4.23 | ± 1.59 | 28.62 | ± 3.57 | 1.26 | ± 0.49 | 6.94 | ± 2.14 | 26.39 | ± 8.17 | 19.09 | ± 4.76 | |
| マン・ホイットニー | Ns | Ns | Ns | * | Ns | * | Ns | Ns | |||||||||
| p値 | 0.1905 | >0.9999 | 0.7302 | 0.0159 | 0.7302 | 0.0317 | 0.7302 | 0.1111 | |||||||||
表2:DHまたはPD法を適用して取得した異なる集団の統計分析。次の表に、図 2Bおよび図 2Cに示すグラフの統計情報を示します。少なくとも6つの独立したサンプルの平均およびSEMが表される。各比較に適用される統計検定のp値と詳細も報告されます。
ディスカッション
ここでは、マウス脳および脊髄からの最も関連性の高いCNS細胞の共精製および同時フローサイトメトリック分析のためのプロトコルについて説明する。従来、組織学的解析は、CNS5、13におけるナノ粒子の分布またはウイルスベクターの伝達効率を記述するために適用されてきたが、病理学または薬理学的治療14の間に特定の細胞型で起こる形態学的および分子変化に関する洞察を提供する。しかし、組織学はプロセス性に欠けており、同時に分析できるマーカーの数が限られているため、同じ組織学的サンプル内の複数の特徴を包括的に検査することはできません。当社のアプローチは、従来の組織学的分析を補完するものであり、複数の下流アプリケーション(ソート、一次培養、生化学的または次世代シーケンシング分析)と組み合わせることで、個々のサンプルから得られる情報のコンパイルを拡大することができます。ただし、このアプローチの成功に重大な影響を与える可能性があるため、以下に示す主な要因を考慮する必要があります。
- 開始組織の量。私たちは、半分の脊髄または半分の脳から始まるように細胞分離を最適化しました。私たちの経験では、PD法で成人8週齢マウスから半脳または半脊髄を処理すると、脳から1−6 x 106生存細胞が生まれ、密度勾配ステップ後の脊髄から約0.1−0.5 x 106生存細胞が生じる。8週未満の新生児またはマウスの組織にPD法を適用した後の細胞収率は測定していない。しかし、私たちの手では、結果は開始組織の重量に比例します。したがって、若い動物(例えば、10日齢の子犬)の場合、脳または脊髄全体を処理して、信頼性の高い下流分析のための良好な細胞収率を保証する必要があります。必要に応じて、複数の動物から組織をプールすることは、細胞収量を増加するのに役立ちます。我々の経験では、このプロトコルはまた、開始組織の重量当たりに使用される試薬の割合が尊重される限り、ラットの脳または脊髄から細胞を分離するために修飾することなく適用することができる。250mg以上の体重の組織の場合、試薬をスケールアップするか、複数のサンプル(各重み<250 mg)で組織を分割することをお考えです。
- 密度勾配の前に髄腔/残留組織チャンクを除去する。我々の経験では、ここで説明するPD法は、脊髄から出現する神経や神経根などの髄痛や非常に高度に髄細分組織を効率的に消化することができない。これらの組織が存在する場合、いくつかの未消化粘着性の部分は、破片除去の前に、酵素消化ステップの後に取り出された細胞懸濁液に残る可能性があります。70 μm のセル ストレーナー (手順 5.1 で示したように) を使用して溶液をフィルタリングしてこれらのチャンクを取り除くことは、細胞調製を成功させるために重要です。実際には、除去されない場合、髄質または組織片は、細胞収率が悪くなる効率的な密度勾配分離を妨げるであろう。
- タイミング、温度、無菌。提案された適切な温度設定とインキュベーションを使用して、すべてのステップをタイムリーに実行することが非常に重要です。これは、サンプルの高い細胞生存率と完全性を確保するために重要です。下流のアプリケーションに応じて、滅菌フードおよび滅菌試薬ですべてのステップを実行する必要があるかもしれません(例えば、一次細胞培養を確立する)。酵素消化液の拡張インキュベーションは、推奨時間(セクション3)を超えると、細胞生存率の低下をもたらす可能性があります。いくつかの表面抗原のエピトープは、流れサイトメトリーで信号の損失をもたらすパパインに敏感である可能性があります。この記事で説明する以外の追加マーカーを必要とする特定のアプリケーションでは、実験を開始する前に異なる抗体クローンのパフォーマンスをテストすることをお勧めします。密度勾配培地は、免疫細胞(ミクログリア/マクロファージ)の活性化を引き起こす可能性のある子宮内毒素のいくつかの痕跡を含むことができることが報告されています。これらの集団が分析されるたびに、適切な内部統制を常に実験に追加し、手順によって誘発される可能性のある影響を除外する必要があります。残骸除去工程の直後に推奨される温度と洗浄密度勾配培地の残り物に固執することは、通常、過度の免疫細胞活性化を避けるために十分である。しかし、下流のアプリケーション(例えば、RNAseqまたは機能解析)がこのステップの影響を受ける場合、ユーザは低エンドトキシン密度勾配培地調製物に切り替える必要があります(材料の表に示唆されています)。
- FACS抗体および機械。ここで提示されたフローサイトメトリー染色プロトコルは、当社の研究室の経験で取得された細胞収率と当社の研究所で利用可能なFACSマシンで最もよく働いた抗体濃度とカラーコンジュゲーションを利用しています。濃度をわずかに調整する必要があるため、新しい実験を開始する前に、ユーザーは自分の手で抗体をチタインする必要があります。また、各実験では常に単色染色制御を使用して、すべての抗体とFACSマシンの補償設定が適切に機能していることを確認することをお勧めします。ニューロンの検出に使用されるCD90(Thy)抗原は、マウス株に応じてCD90.2またはCD90.1の2つの異なるアイソタイプに存在することに注意する必要があります: C57BL6/J発現CD90.2などの最も一般的に使用されるマウス株;AKR/J、PL、FVB/N エクスプレス CD90.1 などのマウス株。したがって、ユーザーは慎重にマウス株を検証し、実験を開始する前に適切な抗CD90抗体(材料表に示されている)を選択する必要があります。
要約すると、ここで提示されたプロトコルは、穏やかな酵素消化を利用し、続いて9色染色を行い、マウスの脳および脊髄から異なる細胞型の効率的な同時フローサイトメトリック評価を可能にする。このプロトコルは、CNS15に投与されたナノ粒子またはウイルスベクターによる細胞ターゲティングの効率を合理化かつ包括的に監視するために利用される可能性がある。さらに、このプロトコルは、細胞選別、ex vivoサブカルチャー、単一細胞RNAseqなどの非常に繊細な下流アプリケーションに容易に採用することができ、治療薬による細胞標的化の前臨床評価だけでなく、神経変性疾患における病理学的プロセスの詳細な特性評価にも最も重要な結果となる。
CNS細胞集団全体の一部は、このプロトコルによって判別されません(図2の「その他」の細胞タイプを参照)。これは、CNSに存在するが、我々が使用した抗体によって捕捉されていない他の細胞サブタイプの存在によって説明することができる。我々の予備分析では、「他の細胞」画分の約14%がCD73に対して陽性であり、神経血管系に富み、いくつかの神経炎症過程16、17に関与する間葉細胞マーカーである。さらに、「他の細胞」画分は、ネスチン+神経幹細胞、ネスチン+ビメンチン+ラジアルグリア前駆体、NG2+オリゴデンドロサイト前駆細胞などの成熟段階の前駆体のような、分化の少ない細胞を含む可能性があると仮定する。これらの細胞サブタイプは、フローサイトメトリープロトコルを適用することで簡単に調査することができ、フルオレセインイソチオシアネート(FITC)またはフィコエリスリン(PE)フルオロフォアのいずれかと結合した2つの追加の細胞マーカーを収容できる蛍光色素の構成を選択しました。
全体的に、当社のアプローチは、質的および高スループットの定量的評価を可能にする十分に統合された技術を利用して、CNS(健康および疾患)のコンテキストでより包括的な調査のための新しいツールを提供することができますフローサイトメトリーなど。
開示事項
著者たちは何も開示する必要はない。
謝辞
この研究は、ボストン小児病院のスタートアップ資金によってA.B.、ALSA助成金nrに資金提供されました。17-IIP-343からM.P.、および筋萎縮性側索硬化症研究プログラムを通じて国防次官補室賞No.W81XWH-17-1-0036 から M.P.DFCIフローサイトメトリーコアの技術サポートを認めます。
資料
| Name | Company | Catalog Number | Comments |
| 10X HBSS (Calcium, Magnesium chloride, and Magnesium Sulfate-free) | Gibco | 14185-052 | |
| 70 mm Cell Strainer | Corning | 431751 | |
| ACSA/ACSA2 anti-mouse antibody | Miltenyi Biotec | 130-117-535 | APC conjugated |
| Bovine Serum Albumin | Sigma Aldrich | A9647-1KG | |
| CD11b rat anti-mouse antibody | Invitrogen | 47-0112-82 | APC-eFluor 780 conjugated |
| CD31 rat anti-mouse antibody | BD Bioscience | 562939 | BV421 conjugated |
| CD45 rat anti-mouse antibody | Biolegend | 103138 | Brilliant Violet 510 conjugated |
| CD90.1/Thy1.1 rat anti-mouse antibody | Biolegend | 202518 | PE/Cy7 conjugated |
| CD90.2/Thy1.2 rat anti-mouse antibody | Biolegend | 1005325 | PE/Cy7 conjugated |
| Conical Tubes (15 mL) | CellTreat | 229411 | |
| Conical Tubes (50 mL) | CellTreat | 229422 | |
| Dounce Tissue Grinder set (Includes Mortar as well as Pestles A and B) | Sigma-Aldrich | D9063-1SET | |
| Fc (CD16/CD32) Block rat anti-mouse antibody | BD Pharmingen | 553142 | |
| Fetal Bovine Serum | Benchmark | 100-106 | |
| Neural Tissue Dissociation Kit (P) | Miltenyi Biotec | 130-092-628 | |
| O4 anti mouse/rat/human antibody | Miltenyi Biotec | 130-095-895 | Biotin conjugated |
| Percoll | GE Healthcare | 10266569 | sold as not sterile reagent |
| Percoll | Sigma | 65455529 | sterile reagent (to be used for applications requiring sterility) |
| Percoll PLUS | Sigma | GE17-5445-01 | reagent containing very low traces of endotoxin |
| Streptavidin | Invitrogen | S3258 | Alexa Fluor 680 conjugated |
参考文献
- Deverman, B. E., Ravina, B. M., Bankiewicz, K. S., Paul, S. M., Sah, D. W. Y. Gene therapy for neurological disorders: progress and prospects. Nature Reviews Drug Discovery. 17 (9), 641-659 (2018).
- Teleanu, D., Negut, I., Grumezescu, V., Grumezescu, A., Teleanu, R. Nanomaterials for Drug Delivery to the Central Nervous System. Nanomaterials. 9 (3), 371 (2019).
- Chen, S., et al. Recombinant Viral Vectors as Neuroscience Tools. Current Protocols in Neuroscience. 87 (1), 67 (2019).
- Alves, S., et al. Ultramicroscopy as a novel tool to unravel the tropism of AAV gene therapy vectors in the brain. Scientific Reports. 6 (1), 28272 (2016).
- Peviani, M., et al. Lentiviral vectors carrying enhancer elements of Hb9 promoter drive selective transgene expression in mouse spinal cord motor neurons. Journal of Neuroscience Methods. 205 (1), 139-147 (2012).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. Journal of Immunological Methods. 243 (1-2), 77-97 (2000).
- Sykora, M. M., Reschke, M. Immunophenotyping of Tissue Samples Using Multicolor Flow Cytometry. Methods in Molecular Biology. 1953, 253-268 (2019).
- Legroux, L., et al. An optimized method to process mouse CNS to simultaneously analyze neural cells and leukocytes by flow cytometry. Journal of Neuroscience Methods. 247, 23-31 (2015).
- Lee, J. K., Tansey, M. G. Microglia Isolation from Adult Mouse Brain. Methods in Molecular Biology. 1041, 17-23 (2013).
- Grabert, K., McColl, B. W. Isolation and Phenotyping of Adult Mouse Microglial Cells. Methods in Molecular Biology. 1784, 77-86 (2018).
- Nikodemova, M., Watters, J. J. Efficient isolation of live microglia with preserved phenotypes from adult mouse brain. Journal of Neuroinflammation. 9 (1), 635 (2012).
- Garcia, J. A., Cardona, S. M., Cardona, A. E. Isolation and analysis of mouse microglial cells. Current Protocols in Immunology. 104 (1), 1-15 (2014).
- Papa, S., et al. Selective Nanovector Mediated Treatment of Activated Proinflammatory Microglia/Macrophages in Spinal Cord Injury. ACS Nano. 7 (11), 9881-9895 (2013).
- Peviani, M., et al. Neuroprotective effects of the Sigma-1 receptor (S1R) agonist PRE-084, in a mouse model of motor neuron disease not linked to SOD1 mutation. Neurobiology of Disease. 62, 218-232 (2014).
- Peviani, M., et al. Biodegradable polymeric nanoparticles administered in the cerebrospinal fluid: Brain biodistribution, preferential internalization in microglia and implications for cell-selective drug release. Biomaterials. 209, 25-40 (2019).
- Meng, F., et al. CD73-derived adenosine controls inflammation and neurodegeneration by modulating dopamine signalling. Brain. 142 (3), 700-718 (2019).
- Nedeljkovic, N. Complex regulation of ecto-5'-nucleotidase/CD73 and A2AR-mediated adenosine signaling at neurovascular unit: A link between acute and chronic neuroinflammation. Pharmacological Research. 144, 99-115 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved