Method Article
Presynapse Формирование Ассас использованием Presynapse Организатор бисера и "Нейрон мяч" Культура
В этой статье
Резюме
Формирование пресинапсов является динамичным процессом, включая накопление синаптических белков в надлежащем порядке. В этом методе, presynapse образование вызвано бисером конъюгированный с протеином presynapse протеин на аксональных листах культуры «нейронного шара», так что накопление синаптических белков легко быть проанализированным во время образования presynapse.
Аннотация
Во время развития нейронов, формирование синапса является важным шагом для создания нейронных цепей. Для формирования синапсов синаптические белки должны поставляться в надлежащем порядке путем транспортировки из клеточных органов и/или локального перевода в незрелые синапсы. Тем не менее, не до конца понял, как синаптические белки накапливаются в синапсах в надлежащем порядке. Здесь мы представляем новый метод анализа пресинаптического образования с помощью сочетания культуры нейронного шара с бисером, чтобы вызвать формирование пресинапсов. Нейронные шары, которые нейронных клеточных агрегатов обеспечивают аксональные листы вдали от клеточных тел и дендритов, так что слабые флуоресцентные сигналы пресинапсов могут быть обнаружены, избегая подавляющих сигналов клеточных тел. В качестве бисера, чтобы вызвать образование пресинапсов, мы используем бисер, спряженый с леуцином богатых повторить трансмембранных нейронов 2 (LRRTM2), возбуждающие пресинаптический организатор. Используя этот метод, мы продемонстрировали, что везикулярный глутаматный транспортер 1 (vGlut1), синаптический протеин везикл, накопленный в пресинапсах быстрее, чем Munc18-1, активный белок зоны. Munc18-1 накопился перевод-зависимо в presynapse даже после удаления клеточных органов. Этот вывод указывает на накопление Munc18-1 путем локального перевода в аксоны, а не транспорт из клеточных тел. В заключение, этот метод подходит для анализа накопления синаптических белков в пресинапсах и источнике синаптических белков. Поскольку культура нейронного шара проста и не обязательно использовать специальный аппарат, этот метод может быть применим к другим экспериментальным платформам.
Введение
Формирование синапса является одним из важнейшихшагов при развитии нейронных цепей 1,2,3. Формирование синапсов, которые являются специализированными отсеками, состоящими из до- и пост-синапсов, представляет собой сложный и многоступенчатый процесс, включающий соответствующее распознавание аксонов и дендритов, формирование активной зоны и постсинаптической плотности, а также правильное выравнивание ионных каналов и нейромедиаторов рецепторов1,2. В каждом процессе, много видов синаптических протеинов аккумулируют к этим специализированным отсекам в правильном времени путем транспортировать синаптические протеины от тел клетки and/or местным переводом в отсеках. Эти синаптические белки считаются организованными, чтобы сформировать функциональные синапсы. Дисфункция некоторых синаптических белков, связанных собразованием синапсов, приводит к неврологическим заболеваниям 4,5. Тем не менее, остается неясным, как синаптические белки накапливаются в надлежащее время.
Чтобы исследовать, как синаптические белки накапливаются организованно, необходимо изучить накопление синаптических белков в хронологическом порядке. Некоторые доклады продемонстрировали живой визуализации наблюдать образование синапсов в разрозненных культуры нейронов6,7. Тем не менее, это отнимает много времени, чтобы найти нейроны, которые только начинают образование синапсов под микроскопией. Чтобы эффективно наблюдать накопление синаптических белков, образование синапса должно начинаться в то время, когда исследователи хотят вызвать образование. Вторая задача состоит в том, чтобы различать накопление синаптических белков из-за переноса из клеточных тел или локального перевода в синапсы. Для этого уровень перевода необходимо измерять при условии, что не допускается перенос синаптических белков из клеточных органов.
Мы разработали новый анализ формирования пресинапсов с использованием сочетания культуры нейронного шара с бисером, чтобы вызвать формирование пресинапсов8. Нейрон мяч культуры разработан для изучения аксонального фенотипа, в связи с образованием аксональных листов окружающих клеточных органов9,10. Мы использовали магнитные бусы, спряженые с леуцином богатых повторить трансмембранных нейронов 2 (LRRTM2), который является пресинаптическим организатором, чтобы вызвать возбуждающие presynapses (Рисунок 1A)11,12,13. С помощью бисера LRRTM2, образование presynapse начинается в то время, когда бусы применяются. Это означает, что формирование пресинапсов начинается в тысячах аксонов нейронного шара в одно и то же время, что позволяет эффективно изучить точный временной ход накопления синаптических белков. Кроме того, культуры нейронов мяч легко блокировать транспортные синаптические белки от сомы, удалив клеточные тела(Рисунок 1B)8. Мы уже подтвердили, что аксоны без клеточных тел могут выжить и здоровы по крайней мере 4 ч после удаления клеточных тел. Таким образом, этот протокол подходит для исследования, откуда получаются синаптические белки (клеточная часть тела или аксон) и как синаптические белки аккумулируются организованно.
протокол
Эксперименты, описанные в этой рукописи, были проведены в соответствии с руководящими принципами, изложенными в Институциональном комитете по уходу за животными и использованию Иокогамского городского университета.
1. Подготовка нейронных шаров как висячая культура падения (Дни в пробирке (DIV) 0-3)
ПРИМЕЧАНИЕ: Процедуры, описанные здесь для подготовки культуры нейронов мяч основаны на методе ранее сообщалось группы Сасаки с некоторыми изменениями9,10. Мы также приняли несколько процедур из метода банкира для разобщенной культуры14.
-
Подтверждение следующих до начала вскрытия
- Подготовьте все необходимые решения и стерилизуйте их с помощью автоклава/фильтрации заранее.
- Будьте готовы все инструменты и материалы, которые будут использоваться в каждом шаге этой корковой культуры нейронов.
- Спрей и протрите ламинарный шкаф воздушного потока, рассечение стол, сценическая пластина стереомикроскоп, ножницы, и щипцы с 70% этанола.
- Эвтаназия мышь при применении CO2 и вскрыть живот для получения E16 эмбрионов.
- Тщательно удалите мозги из эмбрионов с помощью тонких наконечников щипцы и перенесите их в 60 мм клеточной культуры блюд, содержащих 4 мл HEPES Buffered Salt Solution (HBSS).
ПРИМЕЧАНИЕ: Вскрытие среднего HBSS содержит 10 мМ HEPES (pH 7.4), 140 mM NaCl, 5,4 мМ KCl, 1,09 мМ Na2HPO4, 1.1 mM KH2PO4, 5.6 mM D-глюкоза, и 5.64 мкм фенол красный. - Удалить кожу головы, вырезать обонятельную луковицу, отдельные кортики от каждого полушария головного мозга, используя мелкие кончики щипцы под стереомикроскоп, и передать еще 60 мм блюда, содержащие свежие HBSS. Используйте по крайней мере 3-5 эмбрионов для каждой отдельной культуры нейронов шара.
- Разрежьте кортики на мелкие кусочки микрорассектующими пружинными ножницами в ламинарном капюшоне культуры клеток потока.
- Перенесите фарш кортики в трубку 15 мл и протрите фарш кортиками в 4 мл 0,125% трипсина в HBSS в течение 4,5 мин в водяной бане при 37 градусах Цельсия.
ПРИМЕЧАНИЕ: Это время трипсинизации имеет решающее значение для эффективной культуры нейронов, как увеличение времени (4,5 мин) приводит к гораздо больше мертвых нейронов. - Перенесите агрегаты ячейки в новую трубку 15 мл, содержащую 10 мл HBSS стерильной передачей пипетки, и инкубировать при 37 градусах По Цельсию в течение 5 минут. Повторите этот шаг еще раз.
- Передача клеточных агрегатов в новую трубку 15 мл, содержащую 2 мл нейробазальных носителей, содержащих GlutaMax, Дополнение B27 (NGB medium), 0,01% DNase I и 10% лошадиную сыворотку.
- Triturate трипсинизированных кортиков, неоднократно пайки их вверх и вниз (3-5 раз) с помощью огневой полированной тонкого стекла Пастер пипетка.
ПРИМЕЧАНИЕ: Диаметр огневой полированной тонкого стекла Пастер пипетка очень важно, как описано в документе метод банкира14. Если пипетка слишком узкая, чтобы пройти кортики, подготовить пипетки, обладающие 2-3 различных размеров, и попробовать из больших пипетки. - Для подготовки нейронных шариков, возьмите вышеупомянутую суспензию клеток и отрегулируйте плотность клеток до 1 х 106 клеток/мл с помощью NGB-среды.
- Культура корковых нейронов, как висячие капли, содержащие 10000 клеток / капли (1 капля 10 кл) внутри верхних крышках 10 см культуры блюд.
- Добавьте 7 мл фосфатного буферного сосуда (PBS) в нижнюю часть культурных блюд, затем держите в инкубаторе 3 дня при 37 градусах Цельсия с 5% CO2 при увлажнении, чтобы обеспечить образование нейронных шаров.
2. Размещение нейронных шаров на PLL покрытием стеклянные крышки и содержание культуры (DIV 3-11)
ПРИМЕЧАНИЕ: Перед покрытием стеклянных покрывающих листы поли-L-лизином (PLL), мытье обложек с помощью моющего средства имеет важное значение. Стеклянные крышки иногда не так чисты для нейронной культуры и равномерного покрытия с PLL. Неравномерное покрытие PLL может привести к неравномерному аксональному расширению нейронных шариков.
- Замочите крышки в 1/20 разбавленного нейтрального нефосфорного моющего средства в керамических стеллажах для 1-3 ночных часов.
- Вымойте крышки 8 раз в ультрачистой воде, а затем стерилизовать в духовке при температуре 200 градусов по Цельсию в течение 12 ч.
ПРИМЕЧАНИЕ: Все шаги отсюда должно быть сделано в ламинарном воздушном потоке клеточной культуры капота. - Перенесите запеченные чехлы на 100-мм посуду. После герметизации блюда парафильмом между крышкой и нижней блюдом, запеченные крышки могут храниться для длительного хранения.
- (Необязательно) Нанесите парафиновые точки на крышки. Точки делают пространство для предотвращения нейронных шаров, отделяющихся от крышки во время иммуно-стиха путем прямого контакта нейронных шаров с пластиковой посудой. Растопите параффин в подходящей бутылке на горячей водяной бане при температуре около 90 градусов по Цельсию. Опустите пипетку Pasteur в парафин, затем быстро коснитесь его, чтобы сделать три пятна у края крышки.
- Пальто PLL (MW sgt; 300,000) на парафина бисером стекла охватывает в 60-мм блюда с использованием раствора PLL (15 мкг/мл в борате буфер), и держать их, по крайней мере 1 ч в CO2 инкубатора.
- После мытья 4 раз с PBS, передача PLL покрытием крышки на 4-ну хорошо пластины, содержащие 350 Л NGB среды в каждой скважине и цитозин й-арабинофанодисид гидрохлорида (AraC, 3 мКМ) в средствах массовой информации, чтобы убить деления клеток.
- Держите эту 4-колодую пластину, содержащую крышки с покрытием PLL в инкубаторе CO 2, по крайней мере, в течение 20 минут, чтобы обеспечить температуру средней досягаемости 37 градусов по Цельсию перед переносом нейронных шариков.
- На DIV 3, когда "нейронные шары" формируются очень хорошо, передать их на PLL покрытием крышки внутри 4-колодец пластины (5 нейронных шаров / хорошо) хранится в CO2 инкубатора.
- После 48 ч замените среду культуры нейронов на свежую среду NGB без AraC. Используйте горячую пластину в ламинарном капюшоне клеток воздушного потока, температура которого находится в готовом уровне 37 градусов по Цельсию непосредственно перед этой процедурой.
ПРИМЕЧАНИЕ: Необходимо как можно быстрее выполнить среднюю изменяющуюся на горячей тарелке, чтобы сократить время, которое культуры находятся за пределами инкубатора CO 2. - Держите эту культуру нейронов мяч в ИНкубатор CO2 до DIV 11.
ПРИМЕЧАНИЕ: При DIV 11-12 для экспериментов используются нейронные шарики, расширяющие невриты до 1-2 мм.
3. Применение бисера LRRTM2 на культуру нейронного шара с или без клеточных тел (DIV 11-12)
ПРИМЕЧАНИЕ: Перед применением LRRTM2 шарики на нейрон мяч культуры, рекомендуется удалить клеточные тела. Поэтому сначала приготовьте бисер LRRTM2, затем удалите клеточные тела, а затем нанесите на культуру бусины LRRTM2 как можно раньше. Биотинилатированный LRRTM2 предоставляется группой Ноги (Городской университет Иокогамы) в качестве условной среды. Они используют вектор выражения, включая последовательность приема биотина и биотин лигаза от E. кишечная палочка (Бира) Я не против. 15 лет , 16 прикрепить биотин к LRRTM2, и вектор выражения трансфицируется к клеткам Expi293F, включенным в систему экспрессии Expi293. Информация о переносчиках доступна на дополнительной диаграмме 1. Биотинилатированные LRRTM2-конъюгированные стрептавидиновые бусы значительно снизили фон иммуностоинга значительно по сравнению с LRRTM2-Fc - конъюгированным белок Бусин, которые используются для прототипа системы LRRTM28.
-
Приготовление биотинителированных бусинов LRRTM2
- Для удаления избыточного биотина из условной среды клеток Expi293F, выражающих биоинцилатированный LRRTM2, нанесите 1,7 мл условной среды, смешанной с 0,8 мл PBS (всего 2,5 мл) на колонку фильтрации геля PD-10. Колонна ПД-10 предварительно уравновеш— 25 мл сверхчистой воды и 25 мл PBS.
- Elute с 3,5 мл PBS и собирать поток через как LRRTM2 акций.
ПРИМЕЧАНИЕ: Этот запас LRRTM2 можно утилисть с aliquots и хранить при -80 градусах по Цельсию в долгосрочной перспективе. Уровни экспрессии биотинилаповых LRRTM2 иногда варьируются от партии к партии. Таким образом, надлежащий объем запаса LRRTM2 для сопряжения с бисером должен быть определен для формирования пресинапсов достаточно на нейронных шариках, когда в первый раз используется новая партия запаса LRRTM2. - Возьмите 20 qL от суспензии стрептавидина покрытием магнитных частиц (диаметр: 4-5 мкм) в микроцентрифугтрубки. Обездвижить бусины к аппарату ручной работы, прикрепленному с неодимными постоянными магнитами, и промыть три раза с помощью 100 л PBS-MCBC в микроцентрифуговых трубках 1,5 мл.
ПРИМЕЧАНИЕ: PBS-MCBC содержит PBS в том числе 5 мМ MgCl2, 3 мМ CaCl2, 0,1% BSA, и 0,1% Полный ЭДТА-бесплатно. - После полного удаления PBS-MCBC из бисера, добавить заранее объем LRRTM2 запасов (обычно 500-1000 л, см. Примечание 3.1.2) к вымытым бусинкам. Инкубировать смесь с помощью ротатора при 4 градусах по Цельсию на 1-2 ч.
- Вымойте бисер дважды с 100 зл и л PBS-MCBC, а затем с 100 Зл НГБ среды.
- Resuspend LRRTM2 шарики в 50 ЗЛ среды NGB для применения к культуре нейрон мяч.
- Используйте те же процедуры для подготовки контрольных бусин (отрицательный контроль) в другой микроцентрифугной трубке, за исключением добавления биотинилатированных-LRRTM2 белков.
-
Удаление клеточных тел из нейронных шаров на DIV 11-12 и применение бисера LRRTM2
- Этикетка скважины 4-хорошо пластины, как "Cell тела (я)" и "Cell тела (-)".
- Вырезать окончание желтый наконечник на 45 "угол с лезвием бритвы ранее распыляется с 70% этанола под стереомикроскоп (Рисунок 1B).
- Положите желтый конец кончика на область тела клетки нейронов мяч и удалить тела клеток путем всасывания(рисунок 1B).
- Чтобы определить каждое указанное условие эксперимента, снова обозначьте скважины как "бусы LRRTM2" и "Контрольные бусы".
- Нанесите LRRTM2 и контролировать бусы на нейрон мяч культуры, и погрузиться в нижней части пластин в течение 1 мин с помощью ферритовых магнитов, чтобы начать образование пресинапсов. Эта процедура обеспечивает приземление всех бусин в то же время. Особенно, он будет эффективен для кратковременной инкубации (например, 30 мин и 1 ч) с бисером LRRTM2 синхронно.
- Для проведения экспериментов на временной основе пометьте каждый отдельно, по 0 мин, 30 мин, 1 ч, 2 ч, 4 ч и 18 ч и нанесите lRRTM2 на указанные промежутки времени.
- После добавления бисера LRRTM2 инкубировать культуру нейронного шара с бисером в течение определенного времени (от 0 мин до 18 ч) образуйте пресинапсы.
4. Иммуностоинирование и микроскопия
ПРИМЕЧАНИЕ: Исправить клетки в течение 4 ч через инкубацию с LRRTM2 бусы в экспериментальных условиях с и без клеточных тел, как аксоны, как правило, постепенно умирают в отсутствие клеточных тел после 4 ч. В случае курса времени с бисером LRRTM2, зафиксировать клетки в указанное время.
-
Фиксация и окрашивание нейронов в культуре нейронов мяч после формирования presynapse с LRRTM2 бусы
- Удалить NGB среды и исправить нейронных шаров с 4% PFA в PBS (250 л/ну) в течение 20 минут при комнатной температуре, а затем мыть с 500 Л ПБС 4 раза каждый 5 мин.
- Вымойте фиксированные клетки с ПОМОЩЬю TBS (Трис-буферный солен: 50 мм Tris-HCl (pH 7.3) и 150 мМ NaCl) в течение более 5 мин.
- Пермяки клетки / аксоны культуры нейронов шар с TBS, содержащий 0,3% Тритон X-100 в течение 5 мин.
- Держите клетки 1 ч для блокирования с блокирующим буфером (0,1% Triton X-100 и 5% NGS (нормальная сыворотка коз) в TBS).
- Инкубировать клетки первичными антителами; анти-кроличи-vGlut1 (везикулярный глутаматный транспортер 1 (1:4000)) и анти-мышонок-Munc18-1 (1:300) разбавленный антителаразила на ночь при 4 градусах Цельсия.
- Вымойте крышки 4 раза с иммунофлюоресценции (IF) буфер (0,1% Тритон X-100 и 2% BSA в TBS) и инкубировать в течение 30 мин с фторофором (Alexa краситель)-конъюгированных 2-й антител; анти-мышь-IgG-Alexa 555 (1:500), анти-кролик-IgG-Alexa 488 (1:1000).
- Пятно ядра клеточных органов нейронов в течение 5 мин с 4 ",6-диамидино-2-фенилинол (DAPI, 1 мкг/мл) в PBS.
- Вымойте крышки три раза с PBS, а затем установить на стеклянные слайды с помощью монтажа средств, содержащих 167 мг / мл поли (виниловый) алкоголь и 6 мг / мл N-пропил галлат.
- Храните стеклянные горки в холодильнике при -20 градусов по Цельсию до микроскопии. Флуоресцентные сигналы стеклянных горок обнаруживаются не менее 1 года, когда горки хранятся при -20 градусов по Цельсию.
-
Съемки изображений под флуоресценционным микроскопом
- Захват дифференциального интерференции контраста и IF изображения под перевернутым флуоресцентным микроскопом с охлажденной камерой CCD с помощью 60X масляный объектив погружения. Для приобретения изображений используйте систему микроскопов, установленную на программном обеспечении. Используйте Image J в качестве программного обеспечения для анализа изображений.
- Измерьте интенсивность IF в presynapses в аксоне с помощью следующей формулы; ЕСЛИ интенсивность региона интереса на шариках (ROI) - Off бисера интенсивности области / Аксональ интенсивности вдоль 20 мкм от бисера - фоновая интенсивность. Это соотношение интенсивность обеспечивает индекс накопления белка(рисунок 4A). Выполняете измерения на оригинальных 16-битных изображениях с помощью программного обеспечения Image J.
- Для количественной оценки уровня накопления конкретного белка в пресинапсе, индуцированном с помощью бисера LRRTM2, всегда выбирайте область вдали от 2-поля зрения или более отдельно от клеточного тела с помощью микроскопа (60X).
ПРИМЕЧАНИЕ: Выбор области в нейрон мяч для визуализации имеет решающее значение, как плотные аксоны находятся рядом с телом клетки и периферии нейрон мяч может обеспечить один аксон. - Для точного измерения выберите 5-различное аксональное поле (аналогичное расстояние от клеточных тел)/coverslip.
- Храните идентичные условия визуализации в разные дни и в период между экспериментами
Результаты
Здесь мы показываем репрезентативные результаты накопления пресинапических белков в LRRTM2-индуцированных пресинапсах аксональных листов культуры нейронного шара. Как пресинаптические белки, мы проанализировали возбуждая синаптический протеин везикл vGlut1 и активный белок зоны Munc18-1. Мы также изучили временной ход накопления vGlut1 и Munc18-1 в пресинапсах, и получили результаты, указывающие на источник Munc18-1 в пресинапсах с помощью аксонов, удаляющих тела клеток и ингибитора синтеза белка. Недавно мы исследовали роль хрупкого X умственной отсталости белка (FMRP) на накопление Munc18-1 в presynapses8. FMRP, который является причинным генным продуктом синдрома Хрупкий X (FXS), является мРНК связывающий белок для подавления перевода17,18,19. Мы также рассмотрели участие FMRP в накоплении Munc18-1 с помощью модели mice FXS, которая не хватает в fmr1 гена кодирования FMRP.
Применение LRRTM2-бусинв в культуру нейронного шара на DIV11 индуцированного накопления Munc18-1 в пресинапсах аксонов нейронных шаров(рисунок 2A). Даже в аксонах, которые удаляются клеточные тела, накопление Munc18-1 наблюдалось под бисером, похожим на аксоны нейронных шариков с клеточными телами(рисунок 2B). В типичном случае, более 80% бисера после 4 h-инкубации с нейронными шариками может вызвать накопление синаптических белков в пресинапсах, судя по окрашиванию Munc18-1 и vGlut-1. Потому что аксоны настолько переполнены и перекрываются вблизи клеточных тел(Рисунок 2Аа,Ба), более периферийная область аксональных листов были измерены, где аксоны не так перекрываются (Рисунок2Ab, Bb, например, периферийная область от 2-поля зрения или более отдельно от тела клетки с микроскопом (60X)). При анализе периферической области аксонального листа с помощью объектива с высоким увеличением (60X), vGlut1 и Munc18-1 накапливается четко в пресинапсах аксонов под бисером(рисунок 3). Иногда, флуоресцентные сигналы синаптической везикулярных белков, таких как vGlut1 трудно обнаружить в аксональной области за пределами бисера, потому что эти синаптические везикулярные белки накапливаются так много под бисером. В случае Munc18-1, флуоресцентные сигналы могут быть обнаружены слабо в аксональной области за пределами бисера.
Для количественной оценки уровня накопления синаптических белков в пресинапсах, индуцированных LRRTM2-шариками, измерялись флуоресцентные интенсивности аксонов под бисером и вне бисера, а затем рассчитывались как "индекс накопления белка"(рисунок 4А, подробно описано в разделе протокола). Эксперименты с курсом времени показали, что накопление vGlut1 в пресинапсах значительно увеличилось на 30 мин(рисунок 4B). С другой стороны, накопление Munc18-1 начало значительно увеличиваться на 2 ч, и достичь плато на 4 ч(рисунок 4C). Эти данные показывают, что синаптический везикл-белок vGlut1 накапливается в пресинапсах раньше, чем активный белок зоны Munc18-1. Накопление Munc18-1 в пресинапсах нейронов Fmr1-KO увеличилось в 1,5 раза больше, чем у диких типов (WT)(рисунок 4C),что указывает на участие FMRP в накоплении Munc18-1. Далее, чтобы отличить скопление Munc18-1 из-за переноса из клеточных тел или локального перевода в аксоны, эффект ингибитора синтеза белка анисомицина были изучены на накопление в присутствии или отсутствии клеточных тел (Рисунок 4D) . Анисомицин подавлял накопление Munc18-1 значительно в аксонах(рисунок 4D),что указывает на то, что накопление зависит от синтеза белка. Накопление в пресинапсах аксонов без клеточных тел не сильно отличалось от клеточных тел(рисунок 4D). Эти результаты показывают, что накопление Munc18-1 в пресинапсы происходят в основном из аксонов, но не транспорт Munc18-1 из клеточных тел. Если накопление синаптических белков подавляется в пресинапсах аксонов путем удаления клеточных тел, считается, что это снижение связано с транспортом из клеточных тел. На самом деле, когда мы исследовали накопление общего количества новых синтезированных белков, метаболически помеченных флуоресцентным красителем, удаление клеточных органов значительно уменьшило накопление общего числа вновь синтезированных белков, по сравнению с пресинапами аксонов с клеточные тела8. Хотя накопление Munc18-1 в Fmr1-KO увеличилось больше по сравнению с WT, анисомицин подавлял накопление в аналогичном уровне WT и удаление клеточных органов не повлияло на накопление (Рисунок 4D). Эти результаты свидетельствуют о том, что FMRP участвует в локальном переводе Munc18-1 в аксоны.
Представленные здесь результаты представлены, что этот метод подходит для изучения того, как синаптические белки накапливаются организованно экспериментами на временных курсах, и для изучения источника синаптических белков (транспорт из клеточных тел или местных перевод в аксоны) путем удаления клеточных тел.

Рисунок 1. Схема формирования пресинапсов и удаления клеточных тел из нейронного шара.
(A) Пресинапс формирования асссс с использованием биотинилатированных LRRTM2 конъюгированных стрептавидина бусы, чтобы вызвать пресинапсы в аксоны культуры нейронов мяч подготовлен из E16 кортики. LRRTM2, постсинаптический белок, связывает нейрексин (NRXN) и выступает в качестве пресинапсового организатора. Стрептавидин бисер, спряженный с биотинилатами LRRTM2 внеклеточных регионов (LRRTM2 шарики) были применены на DIV11-12 к культуре нейронов мяч, чтобы вызвать пресинапсов. Эта цифра была изменена по сравнению с предыдущей публикацией8. (B) желтый конец кончика был вырезан и помещен на область тела клетки культуры нейронов шара под углом 45 ". Тела клеток были удалены путем всасывания. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2. Munc18-1 накопления в пресинапсы при наличии и отсутствии клеточных органов нейронного шара.
(A) После инкубации 4 ч с бисером LRRTM2, активный зоновый белок Munc18-1 накапливается на индуцированных предсинапических участках в аксонах (Верхняя панель; экспериментальная схема, средняя; фазовое изображение, ниже; ЕСЛИ изображения накопления Munc18-1). Изображения были захвачены в виде изображений с низким увеличением с помощью объектива 10X и промежуточного увеличения (1.5X), чтобы увидеть всю картину, состоящую из нейронного шара, аксонов и бисера. Dashed квадратов указывают область нейронного шара для точного положения изображения бисера. Шкала бар, 20 мкм (слева; исходное изображение), 10 мкм (справа; увеличенное изображение). (B) Munc18-1 накапливается очень хорошо даже при отсутствии клеточных тел на индуцированных предсинапических участках в аксонах. Этот результат указывает на то, что аксоны могут выжить и сформировать пресинапсы даже после удаления клеточных тел, по крайней мере 4 ч. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
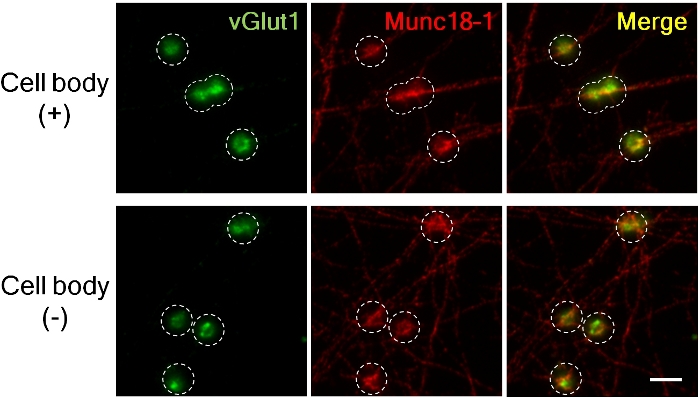
Рисунок 3. Накопление vGlut1 и Munc18-1 в пресинапсах аксонов с и без клеточных тел.
Возбуждаящийся пресинаптический маркер vGlut1 (зеленый) и Munc18-1 (Красный) скопился в пресинапсах 4 ч после добавления бисера LRRTM2. (Верхняя панель; с клеточными телами, нижняя; без клеточных тел). Изображения были захвачены с помощью 60X масляный объектив погружения для высокого увеличения для измерения флуоресцентной интенсивности. Dashed круг изложил положение бисера. Munc18-1 накапливается почти схожие масштабы в присутствии и отсутствии клеточных тел в пресинапсах, но vGlut1 накопление уменьшается без клеточных тел8. Шкала бар, 5 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4. Процедура измерения интенсивности IF и воздействия удаления клеточных тел и ингибитора синтеза белка на накопление Munc18-1 в нейронных шариках.
(A) Диаграмма показала метод количественной оценки интенсивности IF на индуцированно-пресинаптический сайт в аксон евен аль-бол культуры. Шкала бар, 5 мкм. Подробности описаны в разделе протокола. (B) Время хода накопления vGlut1 в пресинапсах, индуцированных с помощью бисера LRRTM2. Данные, отображаемые, являются средними для SEM для n No 20. Двусторонняя ANOVA с многократным сравнительным тестом Туки. р-р злт; 0,01. (C) Время курс накопления Munc18-1 в WT и Fmr1-KO presynapses под lRRTM2 бусы. Данные, показанные, являются средними для SEM для n No 20, Двусторонний ANOVA с многократным тестом сравнения Tukey. n.s., не существенно; P qlt; 0.01, значительно отличаемый между WT и KO. (D) Бар график показал Munc18-1 уровень накопления в пресинапсы WT и Fmr1-KO нейронных шаров в присутствии или отсутствии 25 мМ анисомицин (Анисо) с (CB) или без (CB-) клеточных органов. Данные, отображаемые, являются средними для SEM для n No 20. Двусторонняя ANOVA с многократным сравнительным тестом Туки. Р-л; 0,01, н.с., не значительный. указанный p qlt; 0.01, значительно отличаемый с и без анисомицина. Эти цифры были изменены из предыдущей публикации8. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Дополнительная рисунок 1. Вектор bicystronic выражения для LRRTM2-ECR (Внеклеточный регион) и BirA (биотин лигаза от E. coli).
Между последовательностью кодирования LRRTM2-ECR и BirA существует последовательность внутреннего Ribosomal Entry Site (IRES), которая позволяет совместно выражать оба белка из одного мРНК. HEF1-HTLV промоутер диски экспрессон бистроновой мРНК, и оба белка выделяются сигнал пептидных последовательностей после перевода. Последовательность кодирования LRRTM2-ECR прикрепляется к нескольким последовательности пептидных тегов (DYKDDDDK, TEV, Myc и His tags) и последовательности биотинового приемителя (BAS). BirA прикрепляется к тегу DYKDDDDV. Засекретил BirA биоинтинилаты из последовательности BAS LRRRTM2-ECR, чтобы привязать к стрептавидинбийским бусинам. Пожалуйста, нажмите здесь, чтобы загрузить фигуру.
Обсуждение
Мы разработали новый метод для изучения образования пресинапсов, стимулируемых LRRTM2-шариками с использованием культуры нейронного шара. В настоящее время большая часть пресинапсового образования асса включает в себя поли-D-лизин (PDL)покрытием бисера и диссоциированной культуры / микрофлюидной камеры20,21,22. Одним из преимуществ этого метода является LRRTM2-бисер. В то время как LRRTM2 взаимодействует с нейрексином, чтобы сформировать возбуждающие пресинапы специально11,12,13, PDL-бусы индуцирует как возбуждающие и ингибирующие пресинапсы nonspecifically20. В этом методе, другие организаторы presynapse, члены которых более 10 белков3, применимы, чтобы вызвать пресинапсы, изменив внеклеточный домен биотинилатированного белка в зависимости от экспериментального назначения.
Еще одним преимуществом является культура нейронов мяч. В некоторых случаях, обычные диссоциированной культуры была использована для анализа presynapse формирования20. Однако, разобщенные культуры не подходит для анализа низких уровней синаптических белков в пресинапсы, потому что подавляющее сигналы в клеточных телах и дендритов вмешиваться сигналы в пресинапсов. Вместо этого, некоторые группы используют разобщенные культуры в микрофлюидной камере, которая является специальным аппаратом для культуры аксонов и клеточных органов отдельно в 2 comprtments21,22. С помощью микрофлюидной камеры аксональный лист образуется в аксональном отсеке, и тела клеток могут быть удалены из клеточного отсека тела, подобно культуре нейронного шара. Тем не менее, микрофлюидная камера является специальным аппаратом, и требует некоторых навыков для поддержания постоянного состояния культуры. Нейронная культура шара не является необходимым для использования специального аппарата, и относительно легко быть введены в качестве нового экспериментального метода. Потому что суть культуры нейронного шара как раз уместить агрегаты нейрональных клеток (шарики нейрона) к стеклянн-нижней тарелке/камере, она может легко совмещена с другими методами. Например, считается, что культура нейронов шара с использованием LRRTM2-бусы применима для скрининга высокого содержания для измерения флуоресценции 10-20 бисера области в то же время.
Критическим шагом этого протокола является покрытие PLL. Если покрытие PLL не равномерное, аксоны нейронных шариков не будут равномерно расширяться во всех направлениях. Это нарушает эффективный анализ формирования пресинапсов. Мы используем стеклянные крышки и стеклянные блюда, однако, стекло иногда не так чисто для нейронной культуры и равномерное покрытие с PLL. В этом протоколе сначала стеклянные крышки и стеклянные посуда замачивают в нейтральном нефосфорном моренте 1-3 на ночь, а затем промывают 8 раз ультрачистой водой. Мы используем PLL, чей молекулярный вес 300 000 фунтов стерлингов, чтобы уменьшить его концентрацию (15 мкг/мл) для более низкого нежелательного фона. При использовании более низкой молекулярной массы PLL(например, 30 000-70 000) необходима более высокая концентрация (100 мкг/мл) для расширения аксонов.
Ограничение этого метода является то, что нейрон мяч культуры не может поддерживать йgt; DIV15-16. Аксоны нейронных шаров фрагментированы после DIV15-16. Фрагментированные аксоны не производят пресинапсов после применения бисера LRRTM2. Таким образом, этот метод не применим для анализа зрелых нейронов (Зтт; DIV21). Тем не менее, в большинстве случаев11,12,21,22, presynapse формирования ассссс использует молодые нейроны, которые культивируются до DIV14. Другим ограничением является то, что аксоны без клеточных тел не могут выжить более 4 ч. Мы проанализировали накопление 5 синаптических белков в пресинапсах до сих пор, накопление всех белков, которые мы проверили достигли почти плато в течение 4 ч (неопубликованное наблюдение). Считается, что синаптические белки накапливаются достаточно на 4 ч, чтобы проанализировать, где синаптические белки являются производными от (клетки тела или аксона).
Сочетание культуры нейронного шара с LRRTM2-бисером является относительно простым и гибким, чтобы адаптировать многие экспериментальные платформы. Мы уже применили этот метод для измерения пресинаптической активности с помощью красителя AM1-43 (неопубликованное наблюдение). Этот метод считается применимым для скрининга высокой пропускной связи. Анализ формирования пресинапсов можно применять скрининг высокого содержания путем окрашивания синаптических белков в пресинапсах, образующихся под LRRTM2-шариками. Этот метод будет способствовать поиску новых соединений для лечения неврологических заболеваний.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа частично поддерживается JSPS Грант-в-помощь для научных исследований (KAKENHI) (C) (No 22500336, 25430068, 16K07061) (Y. Сасаки). Мы благодарим д-ра Терукадзу Ноги и г-жу Макико Неязазаки (Городской университет Иокогамы) за любезное предоставление биотинилапопротого белка LRRTM2. Мы также благодарим Хонами Уэчи и Ри Исии за техническую помощь.
Материалы
| Name | Company | Catalog Number | Comments |
| Antibody diluent | DAKO | S2022 | |
| Alexa Fluor 594 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-585-151 | |
| Alexa Fluor 488 AffiniPure Donkey Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-545-152 | |
| mouse anti-Munc18-1 | BD Biosciences | 610336 | |
| B-27 Supplement (50X), serum free | Thermo Fisher Scientific | 17504044 | |
| Bovine Serum Alubumin (BSA) | Nacalai Tesque | 01863-48 | |
| Cell-Culture Treated Multidishes (4 well dish) | Nunc | 176740 | |
| Complete EDTA-free | Roche | 11873580001 | |
| cooled CCD camera | Andor Technology | iXON3 | |
| Coverslip | Matsunami | C015001 | Size: 15 mm, Thickness: 0.13-0.17 mm |
| Cytosine β-D-arabinofuranoside (AraC) | Sigma-Aldrich | C1768 | |
| 4',6-Diamidino-2-phenylindole Dihydrochloride (DAPI) | Nacalai Tesque | 11034-56 | |
| Deoxyribonuclease 1 (DNase I) | Wako pure chemicals | 047-26771 | |
| Expi293 Expression System | Thermo Fisher Scientific | A14635 | |
| Horse serum | Sigma-Aldrich | H1270 | |
| image acquisition software | Nikon | NIS-element AR | |
| Image analysis software | NIH | Image J | https://imagej.nih.gov/ij/ |
| Inverted fluorecent microscope | Nikon | Eclipse Ti-E | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | |
| Neurobasal media | Thermo Fisher Scientific | #21103-049 | |
| Normal Goat Serum (NGS) | Thermo Fisher Scientific | #143-06561 | |
| N-propyl gallate | Nacalai Tesque | 29303-92 | |
| Paraformaldehyde (PFA) | Nacalai Tesque | 26126-25 | |
Paraplast Plus | Sigma-Aldrich | P3558 | |
| Poly-L-lysine Hydrobromide (MW > 300,000) | Nacalai Tesque | 28359-54 | |
| poly (vinyl alcohol) | Sigma | P8136 | |
| Prepacked Disposable PD-10 Columns | GE healthcare | 17085101 | |
| rabbit anti-vesicular glutamate transporter 1 | Synaptic Systems | 135-302 | |
| SCAT 20X-N (neutral non-phosphorous detergent) | Nacalai Tesque | 41506-04 | |
| Streptavidin-coated magnetic particles | Spherotech Inc | SVM-40-10 | diameter: 4-5 µm |
| TritonX-100 | Nacalai Tesque | 35501-15 | |
| Trypsin | Nacalai Tesque | 18172-94 |
Ссылки
- Waites, C. L., Craig, A. M., Garner, C. C. Mechanisms of Vertebrate Synaptogenesis. Annual Review of Neuroscience. 28 (1), 251-274 (2005).
- Ziv, N. E., Garner, C. C. Cellular and molecular mechanisms of presynaptic assembly. Nature Reviews Neuroscience. 5 (5), 385-399 (2004).
- Chia, P. H., Li, P., Shen, K. Cellular and molecular mechanisms underlying presynapse formation. Journal of Cell Biology. 203 (1), 11-22 (2013).
- Südhof, T. C. Neuroligins and neurexins link synaptic function to cognitive disease. Nature. 455 (7215), 903-911 (2008).
- Saitsu, H., et al. CASK aberrations in male patients with Ohtahara syndrome and cerebellar hypoplasia. Epilepsia. 53 (8), 1441-1449 (2012).
- Friedman, H. V., Bresler, T., Garner, C. C., Ziv, N. E. Assembly of New Individual Excitatory Synapses. Neuron. 27 (1), 57-69 (2000).
- Bresler, T., et al. Postsynaptic density assembly is fundamentally different from presynaptic active zone assembly. The Journal of neuroscience the official journal of the Society for Neuroscience. 24 (6), 1507-1520 (2004).
- Parvin, S., Takeda, R., Sugiura, Y., Neyazaki, M., Nogi, T., Sasaki, Y. Fragile X mental retardation protein regulates accumulation of the active zone protein Munc18-1 in presynapses via local translation in axons during synaptogenesis. Neuroscience Research. , (2018).
- Sasaki, Y., et al. Phosphorylation of Zipcode Binding Protein 1 Is Required for Brain-Derived Neurotrophic Factor Signaling of Local β-Actin Synthesis and Growth Cone Turning. Journal of Neuroscience. 30 (28), 9349-9358 (2010).
- Sasaki, Y., Gross, C., Xing, L., Goshima, Y., Bassell, G. J. Identification of axon-enriched microRNAs localized to growth cones of cortical neurons. Developmental neurobiology. 74 (3), 397-406 (2014).
- Linhoff, M. W., et al. An Unbiased Expression Screen for Synaptogenic Proteins Identifies the LRRTM Protein Family as Synaptic Organizers. Neuron. 61 (5), 734-749 (2009).
- de Wit, J., et al. LRRTM2 Interacts with Neurexin1 and Regulates Excitatory Synapse Formation. Neuron. 64 (6), 799-806 (2009).
- Ko, J., Fuccillo, M. V., Malenka, R. C., Südhof, T. C. LRRTM2 Functions as a Neurexin Ligand in Promoting Excitatory Synapse Formation. Neuron. 64 (6), 791-798 (2009).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature protocols. 1 (5), 2406-2415 (2006).
- Hirai, H., et al. Structural basis for ligand capture and release by the endocytic receptor ApoER2. EMBO reports. , (2017).
- Yasui, N., et al. Functional Importance of Covalent Homodimer of Reelin Protein Linked via Its Central Region. Journal of Biological Chemistry. 286 (40), 35247-35256 (2011).
- Bassell, G. J., Warren, S. T. Fragile X Syndrome: Loss of Local mRNA Regulation Alters Synaptic Development and Function. Neuron. 60 (2), 201-214 (2008).
- Darnell, J. C., Klann, E. The translation of translational control by FMRP: therapeutic targets for FXS. Nat Neurosci. 16 (11), 1530-1536 (2013).
- Richter, J. D., Bassell, G. J., Klann, E. Dysregulation and restoration of translational homeostasis in fragile X syndrome. Nature Reviews Neuroscience. 16 (10), 595-605 (2015).
- Lucido, A. L., et al. Rapid Assembly of Functional Presynaptic Boutons Triggered by Adhesive Contacts. Journal of Neuroscience. 29 (40), 12449-12466 (2009).
- Taylor, A. M., Wu, J., Tai, H. C., Schuman, E. M. Axonal Translation of β-Catenin Regulates Synaptic Vesicle Dynamics. Journal of Neuroscience. 33 (13), 5584-5589 (2013).
- Batista, A. F. R., Martínez, J. C., Hengst, U. Intra-axonal Synthesis of SNAP25 Is Required for the Formation of Presynaptic Terminals. Cell reports. 20 (13), 3085-3098 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены