Method Article
使用预突子形成测定使用预突子组织者珠和"神经元球"文化
摘要
预突生形成是一个动态过程,包括以适当的顺序积累突触蛋白。在这种方法中,前突子形成由与"神经元球"培养的正交片上与前突子组织者蛋白结合的珠子触发,因此在先发形成期间很容易分析突触蛋白的积累。
摘要
在神经元发育过程中,突触形成是建立神经回路的重要一步。要形成突触,突触蛋白必须通过从细胞体的传输和/或未成熟的突触中的局部翻译以适当的顺序提供。然而,它不完全了解突触蛋白如何积累在突触以适当的顺序。本文提出了一种利用神经元球培养与珠子结合来诱导前突触形成的新方法。神经元细胞聚集的神经元球提供远离细胞体和树突的斧状片,因此可以通过避免细胞体的压倒性信号来检测前突子的弱荧光信号。作为珠子来触发前突动的形成,我们使用珠子与富含亮氨酸的重复跨膜神经元2(LRRTM2)结合,这是一个兴奋的先发前的组织者。使用这种方法,我们证明了囊性谷氨酸输送剂1(vGlut1),一种突触性囊泡蛋白,在预突触中积累得比Munc18-1(一种活性区蛋白)快。Munc18-1 在切除细胞体后,在先行中积累翻译依赖性。这一发现表明Munc18-1通过局部平移在斧子中积累,而不是从细胞体传输。总之,该方法适用于分析突触前蛋白的积累和突触蛋白的来源。由于神经元球培养简单,无需使用特殊仪器,该方法可适用于其他实验平台。
引言
突触形成是神经回路1、2、3开发过程中的关键步骤之一。由突触前和突触后组成的专门隔间的形成是一个复杂和多步骤的过程,涉及适当识别斧子和树突,形成活动区和后突密度,以及正确对齐电位通道和神经递质受体1,2。在每个过程中,许多种类的突触蛋白通过从细胞体中运输突触蛋白和/或通过隔间中的局部翻译,在适当的时间积累到这些专用隔间。这些突触蛋白被认为是以有组织的方式排列,以形成功能性突触。一些突触蛋白的机能导致神经疾病4,5。然而,目前还不清楚突触蛋白是如何在适当的时间积累。
为了研究突触蛋白如何以有组织的方式积累,有必要按时间顺序检查突触蛋白的积累。一些报告演示了实时成像,以观察神经元分离培养的突触形成6,7。然而,它是费时的神经元,刚刚开始在显微镜下突触形成。为了有效地观察突触蛋白的积累,突触的形成必须在研究人员想要诱导形成的时候开始。第二个挑战是区分突触蛋白的积累,由于从细胞体或突触中的局部翻译。为此,翻译水平是必要的,在不允许从细胞体运输突触蛋白的条件下进行测量。
我们利用神经元球培养物与珠子的结合,开发出了新型的先发性形成测定,以诱导前突子形成8。神经元球培养是开发来检查斧状表型,由于形成围绕细胞体的斧板9,10。我们使用磁珠与富含亮氨酸的重复跨膜神经元2(LRRTM2)结合,这是一个前突触组织者诱导兴奋前突触(图1A)11,12,13。通过使用 LRRTM2 磁珠,在应用磁珠时开始预突子形成。这意味着,前突子的形成开始于神经元球的千个斧子在同一时间,因此它允许有效地检查突触蛋白积累的精确时间过程。此外,神经元球培养很容易通过去除细胞体来阻止从体中传递突触蛋白(图1B)8。我们已经证实,没有细胞体的斧子可以存活,并在去除细胞体后至少4小时健康。因此,此方案适用于研究突触蛋白的衍生位置(细胞体或斧子),以及突触蛋白如何以有组织的方式积累。
研究方案
本手稿中描述的实验是根据横滨城市大学机构动物护理和使用委员会概述的准则进行的。
1. 神经元球作为悬垂培养物的准备(天体外(DIV) 0-3)
注:此处描述的神经元球培养制备过程基于Sasaki组先前报告的方法,并作了一些修改9,10。我们还从Banker方法中采用了几种程序来分离文化14。
-
在开始解剖之前确认以下内容
- 准备所有必需的解决方案,并提前通过高压灭菌器/过滤进行消毒。
- 准备好所有仪器和材料,用于这个皮质神经元培养的每个步骤。
- 用70%乙醇喷洒和擦拭层气流柜、解剖台、立体显微镜、剪刀和钳子的阶段板。
- 在应用CO2时对小鼠实施安乐死,并解剖腹部以获得E16胚胎。
- 在钳子细尖的帮助下,小心地从胚胎中取出大脑,并将其转移到含有4 mPS缓冲盐溶液(HBSS)的60毫米细胞培养皿中。
注: 解剖介质 HBSS 包含 10 mM HEPES (pH 7.4)、 140 mM NaCl、 5.4 mM KCl、1.09 mM Na2HPO4、 1.1 mM KH 2 PO4、 5.6 mM D-葡萄糖和 5.64 μM 苯酚红色。 - 取出头皮,切断嗅球,使用立体显微镜下钳子的细尖从每个大脑半球分离皮质,并转移到另一个含有新鲜HBSS的60毫米菜肴。为每个单独的神经元球培养使用至少 3-5 个胚胎。
- 在层状流动细胞培养罩中用微解剖弹簧剪刀将皮质切成小块。
- 将切碎的皮质转移到15 mL管中,在HBSS中的4mL 0.125%胰蛋白酶中胰蛋白酶中胰小皮草,在37°C的水浴中4.5分钟。
注:此胰蛋白酶化时间对于有效的神经元培养至关重要,因为增加的时间(> 4.5 分钟)会导致更多的死神经元。 - 通过无菌转移移液器将细胞聚集体转移到含有10 mSS的15 mL新管中,并在37°C下孵育5分钟。
- 将细胞聚集体转移到一个新的15 mL管,含有2 mL的神经巴管,含有GlutaMax,B27补充剂(NGB介质),0.01%DNase I和10%马血清。
- 使用火抛光的细玻璃巴斯德移液器反复上下移液(3-5次),对胰蛋白酶化皮质进行三聚化。
注:如Banker方法第14号文件所述,火抛光细玻璃巴斯德移液器的直径非常重要。如果移液器太窄,无法通过皮质,请准备具有 2-3 个不同尺寸的移液器,并尝试从较大的移液器。 - 为了准备神经元球,采取上述细胞悬浮液,并使用NGB培养基将细胞密度调整到1 x 106细胞/mL。
- 在10厘米培养皿的上盖内,将皮质神经元培养为含有10,000个细胞/滴(1滴为10μL)的挂滴。
- 在培养皿的底部加入7 mL的磷酸盐缓冲盐水(PBS),然后在37°C下在培养箱中保存3天,在加湿条件下将5%的CO2保持,以允许神经元球的形成。
2. 将神经元球放置在 PLL 涂层玻璃盖上,并维护培养物 (DIV 3-11)
注:在用聚-L-莱辛 (PLL) 涂覆玻璃盖玻片之前,使用洗涤剂清洗盖玻片非常重要。玻璃盖玻片有时不太干净,用于神经元培养和PLL均匀涂层。不均匀的PLL涂层可能导致神经元球的不平衡的等向延伸。
- 将盖玻片浸泡在陶瓷架中1⁄20稀释中性非磷洗涤剂中,1-3过夜。
- 在超纯水中清洗盖玻片8次,然后在200°C的烤箱中消毒12小时。
注:此处的所有步骤都必须在层压空气流细胞培养罩中完成。 - 将烤盖片转移到 100 毫米的盘子中。在盖和底盘之间用底膜密封盘子后,可保存烘焙盖玻片,以便长期存放。
- (可选)将石蜡点涂到盖玻片上。这些点使空间,以防止神经元球从覆盖物分离免疫染色期间,通过神经元球直接接触到塑料盘子。将石蜡融化在适当的瓶子中,在热水浴中,温度约为90°C。将巴斯德移液器浸入石蜡中,然后快速触摸,使其在盖玻片边缘附近产生三个斑点。
- 使用 PLL 溶液(硼酸盐缓冲液中为 15 μg/mL)将 PLL (MW& gt; 300,000) 涂在 60 mm 的餐具中,并将其保存在 CO2培养箱中至少 1 小时。
- 使用PBS洗涤4次后,将PLL涂层盖片转移到含有350μLNGB介质的4孔板中,每个孔中含有350μL的NGB介质,并将细胞氨酸β-D-阿拉伯盐酸(AraC,3μM)转移到介质上,以杀死分裂细胞。
- 在 CO2 培养箱中至少保持含有 PLL 涂层盖玻片的 4 孔板至少 20 分钟,以确保介质的温度在转移神经元球之前达到 37°C。
- 在DIV 3,当"神经元球"形成良好时,将它们转移到保存在CO2培养箱中的4孔板(5个神经元球/孔)内的PLL涂层盖玻片上。
- 48小时后,用新鲜的无AraC NGB介质替换神经元球培养基。在手术后,在层气细胞培养罩中使用热板,其温度保持在37°C。
注:有必要在热板上尽可能快地进行介质变化,以减少培养物在CO2培养箱外部的时间。 - 将这种神经元球培养在 CO2培养箱中,最多为 DIV 11。
注:在DIV 11-12,神经元球将中性光酸盐延长到1-2毫米用于实验。
3. 在有或没有细胞体的神经元球培养上应用LRRTM2珠(DIV 11-12)
注:在将LRRTM2珠子应用于神经元球培养之前,建议去除细胞体。因此,首先制备LRRTM2珠子,然后取出细胞体,然后尽早将LRRTM2珠子应用到培养中。生物仿当LRRTM2由Nogi集团(横滨城市大学)作为有条件的介质提供。他们使用表达载体,包括生物锡接受器序列和来自E的生物锡连带。大肠杆菌(比拉)15,16将生物子锡附于 LRRTM2,并将表达载体转染为 Expi293 表达系统中的 Expi293F 细胞。矢量信息可在补充图 1中提供。与用于原型LRRTM2系统8的LRRTM2原型蛋白A珠相比,生物浸化的LRRTM2-结合链球蛋白珠子的免疫染色背景大大降低。
-
生物酸酯LRRTM2珠子的制备
- 为了去除Expi293F细胞中表达生物浸化LRRTM2的多余生物锡,将1.7 mL的调节介质与0.8 mL的PBS(共2.5 mL)混合在PD-10凝胶过滤柱上。PD-10 柱与 25 mL 的超纯水和 25 mL 的 PBS 预平衡。
- 具有 3.5 mL 的 PBS,并收集作为 LRRTM2 库存的流通。
注:此 LRRTM2 库存可分配至等分,并长期储存在 -80°C。生物酸酯LRRTM2的表达水平有时因批次而异。因此,当第一次使用新的LRRTM2库存时,应确定适当体积的LRRTM2库存与珠子结合,以形成足够的神经元球前突子。 - 从链球菌涂层磁性颗粒(直径:4-5 μm)的悬浮液到微离心管中取20μL。将珠子固定到手工仪器上,用钛永磁体连接,在1.5 mL微离心管中用100μL的PBS-MCBC清洗三次。
注: PBS-MCBC 包含 PBS,包括 5mM MgCl 2、 3 mM CaCl2、 0.1% BSA 和 0.1% 完全 EDTA 无。 - 从珠子中完全去除PBS-MCBC后,将预定体积的LRRTM2库存(通常为500-1,000μL,见注3.1.2)添加到洗涤的珠子中。在4°C下使用旋转器孵育混合物1-2小时。
- 用100μL的PBS-MCBC清洗珠子两次,然后用100μL的NGB介质清洗。
- 在NGB培养基的50μL中重新悬浮LRRTM2珠子,以应用于神经元球培养。
- 使用相同的程序在另一个微离心管中制备控制珠(阴性控制),但添加生物异位-LRRTM2蛋白除外。
-
在 DIV 11-12 处从神经元球中去除细胞体并应用 LRRTM2 珠子
- 将 4 孔板的孔标为"细胞体 (+)"和"细胞体 (-)"。
- 用剃刀刀片在立体显微镜下用70%乙醇喷洒的剃刀,以45°角切割黄色尖端的尾声(图1B)。
- 将黄色尖端端放在神经元球的细胞体区域上,然后通过吸力去除细胞体(图1B)。
- 要识别实验的每个指定条件,请再次将井标为"LRRTM2 珠子"和"控制珠子"。
- 在神经元球培养上应用LRRTM2和控制珠子,使用铁氧体磁铁在板底浸入1分钟,开始前突触形成。此过程可确保同时触摸所有珠子。特别是,它对于与LRRTM2珠同步进行短时间孵育(例如30分钟和1小时)是有效的。
- 要执行时间过程实验,请分别标记每个单独和 0 分钟、30 分钟、1 小时、2 小时、4 小时和 18 小时,并在指定的时间间隔应用 LRRTM2 磁珠。
- 添加LRRTM2珠子后,用珠子孵育神经元球培养物,在指定时间内(0分钟至18小时)形成前突子。
4. 免疫染色和显微镜
注:在有细胞体和无细胞体的实验条件下,通过LRRTM2珠子通过孵育将细胞修复4小时,因为斧头在4小时后没有细胞体的情况下会逐渐死亡。在时间过程与LRRTM2珠,修复细胞在指定的指定时间。
-
使用LRRTM2珠子形成前突子后,修复和染色神经元球培养
- 在室温下,取出NGB介质,用4%PFA固定神经元球(250μL/井),20分钟,然后用500μL的PBS洗涤4次,每5分钟。
- 使用 TBS(三分缓冲盐水:50 mM Tris-HCl (pH 7.3) 和 150 mM NaCl)清洗固定电池超过 5 分钟。
- 用TBS渗透神经元球培养的细胞/斧子,在5分钟内含有0.3%Triton X-100。
- 保持细胞1小时,以阻止与阻塞缓冲液(0.1%Triton X-100和5%NGS(正常山羊血清)在TBS中。
- 用原抗体孵育细胞;抗兔-vGlut1(谷氨酸转运剂1(1:4000))和抗小鼠-Munc-18-1(1:300)用抗体稀释剂在4°C过夜。
- 用免疫荧光 (IF) 缓冲液(TBS 中 0.1% Triton X-100 和 2% BSA)清洗覆盖唇 4 次,用荧光素(Alexa 染料)结合的第二抗体孵育 30 分钟;抗小鼠-IgG-Alexa 555 (1:500),抗兔子-IgG-Alexa 488 (1:1000)。
- 在PBS中用4°,6-二酰胺-2-苯林多(DAPI,1微克/mL)染色神经元细胞体核5分钟。
- 用 PBS 清洗盖玻片三次,然后使用含有 167 mg/mL 聚酯(乙烯基)酒精和 6 mg/mL N-丙基电酸盐的安装介质安装在玻璃玻片上。
- 将玻璃玻片储存在-20°C的冰箱中,直到显微镜。当玻璃玻片储存在-20°C时,玻璃玻片的荧光信号可检测到至少1年。
-
在荧光显微镜下拍摄图像
- 使用 60X 油浸透镜在倒置荧光显微镜下使用冷却 CCD 相机捕获差分干扰对比度和 IF 图像。对于图像采集软件,请使用软件安装的显微镜系统。使用图像 J 作为图像分析软件。
- 使用以下公式测量斧突中前突子中的 IF 强度;珠子上感兴趣区域的IF强度 = 离珠区域强度/从珠子20 μm的离心区域强度+背景强度。此比例强度提供蛋白质积累指数 (图 4A)。使用 Image J 软件完成原始 16 位图像的测量。
- 要量化使用LRRTM2珠诱导的先增酶中特定蛋白质的积累水平,始终使用显微镜(60X)选择远离2个视场的区域或以上区域。
注:选择神经元球中的成像区域至关重要,因为密集的斧子靠近细胞体,神经元球的外围可以提供单个斧子。 - 要进行精确测量,请选择 5 个不同的等子场(与细胞体的距离相似)/盖玻片。
- 在实验的不同天和两者之间保持相同的成像条件
结果
在这里,我们展示了在神经元球培养的斧板的LRRTM2诱导前突触中预突触蛋白的积累代表性的结果。作为前突触蛋白,我们分析了兴奋性突触性囊泡蛋白vGlut1和活性区蛋白Munc18-1。我们还研究了前突子中vGlut1和Munc18-1积累的时间过程,并利用去突子去除细胞体和蛋白质合成抑制剂的突厥前Munc18-1来源得到结果。最近,我们研究了脆弱X智力迟钝蛋白(FMRP)在预突子8中Munc18-1的积累作用。FMRP是易碎X综合征(FXS)的致能基因产物,是一种mRNA结合蛋白,可抑制翻译17、18、19。我们还使用FXS模型小鼠(Fmr1基因编码FMRP)的缺乏,研究了FMRP在Munc18-1积累中的参与情况。
LRRTM2-珠在DIV11诱导的神经元球培养中的应用在神经元球的突触前,在神经元球的突增中诱导积累(图2A)。即使在被移除的细胞体的斧头中,Munc18-1的积累也观察到在与细胞体神经元球的斧头相似的珠子下(图2B)。在典型情况下,超过80%的珠子在4小时孵育后与神经元球可以诱导突触蛋白在先发预突触的积累,通过染色Munc18-1和vGlut-1判断。由于斧头是如此拥挤和重叠附近的细胞体(图2Aa,Ba),更多的外围区域的斧头板被测量,其中斧头没有那么重叠(图2Ab,Bb,例如,外围区域远离2场视图或更多,除了细胞体与显微镜(60X))。当用高倍率物镜(60X)分析斧头片的外围区域时,vGlut1和Munc18-1在珠子下的斧头前发着明显积累(图3)。有时,在珠子外的突触性心形蛋白(如 vGlut1)的荧光信号很难被检测到,因为这些突触性心形蛋白在珠子下积累得如此之多。在Munc18-1的情况下,荧光信号可以在珠子外的斧头区域弱检测。
为了量化LRRTM2-珠子诱导的突触前蛋白的积累水平,测量了珠子下和珠子外的突触强度,然后计算为"蛋白质积累指数"(图4A,以及在协议部分中详细描述)。时间过程实验表明,在预支时vGlut1的积累在30分钟内显著增加(图4B)。另一方面,Munc18-1的积累在2小时开始显著增加,并在4小时达到一个稳定(图4C)。这些数据表明,突触囊泡蛋白vGlut1在预突触中积累的比活性区蛋白Munc18-1要早。Fmr1-KO神经元前突联中的Munc18-1积累比野生型(WT)增加1.5倍(图4C),表明FMRP在Munc18-1积累中的参与。 接下来,为了区分Munc18-1由于从细胞体或局部翻译在斧子中迁移的累积,检查了蛋白质合成抑制剂异体霉素在细胞体存在或不存在的情况下的积累作用(图4D).Anisomycin显著抑制了在斧子中的Munc18-1积累(图4D),表明该积累与蛋白质合成相关。无细胞体的斧突前积累与细胞体无显著差异(图4D)。这些结果表明,前突子中Munc18-1的积累主要来源于斧子,而不是从细胞体中传输Munc18-1。如果突触蛋白的积累通过去除细胞体抑制在斧子前突合,则认为这种减少是由于从细胞体中传输。实际上,当我们检查用荧光染料代谢标记的总新合成蛋白质的积累时,去除细胞体显著减少了新合成蛋白质总量的积累,而与具有细胞体8.虽然与WT相比,Fmr1-KO中的Munc18-1积累增加较多,但异体素抑制了与WT相似水平的积累,去除细胞体对积累没有影响(图4D)。这些结果表明,FMRP参与在斧子中的Munc18-1的局部翻译。
这里提出的代表性结果表明,这种方法适用于研究突触蛋白如何通过时间过程实验有组织地积累,以及检查突触蛋白的来源(从细胞体或局部运输通过去除细胞体(以斧子)进行翻译。

图 1.前突子的形成和从神经元球中取出细胞体的方案。
(A)使用生物素化 LRRTM2 结合链球蛋白珠诱导从 E16 皮质制备的神经元球培养的突触中的前突子。LRRTM2,一种贴页蛋白,结合神经素(NRXN),并充当前突子的组织者。在DIV11-12中,与生物介义LRRTM2细胞外区域(LRRTM2珠)结合的链球蛋白珠被应用于神经元球培养,以诱导前突起。此图已由以前的出版物8修改。(B)黄尖端被切割,以45°角放置在神经元球培养的细胞体区域。细胞体被吸走。请点击此处查看此图的较大版本。

图 2.Munc18-1在神经元球的细胞体存在和缺乏的先增前积累。
(A)使用LRRTM2珠孵育4小时后,在斧头(上面板;实验方案,中间;相位图像,下部)的诱导前突触位点累积活性区蛋白Munc18-1;Munc18-1 累积的 IF 图像)。使用 10 倍镜头和中间放大倍率(1.5 倍)将图像捕获为低放大倍率图像,以查看由神经元球、斧头和珠子组成的整个图像。虚线方块表示神经元球的面积,用于珠子的精确成像位置。比例尺,20 μm(左;原始图像),10 μm(右;放大图像)。(B) Munc18-1即使在斧子中诱导的先发前位点没有细胞体的情况下,也积累得很好。这一结果表明,即使取出细胞体至少4小时,斧子也能存活并形成前突子。
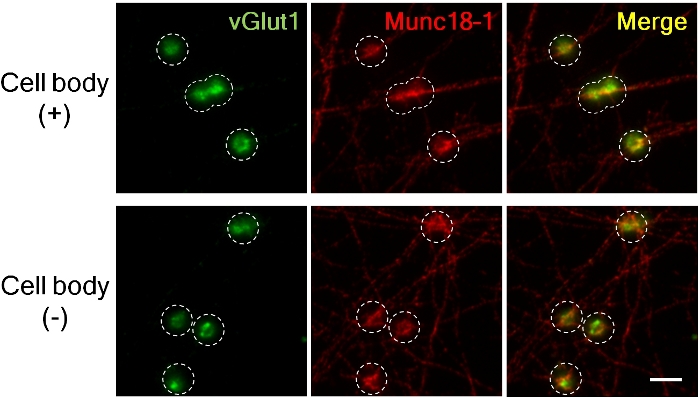
图 3.vGlut1和Munc18-1在带或无细胞体的斧突前积累。
在添加 LRRTM2 珠后 4 h h 中累积的兴奋前突触标记 vGlut1(绿色)和 Munc18-1(红色)。(上面板;带细胞体,下部;无细胞体)。使用 60X 油浸透镜拍摄图像,用于高放大倍率,以测量荧光强度。虚线圆勾勒出珠子的位置。Munc18-1在预突子中存在和没有细胞体时累积了几乎类似的程度,但vGlut1积累减少,没有细胞体8。比例尺,5 μm。请点击此处查看此图的较大版本。

图 4.IF强度测量过程及细胞体去除和蛋白质合成抑制剂对神经元球中Munc18-1积累的影响的程序。
(A)图显示了神经元球培养的诱导前突触位点的IF强度定量方法。刻度条,5 μm。详细情况在协议部分中介绍。(B)用LRRTM2珠诱导的前突子中vGlut1积累的时间过程。显示的数据为 n = 20 的平均 = SEM。双向方差分析与图基的多重比较测试。*p < 0.01。(C)在 WT 和Fmr1-KO 预吸量中,在 LRRTM2 珠子下累积的 Munc18-1 的时间过程。显示的数据为 n = 20 的均值 = SEM,具有 Tukey 多重比较测试的双向方差分析。n.s.,不重要;*p < 0.01,WT 和 KO 之间差异很大。(D)条形图显示MUNc18-1在WT和Fmr1-KO神经元球的先兆中累积水平,在存在或不存在25μM异体素(Aniso)时,有(CB+)或无(CB-)细胞体。显示的数据为 n = 20 的平均 = SEM。双向方差分析与图基的多重比较测试。*p < 0.01, n.s., 不显著。* 指示p < 0.01,与无异种霉素有显著差异。这些数字已由先前出版的第8版修改。请点击此处查看此图的较大版本。
补充图1。LRRTM2-ECR(细胞外区域)和比拉(来自大肠杆菌的生物酶的血酸病毒酶)的比西电子表达载体。
在LRRTM2-ECR和BirA编码序列之间,有一个内部核糖体进入位点(IRES)序列,允许从单个mRNA共同表达这两种蛋白质。hEF1-HTLV启动子驱动在双电子mRNA上表达,两种蛋白质在翻译后通过信号肽序列分泌。LRRTM2-ECR 编码序列附加到多个肽标记序列(DYKDDDDK、TEV、Myc 及其标记)和生物素接受序列 (BAS)。BirA 附加到 DYKDDDDV 标记。分泌的LRRRTM2-ECRBAS序列的BirA生物回酸酯,与链球菌珠结合。请点击此处下载图。
讨论
我们开发了利用神经元球培养法检测用LRRTM2-珠刺激的先增前形成的方法。目前,大多数前突生形成测定包括多-D-流源(PDL)涂层珠和分离培养/微流体室20,21,22。该方法的优点之一是LRRTM2珠子。当LRRTM2与神经素相互作用,形成兴奋的先阴突子,特别是11,12,13,PDL-珠诱导兴奋和抑制预突生非具体20。在这种方法中,其他前突生组织者,其成员超过10个蛋白质3,根据实验目的改变生物浸酯蛋白的细胞外域,适用于诱导前突生。
另一个优势是神经元球培养。在某些情况下,传统的分离文化被用来分析前突子的形成20。然而,分离培养不适合分析前突触中低水平的突触蛋白,因为细胞体和树突中的压倒性信号会干扰前突触中的信号。相反,一些群体在微流体室中使用分离培养物,微流体室是培养斧子和细胞体的特殊装置,分别在2个21,22。使用微流体室,在异体腔中形成斧板,细胞体能够从细胞体室中取出,类似于神经元球培养。然而,微流体室是特殊的仪器,需要一定的技能来维持恒定的培养条件。神经元球培养不需要使用特殊仪器,而且作为一种新的实验方法相对容易被引入。由于神经元球培养的本质只是将神经元细胞聚合体(神经元球)放入玻璃底盘/室,因此可以轻松与其他方法结合使用。例如,认为使用LRRTM2-珠子的神经元球培养适用于高含量筛选,以同时测量10-20个珠区的荧光。
该协议的关键步骤是涂覆 PLL。如果PLL涂层不均匀,神经元球的斧子不会均匀地向所有方向延伸。这干扰了对前突子形成的有效分析。我们使用玻璃盖板和玻璃底餐具,但是,玻璃有时不太干净,用于神经元培养和PLL均匀涂层。在此协议中,首先,玻璃盖玻片和玻璃底洗盘在中性非磷洗涤剂中浸泡1-3次,然后用超纯水洗涤8次。我们使用分子量 > 300,000 的 PLL 来降低其浓度 (15 μg/mL), 以降低不良背景。如果使用 PLL 的较低分子量(例如30,000-70,000),则需要更高浓度 (100 μg/mL) 来延长斧子。
此方法的局限性是神经元球培养不能保持 > DIV15-16。在DIV15-16之后,神经元球的斧子被碎片化。应用 LRRTM2 珠子后,碎片化的斧头不会产生任何前突生。因此,此方法不适用于分析成熟神经元(>DIV21)。然而,在大多数情况下,11,12,21,22,前突子形成测定使用年轻的神经元,培养直到DIV14。另一个限制是,没有细胞体的斧子不能存活超过4小时。我们分析了5个突触蛋白在先期至今的积累,我们检查的所有蛋白质的积累在4小时内几乎达到稳定(未发表的观察)。据认为,突触蛋白在4小时积累足够,以分析突触蛋白来自何处(细胞体或斧子)。
神经元球培养与LRRTM2-珠子的结合相对简单灵活,可以适应许多实验平台。我们已经应用了这种方法来测量前突触活性使用AM1-43染料(未发表的观察)。此方法被认为适用于高通量筛选。预突子形成测定可以通过在LRRTM2-珠下形成的突触前蛋白染色来应用高含量筛选。这种方法将有助于找到治疗神经系统疾病的新化合物。
披露声明
作者没有什么可透露的。
致谢
这项工作部分得到JSPS科学研究援助赠款(C)(第22500336号、25430068号、16K07061号)(Y. Sasaki)的支持。我们感谢野中泰郎博士和木崎美子女士(横滨城市大学)提供生物素素的LRRTM2蛋白。我们还感谢小池和石井的技术援助。
材料
| Name | Company | Catalog Number | Comments |
| Antibody diluent | DAKO | S2022 | |
| Alexa Fluor 594 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-585-151 | |
| Alexa Fluor 488 AffiniPure Donkey Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-545-152 | |
| mouse anti-Munc18-1 | BD Biosciences | 610336 | |
| B-27 Supplement (50X), serum free | Thermo Fisher Scientific | 17504044 | |
| Bovine Serum Alubumin (BSA) | Nacalai Tesque | 01863-48 | |
| Cell-Culture Treated Multidishes (4 well dish) | Nunc | 176740 | |
| Complete EDTA-free | Roche | 11873580001 | |
| cooled CCD camera | Andor Technology | iXON3 | |
| Coverslip | Matsunami | C015001 | Size: 15 mm, Thickness: 0.13-0.17 mm |
| Cytosine β-D-arabinofuranoside (AraC) | Sigma-Aldrich | C1768 | |
| 4',6-Diamidino-2-phenylindole Dihydrochloride (DAPI) | Nacalai Tesque | 11034-56 | |
| Deoxyribonuclease 1 (DNase I) | Wako pure chemicals | 047-26771 | |
| Expi293 Expression System | Thermo Fisher Scientific | A14635 | |
| Horse serum | Sigma-Aldrich | H1270 | |
| image acquisition software | Nikon | NIS-element AR | |
| Image analysis software | NIH | Image J | https://imagej.nih.gov/ij/ |
| Inverted fluorecent microscope | Nikon | Eclipse Ti-E | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | |
| Neurobasal media | Thermo Fisher Scientific | #21103-049 | |
| Normal Goat Serum (NGS) | Thermo Fisher Scientific | #143-06561 | |
| N-propyl gallate | Nacalai Tesque | 29303-92 | |
| Paraformaldehyde (PFA) | Nacalai Tesque | 26126-25 | |
Paraplast Plus | Sigma-Aldrich | P3558 | |
| Poly-L-lysine Hydrobromide (MW > 300,000) | Nacalai Tesque | 28359-54 | |
| poly (vinyl alcohol) | Sigma | P8136 | |
| Prepacked Disposable PD-10 Columns | GE healthcare | 17085101 | |
| rabbit anti-vesicular glutamate transporter 1 | Synaptic Systems | 135-302 | |
| SCAT 20X-N (neutral non-phosphorous detergent) | Nacalai Tesque | 41506-04 | |
| Streptavidin-coated magnetic particles | Spherotech Inc | SVM-40-10 | diameter: 4-5 µm |
| TritonX-100 | Nacalai Tesque | 35501-15 | |
| Trypsin | Nacalai Tesque | 18172-94 |
参考文献
- Waites, C. L., Craig, A. M., Garner, C. C. Mechanisms of Vertebrate Synaptogenesis. Annual Review of Neuroscience. 28 (1), 251-274 (2005).
- Ziv, N. E., Garner, C. C. Cellular and molecular mechanisms of presynaptic assembly. Nature Reviews Neuroscience. 5 (5), 385-399 (2004).
- Chia, P. H., Li, P., Shen, K. Cellular and molecular mechanisms underlying presynapse formation. Journal of Cell Biology. 203 (1), 11-22 (2013).
- Südhof, T. C. Neuroligins and neurexins link synaptic function to cognitive disease. Nature. 455 (7215), 903-911 (2008).
- Saitsu, H., et al. CASK aberrations in male patients with Ohtahara syndrome and cerebellar hypoplasia. Epilepsia. 53 (8), 1441-1449 (2012).
- Friedman, H. V., Bresler, T., Garner, C. C., Ziv, N. E. Assembly of New Individual Excitatory Synapses. Neuron. 27 (1), 57-69 (2000).
- Bresler, T., et al. Postsynaptic density assembly is fundamentally different from presynaptic active zone assembly. The Journal of neuroscience the official journal of the Society for Neuroscience. 24 (6), 1507-1520 (2004).
- Parvin, S., Takeda, R., Sugiura, Y., Neyazaki, M., Nogi, T., Sasaki, Y. Fragile X mental retardation protein regulates accumulation of the active zone protein Munc18-1 in presynapses via local translation in axons during synaptogenesis. Neuroscience Research. , (2018).
- Sasaki, Y., et al. Phosphorylation of Zipcode Binding Protein 1 Is Required for Brain-Derived Neurotrophic Factor Signaling of Local β-Actin Synthesis and Growth Cone Turning. Journal of Neuroscience. 30 (28), 9349-9358 (2010).
- Sasaki, Y., Gross, C., Xing, L., Goshima, Y., Bassell, G. J. Identification of axon-enriched microRNAs localized to growth cones of cortical neurons. Developmental neurobiology. 74 (3), 397-406 (2014).
- Linhoff, M. W., et al. An Unbiased Expression Screen for Synaptogenic Proteins Identifies the LRRTM Protein Family as Synaptic Organizers. Neuron. 61 (5), 734-749 (2009).
- de Wit, J., et al. LRRTM2 Interacts with Neurexin1 and Regulates Excitatory Synapse Formation. Neuron. 64 (6), 799-806 (2009).
- Ko, J., Fuccillo, M. V., Malenka, R. C., Südhof, T. C. LRRTM2 Functions as a Neurexin Ligand in Promoting Excitatory Synapse Formation. Neuron. 64 (6), 791-798 (2009).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature protocols. 1 (5), 2406-2415 (2006).
- Hirai, H., et al. Structural basis for ligand capture and release by the endocytic receptor ApoER2. EMBO reports. , (2017).
- Yasui, N., et al. Functional Importance of Covalent Homodimer of Reelin Protein Linked via Its Central Region. Journal of Biological Chemistry. 286 (40), 35247-35256 (2011).
- Bassell, G. J., Warren, S. T. Fragile X Syndrome: Loss of Local mRNA Regulation Alters Synaptic Development and Function. Neuron. 60 (2), 201-214 (2008).
- Darnell, J. C., Klann, E. The translation of translational control by FMRP: therapeutic targets for FXS. Nat Neurosci. 16 (11), 1530-1536 (2013).
- Richter, J. D., Bassell, G. J., Klann, E. Dysregulation and restoration of translational homeostasis in fragile X syndrome. Nature Reviews Neuroscience. 16 (10), 595-605 (2015).
- Lucido, A. L., et al. Rapid Assembly of Functional Presynaptic Boutons Triggered by Adhesive Contacts. Journal of Neuroscience. 29 (40), 12449-12466 (2009).
- Taylor, A. M., Wu, J., Tai, H. C., Schuman, E. M. Axonal Translation of β-Catenin Regulates Synaptic Vesicle Dynamics. Journal of Neuroscience. 33 (13), 5584-5589 (2013).
- Batista, A. F. R., Martínez, J. C., Hengst, U. Intra-axonal Synthesis of SNAP25 Is Required for the Formation of Presynaptic Terminals. Cell reports. 20 (13), 3085-3098 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。