Method Article
Presynapse Formation Assay Using Presynapse Organizer Beads and "Neuron Ball" Culture
Dans cet article
Résumé
La formation de presynapse est un processus dynamique comprenant l'accumulation de protéines synaptiques dans l'ordre approprié. Dans cette méthode, la formation de presynapse est déclenchée par des perles conjuguées avec une protéine d'organisateur de presynapse sur des feuilles axonales de la culture de « boule de neurone », de sorte que l'accumulation des protéines synaptiques soit facile à analyser pendant la formation de presynapse.
Résumé
Pendant le développement neuronal, la formation de synapse est une étape importante pour établir des circuits neuraux. Pour former des synapses, les protéines synaptiques doivent être fournies dans l'ordre approprié par transport à partir de corps cellulaires et/ou par traduction locale dans des synapses immatures. Cependant, il n'est pas entièrement compris comment les protéines synaptiques s'accumulent dans les synapses dans l'ordre approprié. Ici, nous présentons une nouvelle méthode pour analyser la formation presynaptique en utilisant la combinaison de la culture de boule de neurone avec des perles pour induire la formation de presynapse. Les boules de neurones qui sont des agrégats cellulaires neuronaux fournissent des feuilles axonales loin des corps cellulaires et des dendrites, de sorte que les signaux fluorescents faibles des presynapses peuvent être détectés en évitant les signaux accablants des corps cellulaires. Comme perles pour déclencher la formation de presynapse, nous utilisons des perles conjuguées avec le neuromembrane de transmembrane de répétition leucine-riche 2 (LRRTM2), un organisateur presynaptic excitateur. En utilisant cette méthode, nous avons démontré que le transporteur vésiculaire de glutamate 1 (vGlut1), une protéine synaptique de vésicule, s'est accumulé dans les presynapses plus rapidement que Munc18-1, une protéine active de zone. Munc18-1 a accumulé la traduction-dépendant dans la presynapse même après avoir enlevé des corps cellulaires. Cette constatation indique l'accumulation de Munc18-1 par traduction locale dans les axones, et non par le transport des corps cellulaires. En conclusion, cette méthode convient pour analyser l'accumulation de protéines synaptiques dans les presynapses et la source de protéines synaptiques. Comme la culture neuronale est simple et qu'il n'est pas nécessaire d'utiliser un appareil spécial, cette méthode pourrait s'appliquer à d'autres plates-formes expérimentales.
Introduction
La formation de Synapse est l'une des étapes critiques pendant le développement des circuits neuronaux1,2,3. La formation de synapses qui sont des compartiments spécialisés composés de pré- et de post-synapses est un processus complexe et en plusieurs étapes impliquant la reconnaissance appropriée des axones et des dendrites, la formation de la zone active et la densité postsynaptique, et l'alignement approprié de canaux ioniques et récepteurs neurotransmetteurs1,2. Dans chaque processus, de nombreux types de protéines synaptiques s'accumulent dans ces compartiments spécialisés au bon moment en transportant des protéines synaptiques à partir de corps cellulaires et/ou par traduction locale dans les compartiments. Ces protéines synaptiques sont considérées comme organisées de manière organisée pour former des synapses fonctionnelles. Dysfonctionnement de certaines protéines synaptiques impliquant la formation de synapse entraîne des maladies neurologiques4,5. Cependant, il reste difficile de savoir comment les protéines synaptiques s'accumulent dans le bon timing.
Pour étudier comment les protéines synaptiques s'accumulent de manière organisée, il est nécessaire d'examiner l'accumulation de protéines synaptiques dans l'ordre chronologique. Quelques rapports ont démontré l'imagerie en direct pour observer la formation de synapse dans la culture dissociée des neurones6,7. Cependant, il est long de trouver des neurones qui commencent juste la formation de synapse sous microscopie. Pour observer efficacement l'accumulation de protéines synaptiques, la formation de synapse doit commencer au moment où les chercheurs veulent induire la formation. Le deuxième défi consiste à distinguer l'accumulation de protéines synaptiques due au transport des corps cellulaires ou à la traduction locale dans les synapses. À cette fin, le niveau de traduction est nécessaire pour être mesuré dans la condition qui ne permet pas le transport des protéines synaptiques à partir des corps cellulaires.
Nous avons développé le nouveau presynapse formation d'essayer utilisant la combinaison de la culture de boule de neurone avec des perles pour induire la formation de presynapse8. La culture de boule de neurone est développée pour examiner le phénotype axonal, dû à la formation des feuilles axonales entourant des corps cellulaires9,10. Nous avons utilisé des perles magnétiques conjuguées avec le neuromembrane de transmembrane répéter laleucine-riche 2 (LRRTM2) qui est un organisateur presynaptic pour induire des presynapses excitatrices (figure 1A)11,12,13. En utilisant les perles LRRTM2, la formation de présynapse commence au moment où les perles sont appliquées. Cela signifie que la formation de présynapse commence dans des milliers d'axones d'une boule de neurone en même temps, ce qui permet d'examiner le cours précis du temps de l'accumulation de protéines synaptiques efficacement. En outre, la culture de boule de neurone est facile de bloquer les protéines synaptiques de transport de soma en enlevant des corps cellulaires (figure 1B)8. Nous avons déjà confirmé que les axones sans corps cellulaires peuvent survivre et sont en bonne santé au moins 4 h après l'ablation des corps cellulaires. Ainsi, ce protocole est approprié pour étudier d'où les protéines synaptiques sont dérivées (corps cellulaire ou axone), et comment les protéines synaptiques s'accumulent de manière organisée.
Protocole
Les expériences décrites dans ce manuscrit ont été réalisées selon les lignes directrices décrites par le Comité institutionnel de soins et d'utilisation des animaux de l'Université de la ville de Yokohama.
1. Préparation des boules de neurone comme culture de chute de pendaison (Jours in vitro (DIV) 0-3)
REMARQUE: Les procédures décrites ici pour la préparation de la culture de la balle neuronale sont basées sur la méthode précédemment rapportée par le groupe Sasaki avec quelques modifications9,10. Nous avons également adopté plusieurs procédures de la méthode Banker pour la culture dissociée14.
-
Confirmer les éléments suivants avant de commencer la dissection
- Préparez toutes les solutions requises et stérilisez-les par autoclave/filtration à l'avance.
- Gardez prêt tous les instruments et les matériaux à utiliser à chaque étape de cette culture neuronale corticale.
- Vaporisez et essuyez l'armoire à débit d'air laminaire, la table de dissection, la plaque de scène du stéréomicroscope, les ciseaux et les forceps avec 70% d'éthanol.
- Euthanasier la souris à l'application du CO2 et disséquer l'abdomen pour obtenir des embryons E16.
- Retirez soigneusement le cerveau des embryons à l'aide de fines pointes de forceps et transférez-les dans des plats de culture cellulaire de 60 mm contenant 4 ml de solution de sel tamponné HEPES (HBSS).
REMARQUE : Le milieu de dissection HBSS contient 10 mM HEPES (pH 7,4), 140 mM NaCl, 5,4 mM KCl, 1,09 mM Na2HPO4, 1,1 mM KH2PO4, 5,6 mM D-glucose, et 5,64 M M Phenol rouge. - Retirez le cuir chevelu, coupez l'ampoule olfactive, séparez les cortices de chaque hémisphère cérébral à l'aide des pointes fines des forceps sous stéréomicroscope, et transférez dans un autre plat de 60 mm contenant du HBSS frais. Utilisez au moins 3-5 embryons pour chaque culture neuronale séparée de boule.
- Couper les cortices en petits morceaux avec des ciseaux de ressort microdissés dans une hotte de culture de cellules à flux laminaire.
- Transférer les cortices hachés dans un tube de 15 ml et trypsiniser les cortices hachés en 4 ml de trypsine de 0,125% en HBSS pendant 4,5 min dans un bain d'eau à 37 oC.
REMARQUE: Ce temps de trypsinisation est essentiel pour la culture neuronale efficace que le temps croissant (-gt; 4.5 min) conduit à des neurones beaucoup plus morts. - Transférer les agrégats cellulaires dans un nouveau tube de 15 ml contenant 10 ml de HBSS par une pipette de transfert stérile, et couver à 37 oC pendant 5 min. Répétez cette étape une fois de plus.
- Transférer les agrégats cellulaires dans un nouveau tube de 15 ml contenant 2 ml de milieu xneurobasal contenant GlutaMax, supplément B27 (milieu NGB), 0,01% DNase I et 10% sérum de cheval.
- Triturate les cortices trypsinisés en les faisant monter et descendre à plusieurs reprises (3-5 fois) à l'aide d'une pipette Pasteur en verre fin polie par le feu.
REMARQUE : Le diamètre de la pipette Pasteur en verre fin poli par le feu est très important comme décrit dans le papier de méthode de banquier14. Si la pipette est trop étroite pour passer des cortices, préparez des pipettes possédant 2-3 tailles différentes, et essayez de plus grandes pipettes. - Pour préparer les boules de neurones, prenez la suspension cellulaire ci-dessus et ajustez la densité cellulaire à 1 x 106 cellules/mL à l'aide du milieu NGB.
- Culture les neurones corticaux comme des gouttes suspendues contenant 10.000 cellules / goutte (1 goutte est de 10 L) à l'intérieur des couvercles supérieurs de 10 cm de la culture des plats.
- Ajouter 7 ml de phosphate tamponné salin (PBS) à la partie inférieure des plats de culture, puis conserver dans un incubateur pendant 3 jours à 37 oC avec 5% de CO2 sous condition humidifiée pour permettre la formation de la boule de neurones.
2. Placer des boules de neurone sur des couvertures en verre enduites de PLL et l'entretien de culture (DIV 3-11)
REMARQUE : Avant d'enrober les couvercles de verre avec de la poly-L-lysine (PLL), il est important de laver les résilles à l'aide de détergent. Les couvercles en verre ne sont parfois pas aussi propres pour la culture neuronale et le revêtement uniforme avec PLL. Le revêtement non uniforme de PLL peut avoir comme conséquence l'extension axonale inégale des boules de neurone.
- Faire tremper les couvercles dans 1/20 détergent neutre dilué non phosphoreux dans des supports en céramique pendant 1-3 nuitées.
- Laver les couvercles 8 fois dans de l'eau ultrapure, puis stériliser au four à 200 oC pendant 12 h.
REMARQUE: Toutes les étapes à partir d'ici doivent être faites dans un hotte de culture de cellules de flux d'air laminaire. - Transférer les feuilles de couverture cuites dans des plats de 100 mm. Après sceller le plat par parafilm entre un couvercle et un plat de fond, les couvertures cuites au four peuvent être conservées pour un stockage à long terme.
- (Facultatif) Appliquer des points de paraffine sur les couvertures. Les points font de l'espace pour empêcher les boules de neurones se détacher des couvertures pendant l'immunostaining par contact direct des boules de neurone à la vaisselle en plastique. Faire fondre la paraffine dans une bouteille appropriée dans un bain d'eau chaude à environ 90 oC. Trempez une pipette Pasteur dans la paraffine, puis touchez-la rapidement pour faire trois endroits près du bord d'un bordereau.
- Enduisez le PLL (MW à 300 000 euros) sur les couvercles en verre perlés de paraffine dans des plats de 60 mm à l'aide d'une solution PLL (15 g/mL dans un tampon de borate), et conservez-les pendant au moins 1 h dans un incubateur de CO 2.
- Après avoir lavé 4 fois avec du PBS, transférer les plaques de couverture enduites de PLL dans une plaque de 4 puits contenant 350 ll de milieu NGB dans chaque puits et de l'hydrochlorure cytosine-D-arabinofuranoside (AraC, 3 M) dans les médias pour tuer les cellules de division.
- Gardez cette plaque de 4 puits contenant les plaques de couverture recouvertes de PLL dans l'incubateur CO2 au moins pendant 20 min pour s'assurer que la température du milieu atteint 37 oC avant de transférer les boules de neurones.
- Au DIV 3 lorsque les « boules de neurones » se forment très bien, transférez-les sur des couvertures recouvertes de PLL à l'intérieur de la plaque à 4 puits (5 boules de neurones/bien) conservées dans l'incubateur de CO2.
- Après 48 h, remplacer le milieu de culture de boule de neurone avec le milieu frais AraC-libre de NGB. Utilisez une plaque chauffante dans un capuchon de culture de cellules d'écoulement d'air laminaire dont la température est maintenue prête à 37 oC immédiatement avant cette procédure.
REMARQUE : Il est nécessaire d'effectuer le changement de milieu aussi rapidement que possible sur une plaque chaude pour réduire le temps que les cultures sont à l'extérieur de l'incubateur de CO 2. - Gardez cette culture de boule de neurone dans l'incubateur de CO2 pour jusqu'à DIV 11.
REMARQUE : À DIV 11-12, des boules de neurones prolongeant les neurites jusqu'à 1-2 mm sont utilisées pour des expériences.
3. Appliquer des perles LRRTM2 sur la culture de boule de neurone avec ou sans corps cellulaires (DIV 11-12)
REMARQUE: Avant l'application des perles LRRTM2 sur la culture de boule de neurone, il est recommandé d'enlever les corps cellulaires. Par conséquent, préparer des perles LRRTM2 dans un premier temps, puis enlever les corps cellulaires et plus tard appliquer des perles LRRTM2 à la culture dès que possible. Le LRRTM2 biotinylated est fourni par le groupe de Nogi (Université de la ville de Yokohama) comme milieu conditionné. Ils utilisent un vecteur d'expression comprenant la séquence d'accepteur de biotine et la ligase de biotine de E. coli coli (Bira) 15 Annonces , 16 pour attacher la biotine au LRRTM2, et le vecteur d'expression est transfecté aux cellules Expi293F incluses dans le système d'expression Expi293. L'information sur les vecteurs est disponible dans la figure 1 supplémentaire. Biotinylated LRRTM2-conjugué streptavidin perles réduites fond de l'immunostaining considérablement comparé à LRRTM2-Fc -protéines conjuguées A perles qui sont utilisées pour le prototype LRRTM2 système8.
-
Préparation de perles LRRTM2 biotinylated
- Pour enlever l'excès de biotine du milieu conditionné des cellules d'Expi293F exprimant le LRRTM2 biotinylated, appliquez 1.7 ml du milieu conditionné mélangé avec 0.8 ml de PBS (total 2.5 mL) à la colonne de filtration de gel de PD-10. La colonne PD-10 est pré-équilibrée avec 25 ml d'eau ultrapure et 25 ml de PBS.
- Elute avec 3,5 mL de PBS et de recueillir le flux à travers comme un stock LRRTM2.
REMARQUE : Ce stock LRRTM2 peut être distribué aux aliquots et stocké à -80 oC à long terme. Les niveaux d'expression du LRRTM2 biotinylated varient parfois d'un lot à l'autre. Ainsi, le volume approprié de stock de LRRTM2 pour conjuguer aux perles devrait être déterminé pour former des presynapses assez sur des boules de neurone, quand le nouveau lot de stock de LRRTM2 est employé à la première fois. - Prendre 20 L de la suspension des particules magnétiques enduites de streptavidin (diamètre : 4-5 m) à un tube de microcentrifuge. Immobiliser les perles à un appareil fait à la main attaché avec des aimants permanents au néodyme et laver trois fois avec 100 L de PBS-MCBC dans des tubes microcentrifuges de 1,5 ml.
REMARQUE: PBS-MCBC contient PBS, y compris 5 mM MgCl2, 3 mM CaCl2, 0,1% BSA, et 0,1% complet SANS EDTA. - Après avoir retiré complètement PBS-MCBC des perles, ajouter le volume prédéterminé du stock de LRRTM2 (habituellement de 500 à 1 000 l, voir Note 3.1.2) aux perles lavées. Incuber le mélange à l'aide d'un rotateur à 4 oC pendant 1 à 2 h.
- Laver les perles deux fois avec 100 L de PBS-MCBC, et plus tard avec 100 'L de milieu NGB.
- Resuspendre les perles LRRTM2 dans 50 'L de milieu NGB pour l'application à la culture de boule de neurone.
- Utilisez les mêmes procédures pour préparer les perles témoins (contrôle négatif) dans un autre tube de microcentrifuge, sauf en ajoutant des protéines biotinylated-LRRTM2.
-
Retrait des corps cellulaires des boules de neurones à DIV 11-12 et application de perles LRRTM2
- Étiquetez les puits d'une plaque à 4 puits comme « Corps cellulaire ») et « Corps cellulaire (-)».
- Couper la fin d'une pointe jaune à un angle de 45 degrés à l'aide d'une lame de rasoir préalablement pulvérisée avec 70 % d'éthanol sous stéréomicroscope (Figure 1B).
- Placez l'extrémité jaune de pointe sur la zone du corps cellulaire d'une boule de neurone et enlevez les corps cellulaires par aspiration (figure 1B).
- Pour identifier chaque condition spécifiée de l'expérience, étiquetez à nouveau les puits comme « perles LRRTM2 » et « Perles de contrôle ».
- Appliquer le LRRTM2 et contrôler les perles sur la culture de la boule de neurones, et immerger au fond des plaques pendant 1 min à l'aide d'aimants ferrite pour commencer la formation de présynapse. Cette procédure assure le toucher des roues de toutes les perles en même temps. En particulier, il serait efficace pour l'incubation à court terme (par exemple, 30 min et 1 h) avec des perles LRRTM2 synchrone.
- Pour effectuer des expériences de cours dans le temps, étiquetez chaque bien séparé ainsi que 0 min, 30 min, 1 h, 2 h, 4 h et 18 h et appliquez des perles LRRTM2 aux intervalles de temps indiqués.
- Après l'ajout de perles LRRTM2, incuber la culture de boule de neurone avec les perles pour le temps spécifié (0 min à 18 h) pour former des presynapses.
4. Immunostaining et microscopie
REMARQUE: Fixer les cellules pendant 4 h par incubation avec des perles LRRTM2 dans les conditions expérimentales avec et sans corps cellulaires, que les axones ont tendance à mourir progressivement en l'absence de corps cellulaires après 4 h. Dans le cas du cours de temps avec des perles de LRRTM2, fixez les cellules à l'heure spécifiée indiquée.
-
Fixation et coloration des neurones dans la culture de la boule de neurones après la formation de presynapse avec des perles LRRTM2
- Retirez le milieu NGB et fixez les boules de neurone avec 4% de PFA en PBS (250 l/puits) pendant 20 min à température ambiante, puis lavez-les avec 500 L de PBS 4 fois par 5 min.
- Laver les cellules fixes avec le SCT (Saline tamponnée tris : 50 mM Tris-HCl (pH 7,3) et 150 mM NaCl) pendant plus de 5 min.
- Perméabilize les cellules / axones de la culture balle neuronale avec TBS contenant 0,3% Triton X-100 pendant 5 min.
- Gardez les cellules 1 h pour bloquer avec un tampon de blocage (0,1% Triton X-100 et 5% NGS (sérum de chèvre normal) dans le SCT).
- Incuber les cellules avec des anticorps primaires; anti-lapin-vGlut1 (transporteur de glutamate vésiculaire 1 (1:4000)) et anti-souris-Munc18-1 (1:300) dilué avec diluant d'anticorps pendant la nuit à 4 oC.
- Laver les rématographes 4 fois à l'immunofluorescence (IF) tampon (0,1% Triton X-100 et 2% BSA dans le SCT) et incuber pendant 30 min avec fluorophore (teinture Alexa)-conjugué 2e anticorps; anti-souris-IgG-Alexa 555 (1:500), anti-lapin-IgG-Alexa 488 (1:1000).
- Tainer les noyaux des corps cellulaires des neurones pendant 5 min avec 4,6-diamidino-2-phéenylindole (DAPI, 1 g/mL) en PBS.
- Laver les rémaquilles trois fois avec du PBS, puis monter sur des lames de verre à l'aide de supports de montage contenant 167 mg/mL d'alcool poly (vinyle) et 6 mg/mL de galyle N-propyl.
- Conserver les lames de verre dans un réfrigérateur à -20 oC jusqu'à ce que la microscopie soit microscopie. Les signaux fluorescents des lames de verre sont détectables pendant au moins 1 an lorsque les glissières sont stockées à -20 oC.
-
Prendre des images sous microscope à fluorescence
- Capturez le contraste différentiel d'interférence et les images de SI sous un microscope fluorescent inversé avec une caméra CCD refroidie utilisant la lentille d'immersion d'huile 60X. Pour les logiciels d'acquisition d'images, utilisez un système de microscope installé par logiciel. Utilisez Image J comme logiciel d'analyse d'images.
- Mesurer l'intensité de la FI dans les presynapses en axone en utilisant la formule suivante; Intensités DE la région d'intérêt sur les perles (ROI) - Intensité de la région des perles hors/axonal le long de 20 m à partir de perles - intensité de fond. Cette intensité de ratio fournit l'indice d'accumulation de protéines (figure 4A). Accomplir les mesures sur des images 16 bits originales à l'aide du logiciel Image J.
- Pour quantifier le niveau d'accumulation de protéines particulières dans la presynapse induite par les perles LRRTM2, sélectionnez toujours la zone loin de 2 champs de vision ou plus en dehors du corps cellulaire avec microscope (60X).
REMARQUE : La sélection de la zone dans la boule de neurone pour l'imagerie est cruciale car les axones denses sont près du corps cellulaire et la périphérie de la boule de neurone peut fournir l'axone simple. - Pour une mesure précise, choisissez un champ axonal 5-différent (distance similaire des corps cellulaires)/coverslip.
- Maintenir des conditions d'imagerie identiques à différents jours et entre les expériences
Résultats
Ici, nous montrons des résultats représentatifs de l'accumulation des protéines presynaptiques dans les presynapses LRRTM2-induites des feuilles axonales de la culture de boule de neurone. En tant que protéines presynaptiques, nous avons analysé la protéine synaptique excitatrice de vésicule vGlut1 et la protéine de zone active Munc18-1. Nous avons également examiné le cours de temps de l'accumulation de vGlut1 et de Munc18-1 dans les presynapses, et avons obtenu des résultats indiquant la source de Munc18-1 dans les presynapses utilisant des axones enlevant des corps cellulaires et un inhibiteur de synthèse de protéine. Récemment, nous avons étudié un rôle de la protéine de retard mental fragile X (FMRP) sur l'accumulation de Munc18-1 dans les presynapses8. FMRP, qui est un produit génétique causatif du syndrome de L'X fragile (FXS), est une protéine de liaison de l'ARNm pour supprimer la traduction17,18,19. Nous avons également examiné la participation de FMRP dans l'accumulation de Munc18-1 utilisant des souris de modèle de FXS qui est déficiente dans le gène Fmr1 codant FMRP.
Application de l'application de lRRTM2-perles dans la culture de boule de neurone à DIV11 accumulation induite de Munc18-1 dans les presynapses des axones des boules de neurone (figure 2A). Même dans les axones qui sont enlevés corps cellulaires, l'accumulation de Munc18-1 a été observée sous les perles similaires comme des axones de boules de neurones avec des corps cellulaires (Figure 2B). Dans le cas typique, plus de 80% des perles après 4 h-incubation avec des boules de neurone peuvent induire l'accumulation des protéines synaptiques dans les presynapses, jugé en tactant Munc18-1 et vGlut-1. Étant donné que les axones sont tellement encombrés et superposés près des corps cellulaires (Figure 2Aa, Ba), une région plus périphérique des feuilles axonales a été mesurée lorsque les axones ne sont pas si superposés ( Figure2Ab, Bb, p. ex., zone périphérique éloignée de 2 champs de vue ou plus en dehors du corps cellulaire avec microscope (60X)). Lorsque la région périphérique de la feuille axonale a été analysée par lentille objective à forte grossissement (60X), vGlut1 et Munc18-1 se sont accumulées clairement dans les présynapses d'axones sous les perles (figure 3). Parfois, les signaux fluorescents des protéines vésiculaires synaptiques comme vGlut1 sont difficiles à détecter dans la région axonale en dehors des perles, parce que ces protéines vésiculaires synaptiques s'accumulent tellement sous les perles. Dans le cas de Munc18-1, les signaux fluorescents peuvent être détectés faiblement dans la région axonale en dehors des perles.
Pour quantifier le niveau d'accumulation des protéines synaptiques dans les presynapses induites par les perles LRRTM2, les intensités fluorescentes des axones sous les perles et à l'extérieur des perles ont été mesurées, puis calculées comme « indice d'accumulation de protéines » (figure 4A, et décrit en détail dans la section protocole). Les expériences de cours dans le temps ont démontré que l'accumulation de vGlut1 dans les presynapses a augmenté de façon significative à 30 min (figure 4B). D'autre part, l'accumulation de Munc18-1 a commencé à augmenter de manière significative à 2 h, et a atteint un plateau à 4 h (figure 4C). Ces données indiquent que la protéine synaptique vésicule vGlut1 s'accumule en presynapses plus tôt que la protéine de zone active Munc18-1. L'accumulation de Munc18-1 dans les présynapses des neurones Fmr1-KOa augmenté 1,5 fois plus que celles de type sauvage (WT) (figure 4C), indiquant la participation du FMRP dans l'accumulation de Munc18-1. Ensuite, pour distinguer l'accumulation de Munc18-1 due au transport des corps cellulaires ou à la traduction locale en axones, un effet de l'anisomycine, inhibiteur de la synthèse des protéines, a été examiné sur l'accumulation en présence ou en absence de corps cellulaires (figure 4D) . L'anisomycine a supprimé l'accumulation de Munc18-1 de manière significative dans les axones (Figure 4D), indiquant que l'accumulation est protéine-dépendante. L'accumulation de presynapses d'axones sans corps cellulaires n'était pas significativement différente de celle des corps cellulaires (Figure 4D). Ces résultats suggèrent que l'accumulation de Munc18-1 dans les presynapses sont dérivées principalement des axones, mais pas le transport de Munc18-1 des corps cellulaires. Si l'accumulation de protéines synaptiques est supprimée dans les presynapses des axones en enlevant les corps cellulaires, on considère que cette diminution est due au transport des corps cellulaires. En fait, lorsque nous avons examiné l'accumulation de protéines nouvellement synthétisées totales métaboliquement étiquetées par colorant fluorescent, l'élimination des corps cellulaires a réduit de manière significative l'accumulation de protéines totales nouvellement synthétisées, par rapport aux présynapses d'axones avec corps cellulaires8. Bien que l'accumulation de Munc18-1 dans Fmr1-KOait augmenté plus par rapport à WT, l'anisomycine a supprimé l'accumulation dans le niveau semblable à WT et enlever des corps de cellules n'a eu aucun effet sur l'accumulation (figure 4D). Ces résultats suggèrent que FMRP est impliqué dans la traduction locale de Munc18-1 en axones.
Les résultats représentatifs présentés ici démontrent que cette méthode convient pour étudier comment les protéines synaptiques s'accumulent de manière organisée par des expériences de cours temporels, et pour examiner la source des protéines synaptiques (transport à partir de corps cellulaires ou locaux traduction en axones) en enlevant les corps cellulaires.

Figure 1. Schéma de formation de presynapse et d'enlèvement des corps cellulaires de la boule de neurone.
(A) Présynapse formation d'analyse à l'aide de perles de streptavidin conjugués ltretavidin biotinylated LRRTM2 pour induire les presynapses dans les axones de la culture de boule de neurone préparés à partir des cortices d'E16. LRRTM2, une protéine postsynaptique, lie la neurexine (NRXN) et agit comme un organisateur de présynapse. Des perles de Streptavidin conjuguées aux régions extracellulaires biotinylated de LRRTM2 (perles de LRRTM2) ont été appliquées à DIV11-12 à la culture de boule de neurone pour induire des presynapses. Ce chiffre a été modifié par rapport à la publication précédente8. (B) L'extrémité jaune de pointe a été coupée et placée sur la zone de corps cellulaire de la culture de boule de neurone à l'angle de 45. Les corps cellulaires ont été enlevés par aspiration. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2. Accumulation de Munc18-1 dans les presynapses en présence et l'absence des corps cellulaires de la boule de neurone.
(A) Après 4 h d'incubation avec des perles LRRTM2, la protéine de zone active Munc18-1 s'est accumulée aux sites presynaptiques induits en axones (panneau supérieur; schéma expérimental, milieu; image de phase, inférieure; Images SI de l'accumulation Munc18-1). Les images ont été capturées sous forme d'images à faible grossissement à l'aide de l'objectif 10X et du grossissement intermédiaire (1,5X) pour voir l'ensemble de l'image composée d'une boule de neurones, d'axones et de perles. Les carrés en pointillés indiquent la zone de la boule de neurone pour la position précise d'imagerie des perles. Barre d'échelle, 20 m (gauche; image originale), 10 m (droite ; image agrandie). (B) Munc18-1 s'est très bien accumulé même en l'absence de corps cellulaires aux sites presynaptiques induits dans les axones. Ce résultat indique que les axones peuvent survivre et former des presynapses même après avoir enlevé les corps cellulaires pendant au moins 4 h. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
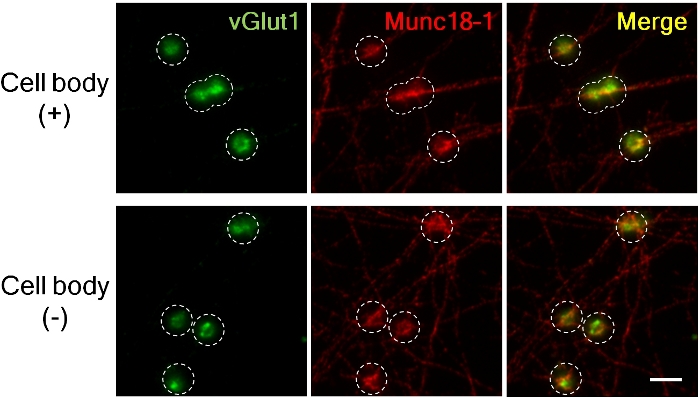
Figure 3. Accumulation de vGlut1 et Munc18-1 dans les presynapses d'axones avec et sans corps cellulaires.
Le marqueur presynaptique excitateur vGlut1 (vert) et Munc18-1 (rouge) se sont accumulés en presynapses 4 h après l'ajout de perles LRRTM2. (panneau supérieur; avec les corps cellulaires, plus bas; sans corps cellulaires). Des images ont été capturées à l'aide de la lentille d'immersion d'huile 60X pour un grossissement élevé afin de mesurer l'intensité fluorescente. Le cercle en pointillés a décrit la position des perles. Munc18-1 a accumulé l'étendue presque semblable en présence et l'absence des corps cellulaires dans les presynapses mais l'accumulation de vGlut1 est réduite sans corps cellulaires8. Barre d'échelle, 5 m. S'il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 4. Procédure de mesure de l'intensité DE FI et de l'impact de l'enlèvement des corps cellulaires et de l'inhibiteur de synthèse des protéines sur l'accumulation de Munc18-1 dans les boules de neurones.
(A) Le diagramme a montré la méthode de quantification de l'intensité de IF à un emplacement induit-presynaptic dans l'axone de la culture de boule de neurone. Barre d'échelle, 5 m. Les détails sont décrits dans la section protocole. (B) Cours de temps de l'accumulation de vGlut1 dans les presynapses induites avec des perles de LRRTM2. Les données présentées sont moyennes ' SEM pour n '20. ANOVA bidirectionnel avec le test de comparaison multiple de Tukey. p 'lt; 0.01. (C) Cours de temps de l'accumulation de Munc18-1 dans les presynapses WT et Fmr1-KO sous les perles LRRTM2. Les données présentées sont moyennes - SEM pour n '20, ANOVA bidirectionnel avec le test de comparaison multiple de Tukey. n.s., pas significatif; p lt; 0,01, significativement différent entre WT et KO. (D) Le graphique à barres a montré le niveau d'accumulation de Munc18-1 dans les présynapses des boules de neurones WT et Fmr1-KO en présence ou en absence de 25 m d'anisomycine (Aniso) avec (CB) ou sans (CB-) corps cellulaires. Les données présentées sont moyennes ' SEM pour n '20. ANOVA bidirectionnel avec le test de comparaison multiple de Tukey. p lt; 0,01, n.s., pas significatif. - indiqué p 'lt; 0.01, sensiblement différent avec et sans anisomycine. Ces chiffres ont été modifiés par rapport à la publication précédente8. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Figure supplémentaire 1. Vecteur d'expression bicystronique pour LRRTM2-ECR (Région extracellulaire) et BirA (ligase de biotine de E. coli ).
Entre les séquences de codage LRRTM2-ECR et BirA, il existe une séquence interne de site d'entrée ribosomal (IRES) qui permet de co-exprimer les deux protéines à partir d'UN seul ARNm. hEF1-HTLV promoteur lecteurs expresson l'ARNm bicstronique, et les deux protéines sont sécrétées par des séquences de peptide de signal après la traduction. La séquence de codage LRRTM2-ECR est jointe à plusieurs séquences d'étiquettes peptidiques (DYKDDDDK, TEV, Myc et ses balises) et Biotin Acceptor Sequence (BAS). BirA est attaché à l'étiquette DYKDDDDV. BirA sécrété biotinylates lysine de la séquence BAS de LRRRTM2-ECR pour se lier aux perles de streptavidine. S'il vous plaît cliquez ici pour télécharger le chiffre.
Discussion
Nous avons développé la nouvelle méthode pour examiner la formation de presynapse stimulée avec des perles de LRRTM2 utilisant la culture de boule de neurone. Actuellement, la plupart des tests de formation de presynapse comprennent des perles enduites de poly-D-lysine (PDL) et une culture dissociée/chambre microfluidique20,21,22. L'un des avantages de cette méthode est l'alds LRRTM2. Tandis que LRRTM2 interagit avec la neurexine pour former des presynapses excitatrices spécifiquement11,12,13, PDL-perles induit à la fois excitatrices et inhibiteurs presynapses non spécifiquement20. Dans cette méthode, d'autres organisateurs de presynapse, dont les membres sont plus de 10 protéines3, sont applicables pour induire des presynapses en changeant le domaine extracellulaire de la protéine biotinylated selon le but expérimental.
Un autre avantage est la culture de boule de neurone. Dans certains cas, la culture dissociée conventionnelle a été utilisée pour analyser la formation de presynapse20. Cependant, la culture dissociée n'est pas appropriée pour analyser de faibles niveaux de protéines synaptiques dans les presynapses, parce que les signaux accablants dans les corps cellulaires et les dendrites interfèrent les signaux dans les presynapses. Au lieu de cela, certains groupes utilisent la culture dissociée dans la chambre microfluidique qui est un appareil spécial pour la culture des axones et des corps cellulaires séparément en 2 comprtments21,22. Utilisant la chambre microfluidique, la feuille axonale est formée dans le compartiment axonal, et les corps cellulaires peuvent être enlevés du compartiment de corps cellulaire, semblable à la culture de boule de neurone. Cependant, la chambre microfluidique est un appareil spécial, et nécessite certaines compétences pour maintenir une condition de culture constante. La culture de boule de neurone n'est pas nécessaire d'employer l'appareil spécial, et est relativement facile d'être présentée comme nouvelle méthode expérimentale. Parce que l'essence de la culture de boule de neurone est juste de placer les agrégats neuronaux de cellules (boules de neurone) au plat de verre-bas/chambre, il peut être facilement combiné avec d'autres méthodes. Par exemple, on considère que la culture de boule de neurone utilisant des perles de LRRTM2 est applicable pour le criblage à haute teneur pour mesurer la fluorescence de 10-20 secteurs de perles en même temps.
L'étape critique de ce protocole est le revêtement avec PLL. Si le revêtement De PLL n'est pas uniforme, les axones des boules de neurone ne s'étendraient pas uniformément dans toutes les directions. Cela perturbe l'analyse efficace de la formation de la présynapse. Nous utilisons des couvercles en verre et des plats à fond de verre, cependant, le verre n'est parfois pas si propre pour la culture neuronale et le revêtement uniforme avec PLL. Dans ce protocole, dans un premier temps, les couvercles en verre et les plats à fond de verre sont trempés dans un détergent neutre non phosphoreux pendant 1-3 pendant la nuit, puis lavés 8 fois avec de l'eau ultrapure. Nous utilisons le PLL dont le poids moléculaire est de 300 000 euros pour réduire sa concentration (15 g/mL) pour un arrière-plan indésirable inférieur. Si l'on utilise un poids moléculaire plus faible de LaPL(p. ex., 30 000 à 70 000) pour prolonger les axones.
Limitation de cette méthode est que la culture de boule de neurones ne peut pas maintenir 'gt; DIV15-16. Les axones des boules de neurone sont fragmentés après DIV15-16. Les axones fragmentés ne produisent aucune presynapse après l'application de perles LRRTM2. Ainsi, cette méthode n'est pas applicable pour analyser les neurones matures (dIV21). Cependant, dans la plupart des cas11,12,21,22, presynapse formation d'assay utilise des neurones plus jeunes qui sont cultivés jusqu'à DIV14. Une autre limitation est que les axones sans corps cellulaires ne peuvent pas survivre plus de 4 h. Nous avons analysé l'accumulation de 5 protéines synaptiques dans les presynapses jusqu'ici, l'accumulation de toutes les protéines que nous avons vérifiées a atteint presque plateau dans un rayon de 4 h (observation non publiée). On considère que les protéines synaptiques s'accumulent suffisamment à 4 h pour analyser d'où les protéines synaptiques sont dérivées (corps cellulaire ou axone).
La combinaison de la culture neuronale de boule avec des perles de LRRTM2 est relativement simple et flexible pour adapter beaucoup de plates-formes expérimentales. Nous avons déjà appliqué cette méthode pour mesurer l'activité présynaptique à l'aide de colorant AM1-43 (observation non publiée). Cette méthode est considérée comme applicable pour le dépistage à haut débit. L'analyse de formation de presynapse est possible d'appliquer le criblage à haute teneur en taclant des protéines synaptiques dans les presynapses formées sous des perles de LRRTM2. Cette méthode contribuerait à trouver de nouveaux composés pour guérir les maladies neurologiques.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Ce travail est en partie soutenu par JSPS Grant-in-Aid for Scientific Research (KAKENHI) (C) (No. 22500336, 25430068, 16K07061) (Y. Sasaki). Nous remercions le Dr Terukazu Nogi et Mme Makiko Neyazaki (Yokohama City University) d'avoir gentiment fourni des protéines LRRTM2 biotinylated. Nous remercions également Honami Uechi et Rie Ishii pour leur assistance technique.
matériels
| Name | Company | Catalog Number | Comments |
| Antibody diluent | DAKO | S2022 | |
| Alexa Fluor 594 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-585-151 | |
| Alexa Fluor 488 AffiniPure Donkey Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-545-152 | |
| mouse anti-Munc18-1 | BD Biosciences | 610336 | |
| B-27 Supplement (50X), serum free | Thermo Fisher Scientific | 17504044 | |
| Bovine Serum Alubumin (BSA) | Nacalai Tesque | 01863-48 | |
| Cell-Culture Treated Multidishes (4 well dish) | Nunc | 176740 | |
| Complete EDTA-free | Roche | 11873580001 | |
| cooled CCD camera | Andor Technology | iXON3 | |
| Coverslip | Matsunami | C015001 | Size: 15 mm, Thickness: 0.13-0.17 mm |
| Cytosine β-D-arabinofuranoside (AraC) | Sigma-Aldrich | C1768 | |
| 4',6-Diamidino-2-phenylindole Dihydrochloride (DAPI) | Nacalai Tesque | 11034-56 | |
| Deoxyribonuclease 1 (DNase I) | Wako pure chemicals | 047-26771 | |
| Expi293 Expression System | Thermo Fisher Scientific | A14635 | |
| Horse serum | Sigma-Aldrich | H1270 | |
| image acquisition software | Nikon | NIS-element AR | |
| Image analysis software | NIH | Image J | https://imagej.nih.gov/ij/ |
| Inverted fluorecent microscope | Nikon | Eclipse Ti-E | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | |
| Neurobasal media | Thermo Fisher Scientific | #21103-049 | |
| Normal Goat Serum (NGS) | Thermo Fisher Scientific | #143-06561 | |
| N-propyl gallate | Nacalai Tesque | 29303-92 | |
| Paraformaldehyde (PFA) | Nacalai Tesque | 26126-25 | |
Paraplast Plus | Sigma-Aldrich | P3558 | |
| Poly-L-lysine Hydrobromide (MW > 300,000) | Nacalai Tesque | 28359-54 | |
| poly (vinyl alcohol) | Sigma | P8136 | |
| Prepacked Disposable PD-10 Columns | GE healthcare | 17085101 | |
| rabbit anti-vesicular glutamate transporter 1 | Synaptic Systems | 135-302 | |
| SCAT 20X-N (neutral non-phosphorous detergent) | Nacalai Tesque | 41506-04 | |
| Streptavidin-coated magnetic particles | Spherotech Inc | SVM-40-10 | diameter: 4-5 µm |
| TritonX-100 | Nacalai Tesque | 35501-15 | |
| Trypsin | Nacalai Tesque | 18172-94 |
Références
- Waites, C. L., Craig, A. M., Garner, C. C. Mechanisms of Vertebrate Synaptogenesis. Annual Review of Neuroscience. 28 (1), 251-274 (2005).
- Ziv, N. E., Garner, C. C. Cellular and molecular mechanisms of presynaptic assembly. Nature Reviews Neuroscience. 5 (5), 385-399 (2004).
- Chia, P. H., Li, P., Shen, K. Cellular and molecular mechanisms underlying presynapse formation. Journal of Cell Biology. 203 (1), 11-22 (2013).
- Südhof, T. C. Neuroligins and neurexins link synaptic function to cognitive disease. Nature. 455 (7215), 903-911 (2008).
- Saitsu, H., et al. CASK aberrations in male patients with Ohtahara syndrome and cerebellar hypoplasia. Epilepsia. 53 (8), 1441-1449 (2012).
- Friedman, H. V., Bresler, T., Garner, C. C., Ziv, N. E. Assembly of New Individual Excitatory Synapses. Neuron. 27 (1), 57-69 (2000).
- Bresler, T., et al. Postsynaptic density assembly is fundamentally different from presynaptic active zone assembly. The Journal of neuroscience the official journal of the Society for Neuroscience. 24 (6), 1507-1520 (2004).
- Parvin, S., Takeda, R., Sugiura, Y., Neyazaki, M., Nogi, T., Sasaki, Y. Fragile X mental retardation protein regulates accumulation of the active zone protein Munc18-1 in presynapses via local translation in axons during synaptogenesis. Neuroscience Research. , (2018).
- Sasaki, Y., et al. Phosphorylation of Zipcode Binding Protein 1 Is Required for Brain-Derived Neurotrophic Factor Signaling of Local β-Actin Synthesis and Growth Cone Turning. Journal of Neuroscience. 30 (28), 9349-9358 (2010).
- Sasaki, Y., Gross, C., Xing, L., Goshima, Y., Bassell, G. J. Identification of axon-enriched microRNAs localized to growth cones of cortical neurons. Developmental neurobiology. 74 (3), 397-406 (2014).
- Linhoff, M. W., et al. An Unbiased Expression Screen for Synaptogenic Proteins Identifies the LRRTM Protein Family as Synaptic Organizers. Neuron. 61 (5), 734-749 (2009).
- de Wit, J., et al. LRRTM2 Interacts with Neurexin1 and Regulates Excitatory Synapse Formation. Neuron. 64 (6), 799-806 (2009).
- Ko, J., Fuccillo, M. V., Malenka, R. C., Südhof, T. C. LRRTM2 Functions as a Neurexin Ligand in Promoting Excitatory Synapse Formation. Neuron. 64 (6), 791-798 (2009).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature protocols. 1 (5), 2406-2415 (2006).
- Hirai, H., et al. Structural basis for ligand capture and release by the endocytic receptor ApoER2. EMBO reports. , (2017).
- Yasui, N., et al. Functional Importance of Covalent Homodimer of Reelin Protein Linked via Its Central Region. Journal of Biological Chemistry. 286 (40), 35247-35256 (2011).
- Bassell, G. J., Warren, S. T. Fragile X Syndrome: Loss of Local mRNA Regulation Alters Synaptic Development and Function. Neuron. 60 (2), 201-214 (2008).
- Darnell, J. C., Klann, E. The translation of translational control by FMRP: therapeutic targets for FXS. Nat Neurosci. 16 (11), 1530-1536 (2013).
- Richter, J. D., Bassell, G. J., Klann, E. Dysregulation and restoration of translational homeostasis in fragile X syndrome. Nature Reviews Neuroscience. 16 (10), 595-605 (2015).
- Lucido, A. L., et al. Rapid Assembly of Functional Presynaptic Boutons Triggered by Adhesive Contacts. Journal of Neuroscience. 29 (40), 12449-12466 (2009).
- Taylor, A. M., Wu, J., Tai, H. C., Schuman, E. M. Axonal Translation of β-Catenin Regulates Synaptic Vesicle Dynamics. Journal of Neuroscience. 33 (13), 5584-5589 (2013).
- Batista, A. F. R., Martínez, J. C., Hengst, U. Intra-axonal Synthesis of SNAP25 Is Required for the Formation of Presynaptic Terminals. Cell reports. 20 (13), 3085-3098 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon