Method Article
Presynapse Formation Assay mit Presynapse Organizer Perlen und "Neuron Ball" Kultur
In diesem Artikel
Zusammenfassung
Presynapse Bildung ist ein dynamischer Prozess einschließlich der Ansammlung von synaptischen Proteinen in der richtigen Reihenfolge. Bei dieser Methode wird die Präsynapsebildung durch Perlen ausgelöst, die mit einem präsynapsischen Organizerprotein auf axonalen Blättern der "Neuronball"-Kultur konjugiert werden, so dass die Ansammlung synaptischer Proteine während der Präsynapsebildung leicht zu analysieren ist.
Zusammenfassung
Während der neuronalen Entwicklung ist die Synapsenbildung ein wichtiger Schritt, um neuronale Schaltkreise zu etablieren. Um Synapsen zu bilden, müssen synaptische Proteine in geeigneter Reihenfolge durch Transport von Zellkörpern und/oder lokale Übersetzung in unreife Synapsen geliefert werden. Jedoch, Es ist nicht vollständig verstanden, wie synaptische Proteine in Synapsen in der richtigen Reihenfolge ansammeln. Hier stellen wir eine neuartige Methode zur Analyse der präsynaptischen Bildung vor, indem wir die Kombination von Neuronenballkultur mit Perlen verwenden, um die Präsynapsebildung zu induzieren. Neuronenkugeln, die neuronale Zellaggregate sind, liefern axonale Blätter weit weg von Zellkörpern und Dendriten, so dass schwache fluoreszierende Signale von Präsynapsen erkannt werden können, indem überwältigende Signale von Zellkörpern vermieden werden. Als Perlen, um die präsynapsische Bildung auszulösen, verwenden wir Perlen, die mit Leucin-reichem Repeat-Transmembran-Neuronal 2 (LRRTM2), einem exzitatorischen präsynaptischen Organisator, konjugiert sind. Mit dieser Methode haben wir gezeigt, dass vesikulärer Glutamattransporter 1 (vGlut1), ein synaptisches Vesikelprotein, sich in Präsynapsen schneller angesammelt hat als Munc18-1, ein Wirkstoffzonenprotein. Munc18-1 akkumulierte auch nach dem Entfernen von Zellkörpern übersetzungsabhängig in Presynapse. Dieser Befund deutet auf die Munc18-1 Akkumulation durch lokale Übersetzung in Axonen hin, nicht durch Transport von Zellkörpern. Zusammenfassend ist diese Methode geeignet, die Ansammlung von synaptischen Proteinen in Präsynapsen und quelle von synaptischen Proteinen zu analysieren. Da die Neuronenballkultur einfach ist und es nicht notwendig ist, spezielle Geräte zu verwenden, könnte diese Methode auf andere experimentelle Plattformen anwendbar sein.
Einleitung
Synapse-Bildung ist einer der kritischen Schritte bei der Entwicklung von neuronalen Schaltkreisen1,2,3. Die Bildung von Synapsen, die spezialisierte Kompartimente sind, die aus Prä- und Post-Synapsen bestehen, ist ein komplexer und mehrstufiger Prozess, der eine angemessene Erkennung von Axonen und Dendriten, die Bildung von aktiver Zone und postsynaptischen Dichte und die richtige Ausrichtung der Ionenkanäle und Neurotransmitter-Rezeptoren1,2. In jedem Prozess akkumulieren viele Arten von synaptischen Proteinen in diesen speziellen Fächern im richtigen Timing, indem sie synaptische Proteine aus Zellkörpern und/oder durch lokale Übersetzung in den Kompartimenten transportieren. Diese synaptischen Proteine gelten als organisiert angeordnet, um funktionelle Synapsen zu bilden. Dysfunktion einiger synaptischer Proteine mit Synapsenbildung führt zu neurologischen Erkrankungen4,5. Es bleibt jedoch unklar, wie sich synaptische Proteine im richtigen Timing ansammeln.
Um zu untersuchen, wie sich synaptische Proteine in organisierter Weise ansammeln, ist es notwendig, die Ansammlung synaptischer Proteine in chronologischer Reihenfolge zu untersuchen. Einige Berichte zeigten Live-Bildgebung, um synapsische Bildung in dissoziierten Kultur der Neuronen zu beobachten6,7. Es ist jedoch zeitaufwändig, Neuronen zu finden, die gerade die Synapsenbildung unter der Mikroskopie beginnen. Um die Ansammlung synaptischer Proteine effizient zu beobachten, muss die Synapsenbildung zu dem Zeitpunkt beginnen, zu dem Forscher die Bildung induzieren wollen. Die zweite Herausforderung besteht darin, die Ansammlung synaptischer Proteine durch den Transport von Zellkörpern oder die lokale Übersetzung in Synapsen zu unterscheiden. Zu diesem Zweck ist die Translationsebene unter der Bedingung zu messen, dass der Transport von synaptischen Proteinen aus Zellkörpern nicht erlaubt ist.
Wir entwickelten neuartigen Presynapse-Formationstest mit Kombination von Neuronenballkultur mit Perlen, um die Präsynapsebildung zu induzieren8. Neuronenkugelkultur wurde entwickelt, um axonalen Phänotyp zu untersuchen, aufgrund der Bildung von axonalen Blättern um Zellkörper9,10. Wir verwendeten magnetische Perlen konjugiert mit Leucin-reichen Wiederholungtransmembran neuronal 2 (LRRTM2), die ein präsynaptischer Organisator ist, um erregende Präsynapsen zu induzieren (Abbildung 1A)11,12,13. Durch die Verwendung der LRRTM2-Perlen beginnt die Präsynapsebildung zu dem Zeitpunkt, zu dem die Perlen aufgetragen werden. Dies bedeutet, dass die Präsynapsebildung in Tausenden von Axonen eines Neuronenballs zu gleichen Zeiten beginnt, so dass es ermöglicht, den genauen Zeitverlauf der Ansammlung synaptischer Proteine effizient zu untersuchen. Darüber hinaus ist die Neuronenkugelkultur einfach, den Transport synaptischer Proteine aus dem Soma zu blockieren, indem Zellkörper entfernt werden (Abbildung 1B)8. Wir haben bereits bestätigt, dass Axone ohne Zellkörper überleben können und mindestens 4 h nach Entfernung von Zellkörpern gesund sind. Daher ist dieses Protokoll geeignet, um zu untersuchen, woher synaptische Proteine abgeleitet werden (Zellkörper oder Axon), und wie sich synaptische Proteine organisiert ansammeln.
Protokoll
Die in diesem Manuskript beschriebenen Experimente wurden gemäß den Richtlinien durchgeführt, die im Institutional Animal Care and Use Committee der Yokohama City University beschrieben wurden.
1. Vorbereitung von Neuronenkugeln als hängende Tropfenkultur (Tage in vitro (DIV) 0-3)
HINWEIS: Die hier beschriebenen Verfahren zur Vorbereitung der Neuronenkugelkultur basieren auf der Methode, die zuvor von der Sasaki-Gruppe mit einigen Modifikationen9,10berichtet wurde. Wir haben auch mehrere Verfahren aus der Banker-Methode für die dissoziierte Kultur14angenommen.
-
Bestätigen der folgenden Punkte vor Beginn der Zerlegung
- Bereiten Sie alle erforderlichen Lösungen vor und sterilisieren Sie sie durch Autoklav/Filtration im Voraus.
- Halten Sie bereit alle Instrumente und Materialien in jedem Schritt dieser kortikalen Neuronenkultur verwendet werden.
- Sprühen und wischen Sie den laminaren Luftstromschrank, den Seziertisch, die Bühnenplatte des Stereomikroskops, die Schere und die Zange mit 70 % Ethanol.
- Euthanisieren Sie die Maus nach Anwendung von CO2 und sezieren Sie den Bauch, um E16-Embryonen zu erhalten.
- Entfernen Sie die Gehirne von Embryonen sorgfältig mit Hilfe von feinen Spitzen der Zange und übertragen Sie sie in 60 mm Zellkulturschalen mit 4 ml HEPES Buffered Salt Solution (HBSS).
HINWEIS: Das Seziermedium HBSS enthält 10 mM HEPES (pH 7.4), 140 mM NaCl, 5,4 mM KCl, 1,09 mM Na2HPO4, 1,1 mM KH2PO4, 5,6 mM D-Glucose und 5,64 mM Phenolrot. - Entfernen Sie die Kopfhaut, schneiden Sie die Olfaktorinde, trennen Sie Die Kortiken von jeder zerebralen Hemisphäre mit den feinen Spitzen der Zange unter Stereomikroskop, und übertragen Sie auf weitere 60 mm Gerichte, die frische HBSS enthalten. Verwenden Sie mindestens 3-5 Embryonen für jede einzelne Neuronenkugelkultur.
- Schneiden Sie die Kortiken in kleine Stücke mit mikrosezierenden Federscheren in einer laminaren Flow Cell Culture Kapuze.
- Hackfleischkortikin in ein 15 ml-Rohr geben und die gehackten Kortices in 4 ml 0,125% Trypsin in HBSS für 4,5 min in einem Wasserbad bei 37 °C versuchen.
HINWEIS: Diese Trypsinisierungszeit ist entscheidend für eine effiziente Neuronenkultur, da die zunehmende Zeit (> 4,5 min) zu viel mehr toten Neuronen führt. - Übertragen Sie die Zellaggregate durch eine sterile Transferpipette in ein neues 15 ml-Rohr mit 10 ml HBSS und inkubieren Sie 5 min bei 37 °C. Wiederholen Sie diesen Schritt noch einmal.
- Übertragen Sie die Zellaggregate in ein neues 15 ml-Rohr, das 2 ml neurobasale Medien enthält, die GlutaMax, B27-Ergänzung (NGB-Medium), 0,01% DNase I und 10% Pferdeserum enthalten.
- Trituieren Sie die trypsinisierten Kortiken, indem Sie sie wiederholt (3-5 Mal) mit feuerpolierter Feinglas-Pasteurpipetette nach oben und unten pfeifen.
HINWEIS: Durchmesser der feuerpolierten Feinglas Pasteur Pipette ist sehr wichtig, wie in der Banker-Methode Papier14beschrieben. Wenn die Pipette zu schmal ist, um Kortiken zu passieren, bereiten Sie Pipetten mit 2-3 verschiedenen Größen vor und versuchen Sie es mit einer größeren Pipette. - Für die Vorbereitung von Neuronenkugeln nehmen Sie die oben genannte Zellsuspension und passen Sie die Zelldichte auf 1 x 106 Zellen/ml mit NGB-Medium an.
- Kultur die kortikalen Neuronen als hängende Tropfen mit 10.000 Zellen/Tropfen (1 Tropfen ist 10 l) in den oberen Deckeln von 10 cm Kulturgerichten.
- Fügen Sie 7 ml Phosphat gepufferte Saline (PBS) in den unteren Teil der Kulturgerichte, dann halten Sie in einem Inkubator für 3 Tage bei 37 °C mit 5% CO2 unter befeuchtetem Zustand, um Neuronkugelbildung zu ermöglichen.
2. Platzieren von Neuronenkugeln auf PLL-beschichteten Glasabdeckungen und Kulturpflege (DIV 3-11)
HINWEIS: Vor der Beschichtung von Glasabdeckungen mit Poly-L-Lysin (PLL) ist das Waschen der Abdeckungen mit Reinigungsmittel wichtig. Glasabdeckungen sind manchmal nicht so sauber für neuronale Kultur und gleichmäßige Beschichtung mit PLL. Eine ungleichmäßige PLL-Beschichtung kann zu einer ungleichmäßigen axonalen Ausdehnung von Neuronenkugeln führen.
- Die Abdeckungen in 1/20 verdünnten neutralen nichtphosphorhaltigen Reinigungsmitteln in Keramikregalen für 1-3 Übernachtungen einweichen.
- Die Deckelbeutel 8 Mal in Reinstwasser waschen und dann im Ofen bei 200 °C für 12 h sterilisieren.
HINWEIS: Alle Schritte von hier müssen in einer laminaren Luftstromzellenkulturhaube durchgeführt werden. - Backte Coverslips auf 100-mm-Gerichte übertragen. Nach dem Versiegeln der Schale durch Parafilm zwischen einem Deckel und einer Bodenschale können gebackene Abdeckungen für die langfristige Lagerung aufbewahrt werden.
- (Optional) Tragen Sie Paraffinpunkte auf die Abdeckungen auf. Die Punkte machen Platz, um zu verhindern, dass sich Neuronenkugeln während der Immunfärbung durch direkten Kontakt von Neuronenkugeln zu Plastikgeschirr von den Abdeckungen lösen. Paraffin in einer geeigneten Flasche in einem Warmwasserbad bei ca. 90 °C schmelzen. Tauchen Sie eine Pasteur Pipette in das Paraffin, dann schnell berühren, um drei Flecken in der Nähe der Kante eines Coverslip zu machen.
- PLL (MW > 300.000) mit PLL-Lösung (15 g/ml im Boratpuffer) auf die Paraffin-Perlenglas-Abdeckungen in 60-mm-Schalen aufschichten und mindestens 1 h in einem CO2-Inkubator aufbewahren.
- Nach dem 4-fachen Waschen mit PBS die PLL-beschichteten Abdeckungen auf eine 4-Well-Platte mit 350 L NGB-Medium in jedem Brunnen und Cytosin-D-Arabinofuranosidhydrochlorid (AraC, 3 m) auf die Medien übertragen, um teilende Zellen abzutöten.
- Bewahren Sie diese 4-Well-Platte mit den PLL-beschichteten Abdeckungen im CO2-Inkubator mindestens 20 min auf, um sicherzustellen, dass die Temperatur des Mediums 37 °C erreicht, bevor Neuronenkugeln übertragen werden.
- Bei DIV 3, wenn "Neuronenkugeln" sehr gut ausgebildet sind, übertragen Sie sie auf PLL-beschichtete Abdeckungen innerhalb der 4-Well-Platte (5 Neuronenkugeln/well), die im CO2-Inkubator aufbewahrt wird.
- Ersetzen Sie nach 48 h das Neuronenballkulturmedium durch ein frisches AraC-freies NGB-Medium. Verwenden Sie eine Kochplatte in einer laminaren Luftstromzellenkulturhaube, deren Temperatur unmittelbar vor diesem Eingriff bei 37 °C gehalten wird.
HINWEIS: Es ist notwendig, das Medium so schnell wie möglich auf einer Kochplatte zu wechseln, um die Zeit zu reduzieren, die die Kulturen außerhalb des CO2-Inkubators sind. - Bewahren Sie diese Neuronenballkultur im CO 2-Inkubator für bis zu DIV 11 auf.
HINWEIS: Bei DIV 11-12 werden Neuronenkugeln, die Neuriten bis zu 1-2 mm ausdehnen, für Experimente verwendet.
3. Anwendung von LRRTM2-Perlen auf Neuronenballkultur mit oder ohne Zellkörper (DIV 11-12)
HINWEIS: Vor der Anwendung von LRRTM2 Perlen auf Neuron Kugelkultur, Es wird empfohlen, Zellkörper zu entfernen. Daher bereiten Sie zuerst LRRTM2 Perlen, dann entfernen Sie die Zellkörper und später verwenden LRRTM2 Perlen auf Kultur so früh wie möglich. Biotinylated LRRTM2 wird von der Nogi-Gruppe (Yokohama City University) als konditioniertes Medium zur Verfügung gestellt. Sie verwenden einen Expressionsvektor einschließlich Biotin-Akzeptorsequenz und Biotinligase aus E. coli (BirA) 15 , 16 biotin an LRRTM2 anzuhängen, und der Expressionsvektor wird in Expi293F-Zellen transfiziert, die im Expi293-Expressionssystem enthalten sind. Die Vektorinformationen sind in der ergänzenden Abbildung 1verfügbar. Biotinylierte LRRTM2-konjugierte Streptavidinperlen reduzierten den Hintergrund der Immunfärbung stark im Vergleich zu LRRTM2-Fc -konjugierten Protein-A-Perlen, die für Prototypen des LRRTM2-Systems 8 verwendet werden.
-
Herstellung von biotinylierten LRRTM2 Perlen
- Um überschüssiges Biotin aus dem konditionierten Medium der Expi293F-Zellen zu entfernen, die biotinyliertes LRRTM2 exdrücken, wenden Sie 1,7 ml des konditionierten Mediums gemischt mit 0,8 ml PBS (insgesamt 2,5 ml) auf die PD-10-Gelfiltrationssäule auf. Die PD-10-Säule wird mit 25 ml Reinstwasser und 25 ml PBS vorausgeglichen.
- Elute mit 3,5 ml PBS und sammeln Sie den Durchfluss als LRRTM2-Bestand.
HINWEIS: Dieser LRRTM2-Bestand kann langfristig an Aliquots abgegeben und bei -80 °C gelagert werden. Expressionsniveaus von biotinylierten LRRTM2 variieren manchmal von Los zu Los. Daher sollte das richtige Volumen des LRRTM2-Lagers, um die Perlen zu konjugieren, bestimmt werden, um Presynapsen genug auf Neuronenkugeln zu bilden, wenn neue Charge nLRRTM2-Bestand beim ersten Mal verwendet wird. - Nehmen Sie 20 l von der Suspension von Streptavidin-beschichteten magnetischen Partikeln (Durchmesser: 4-5 m) zu einem Mikrozentrifugenrohr. Immobilisieren Sie die Perlen zu einem handgefertigten Gerät, das mit Neodym-Permanentmagneten befestigt ist, und waschen Sie dreimal mit 100 l PBS-MCBC in 1,5 ml Mikrozentrifugenröhren.
HINWEIS: PBS-MCBC enthält PBS einschließlich 5 mM MgCl2, 3 mM CaCl2, 0.1% BSA und 0.1% Complete EDTA-frei. - Nachdem Sie PBS-MCBC vollständig aus den Perlen entfernt haben, fügen Sie den gewaschenen Perlen ein vorbestimmtes Volumen an LRRTM2-Lager (in der Regel 500-1.000 l, siehe Anmerkung 3.1.2) hinzu. Inkubieren Sie das Gemisch mit Rotator bei 4 °C für 1-2 h.
- Waschen Sie die Perlen zweimal mit 100 l PBS-MCBC und später mit 100 L NGB-Medium.
- Setzen Sie die LRRTM2-Perlen in 50 l NGB-Medium für die Anwendung auf die Neuronenballkultur aus.
- Verwenden Sie die gleichen Verfahren für die Vorbereitung der Kontrollperlen (Negativkontrolle) in einem anderen Mikrozentrifugenrohr außer zugabe von biotinylierten-LRRTM2-Proteinen.
-
Entfernen von Zellkörpern aus Neuronenkugeln bei DIV 11-12 und Auftragen von LRRTM2-Perlen
- Beschriften Sie die Brunnen einer 4-Well-Platte als "Zellkörper (+)" und "Zellkörper (-)".
- Schneiden Sie das Ende einer gelben Spitze im 45°-Winkel mit einer Rasierklinge, die zuvor mit 70 % Ethanol unter Stereomikroskop besprüht wurde (Abbildung 1B).
- Setzen Sie das gelbe Spitzenende auf den Zellkörperbereich eines Neuronenballs und entfernen Sie die Zellkörper durch Absaugen (Abbildung 1B).
- Um jede angegebene Bedingung des Experiments zu identifizieren, kennzeichnen Sie die Brunnen erneut als "LRRTM2-Perlen" und "Kontrollperlen".
- Tragen Sie die LRRTM2 und Steuern Perlen auf Neuron Kugelkultur, und tauchen Sie auf der Unterseite der Platten für 1 min mit Ferrit-Magneten, um Presynapse-Bildung zu starten. Dieses Verfahren sorgt dafür, dass alle Perlen gleichzeitig touchdown. Insbesondere wäre es bei der kurzzeitigen Inkubation (z.B. 30 min und 1 h) mit LRRTM2 Perlen synchron wirksam.
- Um Zeit-Kurs-Experimente durchzuführen, beschriften Sie jeweils einen separaten Wert sowie 0 min, 30 min, 1 h, 2 h, 4 h und 18 h und tragen LRRTM2-Perlen in den angegebenen Zeitintervallen auf.
- Nach dem Hinzufügen von LRRTM2 Perlen, inkubieren Sie die Neuronenballkultur mit den Perlen für die angegebene Zeit (0 min bis 18 h), um Presynapsen zu bilden.
4. Immunostainierung und Mikroskopie
HINWEIS: Fixieren Sie die Zellen für 4 h über Inkubation mit LRRTM2 Perlen in den experimentellen Bedingungen mit und ohne Zellkörper, da die Axone neigen dazu, allmählich in Abwesenheit von Zellkörpern nach 4 h zu sterben. Im Zeitverlauf mit LRRTM2-Perlen, fixieren Sie die Zellen zur angegebenen Zeit.
-
Fixierung und Färbung von Neuronen in der Neuronenballkultur nach Präsynapsebildung mit LRRTM2-Perlen
- Entfernen Sie NGB-Medium und fixieren Sie die Neuronenkugeln mit 4% PFA in PBS (250 l/well) für 20 min bei Raumtemperatur, und waschen Sie dann mit 500 l PBS 4-mal pro 5 min.
- Waschen Sie die festen Zellen mit TBS (Tris-gepufferte Salin: 50 mM Tris-HCl (pH 7.3) und 150 mM NaCl) für mehr als 5 min.
- Permeabilisieren Sie die Zellen/Axone der Neuronenkugelkultur mit TBS, die 0,3% Triton X-100 für 5 min enthalten.
- Halten Sie die Zellen 1 h für die Blockierung mit Blockierpuffer (0,1% Triton X-100 und 5% NGS (normales Ziegenserum) in TBS).
- Inkubieren Sie die Zellen mit primären Antikörpern; Anti-Kaninchen-vGlut1 (vesikulärer Glutamattransporter 1 (1:4000)) und Anti-Maus-Munc18-1 (1:300) mit Antikörperverdünnungsmittel für die Nacht bei 4 °C verdünnt.
- Waschen Sie die Deckellipsen 4 mal mit Immunfluoreszenz (IF) Puffer (0,1% Triton X-100 und 2% BSA in TBS) und inkubieren für 30 min mit Fluorophor (Alexa Farbstoff)-konjugierten 2. Antikörpern; Anti-Maus-IgG-Alexa 555 (1:500), Anti-Kaninchen-IgG-Alexa 488 (1:1000).
- Stain die Kerne der Zellkörper der Neuronen für 5 min mit 4,6-Diamidino-2-Phenylindole (DAPI, 1 g/ml) in PBS.
- Waschen Sie die Abdeckungen dreimal mit PBS und montieren Sie sie dann auf Glasschlitten mit Montagemedien, die 167 mg/ml Poly (Vinyl) Alkohol und 6 mg/ml N-Propylgallat enthalten.
- Bewahren Sie die Glasgletten bis zur Mikroskopie bei -20 °C im Kühlschrank auf. Fluoreszierende Signale der Glasschlitten sind mindestens 1 Jahr lang nachweisbar, wenn die Dias bei -20 °C gelagert werden.
-
Aufnahme von Bildern unter Fluoreszenzmikroskop
- Erfassen Sie Differentialinterferenzkontraste und IF-Bilder unter einem invertierten Fluoreszenzmikroskop mit einer gekühlten CCD-Kamera mit 60-facher Öl-Tauchlinse. Verwenden Sie für die Bildaufnahmesoftware ein softwareinstalliertes Mikroskopsystem. Verwenden Sie Image J als Bildanalysesoftware.
- Messen Sie die IF-Intensität in Presynapsen im Axon mit der folgenden Formel; IF-Intensitäten der Region of Interest auf Perlen (ROI) – Off-Perlen-Regionsintensität/Axonalintensität entlang 20 m von Perlen – Hintergrundintensität. Diese Verhältnisintensität liefert einen Proteinakkumationsindex (Abbildung 4A). Führen Sie die Messungen auf originalen 16-Bit-Bildern mit der Image J-Software durch.
- Um den Akkumulationsgrad eines bestimmten Proteins in der mit LRRTM2-Perlen induzierten Präsynapse zu quantifizieren, wählen Sie immer den Bereich weg von 2-Sichtfeld oder mehr außer dem Zellkörper mit Mikroskop (60X).
HINWEIS: Die Auswahl der Fläche in Neuronenkugel für die Bildgebung ist entscheidend, da dichte Axone in der Nähe des Zellkörpers sind und die Peripherie des Neuronenballs einzelne Axonliefern liefern kann. - Für eine genaue Messung wählen Sie 5-verschiedene axonale Feld (ähnliche Entfernung von Zellkörpern)/Coverslip.
- Halten Sie identische Bildbedingungen an verschiedenen Tagen und zwischen den Experimenten
Ergebnisse
Hier zeigen wir repräsentative Ergebnisse der Anhäufung von präsynaptischen Proteinen in LRRTM2-induzierten Präsynapsen von axonalen Blättern der Neuronenkugelkultur. Als präsynaptische Proteine analysierten wir das exzitatorische synaptische Vesikelprotein vGlut1 und das Wirkstoffzonenprotein Munc18-1. Wir untersuchten auch den Zeitlichen Verlauf der Akkumulation von vGlut1 und Munc18-1 in Presynapsen und erzielten Ergebnisse, die die Quelle von Munc18-1 in Presynapsen mit Axonen, die Zellkörper entfernen, und einem Proteinsynthesehemmer zeigten. Kürzlich haben wir eine Rolle von Fragile X mental retardation protein (FMRP) bei der Akkumulation von Munc18-1 in Presynapses8untersucht. FMRP, ein ursächliches Genprodukt des Fragile X-Syndroms (FXS), ist ein mRNA-bindendes Protein zur Unterdrückung der Translation17,18,19. Wir untersuchten auch die Beteiligung von FMRP an der Munc18-1 Akkumulation mit FXS-Modellmäusen, die einen Mangel an Fmr1-Gencodierung FMRP hat.
Anwendung von LRRTM2-Perlen in die Neuronenballkultur bei DIV11 induzierte Akkumulation von Munc18-1 in Präsynapsen von Axonen von Neuronenkugeln (Abbildung 2A). Selbst bei Axonen, die zellkörperentfernt sind, wurde die Akkumulation von Munc18-1 unter den Perlen ähnlich wie Axone von Neuronenkugeln mit Zellkörpern beobachtet (Abbildung 2B). Im typischen Fall können über 80% der Perlen nach 4 h-Inkubation mit Neuronenkugeln eine Ansammlung synaptischer Proteine in Präsynapsen induzieren, die durch Färbung von Munc18-1 und vGlut-1 beurteilt werden. Da Axone so überfüllt und in der Nähe von Zellkörpern überlappen (Abbildung 2Aa, Ba), wurden eher periphere Bereich von Axonblättern gemessen, wo Axone nicht so überlappend sind (Abbildung2Ab, Bb, z.B. Randbereich weg von 2-Feld oder mehr außer dem Zellkörper mit Mikroskop (60X)). Wenn periphere Region des Axonalblattes mit hochvergrößerungobjektiven Linsen (60X) analysiert wurde, akkumulierten sich vGlut1 und Munc18-1 deutlich in Vorsynapen von Axonen unter den Perlen (Abbildung 3). Manchmal sind fluoreszierende Signale von synaptischen vesikulären Proteinen wie vGlut1 im axonalen Bereich außerhalb der Perlen schwer zu detektieren, da sich diese synaptischen vesikulären Proteine so sehr unter den Perlen ansammeln. Im Fall von Munc18-1 können fluoreszierende Signale schwach im axonalen Bereich außerhalb der Perlen detektiert werden.
Um den Akkumulationsgrad synaptischer Proteine in durch LRRTM2-Perlen induzierten Präsynapsen zu quantifizieren, wurden fluoreszierende Intensitäten von Axonen unter den Perlen und außerhalb der Perlen gemessen und dann als "Proteinakkumulationsindex" berechnet (Abbildung 4Aund im Protokollabschnitt ausführlich beschrieben). Zeitverlaufsexperimente zeigten, dass die Anhäufung von vGlut1 in Presynapsen bei 30 min signifikant zunahm (Abbildung 4B). Auf der anderen Seite begann die Akkumulation von Munc18-1 bei 2 h signifikant zu zunehmen und ein Plateau bei 4 h zu erreichen (Abbildung 4C). Diese Daten deuten darauf hin, dass sich das synaptische Vesikelprotein vGlut1 in Vorsynapsen früher als das Wirkstoffprotein Munc18-1 ansammelt. Die Munc18-1 Akkumulation in Presynapsen von Fmr1-KO-Neuronen erhöhte sich 1,5-mal mehr als bei Wild -Typ (WT) (Abbildung 4C), was auf eine Beteiligung von FMRP an der Munc18-1 Akkumulation hindeutet. Um die Munc18-1-Akkumulation durch Transport von Zellkörpern oder lokale Translation in Axone zu unterscheiden, wurde eine Wirkung des Proteinsyntheseinhibitors Anisomycin auf die Akkumulation in Gegenwart oder Abwesenheit von Zellkörpern untersucht (Abbildung 4D) . Anisomycin unterdrückte die Munc18-1-Akkumulation signifikant in Axonen (Abbildung 4D), was darauf hindeutet, dass die Akkumulation proteinsyntheseabhängig ist. Die Akkumulation von Axonen ohne Zellkörper in Präsynapen war nicht signifikant anders als bei Zellkörpern (Abbildung 4D). Diese Ergebnisse deuten darauf hin, dass die Akkumulation von Munc18-1 in Presynapsen hauptsächlich von Axonen abgeleitet wird, nicht aber der Transport von Munc18-1 aus Zellkörpern. Wenn die Ansammlung synaptischer Proteine in Vorsynapsen von Axonen durch Entfernen von Zellkörpern unterdrückt wird, wird davon ausgegangen, dass diese Abnahme auf den Transport von Zellkörpern zurückzuführen ist. Tatsächlich, als wir die Anhäufung von insgesamt neu synthetisierten Proteinen metabolisch mit fluoreszierendem Farbstoff markiert untersuchten, reduzierte die Entfernung von Zellkörpern signifikant die Ansammlung von insgesamt neu synthetisierten Proteinen im Vergleich zu Präsynapen von Axonen mit Zellkörper8. Obwohl die Munc18-1 Akkumulation in Fmr1-KO im Vergleich zu WT stärker zunahm, unterdrückte Anisomycin die Akkumulation in ähnlicher Höhe wie WT und das Entfernen von Zellkörpern hatte keinen Einfluss auf die Akkumulation (Abbildung 4D). Diese Ergebnisse deuten darauf hin, dass FMRP an der lokalen Übersetzung von Munc18-1 in Axonen beteiligt ist.
Repräsentative Ergebnisse, die hier vorgestellt werden, zeigen, dass diese Methode geeignet ist, um zu untersuchen, wie sich synaptische Proteine in organisierter Weise durch Zeitverlaufsexperimente ansammeln, und um die Quelle synaptischer Proteine (Transport aus Zellkörpern oder lokalen Übersetzung in Axone) durch Entfernen von Zellkörpern.

Abbildung 1. Schema der Präsynapse-Bildung und Entfernung von Zellkörpern aus Neuronenball.
(A) Presynapse-Formationstest mit biotinylierten LRRTM2 konjugierten Streptavidinperlen, um die Präsynapsen in Axone der Neuronenkugelkultur aus E16-Kortiken zu induzieren. LRRTM2, ein postsynaptisches Protein, bindet Neurexin (NRXN) und fungiert als Presynapse-Organisator. Streptavidin-Perlen, die mit biotinylierten hochzellulären LRRTM2-Regionen (LRRTM2-Perlen) konjugiert wurden, wurden bei DIV11-12 zur Neuronenkugelkultur aufgetragen, um Präsynapsen zu induzieren. Diese Zahl wurde gegenüber der vorherigen Veröffentlichung8geändert. (B) Das gelbe Spitzenende wurde geschnitten und im 45°-Winkel auf den Zellkörperbereich der Neuronenkugelkultur gelegt. Die Zellkörper wurden durch Absaugen entfernt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2. Munc18-1 Akkumulation in Presynapsen in Gegenwart und Abwesenheit von Zellkörpern von Neuronenball.
(A) Nach 4 h Inkubation mit LRRTM2-Perlen akkumulierte das Wirkstoffprotein Munc18-1 an den induzierten präsynaptischen Stellen in Axonen (Oberpanel; Versuchsschema, Mitte; Phasenbild, niedriger; IF-Bilder von Munc18-1 Akkumulation). Bilder wurden als Bilder mit geringer Vergrößerung mit 10X Linse und Zwischenvergrößerung (1,5X) aufgenommen, um das gesamte Bild aus einem Neuronenball, Axonen und Perlen zu sehen. Gestrichelte Quadrate zeigen den Bereich des Neuronenballs für eine genaue Bildposition von Perlen an. Maßstabsleiste, 20 m (links; Originalbild), 10 m (rechts; vergrößertes Bild). (B) Munc18-1 akkumulierte sich sehr gut auch in Ermangelung von Zellkörpern an den induzierten präsynaptischen Stellen in Axonen. Dieses Ergebnis zeigt, dass Axone überleben können und Presynapsen bilden können, auch nach dem Entfernen von Zellkörpern für mindestens 4 h. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
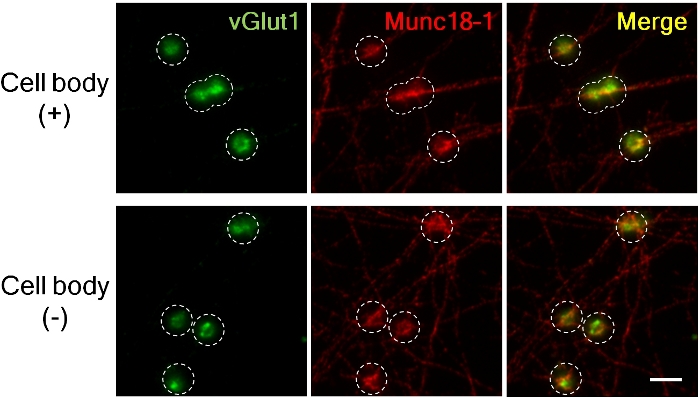
Abbildung 3. Akkumulation von vGlut1 und Munc18-1 in Vorsynapsen von Axonen mit und ohne Zellkörper.
Der exzitatorische präsynaptische Marker vGlut1 (grün) und Munc18-1 (Rot) akkumuliert in Presynapsen 4 h nach Zugabe von LRRTM2 Perlen. (Obere Platte; mit Zellkörpern, unten; ohne Zellkörper). Die Bilder wurden mit einer 60-fachen Öl-Tauchlinse für eine hohe Vergrößerung aufgenommen, um die fluoreszierende Intensität zu messen. Gestrichelter Kreis umriss die Position der Perlen. Munc18-1 akkumulierte fast ähnliches Ausmaß in Gegenwart und Abwesenheit von Zellkörpern in Präsynapsen, aber vGlut1 Akkumulation wird ohne Zellkörper reduziert8. Skala Bar, 5 'm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 4. Verfahren der IF-Intensitätsmessung und Auswirkungen der Zellkörper Entfernung und Proteinsynthese-Hemmer auf Munc18-1 Akkumulation in Neuronenkugeln.
(A) Diagramm zeigte die Quantifizierungsmethode der IF-Intensität an einer induzierten-präsynaptischen Stelle im Axon der Neuronenballkultur. Skalenbalken, 5 m. Die Details werden im Protokollabschnitt beschrieben. (B) Zeitverlauf der vGlut1-Akkumulation in Präsynapsen, die mit LRRTM2-Perlen induziert werden. Die angezeigten Daten sind mittelwert - SEM für n = 20. Zwei-Wege-ANOVA mit Tukeys Mehrfachvergleichstest. **p < 0,01. (C) Zeitverlauf der Munc18-1 Akkumulation in WT- und Fmr1-KO-Presynapsen unter LRRTM2-Perlen. Die angezeigten Daten sind mittelwert für n = 20, Zwei-Wege-ANOVA mit Tukeys Mehrfachvergleichstest. n.s., nicht signifikant; **p < 0,01, deutlich unterschiedlich zwischen WT und KO. (D) Das Balkendiagramm zeigte den Akkumulationsgrad Von Munc18-1 in Vorsynapsen von WT- und Fmr1-KO-Neuronkugeln in Gegenwart oder Abwesenheit von 25 M Anisomycin (Aniso) mit (CB+) oder ohne (CB-)Zellkörper. Die angezeigten Daten sind mittelwert - SEM für n = 20. Zwei-Wege-ANOVA mit Tukeys Mehrfachvergleichstest. **p < 0,01, n.s., nicht signifikant. • p < 0,01 angegeben, deutlich anders mit und ohne Anisomycin. Diese Zahlen wurden gegenüber der vorherigen Veröffentlichung8geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung 1. Bicystronischer Expressionsvektor für LRRTM2-ECR (Extrazelluläre Region) und BirA (Biotinligase von E. coli ).
Zwischen LRRTM2-ECR- und BirA-Codierungssequenzen gibt es eine interne Ribosomal Entry Site (IRES)-Sequenz, die es ermöglicht, beide Proteine aus einer einzigen mRNA mitzuexprimieren. hEF1-HTLV-Promotor treibt Express on die bicstronische mRNA, und beide Proteine werden durch Signalpeptidsequenzen nach der Translation sezerniert. Die LRRTM2-ECR-Codierungssequenz ist an mehrere Peptid-Tag-Sequenzen (DYKDDDDK, TEV, Myc und His Tags) und Biotin Acceptor Sequence (BAS) angehängt. BirA ist an das DYKDDDDV-Tag angeschlossen. Sezerre BirA-Biotinylatelysin der BAS-Sequenz von LRRRTM2-ECR, um an Streptavidinperlen zu binden. Bitte klicken Sie hier, um die Figur herunterzuladen.
Diskussion
Wir entwickelten eine neuartige Methode zur Untersuchung der Präsynapse-Bildung, die mit LRRTM2-Perlen mit Neuronenballkultur stimuliert wurde. Derzeit umfasst der größte Teil des Präsynapse-Formations-Assays Poly-D-Lysin (PDL)-beschichtete Perlen und dissoziierte Kultur/Mikrofluidische Kammer20,21,22. Einer der Vorteile dieser Methode ist LRRTM2-Perlen. Während LRRTM2 interagiert mit Neurexin, um exzitatorische Präsynapsen speziell11,12,13, PDL-Perlen induziert sowohl erregende und hemmende Presynapsen nicht spezifisch20. Bei dieser Methode sind andere Presynapse-Organisatoren, deren Mitglieder über 10 Proteine3sind, anwendbar, um Präsynapsen zu induzieren, indem sie die extrazelluläre Domäne des biotinylierten Proteins je nach experimentellem Zweck ändern.
Ein weiterer Vorteil ist die Neuronenballkultur. In einigen Fällen wurde die konventionelle dissoziierte Kultur verwendet, um die Präsynapsebildung zu analysieren20. Jedoch, dissoziierte Kultur ist nicht geeignet, niedrige Konzentrationen von synaptischen Proteinen innerhalb von Presynapsen zu analysieren, weil überwältigende Signale in Zellkörpern und Dendriten stören Signale in Presynapsen. Stattdessen verwenden einige Gruppen dissoziierte Kultur in der mikrofluidischen Kammer, die eine besondere Apparatur für kulturaxone und Zellkörper getrennt in 2 Komplizen21,22ist. Mit Hilfe der mikrofluidischen Kammer wird das Axonalblech im axonalen Fach gebildet, und Zellkörper können aus dem Zellkörperfach entfernt werden, ähnlich der Neuronenkugelkultur. Mikrofluidische Kammer ist jedoch ein spezialfluidischer Apparat und erfordert einige Fähigkeiten, um den konstanten Kulturzustand aufrechtzuerhalten. Neuronenkugelkultur ist nicht notwendig, um spezielle Geräte zu verwenden, und ist relativ einfach als neue experimentelle Methode eingeführt werden. Da die Essenz der Neuronenballkultur nur darin besteht, neuronale Zellaggregate (Neuronenkugeln) auf Glasbodenschale/Kammer zu platzieren, kann sie leicht mit anderen Methoden kombiniert werden. Zum Beispiel wird angenommen, dass Neuronenballkultur mit LRRTM2-Perlen für Hochgehalt Screening anwendbar ist, um Fluoreszenz von 10-20 Perlen Bereich zur gleichen Zeit zu messen.
Kritischer Schritt dieses Protokolls ist die Beschichtung mit PLL. Wenn die PLL-Beschichtung nicht einheitlich ist, würden sich Axone von Neuronenkugeln nicht gleichmäßig in alle Richtungen ausdehnen. Dies stört die effiziente Analyse der Präsynapsebildung. Wir verwenden Glasabdeckungen und Glasbodenschalen, aber Glas ist manchmal nicht so sauber für neuronale Kultur und gleichmäßige Beschichtung mit PLL. In diesem Protokoll werden zunächst Glasabdeckungen und Glasbodenschalen in neutralem nichtphosphorhaltigem Reinigungsmittel für 1-3 über Nacht eingeweicht und dann 8 Mal mit Reinstwasser gewaschen. Wir verwenden PLL, deren Molekulargewicht > 300.000, um seine Konzentration (15 g/ml) für einen niedrigeren unerwünschten Hintergrund zu reduzieren. Bei Verwendung eines niedrigeren Molekulargewichts von PLL(z.B. 30.000-70.000) ist eine höhere Konzentration (100 g/ml) erforderlich, um Axone zu erweitern.
Einschränkung dieser Methode ist, dass Neuronenballkultur nicht beibehalten kann > DIV15-16. Axone von Neuronenkugeln sind nach DIV15-16 fragmentiert. Fragmentierte Axone produzieren keine Vorsynapse nach DER Anwendung der LRRTM2-Perlen. Daher ist diese Methode nicht anwendbar, um reife Neuronen zu analysieren (> DIV21). Jedoch, in den meisten Fällen11,12,21,22, Presynapse Bildung Assay verwendet jüngere Neuronen, die bis DIV14 kultiviert werden. Eine weitere Einschränkung ist, dass Axone ohne Zellkörper nicht über 4 h überleben können. Wir analysierten die Akkumulation von 5 synaptischen Proteinen in Präsynapsen bisher, die Ansammlung aller Proteine, die wir überprüften erreicht fast Plateau innerhalb von 4 h (unveröffentlichte Beobachtung). Es wird angenommen, dass synaptische Proteine sich bei 4 h ausreichend ansammeln, um zu analysieren, woher synaptische Proteine stammen (Zellkörper oder Axon).
Die Kombination von Neuronenballkultur mit LRRTM2-Perlen ist relativ einfach und flexibel, um viele experimentelle Plattformen anzupassen. Wir haben diese Methode bereits angewendet, um die präsynaptische Aktivität mit AM1-43 Farbstoff (unveröffentlichte Beobachtung) zu messen. Diese Methode gilt als für das Screening mit hohem Durchsatz anwendbar. Presynapse-Formationstest ist möglich, hochgehaltige Screenings anzuwenden, indem synaptische Proteine in Unterbau von LRRTM2-Perlen gebildeten Präsynapsen gefärbt werden. Diese Methode würde dazu beitragen, neue Verbindungen zu finden, um neurologische Erkrankungen zu heilen.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wird teilweise von JSPS Grant-in-Aid for Scientific Research (KAKENHI) (C) (Nr. 22500336, 25430068, 16K07061) (Y. Sasaki) unterstützt. Wir danken Dr. Terukazu Nogi und Frau Makiko Neyazaki (Yokohama City University) für die freundliche Bereitstellung von biotinyliertem LRRTM2-Protein. Wir danken auch Honami Uechi und Rie Ishii für die technische Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| Antibody diluent | DAKO | S2022 | |
| Alexa Fluor 594 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-585-151 | |
| Alexa Fluor 488 AffiniPure Donkey Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-545-152 | |
| mouse anti-Munc18-1 | BD Biosciences | 610336 | |
| B-27 Supplement (50X), serum free | Thermo Fisher Scientific | 17504044 | |
| Bovine Serum Alubumin (BSA) | Nacalai Tesque | 01863-48 | |
| Cell-Culture Treated Multidishes (4 well dish) | Nunc | 176740 | |
| Complete EDTA-free | Roche | 11873580001 | |
| cooled CCD camera | Andor Technology | iXON3 | |
| Coverslip | Matsunami | C015001 | Size: 15 mm, Thickness: 0.13-0.17 mm |
| Cytosine β-D-arabinofuranoside (AraC) | Sigma-Aldrich | C1768 | |
| 4',6-Diamidino-2-phenylindole Dihydrochloride (DAPI) | Nacalai Tesque | 11034-56 | |
| Deoxyribonuclease 1 (DNase I) | Wako pure chemicals | 047-26771 | |
| Expi293 Expression System | Thermo Fisher Scientific | A14635 | |
| Horse serum | Sigma-Aldrich | H1270 | |
| image acquisition software | Nikon | NIS-element AR | |
| Image analysis software | NIH | Image J | https://imagej.nih.gov/ij/ |
| Inverted fluorecent microscope | Nikon | Eclipse Ti-E | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | |
| Neurobasal media | Thermo Fisher Scientific | #21103-049 | |
| Normal Goat Serum (NGS) | Thermo Fisher Scientific | #143-06561 | |
| N-propyl gallate | Nacalai Tesque | 29303-92 | |
| Paraformaldehyde (PFA) | Nacalai Tesque | 26126-25 | |
Paraplast Plus | Sigma-Aldrich | P3558 | |
| Poly-L-lysine Hydrobromide (MW > 300,000) | Nacalai Tesque | 28359-54 | |
| poly (vinyl alcohol) | Sigma | P8136 | |
| Prepacked Disposable PD-10 Columns | GE healthcare | 17085101 | |
| rabbit anti-vesicular glutamate transporter 1 | Synaptic Systems | 135-302 | |
| SCAT 20X-N (neutral non-phosphorous detergent) | Nacalai Tesque | 41506-04 | |
| Streptavidin-coated magnetic particles | Spherotech Inc | SVM-40-10 | diameter: 4-5 µm |
| TritonX-100 | Nacalai Tesque | 35501-15 | |
| Trypsin | Nacalai Tesque | 18172-94 |
Referenzen
- Waites, C. L., Craig, A. M., Garner, C. C. Mechanisms of Vertebrate Synaptogenesis. Annual Review of Neuroscience. 28 (1), 251-274 (2005).
- Ziv, N. E., Garner, C. C. Cellular and molecular mechanisms of presynaptic assembly. Nature Reviews Neuroscience. 5 (5), 385-399 (2004).
- Chia, P. H., Li, P., Shen, K. Cellular and molecular mechanisms underlying presynapse formation. Journal of Cell Biology. 203 (1), 11-22 (2013).
- Südhof, T. C. Neuroligins and neurexins link synaptic function to cognitive disease. Nature. 455 (7215), 903-911 (2008).
- Saitsu, H., et al. CASK aberrations in male patients with Ohtahara syndrome and cerebellar hypoplasia. Epilepsia. 53 (8), 1441-1449 (2012).
- Friedman, H. V., Bresler, T., Garner, C. C., Ziv, N. E. Assembly of New Individual Excitatory Synapses. Neuron. 27 (1), 57-69 (2000).
- Bresler, T., et al. Postsynaptic density assembly is fundamentally different from presynaptic active zone assembly. The Journal of neuroscience the official journal of the Society for Neuroscience. 24 (6), 1507-1520 (2004).
- Parvin, S., Takeda, R., Sugiura, Y., Neyazaki, M., Nogi, T., Sasaki, Y. Fragile X mental retardation protein regulates accumulation of the active zone protein Munc18-1 in presynapses via local translation in axons during synaptogenesis. Neuroscience Research. , (2018).
- Sasaki, Y., et al. Phosphorylation of Zipcode Binding Protein 1 Is Required for Brain-Derived Neurotrophic Factor Signaling of Local β-Actin Synthesis and Growth Cone Turning. Journal of Neuroscience. 30 (28), 9349-9358 (2010).
- Sasaki, Y., Gross, C., Xing, L., Goshima, Y., Bassell, G. J. Identification of axon-enriched microRNAs localized to growth cones of cortical neurons. Developmental neurobiology. 74 (3), 397-406 (2014).
- Linhoff, M. W., et al. An Unbiased Expression Screen for Synaptogenic Proteins Identifies the LRRTM Protein Family as Synaptic Organizers. Neuron. 61 (5), 734-749 (2009).
- de Wit, J., et al. LRRTM2 Interacts with Neurexin1 and Regulates Excitatory Synapse Formation. Neuron. 64 (6), 799-806 (2009).
- Ko, J., Fuccillo, M. V., Malenka, R. C., Südhof, T. C. LRRTM2 Functions as a Neurexin Ligand in Promoting Excitatory Synapse Formation. Neuron. 64 (6), 791-798 (2009).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature protocols. 1 (5), 2406-2415 (2006).
- Hirai, H., et al. Structural basis for ligand capture and release by the endocytic receptor ApoER2. EMBO reports. , (2017).
- Yasui, N., et al. Functional Importance of Covalent Homodimer of Reelin Protein Linked via Its Central Region. Journal of Biological Chemistry. 286 (40), 35247-35256 (2011).
- Bassell, G. J., Warren, S. T. Fragile X Syndrome: Loss of Local mRNA Regulation Alters Synaptic Development and Function. Neuron. 60 (2), 201-214 (2008).
- Darnell, J. C., Klann, E. The translation of translational control by FMRP: therapeutic targets for FXS. Nat Neurosci. 16 (11), 1530-1536 (2013).
- Richter, J. D., Bassell, G. J., Klann, E. Dysregulation and restoration of translational homeostasis in fragile X syndrome. Nature Reviews Neuroscience. 16 (10), 595-605 (2015).
- Lucido, A. L., et al. Rapid Assembly of Functional Presynaptic Boutons Triggered by Adhesive Contacts. Journal of Neuroscience. 29 (40), 12449-12466 (2009).
- Taylor, A. M., Wu, J., Tai, H. C., Schuman, E. M. Axonal Translation of β-Catenin Regulates Synaptic Vesicle Dynamics. Journal of Neuroscience. 33 (13), 5584-5589 (2013).
- Batista, A. F. R., Martínez, J. C., Hengst, U. Intra-axonal Synthesis of SNAP25 Is Required for the Formation of Presynaptic Terminals. Cell reports. 20 (13), 3085-3098 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten