Method Article
Saggio di formazione Presynapse utilizzando perline dell'organizzatore della presynapsi e cultura "Neuron Ball"
In questo articolo
Riepilogo
La formazione della presilnapsi è un processo dinamico che include l'accumulo di proteine sinaptiche nell'ordine corretto. In questo metodo, la formazione del presilnapsi è innescata da perline coniugate con una proteina organizzatore presilnapse su fogli assonali di cultura "palla di neurone", in modo che l'accumulo di proteine sinaptiche sia facile da analizzare durante la formazione del presilnapsi.
Abstract
Durante lo sviluppo neuronale, la formazione di sinapsi è un passo importante per stabilire circuiti neurali. Per formare le sinapsi, le proteine sinaptiche devono essere fornite in ordine appropriato mediante il trasporto da corpi cellulari e/o traduzioni locali in sinapsi immature. Tuttavia, non è completamente compreso come le proteine sinaptiche si accumulano nelle sinapsi in ordine corretto. Qui, presentiamo un nuovo metodo per analizzare la formazione presinaptica utilizzando la combinazione della coltura della palla del neurone con perline per indurre la formazione di presynapsi. Le sfere di neuroni che sono aggregati di cellule neuronali forniscono fogli assonali lontani dai corpi cellulari e dai dendriti, in modo che i deboli segnali fluorescenti di presynapsi possano essere rilevati evitando segnali schiaccianti di corpi cellulari. Come perline per innescare la formazione di presynapsi, usiamo perline coniugate con transmembrana ripetuta ricca di leucina neurone 2 (LRRTM2), un organizzatore pressinaptico eccitatorio. Utilizzando questo metodo, abbiamo dimostrato che il trasportatore di glutammato vescicolare 1 (vGlut1), una proteina vescica sinaptica, si è accumulata nei presilnapsi più velocemente di Munc18-1, una proteina della zona attiva. Munc18-1 ha accumulato la traduzione in modo dipendente nella pressinapse anche dopo la rimozione dei corpi cellulari. Questo risultato indica l'accumulo di Munc18-1 per traduzione locale negli assoni, non il trasporto da corpi cellulari. In conclusione, questo metodo è adatto per analizzare l'accumulo di proteine sinaptiche nei presilnapsi e la fonte di proteine sinaptiche. Poiché la cultura della palla neuronale è semplice e non è necessario utilizzare un apparato speciale, questo metodo potrebbe essere applicabile ad altre piattaforme sperimentali.
Introduzione
La formazione di sinapsi è uno dei passaggi critici durante lo sviluppo dei circuiti neurali1,2,3. La formazione di sinapsi specializzate composti da post-sinapsi è un processo complesso e multifase che prevede un adeguato riconoscimento di assoni e dendriti, formazione di zona attiva e densità post-sinaptica e un corretto allineamento canali ionici e recettori del neurotrasmettitore1,2. In ogni processo, molti tipi di proteine sinaptiche si accumulano in questi compartimenti specializzati in tempi adeguati trasportando proteine sinaptiche da corpi cellulari e/o mediante traduzione locale nei compartimenti. Queste proteine sinaptiche sono considerate organizzate in modo organizzato per formare sinapsi funzionali. La disfunzione di alcune proteine sinaptiche che coinvolgono la formazione di sinapsi provoca malattie neurologiche4,5. Tuttavia, non è chiaro come le proteine sinaptiche si accumulino in tempi adeguati.
Per studiare come le proteine sinaptiche si accumulano in modo organizzato, è necessario esaminare l'accumulo di proteine sinaptiche in ordine cronologico. Alcuni rapporti hanno dimostrato l'imaging dal vivo per osservare la formazione di sinapsi nella coltura dissociata dei neuroni6,7. Tuttavia, è necessario molto tempo per trovare neuroni che iniziano solo la formazione di sinapsi sotto microscopia. Per osservare l'accumulo di proteine sinaptiche in modo efficiente, la formazione delle sinapsi deve iniziare nel momento in cui i ricercatori vogliono indurre la formazione. La seconda sfida consiste nel distinguere l'accumulo di proteine sinaptiche dovuto al trasporto da corpi cellulari o alla traduzione locale nelle sinapsi. A tal fine, il livello di traduzione deve essere misurato nella condizione che non consente il trasporto di proteine sinaptiche da corpi cellulari.
Abbiamo sviluppato un nuovo saggio di formazione presynapse utilizzando la combinazione di coltura della palla neurone con perline per indurre la formazione di presynapsi8. La coltura della palla del neurone è sviluppata per esaminare il fenotipo assonale, a causa della formazione di fogli assonali che circondano i corpi cellulari9,10. Abbiamo usato perline magnetiche coniugate con transmembrane transmembrane a ecricca di leucina neuronale 2 (LRRTM2) che è un organizzatore presilnaptico per indurre presynapsi eccitatori (Figura 1A)11,12,13. Utilizzando le perline LRRTM2, la formazione di presynapsi inizia nel momento in cui vengono applicate le perline. Ciò significa che la formazione di presilnapsi inizia in migliaia di assoni di una palla neuronale allo stesso tempo, quindi permette di esaminare in modo preciso il percorso temporale dell'accumulo di proteine sinaptiche in modo efficiente. Inoltre, la coltura della palla neuronale è facile da bloccare il trasporto di proteine sinaptiche dal soma rimuovendo i corpi cellulari (Figura 1B)8. Abbiamo già confermato che gli assoni senza corpi cellulari possono sopravvivere e sono sani almeno 4 h dopo la rimozione dei corpi cellulari. Pertanto, questo protocollo è adatto per studiare da dove derivano le proteine sinaptiche (corpo cellulare o assone) e come le proteine sinaptiche si accumulano in modo organizzato.
Protocollo
Gli esperimenti descritti in questo manoscritto sono stati eseguiti secondo le linee guida delineate nel Comitato di cura e uso degli animali istituzionali della Yokohama City University.
1. Preparazione delle sfere di neurone come coltura goccia appesa (Giorni in vitro (DIV) 0-3)
NOTA: Le procedure qui descritte per la preparazione della coltura della palla neuronale si basano sul metodo precedentemente riportato dal gruppo Sasaki con alcune modifiche9,10. Abbiamo anche adottato diverse procedure dal metodo Banker per la cultura dissociata14.
-
Conferma dei seguenti elementi prima di iniziare la dissezione
- Preparare tutte le soluzioni necessarie e sterilizzarle con autoclave/filtrazione in anticipo.
- Tenere pronti tutti gli strumenti e materiali da utilizzare in ogni passo di questa coltura neuronale corticale.
- Spruzzare e pulire l'armadio del flusso d'aria laminalista, tavolo di dissezione, piastra scenica di stereomicroscopio, forbici e pinze con 70% etanolo.
- Eutanasia del topo al momento dell'applicazione di CO2 e sezionare l'addome per ottenere embrioni E16.
- Rimuovere i cervelli dagli embrioni con l'aiuto di punte fini di pinze e trasferirli in 60 mm piatti di coltura cellulare contenenti 4 mL di HEPES Buffered Salt Solution (HBSS).
NOTA: il mezzo di dissezione HBSS contiene 10 mM HEPES (pH 7.4), 140 mM NaCl, 5,4 mM KCl, 1.09 mM Na2HPO4, 1.1 mM KH2PO4, 5.6 mM D-glucosio, e 5.64 : M fenolo rosso. - Rimuovere il cuoio capelluto, tagliare il bulbo olfattivo, cortice separate da ogni emisfero cerebrale utilizzando le punte fini delle pinze sotto stereomicroscopio e trasferirle ad altri piatti da 60 mm contenenti HBSS freschi. Utilizzare almeno 3-5 embrioni per ogni cultura della palla neuronale separata.
- Tagliare le cortice in piccoli pezzi con forbici primaverili microdisseci in una cappa di coltura delle cellule di flusso laminare.
- Trasferire cortice macinate in un tubo da 15 mL e atrizzare le cortice macinate in 4 mL di 0,125% di trypsin in HBSS per 4,5 min in un bagno d'acqua a 37 gradi centigradi.
NOTA: Questo tempo di provapinizzazione è fondamentale per la cultura efficiente dei neuroni come il tempo di aumento (> 4.5 min) porta a molto più neuroni morti. - Trasferire gli aggregati cellulari in un nuovo tubo da 15 mL contenente 10 mL di HBSS mediante una pipetta di trasferimento sterile e incubare a 37 gradi centigradi per 5 minuti.
- Trasferire gli aggregati cellulari su un nuovo tubo da 15 mL contenente 2 mL di supporti Neurobasal contenenti GlutaMax, supplemento B27 (mezzo NGB), 0,01% DNase I e 10% siero di cavallo.
- Triturare le cortice orpsinizzate pipettandole ripetutamente su e giù (3-5 volte) utilizzando una pipetta Pasteur in vetro fine lucidata dal fuoco.
NOTA: Diametro di vetro fine lucidato al fuoco Pasteur pipette è molto importante come descritto nella carta metodo Banker14. Se la pipetta è troppo stretta per passare cortice, preparare pipette che possiedono 2-3 dimensioni diverse e provare da pipette più grandi. - Per preparare le sfere del neurone, prendere la sospensione cellulare di cui sopra e regolare la densità cellulare a 1 x 106 cellule / mL utilizzando il mezzo NGB.
- Cultura i neuroni corticali come gocce appese contenenti 10.000 cellule / goccia (1 goccia è 10 l) all'interno del coperchio superiore di 10 cm di coltura piatti.
- Aggiungere 7 mL di fosfato tampinato salina (PBS) alla parte inferiore dei piatti di coltura, quindi tenere in un'incubatrice per 3 giorni a 37 gradi centigradi con 5% di CO2 in condizioni umidificate per consentire la formazione di palla neuronale.
2. Posizionamento palle neurone su vetro rivestito di PLLcoperture e manutenzione della coltura (DIV 3-11)
NOTA: Prima del rivestimento di vetro coprilabbra con poli-L-lysina (PLL), lavare le coperture con detersivo è importante. Coperture di vetro a volte non sono così pulite per la coltura neuronale e rivestimento uniforme con PLL. Rivestimento PLL non uniforme può provocare estensione assonale irregolare delle sfere del neurone.
- Immergere i copricopertine in detersivo neutro non fosforo diluito in rack ceramici per 1-3 pernottamenti.
- Lavare le coverlips 8 volte in acqua ultrapura, e poi sterilizzare in forno a 200 gradi centigradi per 12 h.
NOTA: Tutti i passaggi da qui devono essere fatti in una cappa di coltura delle cellule di flusso d'aria laminare. - Trasferire i coprilabbra al forno a piatti da 100 mm. Dopo aver sigillato il piatto con parafilm tra un coperchio e un piatto di fondo, i coprilabbra al forno possono essere conservati per lo stoccaggio a lungo termine.
- (Facoltativo) Applicare i punti di paraffina ai copricopertine. I puntini fanno spazio per evitare che le sfere del neurone si stacchino dai coperchi durante l'immunostaining mediante contatto diretto delle sfere di neurone a i piatti di plastica. Sciogliere la paraffina in una bottiglia adatta in un bagno d'acqua calda a circa 90 gradi centigradi. Immergere una pipetta Pasteur nella paraffina, quindi toccarla rapidamente per fare tre punti vicino al bordo di un coperchio.
- Coat PLL (MW > 300.000) sul vetro con perline di paraffina copre le labbra in piatti da 60 mm utilizzando la soluzione PLL (15 g/mL nel tampone di ritassio), e conservarli per almeno 1 h in un'incubatrice di CO 2.
- Dopo aver lavato 4 volte con PBS, trasferire i copricapelli rivestiti di PLL su una piastra di 4 pozze contenente 350 l- di supporto NGB in ogni pozzo e ctosina -D-arabinofuranoside idrocloride (AraC, 3 m) ai media per uccidere le cellule divisorie.
- Tenere questa piastra di 4 pozze contenenti i coprilabbra rivestiti di PLL nell'incubatrice di CO2 almeno per 20 min per garantire che la temperatura del mezzo raggiunga i 37 gradi centigradi prima di trasferire le sfere del neurone.
- Al DIV 3 quando le "sfere di neurone" si formano molto bene, trasferirle su copritrici rivestite di PLL all'interno della piastra a 4 pozzi (5 sfere di neurone/bene) conservate nell'incubatrice di CO 2.
- Dopo 48 h, sostituire il mezzo di coltura della palla neuronale con fresco supporto NGB senza AraC. Utilizzare una piastra calda in una cappa di coltura cellulare flusso d'aria laminare la cui temperatura è mantenuta pronta a 37 gradi centigradi immediatamente prima di questa procedura.
NOTA: È necessario eseguire il mezzo cambiando il più rapidamente possibile su una piastra calda per ridurre il tempo che le colture si trovano all'esterno dell'incubatrice di CO 2. - Mantenere questa coltura palla neurone nell'incubatrice di CO2 fino a DIV 11.
NOTA: A DIV 11-12, per gli esperimenti vengono utilizzate sfere neuronali che estendono neuriti fino a 1-2 mm.
3. Applicazione di perline LRRTM2 sulla coltura della palla neuronale con o senza corpi cellulari (DIV 11-12)
NOTA: Prima dell'applicazione di perline LRRTM2 sulla coltura della palla neuronale, si consiglia di rimuovere i corpi cellulari. Pertanto, preparare le perle LRRTM2 in un primo momento, quindi rimuovere i corpi cellulari e poi applicare perline LRRTM2 alla coltura il più presto possibile. LRRTM2 biotinylato è fornito dal gruppo di Nogi (Yokohama City University) come mezzo condizionato. Usano un vettore di espressione che include la sequenza di accettatori di biotina e la biotina da E. coli (BirA) 15 Mi lasa del sistema , 16 per collegare la biotina a LRRTM2 e il vettore di espressione viene transfettato alle cellule Expi293F incluse nel sistema di espressione Expi293. Le informazioni sul vettore sono disponibili nella figura supplementare 1. Le perle streptavidine coniugate LRRTM2 biotinylate hanno ridotto notevolmente lo sfondo dell'immunostaining rispetto alle perline LRRTM2-Fc -conjugated Protein A che vengono utilizzate per il prototipo del sistema LRRTM28.
-
Preparazione di perline LRRTM2 biotinylate
- Per rimuovere la biotina in eccesso dal mezzo condizionato delle cellule Expi293F che esprimono LRRTM2 biotinylata, applicare 1,7 mL del mezzo condizionato mescolato con 0,8 mL di PBS (totale 2,5 mL) alla colonna di filtrazione del gel PD-10. La colonna PD-10 è pre-equilibrata con 25 mL di acqua ultrapura e 25 mL di PBS.
- Elute con 3,5 mL di PBS e raccogliere il flow-through come un magazzino LRRTM2.
NOTA: Questo stock LRRTM2 può essere erogato a aliquote e conservato a -80 gradi centigradi a lungo termine. I livelli di espressione di LRRTM2 biotinylato a volte variano da lotto a lotto. Così, il volume corretto di gnessere LRRTM2 per coniugare alle perline dovrebbe essere determinato a formare presynapses abbastanza sulle sfere del neurone, quando nuovo lotto di lRRTM2 stock viene utilizzato al primo tempo. - Prendere 20 -L dalla sospensione delle particelle magnetiche rivestite di streptavidin (diametro: 4-5 m) a un tubo di microcentrifuga. Immobilizza le perline di un apparato fatto a mano attaccato con magneti permanenti neodimium e lavati tre volte con 100 -L di PBS-MCBC in tubi di microcentrizzazione da 1,5 mL.
NOTA: PBS-MCBC contiene PBS tra cui 5 mM MgCl2, 3 mM CaCl2, 0.1% BSA e 0.1% Complete EDTA-free. - Dopo aver rimosso completamente PBS-MCBC dalle perline, aggiungere il volume predeterminato di 0dinda LRRTM2 (di solito 500-1.000 l, vedere la nota 3.1.2) alle perline lavate. Incubare la miscela utilizzando rotatore a 4 gradi centigradi per 1-2 h.
- Lavare le perline due volte con 100 -L di PBS-MCBC e più tardi con 100 L di supporto NGB.
- Risospendere le perline LRRTM2 in 50 gradi di supporto NGB per l'applicazione alla coltura della palla neuronale.
- Utilizzare le stesse procedure per preparare le perline di controllo (controllo negativo) in un altro tubo di microcentrifuga, ad eccezione dell'aggiunta di proteine lRIBTM2 biotinylate.
-
Rimozione dei corpi cellulari dalle sfere dei neuroni al DIV 11-12 e applicazione di perline LRRTM2
- Etichettare i pozze di una piastra di 4 piani come "Corpo della cella ( ) e "Corpo della cella (-)".
- Tagliare la fine di una punta gialla ad un angolo di 45 gradi con una lama di rasoio precedentemente spruzzata con 70% di etanolo sotto stereoscopio (Figura 1B).
- Posizionare l'estremità della punta gialla sull'area del corpo cellulare di una palla neuronale e rimuovere i corpi delle cellule per aspirazione (Figura 1B).
- Per identificare ogni condizione specificata dell'esperimento, etichettare nuovamente i pozzi come "perline LRRTM2" e "perline di controllo".
- Applicare il LRRTM2 e controllare le perline sulla coltura della palla neurone, e immergersi sul fondo delle piastre per 1 min utilizzando magneti ferrite per iniziare la formazione di pressinapsi. Questa procedura assicura di touchdown tutte le perline allo stesso tempo. In particolare, sarebbe efficace per breve tempo incubazione (ad esempio, 30 min e 1 h) con l'LRRTM2 perline in modo sincrono.
- Per eseguire esperimenti di analisi del percorso temporale, etichettare ciascuno di essi in modo separato su 0 min, 30 min, 1 h, 2 h, 4 h e 18 h e applicare perline LRRTM2 agli intervalli di tempo indicati.
- Dopo l'aggiunta di perline LRRTM2, incubare la coltura della palla neuronale con le perline per il tempo specificato (0 min a 18 h) per formare presynapsi.
4. Immunostaining e microscopia
NOTA: Fissare le cellule per 4 h tramite incubazione con perline LRRTM2 in condizioni sperimentali con e senza corpi cellulari, poiché gli assoni tendono a morire gradualmente in assenza di corpi cellulari dopo 4 h. In caso di corso temporale con perline LRRTM2, fissare le celle all'ora specificata indicata.
-
Fissare e macchiare i neuroni nella coltura della palla del neurone dopo la formazione di presynapsi con perline LRRTM2
- Rimuovere il mezzo NGB e fissare le sfere del neurone con il 4% di PFA in PBS (250 gradi l/pozzetto) per 20 min a temperatura ambiente, quindi lavare con 500 gradi l di PBS 4 volte ogni 5 min.
- Lavare le celle fisse con TBS (Tris-buffered saline: 50 mM Tris-HCl (pH 7.3) e 150 mM NaCl) per più di 5 min.
- Permeabilizzare le cellule/assoni della coltura della palla neuronale con TBS contenente 0,3% Triton X-100 per 5 min.
- Mantenere le celle 1 h per il blocco con buffer di blocco (0,1% Triton X-100 e 5% NGS (siero di capra normale) in TBS).
- Incubare le cellule con anticorpi primari; anti-coniglio-vGlut1 (trasportatore di glutammato vescicolare 1 (1:4000)) e anti-topo-Munc18-1 (1:300) diluito con diluito relè anticorpale per una notte a 4 gradi centigradi.
- Lavare i coperchi 4 volte con buffer di immunofluorescenza (IF) (0,1% Triton X-100 e 2% BSA in TBS) e incubare per 30 min con fluoroforo (Alexa dye)-agenteti 2nd anticorpi; anti-mouse-IgG-Alexa 555 (1:500), anti-coniglio-IgG-Alexa 488 (1:1000).
- Macchiare i nuclei dei corpi cellulari dei neuroni per 5 min con 4,6-diamidino-2-fenilindole (DAPI, 1 g/mL) in PBS.
- Lavare i coperchi per tre volte con PBS e poi montare su vetrini di vetro utilizzando supporti di montaggio contenenti 167 mg/mL poli (vinile) alcool e 6 mg/mL Gallato N-propyl.
- Conservare i vetrini di vetro in frigorifero a -20 gradi fino alla microscopia. I segnali fluorescenti dei vetrini di vetro sono rilevabili per almeno 1 anno quando i vetrini sono conservati a -20 gradi centigradi.
-
Scattare immagini al microscopio a fluorescenza
- Cattura il contrasto delle interferenze differenziali e le immagini IF al microscopio fluorescente invertito con una fotocamera CCD raffreddata utilizzando l'obiettivo ad immersione ad olio 60X. Per il software di acquisizione delle immagini, utilizzare un sistema di microscopio installato nel software. Utilizzare Image J come software di analisi delle immagini.
- Misurare l'intensità SE in presynapses in assone utilizzando la seguente formula; SE intensità di Regione di interesse su perline (ROI) – Off perline intensità regione / intensità assiale lungo 20 m da perline – intensità di fondo. Questa intensità di rapporto fornisce l'indice di accumulo di proteine (Figura 4A). Eseguire le misurazioni sulle immagini originali a 16 bit utilizzando il software Image J.
- Per quantificare il livello di accumulo di particolari proteine nella pressinapsi indotta con perline LRRTM2, selezionare sempre l'area lontano da 2 campi o più a parte il corpo cellulare con microscopio (60X).
NOTA: La selezione dell'area nella sfera del neurone per l'imaging è fondamentale in quanto gli assoni densi sono vicini al corpo cellulare e la periferia della sfera del neurone può fornire un singolo assonale. - Per una misurazione accurata, scegliere un campo assonale assonale a 5 diversi (distanza simile dai corpi delle cellule)/coverslip.
- Mantenere condizioni di imaging identiche in un giorno diverso e tra esperimenti e qui
Risultati
Qui, mostriamo risultati rappresentativi dell'accumulo di proteine pressinaptiche in presynapsi indotta da LRRTM2 di fogli assonali di coltura della palla neuronale. Come proteine presinterratiche, abbiamo analizzato la proteina vesicle sinaptica eccitatoria vGlut1 e la proteina della zona attiva Munc18-1. Abbiamo anche esaminato il ciclo temporale dell'accumulo di vGlut1 e Munc18-1 nei presynapsi, e abbiamo ottenuto risultati che indicano la fonte di Munc18-1 nei presynapsi usando assoni che rimuovono i corpi cellulari e un inibitore di sintesi proteica. Recentemente, abbiamo studiato un ruolo della proteina di ritardo mentale Fragile X (FMRP) sull'accumulo di Munc18-1 nei presynapsi8. L'FMRP, che è un prodotto genetico causale della sindrome di Fragile X (FXS), è una proteina legante mRNA per sopprimere la traduzione17,18,19. Abbiamo anche esaminato il coinvolgimento di FMRP nell'accumulo di Munc18-1 utilizzando topi modello FXS che è carente nella codifica genica Fmr1 FMRP.
Applicazione di LRRTM2-perline nella coltura di palla neurone a DIV11 accumulo indotto di Munc18-1 in presynapsi di assoni di sfere di neurone (Figura 2A). Anche negli assoni che vengono rimossi i corpi cellulari, l'accumulo di Munc18-1 è stato osservato sotto le perline simili agli assoni delle sfere neuronali con corpi cellulari (Figura 2B). In un caso tipico, oltre l'80% delle perline dopo 4 h-incubazione con sfere di neurone può indurre l'accumulo di proteine sinaptiche nelle presynapsi, giudicate dalla colorazione Munc18-1 e vGlut-1. Poiché gli assoni sono così affollati e sovrapposti vicino ai corpi cellulari (Figura 2Aa, Ba), sono state misurate regioni più periferiche di fogli assonali in cui gli assoni non sono così sovrapposti ( Figura2Ab, Bb, ad esempio, area periferica lontana da 2 campi di vista o più a parte il corpo cellulare con microscopio (60X)). Quando la regione periferica del foglio assonale è stata analizzata da obiettivo ad alto ingrandimento obiettivo (60X), vGlut1 e Munc18-1 accumulato chiaramente in presynapsi di assoni sotto le perline (Figura 3). A volte, i segnali fluorescenti di proteine vessicolari sinaptiche come vGlut1 sono difficili da rilevare nella regione assonale al di fuori delle perline, perché queste proteine vessicolari sinaptiche si accumulano così tanto sotto le perline. Nel caso di Munc18-1, i segnali fluorescenti possono essere rilevati debolmente nella regione assonale al di fuori delle perline.
Per quantificare il livello di accumulo delle proteine sinaptiche nei presynapsi indotti da LRRTM2-perline, sono state misurate le intensità fluorescenti degli assoni sotto le perline e al di fuori delle perline, e quindi calcolate come "indice di accumulo delle proteine" (Figura4A, e descritte in dettaglio nella sezione protocollo). Gli esperimenti del corso temporale hanno dimostrato che l'accumulo di vGlut1 nelle presynapsi è aumentato in modo significativo a 30 min (Figura 4B). D'altra parte, l'accumulo di Munc18-1 ha iniziato ad aumentare significativamente a 2 h, e raggiungere un altopiano a 4 h (Figura 4C). Questi dati indicano che la proteina vescica sinaptica vGlut1 si accumula nei presilnapsi prima della proteina della zona attiva Munc18-1. L'accumulo di Munc18-1 nei presynapsi di neuroni Fmr1-KO è aumentato 1,5 volte di più rispetto a quelli in tipo selvaggio (WT) (Figura 4C), indicando il coinvolgimento dell'FMRP nell'accumulo di Munc18-1. Successivamente, per distinguere l'accumulo di Munc18-1 dovuto al trasporto da corpi cellulari o traduzione locale negli assoni, è stato esaminato un effetto dell'anisomicina inibitore della sintesi proteica sull'accumulo in presenza o assenza di corpi cellulari (Figura4D) . L'anisomicina ha soppresso significativamente l'accumulo di Munc18-1 negli assoni (Figura 4D), indicando che l'accumulo è dipendente dalla sintesi proteica. L'accumulo in presynapsi di assoni senza corpi cellulari non era significativamente diverso da quello con i corpi cellulari (Figura 4D). Questi risultati suggeriscono che l'accumulo di Munc18-1 nei presynapsi deriva principalmente da assoni, ma non il trasporto di Munc18-1 da corpi cellulari. Se l'accumulo di proteine sinaptiche viene soppresso nei presilnapsi di assoni rimuovendo i corpi cellulari, si ritiene che questa diminuzione sia dovuta al trasporto da corpi cellulari. In realtà, quando abbiamo esaminato l'accumulo di proteine totali appena sintetizzate etichettate metabolicamente da tinture fluorescenti, la rimozione dei corpi cellulari ha ridotto significativamente l'accumulo di proteine totali appena sintetizzate, rispetto ai presynapsi di assoni con corpi cellulari8. Anche se l'accumulo di Munc18-1 in Fmr1-KO è aumentato di più rispetto a WT, l'anisomicina ha soppresso l'accumulo in livelli simili a WT e la rimozione dei corpi cellulari non ha avuto alcun effetto sull'accumulo (Figura 4D). Questi risultati suggeriscono che FMRP è coinvolto nella traduzione locale di Munc18-1 negli assoni.
I risultati rappresentativi qui presentati dimostrano che questo metodo è adatto a studiare come le proteine sinaptiche si accumulano in modo organizzato mediante esperimenti di corsi temporali e ad esaminare la fonte di proteine sinaptiche (trasporto da corpi cellulari o locali traslazione negli assoni) rimuovendo i corpi cellulari.

come illustrato nella Figura 1. Schema di formazione e rimozione dei corpi cellulari dalla sfera del neurone.
(A) Analisi della formazione di presynapsi utilizzando perline di streptavidina coniugate ltinyularate biotinylata per indurre i presynapsi negli assoni della cultura della palla neuronale preparati a partire dai cortici E16. LRRTM2, una proteina post-sinaptica, lega la neurexina (NRXN) e agisce come organizzatore di presynapsi. Le perle Streptavidin coniugate alle regioni extracellulari LRRTM2 biotinylate (perline LRRTM2) sono state applicate a DIV11-12 alla coltura della palla neuronale per indurre le presynapsi. Questa cifra è stata modificata rispetto alla precedente pubblicazione8. (B) L'estremità della punta gialla è stata tagliata e posizionata sull'area del corpo cellulare della coltura della palla del neurone ad un angolo di 45 gradi. I corpi cellulari sono stati rimossi per aspirazione. Fare clic qui per visualizzare una versione più grande di questa figura.

come illustrato nella Figura 2. Accumulo di Munc18-1 in presynapsi in presenza e assenza di corpi cellulari di palla del neurone.
(A) Dopo l'incubazione di 4 h con perline LRRTM2, la proteina zona attiva Munc18-1 si è accumulata nei siti pressinaptici indotti negli assoni (pannello superiore; schema sperimentale, immagine di fase centrale; inferiore; SE immagini di accumulo di Munc18-1). Le immagini sono state catturate come immagini a basso ingrandimento utilizzando l'obiettivo 10X e l'ingrandimento intermedio (1.5X) per vedere l'intera immagine composta da una palla neuronale, assoni e perline. I quadrati tratteggiati indicano l'area della sfera del neurone per la posizione di imaging accurata delle perline. Barra della scala, 20 m (a sinistra; immagine originale), 10 m (a destra; immagine ingrandita). (B) Munc18-1 si è accumulato molto bene anche in assenza di corpi cellulari nei siti pressinaptici indotti negli assoni. Questo risultato indica che gli assoni possono sopravvivere e formare presnapsi anche dopo aver rimosso i corpi cellulari per almeno 4 h. Fare clic qui per visualizzare una versione più grande di questa figura.
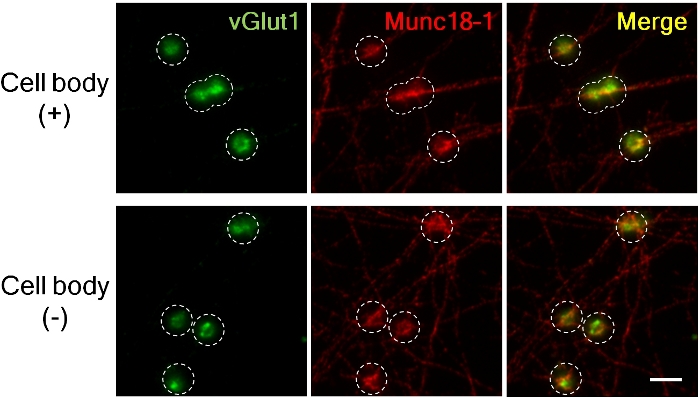
come illustrato nella figura 3. Accumulo di vGlut1 e Munc18-1 in presynapsi di assoni con e senza corpi cellulari.
Il marcatore pressinaptico eccitatorio vGlut1 (verde) e Munc18-1 (rosso) accumulato in presynapses 4 h dopo l'aggiunta di perline LRRTM2. (Pannello superiore; con corpi cellulari, più basso; senza corpi cellulari). Le immagini sono state catturate utilizzando lenti ad immersione ad olio 60X per un ingrandimento elevato per misurare l'intensità fluorescente. Cerchio tratteggiato delineato la posizione di perline. Munc18-1 ha accumulato un'estensione quasi simile in presenza e assenza di corpi cellulari nei presilnapsi, ma l'accumulo di vGlut1 è ridotto senza corpi cellulari8. Barra di scala, 5 m. Fare clic qui per visualizzare una versione più grande di questa figura.

come illustrato nella Figura 4. Procedura di misurazione dell'intensità SE e impatto della rimozione dei corpi cellulari e dell'inibizione della sintesi proteica sull'accumulo di Munc18-1 nelle sfere di neurone.
(A) Il diagramma ha mostrato il metodo di quantificazione dell'intensità IF in un sito pressinaptico indotto in un assone della coltura della palla neuronale. Barra della scala, 5 m. I dettagli sono descritti nella sezione protocollo. (B) Corso temporale dell'accumulo di vGlut1 in presynapsi indotti con perline LRRTM2. I dati mostrati sono medi: SEM per n - 20. ANOVA bidirezionale con test di confronto multiplo di Tukey. < 0,01. (C) Corso di tempo di accumulo di Munc18-1 in WT e Fmr1-KO presynapses sotto perline LRRTM2. I dati mostrati sono medi: SEM per n - 20, ANOVA bidirezionale con test di confronto multiplo di Tukey. n.s., non significativo; p < 0,01, significativamente diverso tra WT e KO. (D) Il grafico a barre mostrava il livello di accumulo Munc18-1 nei presynapsi delle sfere del neurone WT e Fmr1-KO in presenza o assenza di 25 anisomicina M (Aniso) con (CB) o senza (CB-) corpi cellulari. I dati mostrati sono medi: SEM per n - 20. ANOVA bidirezionale con test di confronto multiplo di Tukey. < 0,01, n.s., non significativo. : indicato p < 0.01, significativamente diverso con e senza anisomicina. Queste cifre sono state modificate rispetto alla precedente pubblicazione8. Fare clic qui per visualizzare una versione più grande di questa figura.
Figura supplementare Figura 1. Vettore di espressione bicystronica per LRRTM2-ECR (Regione Extracellulare) e BirA (biotin a ligase di E. coli ).
Tra le sequenze di codifica LRRTM2-ECR e BirA, esiste una sequenza IRES (Internal Ribosomal Entry Site) che permette di co-esprimere entrambe le proteine da singolo mRNA. Gli azionamenti promotori hEF1-HTLV esprimono l'mRNA bicstronico, ed entrambe le proteine vengono secrete dalle sequenze di peptidi del segnale dopo la traduzione. Sequenza di codifica LRRTM2-ECR è collegata a diverse sequenze di tag peptidi (DYKDDDDK, TEV, Myc e His tag) e Biotin Acceptor Sequence (BAS). BirA è collegato al tag DYKDDDDV. Secreted BirA biotinylas lisina della sequenza BAS di LRRRTM2-ECR per legarsi a perline streptavidine. Clicca qui per scaricare la figura.
Discussione
Abbiamo sviluppato un nuovo metodo per esaminare la formazione di presynapsi stimolata con l'uso di perle l'RRTM2 utilizzando la coltura della palla neuronale. Attualmente, la maggior parte del test di formazione presilnapse include perline rivestite poli-D-lysina (PDL) e coltura dissociata/camera microfluidica20,21,22. Uno dei vantaggi di questo metodo è LRRTM2-perline. Mentre LRRTM2 interagisce con neurexin per formare presynapsi eccitatori specificamente11,12,13, PDL-perline induce presynapsi eccitatori e inibitori non specificamente20. In questo metodo, altri organizzatori di presynapsi, i cui membri sono oltre 10 proteine3, sono applicabili per indurre presynapses cambiando dominio extracellulare di proteine biotinylate a seconda dello scopo sperimentale.
Un altro vantaggio è la cultura della palla del neurone. In alcuni casi, la coltura dissociata convenzionale è stata utilizzata per analizzare la formazione di presynapsi20. Tuttavia, la coltura dissociata non è adatta per analizzare bassi livelli di proteine sinaptiche all'interno delle carenze, perché i segnali schiaccianti nei corpi cellulari e nei dendriti interferiscono i segnali nei presnapsi. Invece, alcuni gruppi utilizzano coltura dissociata nella camera microfluidica che è un apparato speciale per la coltura di assoni e corpi cellulari separatamente in 2 comprtments21,22. Utilizzando la camera microfluidica, il foglio assonale si forma nel compartimento assonale e i corpi cellulari sono in grado di essere rimossi dal compartimento del corpo cellulare, simile alla coltura della palla del neurone. Tuttavia, la camera microfluidica è un apparato speciale e richiede alcune abilità per mantenere una condizione di coltura costante. La coltura della palla neuronale non è necessaria per utilizzare un apparato speciale, ed è relativamente facile da introdurre come un nuovo metodo sperimentale. Poiché l'essenza della cultura della palla neuronale è solo per posizionare aggregati di cellule neuronali (palle di neurone) alla piatta/ camera con fondo di vetro, può essere facilmente combinata con altri metodi. Ad esempio, si ritiene che la coltura della palla neuronale utilizzando LRRTM2-perline è applicabile per lo screening ad alto contenuto per misurare la fluorescenza di 10-20 perline area allo stesso tempo.
Fase critica di questo protocollo è il rivestimento con PLL. Se il rivestimento PLL non è uniforme, gli assoni delle sfere del neurone non si estenderebbero uniformemente in tutte le direzioni. Questo disturba l'analisi efficiente della formazione di presynapsi. Usiamo coverin pelle di vetro e piatti con fondo di vetro, tuttavia, il vetro a volte non è così pulito per la coltura neuronale e rivestimento uniforme con PLL. In questo protocollo, in un primo momento, coperture in vetrolips e piatti con fondo di vetro sono immersi in detersivo neutro non fosforo per 1-3 durante la notte, e poi lavati 8 volte con acqua ultrapura. Usiamo PLL il cui peso molecolare > 300.000 per ridurre la sua concentrazione (15 g/mL) per uno sfondo indesiderato inferiore. Se viene utilizzato un peso molecolare inferiore di PLL (adesempio, 30.000-70,000), è necessaria una maggiore concentrazione (100 g/mL) per estendere gli assoni.
La limitazione di questo metodo è che la cultura della palla neuronale non può mantenere > DIV15-16. Assoni di sfere di neurone sono frammentati dopo DIV15-16. Gli assoni frammentati non producono alcuna pressinapsi dopo l'applicazione di perline LRRTM2. Pertanto, questo metodo non è applicabile per analizzare i neuroni maturi (> DIV21). Tuttavia, nella maggior parte dei casi11,12,21,22, test di formazione presilnapse utilizza neuroni più giovani che sono coltivati fino a DIV14. Un'altra limitazione è che gli assoni senza corpi cellulari non possono sopravvivere oltre 4 h. Abbiamo analizzato l'accumulo di 5 proteine sinaptiche in presynapsi finora, l'accumulo di tutte le proteine che abbiamo controllato ha raggiunto quasi plateau entro 4 h (osservazione inedita). Si ritiene che le proteine sinaptiche si accumulino abbastanza a 4 h per analizzare da dove derivano le proteine sinaptiche (corpo cellulare o assone).
La combinazione della cultura della palla neuronale con LRRTM2-perline è relativamente semplice e flessibile per adattare molte piattaforme sperimentali. Abbiamo già applicato questo metodo per misurare l'attività pressinaptica utilizzando colorante AM1-43 (osservazione inedita). Questo metodo è considerato applicabile per lo screening ad alta velocità effettiva. L'applicazione della formazione di presynapsi è possibile applicare lo screening ad alto contenuto macchiando le proteine sinaptiche nelle presynapsi formate sotto l'LRRTM2-perle. Questo metodo contribuirebbe a trovare nuovi composti per curare le malattie neurologiche.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è in parte supportato da JSPS Grant-in-Aid for Scientific Research (KAKENHI) (C) (n. 22500336, 25430068, 16K07061) (Y. Sasaki). Ringraziamo il Dr. Terukazu Nogi e la signora Makiko Neyazaki (Yokohama City University) per aver gentilmente fornito proteine LRRTM2 biotinylate. Ringraziamo anche Honami Uechi e Rie Ishii per l'assistenza tecnica.
Materiali
| Name | Company | Catalog Number | Comments |
| Antibody diluent | DAKO | S2022 | |
| Alexa Fluor 594 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-585-151 | |
| Alexa Fluor 488 AffiniPure Donkey Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-545-152 | |
| mouse anti-Munc18-1 | BD Biosciences | 610336 | |
| B-27 Supplement (50X), serum free | Thermo Fisher Scientific | 17504044 | |
| Bovine Serum Alubumin (BSA) | Nacalai Tesque | 01863-48 | |
| Cell-Culture Treated Multidishes (4 well dish) | Nunc | 176740 | |
| Complete EDTA-free | Roche | 11873580001 | |
| cooled CCD camera | Andor Technology | iXON3 | |
| Coverslip | Matsunami | C015001 | Size: 15 mm, Thickness: 0.13-0.17 mm |
| Cytosine β-D-arabinofuranoside (AraC) | Sigma-Aldrich | C1768 | |
| 4',6-Diamidino-2-phenylindole Dihydrochloride (DAPI) | Nacalai Tesque | 11034-56 | |
| Deoxyribonuclease 1 (DNase I) | Wako pure chemicals | 047-26771 | |
| Expi293 Expression System | Thermo Fisher Scientific | A14635 | |
| Horse serum | Sigma-Aldrich | H1270 | |
| image acquisition software | Nikon | NIS-element AR | |
| Image analysis software | NIH | Image J | https://imagej.nih.gov/ij/ |
| Inverted fluorecent microscope | Nikon | Eclipse Ti-E | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | |
| Neurobasal media | Thermo Fisher Scientific | #21103-049 | |
| Normal Goat Serum (NGS) | Thermo Fisher Scientific | #143-06561 | |
| N-propyl gallate | Nacalai Tesque | 29303-92 | |
| Paraformaldehyde (PFA) | Nacalai Tesque | 26126-25 | |
Paraplast Plus | Sigma-Aldrich | P3558 | |
| Poly-L-lysine Hydrobromide (MW > 300,000) | Nacalai Tesque | 28359-54 | |
| poly (vinyl alcohol) | Sigma | P8136 | |
| Prepacked Disposable PD-10 Columns | GE healthcare | 17085101 | |
| rabbit anti-vesicular glutamate transporter 1 | Synaptic Systems | 135-302 | |
| SCAT 20X-N (neutral non-phosphorous detergent) | Nacalai Tesque | 41506-04 | |
| Streptavidin-coated magnetic particles | Spherotech Inc | SVM-40-10 | diameter: 4-5 µm |
| TritonX-100 | Nacalai Tesque | 35501-15 | |
| Trypsin | Nacalai Tesque | 18172-94 |
Riferimenti
- Waites, C. L., Craig, A. M., Garner, C. C. Mechanisms of Vertebrate Synaptogenesis. Annual Review of Neuroscience. 28 (1), 251-274 (2005).
- Ziv, N. E., Garner, C. C. Cellular and molecular mechanisms of presynaptic assembly. Nature Reviews Neuroscience. 5 (5), 385-399 (2004).
- Chia, P. H., Li, P., Shen, K. Cellular and molecular mechanisms underlying presynapse formation. Journal of Cell Biology. 203 (1), 11-22 (2013).
- Südhof, T. C. Neuroligins and neurexins link synaptic function to cognitive disease. Nature. 455 (7215), 903-911 (2008).
- Saitsu, H., et al. CASK aberrations in male patients with Ohtahara syndrome and cerebellar hypoplasia. Epilepsia. 53 (8), 1441-1449 (2012).
- Friedman, H. V., Bresler, T., Garner, C. C., Ziv, N. E. Assembly of New Individual Excitatory Synapses. Neuron. 27 (1), 57-69 (2000).
- Bresler, T., et al. Postsynaptic density assembly is fundamentally different from presynaptic active zone assembly. The Journal of neuroscience the official journal of the Society for Neuroscience. 24 (6), 1507-1520 (2004).
- Parvin, S., Takeda, R., Sugiura, Y., Neyazaki, M., Nogi, T., Sasaki, Y. Fragile X mental retardation protein regulates accumulation of the active zone protein Munc18-1 in presynapses via local translation in axons during synaptogenesis. Neuroscience Research. , (2018).
- Sasaki, Y., et al. Phosphorylation of Zipcode Binding Protein 1 Is Required for Brain-Derived Neurotrophic Factor Signaling of Local β-Actin Synthesis and Growth Cone Turning. Journal of Neuroscience. 30 (28), 9349-9358 (2010).
- Sasaki, Y., Gross, C., Xing, L., Goshima, Y., Bassell, G. J. Identification of axon-enriched microRNAs localized to growth cones of cortical neurons. Developmental neurobiology. 74 (3), 397-406 (2014).
- Linhoff, M. W., et al. An Unbiased Expression Screen for Synaptogenic Proteins Identifies the LRRTM Protein Family as Synaptic Organizers. Neuron. 61 (5), 734-749 (2009).
- de Wit, J., et al. LRRTM2 Interacts with Neurexin1 and Regulates Excitatory Synapse Formation. Neuron. 64 (6), 799-806 (2009).
- Ko, J., Fuccillo, M. V., Malenka, R. C., Südhof, T. C. LRRTM2 Functions as a Neurexin Ligand in Promoting Excitatory Synapse Formation. Neuron. 64 (6), 791-798 (2009).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature protocols. 1 (5), 2406-2415 (2006).
- Hirai, H., et al. Structural basis for ligand capture and release by the endocytic receptor ApoER2. EMBO reports. , (2017).
- Yasui, N., et al. Functional Importance of Covalent Homodimer of Reelin Protein Linked via Its Central Region. Journal of Biological Chemistry. 286 (40), 35247-35256 (2011).
- Bassell, G. J., Warren, S. T. Fragile X Syndrome: Loss of Local mRNA Regulation Alters Synaptic Development and Function. Neuron. 60 (2), 201-214 (2008).
- Darnell, J. C., Klann, E. The translation of translational control by FMRP: therapeutic targets for FXS. Nat Neurosci. 16 (11), 1530-1536 (2013).
- Richter, J. D., Bassell, G. J., Klann, E. Dysregulation and restoration of translational homeostasis in fragile X syndrome. Nature Reviews Neuroscience. 16 (10), 595-605 (2015).
- Lucido, A. L., et al. Rapid Assembly of Functional Presynaptic Boutons Triggered by Adhesive Contacts. Journal of Neuroscience. 29 (40), 12449-12466 (2009).
- Taylor, A. M., Wu, J., Tai, H. C., Schuman, E. M. Axonal Translation of β-Catenin Regulates Synaptic Vesicle Dynamics. Journal of Neuroscience. 33 (13), 5584-5589 (2013).
- Batista, A. F. R., Martínez, J. C., Hengst, U. Intra-axonal Synthesis of SNAP25 Is Required for the Formation of Presynaptic Terminals. Cell reports. 20 (13), 3085-3098 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon