Method Article
Ensaio de formação presynapse usando Presynapse organizador contas e "Neuron Ball" cultura
Neste Artigo
Resumo
A formação de presynapse é um processo dinâmico que inclui a acumulação de proteínas sináptica na ordem apropriada. Neste método, a formação do presynapse é provocada pelos grânulos conjugados com uma proteína do organizador do presynapse em folhas axonal da cultura da esfera do Neuron do "", de modo que a acumulação de proteínas sináptica seja fácil de ser analisada durante a formação do presynapse.
Resumo
Durante o desenvolvimento neuronal, a formação de sinapse é um passo importante para estabelecer circuitos neurais. Para formar sinapses, as proteínas sinápticas devem ser fornecidas em ordem apropriada pelo transporte de corpos celulares e/ou tradução local em sinapses imaturas. No entanto, não é totalmente compreendido como as proteínas sinápticas se acumulam em sinapses em ordem adequada. Aqui, nós apresentamos um método novo para analisar a formação pré-sináptica usando a combinação da cultura da esfera do neurônio com os grânulos para induzir a formação do presynapse. As esferas do Neuron que são agregados da pilha neuronal fornecem as folhas axonal longe dos corpos e dos dendrites da pilha, de modo que os sinais fluorescentes fracos dos presynapses possam ser detectados evitando sinais esmagadores de corpos da pilha. Como grânulos para desencadear a formação de presynapse, usamos grânulos conjugados com repetição rica em leucina transmembrana neuronal 2 (LRRTM2), um organizador pré-sináptica excitatória. Usando este método, Nós demonstramos que o transportador vesicular 1 do glutamato (vGlut1), uma proteína sináptica do vesícula, acumulada em presynapses mais rapidamente do que Munc18-1, uma proteína da zona ativa. Munc18-1 acumulou a tradução-dependente no presynapse mesmo depois de remover corpos de pilha. Este achado indica o acúmulo de Munc18-1 por tradução local em axônios, não transporte de corpos celulares. Em conclusão, este método é apropriado analisar a acumulação de proteínas sináptica em presynapses e na fonte de proteínas sináptica. Como a cultura da esfera do neurônio é simples e não é necessário usar o instrumento especial, este método poderia ser aplicável a outras plataformas experimentais.
Introdução
A formação de sinapse é uma das etapas críticas durante o desenvolvimento de circuitos neurais1,2,3. A formação de sinapses especializadas em compartimentos compostos de pré e pós-sinapses é um processo complexo e multipasso que envolve o reconhecimento adequado de axônios e dendritos, formação de zona ativa e densidade pós-sináptica, e alinhamento adequado de canais iônicos e receptores neurotransmissores1,2. Em cada processo, muitos tipos de proteínas sinápticas se acumulam a estes compartimentos especializados em tempo adequado, transportando proteínas sinápticas de corpos celulares e/ou por tradução local nos compartimentos. Estas proteínas sinápticas são consideradas dispostas de forma organizada para formar sinapses funcionais. Disfunção de algumas proteínas sinápticas envolvendo a formação de sinapse resulta em doenças neurológicas4,5. Entretanto, permanece obscuro como as proteínas sináptica acumulam no sincronismo apropriado.
Para investigar como as proteínas sinápticas se acumulam de forma organizada, é necessário examinar a acumulação de proteínas sinápticas em ordem cronológica. Alguns relatos demonstraram imagens ao vivo para observar a formação de sinapse em cultura dissociada de neurônios6,7. Entretanto, é demorado encontrar os neurônios que apenas começam a formação do sinapse a microscopia. Para observar a acumulação de proteínas sinápticas de forma eficiente, a formação de sinapse deve começar no momento em que os pesquisadores querem induzir a formação. O segundo desafio é distinguir o acúmulo de proteínas sinápticas devido ao transporte de corpos celulares ou tradução local em sinapses. Para esse efeito, o nível de tradução é necessário para ser medido a condição de que não permite o transporte de proteínas sinápticas de corpos celulares.
Nós desenvolvemos o ensaio novo da formação do presynapse usando a combinação de cultura da esfera do neurônio com grânulos para induzir a formação do presynapse8. A cultura da esfera do Neuron é desenvolvida para examinar o phenotype axonal, devido à formação de folhas axonal que cercam corpos da pilha9,10. Foram utilizados grânulos magnéticos conjugados com repetição rica em leucina transmembrana neuronal 2 (LRRTM2) que é um organizador pré-sináptico para induzir presynapses excitatórias (Figura 1a)11,12,13. Usando os grânulos LRRTM2, a formação do presynapse começa no momento em que os grânulos são aplicados. Isto significa que a formação de pré-sinapse começa em milhares de axônios de uma bola de neurônio ao mesmo tempo, assim, permite examinar o curso de tempos precisos de acumulação de proteínas sináptica eficientemente. Além disso, a cultura da bola de neurônio é fácil de bloquear o transporte de proteínas sinápticas de soma removendo corpos celulares (Figura 1b)8. Já confirmamos que os axônios sem corpos celulares podem sobreviver e são saudáveis pelo menos 4 h após a remoção de corpos celulares. Assim, este protocolo é adequado para investigar a partir de onde as proteínas sinápticas são derivadas (corpo celular ou AXON), e como as proteínas sinápticas se acumulam de forma organizada.
Protocolo
Os experimentos descritos neste manuscrito foram realizados de acordo com as diretrizes delineadas no Comitê institucional de cuidado e uso de animais da Universidade da cidade de Yokohama.
1. preparação de esferas do neurônio como a cultura de suspensão da gota (dias in vitro (div) 0-3)
Nota: os procedimentos descritos aqui para a preparação da cultura da esfera do neurônio são baseados no método relatado previamente pelo grupo de Sasaki com algumas modificações9,10. Também adotamos diversos procedimentos do método Banker para a cultura dissociada14.
-
Confirmando os seguintes antes de começar a dissecção
- Prepare todas as soluções necessárias e esterilize-as por autoclave/filtração com antecedência.
- Mantenha-se pronto todos os instrumentos e materiais a ser usados em cada etapas desta cultura cortical do neurônio.
- Pulverize e limpe o armário do fluxo de ar laminar, a tabela da dissecção, a placa do estágio do stereomicroscope, as tesouras, e o fórceps com etanol 70%.
- Eutanizar o rato em cima da aplicação de CO2 e dissecar o abdômen para obter os embriões E16.
- Retire os cérebros dos embriões com cuidado com a ajuda de pontas finas do fórceps e transfira-os em pratos da cultura da pilha de 60 milímetros que contêm 4 mL da solução de sal tamponada HEPES (HBSS).
Nota: o meio de dissecção HBSS contém 10 mM de HEPES (pH 7,4), 140 mM NaCl, 5,4 mM KCl, 1, 9 mM na2HPO4, 1,1 mm KH2po4, 5,6 mm D-glucose e 5,64 μm de fenol vermelho. - Retire o couro cabeludo, cortar o bulbo olfativo, separar córtices de cada hemisfério cerebral usando as pontas finas de fórceps estereomicroscópio, e transferir para outros 60 mm pratos contendo HBSS fresco. Use pelo menos 3-5 embriões para cada cultura separada da esfera do neurônio.
- Corte os córtices em partes pequenas com as tesouras microdissecando da mola em uma capa laminar da cultura da pilha de fluxo.
- Transfira os córtices triturados a um tubo de 15 ml e Trypsinize os córtices triturados em 4 ml de tripsina de 0,125% em HBSS para 4,5 minutos em um banho de água em 37 ° c.
Nota: este tempo de tripsinização é crítico para a cultura eficiente do neurônio como o tempo crescente (> 4,5 min) conduz aos neurônios muito mais inoperantes. - Transfira os agregados celulares para um novo tubo de 15 mL contendo 10 mL de HBSS por uma pipeta de transferência estéril e incubar a 37 ° c durante 5 min. Repita este passo mais uma vez.
- Transfira os agregados celulares para um novo tubo de 15 mL contendo 2 mL de meios Neurobasais contendo GlutaMax, suplemento B27 (meio NGB), 0, 1% DNase I e 10% de soro de cavalo.
- Triturar os córtices tripsinizadas repetidamente pipetagem os acima e para baixo (3-5 vezes) usando o vidro fino fogo-lustrado pipeta de Pasteur.
Nota: o diâmetro do vidro fino polido a fogo pipeta de Pasteur é muito importante como descrito no papel14do método do banqueiro. Se a pipeta é demasiado estreita para passar córtices, prepare pipetas possuindo 2-3 tamanhos diferentes, e tente a partir de pipeta maior. - Para preparar as esferas do neurônio, tome a suspensão acima da pilha e ajuste a densidade da pilha a 1 x 106 Cells/ml usando o meio de NGB.
- Cultura os neurônios corticais como gotas penduradas contendo 10.000 células/gota (1 gota é 10 μL) dentro das tampas superiores de 10 cm pratos de cultura.
- Adicionar 7 ml de fosfato salina tamponado (PBS) para a parte inferior dos pratos de cultura, em seguida, manter em uma incubadora para 3 dias a 37 ° c com 5% co2 condição umidificada para permitir a formação de bola de neurônio.
2. colocando bolas de neurônio em coberturas de vidro revestidas com PLL e manutenção da cultura (div 3-11)
Nota: antes do revestimento de coberturas de vidro com poli-L-lisina (PLL), lavar as lamelas usando detergente é importante. Os COVERSLIP de vidro são às vezes não tão limpos para a cultura neuronal e o revestimento uniforme com PLL. O revestimento não-uniforme de PLL pode conduzir à extensão axonal desigual de esferas do neurônio.
- Mergulhe as coberturas em 1/20 diluído neutro não-fósforo detergente em cerâmica racks para 1-3 overnights.
- Lave os lamínulas 8 vezes em água ultrapura e, em seguida, esterilize num forno a 200 ° c durante 12 h.
Nota: todas as etapas daqui devem ser feitas em uma capa de cultura de célula de fluxo de ar laminar. - Transfira coberturas assadas para pratos de 100 mm. Após selar o prato por parafilm entre uma tampa e um prato inferior, os COVERSLIP cozidos podem ser mantidos para o armazenamento a longo prazo.
- Opcional Aplique pontos de parafina nos lamínulas. Os pontos fazem o espaço para impedir as esferas do neurônio que desanexam dos COVERSLIP durante a imunomarcação pelo contato direto de esferas do neurônio aos pratos plásticos. Derreter a parafina em um frasco adequado em um banho de água quente em cerca de 90 ° c. Mergulhe uma pipeta Pasteur na parafina, em seguida, tocá-lo rapidamente para fazer três pontos perto da borda de uma lamínula.
- Revestimento PLL (MW > 300.000) nas coberturas de vidro parafina-frisadas em pratos de 60-mm usando a solução de PLL (15 μg/mL no tampão do borato), e mantenha-os para pelo menos 1 h em uma incubadora do CO2 .
- Depois de lavar 4 vezes com PBS, transfira as coberturas revestidas com PLL para uma placa de 4 poços contendo 350 μL de meio NGB em cada poço e cloridrato de citosina β-D-arabinofuranoside (AraC, 3 μM) para a mídia para matar células divisórias.
- Mantenha esta placa 4-well que contem os COVERSLIP PLL-revestidos na incubadora do co2 pelo menos por 20 minutos para assegurar a temperatura do alcance médio 37 ° c antes de transferir esferas do neurônio.
- Na div 3, quando "bolas de neurônio" são formadas muito bem, transferi-los para coberturas revestidas PLL dentro da placa de 4 poços (5 bolas neurônio/poço) mantidos na incubadora co2 .
- Após 48 h, substitua o meio de cultura da esfera do neurônio com meio arac-livre fresco de NGB. Use uma placa quente em uma capa da cultura da pilha do fluxo de ar laminar cuja a temperatura seja mantida pronta em 37 ° c imediatamente antes deste procedimento.
Nota: é necessário executar o meio que muda tão ràpida como possível em uma placa quente para reduzir o tempo que as culturas estão na parte externa da incubadora do CO2 . - Mantenha esta cultura da esfera do neurônio na incubadora do co2 para até div 11.
Nota: em div 11-12, as esferas do neurônio que estendem neuritos até 1-2 milímetros são usadas para experiências.
3. aplicando LRRTM2 grânulos na cultura da esfera do neurônio com ou sem corpos da pilha (div 11-12)
Nota: antes da aplicação de LRRTM2 grânulos na cultura da esfera do neurônio, recomenda-se remover corpos da pilha. Portanto, prepare LRRTM2 grânulos em primeiro lugar, em seguida, remova os corpos celulares e, mais tarde, aplique LRRTM2 grânulos para a cultura o mais cedo possível. O LRRTM2 biotinylated é fornecido pelo grupo de Nogi (Universidade da cidade de Yokohama) como o meio condicionado. Usam um vetor da expressão que inclui a seqüência do Acceptor da biotina e a ligase da biotina de e. coli BirA 15 anos de , 16 para anexar biotina a LRRTM2, e o vetor de expressão é transfected para Expi293F células incluídas no sistema de expressão Expi293. A informação vetorial está disponível na Figura 1 suplementar. Os grânulos LRRTM2-conjugated do estreptavidina de biotinylated reduziram o fundo da imunocoloração comparado extremamente ao LRRTM2-FC-grânulos conjugated da proteína A que são usados para o sistema do protótipo LRRTM28.
-
Preparação de grânulos LRRTM2 biotinylated
- Para remover o excesso de biotina do meio condicionado de células Expi293F expressando LRRTM2 biotinylated, aplique 1,7 mL do meio condicionado misturado com 0,8 mL de PBS (total 2,5 mL) para a coluna de filtração de gel PD-10. A coluna PD-10 é pré-equilibrada com 25 mL de água ultrapura e 25 mL de PBS.
- Elute com 3,5 mL de PBS e recolhe o fluxo-através como um estoque LRRTM2.
Nota: este estoque LRRTM2 pode ser dispensado a alíquotas e armazenada em-80 ° c para longo prazo. Os níveis de expressão de LRRTM2 biotinylated às vezes variam do lote ao lote. Assim, o volume apropriado do estoque LRRTM2 ao conjugado aos grânulos deve ser determinado para dar forma a presynapses bastante em esferas do neurônio, quando o lote novo do estoque LRRTM2 é usado na primeira vez. - Tome 20 μL da suspensão de partículas magnéticas revestidas com streptavidina (diâmetro: 4-5 μm) a um tubo de microcentrífuga. Imobilize os grânulos a um instrumento handmade Unido com os ímãs permanentes do neodymium e lave três vezes com 100 μL de PBS-MCBC em tubos do microcentrifugador de 1,5 mL.
Nota: PBS-MCBC contém PBS incluindo 5 mM MgCl2,3mm CAcl2, 0,1% BSA, e 0,1% completo EDTA-livre. - Após a remoção completamente PBS-MCBC dos grânulos, adicione o volume predeterminado de estoque LRRTM2 (geralmente 500-1000 μL, veja a nota 3.1.2) aos grânulos lavados. Incubar a mistura utilizando rotador a 4 ° c por 1-2 h.
- Lave os grânulos duas vezes com 100 μL de PBS-MCBC, e mais tarde com 100 μL de meio NGB.
- Resuspend os grânulos LRRTM2 em 50 μl do meio de NGB para a aplicação à cultura da esfera do neurônio.
- Use os mesmos procedimentos para preparar as esferas de controle (controle negativo) em um outro tubo do microcentrifugador exceto a adição de proteínas biotinylated-LRRTM2.
-
Removendo corpos de células de bolas de neurônio em div 11-12 e aplicando LRRTM2 contas
- Rotule os poços de uma placa 4-well como "corpo da pilha (+)" e "corpo da pilha (-)".
- Corte o final de uma ponta amarela no ângulo de 45 ° com uma lâmina de barbear previamente pulverizada com 70% de etanol estereomicroscópio (Figura 1b).
- Coloque a ponta amarela na área do corpo da célula de uma bola de neurônio e retire os corpos celulares por sucção (Figura 1b).
- Para identificar cada condição especificada do experimento, Rotule os poços novamente como "LRRTM2 Beads" e "contas de controle".
- Aplique o LRRTM2 e esferas de controle na cultura da esfera do neurônio, e mergulhe à parte inferior das placas por 1 minuto usando ímãs da ferrite para começar a formação do presynapse. Este procedimento assegura para touchdown todas as contas ao mesmo tempo. Especialmente, seria eficaz para incubação de curto período de tempo (por exemplo, 30 min e 1 h) com LRRTM2 contas de forma síncrona.
- Para realizar experimentos de curso de tempo, rotule cada poço separado como 0 min, 30 min, 1 h, 2 h, 4 h e 18 h e aplique LRRTM2 grânulos nos intervalos de tempo indicados.
- Após a adição de LRRTM2 grânulos, incubar a cultura da esfera do neurônio com os grânulos para o tempo especific (0 min a 18 h) para dar forma a presynapses.
4. imunocoloração e microscopia
Nota: fixar as células por 4 h através de incubação com LRRTM2 grânulos nas condições experimentais com e sem corpos celulares, como os axônios tendem gradualmente a morrer na ausência de corpos celulares após 4 h. Em caso do curso do tempo com grânulos LRRTM2, fixe as pilhas no tempo especificado indicado.
-
Fixar e manchar neurônios na cultura da esfera do neurônio após a formação do presynapse com grânulos LRRTM2
- Remova o meio de NGB e fixe as esferas do neurônio com o PFA de 4% em PBS (250 μl/poço) por 20 minutos na temperatura ambiente, e lave então com 500 μL de PBS 4 vezes cada 5 minutos.
- Lave as células fixas com TBS (solução tampão salina Tris: 50 mM Tris-HCl (pH 7,3) e 150 mM NaCl) por mais de 5 min.
- Permeabilize as células/axônios da cultura da esfera do neurônio com TBS contendo 0,3% Triton X-100 por 5 min.
- Mantenha as células 1 h para bloqueio com tampão de bloqueio (0,1% Triton X-100 e 5% NGS (soro de cabra normal) em TBS).
- Incubar as células com anticorpos primários; anti-Rabbit-vGlut1 (transportador vesicular do glutamato 1 (1:4000)) e anti-rato-Munc18-1 (1:300) diluído com o diluente do anticorpo para durante a noite em 4 ° c.
- Lave as coberturas 4 vezes com a reserva de imunofluorescência (IF) (0,1% Triton X-100 e 2% BSA em TBS) e incubar por 30 min com fluoróforo (Alexa Dye)-2 anticorpos conjugados; anti-mouse-IgG-Alexa 555 (1:500), anti-Rabbit-IgG-Alexa 488 (1:1000).
- Manchar os núcleos dos corpos celulares de neurônios por 5 min com 4 ′, 6-diamidino-2-phenylindole (DAPI, 1 μg/mL) em PBS.
- Lave as coberturas três vezes com PBS e, em seguida, monte em lâminas de vidro usando suportes de montagem contendo 167 mg/mL de álcool poli (vinil) e 6 mg/mL de N-propil galato.
- Guarde as lâminas de vidro num frigorífico a-20 ° c até à microscopia. Sinais fluorescentes das lâminas de vidro são detectáveis por pelo menos 1 ano quando as lâminas são armazenadas a-20 ° c.
-
Tirar imagens microscópio de fluorescência
- Capture o contraste diferencial da interferência e as imagens de IF um microscópio fluorescente invertido com uma câmera refrigerada do CCD usando a lente da imersão do óleo 60X. Para o software da aquisição da imagem, use um sistema instalado software do microscópio. Use Image J como software de análise de imagem.
- Meça a intensidade de IF em presynapses no AXON usando a seguinte fórmula; SE intensidades de região de interesse em grânulos (ROI) – off esferas região intensidade/axonal intensidade ao longo de 20 μm de grânulos – intensidade de fundo. Esta intensidade da relação fornece o índice da acumulação da proteína (figura 4a). Realize as medições em imagens originais de 16 bits usando o software Image J.
- Para quantificar o nível de acumulação de proteína particular em pré-sinapse induzida com LRRTM2 grânulos, sempre selecione a área longe de 2-campo de visão ou mais para além do corpo celular com microscópio (60X).
Nota: a seleção da área na esfera do neurônio para a imagem latente é crucial porque os axônios densos estão perto do corpo da pilha e a periferia da esfera do neurônio pode fornecer o único AXON. - Para a medida exata, escolha o campo axonal 5-Different (distância similar dos corpos da pilha)/COVERSLIP.
- Manter condições de imagem idênticas em diferentes dias e entre experimentos
Resultados
Aqui, nós mostramos resultados representativos da acumulação de proteínas pré-sináptica em presynapses LRRTM2-induced de folhas axonal da cultura da esfera do neurônio. Como proteínas pré-sinápticas, foi analisada a proteína de vesículas excitatórias vGlut1 e a proteína da zona ativa Munc18-1. Nós igualmente examinamos o curso do tempo da acumulação de vGlut1 e de Munc18-1 em presynapses, e obtivemos resultados que indicam a fonte de Munc18-1 nos presynapses usando axônios que removemos corpos de pilha e um inibidor da síntese da proteína. Recentemente, nós investigamos um papel da proteína de retardo mental frágil de X (FMRP) na acumulação de Munc18-1 em presynapses8. O FMRP, que é um produto de gene causador da síndrome de X frágil (FXS), é uma proteína de ligação de mRNA para suprimir a tradução17,18,19. Nós igualmente examinamos a participação de FMRP na acumulação Munc18-1 usando os ratos modelo de FXS que é deficiente no FMRP da codificação do gene Fmr1 .
A aplicação de LRRTM2-Beads na cultura da esfera do neurônio no DIV11 induziu a acumulação de Munc18-1 em presynapses dos axônios de esferas do neurônio (Figura 2a). Mesmo em axônios que são corpos celulares removidos, a acumulação de Munc18-1 foi observada as esferas semelhantes como axônios de esferas neuronas com corpos celulares (Figura 2b). No caso típico, mais de 80% dos grânulos após 4 h-incubação com esferas do neurônio podem induzir a acumulação de proteínas sináptica em presynapses, julgado manchando Munc18-1 e vglut-1. Como os axônios são tão lotados e sobrepostos perto de corpos celulares (Figura 2AA, BA), mais região periférica de folhas axonais foram medidos onde os axônios não são tão sobrepostos (Figura 2AB, BB, por exemplo, área periférica longe de 2-campo da vista ou mais aparte do corpo da pilha com microscópio (60X)). Quando a região periférica da folha axonal foi analisada por lente objetiva de alta ampliação (60X), vGlut1 e Munc18-1 acumularam-se claramente em pré-sinapses de axônios as esferas (Figura 3). Às vezes, sinais fluorescentes de proteínas vesiculares sinápticas como vGlut1 são difíceis de serem detectados na região axonal fora dos grânulos, porque essas proteínas vesiculares sinápticas se acumulam tanto os grânulos. No caso de Munc18-1, os sinais fluorescentes podem ser detectados fracamente na região axonal fora dos grânulos.
Para quantificar o nível de acúmulo de proteínas sinápticas em pré-sínfitos induzidos por LRRTM2-Beads, foram mensuradas intensidades fluorescentes de axônios as esferas e fora dos grânulos e, em seguida, calculadas como índice de acumulação protéica (figura 4a, e descrito na seção de protocolo em detalhe). As experiências do curso do tempo demonstraram que a acumulação de vGlut1 em presynapses aumentou significativamente em 30 minutos (Figura 4B). Por outro lado, a acumulação de Munc18-1 passou a aumentar significativamente a 2 h, e atinge um planalto a 4 h (Figura 4C). Esses dados indicam que a proteína de vesícula sináptica vGlut1 acumula-se em pré-sínfitos anteriores à proteína da zona ativa Munc18-1. O acúmulo de Munc18-1 em pré-sinapses de neurônios Fmr1-KO aumentou 1,5 vezes mais do que aqueles em tipo selvagem (WT) (Figura 4C), indicando envolvimento da FMRP na acumulação de Munc18-1. Em seguida, para distinguir o acúmulo de Munc18-1 devido ao transporte de corpos celulares ou tradução local em axônios, um efeito do inibidor da síntese proteica anisomicina foi examinado sobre o acúmulo na presença ou ausência de corpos celulares (Figura 4D) . Anisomycin suprimiu a acumulação Munc18-1 significativamente nos axônios (Figura 4D), indicando que a acumulação é síntese da proteína-dependente. O acúmulo de pré-sinapses de axônios sem corpos celulares não foi significativamente diferente daquele com corpos celulares (Figura 4D). Estes resultados sugerem que a acumulação de Munc18-1 nos presynapses seja derivada na maior parte dos axônios, mas não transporte de Munc18-1 dos corpos de pilha. Se a acumulação de proteínas sinápticas é suprimida em presynapses de axônios, removendo corpos celulares, considera-se que esta diminuição é devido ao transporte de corpos celulares. Na verdade, quando examinamos o acúmulo de proteínas totais recém-sintetizadas metabolicamente marcadas por corante fluorescente, a remoção de corpos celulares reduziu significativamente o acúmulo de proteínas totais recém-sintetizadas, em comparação com as pré-sinapses de axônios com corpos celulares8. Embora o acúmulo de Munc18-1 em Fmr1-ko tenha aumentado mais em relação ao WT, a anisomicina suprimiu o acúmulo em nível semelhante ao WT e a remoção de corpos celulares não teve efeito sobre o acúmulo (Figura 4D). Esses resultados sugerem que a FMRP está envolvida na tradução local de Munc18-1 em axônios.
Os resultados representativos apresentados aqui demonstram que este método é adequado para investigar como as proteínas sinápticas se acumulam de forma organizada por experimentos de curso de tempo, e para examinar a fonte de proteínas sinápticas (transporte de corpos celulares ou locais Tradução em axônios) removendo corpos celulares.

Figura 1. Esquema da formação e da remoção do presynapse de corpos da pilha da esfera do neurônio.
(A) ensaio de formação de presynapse utilizando grânulos de streptavidina conjugados LRRTM2 biotinilados para induzir os pré-sinapses em axônios da cultura da esfera do neurônio preparados a partir de E16 córtices. LRRTM2, uma proteína pós-sináptica, liga neurexin (nrxn) e actua como um organizador do presynapse. Os grânulos de streptavidin conjugados às regiões LRRTM2 extracelular de biotinylated (grânulos LRRTM2) foram aplicados em DIV11-12 à cultura da esfera do neurônio para induzir presynapses. Este valor foi modificado a partir da publicação anterior8. (B) a extremidade amarela da ponta foi cortada e coloc na área de corpo da pilha da cultura da esfera do neurônio no ângulo de 45 °. Os corpos celulares foram removidos por sucção. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2. Munc18-1 acumulação em presynapses na presença e na ausência de corpos de pilha da esfera do neurônio.
(A) após 4 h de incubação com grânulos de LRRTM2, a proteína da zona ativa Munc18-1 acumulada nos sítios pré-sinápticos induzidos em axônios (painel superior; esquema experimental, meio; imagem de fase, inferior; SE imagens de Munc18-1 acumulação). As imagens foram capturadas como imagens de baixa ampliação usando lente 10x e ampliação intermediária (1,5 x) para ver toda a imagem composta de uma bola de neurônio, axônios e grânulos. Os quadrados tracejados indicam a área da esfera do neurônio para a posição exata da imagem latente dos grânulos. Barra de escala, 20 μm (esquerda; imagem original), 10 μm (direita; imagem ampliada). (B) Munc18-1 acumulou muito bem mesmo na ausência de corpos de pilha nos locais pré-sináptica induzidos nos axônios. Este resultado indica que os axônios podem sobreviver e formar pré-sinapses mesmo após a remoção de corpos celulares por pelo menos 4 h. por favor clique aqui para ver uma versão maior desta figura.
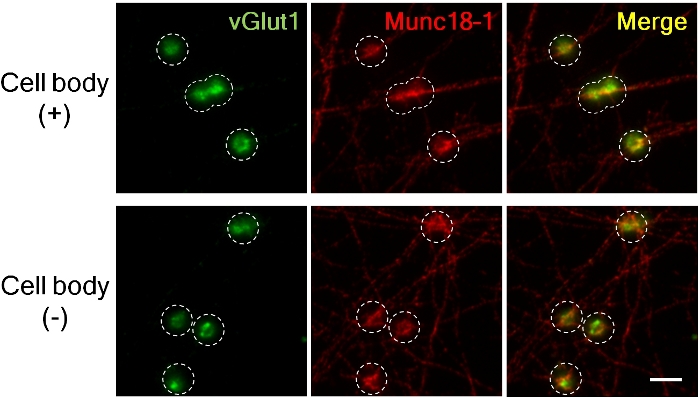
Figura 3. Acúmulo de vGlut1 e Munc18-1 em pré-sinapses de axônios com e sem corpos celulares.
O marcador pré-sináptica excitatórios vGlut1 (verde) e Munc18-1 (vermelho) acumulou em presynapses 4 h após a adição de LRRTM2 grânulos. (Painel superior; com corpos celulares, inferiores; sem corpos celulares). As imagens foram capturadas usando 60X lente de imersão de óleo para alta ampliação para medir a intensidade fluorescente. Círculo tracejado delineou a posição dos grânulos. Munc18-1 acumulou quase a extensão similar na presença e na ausência de corpos da pilha em presynapses mas a acumulação de vGlut1 é reduzida sem corpos de pilha8. Barra de escala, 5 μm. por favor clique aqui para ver uma versão maior desta figura.

Figura 4. Procedimento da medida da intensidade do If e do impacto da remoção dos corpos de pilha e do inibidor da síntese da proteína na acumulação Munc18-1 em esferas do neurônio.
(A) o diagrama mostrou o método da quantificação da intensidade do If em um local induzido-presynaptic no AXON da cultura da esfera do neurônio. Barra de escala, 5 μm. Os detalhes são descritos na seção de protocolo. (B) curso do tempo da acumulação de vGlut1 em presynapses induzidos com grânulos LRRTM2. Os dados mostrados são médios ± SEM para n = 20. ANOVA bidirecional com teste de comparação múltipla de Tukey. * *p < 0, 1. (C) tempo de acúmulo de Munc18-1 em WT e Fmr1-ko presynapses LRRTM2 grânulos. Os dados mostrados são média ± SEM para n = 20, ANOVA bidirecional com teste de comparação múltipla de Tukey. n.s., não significativo; * *p < 0, 1, significativamente diferente entre WT e ko. (D) o gráfico de barras mostrou nível de acúmulo de Munc18-1 em pré-sinapses de esferas de neurônio WT e Fmr1-ko na presença ou ausência de 25 μm de anisomicina (aniso) com (CB +) ou sem corpos celulares (CB-). Os dados mostrados são médios ± SEM para n = 20. ANOVA bidirecional com teste de comparação múltipla de Tukey. * *p < 0, 1, n.s., não significativo. # indicado p < 0, 1, significativamente diferente com e sem anisomicina. Estes valores foram modificados a partir da publicação anterior8. Por favor clique aqui para ver uma versão maior desta figura.
Figura complementar 1. Vetor da expressão bicystronic para LRRTM2-ECR (região extracellular) e BirA (ligase da biotina de E. coli ).
Entre LRRTM2-ECR e seqüências de codificação de BirA, há uma seqüência interna do local de entrada ribosomal (IRES) que permita coexpressar ambas as proteínas do único mRNA. as movimentações do promotor de hEF1-HTLV expressão o mRNA bicstronic, e ambas as proteínas secretado por seqüências do peptide do sinal após a tradução. A seqüência de codificação do LRRTM2-ECR é unida a diversas seqüências do Tag do peptide (DYKDDDDK, TEV, Myc e seus tag) e seqüência do Acceptor da biotina (BAS). BirA é anexado à tag de DYKDDDDV. Secreted Bira biotinylates lisina da seqüência de Bas de LRRRTM2-ECR para ligar aos grânulos do streptavidina. Por favor clique aqui para baixar a figura.
Discussão
Nós desenvolvemos o método novo para examinar a formação do presynapse estimulada com LRRTM2-Beads usando a cultura da esfera do neurônio. Atualmente, a maior parte do ensaio de formação pré-sinapse inclui grânulos revestidos de poli-D-lisina (PDL) e cultura dissociada/câmara microfluídica20,21,22. Uma das vantagens deste método é LRRTM2-Beads. Quando LRRTM2 interagir com o neurexin para dar forma a presynapses excitatórios especificamente11,12,13, PDL-grânulos induz os presynapses excitatórios e inibitórios nonespecificamente20. Neste método, outros organizadores do presynapse, cujos os membros são sobre 10 proteínas3, são aplicáveis para induzir presynapses mudando o domínio extracelular da proteína biotinylated dependendo da finalidade experimental.
Outra vantagem é a cultura da bola neurônio. Em alguns casos, a cultura dissociada convencional foi utilizada para analisar a formação de pré-sinapse20. No entanto, a cultura dissociada não é adequada para analisar baixos níveis de proteínas sinápticas dentro de presynapses, porque os sinais esmagadores em corpos celulares e dendritos interferem em sinais em pré-sínfitos. Em vez disso, alguns grupos utilizam a cultura dissociada na câmara microfluíica, que é um aparelho especial para a cultura de axônios e corpos celulares separadamente em 2 compramentos21,22. Usando a câmara microfluídicos, a folha axonal é dada forma no compartimento axonal, e os corpos da pilha podem ser removidos do compartimento do corpo da pilha, similar à cultura da esfera do neurônio. Entretanto, a câmara microfluídicos é instrumento especial, e exige algumas habilidades manter a condição constante da cultura. A cultura da esfera do Neuron não é necessário usar o instrumento especial, e é relativamente fácil ser introduzido como um método experimental novo. Porque a essência da cultura da esfera do neurônio é apenas colocar agregados da pilha neuronal (esferas do neurônio) ao prato/câmara do vidro-fundo, pode facilmente ser combinado com outros métodos. Por exemplo, considera-se que a cultura da esfera do neurônio que usa LRRTM2-Beads é aplicável para a seleção elevada do índice medir a fluorescência da área de 10-20 grânulos ao mesmo tempo.
O passo crítico deste protocolo é o revestimento com PLL. Se o revestimento de PLL não é uniforme, os axônios de esferas do neurônio não estenderam uniformemente em toda a direção. Isto perturba a análise eficiente da formação do presynapse. Usamos coberturas de vidro e pratos de fundo de vidro, no entanto, o vidro às vezes não é tão limpo para a cultura neuronal e revestimento uniforme com PLL. Neste protocolo, no início, as coberturas de vidro e os pratos de fundo de vidro são embebidos em detergente neutro não-fosfatos para 1-3 durante a noite e, em seguida, lavados 8 vezes com água ultrapura. Utilizamos PLL cujo peso molecular > 300.000 para reduzir a sua concentração (15 μg/mL) para um fundo indesejável inferior. Se for utilizado um peso molecular mais baixo de PLL (por exemplo, 30000-70000), é necessária uma concentração mais elevada (100 μg/ml) para estender os axônios.
A limitação deste método é que a cultura da esfera do neurônio não pode manter > DIV15-16. Os axônios das esferas do neurônio são fragmentados após DIV15-16. Os axônios fragmentados não produzem nenhum presynapse após a aplicação de LRRTM2 grânulos. Assim, este método não é aplicável para analisar os neurônios maduros (> DIV21). Entretanto, na maioria dos casos11,12,21,22, o ensaio da formação de presynapse usa os neurônios mais novos que são cultivados até DIV14. Outra limitação é que os axônios sem corpos celulares não podem sobreviver mais de 4 h. Nós analisamos a acumulação de 5 proteínas sináptica nos presynapses até agora, a acumulação de todas as proteínas que nós verific alcangou quase o platô dentro de 4 h (observação Unpublished). Considera-se que as proteínas sinápticas acumulam o suficiente em 4 h para analisar onde as proteínas sinápticas são derivadas (corpo celular ou AXON).
A combinação da cultura da esfera do neurônio com LRRTM2-Beads é relativamente simples e flexível adaptar muitas plataformas experimentais. Já aplicamos este método para medir a atividade pré-sináptica usando corante de-43 (observação inédita). Este método é considerado para ser aplicável para a triagem de alta taxa de transferência. O ensaio da formação de presynapse é possível aplicar a seleção elevada do índice manchando proteínas sináptica nos presynapses dados forma LRRTM2-Beads. Este método contribuiria para encontrar novos compostos para curar a doença neurológica.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho é parcialmente apoiado pelo JSPS Grant-in-Aid para a pesquisa científica (KAKENHI) (C) (no. 22500336, 25430068, 16K07061) (Y. Sasaki). Agradecemos ao Dr. Terukazu Nogi e à Sra. Makiko Neyazaki (Universidade da cidade de Yokohama) por gentilmente fornecer proteína LRRTM2 biotinylated. Agradecemos também Honami Uechi e rie Ishii pela assistência técnica.
Materiais
| Name | Company | Catalog Number | Comments |
| Antibody diluent | DAKO | S2022 | |
| Alexa Fluor 594 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-585-151 | |
| Alexa Fluor 488 AffiniPure Donkey Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-545-152 | |
| mouse anti-Munc18-1 | BD Biosciences | 610336 | |
| B-27 Supplement (50X), serum free | Thermo Fisher Scientific | 17504044 | |
| Bovine Serum Alubumin (BSA) | Nacalai Tesque | 01863-48 | |
| Cell-Culture Treated Multidishes (4 well dish) | Nunc | 176740 | |
| Complete EDTA-free | Roche | 11873580001 | |
| cooled CCD camera | Andor Technology | iXON3 | |
| Coverslip | Matsunami | C015001 | Size: 15 mm, Thickness: 0.13-0.17 mm |
| Cytosine β-D-arabinofuranoside (AraC) | Sigma-Aldrich | C1768 | |
| 4',6-Diamidino-2-phenylindole Dihydrochloride (DAPI) | Nacalai Tesque | 11034-56 | |
| Deoxyribonuclease 1 (DNase I) | Wako pure chemicals | 047-26771 | |
| Expi293 Expression System | Thermo Fisher Scientific | A14635 | |
| Horse serum | Sigma-Aldrich | H1270 | |
| image acquisition software | Nikon | NIS-element AR | |
| Image analysis software | NIH | Image J | https://imagej.nih.gov/ij/ |
| Inverted fluorecent microscope | Nikon | Eclipse Ti-E | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | |
| Neurobasal media | Thermo Fisher Scientific | #21103-049 | |
| Normal Goat Serum (NGS) | Thermo Fisher Scientific | #143-06561 | |
| N-propyl gallate | Nacalai Tesque | 29303-92 | |
| Paraformaldehyde (PFA) | Nacalai Tesque | 26126-25 | |
Paraplast Plus | Sigma-Aldrich | P3558 | |
| Poly-L-lysine Hydrobromide (MW > 300,000) | Nacalai Tesque | 28359-54 | |
| poly (vinyl alcohol) | Sigma | P8136 | |
| Prepacked Disposable PD-10 Columns | GE healthcare | 17085101 | |
| rabbit anti-vesicular glutamate transporter 1 | Synaptic Systems | 135-302 | |
| SCAT 20X-N (neutral non-phosphorous detergent) | Nacalai Tesque | 41506-04 | |
| Streptavidin-coated magnetic particles | Spherotech Inc | SVM-40-10 | diameter: 4-5 µm |
| TritonX-100 | Nacalai Tesque | 35501-15 | |
| Trypsin | Nacalai Tesque | 18172-94 |
Referências
- Waites, C. L., Craig, A. M., Garner, C. C. Mechanisms of Vertebrate Synaptogenesis. Annual Review of Neuroscience. 28 (1), 251-274 (2005).
- Ziv, N. E., Garner, C. C. Cellular and molecular mechanisms of presynaptic assembly. Nature Reviews Neuroscience. 5 (5), 385-399 (2004).
- Chia, P. H., Li, P., Shen, K. Cellular and molecular mechanisms underlying presynapse formation. Journal of Cell Biology. 203 (1), 11-22 (2013).
- Südhof, T. C. Neuroligins and neurexins link synaptic function to cognitive disease. Nature. 455 (7215), 903-911 (2008).
- Saitsu, H., et al. CASK aberrations in male patients with Ohtahara syndrome and cerebellar hypoplasia. Epilepsia. 53 (8), 1441-1449 (2012).
- Friedman, H. V., Bresler, T., Garner, C. C., Ziv, N. E. Assembly of New Individual Excitatory Synapses. Neuron. 27 (1), 57-69 (2000).
- Bresler, T., et al. Postsynaptic density assembly is fundamentally different from presynaptic active zone assembly. The Journal of neuroscience the official journal of the Society for Neuroscience. 24 (6), 1507-1520 (2004).
- Parvin, S., Takeda, R., Sugiura, Y., Neyazaki, M., Nogi, T., Sasaki, Y. Fragile X mental retardation protein regulates accumulation of the active zone protein Munc18-1 in presynapses via local translation in axons during synaptogenesis. Neuroscience Research. , (2018).
- Sasaki, Y., et al. Phosphorylation of Zipcode Binding Protein 1 Is Required for Brain-Derived Neurotrophic Factor Signaling of Local β-Actin Synthesis and Growth Cone Turning. Journal of Neuroscience. 30 (28), 9349-9358 (2010).
- Sasaki, Y., Gross, C., Xing, L., Goshima, Y., Bassell, G. J. Identification of axon-enriched microRNAs localized to growth cones of cortical neurons. Developmental neurobiology. 74 (3), 397-406 (2014).
- Linhoff, M. W., et al. An Unbiased Expression Screen for Synaptogenic Proteins Identifies the LRRTM Protein Family as Synaptic Organizers. Neuron. 61 (5), 734-749 (2009).
- de Wit, J., et al. LRRTM2 Interacts with Neurexin1 and Regulates Excitatory Synapse Formation. Neuron. 64 (6), 799-806 (2009).
- Ko, J., Fuccillo, M. V., Malenka, R. C., Südhof, T. C. LRRTM2 Functions as a Neurexin Ligand in Promoting Excitatory Synapse Formation. Neuron. 64 (6), 791-798 (2009).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature protocols. 1 (5), 2406-2415 (2006).
- Hirai, H., et al. Structural basis for ligand capture and release by the endocytic receptor ApoER2. EMBO reports. , (2017).
- Yasui, N., et al. Functional Importance of Covalent Homodimer of Reelin Protein Linked via Its Central Region. Journal of Biological Chemistry. 286 (40), 35247-35256 (2011).
- Bassell, G. J., Warren, S. T. Fragile X Syndrome: Loss of Local mRNA Regulation Alters Synaptic Development and Function. Neuron. 60 (2), 201-214 (2008).
- Darnell, J. C., Klann, E. The translation of translational control by FMRP: therapeutic targets for FXS. Nat Neurosci. 16 (11), 1530-1536 (2013).
- Richter, J. D., Bassell, G. J., Klann, E. Dysregulation and restoration of translational homeostasis in fragile X syndrome. Nature Reviews Neuroscience. 16 (10), 595-605 (2015).
- Lucido, A. L., et al. Rapid Assembly of Functional Presynaptic Boutons Triggered by Adhesive Contacts. Journal of Neuroscience. 29 (40), 12449-12466 (2009).
- Taylor, A. M., Wu, J., Tai, H. C., Schuman, E. M. Axonal Translation of β-Catenin Regulates Synaptic Vesicle Dynamics. Journal of Neuroscience. 33 (13), 5584-5589 (2013).
- Batista, A. F. R., Martínez, J. C., Hengst, U. Intra-axonal Synthesis of SNAP25 Is Required for the Formation of Presynaptic Terminals. Cell reports. 20 (13), 3085-3098 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados