Method Article
シナプス前オーガナイザービーズと「ニューロンボール」培養を用いたシナプス形成アッセイ
要約
シナプス前形成は、シナプスタンパク質の蓄積を含む動的なプロセスを適切な順序で行う。この方法では、シナプス前形成は「ニューロンボール」培養物の軸シート上にプレシナプスオーガナイザータンパク質と結合したビーズによって引き起こされ、シナプス形成前にシナプスタンパク質の蓄積が解析されやすくなる。
要約
神経発達の間、シナプス形成は神経回路を確立するための重要なステップである。シナプスを形成するには、シナプスタンパク質は、細胞体からの輸送および/または未熟なシナプスにおける局所翻訳によって適切な順序で供給されなければならない。しかし、シナプスタンパク質がシナプスに適切な順序で蓄積する方法を完全に理解していません。ここでは、ニューロンボール培養とビーズの組み合わせを用いてシナプス前形成を誘導する新しい方法を提示する。ニューロン細胞凝集体であるニューロンボールは、細胞体やデンドライトから遠く離れた軸シートを提供するため、細胞体の圧倒的なシグナルを避けることで、シナプス前の弱い蛍光シグナルを検出することができます。シナプス前形成を引き起こすビーズとして、刺激性前シナプスオーガナイザーであるロイシンリッチリピート膜神経神経2(LRRTM2)と共役のビーズを使用します。この方法を用いて、シナプス小胞タンパク質である小胞性グルタミン酸トランスポーター1(vGlut1)が、活性ゾーンタンパク質であるMunc18-1よりも早くプレシナプスに蓄積することを実証した。Munc18-1は、細胞体を除去した後も、プレシナプスに翻訳依存的に蓄積した。この知見は、細胞体からの輸送ではなく、軸ゾンにおける局所翻訳によるMunc18-1蓄積を示す。結論として、この方法は、シナプス前シナプスおよびシナプスタンパク質の供給源におけるシナプスタンパク質の蓄積を分析するのに適している。ニューロンボール培養は単純で、特別な装置を使用する必要がないため、この方法は他の実験プラットフォームにも適用可能です。
概要
シナプス形成は、神経回路1、2、3の発達中の重要なステップの1つである。シナプス前およびポストシナプスで構成される特殊なコンパートメントであるシナプスの形成は、軸線とデンドライトの適切な認識、活性ゾーンおよびポストシナプス密度の形成、および適切なアライメントを伴う複雑で多段階のプロセスである。イオンチャネルおよび神経伝達物質受容体1、2.各プロセスでは、多くの種類のシナプスタンパク質が、細胞体からシナプスタンパク質を輸送したり、コンパートメント内の局所翻訳によって適切なタイミングでこれらの特殊なコンパートメントに蓄積します。これらのシナプスタンパク質は、機能性シナプスを形成するために組織的に配置されていると考えられる。シナプス形成を伴ういくつかのシナプスタンパク質の機能不全は、神経疾患4,5をもたらす。しかし、シナプスタンパク質が適切なタイミングでどのように蓄積するかは不明です。
シナプスタンパク質がどのように組織的に蓄積するかを調べるには、シナプスタンパク質の蓄積を時系列順に調べる必要があります。いくつかの報告は、ニューロン6、7の解離培養におけるシナプス形成を観察するライブイメージングを実証した。しかし、顕微鏡検査の下でシナプス形成を開始するニューロンを見つけるのは時間がかかります。シナプスタンパク質の蓄積を効率的に観察するには、研究者が形成を誘導したい時にシナプス形成を開始する必要があります。第2の課題は、細胞体からの輸送またはシナプス中の局所翻訳によるシナプスタンパク質の蓄積を区別することです。そのためには、細胞体からのシナプスタンパク質の輸送を許可しない条件下で翻訳レベルを測定する必要があります。
ニューロンボール培養とビーズの組み合わせを用いて、シナプス前形成を誘導する新規のシナプス形成アッセイを開発した。ニューロン球培養は、細胞体9、10を取り巻く軸シートの形成に起因する軸次表現型を調べるために開発される。興奮前シナプスを誘導する前シナプスオーガナイザーであるロイシンリッチリピート膜神経神経2(LRRTM2)と共役した磁気ビーズ(図1A)11、12、13を用いた。LRRTM2ビーズを用いることで、ビーズが塗布された時点でシナプス形成が開始される。これは、シナプス前形成がニューロンボールの数千の軸で同時に始まることを意味し、したがって、シナプスタンパク質の蓄積の正確な時間経過を効率的に調べることができる。また、ニューロンボール培養は、細胞体を除去することにより、ソマからのシナプスタンパク質の輸送をブロックすることが容易である(図1B)8.我々はすでに、細胞体のない軸ソンが生き残ることができ、細胞体を除去した後、少なくとも4時間は健康であることを確認しました。したがって、このプロトコルは、シナプスタンパク質がどこから(細胞体または軸)由来し、シナプスタンパク質が組織的に蓄積するかを調するのに適しています。
プロトコル
本原稿に記載された実験は、横浜市立大学動物管理利用委員会に概説されたガイドラインに従って行われました。
1. ぶら下がりドロップ培養としてのニューロンボールの調製(インビトロ(DIV)0-3)
注:ニューロンボール培養の調製のためにここに説明する手順は、以前に佐々木群によって報告された方法に基づいており、いくつかの変更9,10.また、解離培養14のバンカー法からいくつかの手順を採用した。
-
解剖を開始する前に以下を確認する
- 必要なすべてのソリューションを準備し、オートクレーブ/ろ過によって事前に殺菌します。
- この皮質ニューロン培養の各ステップで使用されるすべての器具と材料を準備してください。
- スプレーし、70%エタノールで層の空気の流れキャビネット、解剖テーブル、立体顕微鏡のステージプレート、はさみ、および鉗子を拭きます。
- CO2の塗布時にマウスを安楽死させ、腹部を解剖してE16胚を得る。
- 鉗子の微細な先端の助けを借りて慎重に胚から脳を取り除き、HEPESバッファー塩溶液(HBSS)の4 mLを含む60mm細胞培養皿に移します。
注:解剖媒体HBSSは10 mM HEPES(pH 7.4)、140 mM NaCl、5.4 mM KCl、1.09 mM Na2HPO 4、1.1 mM KH2PO4、5.6mM D-グルコース、および5.64 μMフェノール赤を含む。 - 頭皮を取り外し、嗅球を切り、立体顕微鏡下の鉗子の細かい先端を使用して各大脳半球から皮質を分離し、新鮮なHBSSを含む別の60ミリメートルの皿に移す。各別々のニューロンボール培養に少なくとも3〜5個の胚を使用します。
- 皮質を薄皮の流れ細胞培養フードで微細解剖ばばしで小片に切ります。
- 15 mLチューブにひきものコルチスを移し、37°Cの水浴で4.5分間HBSSで0.125%トリプシンの4mLでミンチコルチをトリプシン化します。
注:このトリプシン化時間は、時間の増加(> 4.5分)がはるかに多くの死んだニューロンにつながるので、効率的なニューロン培養のために重要です。 - 細胞凝集体を無菌転写ピペットで10mLのHBSSを含む新しい15 mLチューブに移し、37°Cで5分間インキュベートする。
- 細胞凝集体を、グルタマックス、B27サプリメント(NGB培地)、0.01%DNase Iおよび10%馬血清を含む神経基球媒の2mLを含む新しい15 mLチューブに移す。
- 火磨き細かいガラスのパスツールピペットを使用して、上下(3〜5回)繰り返しピペッティングして、トリプシン化された皮質をトリビュートします。
注:火磨かれた細かいガラスパスツールピペットの直径は、バンカー法紙14に記載されているように非常に重要です。ピペットが狭すぎてコルチスを渡せない場合は、2~3種類のサイズを持つピペットを準備し、より大きなピペットから試してみてください。 - ニューロンボールを調製するために、上記の細胞懸濁液を取り、NGB培地を使用して1 x 106細胞/mLに細胞密度を調整します。
- 10cm培養皿の上蓋内に10,000個/滴(1滴は10μL)を含む垂れ下がり滴として皮質ニューロンを培養する。
- 培養皿の底部に7mLのリン酸緩衝生理食塩分(PBS)を加え、加湿状態で5%CO2を含む37°Cで3日間インキュベーターに保管し、ニューロンボール形成を可能にする。
2. PLLコーティングガラスカバーリップと培養メンテナンス(DIV 3-11)にニューロンボールを配置する
注:ガラスカバーのコーティングを行う前にポリLリジン(PLL)でスリップする前に、洗剤を使用してカバースリップを洗浄することが重要です。ガラスカバースリップは、神経培養とPLLによる均一なコーティングのために、時にはそれほどきれいではありません。不均一なPLLコーティングは、ニューロンボールの不均一な軸線延長をもたらす可能性があります。
- 1/20希釈中性非リン非リン洗剤に1~3晩セラミックラックにカバーリップを浸します。
- カバースリップを超純水で8回洗い、200°Cのオーブンで12時間殺菌します。
注:ここからのすべてのステップは、層状の空気流細胞培養フードで行う必要があります。 - 焼きカバーを100mmの皿に移します。蓋と底皿の間にパラフィルムで皿を密封した後、焼いたカバースリップは長期保存のために保つことができる。
- (オプション)カバースリップにパラフィンドットを適用します。ドットは、ニューロンボールをプラスチック皿に直接接触させ、免疫染色中にカバースリップから切り離されるニューロンボールを防ぐためのスペースを作ります。約90°Cでお湯浴中に適当なボトルにパラフィンを溶かします。パストゥールピペットをパラフィンに浸し、急速に触れてカバースリップの端近くに3つのスポットを作ります。
- PLL溶液(ホウ酸バッファー内15μg/mL)を使用して60mmの皿にパラフィンビーズガラスカバーにPLL(MW>300,000)を塗り、CO2インキュベーターで少なくとも1時間保持します。
- PBSで4回洗浄した後、PLL被覆カバーリップを各ウェルに350μLのNGB培地を含む4ウェルプレートに移し、シトシンβ-D-アラビノウラノシド塩酸塩(AraC,3 μM)を培地に移し、分裂細胞を死滅させる。
- PLLコーティングされたカバーを含むこの4ウェルプレートは、ニューロンボールを転写する前に、培地の温度が37°Cに達することを確認するために、少なくとも20分間CO2インキュベーターに入れ続けてください。
- DIV 3で「ニューロンボール」が非常によく形成された場合は、CO2インキュベーターに保持された4ウェルプレート(5ニューロンボール/ウェル)内のPLLコーティングされたカバーリップに転送します。
- 48時間後、ニューロンボール培養培地を新鮮なAraCフリーNGB培地に置き換えます。この手順の直前に温度が37°Cで準備されている層板の流れ細胞培養フードにホットプレートを使用してください。
注:培養物がCO2インキュベーターの外側にある時間を短縮するために、ホットプレート上で可能な限り迅速に中変化を実行する必要があります。 - このニューロンボール培養をCO2インキュベーターに入れ、DIV 11まで保持してください。
注:DIV 11-12では、1〜2ミリメートルまでニューライトを伸ばすニューロンボールが実験に使用されます。
3. 細胞体の有無にかかわらずニューロンボール培養にLRRTM2ビーズを塗布する(DIV 11-12)
注:ニューロンボール培養にLRRTM2ビーズを適用する前に、細胞体を除去することをお勧めします。したがって、最初にLRRTM2ビーズを調布し、次に細胞体を除去し、後でLRRTM2ビーズをできるだけ早く培養に適用する。ビオチニル化LRRTM2は、野木グループ(横浜市立大学)が条件付き媒体として提供しています。彼らは、E由来のビオチン受入配列およびビオチンリエーゼを含む発現ベクターを使用する。コリ(ビラ)15歳,16は、ビオチンをLRRTM2に付着させ、発現ベクターがExpi293式システムに含まれるExpi293F細胞にトランスフェクトされる。ベクトル情報は補足図 1で使用できます。バイオチリン化LRRTM2結合ストレプトアビジンビーズは、LRRTM2-Fc-共役タンパク質Aビーズと比較して免疫染色の背景を大幅に減少させ、プロトタイプLRRTM2系8に使用される。
-
ビオチン化LRRTM2ビーズの調製
- ビオチン化LRRTM2を発現するExpi293F細胞の条件付き培地から過剰なビオチンを除去するには、PBSの0.8mL(合計2.5mL)を混合した条件付き培地の1.7mLをPD-10ゲル濾過カラムに適用する。PD-10カラムは、25mLの超純水と25mLのPBSで予め平衡化されています。
- PBSの3.5 mLで溶出し、LRRTM2ストックとしてフロースルーを収集します。
注:このLRRTM2ストックは、アリコートに分配され、長期のために-80 °Cで保存することができます。ビオチン化LRRTM2の発現レベルは、ロットごとに異なる場合があります。したがって、ビーズに結合するLRRTM2ストックの適切な体積は、新しいLRRTM2ストックが初めて使用される場合に、ニューロンボールに十分なプレシナプスを形成するように決定されるべきである。 - ストレプトアビジンコーティング磁性粒子(直径:4-5 μm)の懸濁液からマイクロ遠心管まで20μLを取ります。ビーズをネオジム永久磁石に取り付けた手作りの装置に固定し、1.5 mLマイクロ遠心管で100μLのPBS-MCBCで3回洗浄します。
注: PBS-MCBC には、5 mM MgCl 2、3mM CaCl 2、0.1% BSA、および 0.1% 完全 EDTA フリーを含む PBS が含まれています。 - ビーズから完全にPBS-MCBCを取り除き、所定の量のLRRTM2ストック(通常500~1,000 μL、注3.1.2)を洗浄ビーズに追加します。1-2時間4°Cで回転子を使用して混合物をインキュベートします。
- ビーズをPBS-MCBCの100 μLで2回洗い、後で100μLのNGB培地で洗います。
- ニューロンボール培養への適用のために、NGB培地の50μLでLRRTM2ビーズを再中断します。
- ビオチン化-LRRTM2タンパク質を添加する以外は、別のマイクロ遠心管に対照ビーズ(陰性対照)を調製するための同じ手順を使用します。
-
DIV 11-12でニューロンボールから細胞体を除去し、LRRTM2ビーズを塗布
- 4ウェルプレートのウェルに「セル本体(+)」および「セル本体(-)」とラベルを付けます。
- 45°角で黄色の先端の終端を45°の角度で切り、以前に立体顕微鏡下で70%のエタノールを噴霧したかみそり刃で(図1B)。
- ニューロンボールの細胞体領域に黄色の先端端を置き、吸引によって細胞体を取り除きます(図1B)。
- 実験の各指定条件を識別するには、ウェルに「LRRTM2ビーズ」および「制御ビーズ」として再度ラベルを付けます。
- ニューロンボール培養にLRRTM2を塗布し、フェライト磁石を使用してプレートの底部に1分間沈み、シナプス前形成を開始します。この手順では、すべてのビーズを同時にタッチダウンできます。特に、LRRTM2ビーズを同期的にインキュベーションする短時間(例えば、30分と1時間)に有効であろう。
- 時間コース実験を行うには、それぞれ0分、30分、1時間、2時間、4時間、18時間とラベルを付け、指示された時間間隔でLRRTM2ビーズを適用します。
- LRRTM2ビーズを添加した後、指定された時間(0分~18時間)のビーズでニューロンボール培養物をインキュベートし、プレシナプスを形成する。
4. 免疫染色と顕微鏡検査
注:軸が4時間後に細胞体の不在で徐々に死ぬ傾向があるので、細胞体の有無にかかわらず実験条件でLRRTM2ビーズを使用してインキュベーションを介して4時間の細胞を固定します。LRRTM2 ビーズを使用した時間経過の場合は、指定した時間にセルを固定します。
-
LRRTM2ビーズによるシナプス形成前形成後のニューロン球培養におけるニューロンの固定と染色
- NGB培地を取り出し、室温で20分間PBS(250 μL/ウェル)で4%のPFAでニューロンボールを固定し、500μLのPBSで500μLを5分毎に5分ずつ洗浄します。
- 固定細胞をTBS(トリスバッファー生理生理/50 mMトリス-HCl(pH 7.3)および150mM NaCl)で5分以上洗浄します。
- 0.3%トリトンX-100を5分間含むTBSでニューロンボール培養の細胞/軸を透過化します。
- ブロッキングバッファー(0.1%トリトンX-100および5%NGS(通常のヤギ血清)でブロッキングのための細胞を1時間保つ。
- 一次抗体で細胞をインキュベートします。抗ウサギ-vGlut1(小胞グルタミン酸トランスポーター1(1:4000))および抗マウス-Munc18-1(1:300)を抗体希釈剤で希釈し、4°Cで一晩希釈した。
- カバースリップを免疫蛍光(IF)バッファー(TBSで0.1%トリトンX-100および2%BSA)で4回洗浄し、蛍光色素(Alexa色素)で30分間インキュベートする第2抗体。アンチマウスIgG-Alexa 555(1:500)、アンチウサギIgG-Alexa 488(1:1000)。
- PBSで4',6-ジアミド-2-フェニリンドール(DAPI、1 μg/mL)で5分間ニューロンの細胞体の核を染色します。
- カバースリップをPBSで3回洗い、167mg/mLポリ(ビニール)アルコールと6mg/mL N-プロピルガレートを含む取り付け媒体を使用してガラススライドに取り付けます。
- 顕微鏡検査まで-20°Cの冷蔵庫にガラススライドを保管してください。ガラススライドの蛍光信号は、スライドが-20°Cで保存されている場合、少なくとも1年間検出可能です。
-
蛍光顕微鏡下での画像撮影
- 60Xオイル浸漬レンズを使用して冷却されたCCDカメラで反転蛍光顕微鏡下で差動干渉コントラストとIF画像をキャプチャします。画像集録ソフトウェアの場合は、ソフトウェアインストールされた顕微鏡システムを使用します。イメージ J をイメージ解析ソフトウェアとして使用します。
- 次の式を使用して、軸ゾンのシナプス前の IF 強度を測定します。ビーズ上の関心領域の強度 (ROI) – ビーズから 20 μm に沿ったオフビーズ領域強度/軸上強度 – 背景強度。この比強度はタンパク質蓄積指数を提供する(図4A)。Image J ソフトウェアを使用して、元の 16 ビット イメージの測定を実行します。
- LRRTM2ビーズで誘導されたシナプス前における特定のタンパク質の蓄積レベルを定量化するには、常に顕微鏡(60X)を用いて細胞体から離れた2分野以上の領域を選択する。
注:画像化のためのニューロンボールの領域の選択は、密な軸が細胞体の近くにあり、ニューロンボールの周辺が単一軸を提供することができるので、重要です。 - 正確な測定を行うには、5種類の軸位フィールド(セルボディからの同様の距離)/カバースリップを選択します。
- 異なる日と実験の間に同一のイメージング条件を保つ
結果
ここでは、ニューロンボール培養の軸シートのLRRTM2誘導プレシナプスにおけるシナプス前タンパク質の蓄積の代表的な結果を示す。シナプス前タンパク質として、興奮性シナプス小胞タンパク質vGlut1と活性ゾーンタンパク質Munc18-1を分析した。また、vGlut1およびMunc18-1の蓄積の時間経過を事前シナプスで調べ、細胞体を除去する軸ソンとタンパク質合成阻害剤を用いて、プレシナプス中のMunc18-1の供給源を示す結果を得た。最近、我々は、プレシナプス8におけるMunc18-1の蓄積に関する脆弱X精神遅滞タンパク質(FMRP)の役割を調査した。脆弱X症候群(FXS)の原因遺伝子産物であるFMRPは、翻訳17、18、19を抑制するmRNA結合タンパク質である。また、FMRPをコードするFmr1遺伝子に欠損しているFXSモデルマウスを用いて、Munc18-1蓄積におけるFMRPの関与についても検討した。
DIV11におけるニューロンボール培養におけるLRRTM2ビーズの応用は、ニューロンボールの軸のプレシナプスにおけるMunc18-1の蓄積を誘導した(図2A)。細胞体を取り除いた軸ゴンにおいても、細胞体を持つニューロンボールの軸ゴンと同様のビーズ下でMunc18-1の蓄積が観察された(図2B)。典型的なケースでは、ニューロンボールを用いて4時間インキュベーション後のビーズの80%以上が、Munc18-1およびvGlut-1を染色することによって判断されるプレシナプス中のシナプスタンパク質の蓄積を誘導することができる。軸ゴンは非常に混雑し、細胞体の近くに重なっているので(図2Aa,Ba)、軸ゾンがそれほど重なっていない場所で軸ゾンシートのより多くの周辺領域を測定した(図2Ab、Bb、例えば、2フィールドから離れた周辺領域)顕微鏡(60X)を用いた細胞体から離れた視野の数。軸シートの周辺領域を高倍率対物レンズ(60X)で分析した場合、vGlut1およびMunc18-1はビーズ下の軸子のプレシナプスに明確に蓄積した(図3)。時々、vGlut1のようなシナプス小胞タンパク質の蛍光シグナルは、ビーズの外側の軸領域で検出することは困難です。Munc18-1の場合、ビーズの外側の軸領域では蛍光シグナルが弱く検出されます。
LRRTM2ビーズによって誘導されるシナプス前シナプス中のシナプスタンパク質の蓄積レベルを定量するために、ビーズの下およびビーズの外側の軸索の蛍光強度を測定し、次いで「タンパク質蓄積指数」(図4A、および詳細については、プロトコルセクションで説明します)。タイムコース実験は、プレシナプスにおけるvGlut1の蓄積が30分で有意に増加することを実証した(図4B)。一方、Munc18-1の蓄積は2時間で大幅に増加し始め、4時間(図4C)で高原に達した。これらのデータは、シナプス小胞タンパク質vGlut1が活性ゾーンタンパク質Munc18-1よりも早くシナプス前に蓄積することを示している。Fmr1-KOニューロンのプレシナプスにおけるMunc18-1蓄積は、野生型(WT)(図4C)の1.5倍増加し、Munc18-1蓄積におけるFMRPの関与を示した。次に、アクソンにおける細胞体または局所翻訳からの輸送によるMunc18-1蓄積を区別するために、タンパク質合成阻害阻害剤アニソマイシンの効果を細胞体の有無に関する調像(図4D)。.アニソマイシンは、アクソンにおけるMunc18-1蓄積を有意に抑制し(図4D)、蓄積がタンパク質合成依存性であることを示す。細胞体を持たない軸子のプレシナプスの蓄積は、細胞体と有意に異なっていなかった(図4D)。これらの結果は、プレシナプスにおけるMunc18-1の蓄積は主に軸に由来するが、細胞体からのMunc18-1の輸送ではないことを示唆している。細胞体を取り除くことによって軸質のプレシナプス中にシナプスタンパク質の蓄積が抑制された場合、この減少は細胞体からの輸送によるものと考えられる。実際、蛍光色素で代謝的に標識された全新に合成されたタンパク質の蓄積を調べたところ、細胞体を除去すると、アクソンのプレシナプスと比較して、新たに合成されたタンパク質の蓄積が大幅に減少しました。セルボディ8.Fmr1-KOにおけるMunc18-1蓄積はWTに比べて増加したが、アニソマイシンはWTと同様のレベルで蓄積を抑制し、細胞体の除去は蓄積に影響を及ぼさなかった(図4D)。これらの結果は、FMRPが軸子におけるMunc18-1のローカル翻訳に関与していることを示唆している。
ここで提示される代表的な結果は、この方法が時間経過実験によってシナプスタンパク質がどのように組織的に蓄積されるかを調べ、シナプスタンパク質の供給源(細胞体または局所からの輸送)を調べるのに適していることを示している。セルボディを除去することにより、軸ゾン)での翻訳。

図 1.ニューロンボールからの細胞体の前シナプス形成と除去のスキーム。
(A)バイオチリン化LRRTM2共役ストレプトアビジンビーズを用いたプレシナプス形成アッセイは、E16皮質から調製されたニューロン球培養の軸にプレシナプスを誘導する。LRRTM2は、後のタンパク質であるネレキシン(NRXN)に結合し、シナプス前のオーガナイザーとして機能する。ビオチン化LRRTM2細胞外領域(LRRTM2ビーズ)に結合したストレプトアビジンビーズをDIV11-12でニューロンボール培養に塗布し、プレシナプスを誘導した。この図は、以前のパブリケーション8から変更されています。(B)黄色の先端端を切断し、45°角でニューロン球培養の細胞体領域に配置した。細胞体は吸引によって取り除かれた。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 2.Munc18-1 ニューロンボールの細胞体の存在および不在におけるシナプス前の蓄積.
(A) LRRTM2ビーズを用いて4時間インキュベーションした後、アクソンの誘導シナプス部位に活性ゾーンタンパク質Munc18-1が蓄積した(上パネル;実験スキーム、中間、位相画像、下方;Munc18-1蓄積のIF画像)。画像は10倍レンズと中間倍率(1.5倍)を用いて低倍率画像として撮影し、ニューロンボール、軸、ビーズで構成された画像全体を見ました。破線の正方形は、ビーズの正確なイメージング位置のためのニューロンボールの面積を示す。スケールバー、20 μm(左、元の画像)、10 μm(右、拡大画像)。 (B)Munc18-1は、軸ゾン内の誘導シナプス部位に細胞体が存在しない場合でも非常によく蓄積した。この結果は、軸が少なくとも4時間細胞体を取り除いても生き残り、プレシナプスを形成できることを示しています。
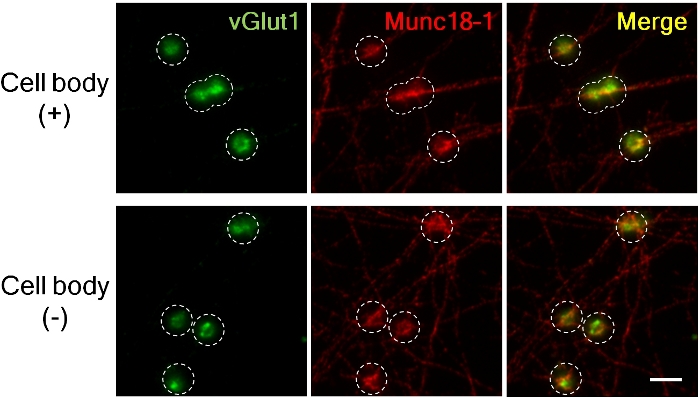
図 3.細胞体の有無にかかわらず軸のプレシナプスにおけるvGlut1およびMunc18-1の蓄積。
興奮性プレシナプスマーカーvGlut1(緑色)およびMunc18-1(赤色)は、LRRTM2ビーズを添加した後4時間前シナプスに蓄積した。(上部パネル、セルボディ、下部、セルボディなし)。画像は、蛍光強度を測定するために高倍率のために60Xオイル浸漬レンズを使用して撮影されました。破線の円はビーズの位置を概説した。Munc18-1は、シナプス前における細胞体の存在および不在においてほぼ同様の程度を蓄積したが、vGlut1蓄積は細胞体なしで減少する8.スケールバー、5 μm.この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 4.ニューロンボールにおけるMunc18-1蓄積に対する細胞体除去およびタンパク質合成阻害剤のIF強度測定および影響の手順
(A)図は、ニューロン球培養の軸位における誘導シナプス部位におけるIF強度の定量方法を示した。スケールバー、5 μm。詳細については、プロトコルセクションで説明します。 (B)LRRTM2ビーズで誘導されたシナプス前におけるvGlut1蓄積の時間経過。示されるデータは、n=20の平均±SEMである。Tukeyの多重比較テストを伴う双方向分散分析。**p < 0.01.(C) WTおよびFmr1-KOの蓄積におけるMunc18-1蓄積のタイムコースは、LRRTM2ビーズの下でのプレシナプスである。 示されているデータは、n = 20 の平均 ± SEM、Tukey の多重比較検定による双方向分散分析です。n.s., 有意ではない;**p < 0.01, WT と KO の間で有意に異なります。(D)棒グラフは、(CB+)細胞体を有する25 μMアニソマイシン(Aniso)の有無において、WTおよびFmr1-KOニューロン球の前シナプスにおけるMunc18-1蓄積レベルを示した。示されるデータは、n=20の平均±SEMである。Tukeyの多重比較テストを伴う双方向分散分析。**p < 0.01、 n.s.# 示されたp < 0.01, アニソマイシンの有無にかかわらず有意に異なる.これらの数値は、以前の出版物8から変更されています。この図のより大きなバージョンを表示するには、ここをクリックしてください。
補足図 1.LRRTM2-ECR(細胞外領域)およびBirA(大腸菌由来のビオチンリゲス)に対するビシストロン発現ベクター。
LRRTM2-ECRおよびBirAコード配列の間には、単一mRNAから両方のタンパク質を共発現することを可能にする内部リボソームエントリサイト(IRES)配列がある。hEF1-HTLVプロモーターは、ビクトロニックmRNA上で発現し、両方のタンパク質は、翻訳後のシグナルペプチド配列によって分泌される。LRRTM2-ECRコード配列は、いくつかのペプチドタグ配列(DYKDDDK、TEV、MycおよびHisタグ)およびビオチン受入配列(BAS)に付着している。BirA は DYKDDDDV タグにアタッチされています。分泌されたBirAビオチン化は、LRRRTM2-ECRのBAS配列のリジンをストレプトアビジンビーズに結合させる。図をダウンロードするには、ここをクリックしてください。
ディスカッション
ニューロンボール培養を用いてLRRTM2ビーズで刺激されたシナプス前形成を調べる新しい方法を開発した。現在、シナプス前形成アッセイのほとんどは、ポリD-リジン(PDL)コーティングビーズおよび解離培養/マイクロ流体室20、21、22を含む。この方法の利点の1つはLRRTM2ビーズです。LRRTM2は、特異的に11、12、13、PDLビーズを形成するためにニューレキシンと相互作用するが、PDL-ビーズは、非特異的に20の興奮性および阻害前シナプスの両方を誘導する。この方法では、メンバーが10以上のタンパク質3を有する他のプレシナプス主催者は、実験目的に応じてビオチン化タンパク質の細胞外ドメインを変化することによってプレシナプスを誘導するために適用可能である。
もう一つの利点は、ニューロンボール培養です。いくつかのケースでは、従来の解離培養は、シナプス形成20の前部を分析するために使用された。しかし、細胞体内およびデンドライト中の圧倒的なシグナルがシナプス前のシグナルを妨害するため、解離培養はシナプス前内のシナプスタンパク質の低レベルを分析するのに適していません。その代わりに、一部のグループは、21、22で別々に軸官および細胞体を培養する特別な装置である微小流動性室内で解離培養を使用する。マイクロ流体室を使用して、軸シートは軸室に形成され、細胞体はニューロンボール培養と同様に細胞体コンパートメントから除去することができる。しかしながら、マイクロ流体室は特殊な装置であり、一定の培養状態を維持するためにいくつかのスキルを必要とする。ニューロン球培養は、特殊な装置を使用する必要なく、新しい実験方法として導入されが比較的容易である。ニューロンボール培養の本質は、ニューロン細胞凝集体(ニューロンボール)をガラス底皿/チャンバーに配置するだけで、他の方法と簡単に組み合わせることができます。例えば、LRRTM2ビーズを用いてニューロンボール培養は、10〜20ビーズ領域の蛍光を同時に測定する高含有度スクリーニングに適用可能であると考えられる。
このプロトコルの重要なステップは、PLLでコーティングすることです。PLLコーティングが均一でない場合、ニューロンボールの軸が全方向に均一に伸びない。これは、シナプス前形成の効率的な分析を妨げる。ガラスカバーリップとガラス底皿を使用していますが、PLLを用いて神経培養や均一なコーティングを行う場合、ガラスはそれほどきれいではない場合があります。このプロトコルでは、最初に、ガラスカバースリップとガラス底皿は、一晩1〜3の中性非リン酸洗剤に浸し、その後、超純水で8回洗浄されます。分子量> 300,000のPLLを使用して、その濃度(15 μg/mL)を低く抑え、望ましくない背景を低くします。PLLの低分子量(例えば、30,000〜70,000)を使用する場合、軸を延長するためにより高い濃度(100 μg/mL)が必要である。
この方法の限界は、ニューロンボール培養が> DIV15-16を維持できないことである。ニューロンボールの軸はDIV15-16の後に断片化される。フラグメント化された軸ゴンは、LRRTM2 ビーズ アプリケーションの後にシナプスを生成しません。したがって、この方法は成熟したニューロン(> DIV21)を分析するためには適用できない。しかし、ほとんどの場合、11、12、21、22、シナプス形成アッセイはDIV14まで培養される若いニューロンを使用する。もう一つの制限は、細胞体のない軸ゴンが4時間以上生き残ることができないという。これまでにシナプス前に5つのシナプスタンパク質が蓄積された場合、チェックしたすべてのタンパク質の蓄積は4時間以内にほぼ高原に達しました(未発表の観察)。シナプスタンパク質は、シナプスタンパク質がどこから由来するか(細胞体または軸)を分析するのに十分な4時間で蓄積すると考えられています。
ニューロンボール培養とLRRTM2ビーズの組み合わせは、比較的シンプルで柔軟に多くの実験プラットフォームを適応させる。AM1-43色素(未発表の観測値)を用いてシナプス前活性を測定するために、この方法を既に適用しています。この方法は、高スループットスクリーニングに適用可能であると考えられる。プレシナプス形成アッセイは、LRRTM2ビーズ下に形成されたシナプス前シナプス中のシナプスタンパク質を染色することにより高い含有量スクリーニングを適用することができる。この方法は、神経疾患を治すために新しい化合物を見つけるのに貢献するだろう.
開示事項
著者は何も開示していない。
謝辞
この研究の一部は、JSPS科学研究助成金(KAKENHI)(第2250036号、25430068、16K07061)(佐々木Y.生体化LRRTM2タンパク質を提供してくださった野木輝和先生と寝屋崎真紀子さん(横浜市立大学)に感謝申し上げます。また、上地穂波さんと石井理恵さんの技術支援にも感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Antibody diluent | DAKO | S2022 | |
| Alexa Fluor 594 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-585-151 | |
| Alexa Fluor 488 AffiniPure Donkey Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-545-152 | |
| mouse anti-Munc18-1 | BD Biosciences | 610336 | |
| B-27 Supplement (50X), serum free | Thermo Fisher Scientific | 17504044 | |
| Bovine Serum Alubumin (BSA) | Nacalai Tesque | 01863-48 | |
| Cell-Culture Treated Multidishes (4 well dish) | Nunc | 176740 | |
| Complete EDTA-free | Roche | 11873580001 | |
| cooled CCD camera | Andor Technology | iXON3 | |
| Coverslip | Matsunami | C015001 | Size: 15 mm, Thickness: 0.13-0.17 mm |
| Cytosine β-D-arabinofuranoside (AraC) | Sigma-Aldrich | C1768 | |
| 4',6-Diamidino-2-phenylindole Dihydrochloride (DAPI) | Nacalai Tesque | 11034-56 | |
| Deoxyribonuclease 1 (DNase I) | Wako pure chemicals | 047-26771 | |
| Expi293 Expression System | Thermo Fisher Scientific | A14635 | |
| Horse serum | Sigma-Aldrich | H1270 | |
| image acquisition software | Nikon | NIS-element AR | |
| Image analysis software | NIH | Image J | https://imagej.nih.gov/ij/ |
| Inverted fluorecent microscope | Nikon | Eclipse Ti-E | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | |
| Neurobasal media | Thermo Fisher Scientific | #21103-049 | |
| Normal Goat Serum (NGS) | Thermo Fisher Scientific | #143-06561 | |
| N-propyl gallate | Nacalai Tesque | 29303-92 | |
| Paraformaldehyde (PFA) | Nacalai Tesque | 26126-25 | |
Paraplast Plus | Sigma-Aldrich | P3558 | |
| Poly-L-lysine Hydrobromide (MW > 300,000) | Nacalai Tesque | 28359-54 | |
| poly (vinyl alcohol) | Sigma | P8136 | |
| Prepacked Disposable PD-10 Columns | GE healthcare | 17085101 | |
| rabbit anti-vesicular glutamate transporter 1 | Synaptic Systems | 135-302 | |
| SCAT 20X-N (neutral non-phosphorous detergent) | Nacalai Tesque | 41506-04 | |
| Streptavidin-coated magnetic particles | Spherotech Inc | SVM-40-10 | diameter: 4-5 µm |
| TritonX-100 | Nacalai Tesque | 35501-15 | |
| Trypsin | Nacalai Tesque | 18172-94 |
参考文献
- Waites, C. L., Craig, A. M., Garner, C. C. Mechanisms of Vertebrate Synaptogenesis. Annual Review of Neuroscience. 28 (1), 251-274 (2005).
- Ziv, N. E., Garner, C. C. Cellular and molecular mechanisms of presynaptic assembly. Nature Reviews Neuroscience. 5 (5), 385-399 (2004).
- Chia, P. H., Li, P., Shen, K. Cellular and molecular mechanisms underlying presynapse formation. Journal of Cell Biology. 203 (1), 11-22 (2013).
- Südhof, T. C. Neuroligins and neurexins link synaptic function to cognitive disease. Nature. 455 (7215), 903-911 (2008).
- Saitsu, H., et al. CASK aberrations in male patients with Ohtahara syndrome and cerebellar hypoplasia. Epilepsia. 53 (8), 1441-1449 (2012).
- Friedman, H. V., Bresler, T., Garner, C. C., Ziv, N. E. Assembly of New Individual Excitatory Synapses. Neuron. 27 (1), 57-69 (2000).
- Bresler, T., et al. Postsynaptic density assembly is fundamentally different from presynaptic active zone assembly. The Journal of neuroscience the official journal of the Society for Neuroscience. 24 (6), 1507-1520 (2004).
- Parvin, S., Takeda, R., Sugiura, Y., Neyazaki, M., Nogi, T., Sasaki, Y. Fragile X mental retardation protein regulates accumulation of the active zone protein Munc18-1 in presynapses via local translation in axons during synaptogenesis. Neuroscience Research. , (2018).
- Sasaki, Y., et al. Phosphorylation of Zipcode Binding Protein 1 Is Required for Brain-Derived Neurotrophic Factor Signaling of Local β-Actin Synthesis and Growth Cone Turning. Journal of Neuroscience. 30 (28), 9349-9358 (2010).
- Sasaki, Y., Gross, C., Xing, L., Goshima, Y., Bassell, G. J. Identification of axon-enriched microRNAs localized to growth cones of cortical neurons. Developmental neurobiology. 74 (3), 397-406 (2014).
- Linhoff, M. W., et al. An Unbiased Expression Screen for Synaptogenic Proteins Identifies the LRRTM Protein Family as Synaptic Organizers. Neuron. 61 (5), 734-749 (2009).
- de Wit, J., et al. LRRTM2 Interacts with Neurexin1 and Regulates Excitatory Synapse Formation. Neuron. 64 (6), 799-806 (2009).
- Ko, J., Fuccillo, M. V., Malenka, R. C., Südhof, T. C. LRRTM2 Functions as a Neurexin Ligand in Promoting Excitatory Synapse Formation. Neuron. 64 (6), 791-798 (2009).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature protocols. 1 (5), 2406-2415 (2006).
- Hirai, H., et al. Structural basis for ligand capture and release by the endocytic receptor ApoER2. EMBO reports. , (2017).
- Yasui, N., et al. Functional Importance of Covalent Homodimer of Reelin Protein Linked via Its Central Region. Journal of Biological Chemistry. 286 (40), 35247-35256 (2011).
- Bassell, G. J., Warren, S. T. Fragile X Syndrome: Loss of Local mRNA Regulation Alters Synaptic Development and Function. Neuron. 60 (2), 201-214 (2008).
- Darnell, J. C., Klann, E. The translation of translational control by FMRP: therapeutic targets for FXS. Nat Neurosci. 16 (11), 1530-1536 (2013).
- Richter, J. D., Bassell, G. J., Klann, E. Dysregulation and restoration of translational homeostasis in fragile X syndrome. Nature Reviews Neuroscience. 16 (10), 595-605 (2015).
- Lucido, A. L., et al. Rapid Assembly of Functional Presynaptic Boutons Triggered by Adhesive Contacts. Journal of Neuroscience. 29 (40), 12449-12466 (2009).
- Taylor, A. M., Wu, J., Tai, H. C., Schuman, E. M. Axonal Translation of β-Catenin Regulates Synaptic Vesicle Dynamics. Journal of Neuroscience. 33 (13), 5584-5589 (2013).
- Batista, A. F. R., Martínez, J. C., Hengst, U. Intra-axonal Synthesis of SNAP25 Is Required for the Formation of Presynaptic Terminals. Cell reports. 20 (13), 3085-3098 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved