Method Article
Presynapse تشكيل التبيّن باستخدام الخرز المنظم Presynapse و "الكرة العصبية" الثقافة
In This Article
Summary
تشكيل Presynapse هو عملية ديناميكية بما في ذلك تراكم البروتينات متشابك في الترتيب السليم. في هذه الطريقة، يتم تشغيل تشكيل presynapse بواسطة الخرز المترافق مع بروتين منظم presynapse على أوراق axonal من ثقافة "الكرة العصبية"، بحيث تراكم البروتينات متشابك من السهل تحليلها خلال تشكيل presynapse.
Abstract
خلال تطوير الخلايا العصبية، تشكيل المشبك هو خطوة هامة لإنشاء الدوائر العصبية. لتشكيل نقاط الاشتباك العصبي، يجب توفير البروتينات متشابك في الترتيب المناسب عن طريق النقل من الهيئات الخلية و / أو الترجمة المحلية في نقاط الاشتباك العصبي غير ناضجة. ومع ذلك، فإنه ليس من المفهوم تماما كيف تتراكم البروتينات متشابك في نقاط الاشتباك العصبي في الترتيب السليم. هنا، نقدم طريقة جديدة لتحليل تشكيل presynaptic باستخدام مزيج من ثقافة الكرة العصبية مع الخرز للحث على تشكيل presynapse. كرات الخلايا العصبية التي هي المجاميع الخلايا العصبية توفر أوراق axonal بعيدا عن أجسام الخلايا وdendrites، بحيث يمكن الكشف عن إشارات الفلورسنت ضعيفة من presynapses عن طريق تجنب إشارات ساحقة من أجسام الخلايا. كما الخرز لتحريك تشكيل presynapse، ونحن نستخدم الخرز المترافق مع اللوين الغنية تكرار الخلايا العصبية عبر الغشاء 2 (LRRTM2)، وهو منظم presynaptic مثير. باستخدام هذه الطريقة، أظهرنا أن الغلوتامات الحويصلي الناقل 1 (vGlut1)، وهو بروتين الحويصلة متشابك، المتراكمة في presynapses أسرع من Munc18-1، وهو بروتين منطقة نشطة. Munc18-1 المتراكمة الترجمة تعتمد في presynapse حتى بعد إزالة الهيئات الخلية. وتشير هذه النتيجة إلى تراكم Munc18-1 عن طريق الترجمة المحلية في المحاور، وليس النقل من أجسام الخلايا. في الختام، هذه الطريقة مناسبة لتحليل تراكم البروتينات متشابك في presynapses ومصدر البروتينات متشابك. كما ثقافة الكرة العصبية بسيطة وليس من الضروري استخدام جهاز خاص، يمكن أن تكون هذه الطريقة قابلة للتطبيق على منصات تجريبية أخرى.
Introduction
تشكيل متشابك هو واحد من الخطوات الحاسمة أثناء تطوير الدوائر العصبية1،2،3. تشكيل نقاط الاشتباك العصبي التي هي مقصورات متخصصة تتكون من ما قبل وبعد نقاط الاشتباك العصبي هو عملية معقدة ومتعددة الخطوات تنطوي على الاعتراف المناسب للمحاور وdendrites، وتشكيل المنطقة النشطة وكثافة postynaptic، والمحاذاة المناسبة لل قنوات أيون ومستقبلات الناقل العصبي1,2. في كل عملية، تتراكم أنواع كثيرة من البروتينات متشابك إلى هذه المقصورات المتخصصة في توقيت مناسب عن طريق نقل البروتينات متشابك من أجسام الخلايا و / أو عن طريق الترجمة المحلية في المقصورات. وتعتبر هذه البروتينات متشابك ليتم ترتيبها بطريقة منظمة لتشكيل نقاط الاشتباك العصبي الوظيفية. خلل في بعض البروتينات متشابك التي تنطوي على تكوين متشابك يؤدي إلى الأمراض العصبية4,5. ومع ذلك، لا يزال من غير الواضح كيف تتراكم البروتينات متشابك في التوقيت المناسب.
للتحقيق في كيفية تراكم البروتينات متشابك بطريقة منظمة، فمن الضروري لدراسة تراكم البروتينات متشابك في الترتيب الزمني. وأظهرت بعض التقارير التصوير الحي لمراقبة تشكيل متشابك في ثقافة منفصلة من الخلايا العصبية6،7. ومع ذلك، فإنه من يستغرق وقتا طويلا للعثور على الخلايا العصبية التي تبدأ للتو تشكيل متشابك تحت الفحص المجهري. لمراقبة تراكم البروتينات متشابك بكفاءة، يجب أن يبدأ تشكيل متشابك في الوقت الذي يريد الباحثون للحث على تشكيل. والتحدي الثاني هو التمييز بين تراكم البروتينات المتشابكة بسبب النقل من أجسام الخلايا أو الترجمة المحلية في نقاط الاشتباك العصبي. ولهذا الغرض، من الضروري قياس مستوى الترجمة في ظل شرط لا يسمح بنقل البروتينات المتشابكة من أجسام الخلايا.
قمنا بتطوير رواية presynapse تشكيل التبيّن باستخدام مزيج منثقافة الكرة العصبية مع الخرز للحث على تشكيل presynapse 8. تم تطوير ثقافة الكرة العصبية لفحص النمط الظاهري المحاور، وذلك بسبب تشكيل أوراق axonal المحيطة الهيئات الخلية9،10. استخدمنا الخرز المغناطيسي المترافق مع اللوشأنهين الغنية تكرار الخلايا العصبية عبر الغشاء 2 (LRRTM2) وهذا هو منظم presynaptic للحث على presynapses الإثارة (الشكل1A)11،12،13. باستخدام الخرز LRRTM2، يبدأ تشكيل presynapse في الوقت الذي يتم فيه تطبيق الخرز. وهذا يعني أن تشكيل presynapse يبدأ في الآلاف من محاور الكرة العصبية في نفس الوقت، وبالتالي فإنه يسمح لدراسة مسار زمني دقيق من تراكم البروتينات متشابك بكفاءة. وبالإضافة إلى ذلك، فإن ثقافة الكرة العصبية من السهل منع نقل البروتينات متشابك من سوما عن طريق إزالة الهيئات الخلية (الشكل1B)8. وقد أكدنا بالفعل أن المحاور التي لا تحتوي على أجسام خلوية يمكن أن تبقى على قيد الحياة وأنها صحية على الأقل 4 ساعة بعد إزالة أجسام الخلايا. وهكذا، فإن هذا البروتوكول مناسب للتحقيق من حيث يتم اشتقاق البروتينات متشابك (جسم الخلية أو محور عصبي)، وكيف تتراكم البروتينات متشابك بطريقة منظمة.
Protocol
أجريت التجارب الموصوفة في هذه المخطوطة وفقاً للمبادئ التوجيهية المبينة في اللجنة المؤسسية لرعاية الحيوانات واستخدامها التابعة لجامعة مدينة يوكوهاما.
1. إعداد كرات الخلايا العصبية كما شنقا انخفاض الثقافة (أيام في المختبر (DIV) 0-3)
ملاحظة: تستند الإجراءات الموضحة هنا لإعداد ثقافة الكرة العصبية على الطريقة التي سبق أن أبلغت عنها مجموعة ساساكي مع بعض التعديلات9و10. كما اعتمدنا عدة إجراءات من طريقة المصرفي للثقافة المنفصلة14.
-
تأكيد ما يلي قبل بدء تشريح
- إعداد جميع الحلول المطلوبة وتعقيمها عن طريق الأوتوكلاف / الترشيح مقدما.
- الحفاظ على استعداد جميع الأدوات والمواد لاستخدامها في كل خطوة من هذه الثقافة الخلايا العصبية القشرية.
- رش ومسح مجلس الوزراء تدفق الهواء laminar، طاولة تشريح، لوحة مرحلة من مجهر مجسم، مقص، وملقط مع الإيثانول 70٪.
- قتل الفأر عند تطبيق CO2 وتشريح البطن للحصول على الأجنة E16.
- إزالة العقول من الأجنة بعناية مع مساعدة من نصائح غرامة من الملقط ونقلها إلى 60 ملم أطباق زراعة الخلايا التي تحتوي على 4 مل من محلول الملح المخزنة HEPES (HBSS).
ملاحظة: يحتوي التشريح الأوسط HBSS على 10 مليون متر من حمض الهيدروكلوريك (درجة الحموضة 7.4)، و140 مليون مترمن كل+، و5.4مليون متر مربع، و1.09 مليون متر مربع، و1.09 مليون متر مربع، و1.1 مليون متر مربع، و1.1 مليون متر مربع، و1.6 مليون متر من السكر في الدم، و5.64 مليون متر من اللون الفينول الأحمر. - إزالة فروة الرأس، وقطع لمبة الشم، والقشرية منفصلة من كل نصف الكرة الدماغي باستخدام نصائح غرامة من ملقط تحت مجهر ستيريو، ونقل إلى أطباق أخرى 60 ملم تحتوي على HBSS الطازجة. استخدام ما لا يقل عن 3-5 الأجنة لكل ثقافة الكرة العصبية منفصلة.
- قطع القشرية إلى قطع صغيرة مع مقص الربيع microdissecting في غطاء غطاء ثقافة الخلية تدفق laminar.
- نقل القشريات المفرومة إلى أنبوب 15 مل وtrypsinize القشرية المفرومة في 4 مل من 0.125٪ تريبسين في HBSS لمدة 4.5 دقيقة في حمام مائي عند 37 درجة مئوية.
ملاحظة: هذا الوقت trypsinization أمر بالغ الأهمية لثقافة الخلايا العصبية الفعالة كما الوقت المتزايد (> 4.5 دقيقة) يؤدي إلى الخلايا العصبية أكثر من ذلك بكثير ميتة. - نقل المجاميع الخلية إلى أنبوب جديد 15 مل تحتوي على 10 مل من HBSS بواسطة ماصة نقل معقمة، وحضانة في 37 درجة مئوية لمدة 5 دقائق.
- نقل مجاميع الخلية إلى أنبوب جديد 15 مل يحتوي على 2 مل من وسائل الإعلام العصبية التي تحتوي على GlutaMax، الملحق B27 (NGB المتوسطة)، 0.01٪ DNase الأول و 10٪ مصل الحصان.
- Triturate القشرية trypsinized عن طريق الأنابيب مرارا وتكرارا لهم صعودا وهبوطا (3-5 مرات) باستخدام النار مصقول الزجاج غرامة باستور ماصة.
ملاحظة: قطر الزجاج غرامة مصقول النار باستور ماصة مهم جدا كما هو موضح في ورقة طريقة المصرفي14. إذا كانت الماصة ضيقة جدا ً بحيث لا يمكن تمريرها من القشرية، قم بإعداد الماصات التي تمتلك 2-3 أحجام مختلفة، وحاول من ماصة أكبر. - لإعداد كرات الخلايا العصبية، واتخاذ تعليق الخلية أعلاه وضبط كثافة الخلية إلى 1 × 106 خلايا / مل باستخدام NGB المتوسطة.
- ثقافة الخلايا العصبية القشرية كما قطرات معلقة تحتوي على 10،000 خلية / قطرة (1 قطرة هو 10 درجة مئوية) داخل الأغطية العليا من 10 سم أطباق الثقافة.
- إضافة 7 مل من الفوسفات المخزنة المالحة (PBS) إلى الجزء السفلي من أطباق الثقافة، ثم تبقى في حاضنة لمدة 3 أيام في 37 درجة مئوية مع 5٪ CO2 تحت حالة ترطيب للسماح لتشكيل الكرة العصبية.
2. وضع كرات الخلايا العصبية على الأغطية الزجاجية المغلفة PLL وصيانة الثقافة (DIV 3-11)
ملاحظة: قبل طلاء الأغطية الزجاجية مع بولي-L-يسين (PLL)، وغسل الأغطية باستخدام المنظفات أمر مهم. الأغطية الزجاجية في بعض الأحيان ليست نظيفة جدا للثقافة العصبية وطلاء موحد مع PLL. طلاء PLL غير موحدة قد يؤدي إلى تمديد axonal متفاوتة من كرات الخلايا العصبية.
- نقع الأغطية في 1/20 المخففة محايدة غير الفوسفور المنظفات في رفوف السيراميك لمدة 1-3 ليلة.
- اغسل الأغطية 8 مرات في الماء النقي، ثم قم بالتعقيم في فرن عند 200 درجة مئوية لمدة 12 ساعة.
ملاحظة: يجب أن يتم جميع الخطوات من هنا في غطاء محرك السيارة ثقافة تدفق الهواء laminar. - نقل الأغطية المخبوزة إلى أطباق من عيار 100 ملم. بعد ختم الطبق بواسطة parafilm بين غطاء وطبق أسفل، يمكن الاحتفاظ الأغطية المخبوزة للتخزين على المدى الطويل.
- (اختياري) تطبيق النقاط البارافين على الأغطية. النقاط تجعل مساحة لمنع كرات الخلايا العصبية فصل من الأغطية أثناء تلطيخ المناعة عن طريق الاتصال المباشر من كرات الخلايا العصبية إلى الأطباق البلاستيكية. تذوب البارافين في زجاجة مناسبة في حمام الماء الساخن في حوالي 90 درجة مئوية. تراجع ماصة باستور في البارافين، ثم لمسها بسرعة لجعل ثلاثة بقع بالقرب من حافة غطاء.
- معطف PLL (MW > 300,000) على الأغطية الزجاجية مطرز بالبارافين في أطباق 60 ملم باستخدام محلول PLL (15 ميكروغرام /مل في المخزن المؤقت)، والاحتفاظ بها لمدة ساعة واحدة على الأقل في حاضنة CO 2.
- بعد غسل 4 مرات مع PBS، نقل الأغطية المغلفة PLL إلى لوحة 4-جيدا تحتوي على 350 ميكرولتر من وسائل NGB في كل بئر والسيتوسين β-D-أرابينوفيورنوسيد هيدروكلوريد (AraC، 3 μM) إلى وسائل الإعلام لقتل الخلايا الفاصلة.
- الحفاظ على هذه اللوحة 4 جيدا تحتوي على الأغطية المغلفة PLL في حاضنة CO2 على الأقل لمدة 20 دقيقة لضمان درجة حرارة متوسطة تصل إلى 37 درجة مئوية قبل نقل كرات الخلايا العصبية.
- في DIV 3 عندما يتم تشكيل "كرات الخلايا العصبية" بشكل جيد جدا، نقلها على الأغطية المغلفة PLL داخل لوحة 4 جيدا (5 كرات الخلايا العصبية / جيدا) أبقى في حاضنة CO 2.
- بعد 48 ح، استبدال وسط ثقافة الكرة العصبية مع الطازجة AraC خالية من NGB المتوسطة. استخدام لوحة ساخنة في غطاء غطاء ثقافة تدفق الهواء laminar الذي يتم الاحتفاظ درجة الحرارة جاهزة في 37 درجة مئوية مباشرة قبل هذا الإجراء.
ملاحظة: من الضروري أداء المتوسط المتغير في أسرع وقت ممكن على لوحة ساخنة لتقليل الوقت الذي تكون فيه الثقافات في الخارج من حاضنة CO 2. - الحفاظ على هذه الثقافة الكرة العصبية في حاضنة CO2 لمدة تصل إلى DIV 11.
ملاحظة: في DIV 11-12، يتم استخدام كرات الخلايا العصبية تمديد النيورايتات تصل إلى 1-2 ملم للتجارب.
3. تطبيق الخرز LRRTM2 على ثقافة الكرة العصبية مع أو بدون الهيئات الخلية (DIV 11-12)
ملاحظة: قبل تطبيق الخرز LRRTM2 على ثقافة الكرة العصبية، فمن المستحسن لإزالة الهيئات الخلية. لذلك، إعداد الخرز LRRTM2 في البداية، ثم إزالة الهيئات الخلية وتطبيق في وقت لاحق الخرز LRRTM2 للثقافة في أقرب وقت ممكن. يتم توفير LRRTM2 Biotinylated من قبل مجموعة نوجي (جامعة مدينة يوكوهاما) كوسيلة مكيفة. أنها تستخدم ناقلات التعبير بما في ذلك تسلسل قبول البيوتين والرباط ية البيوتين من E. كولاي (بيرا) هل من أحد 15 , 16 لإرفاق البيوتين LRRTM2، ويتم نقل متجه التعبير إلى خلايا Expi293F المضمنة في نظام التعبير Expi293. وتتوافر معلومات المتجهات في الشكل التكميلي1. Biotinylated LRRTM2-مترافق الخرز streptavidin يقلل من خلفية من تلطيخ المناعة إلى حد كبير بالمقارنة مع LRRTM2-Fc - البروتين المترافق الخرز A التي تستخدم لنموذج LRRTM2 نظام8.
-
إعداد حبات LRRTM2 biotinylated
- لإزالة البيوتين الزائد من المتوسطة المكيفة من خلايا Expi293F التي تعبر عن LRRTM2 biotinylated، وتطبيق 1.7 مل من المتوسطة مكيفة مختلطة مع 0.8 مل من PBS (المجموع 2.5 مل) إلى PD-10 عمود الترشيح هلام. يتم تقويم عمود PD-10 مسبقًا مع 25 مل من المياه النقية و25 مل من PBS.
- Elute مع 3.5 مل من PBS وجمع تدفق من خلال كمخزون LRRTM2.
ملاحظة: يمكن الاستغناء عن هذا المخزون LRRTM2 إلى aliquots وتخزينها في -80 درجة مئوية على المدى الطويل. مستويات التعبير من LRRTM2 biotinylated تختلف في بعض الأحيان من الكثير إلى الكثير. وهكذا، ينبغي تحديد حجم مناسب من الأسهم LRRTM2 لالتواء إلى الخرز لتشكيل presynapses بما فيه الكفاية على كرات الخلايا العصبية، عندما يتم استخدام الكثير جديد من الأسهم LRRTM2 في المرة الأولى. - خذ 20 ميكرولتر من تعليق الجسيمات المغناطيسية المغلفة بstreptavidin (القطر: 4-5 ميكرومتر) إلى أنبوب الطرد المركزي الدقيق. تعطيل الخرز إلى جهاز مصنوع يدويا تعلق مع مغناطيس دائم النيوديميوم وغسل ثلاث مرات مع 100 درجة مئوية من PBS-MCBC في أنابيب الطرد المركزي الصغيرة 1.5 مل.
ملاحظة: PBS-MCBC يحتوي على PBSبما في ذلك 5 مليون متر MgCl 2، 3 مليون متر CaCl2،0.1٪ BSA، و 0.1٪ كاملة EDTA خالية. - بعد إزالة تماما PBS-MCBC من الخرز، إضافة حجم محدد مسبقا من الأسهم LRRTM2 (عادة 500-1000 درجة مئوية، انظر الملاحظة 3.1.2) إلى الخرز غسلها. تحضن الخليط باستخدام الدوار في 4 درجة مئوية لمدة 1-2 ساعة.
- غسل الخرز مرتين مع 100 درجة مئوية من PBS-MCBC، وفي وقت لاحق مع 100 درجة مئوية من NGB المتوسطة.
- إعادة تعليق الخرز LRRTM2 في 50 درجة مئوية من وسائل NGB لتطبيقها على ثقافة الكرة العصبية.
- استخدام نفس الإجراءات لإعداد حبات التحكم (التحكم السلبي) في أنبوب آخر للطرد المركزي الصغير باستثناء إضافة بروتينات biotinylated-LRRTM2.
-
إزالة أجسام الخلايا من كرات الخلايا العصبية في DIV 11-12 وتطبيق الخرز LRRTM2
- تسمية الآبار من لوحة 4-جيدا باسم "جسم الخلية (+)" و "جسم الخلية (-)".
- قطع نهاية طرف أصفر في زاوية 45 درجة مع شفرة الحلاقة رش سابقا مع الإيثانول 70٪ تحت مجهر ستيريو (الشكل1B).
- وضع نهاية طرف أصفر على منطقة جسم الخلية من الكرة العصبية وإزالة الهيئات الخلية عن طريق شفط (الشكل1B).
- لتحديد كل حالة محددة من التجربة، تسمية الآبار مرة أخرى باسم "الخرز LRRTM2" و "الخرز التحكم".
- تطبيق LRRTM2 والخرز السيطرة على ثقافة الكرة العصبية، وغمر إلى الجزء السفلي من لوحات لمدة 1 دقيقة باستخدام المغناطيس الفريت لبدء تشكيل presynapse. هذا الإجراء يضمن لهبوط جميع الخرز في نفس الوقت. خاصة، فإنه سيكون فعالا لفترة قصيرة الحضانة (على سبيل المثال، 30 دقيقة و 1 ساعة) مع الخرز LRRTM2 بشكل متزامن.
- لإجراء تجارب الدورة الزمنية، قم بتسمية كل فصل بالإضافة إلى 0 دقيقة و30 دقيقة و1 ساعة و2 ساعة و4 ح و18 ساعة وتطبيق حبات LRRTM2 في الفترات الزمنية المشار إليها.
- بعد إضافة حبات LRRTM2، احتضان ثقافة الكرة العصبية مع الخرز لفترة محددة (0 دقيقة إلى 18 ساعة) لتشكيل presynapses.
4. تلطيخ المناعة والفحص المجهري
ملاحظة: إصلاح الخلايا لمدة 4 ساعة عن طريق الحضانة مع الخرز LRRTM2 في الظروف التجريبية مع وبدون أجسام الخلية، كما محاور تميل تدريجيا إلى الموت في غياب الهيئات الخلية بعد 4 ح. في حالة الوقت بالطبع مع الخرز LRRTM2، إصلاح الخلايا في الوقت المحدد المشار إليه.
-
إصلاح وتلطيخ الخلايا العصبية في ثقافة الكرة العصبية بعد تشكيل presynapse مع الخرز LRRTM2
- إزالة NGB المتوسطة وإصلاح كرات الخلايا العصبية مع 4٪ PFA في PBS (250 درجة مئوية / جيدا) لمدة 20 دقيقة في درجة حرارة الغرفة، ومن ثم يغسل مع 500 ميكرولتر من PBS 4 مرات كل 5 دقائق.
- اغسل الخلايا الثابتة بـ TBS (ملحي مُسَنَع َتريس: 50 مم تريس-هكل (درجة الحموضة 7.3) و150 مم حمض الهيدروكلوريك) لأكثر من 5 دقائق.
- Permeabilize الخلايا / محاور من ثقافة الكرة العصبية مع TBS تحتوي على 0.3٪ تريتون X-100 لمدة 5 دقائق.
- الحفاظ على الخلايا 1 ساعة لحجب مع حظر العازلة (0.1٪ تريتون X-100 و 5٪ NGS (مصل الماعز العادي) في TBS).
- حضانة الخلايا مع الأجسام المضادة الأولية. المضادة للأرنب-vGlut1 (اللوتامات الحويصلي الناقل 1 (1:4000)) ومكافحة الماوس Munc18-1 (1:300) المخففة مع تخفيف الأجسام المضادة ليلا في 4 درجة مئوية.
- غسل الأغطية 4 مرات مع الفلورة المناعية (IF) العازلة (0.1٪ تريتون X-100 و 2٪ BSA في TBS) وحضانة لمدة 30 دقيقة مع فلوروفور (صبغ اليكسا) -مترافق الأجسام المضادة 2؛ مكافحة الماوس-IgG-اليكسا 555 (1:500)، ومكافحة الأرنب-IgG-اليكسا 488 (1:1000).
- وصمة عار نوى من الهيئات الخلية من الخلايا العصبية لمدة 5 دقائق مع 4′,6-دياميدينو-2-فينيليندول (DAPI, 1 ميكروغرام / مل) في PBS.
- غسل الأغطية ثلاث مرات مع PBS ومن ثم جبل على الشرائح الزجاجية باستخدام وسائل الإعلام المتصاعدة التي تحتوي على 167 ملغ / مل بولي (الفينيل) الكحول و 6 ملغ / مل N-بروبيل جالات.
- تخزين الشرائح الزجاجية في الثلاجة في -20 درجة مئوية حتى الفحص المجهري. يمكن الكشف عن إشارات الفلورسنت للشرائح الزجاجية لمدة سنة واحدة على الأقل عندما يتم تخزين الشرائح عند -20 درجة مئوية.
-
التقاط الصور تحت المجهر الفلوري
- التقط تباين التداخل التفاضلي وصور IF تحت مجهر فلوري مقلوب مع كاميرا CCD مبردة باستخدام عدسة غمر الزيت 60X. للحصول على برنامج الحصول على الصور، استخدم نظام المجهر المثبت على البرامج. استخدم Image J كبرنامج لتحليل الصور.
- قياس كثافة IF في presynapses في axon باستخدام الصيغة التالية؛ إذا كثافة منطقة الاهتمام على الخرز (ROI) - قبالة كثافة منطقة الخرز / كثافة Axonal على طول 20 ميكرومتر من الخرز – كثافة الخلفية. توفر هذه الكثافة نسبة مؤشر تراكم البروتين (الشكل4A). إنجاز القياسات على الصور الأصلية 16 بت باستخدام برنامج صورة J.
- لتحديد مستوى تراكم بروتين معين في presynapse الناجمة عن حبات LRRTM2، حدد دائما المنطقة بعيدا عن 2-مجال الرؤية أو أكثر وبصرف النظر عن جسم الخلية مع المجهر (60X).
ملاحظة: اختيار المنطقة في الكرة العصبية للتصوير أمر بالغ الأهمية كما محاور كثيفة بالقرب من جسم الخلية ومحيط الكرة العصبية يمكن أن توفر محور واحد. - لقياس دقيق، اختر 5-حقل axonal مختلفة (مسافة مماثلة من أجسام الخلية) / coverslip.
- الحفاظ على ظروف التصوير متطابقة في يوم مختلف وفي ما بين التجارب
النتائج
هنا، نعرض النتائج التمثيلية لتراكم البروتينات presynaptic في presynapses التي يسببها LRRTM2 من أوراق axonal من ثقافة الكرة العصبية. كبروتينات presynaptic، قمنا بتحليل البروتين الحويصلة المتشابكة المحفزة vGlut1 وبروتين المنطقة النشطة Munc18-1. كما درسنا مسار الوقت من تراكم vGlut1 و Munc18-1 في presynapses، والحصول على نتائج تشير إلى مصدر Munc18-1 في presynapses باستخدام محاور إزالة أجسام الخلايا ومثبط تخليق البروتين. في الآونة الأخيرة، قمنا بالتحقيق في دور بروتين التخلف العقلي X الهشة (FMRP) على تراكم Munc18-1 في presynapses8. FMRP، وهو منتج الجينات المسببة لمتلازمة X الهشة (FXS)، هو بروتين ملزم mRNA لقمع الترجمة17،18،19. كما درسنا مشاركة FMRP في تراكم Munc18-1 باستخدام الفئران نموذج FXS الذي يعاني من نقص في Fmr1 ترميز الجينات FMRP.
تطبيق LRRTM2-الخرز في ثقافة الكرة العصبية في DIV11 تراكم الناجمة عن Munc18-1 في presynapses من محاور كرات الخلايا العصبية (الشكل2A). حتى في المحاور التي تتم إزالتها الهيئات الخلية، لوحظ تراكم Munc18-1 تحت الخرز مماثلة لمحاور كرات الخلايا العصبية مع أجسام الخلية (الشكل2B). في الحالة النموذجية، أكثر من 80٪ من الخرز بعد 4 ح حضانة مع كرات الخلايا العصبية يمكن أن تحفز تراكم البروتينات متشابك في presynapses، الحكم عليها عن طريق تلطيخ Munc18-1 و vGlut-1. لأن المحاور مزدحمة جدا ومتداخلة بالقرب من الهيئات الخلية (الشكل2AA، با)،تم قياس منطقة أكثر هامشية من صفائح axonal حيث لا تتداخل المحاور حتى (الشكل2Ab، Bb،على سبيل المثال، منطقة هامشية بعيدا عن 2-حقل من وجهة نظر أو أكثر وبصرف النظر عن جسم الخلية مع المجهر (60X)). عندما تم تحليل المنطقة الطرفية من ورقة axonal من قبل عدسة موضوعية عالية التكبير (60X)، vGlut1 وMunc18-1تراكمت بوضوح في presynapses من المحاور تحت الخرز (الشكل 3). في بعض الأحيان، إشارات الفلورسنت من البروتينات الحويصلي متشابك مثل vGlut1 من الصعب الكشف عنها في منطقة axonal خارج الخرز، لأن هذه البروتينات الحويصلي متشابك تتراكم كثيرا تحت الخرز. في حالة Munc18-1، يمكن الكشف عن إشارات الفلورسنت ضعيفة في المنطقة الإبطية خارج الخرز.
لتحديد مستوى تراكم البروتينات المتشابكة في presynapses التي يسببها الخرز LRRTM2، تم قياس كثافات الفلورسنت من المحاور تحت الخرز وخارج الخرز، ومن ثم حسابها على أنها "مؤشر تراكم البروتين" (الشكل4A،و الموضحة في قسم البروتوكول بالتفصيل). وأظهرت تجارب الدورة الزمنية أن تراكم vGlut1 في presynapses زاد بشكل ملحوظ في 30 دقيقة (الشكل4B). من ناحية أخرى، بدأ تراكم Munc18-1 في الزيادة بشكل ملحوظ في 2 ح، وتصل إلى هضبة في 4 ح (الشكل4C). وتشير هذه البيانات إلى أن البروتين الحويصلة متشابك vGlut1 يتراكم في presynapses في وقت سابق من البروتين المنطقة النشطة Munc18-1. تراكم Munc18-1 في presynapses من الخلايا العصبية Fmr1-KO زيادة 1.5 مرات أكثر من تلك الموجودة في النوع البري (WT) (الشكل4C)،مما يشير إلى مشاركة FMRP في تراكم Munc18-1. بعد ذلك، للتمييز بين تراكم Munc18-1 بسبب النقل من أجسام الخلايا أو الترجمة المحلية في المحاور، تم فحص تأثير مثبطات تخليق البروتين أنيومايسين على تراكم في وجود أو عدم وجود أجسام الخلية (الشكل 4D) . قمع الأنيسومايسين تراكم Munc18-1 بشكل كبير في المحاور (الشكل 4D)،مما يشير إلى أن تراكم البروتين تعتمد على التوليف. لم يكن تراكم الأوجال من المحاور بدون أجسام خلوية مختلفاً اختلافاً كبيراً عن تراكم الأجسام الخلوية (الشكل4D). وتشير هذه النتائج إلى أن تراكم Munc18-1 في presynapses مستمدة في الغالب من المحاور، ولكن ليس نقل Munc18-1 من أجسام الخلايا. إذا تم قمع تراكم البروتينات متشابك في presynapses من المحاور عن طريق إزالة أجسام الخلايا، ويعتبر أن هذا الانخفاض يرجع إلى النقل من أجسام الخلايا. في الواقع، عندما درسنا تراكم مجموع البروتينات توليفها حديثا المسمى من قبل صبغ الفلورسنت، وإزالة الهيئات الخلية خفضت بشكل كبير تراكم مجموع البروتينات توليفها حديثا، مقارنة مع presynapses من المحاور مع الهيئات الخلية8. على الرغم من أن تراكم Munc18-1 في Fmr1-KOزاد أكثر مقارنة مع WT، الأنيسوميسيين قمعت تراكم في مستوى مماثل لWT وإزالة الهيئات الخلية لم يكن لها تأثير على تراكم (الشكل4D). وتشير هذه النتائج إلى أن FMRP تشارك في الترجمة المحلية لMunc18-1 في المحاور.
تظهر النتائج التمثيلية المعروضة هنا أن هذه الطريقة مناسبة للتحقيق في كيفية تراكم البروتينات المتشابكة بطريقة منظمة من خلال تجارب الدورة التدريبية الزمنية، ولفحص مصدر البروتينات المتشابكة (النقل من أجسام الخلايا أو المحلية الترجمة في المحاور) عن طريق إزالة الهيئات الخلية.

الشكل 1 مخطط تشكيل presynapse وإزالة الهيئات الخلية من الكرة العصبية.
(A) اختبار تشكيل Presynapse باستخدام biotinylated LRRTM2 مترافق ة حبات streptavidin للحث على presynapses في محاور ثقافة الكرة العصبية أعدت من القشرية E16. LRRTM2، وهو بروتين postsynaptic، يربط neurexin (NRXN) وتعمل كمنظم presynapse. تم تطبيق حبات Streptavidin المترافقة مع المناطق خارج الخلية LRRTM2 biotinylated (الخرز LRRTM2) في DIV11-12 لثقافة الكرة العصبية للحث على presynapses. تم تعديل هذا الرقم من المنشور السابق8. (ب) تم قطع نهاية طرف أصفر ووضعها على منطقة الجسم الخلية من ثقافة الكرة العصبية في زاوية 45 درجة. تمت إزالة أجسام الخلايا عن طريق الشفط. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2 Munc18-1 تراكم في presynapses في وجود وغياب الهيئات الخلية من الكرة العصبية.
(أ) بعد 4 ح حضانة مع حبات LRRTM2، البروتين المنطقة النشطة Munc18-1 المتراكمة في المواقع presynaptic المستحثة في المحاور (اللوحة العليا؛ مخطط تجريبي، منتصف؛ صورة المرحلة، أقل؛ IF صور تراكم Munc18-1). تم التقاط الصور كصور تكبير منخفضة باستخدام عدسة 10X والتكبير المتوسط (1.5X) لرؤية الصورة بأكملها تتكون من كرة الخلايا العصبية، والمحاور، والخرز. المربعات متقطعة تشير إلى منطقة الكرة العصبية لموقف التصوير الدقيق من الخرز. شريط مقياس، 20 ميكرومتر (يسار؛ صورة أصلية)، 10 ميكرومتر (يمين؛ صورة مكبرة). (ب) تراكم Munc18-1 بشكل جيد جداحتى في غياب الهيئات الخلوية في المواقع المتبصّلة المستحثة في المحاور. وتشير هذه النتيجة إلى أن المحاور يمكن أن تبقى على قيد الحياة وتشكل presynapses حتى بعد إزالة الهيئات الخلية لمدة 4 ساعة على الأقل.
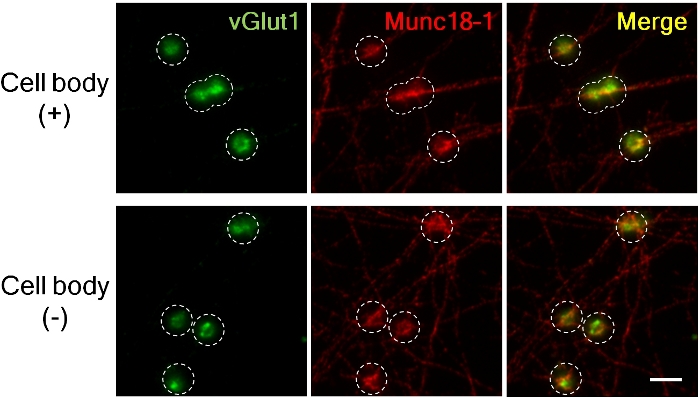
الشكل 3 تراكم vGlut1 و Munc18-1 في presynapses من المحاور مع وبدون أجسام الخلية.
علامة presynaptic excitatory vGlut1 (الأخضر) وMunc18-1 (الأحمر) المتراكمة في presynapses 4 ساعة بعد إضافة الخرز LRRTM2. (اللوحة العليا؛ مع أجسام الخلايا، أقل؛ بدون أجسام خلوية). تم التقاط الصور باستخدام عدسة غمر الزيت 60X للتكبير العالي لقياس شدة الفلورسنت. دائرة متقطعة الخطوط العريضة موقف الخرز. Munc18-1 المتراكمة تقريبا مماثلة مدى في وجود وعدم وجود الهيئات الخلية في presynapses ولكن يتم تقليل تراكم vGlut1 دون الهيئات الخلية8. شريط مقياس، 5 ميكرومتر.

الشكل 4 إجراء قياس كثافة IF وتأثير إزالة أجسام الخلايا ومثبطات تخليق البروتين على تراكم Munc18-1 في كرات الخلايا العصبية.
(أ) أظهر الرسم البياني طريقة القياس الكمي لكثافة IF في موقع مستحث-presynaptic في محور ثقافة الكرة العصبية. شريط مقياس، 5 ميكرومتر. يتم وصف التفاصيل في قسم البروتوكول. (ب) مسار زمني لتراكم vGlut1 في presynapses الناجمة عن حبات LRRTM2. البيانات المعروضة هي متوسط ± SEM لn = 20. في اتجاهين ANOVA مع اختبار المقارنة متعددة توكي. **ص < 0.01. (C) مسار زمني لتراكم Munc18-1 في WT و Fmr1-KOpresynapses تحت حبات LRRTM2. البيانات المعروضة هي يعني ± SEM لn = 20، ANOVA في اتجاهين مع اختبار المقارنة متعددة توكي. n.s.، ليست كبيرة؛ **p < 0.01, تختلف اختلافا كبيرا بين WT وKO. (د) أظهر الرسم البياني للشريط مستوى تراكم Munc18-1 في القيلولة من كرات الخلايا العصبية WT وFmr1-KOفي وجود أو غياب 25 ميكرومتر أنيسو (أنيسو) مع (CB +) أو بدون (CB-) أجسام الخلايا. البيانات المعروضة هي متوسط ± SEM لn = 20. في اتجاهين ANOVA مع اختبار المقارنة متعددة توكي. **p < 0.01, n.s., ليست كبيرة. # وأشار p < 0.01، مختلفة بشكل ملحوظ مع وبدون الإيزوميسين. وقد عُدلت هذه الأرقام من المنشور السابق8. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1 [بيسستروترونيكس] تعبير مجانب ل [لرتم2-إكر] ([إإكسترسلّر] منطقة) و [بيرا] ([بيوتين] [ليغس] من [إ.]. [كلّي] ).
بين تسلسلات الترميز LRRTM2-ECR وBirA، هناك تسلسل موقع إدخال ريبوسومال داخلي (IRES) يسمح بالمشاركة في التعبير عن كلا البروتينات من mRNA واحد. hEF1-HTLV المروج محركات التعبير عن mRNA bicstronic، ويتم إفراز كل من البروتينات من قبل تسلسل الببتيد إشارة بعد الترجمة. يتم إرفاق تسلسل الترميز LRRTM2-ECR إلى عدة تسلسلات علامات الببتيد (DYKDDDDK، TEV، Myc وعلاماته) وتسلسل مقبول البيوتين (BAS). يتم إرفاق BirA إلى العلامة DYKDDDDV. يفرز BirA biotinylates يسين من تسلسل BAS من LRRRTM2-ECR لربط الخرز streptavidine. الرجاء النقر هنا لتحميل الرقم.
Discussion
قمنا بتطوير طريقة جديدة لدراسة تشكيل presynapse حفز مع LRRTM2-الخرز باستخدام ثقافة الكرة العصبية. حاليا، معظم اختبار تشكيل presynapse يشمل بولي-D-يسين (PDL) الخرز المغلفة والثقافة المنفصلة / غرفة microfluidic20،21،22. واحدة من مزايا هذه الطريقة هو LRRTM2 الخرز. في حين يتفاعل LRRTM2 مع neurexin لتشكيل presynapses الإثارة على وجه التحديد11،12،13، PDL الخرز يحفز على حد سواء الإثارة والمثبطة presynapses غير محدد20. في هذه الطريقة، يمكن تطبيق منظمي presynapse الآخرين، الذين يزيد عدد أعضائهم على 10 بروتينات3، على الحث على الpresynapses عن طريق تغيير المجال خارج الخلية من البروتين biotinylated اعتمادا على الغرض التجريبي.
ميزة أخرى هي ثقافة الكرة العصبية. في بعض الحالات، تم استخدام الثقافة التقليدية المنفصلة لتحليل تشكيل presynapse20. ومع ذلك، فإن الثقافة المنفصلة ليست مناسبة لتحليل مستويات منخفضة من البروتينات متشابك داخل presynapses، لأن الإشارات الساحقة في أجسام الخلايا وdendrites تتداخل الإشارات في presynapses. بدلا من ذلك، بعض المجموعات استخدام الثقافة المنفصلة في غرفة microfluidic التي هي جهاز خاص للمحاور الثقافة والهيئات الخلية بشكل منفصل في 2 comprtments21،22. باستخدام غرفة microfluidic، يتم تشكيل ورقة axonal في مقصورة axonal، والهيئات الخلية قادرة على إزالتها من حجرة الجسم الخلية، على غرار ثقافة الكرة العصبية. ومع ذلك، غرفة microfluidic هو جهاز خاص، ويتطلب بعض المهارات للحفاظ على حالة الثقافة المستمرة. ثقافة الكرة العصبية ليست ضرورية لاستخدام جهاز خاص، ومن السهل نسبيا أن يتم إدخالها كطريقة تجريبية جديدة. لأن جوهر ثقافة الكرة العصبية هو فقط لوضع المجاميع الخلايا العصبية (كرات الخلايا العصبية) إلى طبق الزجاج القاع / غرفة، فإنه يمكن الجمع بسهولة مع أساليب أخرى. على سبيل المثال، يعتبر أن ثقافة الكرة العصبية باستخدام LRRTM2-الخرز ينطبق على فحص المحتوى العالي لقياس الفلورة من 10-20 مساحة الخرز في نفس الوقت.
الخطوة الحاسمة من هذا البروتوكول هو طلاء مع PLL. إذا طلاء PLL ليست موحدة، ومحاور كرات الخلايا العصبية لن تمتد بشكل موحد في كل اتجاه. وهذا يزعج التحليل الفعال لتشكيل presynapse. نحن نستخدم الأغطية الزجاجية والأطباق الزجاجية القاع، ومع ذلك، الزجاج في بعض الأحيان ليست نظيفة جدا لثقافة الخلايا العصبية وطلاء موحد مع PLL. في هذا البروتوكول، في البداية، يتم نقع الأغطية الزجاجية والأطباق الزجاجية القاع في المنظفات المحايدة غير الفوسفورية لمدة 1-3 بين عشية وضحاها، ثم غسلها 8 مرات بالماء النقي. نحن نستخدم PLL الذي الوزن الجزيئي > 300،000 للحد من تركيزها (15 ميكروغرام / مل) لخلفية غير مرغوب فيها أقل. إذا تم استخدام انخفاض الوزن الجزيئي لـ PLL (علىسبيل المثال، 30,000-70,000) ، فإن التركيز الأعلى (100 ميكروغرام/مل) ضروري لتوسيع المحاور.
الحد من هذا الأسلوب هو أن ثقافة الكرة العصبية لا يمكن الحفاظ على > DIV15-16. يتم تجزئة Axons من كرات الخلايا العصبية بعد DIV15-16. لا تنتج المحاور المجزأة أي presynapse بعد تطبيق الخرز LRRTM2. وبالتالي، فإن هذه الطريقة لا تنطبق على تحليل الخلايا العصبية الناضجة (> DIV21). ومع ذلك، في معظم الحالات11،12،21،22، يستخدم فحص تشكيل presynapse الخلايا العصبية الأصغر سنا التي يتم التزراع حتى DIV14. وثمة قيد آخر هو أن المحاور بدون أجسام الخلايا لا يمكن أن تبقى على قيد الحياة أكثر من 4 ح. قمنا بتحليل تراكم 5 بروتينات متشابكة في presynapses حتى الآن، وتراكم جميع البروتينات التي فحصناها وصلت إلى هضبة تقريبا في غضون 4 ح (ملاحظة غير منشورة). ويعتبر أن البروتينات متشابك تتراكم بما فيه الكفاية في 4 ح لتحليل حيث يتم اشتقاق البروتينات متشابك من (جسم الخلية أو محور عصبي).
مزيج من ثقافة الكرة العصبية مع LRRTM2-الخرز هو بسيط نسبيا ومرنة لتكييف العديد من المنصات التجريبية. لقد قمنا بالفعل بتطبيق هذه الطريقة لقياس النشاط presynaptic باستخدام صبغ AM1-43 (ملاحظة غير منشورة). وتعتبر هذه الطريقة قابلة للتطبيق على فحص الإنتاجية العالية. اختبار تشكيل Presynapse من الممكن تطبيق فحص المحتوى العالي عن طريق تلطيخ البروتينات متشابك في presynapses شكلت تحت الخرز LRRTM2. ومن شأن هذه الطريقة أن تسهم في العثور على مركبات جديدة لعلاج الأمراض العصبية.
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
ويدعم هذا العمل جزئيا ً منحة المساعدة المقدمة للبحوث العلمية (KaKENHI) (C) (رقم 22500336، 25430068، 16K07061) (Y. Sasaki). نشكر الدكتور تيروكوزو نوجي والسيدة ماكيكو نيازاكي (جامعة مدينة يوكوهاما) على تقديم بروتين LRRTM2 البيوتيني. ونشكر أيضا هونامي أوتشي وري إيشي على المساعدة التقنية.
Materials
| Name | Company | Catalog Number | Comments |
| Antibody diluent | DAKO | S2022 | |
| Alexa Fluor 594 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-585-151 | |
| Alexa Fluor 488 AffiniPure Donkey Anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-545-152 | |
| mouse anti-Munc18-1 | BD Biosciences | 610336 | |
| B-27 Supplement (50X), serum free | Thermo Fisher Scientific | 17504044 | |
| Bovine Serum Alubumin (BSA) | Nacalai Tesque | 01863-48 | |
| Cell-Culture Treated Multidishes (4 well dish) | Nunc | 176740 | |
| Complete EDTA-free | Roche | 11873580001 | |
| cooled CCD camera | Andor Technology | iXON3 | |
| Coverslip | Matsunami | C015001 | Size: 15 mm, Thickness: 0.13-0.17 mm |
| Cytosine β-D-arabinofuranoside (AraC) | Sigma-Aldrich | C1768 | |
| 4',6-Diamidino-2-phenylindole Dihydrochloride (DAPI) | Nacalai Tesque | 11034-56 | |
| Deoxyribonuclease 1 (DNase I) | Wako pure chemicals | 047-26771 | |
| Expi293 Expression System | Thermo Fisher Scientific | A14635 | |
| Horse serum | Sigma-Aldrich | H1270 | |
| image acquisition software | Nikon | NIS-element AR | |
| Image analysis software | NIH | Image J | https://imagej.nih.gov/ij/ |
| Inverted fluorecent microscope | Nikon | Eclipse Ti-E | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | |
| Neurobasal media | Thermo Fisher Scientific | #21103-049 | |
| Normal Goat Serum (NGS) | Thermo Fisher Scientific | #143-06561 | |
| N-propyl gallate | Nacalai Tesque | 29303-92 | |
| Paraformaldehyde (PFA) | Nacalai Tesque | 26126-25 | |
Paraplast Plus | Sigma-Aldrich | P3558 | |
| Poly-L-lysine Hydrobromide (MW > 300,000) | Nacalai Tesque | 28359-54 | |
| poly (vinyl alcohol) | Sigma | P8136 | |
| Prepacked Disposable PD-10 Columns | GE healthcare | 17085101 | |
| rabbit anti-vesicular glutamate transporter 1 | Synaptic Systems | 135-302 | |
| SCAT 20X-N (neutral non-phosphorous detergent) | Nacalai Tesque | 41506-04 | |
| Streptavidin-coated magnetic particles | Spherotech Inc | SVM-40-10 | diameter: 4-5 µm |
| TritonX-100 | Nacalai Tesque | 35501-15 | |
| Trypsin | Nacalai Tesque | 18172-94 |
References
- Waites, C. L., Craig, A. M., Garner, C. C. Mechanisms of Vertebrate Synaptogenesis. Annual Review of Neuroscience. 28 (1), 251-274 (2005).
- Ziv, N. E., Garner, C. C. Cellular and molecular mechanisms of presynaptic assembly. Nature Reviews Neuroscience. 5 (5), 385-399 (2004).
- Chia, P. H., Li, P., Shen, K. Cellular and molecular mechanisms underlying presynapse formation. Journal of Cell Biology. 203 (1), 11-22 (2013).
- Südhof, T. C. Neuroligins and neurexins link synaptic function to cognitive disease. Nature. 455 (7215), 903-911 (2008).
- Saitsu, H., et al. CASK aberrations in male patients with Ohtahara syndrome and cerebellar hypoplasia. Epilepsia. 53 (8), 1441-1449 (2012).
- Friedman, H. V., Bresler, T., Garner, C. C., Ziv, N. E. Assembly of New Individual Excitatory Synapses. Neuron. 27 (1), 57-69 (2000).
- Bresler, T., et al. Postsynaptic density assembly is fundamentally different from presynaptic active zone assembly. The Journal of neuroscience the official journal of the Society for Neuroscience. 24 (6), 1507-1520 (2004).
- Parvin, S., Takeda, R., Sugiura, Y., Neyazaki, M., Nogi, T., Sasaki, Y. Fragile X mental retardation protein regulates accumulation of the active zone protein Munc18-1 in presynapses via local translation in axons during synaptogenesis. Neuroscience Research. , (2018).
- Sasaki, Y., et al. Phosphorylation of Zipcode Binding Protein 1 Is Required for Brain-Derived Neurotrophic Factor Signaling of Local β-Actin Synthesis and Growth Cone Turning. Journal of Neuroscience. 30 (28), 9349-9358 (2010).
- Sasaki, Y., Gross, C., Xing, L., Goshima, Y., Bassell, G. J. Identification of axon-enriched microRNAs localized to growth cones of cortical neurons. Developmental neurobiology. 74 (3), 397-406 (2014).
- Linhoff, M. W., et al. An Unbiased Expression Screen for Synaptogenic Proteins Identifies the LRRTM Protein Family as Synaptic Organizers. Neuron. 61 (5), 734-749 (2009).
- de Wit, J., et al. LRRTM2 Interacts with Neurexin1 and Regulates Excitatory Synapse Formation. Neuron. 64 (6), 799-806 (2009).
- Ko, J., Fuccillo, M. V., Malenka, R. C., Südhof, T. C. LRRTM2 Functions as a Neurexin Ligand in Promoting Excitatory Synapse Formation. Neuron. 64 (6), 791-798 (2009).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature protocols. 1 (5), 2406-2415 (2006).
- Hirai, H., et al. Structural basis for ligand capture and release by the endocytic receptor ApoER2. EMBO reports. , (2017).
- Yasui, N., et al. Functional Importance of Covalent Homodimer of Reelin Protein Linked via Its Central Region. Journal of Biological Chemistry. 286 (40), 35247-35256 (2011).
- Bassell, G. J., Warren, S. T. Fragile X Syndrome: Loss of Local mRNA Regulation Alters Synaptic Development and Function. Neuron. 60 (2), 201-214 (2008).
- Darnell, J. C., Klann, E. The translation of translational control by FMRP: therapeutic targets for FXS. Nat Neurosci. 16 (11), 1530-1536 (2013).
- Richter, J. D., Bassell, G. J., Klann, E. Dysregulation and restoration of translational homeostasis in fragile X syndrome. Nature Reviews Neuroscience. 16 (10), 595-605 (2015).
- Lucido, A. L., et al. Rapid Assembly of Functional Presynaptic Boutons Triggered by Adhesive Contacts. Journal of Neuroscience. 29 (40), 12449-12466 (2009).
- Taylor, A. M., Wu, J., Tai, H. C., Schuman, E. M. Axonal Translation of β-Catenin Regulates Synaptic Vesicle Dynamics. Journal of Neuroscience. 33 (13), 5584-5589 (2013).
- Batista, A. F. R., Martínez, J. C., Hengst, U. Intra-axonal Synthesis of SNAP25 Is Required for the Formation of Presynaptic Terminals. Cell reports. 20 (13), 3085-3098 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved