Method Article
Протеомного анализа человека макрофагов поляризации в среде с низким содержанием кислорода
В этой статье
Резюме
Мы представляем протокол для получения подписи proteomic человека макрофагов и применить это к определению влияния среды низким содержанием кислорода на макрофагов поляризации.
Аннотация
Макрофаги являются врожденные иммунные клетки, участвует в ряде физиологических функций, начиная от ответов на инфекционных возбудителей ткани гомеостаза. Различные функции этих клеток связаны с их активации государств, которая также называется поляризации. Молекулярные точное описание этих различных поляризациях является одной из приоритетных задач в области биологии макрофагов. В настоящее время признается, что многоаспектный подход необходимо описать как поляризации контролируется экологические сигналы. В настоящем докладе мы описываем протокол, разработанный для получения proteomic подписания различных поляризациях в человека макрофагов. Этот протокол основан на лейбл свободный количественной оценки экспрессии белков макрофагов, полученные из геля фракционированный и Lys C/трипсина переваривается лизис клеточных содержание. Мы также предоставляем протокол, основанный на пищеварение-решение и изоэлектрического, сосредоточив внимание фракционирование для использования в качестве альтернативы. Поскольку концентрация кислорода соответствующих экологических параметров в тканях, мы используем этот протокол для изучения состава как атмосферы или среде с низким содержанием кислорода влияет на классификации макрофагов поляризации.
Введение
Макрофаги являются врожденные иммунные клетки участвуют в осуществлении ряда физиологических функций, начиная от ответов на инфекционных возбудителей ткани гомеостаза, включая вывоз apoptotic клеток и реорганизацию внеклеточная матрица1. Эти клетки характеризуются сильной фенотипические пластичности2 , который переводит на многие государства возможности активации, которые также называются поляризаций. Молекулярные точное описание этих различных поляризациях является одной из приоритетных задач в области биологии макрофагов3. Было предложено классифицировать эти поляризаций, используя так называемые дихотомия М1/м2, в котором M1 представляет провоспалительных и м2 представляет противовоспалительное макрофагов. Эта модель хорошо вписывается в различных патологических ситуациях как острые инфекции, аллергии и ожирение4. Однако в хронически воспаленных тканей и рака, было продемонстрировано, что эта классификация не в состоянии понять широкий репертуар фенотипические, что макрофаги в некоторых сотовых средах5,6, 7. Нынешний консенсус является что макрофагов поляризации лучше описывается использование многомерной модели для интеграции конкретных сигналов microenvironmental8. Этот вывод был подтвержден путем анализа транскриптомики человека макрофагов, показывая, что модель М1/м2 является неэффективным в описании полученные поляризаций9.
Это исследование представлено призвана обеспечить протокол для получения proteomic подписи различных поляризациях в человека макрофагов. Мы опишем, как отличить человека макрофагов в средах различных уровней кислорода и получать пептиды от всей макрофагов протеома выполнить количественную оценку лейбл бесплатно. Эта количественная оценка позволяет сравнивать уровни выражения различных белков. Как исследование стволовых клеток показал важность кислорода в качестве экологического параметра key10, мы стремимся понять, как этот параметр ткани может повлиять макрофагов поляризации в организме человека. Парциальное давление кислорода было установлено в диапазоне от 3 до 20% (общее атмосферное давление) в человеческом теле, где 20% примерно соответствует то, что обычно используется в инкубатор культуры клеток (точное значение составляет 18,6% принимая присутствие воды во внимание).
Предыдущие работы показал, что альвеолярные отличаются от интерстициальных макрофаги от функциональных и морфологической точки просмотров11 и что эти различия, вероятно, частично из-за различных кислорода, которым они подвергаются12. Кроме того костного мозга, полученных макрофаги показывают увеличение способность фагоцитируют бактерий при контакте с низким содержанием кислорода среды12. Противоположный эффект было найдено для THP1-продифференцировано человека макрофаги13, но эти результаты поддерживают идею, что кислород является регулятор макрофагов биологии и что это необходимо уточнить эту роль на молекулярном уровне в человека макрофагов. В предыдущем исследовании мы применили протеомики подход к решению этих вопросов. Путем измерения уровня выражения для тысяч белков одновременно, мы подчеркнул влияние кислорода на поляризации и представила список новых молекулярных маркеров. Мы также смогли увязать эти результаты некоторых функций макрофагов. В частности мы обнаружили, что уровень фагоцитоз apoptotic клеток был увеличен в IL4/IL13-поляризованных макрофагов, который был связан с upregulation ALOX15, как свидетельствуют протеомного анализа14. В настоящем исследовании мы опишем, как для выполнения такого анализа.
протокол
Образцы крови человека (LRSC) от здоровых, обезличенных доноров были получены из EFS (Французская Национальная служба крови) как часть протокола уполномоченным (CODECOH DC-2018 – 3114). Доноры дали подписанного согласия для использования крови.
1. средства массовой информации и подготовка буфера
- Подготовка среднего макрофагов [RPMI glutamax + 10 мм HEPES + 1 x несущественные аминокислот (NEAA)] и нагреть его до 37 ° C.
- Подготовить макрофагов средний + 10% человеческой сыворотки от AB плазмы (НКС), фильтр (0.22 мкм фильтром), затем нагреть его до 37 ° C (именуемые макрофагов средний + 10% SAB далее).
- Подготовить буфере сортировки [1 x-фосфатный буфер (PBS) + 0,5%, бычьим сывороточным альбумином (БСА) + 2 мм Этилендиаминтетрауксусная кислота (ЭДТА)], фильтр (0.22 мкм фильтром) и поддерживать его на 4 ° C.
2. изоляция мононуклеаров периферической крови (получения) от Leukoreduction системы камеры (LRSC)
- 15 мл плотности градиента клетки разделения раствора (см. Таблицу материалы) в 50 мл центрифугирования пробки, так что он может нагреться до комнатной температуры (RT) до получения LRSC.
Примечание: Плотность зависит от температуры. Как этот продукт хранится при температуре 4 ° C, этот шаг должно быть сделано заранее, так что он может сбалансировать для RT. - Пустой LRSC в 50 мл трубки центрифугирования, добавить 50 мл ПБС и перемешать. Очень медленно добавьте 25 мл смеси подготовлен на шаге 2.2 поверх 15 мл градиентного раствора плотностью разогревается во время шага 2.1.
Примечание: Будьте осторожны, чтобы не смешивать фаз во время этого шага. Крови должны быть добавлены на плотность градиента решение без каких-либо нарушений этого этапа. - Центрифуга для обеих трубок центрифугирования для 25 мин на 700 x g без перерывов.
Примечание: В конце плотность градиентного центрифугирования, являются слои от дна к верхней части: гранулоцитов формирование гранул, плотность градиента решение фазы, слой репликацию, и плазмы и эритроцитов. - Пипетки проходят через этап плазмы без аспирационных его и собирать КСДОР слой в новой центрифугирования Тюбик 50 мл. Добавьте до 50 мл 1 x PBS для получения как стиральная шаг и центрифуги для 10 мин на 300 x g.
- Аспирационная супернатант и Ресуспензируйте гранулы в 40 мл среды макрофагов.
3. магнитные маркировки и изоляции CD14+ клеток (моноциты)
- Граф репликацию в камере Malassez. Вывести количество получения необходимых для проведения эксперимента (обычно 100-300 x 106 клеток), поместите их в трубку центрифугирования и центрифуги для 10 мин на 300 x g.
- Аспирационная супернатант и Ресуспензируйте гранулы в 80 мкл буфере сортировки, подготовленные во время шага 1.3 за 107 получения. добавить 20 мкл CD14 микрошарики на 107 получения. микс Ну и Инкубируйте 15 мин при температуре 4 ° C под постоянным агитации.
- Добавьте 1 mL сортировки буфера за 107 получения как стиральная шаг и центрифуги для 10 мин на 300 x g. аспирационная супернатант и Ресуспензируйте гранулы в 500 мкл сортировки буфера за 108 репликацию.
- Место в магнитном поле разделителя столбца. Подготовьте столбце промыв его с 3 мл сортировки буфера.
- Примените суспензию клеток на столбец. Столбце зависит количество клеток быть изолированы (здесь, используются столбцы LS для получения до 109 ). Собирайте потока через содержащих немеченого клетки.
Примечание: Начиная с этого шага, все трубы (положительные и отрицательные параметры) хранятся позднее проверки различных этапов проточной цитометрии. - Промойте колонку с 3 x 3 мл сортировки буфера. Соберите немеченого клетки, проходя через же трубку от шага 3.12. Выполните Стиральная путем добавления сортировки буфера, будьте осторожны, чтобы не высушить ваши колонки. Место сбора трубку в столбце и удалить его из сепаратора.
- Пипетка 5 мл сортировки буфера в столбце. Немедленно промойте магнитно помечены клетки, твердо толкает поршень в столбце. Для повышения чистоты CD14+ клетки, eluted фракция обогащается на второй столбец.
- Повторите шаги с 3,4 до 3,7 с новым столбцом.
4. обшивка моноциты
- Граф моноцитов в камере Malassez. Проверить чистоту CD14+ клеток путем проточной цитометрии. Вывести количество моноцитов, необходимого для выполнения эксперимента и поместите их в трубу центрифугирования.
- Центрифуга для 10 мин на 300 x g. аспирата супернатант и Ресуспензируйте Моноцит Пелле в среде макрофагов. Пластина клетки и пусть они поселиться за 50 мин до 1 ч. аспирационная среднего и заменить его с макрофагов средний + 10% SAB + 25 нг/мл макрофагальный колонии стимулирующий фактор (M-CSF) чтобы побудить дифференциации.
5. поляризация макрофагов в день 6
- Аспирационная среды. Замените его макрофагов средний + 10% САБ с различных раздражителей. Например добавьте 10 нг/мл интерферона гамма (INFγ) + 1 нг/мл липополисахарида (LPS) для получения M1 поляризации, или 20 нг/мл интерлейкинов 4 (IL4) + 20 нг/мл интерлейкинов 13 (IL13) для поляризации м2.
Примечание: Стимуляция может производиться между 24 и 48 часов прежде чем другие тесты. - Урожай клеток с использованием отсоединение решения или скребок ячейки.
6. клеточной культуры в условиях низкой кислорода
- Начиная с шага 4, поддерживать моноцитов и затем макрофагов в контролируемой кислородом среде для выполнения анализа гипоксические состояния. Использование гипоксии рабочей станции для поддержания клеток под парциального давления кислорода желаемого во время эксперимента.
Примечание: При работе под давлением низким содержанием кислорода, важно подготовить все средства массовой информации и стиральная буферов под станцией и ждать достаточно, чтобы получить правильный парциальное давление в жидкости. Например 10 мл PBS в 60 мм Петри блюдо требует примерно за 2 ч до 25 мм рт.ст на O2 парциальное давление, начиная от атмосферного давления (как мы измеряли его с помощью волоконно оптических кислородный датчик). Во многих гипоксических станции или инкубаторы давление кислорода устанавливается в процентах от атмосферного давления. Если необходимы точные измерения, то лучше использовать станцию, разрешающие непосредственно установить давление кислорода в мм рт.ст..
7. lysis и в гель пищеварения (протокол 1)
Примечание: В этом и следующих разделах описаны два протоколы, используемые для получения пептидов и выполнять анализ LC-MS/MS. Протокол 1 описывает лизис клетки и в гель фракционирования и пищеварение, а протокол 2 лизис клеток в решение, следуют в решение пищеварение и фракционирования, используя метод изоэлектрической фокусировки.
- Выполните лизис клеток в буфер Лэмли [234 мм трис-HCL (рН 6,8), 7,5% SDS, 37% глицерина, 33,3% (v/v) β-меркаптоэтанол, бромфеноловый синий 0,2% w/v]. Загрузите белка эквивалент 300 000 клеток для каждого образца, на 4-12% бис трис акриламида гели.
- Контролировать время электрофорезного миграции разрешить каждый образец протеина разделить на 6 гель полос, как проявляется в рисунке 3.
- Исправить гель с раствором крепления (30% этанола + 7,5% уксусной кислоты для 20 мин), а затем добавьте окрашивание раствора (R-250 Кумасси синий для 45 мин). Destaining решение (30% этанола + 7,5% уксусной, пока не появятся полосы) добавить до иссечения белка полосы с чистой скальпель.
- Кости каждый обрезанию группы до введения в 500 мкл трубы. Чистую стеклянную поверхность является оправданным во избежание загрязнения с кератины (5% раствор SDS в деионизированной воде может использоваться для очистки поверхностей).
- Вымойте ломтики гель 3 раза в 200 мкл бикарбонат аммония 25 мм для 20 минут при 37 ° C, следуют один мыть в бикарбонат аммония 25 мм и ацетонитриле (50% v/v). Обезвоживает гель куски с 200 мкл Ацетонитрил 100% за 10 мин.
- Инкубировать каждый кусок гель с 10 мм DTT (Дитиотреитол) в бикарбонат аммония 25 мм для 45 мин на 56 ° C (200 мкл), следуют 55 мм iodoacetamide в бикарбонат аммония 25 мм (200 мкл) 35 мин в темноте на RT.
- Чтобы остановить алкилирования, инкубировать каждый кусок гель с 200 мкл 10 мм DTT в бикарбонат аммония 25 мм для 10 мин на RT. мыть гель куски в 200 мкл бикарбонат аммония 25 мм, а затем обезвоживает с 200 мкл Ацетонитрил 100% за 10 мин.
- Переваривать белки на ночь при 37 ° C с трипсина/Lys-C смеси согласно инструкциям производителя.
- Распакуйте полученный пептиды из кусочков гель, добавляя 50 мкл Ацетонитрил 50% за 15 мин, затем 50 мкл 5% муравьиной кислоты 15 мин и наконец, 50 мкл Ацетонитрил 100% за 15 мин бассейн и высушите каждую долю в трубки низкого поглощения ограничить адсорбции пептидов и Образец потери. Хранение образцов-80 ° C до дальнейшего анализа.
8. белка добычу и пищеварение-решение (протокол 2)
- Лизис клеток (2 x 106 клеток) выполните с 150 мкл следующих литического буфера:
- Мочевина 7 М, 2 М тиомочевины, 40 мм трис и 4% ПАРНЕЙ, дополняют ингибиторы протеазы (полный мини, ЭДТА бесплатно ингибитор протеазы коктейль).
- Решения для 30 мин на RT с греющую гомогенизировать. Центрифуга в 13800 x g 20 мин RT и держать супернатант.
- Удаление загрязнений с 2D комплект очистки:
- Комплект содержит осадителя раствора, Сопредседатель осадителя раствора, буфер мыть и мыть присадок.
- Добавить 300 мкл осадителя раствора и хорошо перемешать. Инкубируйте на льду для 15 минут добавить 300 мкл Сопредседатель осадителя раствора. Центрифуга трубы (по крайней мере) на 12000 g x 5 мин. Малый Пелле должен быть виден. Быстро перейти к следующему шагу, чтобы избежать ресуспендирования или дисперсии гранул. Удалите супернатант не нарушая гранулы.
- Центрифуга трубки снова с-шпингалет и гранулы наружу довести любые оставшиеся жидкости в нижней части трубки. Краткий импульс является достаточным. Там должно быть без видимых жидкого оставшихся в трубы.
- Не нарушая гранулы, 40 мкл Сопредседатель осадителя раствора. Пусть трубе сидеть на льду на 5 мин центрифуги для 5 минут, затем снимите и выбросьте мыть. 25 мкл деионизированной воды. Вихревой каждой трубки для 5-10 s. Гранулы должны разогнать но не растворяются в воде.
- Добавьте 1 мл буфера мытья (предварительно охлажденным для по крайней мере 1 час при температуре-20 ° C) и 5 мкл мыть добавки. Вихрь, до тех пор, пока гранулы полностью рассеяны. Инкубировать трубы при-20 ° C для по крайней мере 30 минут Vortex для 20-30 s каждые 10 мин
Примечание: Трубы может храниться при температуре-20 ° C до 1 недели с минимальным белка деградации или модификации. - Центрифуга трубы (по крайней мере) на 12000 g × 5 мин тщательно удалить и удалить супернатант. Должны быть видны белые гранулы. Разрешить Пелле в airdry не более 5 минут (при слишком сухой, это будет трудно Ресуспензируйте гранулы).
- Ресуспензируйте Пелле белка в 300 мкл бикарбонат аммония карбамид и 0,1 М 8 М. Вихревой сильно за 1 мин определяют концентрацию протеина, с использованием колориметрического анализа.
9. решение пищеварение (протокол 2)
- Уменьшить мосты дисульфида, добавив 5.1 мкл 700 мм DTT водный раствор (конечная концентрация 12,5 мм) на ресуспензированы белки от шаг 8.4 и инкубировать при 37 ° C за 30 минут с греющую. Алкилата остатков цистеина, добавив 20.3 мкл 700 мм iodoacetamide водный раствор (конечная концентрация 40 мм) и инкубации при 25° C на 30 мин в темноте с греющую.
- 990 мкл бикарбонат аммония 0,1 М, к образцу. Добавьте соответствующий объем смеси трипсина/Lys-C (фермента: субстрат соотношение 1: 100 w/w). Инкубируйте при 37° C ночь с греющую.
10. Очистка картриджа (протокол 2)
- Влажные картридж объёмом 1 колонка-(1 мл) метанола. Очистить картридж с 1 колонка объем (1 мл) воды 80% Ацетонитрил/ВЭЖХ класс и отбросить потока через. Сбалансировать патрон с 4 колонки тома (4 мл) воды муравьиной кислоты/ВЭЖХ класса 0,1% и отбросить потока через.
- Подкислять образцы с 90 мкл 10% муравьиной кислоты или воды рН 2-3 (проверить рН с pH индикатор). Загрузить образцы Окислованная и собирать потока через. Перезагрузите потока через (содержащая пептиды не сохранен). Вымойте патрон с 6 столбцов тома (6 мл) воды муравьиной кислоты/ВЭЖХ класса 0,1%.
- Элюировать пептиды из картриджа с 1 колонка томов (1 мл) воды Ацетонитрил/ВЭЖХ класса 0,1% муравьиной acid/50%. Переезд в пробки microcentrifuge 1,5 мл. Концентрат образца с помощью вакуумного концентратор (150 x g, вакуумные на 160 мбар).
11. фракционирование изоэлектрической сосредоточив (протокол 2)
Примечание: Пептиды разделены согласно их изоэлектрической точки с помощью фракционатор-гель на 13 см газа, охватывающих диапазон рН от 3 до 10. Мы использовали следующий протокол, предоставленных поставщиком (ниже кратко):
- Подготовить следующие решения: решение (600 мкл раствора глицерина, 60 мкл буфера OFFGEL, 4.34 мл ультрачистая вода) и решение B (1,776 мл раствора A) и 444 мкл ультрачистая вода.
- Соберите полоски IPG, фоторамки и электродов согласно инструкциям производителя.
- Ресуспензируйте образца с 1.8 мл раствора б. добавить 40 мкл раствора B в каждой скважине. Загрузите 150 мкл пример в каждой скважине.
- Выберите метод по умолчанию для пептиды: OG12PE00 (OFFGEL метод по умолчанию для пептидов для использования с низким Res 3100 OFFGEL комплект, рН 3-10, 12-ну кадров. Подождите, пока этот метод был завершено (~ 20 h). Сбор фракций в должным образом помечены трубы.
12. Очистка Гарвардского аппарат столбца обратного C18 пост МЭФ (протокол 2)
- Постепенно добавить несколько мкл в то время 1% TFA в деионизированной воде для каждой фракции для подкислять образца. Проверка с помощью РН бумаги, что pH около 3 или ниже.
- Подготовить следующие решения: решение 1 (5 мл ацетонитриле, 10 мкл рабочего раствора муравьиной кислоты, 4.99 мл ультрачистая вода) и решение 2 (0,5 мл ацетонитриле, 10 мкл муравьиной кислоты, 9.49 мл ультрачистая вода).
- Предварительно Намочите столбце спин с 150 мкл раствора 1. Центрифуги для 90 s на 750 x g и отмены потока через. Промойте колонку спин с 150 мкл раствора 2. Центрифуги для 90 s на 750 x g и отмены потока через.
- Пройти часть через колонку. Центрифуги для 90 s на 750 x g и отмены потока через. Промойте 150 мкл раствора 2. Центрифуги для 90 s на 750 x g и отмены потока через.
- Элюировать дроби с 50 мкл раствора 1. Центрифуги для 90 s в 750 x g. повторять эти шаги еще раз.
- Химчистка фракция с помощью вакуумного концентратор (150 x g, вакуумные 160 мбар) и хранить при температуре-80 ° C
13. анализ протеомических данных и биоинформатики18
- Анализировать данные, полученные от nano-LC-MS/MS массовые спектрометре с использованием программного обеспечения количественной оценки таких MaxQuant (версия 1.5.2.8) и Андромеда поисковой системы.
- Установите частоту ложных обнаружения (ФДР) 1% белков и пептидов и минимальная длина 7 аминокислот. Установить фермента специфику как C-терминал для Arg и Lys. Позвольте 2 пропущенных разобщенность пролина облигаций. Выберите carbamidomethylation цистеина как фиксированной модификации и N-терминальный белка ацетилирования и метионин окисления изменения переменной.
- Дальнейшего анализа данных статистического анализа программного обеспечения. Провести анализ функциональной обогащения с помощью программного обеспечения FunRich (www.funrich.org/). Выполните анализ обогащения онтология гена, с помощью Дэвид программного обеспечения (https://david.ncifcrf.gov/).
Результаты
Начиная от мононуклеарных клеток периферической крови (получения) получено дифференциального центрифугирования, Протокол допускает получение населением CD14+ моноциты с начисленных чистоты более чем 98% проточной цитометрии (рис. 1). Вторично эти моноциты дифференцируются к различных поляризациях (рис. 2). Когда выбирается фракционированием на геле, миграция на гелях SDS-page приспособлен для получения количество желаемых полос и обрезанию полосы (рис. 3). Пищеварение вторично выполняется в подакцизным полос гель, а затем извлекаются пептидов. Пептиды, анализируются с помощью нано LC (жидкостная хроматография)-MS/MS Масса спектрометра. МС/МС спектры дать личность различных белков согласно аннотации спектров для известных пептидов (рис. 4A). Количественная оценка обилие белок затем вычисляется в связи с количеством выявленных пептидов из белка, с использованием опубликованных программного обеспечения и баз данных15,16. Этот протокол с пищеварением-гель дает примерно 4000 определенных белков, и было установлено, что динамический диапазон покрытия 5 логарифмической шкалы единиц (рис. 4В). Анализ дифференциального выражения этих выявленных белков может использоваться для определения кластеризация различных поляризациях условиях различных кислорода.
С помощью этого метода мы также можем признать кластеры белков, которые вверх регулируются при контакте с низким содержанием кислорода концентрации 3% (рис. 5, таблица 1). Для оценки эффективности пищеварения, который не представляется возможным, когда используется протокол в гель, мы предложили метод пищеварение в раствор, который был адаптирован для человека макрофагов (рис. 6A). С помощью этого метода, мы легко можем получить (после переваривания-решение) идентификации 3600 белков без фракционировки, означает, что фракционирование с МЭФ будет разумно увеличить это число (Рисунок 6B).

Рисунок 1: cytometry анализ экспрессии CD14 КСДОР до сортировки (левая панель) и после сортировки (правая панель) потока показаны полученные чистоты после выбора магнитной бусины. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2: фаза контрастность изображения дифференцированной человека макрофагов, показаны неоднородность полученных морфологии для двух разных поляризаций. Линейки шкалы представляет 50 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3: Визуализация Кумасси синий окрашенных гель показаны различные полосы, которые будет вырезана [здесь, 6 полос в макрофагах M(Ø)] для 5 поляризаций макрофагов, подвергаются в среде с низким содержанием кислорода. IC = иммунных комплексов, DXM = дексаметазона. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
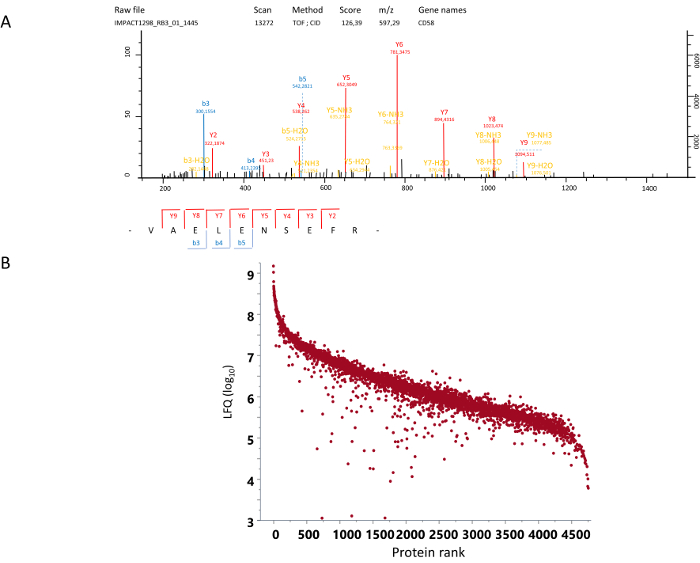
Рисунок 4: МС/МС спектра и квантификация. (A) пример МС/МС спектра. Здесь показан CID (столкновения индуцированной диссоциации) спектр пептида найдено в 597.29 m/z МС спектра с электрическим зарядом + 2. От этого спектра как Val-Ala-Glu-Leu-Glu-Asn-Ser-Glu-Phe-Arg от белка CD58 был определен соответствующей последовательности. (B) Очередность Этикетки бесплатно количественной оценки для каждого из определенных белков (журнала10 LFQ). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
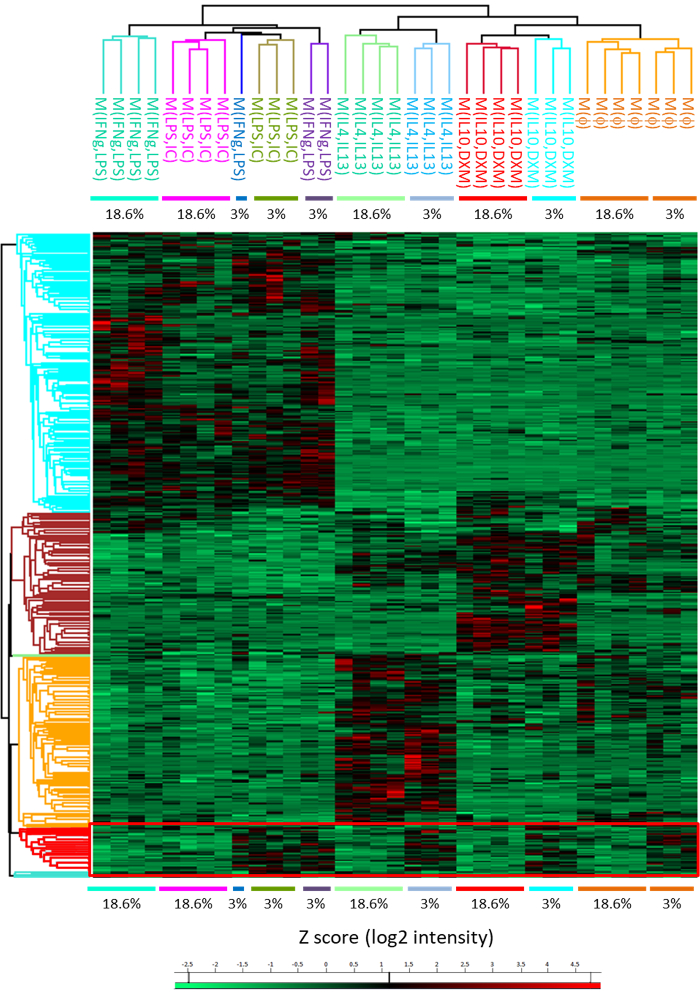
Рисунок 5: тепловой карты, представляющие иерархические объединения всех поляризации государств с использованием дифференциально выразил белки. Анализ показывает кластер белков, оверэкспрессировали в всех поляризаций в 3% O2 состояния (красный прямоугольник). Цветовая шкала представляет z результаты (log2 интенсивности). Каждая строка является белок, и каждый столбец представлен образец. Эта цифра возникла из предыдущей публикации14. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 6: SDS-PAGE и хроматограммы. (A) серебро витражные Гели SDS-PAGE с белком лизис клеток и после-решение пищеварение, отсутствие деградации во время лизис и эффективность переваривания. (B) Хроматограмма, полученные после переваривания-решение без фракционировки. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Кластер | proteinID | Имена белка | Джин имена | Пептиды | Бритва + уникальный пептиды | Уникальный пептиды | Белка идентификаторы | ||
| Красный | P0DMV9 | Тепловой шок 70 кДа белками 1B | HSPA1A | 40 | 37 | 4 | P0DMV9; P0DMV8; A8K5I0; Q59EJ3; B4DNT8; B4DWK5; B4DFN9; B4DI39; B4E1S9; B4DVU9; V9GZ37; B3KTT5; B4DNX1; B4E1T6; B4DNV4; Q9UQC1 | ||
| Красный | P54709 | Натрия/калия транспортировки АТФазы Субблок бета-3 | ATP1B3 | 8 | 8 | 8 | P54709; D3DNF9; C9JXZ1; C9JA36; H7C547; F8WBY4; Q58I18 | ||
| Красный | O00462 | Бета mannosidase | MANBA | 14 | 13 | 13 | O00462; A7LFP5; A8K6D3; E9PFW2; B4DT18; Q59EG5 | ||
| Красный | Q8NAS7 | НАДН дегидрогеназа [убихинон] железо сера белки 7, митохондриальных | NDUFS7 | 4 | 4 | 4 | Q8NAS7; Q6ZQU6; F5H5N1; B7Z1U1; A8K0V6; Q7LD69; F5GXJ1; O75251; B7Z4P1; Q9H3K5; A0A087WXF6; A0A087WTI3; Q6ZS38 | ||
| Красный | Q8WWQ0 | PH-взаимодействия протеина | PHIP | 5 | 5 | 4 | Q8WWQ0; Q9NWP3 | ||
| Красный | E5RHK8 | Динамин-3 | DNM3 | 11 | 2 | 2 | E5RHK8; Q9UQ16; B3KPF2; E5RIK2 | ||
| Красный | A0A024QZ64 | Фруктоза Бисфосфат aldolase C | АЛДОК | 18 | 14 | 7 | A0A024QZ64; P09972; B7Z1Y2; B7Z3K9; B7Z1N6; B7Z3K7; A8MVZ9; J3KSV6; J3QKP5; B7Z1L5; C9J8F3; K7EKH5; J3QKK1; B7Z1H6 | ||
| Красный | O75489 | НАДН дегидрогеназа [убихинон] железо сера протеин 3, митохондриальных | NDUFS3 | 12 | 12 | 12 | O75489; Q9UF24; Q53FM7; E9PS48; E9PKL8; G3V194 | ||
| Красный | P21912 | Сукцинат дегидрогеназа [убихинон] железо сера Субблок, митохондриальных | SDHB | 11 | 11 | 11 | P21912; A0A087WXX8; A0A087WWT1 | ||
| Красный | A0A024R1Y7 | GH3 домена содержащих белков | LGP1; GHDC | 7 | 7 | 7 | A0A024R1Y7; Q8N2G8; B3KVB0; K7ESN3; K7EJT7; K7EQ41; K7EL54 | ||
| Красный | E5KRK5 | НАДН убихинон Оксидоредуктазы 75 кДа Субблок, митохондриальных | NDUFS1 | 29 | 29 | 29 | E5KRK5; P28331; B4DJ81; Q9P1A0; C9JPQ5; F8WDL5 | ||
| Красный | A0A024QZ30 | Сукцинат дегидрогеназа [убихинон] флавопротеинами Субблок, митохондриальных | SDHA | 17 | 17 | 17 | A0A024QZ30; P31040; D6RFM5; B3KT34; A0A087X1I3; Q0QF12; B4DYN5; B3KYA5; B4DNB2; H0Y8X1; B7Z6J5 | ||
| Красный | A0A024R2F9 | Белка трансмембранного 43 | TMEM43 | 16 | 16 | 16 | A0A024R2F9; Q9BTV4; Q8TEP9; V9GY05 | ||
| Красный | A0A024R5K3 | НАДН дегидрогеназа [убихинон] железо сера белка 8, митохондриальных | NDUFS8 | 5 | 5 | 5 | A0A024R5K3; E9PPW7; O00217; E9PN51; F8W9K7; E9PKH6; B4DYI3; Q53G17 | ||
| Красный | O76003 | Glutaredoxin-3 | GLRX3 | 13 | 13 | 13 | O76003 | ||
| Красный | Q1HBJ4 | Митоген активации протеинкиназы; Митоген активированный протеин киназы 1 | MAPK1 | 26 | 26 | 21 | Q1HBJ4; P28482; B4DHN0; Q499G7; K7ELV1; K7EN18; B4E104; P31152; Q16659 | ||
| Красный | Q13151 | Гетерогенные ядерных рибонуклеопротеида A0 | HNRNPA0 | 8 | 8 | 8 | Q13151 | ||
| Красный | V9HWN7 | Фруктоза Бисфосфат aldolase A | ALDOA | 36 | 36 | 14 | V9HWN7; P04075; J3KPS3; H3BQN4; H3BUH7; H3BR04; H3BMQ8; H3BU78; H3BR68; A4UCS9; A4UCT0 | ||
| Красный | B4DVJ0 | Глюкозо-6-фосфат глюкозоизомеразная | GPI | 32 | 32 | 23 | B4DVJ0; P06744; B4DE36; A0A0A0MTS2; K7EQ48; K7EP41; K7EPY4; K7ELR7; K7ERC6; K7ENA0; K7ESF4; K7EIL4; K7ERK8; Q59F85 | ||
| Красный | V9HWB9 | L-лактатдегидрогеназа; L-лактатдегидрогеназа цепь | LDHA | 36 | 36 | 34 | V9HWB9; P00338; B4DJI1; F5GXY2; F5GYU2; F5GXH2; F5H5J4; F5H6W8; F5GZQ4; F5H8H6; F5GXC7; F5GWW2; F5GXU1; A0A087WUM2; Q96L19; Q6ZMR3 | ||
| Красный | P13674 | Проли 4-гидроксилазы Субблок альфа-1 | P4HA1 | 26 | 26 | 26 | P13674; Q5VSQ6 | ||
| Красный | Q6FHV6 | Гамма энолаза; Энолаза | ENO2 | 18 | 15 | 14 | Q6FHV6; P09104; A8K3B0; F5H0C8; F5H1C3; U3KQP4; U3KQQ1; Q9NPL4 | ||
| Красный | Q99798 | Aconitate hydratase, митохондриальных | ACO2 | 40 | 40 | 40 | Q99798; B4DZ08; B2RBW5; A2A274; B4DJW1; B4DLY4; Q71UF1; B4DEC3; B4DW08; O75944 | ||
| Красный | P17858 | АТФ зависимые тип 6-фосфорфруктокиназу, печени | PFKL | 32 | 29 | 28 | P17858; Q7L2M7; Q9BSP4; B3KNQ7; B4E108; Q59GI2; F8WEU2; Q7Z3R9; Q6MZK4 | ||
| Красный | A0A024R872 | Нибан как протеин 1 | FAM129B | 32 | 32 | 32 | A0A024R872; Q96TA1; Q9H8K1; Q2YD88; Q9H6L6 | ||
| Красный | A0A024RC61 | Aminopeptidase N | ANPEP | 58 | 58 | 25 | A0A024RC61; P15144; Q59E93; B4DV63; B4DP01; B4DP96; H0YKT6; H0YLZ8; Q71E46; H0YMC1; Q8IVL7 | ||
| Красный | V9HWF4 | Киназы Phosphoglycerate; Phosphoglycerate киназы 1 | PGK1 | 41 | 41 | 35 | V9HWF4; P00558; B4E1H9; B4DHM5; B4DHB3; B4DWQ3; Q16444 | ||
| Красный | Q12882 | Dihydropyrimidine дегидрогеназа [NADP(+)] | DPYD | 44 | 44 | 44 | Q12882; B4DML1 | ||
| Красный | B4DEQ0 | Электрона передачи флавопротеинами убихинон Оксидоредуктазы, митохондриальных | ETFDH | 9 | 9 | 9 | B4DEQ0; Q547S8; A7UNU5; Q16134; D6RAD5 | ||
| Красный | D9UAX9 | Гистосовместимости антигена | HLA-B | 13 | 3 | 2 | D9UAX9 | ||
| Красный | V9HWK1 | Triosephosphate глюкозоизомеразная | TPI1 | 29 | 29 | 17 | V9HWK1; P60174; Q53HE2; B4DUI5; U3KPZ0; U3KQF3; U3KPS5 | ||
| Красный | Q96HE7 | ERO1-как белка альфа | ERO1L | 28 | 28 | 28 | Q96HE7; G3V3E6; G3V5B3; G3V2H0; G3V503; Q5TAE8; B2RD00; Q86YB8 | ||
| Красный | P14868 | Аспартат--tRNA лигаза, цитоплазмы | DARS | 29 | 29 | 2 | P14868; Q53T60; Q53R85; H7BZ35; H7C278 | ||
| Красный | P36871 | Фосфоглюкомутаза-1 | PGM1 | 24 | 24 | 5 | P36871; B4DFP1; Q9H1D2 | ||
Таблица 1: Список чрезмерно выраженная белков для человека макрофагов, общих для каждого поляризации натяжением низким содержанием кислорода.
Обсуждение
Потому что протеомики является мощным инструментом для изучения выражение различных белков от всей ячейки или субцеллюлярные отсеков, Оптимизация протокола лизис клеток и переваривание белков рассматривался ряд исследований. Существует три основных класса методов, которые включают в гель пищеварения (переваривание белков в матрице геля полиакриламида)17, пищеварение в решение18 и фильтра aided образца подготовка19. Сообщается, что этот последний метод, во-первых, как универсальная, обладают низкой воспроизводимостью и возможная потеря белков на фильтр20. В гель пищеварения является трудоемкий метод, который может быть длительным и невыгодной в том, что оценки эффективности пищеварения не легко, если это возможно. Пищеварение в решение предлагает эту возможность, но требует очистки образцов после переваривания и МЭФ. Когда эти два метода сравниваются между того же образца, пищеварение в раствор с МЭФ фракционирование протокол дает большее количество выявленных белков (с же количество фракций), чем гель пищеварения21.
Несмотря на это преимущество это необходимо учитывать возможные белка деградации во время лизис-решение за внутриклеточные протеаз (особенно в миелоидных клеток). Это также важно иметь в виду, что эти методы основаны на переваривание белков и только в состоянии анализировать представляя трипсина сайты конкретных расщепления белков. Это можно использовать нисходящий proteomic подход, который снимает это ограничение пищеварение, но добавляет шаги анализа данных и биоинформатики ressources22. Солюбилизация белков из различных клеточных отсеков также может быть трудно получить, особенно от мембраны плазмы, приводит к неконтролируемым выборки клеточного протеома. Для того чтобы продолжать с нано LC-MS/MS масс-спектрометр анализ образцов, важно получить достаточное количество пептиды, которые могут зависеть от используемых масс-спектрометр (как правило, начиная с общего белка должно быть по крайней мере 1 мкг для состояния, и предполагается увеличить это количество согласно количество дроби, используемые с МЭФ). Это ограничение может быть недостаток если популяции клеток изучается не хватает, что отличает proteomic от геномной методы, в которых возможно усиление сырья.
Даже после семенную работ богаче и коллег23 и24упаковщика и Fuehr недостаточно признается важность кислорода в клеточных культурах. Теперь мы знаем, что культивирование клеток под низким содержанием кислорода концентрация способствует адгезии, срок службы и Отдела. Она признала, что это имеет чрезвычайно важное значение для исследований стволовых клеток25. Главным техническим вопросом для клеточных культур в условиях контролируемой кислорода связано поддержание концентрации желаемого кислорода в течение всего эксперимента. Это требует предварительной инкубации всех средств массовой информации для предотвращения выхода растворенного кислорода и использования гипоксических рабочих станций разрешить манипуляции клеток под низким содержанием кислорода (обработка камеры с перчаточный ящик) и предотвращения временной экспозиции для условий высокого кислорода .
Описывается протокол был использован для получения молекулярных подписей различными поляризациями человеческого моноцитарных макрофагов и изучение воздействия кислорода модуляции на эти подписи. Это исследование дал представление на описание этих поляризациях и показал некоторые функциональные последствия. Например мы обнаружили, что много белков, участвующих в efferocytosis были модулированный в среде с низким содержанием кислорода. Этот proteomic подход, основанный на протоколе описывается, представляет возможность исследовать как экологических параметров изменить функции макрофагов и как эти сигналы могут быть использованы для разработки новых терапевтических подходов14.
Proteomic подход, описанный в этой работе является дополнением к геномной подходы, которые были использованы в последние годы в области исследований человеческого макрофагов поляризации. Протеомика предлагают преимущество белка количественной оценки, которые могут представлять различные выражения чем их соответствующей мРНК за столб-поступательные изменения и привести к открытию нового биомаркерами. Несмотря на это преимущество протеомических данных обычно трудно интерпретировать, отчасти из-за высокой чувствительности масс-спектрометрии, приводит к очень сложным МС спектры и ложных положительных обнаружения пептидов. Недавно программное обеспечение для анализа приобрела эффективности для того, чтобы предотвратить это. Даже если это меняющейся ситуации, Протеомика также сталкивается Нижняя воспроизводимость чем геномики26 и ассоциируется с проверочные шаги, с помощью других методов (проточной цитометрии, immunoblotting) для подтверждения количественных изменений белка уровни выражения.
Раскрытие информации
Авторы заявляют отсутствие конфликта интересов.
Благодарности
AM финансируется по программе лидер группы молодых (ATIP/Avenir Inserm-CNRS), la le Национальная лига против рака и la Fondation дуги pour la recherche sur le рака. Мы благодарим Mariette Матондо от масс-спектрометрии для биологии платформы (UTECHS MSBIO, Институт Пастера, Париж). Мы благодарим Лорен Андерсон за ее чтение рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| Hypoxia Working Station | Oxford Optronix | Hypoxylab | |
| C6 Flow cytometer | BD | Accuri C6 | |
| Urea | Agilent Technologies | 5188-6435 | |
| Formic acid (FA) | ARISTAR | 450122M | |
| R-250 Coomassie blue | Biorad | 1,610,436 | |
| Lipopolysaccharide, E.Coli (LPS) | Calbiochem | 437627 | |
| 2D clean-up kit | GE Healthcare | 80-6484-51 | |
| RPMI 1640 medium, glutamax supplement | Gibco | 61870044 | |
| HEPES 1 M | Gibco | 15630-080 | |
| MEM Non-Essential Amino Acids (NEAA) Solution 100X | Gibco | 11140-035 | |
| Phosphate Buffered Saline (PBS) 1X | Gibco | 14190-094 | |
| Harvard Apparatus column Reverse C18 micro spin column | Harvard Apparatus | 74-4601 | |
| EDTA 0.5 M, pH 8.0 | Invitrogen | AM9260G | |
| NuPAGE Bis-Tris 4-12% | Life Technologies SAS | NP0321 BOX | |
| CD14 Microbeads human | Miltenyi Biotec | 130-050-201 | |
| MACS separation column LS | Miltenyi Biotec | 130-042-401 | |
| Macrophage colony-stimulating factor (M-CSF) | Miltenyi Biotec | 130-096-485 | |
| Interleukin 4 (IL4) | Miltenyi Biotec | 130-093-917 | |
| Interleukin 13 (IL13) | Miltenyi Biotec | 130-112-410 | |
| Interferon gamma (INFγ) | Miltenyi Biotec | 130-096-482 | |
| CD14-FITC (clone TÜK4) | Miltenyi Biotec | 130-080-701 | |
| MACSmix Tube Rotator | Miltenyi Biotec | 130-090-753 | |
| Trifluoroacetic Acid (TFA) | Pierce | 28904 | |
| Trypsin/Lys-C Mix | PROMEGA | V5073 | |
| Complete Mini, EDTA-free Protease Inhibitor cocktail | Roche | 11836170001 | |
| Density Gradient Solution (Histopaque 1077) | Sigma Aldrich | 10771-100ML | |
| Accumax | Sigma Aldrich | A7089-100ML | |
| Human Serum from human male AB plasma (SAB) | Sigma Aldrich | H4522-100ML | |
| Bovine Serum Albumin (BSA) solution 30% | Sigma Aldrich | A9576-50ML | |
| Trisma-base | Sigma Aldrich | T1503 | |
| Glycerol | Sigma Aldrich | 49767 | |
| β-Mercaptoethanol | Sigma Aldrich | M3148 | |
| Bromophenol blue | Sigma Aldrich | 114405 | |
| Sodium Dodecyl Sulfate (SDS) 20% | Sigma Aldrich | 5030 | |
| Ammonium bicarbonate | Sigma Aldrich | 9830 | |
| Acetonitrile | Sigma Aldrich | 34888 | |
| Dithiothreitol | Sigma Aldrich | 43819 | |
| Iodoacetamide | Sigma Aldrich | 57670 | |
| Thiourea | Sigma Aldrich | T8656 | |
| CHAPS | Sigma Aldrich | C9426 | |
| Micro BCA Assay Kit | ThermoFisher | 23235 | |
| 5 mL sterile plastic pipette | VWR | 612-1685 | |
| Thermomixer C Eppendorf | VWR | 460-0223 | |
| Sep-Pak tC18 reverse phase cartridges, 100 mg | Waters | WAT036820 |
Ссылки
- Okabe, Y., Medzhitov, R. Tissue biology perspective on macrophages. Nature Immunology. 17 (1), 9-17 (2016).
- Sica, A., Mantovani, A. Macrophage plasticity and polarization: in vivo veritas. The Journal of Clinical Investigation. 122 (3), 787-795 (2012).
- Murray, P. J. Macrophage Polarization. Annual Review of Physiology. 79, 541-566 (2017).
- Chinetti-Gbaguidi, G., Staels, B. Macrophage polarization in metabolic disorders: functions and regulation. Current Opinion in Lipidology. 22 (5), 365-372 (2011).
- Chow, A., Brown, B. D., Merad, M. Studying the mononuclear phagocyte system in the molecular age. Nature Reviews Immunology. 11 (11), 788-798 (2011).
- Mosser, D. M., Edwards, J. P. Exploring the full spectrum of macrophage activation. Nature Reviews Immunology. 8 (12), 958-969 (2008).
- Murray, P. J., Wynn, T. A. Protective and pathogenic functions of macrophage subsets. Nature Reviews Immunology. 11 (11), 723-737 (2011).
- Ginhoux, F., Schultze, J. L., Murray, P. J., Ochando, J., Biswas, S. K. New insights into the multidimensional concept of macrophage ontogeny, activation and function. Nature Immunology. 17 (1), 34-40 (2016).
- Xue, J., et al. Transcriptome-based network analysis reveals a spectrum model of human macrophage activation. Immunity. 40 (2), 274-288 (2014).
- Csete, M. Oxygen in the cultivation of stem cells. Annals of the New York Academy of Sciences. 1049, 1-8 (2005).
- Johansson, A., et al. Functional, morphological, and phenotypical differences between rat alveolar and interstitial macrophages. American Journal of Respiratory Cell and Molecular Biology. 16 (5), 582-588 (1997).
- Pfau, J. C., Schneider, J. C., Archer, A. J., Sentissi, J., Leyva, F. J., Cramton, J. Environmental oxygen tension affects phenotype in cultured bone marrow-derived macrophages. American Journal of Physiology. Lung Cellular and Molecular Physiology. 286 (2), L354-L362 (2004).
- Grodzki, A. C. G., Giulivi, C., Lein, P. J. Oxygen tension modulates differentiation and primary macrophage functions in the human monocytic THP-1 cell line. PLoS One. 8 (1), e54926(2013).
- Court, M., Petre, G., Atifi, M. E., Millet, A. Proteomic Signature Reveals Modulation of Human Macrophage Polarization and Functions Under Differing Environmental Oxygen Conditions. Molecular & Cellular Proteomics. 16 (12), 2153-2168 (2017).
- Cox, J., et al. Accurate proteome-wide label-free quantification by delayed normalization and maximal peptide ratio extraction, termed MaxLFQ. Molecular & Cellular Proteomics. 13 (9), 2513-2526 (2014).
- Cox, J., Neuhauser, N., Michalski, A., Scheltema, R. A., Olsen, J. V., Mann, M. Andromeda: a peptide search engine integrated into the MaxQuant environment. Journal of Proteome Research. 10 (4), 1794-1805 (2011).
- Shevchenko, A., Tomas, H., Havlis, J., Olsen, J. V., Mann, M. In-gel digestion for mass spectrometric characterization of proteins and proteomes. Nature Protocols. 1 (6), 2856-2860 (2006).
- Court, M., et al. Toward a standardized urine proteome analysis methodology. Proteomics. 11 (6), 1160-1171 (2011).
- Wiśniewski, J. R., Zougman, A., Nagaraj, N., Mann, M. Universal sample preparation method for proteome analysis. Nature Methods. 6 (5), 359-362 (2009).
- Liebler, D. C., Ham, A. -J. L. Spin filter-based sample preparation for shotgun proteomics. Nature Methods. 6 (11), 785-786 (2009).
- Hubner, N. C., Ren, S., Mann, M. Peptide separation with immobilized pI strips is an attractive alternative to in-gel protein digestion for proteome analysis. Proteomics. 8 (23-24), 4862-4872 (2008).
- Park, J., et al. Informed-Proteomics: open-source software package for top-down proteomics. Nature Methods. 14 (9), 909-914 (2017).
- Richter, A., Sanford, K. K., Evans, V. J. Influence of oxygen and culture media on plating efficiency of some mammalian tissue cells. Journal of the National Cancer Institute. 49 (6), 1705-1712 (1972).
- Packer, L., Fuehr, K. Low oxygen concentration extends the lifespan of cultured human diploid cells. Nature. 267 (5610), 423-425 (1977).
- Lengner, C. J., et al. Derivation of pre-X inactivation human embryonic stem cells under physiological oxygen concentrations. Cell. 141 (5), 872-883 (2010).
- Sidoli, S., Kulej, K., Garcia, B. A. Why proteomics is not the new genomics and the future of mass spectrometry in cell biology. Journal of Cell Biology. 216 (1), 21-24 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены