Method Article
Análise de Proteomic do macrófago humano polarização sob um ambiente de baixo oxigênio
Neste Artigo
Resumo
Apresentamos um protocolo para obter assinaturas de proteomic de macrófagos humanos e aplicar isso a determinação do impacto de um ambiente de baixo oxigênio na polarização do macrófago.
Resumo
Os macrófagos são células do sistema imune inatas envolvido com uma série de funções fisiológicas, variando das respostas de patógenos infecciosos a homeostase do tecido. As várias funções dessas células estão relacionadas aos seus Estados de ativação, que é também chamado de polarização. A descrição molecular precisa destas várias polarizações é uma prioridade no campo da biologia do macrófago. Atualmente é reconhecido que uma abordagem multidimensional é necessária para descrever como a polarização é controlada por sinais ambientais. Neste relatório, descrevemos um protocolo projetado para obter a assinatura de proteomic de várias polarizações em macrófagos humanos. Este protocolo é baseado em uma rótulo livre quantificação da expressão da proteína de macrófago obtido de fracionada em gel e conteúdo de lise celular Lys C/tripsina-digerido. Nós também fornecemos um protocolo baseado na solução de digestão e isoeléctrico focando fracionamento para usar como uma alternativa. Porque a concentração de oxigênio é um parâmetro ambiental relevante nos tecidos, usamos este protocolo para explorar a composição atmosférica como ou um ambiente de baixo oxigênio afeta a classificação de polarização de macrófagos.
Introdução
Os macrófagos são células do sistema imune inatas envolvido com uma série de funções fisiológicas, variando das respostas de patógenos infecciosos a homeostase do tecido, incluindo a remoção de pilhas apoptotic e remodelação da matriz extracelular1. Estas células são caracterizadas por uma forte plasticidade fenotípica2 , que se traduz em um muitos Estados possíveis de ativação, que também são chamados de polarizações. A descrição molecular precisa destas várias polarizações é uma prioridade no campo do macrófago biologia3. Foi proposto para classificar estas polarizações usando a chamados dicotomia M1/M2, em que M1 representa pro-inflamatórios e M2 representa macrófagos anti-inflamatórios. Este modelo se encaixa bem em diversas situações patológicas, como infecções agudas, alergia e obesidade4. No entanto, em tecidos cronicamente inflamados e câncer, foi demonstrado que esta classificação é incapaz de compreender o amplo repertório fenotípico que macrófagos presentes em certos ambientes celulares5,6, 7. o consenso atual é que polarização macrófago é melhor descrita usando um modelo multidimensional para integrar sinais específicos microenvironmental8. Esta conclusão foi confirmada através da análise de transcriptomic de macrófagos humanos, mostrando que o modelo M1/M2 é ineficiente em descrever as polarizações obtidos9.
O estudo apresentado tem como objetivo proporcionar um protocolo para obter assinaturas de proteomic de várias polarizações em macrófagos humanos. Descrevemos como diferenciar os macrófagos humanos em ambientes de vários níveis de oxigênio e obter peptídeos o proteome macrófago toda para realizar uma rótulo livre de quantificação. Esta quantificação permite a comparação dos níveis de expressão de várias proteínas. Como pesquisas sobre células-tronco tem revelado a importância de oxigênio como um parâmetro chave ambiental10, procuramos entender como esse parâmetro de tecido pode influenciar a polarização do macrófago em seres humanos. A pressão parcial de oxigênio foi encontrada para o intervalo de 3 a 20% (de pressão atmosférica total) no corpo humano, onde 20% corresponde mais ou menos o que é comumente usado em uma incubadora de cultura celular (o valor exato é de cerca de 18,6%, tendo a presença de água em conta).
Trabalhos anteriores tem mostrado que alveolar diferem dos macrófagos intersticiais de funcionais e morfológico ponto de vistas11 e que essas diferenças são provavelmente parcialmente devido aos níveis de oxigênio diferentes a que estão expostos12. Além disso, os macrófagos da medula óssea-derivado mostram uma habilidade aumentada para phagocytize bactérias quando expostos a um ambiente de oxigênio baixo12. O efeito oposto foi encontrado por macrófagos humanos diferenciadas THP113, mas estes resultados suportam a ideia de que o oxigênio é um regulador da biologia do macrófago e que é necessário clarificar este papel a nível molecular em macrófagos humanos. Em um estudo anterior, nós aplicamos uma abordagem proteômica para solucionar esses problemas. Medindo os níveis de expressão de milhares de proteínas simultaneamente, nós destacou o impacto do oxigênio na polarização e forneceu uma lista de novos marcadores moleculares. Também fomos capazes de relacionar esses achados para algumas funções de macrófagos. Em particular, nós encontramos que a taxa de fagocitose das células apoptóticas foi aumentada em macrófagos IL4/IL13-polarizada, que estava relacionado com o upregulation de ALOX15, como revelado pela análise proteômica14. No presente estudo, descrevemos como executar tal análise.
Protocolo
Amostras de sangue humano (LRSC) de doadores saudáveis, elimina identificados foram obtidas de EFS (serviço nacional de sangue da francesa) como parte de um protocolo autorizado (DC CODECOH-2018 – 3114). Os doadores deram consentimento assinado para o uso de sangue.
1. mídia e preparação de Buffer
- Prepare o suporte de macrófagos [glutamax RPMI + 10 mM HEPES + 1 x não aminoácidos essenciais (timina)] e aquecê-lo a 37 ° C.
- Preparar o macrófago médio + 10% de soro humano de plasma AB (SAB), filtrar (filtro de 0,22 µm) e, em seguida, esquente a 37 ° C (conhecido como macrófago médio + 10% SAB daqui em diante).
- Preparar o buffer de classificação [1 x salina tamponada fosfato (PBS) + 0,5% albumina de soro bovino (BSA) + ácido de 2mm ácido etilenodiaminotetracético (EDTA)], filtrar (filtro de 0,22 µm) e mantê-lo em 4 ° C.
2. isolamento de células mononucleares do sangue periférico (PBMC) da câmara de leucorredução sistema (LRSC)
- Colocar 15 mL de solução de separação de células gradiente de densidade (ver Tabela de materiais) em 50 mL de um tubo de centrifugação assim que pode aquecer à temperatura ambiente (RT) antes de receber o LRSC.
Nota: A densidade depende da temperatura. Como este produto é armazenado em 4 ° C, esta etapa deve ser feita com antecedência, então isso pode equilibrar a RT - Esvazie o LRSC em um tubo de centrifugação de 50 mL, adicionar até 50 mL de 1X PBS e misture. Muito lentamente, adicione 25 mL da mistura preparada durante a etapa 2.2 em cima de 15 mL de solução de gradiente de densidade aquecida durante a etapa 2.1.
Nota: Tenha cuidado para não misturar as fases durante esta etapa. O sangue deve ser adicionado a solução de gradiente de densidade sem nenhum distúrbio desta fase. - Centrifugue a ambos os tubos de centrifugação para 25 min a 700 x g, sem pausas.
Nota: No final da centrifugação gradiente de densidade, as camadas de baixo para cima são: os eritrócitos e granulócitos, formando a pelota, fase de solução gradiente de densidade, camada de PBMC e plasma. - Com uma pipeta, passar pela fase de plasma sem aspiração- e recolher a camada PBMC em um novo tubo de centrifugação de 50 mL. Adicione até 50 mL de 1X PBS para os PBMCs como uma etapa de lavagem e centrifugação por 10min a 300 x g.
- Aspirar o sobrenadante e resuspenda o pellet em 40 mL de meio de macrófagos.
3. magnético rotulagem e isolamento de CD14+ células (monócitos)
- Conte os PBMCs em uma câmara de Malassez. Retirar a quantidade de PBMC necessária para a realização do experimento (tipicamente 100 a 300 x 106 células), colocá-los em um tubo de centrifugação e centrifugar durante 10 minutos a 300 x g.
- Aspirar o sobrenadante e ressuspender o precipitado em 80 µ l de buffer de classificação preparado durante a etapa 1.3 por 107 PBMCs. Adicionar 20 µ l de CD14 microbeads por 107 PBMCs. Mix bem e incube por 15 min a 4 ° C, sob agitação constante.
- Adicione 1 mL de tampão por 107 PBMC de classificação como uma etapa de lavagem e centrifugar durante 10 minutos a 300 x g. Aspire o sobrenadante e ressuspender o precipitado em 500 µ l de tampão por 108 PBMC de classificação.
- Coloca uma coluna no campo magnético do separador. Prepare a coluna, enxaguá-lo com 3 mL de tampão de classificação.
- Aplica a suspensão de células na coluna. A coluna depende do número de células a ser isolado (aqui, são usadas colunas LS para até 109 PBMCs). Colete o escoamento contendo células sem rótulo.
Nota: Começando com esta etapa, todos os tubos (seleções de negativos e positivos) são mantidos para depois verificar as diferentes etapas por citometria de fluxo. - Lave a coluna com 3 x 3 mL de tampão de classificação. Recolha pilhas sem rótulo, passando através do mesmo tubo da etapa 3.12. Executar etapas de lavagem por adição de buffer classificação, tenha cuidado para não secar a sua coluna. Coloque um tubo de coleta sob a coluna e removê-lo do separador.
- Pipete 5 mL de tampão de classificação para a coluna. Imediatamente lave as pilhas magneticamente etiquetadas empurrando firmemente o êmbolo na coluna. Para aumentar a pureza do CD14+ células, a fração eluted é enriquecida sobre uma segunda coluna.
- Repita as etapas de 3.4 a 3.7 com uma nova coluna.
4. chapeamento de monócitos
- Conte os monócitos em uma câmara de Malassez. Verificar a pureza do CD14+ células por citometria de fluxo. Retirar a quantidade de monócitos necessários para o experimento e colocá-los em um tubo de centrifugação.
- Centrifugar durante 10 minutos a 300 x g. Aspire o sobrenadante e ressuspender o monócito em meio de macrófagos. As células da placa e deixá-los a resolver para 50 min a 1 h. Aspire o meio e substituí-lo com média de macrófagos + 10% SAB + 25 ng/mL macrófago colônia estimulante fator (M-CSF) para induzir a diferenciação.
5. polarização de macrófagos no dia 6
- Aspire o meio. Substituí-lo por meio do macrófago + 10% SAB com vários estímulos. Por exemplo, adicione 10 ng/mL interferon gama (INFγ) + 1 lipopolissacarídeo ng/mL (LPS) para obter a polarização de M1, ou 20 ng/mL interleucina 4 (IL4) + 20 ng/mL interleucina 13 (IL13) para a polarização de M2.
Nota: A estimulação pode ser realizada entre 24 e 48 h antes de prosseguir para outros testes. - Colheita de células usando uma solução de desmontar ou um raspador de célula.
6. célula de cultura sob condições de baixo oxigênio
- A partir do passo 4, manter a monócitos e macrófagos em um ambiente controlado por oxigênio para realizar análise de condição hipóxica. Use uma estação de trabalho de hipóxia para manter as células sob a pressão parcial de oxigênio desejado durante o experimento.
Nota: Quando se trabalha sob pressão de oxigênio baixa, é importante preparar todas as mídias e buffers de lavar debaixo da estação e esperar suficientemente para obter a correta pressão parcial no líquido. Por exemplo, 10 mL de PBS em uma placa de Petri de 60mm requer aproximadamente 2h para chegar a 25 mmHg para O pressão parcial de2 a partir de pressões atmosféricas (como medimos usando um sensor de oxigênio de fibra óptica). Em muitas estações de hipoxia ou incubadoras, a pressão de oxigênio é definida como uma percentagem da pressão atmosférica. Se medidas precisas são necessárias, é melhor usar uma estação autorizando para definir diretamente a pressão de oxigênio em mmHg.
7. Lise e digestão em-Gel (protocolo 1)
Nota: Nesta e as seções a seguir, são descritos dois protocolos usados para obter peptídeos e executar análise de LC-MS/MS. Protocolo n º 1 descreve lysis da pilha e fracionamento em gel e digestão e protocolo 2 descreve a lise celular em solução seguida em solução de digestão e fracionamento usando um método de focagem isoeléctrico.
- Execute o lysis da pilha no buffer Laemmli [234 mM Tris-HCL (pH 6,8), 7,5% SDS, 37% de glicerol, 33,3% (v/v) β-Mercaptoetanol, azul de bromofenol 0,2% w/v]. Carrega o equivalente de proteína de 300.000 células para cada amostra em géis de acrilamida bis-Tris 4-12%.
- Controle a duração da migração eletroforética para permitir que cada amostra de proteína a ser dividido em gel de 6 bandas, como exemplificado na Figura 3.
- Corrigir o gel com uma solução de fixação (30% etanol + 7,5% de ácido acético por 20 min) e, em seguida, adicionar a solução de coloração (R-250 Coomassie azul por 45 min.). Adicionar a solução de descoloração (30% etanol + 7,5% ácido acético até bandas aparecem) antes de excisão das bandas de proteínas com um bisturi limpo.
- Corte cada banda extirpada antes da sua introdução em tubos de 500 µ l. Uma superfície de vidro limpo é garantida para evitar a contaminação com queratina (5% solução de SDS em água deionizada pode ser usada para limpar superfícies).
- Lave as fatias do gel 3 vezes em 200 µ l de 25mm bicarbonato de amônio por 20 min a 37 ° C, seguido de uma lavagem em 25mm bicarbonato de amônio e acetonitrila (50% v/v). Desidrata-se os pedaços de gel com 200 µ l de acetonitrilo 100% por 10 min.
- Incube cada pedaço de gel com 10 mM DTT (ditiotreitol) em 25mm bicarbonato de amônio por 45 min a 56 ° C (200 µ l), seguido por iodoacetamide 55mm em 25mm bicarbonato de amônio (200 µ l) por 35 min no escuro no RT
- Para parar a alquilação, incubar cada pedaço de gel com 200 µ l de 10mm TDT em 25mm bicarbonato de amónio para 10 min a RT. Wash os pedaços de gel em 200 µ l de 25mm bicarbonato de amônio e desidratam com 200 µ l de acetonitrilo 100% por 10 min.
- Digeri as proteínas durante a noite a 37 ° C, com mistura de tripsina/Lys-C de acordo com as instruções do fabricante.
- Extrair os peptídeos resultantes de pedaços de gel, adicionando 50 μL de acetonitrilo 50% por 15 min e, em seguida, 50 μL de 5% de ácido fórmico por 15 min e finalmente, 50 μL de acetonitrilo 100% por 15 min. piscina e secar cada fração em tubos de baixa absorção para limitar a adsorção de peptídeos e perda de amostra. Armazene as amostras a-80 ° C até posterior análise.
8. proteína extração e na solução de digestão (protocolo 2)
- Realize a lise celular (2 x 106 células) com 150 µ l da lise seguintes:
- Ureia de 7 M, 2m tioureia, 40 mM Tris e 4% CHAPS, completadas com inibidores de protease (mini completo, livre de EDTA inibidor da protease cocktail).
- Homogeneizar as soluções durante 30 min à RT com um thermoshaker. Centrifugar a 13.800 x g por 20 min RT e manter o sobrenadante.
- Remova contaminantes com um kit de limpeza 2D:
- O kit contém solução precipitant, solução dessensibilizador co, tampão de lavagem e lavagem de aditivo.
- Adicione 300 µ l de solução precipitant e misture bem. Incube no gelo por 15 min. Adicionar 300 µ l de solução dessensibilizador co. Centrifuga os tubos (pelo menos) a 12.000 x g por 5 min. Um pequeno sedimento deve ser visível. Avançar rapidamente para a próxima etapa para evitar ressuspensão ou dispersão da pelota. Remova o sobrenadante sem perturbar o sedimento.
- Centrifuga os tubos novamente com o cap-dobradiça e pelota virada para fora para trazer qualquer líquido restante para o fundo do tubo. Um breve pulso é suficiente. Não deve haver nenhuma visível restante líquido nos tubos.
- Sem perturbar o sedimento, adicione 40 µ l de solução dessensibilizador co. Sente-se no gelo por 5 min. centrifugar por 5 min, em seguida, remova e descarte a lavagem, deixe o tubo. Adicione 25 µ l de água deionizada. Tubo de vórtice cada durante 5-10 s. A pelota deve dispersar, mas não se dissolvem na água.
- Adicione 1 mL de tampão de lavagem (pre-refrigerado pelo menos 1 h a-20 ° C) e 5 µ l de aditivo de lavagem. Vórtice até a pelota é totalmente disperso. Incubar os tubos a-20 ° C durante pelo menos 30 min. Vortex para 20-30 s cada 10min
Nota: Os tubos podem ser armazenados a-20 º C por até 1 semana com degradação proteica mínima ou modificação. - Centrifuga os tubos (pelo menos) a 12.000 × g por 5 min. Retire cuidadosamente e descartar o sobrenadante. Um sedimento branco deve ser visível. Permita a pelota para muito por não mais que 5 min (se a pelota é muito seca, vai ser difícil Ressuspender).
- Resuspenda o pellet de proteína em 300 µ l de bicarbonato de Amônio ureia e 0,1 M 8 M. Vórtice fortemente por 1 min. Determine a concentração de proteína usando um ensaio colorimétrico.
9. em solução de digestão (protocolo 2)
- Reduzir as pontes dissulfeto adicionando 5,1 µ l de uma solução aquosa de 700 mM DTT (concentração final 12,5 mM) para as proteínas ressuspensa de passo 8.4 e incubar a 37 ° C por 30 min com um thermoshaker. Alkylate resíduos de cisteína, adicionando 20,3 µ l de uma solução aquosa de iodoacetamide de 700 mM (concentração final 40 mM) e incubados a 25° C por 30 min no escuro com uma thermoshaker.
- Adicione 990 µ l de bicarbonato de amônio 0,1 M para a amostra. Adicione um volume correspondente de tripsina/Lys-C mix (substrato: relação 1: 100 w/w). Incube a 37° C durante a noite com um thermoshaker.
10. limpar cartucho (protocolo 2)
- Molhe um cartucho com 1 coluna do volume (1 mL) de metanol. Limpe o cartucho com 1 coluna do volume (1 mL) de água de acetonitrilo/HPLC-grau de 80% e descartar o escoamento. Equilibrar o cartucho com 4 coluna-volumes (4 mL) de água de 0,1% de ácido fórmico/HPLC-grau e descartar o escoamento.
- Acidificar com amostras com 90 µ l de água de pH 2-3 (verifique o pH com um indicador de pH) ou 10% de ácido fórmico. Carregar as amostras acidificadas e coletar o escoamento. Recarrega o escoamento (contendo os peptídeos não-retida). Lave o cartucho com coluna-volume 6 (6 mL) de água de ácido fórmico/HPLC-nível de 0,1%.
- Eluir peptides do cartucho com 1 coluna-volumes (1 mL) de água de acetonitrilo/HPLC-grau fórmico acid/50% 0,1%. Transfira para um tubo de microcentrifugadora de 1,5 mL. Concentre a amostra utilizando um concentrador de vácuo (150 x g, vácuo a 160 mBar).
11. fracionamento por isoeléctrica (protocolo 2)
Nota: Peptídeos são separados de acordo com seus pontos isoeléctrico usando um fracionador de fora-gel em uma faixa de 13 cm, cobrindo uma faixa de pH de 3 a 10. Usamos o seguinte protocolo fornecido pelo fornecedor (resumido a seguir):
- Preparar as seguintes soluções: solução um (600 µ l de solução de glicerol, 60 µ l de tampão OFFGEL, 4,34 mL de água ultrapura) e solução B (1,776 mL da solução A) e 444 µ l de água ultrapura.
- Monte as tiras IPG, quadros e eletrodos de acordo com as instruções do fabricante.
- Resuspenda a amostra com 1,8 mL de solução B. Adicione 40 µ l da solução B em cada poço. Carrega 150 µ l de amostra em cada poço.
- Selecione o método padrão para peptídeos: OG12PE00 (método de padrão OFFGEL de peptídeos para uso com um Kit de Res de baixa de OFFGEL 3100, frames de 12-poços de 3-10, pH. Espere até que esse método tenha sido concluído (~ 20 h). Recolha as frações em tubos corretamente etiquetados.
12. limpar Harvard aparelho coluna reversa C18 Post-IEF (protocolo 2)
- Progressivamente, adicionar alguns μL em vez de 1% TFA em água deionizada a cada fração para acidificar a amostra. Seleção usando papel de pH o pH é de cerca de 3 ou abaixo.
- Preparar as seguintes soluções: solução 1 (5 mL de acetonitrilo, 10 µ l de ácido fórmico, 4,99 mL de água ultrapura) e a solução 2 (0,5 mL de acetonitrilo, 10 µ l de ácido fórmico, 9,49 mL de água ultrapura).
- Pre-molhado a coluna de rotação com 150 µ l de solução 1. Centrífuga para 90 s em 750 x g e descarte o escoamento. Lave a coluna de rotação com 150 µ l de solução 2. Centrífuga para 90 s em 750 x g e descarte o escoamento.
- Passe a fração através da coluna. Centrífuga para 90 s em 750 x g e descarte o escoamento. Lavar com 150 µ l de solução 2. Centrífuga para 90 s em 750 x g e descarte o escoamento.
- Eluir a fração com 50 μL de solução 1. Centrífuga para 90 s em 750 g de x. Repita estes passos mais uma vez.
- Seco-fração usando um concentrador de vácuo (150 x g, vácuo 160 mBar) e armazenar a-80 ° C
13. análise de dados Proteomic e bioinformática18
- Analisar os dados obtidos por um nano-LC-MS/MS massa espectrômetro usando software de quantificação, como MaxQuant (versão 1.5.2.8) e o motor de busca de Andrômeda.
- Definir taxa falsa da descoberta (FDR) a 1% para proteínas e peptídeos e um comprimento mínimo de 7 aminoácidos. Definir a especificidade da enzima como C-terminal para Arg e Lys. Permitir que 2 decotes perdidas em títulos de prolina. Selecione carbamidomethylation de cisteína como uma modificação fixa e N-terminal da proteína acetilação e metionina oxidação como variáveis modificações.
- Além disso, analise os dados com o software de análise estatística. Realizar uma análise de enriquecimento funcional usando o software FunRich (www.funrich.org/). Realizar uma análise de enriquecimento de ontologia do gene utilizando software de DAVID (https://david.ncifcrf.gov/).
Resultados
A partir de células mononucleares de sangue periférico (PBMC) obtidas através da centrifugação diferencial, o protocolo permite a obtenção de uma população de CD14+ monócitos com uma pureza avaliou mais de 98% por citometria de fluxo (Figura 1). Estes monócitos secundariamente são diferenciados em direção a várias polarizações (Figura 2). Quando um fracionamento em gel é escolhido, a migração em geles de SDS-page é adaptada para obter o número de faixas desejadas e as bandas são extirpadas (Figura 3). Secundariamente, a digestão é realizada nas bandas excisadas do gel e, em seguida, os peptídeos são extraídos. Os peptídeos são analisados usando um nano-(cromatografia líquida) LC-MS/MS, espectrômetro de massa. Espectros de MS/MS dar a identidade de várias proteínas de acordo com a anotação dos espectros obtidos por peptídeos conhecidos (Figura 4A). A quantificação da abundância de uma proteína é então calculada em relação a quantidade de peptídeos identificados provenientes da proteína usando software publicado e bancos de dados15,16. Este protocolo com a digestão em-gel dá aproximadamente 4000 proteínas identificadas, e a gama dinâmica foi encontrada para cobrir 5 unidades de escala logarítmica (Figura 4B). Análise da expressão diferencial destas proteínas identificadas pode ser usado para determinar o agrupamento de várias polarizações sob ambientes diferentes de oxigênio.
Com esse método, nós também podemos reconhecer aglomerados de proteínas que são acima-regulada quando exposto a uma concentração de oxigênio baixa de 3% (Figura 5, tabela 1). Para avaliar a eficiência da digestão, que é não é possível quando é usado um protocolo em-gel, propusemos um método de digestão em solução que foi adaptado para macrófagos humanos (figura 6A). Com este método, podemos facilmente obter (após digestão na solução) identificação de 3600 proteínas sem fracionamento, significando o fracionamento com vontade IEF sensatamente aumentar esse número (Figura 6B).

Figura 1: fluxo cytometry análise da expressão de CD14 de PBMC antes de classificação (painel esquerdo) e depois da classificação (painel direito) mostrando a pureza obtida após seleção de grânulos magnético. Clique aqui para ver uma versão maior desta figura.

Figura 2: imagens de contraste de fase de macrófagos humanos diferenciados, mostrando a heterogeneidade das morfologias obtidas por dois diferentes polarizações. Barra de escala representa 50 µm. clique aqui para ver uma versão maior desta figura.

Figura 3: imagem latente de Coomassie azul manchado gel mostrando as várias bandas que vão ser extirpadas [aqui, 6 bandas em macrófagos M(Ø)] para 5 polarizações de macrófagos expostos a um ambiente de oxigênio baixo. IC = imunocomplexos, DXM = dexametasona. Clique aqui para ver uma versão maior desta figura.
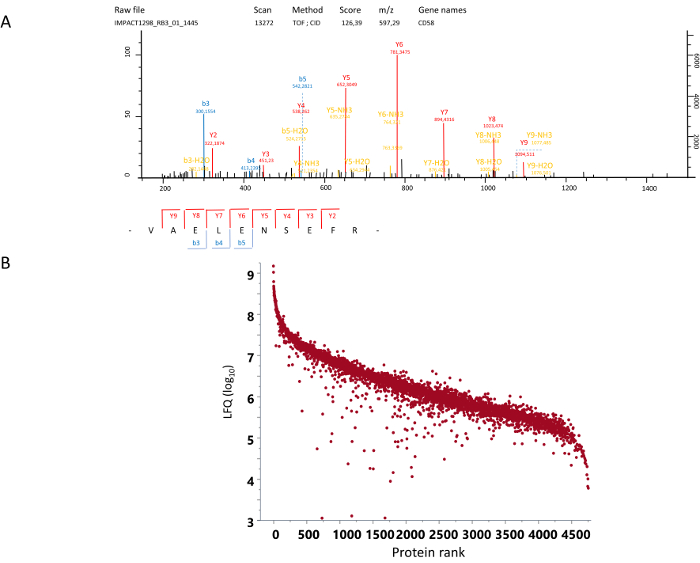
Figura 4: espectro de MS/MS e quantificação. (A) um exemplo de um espectro de MS/MS. Mostrado aqui é o espectro de CID (dissociação induzida por colisão) de um peptídeo encontrado em m/z 597.29 no espectro do MS, com uma carga elétrica de + 2. A sequência correspondente foi determinada a partir deste espectro como Val-Ala-Glu-Leu-Glu-Asn-Ser-Glu-Phe-Arg da proteína CD58. (B) rank ordenou quantificação livre de rótulo para cada uma das proteínas identificadas (log10 LFQ). Clique aqui para ver uma versão maior desta figura.
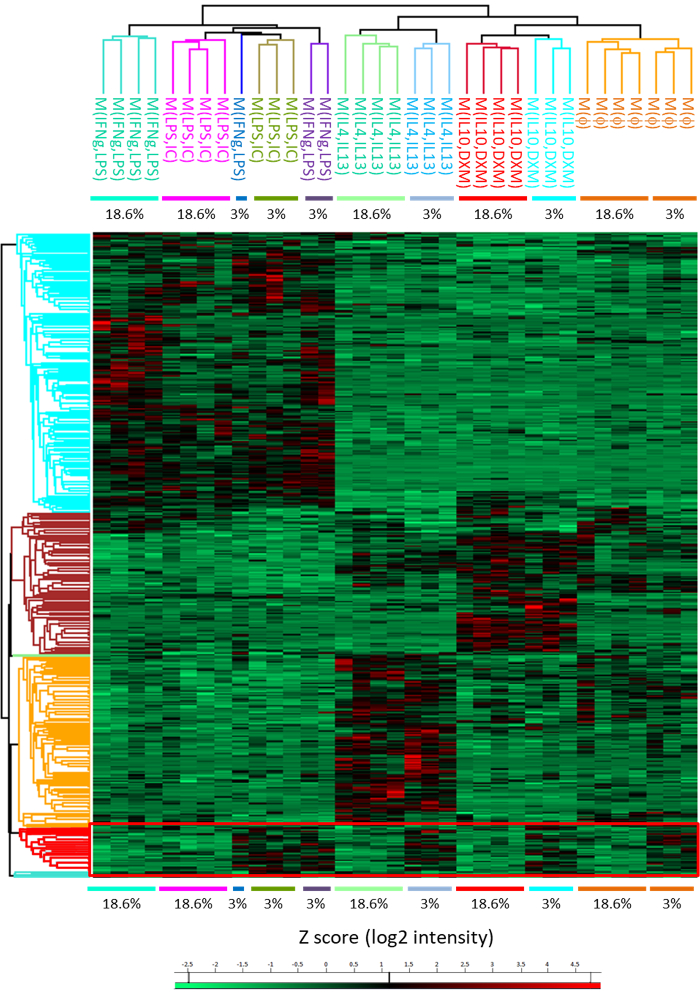
Figura 5: mapa de calor que representa o agrupamento hierárquico de polarização de todos os Estados usando diferencialmente expressas proteínas. A análise revela um aglomerado de proteínas overexpressed em todas as polarizações na condição de2 a 3% O (retângulo vermelho). A escala de cores representa z-scores (log2 intensidade). Cada linha é uma proteína e cada coluna é uma amostra. Esta figura que se originou de uma anterior publicação14. Clique aqui para ver uma versão maior desta figura.

Figura 6: SDS-PAGE e cromatograma. (A) prata manchada geles de SDS-PAGE com proteína de lise celular e depois na solução de digestão, mostrando a ausência de degradação durante a Lise e a eficiência da digestão. (B) cromatograma obtida após a digestão na solução sem fracionamento. Clique aqui para ver uma versão maior desta figura.
| Cluster de | proteinID | Nomes de proteína | Nomes de gene | Peptídeos | Razor + peptídeos exclusivos | Peptídeos exclusivos | IDs de proteína | ||
| Vermelho | P0DMV9 | 70 kDa proteína 1B de choque do calor | HSPA1A | 40 | 37 | 4 | P0DMV9; P0DMV8; A8K5I0; Q59EJ3; B4DNT8; B4DWK5; B4DFN9; B4DI39; B4E1S9; B4DVU9; V9GZ37; B3KTT5; B4DNX1; B4E1T6; B4DNV4; Q9UQC1 | ||
| Vermelho | P54709 | Transporte de sódio/potássio ATPase subunidade beta-3 | ATP1B3 | 8 | 8 | 8 | P54709; D3DNF9; C9JXZ1; C9JA36; H7C547; F8WBY4; Q58I18 | ||
| Vermelho | O00462 | Beta-mannosidase | MANBA | 14 | 13 | 13 | O00462; A7LFP5; A8K6D3; E9PFW2; B4DT18; Q59EG5 | ||
| Vermelho | Q8NAS7 | Proteínas de ferro-enxofre NADH desidrogenase [ubiquinona] 7, mitocondrial | NDUFS7 | 4 | 4 | 4 | Q8NAS7; Q6ZQU6; F5H5N1; B7Z1U1; A8K0V6; Q7LD69; F5GXJ1; O75251; B7Z4P1; Q9H3K5; A0A087WXF6; A0A087WTI3; Q6ZS38 | ||
| Vermelho | Q8WWQ0 | PH-interação proteína | PHIP | 5 | 5 | 4 | Q8WWQ0; Q9NWP3 | ||
| Vermelho | E5RHK8 | Dinamina-3 | DNM3 | 11 | 2 | 2 | E5RHK8; Q9UQ16; B3KPF2; E5RIK2 | ||
| Vermelho | A0A024QZ64 | Frutose-bisphosphate aldolase C | ALDOC | 18 | 14 | 7 | A0A024QZ64; P09972; B7Z1Y2; B7Z3K9; B7Z1N6; B7Z3K7; A8MVZ9; J3KSV6; J3QKP5; B7Z1L5; C9J8F3; K7EKH5; J3QKK1; B7Z1H6 | ||
| Vermelho | O75489 | Proteínas de ferro-enxofre NADH desidrogenase [ubiquinona] 3, mitocondrial | NDUFS3 | 12 | 12 | 12 | O75489; Q9UF24; Q53FM7; E9PS48; E9PKL8; G3V194 | ||
| Vermelho | P21912 | Subunidade de ferro-enxofre Succinato desidrogenase [ubiquinona], mitocondrial | SDHB | 11 | 11 | 11 | P21912; A0A087WXX8; A0A087WWT1 | ||
| Vermelho | A0A024R1Y7 | Proteína de domínio-contendo GH3 | LGP1; GHDC | 7 | 7 | 7 | A0A024R1Y7; Q8N2G8; B3KVB0; K7ESN3; K7EJT7; K7EQ41; K7EL54 | ||
| Vermelho | E5KRK5 | NADH-ubiquinona oxidorredutase 75 kDa subunit do, mitocondrial | NDUFS1 | 29 | 29 | 29 | E5KRK5; P28331; B4DJ81; Q9P1A0; C9JPQ5; F8WDL5 | ||
| Vermelho | A0A024QZ30 | Subunidade de flavoproteína Succinato desidrogenase [ubiquinona], mitocondrial | SDHA | 17 | 17 | 17 | A0A024QZ30; P31040; D6RFM5; B3KT34; A0A087X1I3; Q0QF12; B4DYN5; B3KYA5; B4DNB2; H0Y8X1; B7Z6J5 | ||
| Vermelho | A0A024R2F9 | Proteína do transmembrane 43 | TMEM43 | 16 | 16 | 16 | A0A024R2F9; Q9BTV4; Q8TEP9; V9GY05 | ||
| Vermelho | A0A024R5K3 | Proteínas de ferro-enxofre NADH desidrogenase [ubiquinona] 8, mitocondrial | NDUFS8 | 5 | 5 | 5 | A0A024R5K3; E9PPW7; O00217; E9PN51; F8W9K7; E9PKH6; B4DYI3; Q53G17 | ||
| Vermelho | O76003 | Glutarredoxina-3 | GLRX3 | 13 | 13 | 13 | O76003 | ||
| Vermelho | Q1HBJ4 | O mitogen-ativado proteína quinase; O mitogen-ativado proteína quinase 1 | MAPK1 | 26 | 26 | 21 | Q1HBJ4; P28482; B4DHN0; Q499G7; K7ELV1; K7EN18; B4E104; P31152; Q16659 | ||
| Vermelho | Q13151 | Heterogêneo nuclear ribonucleoprotein A0 | HNRNPA0 | 8 | 8 | 8 | Q13151 | ||
| Vermelho | V9HWN7 | Frutose-bisphosphate aldolase A | ALDOA | 36 | 36 | 14 | V9HWN7; P04075; J3KPS3; H3BQN4; H3BUH7; H3BR04; H3BMQ8; H3BU78; H3BR68; A4UCS9; A4UCT0 | ||
| Vermelho | B4DVJ0 | Glicose-6-fosfato isomerase | GPI | 32 | 32 | 23 | B4DVJ0; P06744; B4DE36; A0A0A0MTS2; K7EQ48; K7EP41; K7EPY4; K7ELR7; K7ERC6; K7ENA0; K7ESF4; K7EIL4; K7ERK8; Q59F85 | ||
| Vermelho | V9HWB9 | L-lactato desidrogenase; L-lactato desidrogenase uma cadeia | LDHA | 36 | 36 | 34 | V9HWB9; P00338; B4DJI1; F5GXY2; F5GYU2; F5GXH2; F5H5J4; F5H6W8; F5GZQ4; F5H8H6; F5GXC7; F5GWW2; F5GXU1; A0A087WUM2; Q96L19; Q6ZMR3 | ||
| Vermelho | P13674 | Subunidade alfa-4-hidroxilase prolil-1 | P4HA1 | 26 | 26 | 26 | P13674; Q5VSQ6 | ||
| Vermelho | Q6FHV6 | Gama-enolase; Enolase | ENO2 | 18 | 15 | 14 | Q6FHV6; P09104; A8K3B0; F5H0C8; F5H1C3; U3KQP4; U3KQQ1; Q9NPL4 | ||
| Vermelho | Q99798 | Aconitate hydratase, mitocondrial | ACO2 | 40 | 40 | 40 | Q99798; B4DZ08; B2RBW5; A2A274; B4DJW1; B4DLY4; Q71UF1; B4DEC3; B4DW08; O75944 | ||
| Vermelho | P17858 | Tipo 6-fosfofrutoquinase, fígado de ATP-dependente | PFKL | 32 | 29 | 28 | P17858; Q7L2M7; Q9BSP4; B3KNQ7; B4E108; Q59GI2; F8WEU2; Q7Z3R9; Q6MZK4 | ||
| Vermelho | A0A024R872 | Niban-como a proteína 1 | FAM129B | 32 | 32 | 32 | A0A024R872; Q96TA1; Q9H8K1; Q2YD88; Q9H6L6 | ||
| Vermelho | A0A024RC61 | Aminopeptidase N | ANPEP | 58 | 58 | 25 | A0A024RC61; P15144; Q59E93; B4DV63; B4DP01; B4DP96; H0YKT6; H0YLZ8; Q71E46; H0YMC1; Q8IVL7 | ||
| Vermelho | V9HWF4 | Fosfoglicerato quinase; Fosfoglicerato quinase 1 | PGK1 | 41 | 41 | 35 | V9HWF4; P00558; B4E1H9; B4DHM5; B4DHB3; B4DWQ3; Q16444 | ||
| Vermelho | Q12882 | Dihydropyrimidine desidrogenase [NADP(+)] | DPYD | 44 | 44 | 44 | Q12882; B4DML1 | ||
| Vermelho | B4DEQ0 | Oxidorredutase electrões da flavoproteína-ubiquinona transferência, mitocondrial | ETFDH | 9 | 9 | 9 | B4DEQ0; Q547S8; A7UNU5; Q16134; D6RAD5 | ||
| Vermelho | D9UAX9 | MHC de classe I do antígeno | HLA-B | 13 | 3 | 2 | D9UAX9 | ||
| Vermelho | V9HWK1 | Triose isomerase | TPI1 | 29 | 29 | 17 | V9HWK1; P60174; Q53HE2; B4DUI5; U3KPZ0; U3KQF3; U3KPS5 | ||
| Vermelho | Q96HE7 | Alfa da proteína de ERO1, como | ERO1L | 28 | 28 | 28 | Q96HE7; G3V3E6; G3V5B3; G3V2H0; G3V503; Q5TAE8; B2RD00; Q86YB8 | ||
| Vermelho | P14868 | Aspartato - ligase do tRNA, citoplasmática | DARS | 29 | 29 | 2 | P14868; Q53T60; Q53R85; H7BZ35; H7C278 | ||
| Vermelho | P36871 | Fosfoglicomutase-1 | PGM1 | 24 | 24 | 5 | P36871; B4DFP1; Q9H1D2 | ||
Tabela 1: Lista de proteínas over expressas por macrófagos humanos comuns para cada polarização sob tensão baixa de oxigênio.
Discussão
Porque proteomics é uma poderosa ferramenta para estudar a expressão de diferentes proteínas de uma célula inteira ou compartimentos subcelulares, otimização do protocolo de lise celular e digestão de proteínas tem sido abordadas por um número de estudos. Existem três classes principais de métodos, que incluem em-gel digestão (digestão de proteínas em gel de poliacrilamida matriz)17, digestão em solução18 e de preparação de amostra auxiliado por filtro19. Este último método, inicialmente descrito como universal, tem sido relatado que exibem baixa reprodutibilidade e possível perda de proteínas no filtro20. Digestão em-gel é um método robusto que pode ser demorada e desvantajoso em que avaliar a eficiência da digestão não é fácil, se possível. Em solução de digestão oferece essa possibilidade, mas exige a limpeza das amostras após a digestão e IEF. Quando esses dois métodos são comparados entre a mesma amostra, em solução de digestão com protocolo de fraccionamento do IEF produz um maior número de proteínas identificadas (com o mesmo número de fracções) de digestão21em-gel.
Apesar desta vantagem, é necessário considerar a degradação de proteínas possível durante lise na solução devido a proteases intracelulares (especialmente em células mieloides). Também é importante ter em mente que essas técnicas baseiam-se na digestão de proteínas e apenas capaz de analisar proteínas apresentando tripsina sites específicos de clivagem. É possível usar uma abordagem de cima para baixo proteomic que alivia essa restrição de digestão, mas adiciona as etapas de análise de dados e bioinformática ressources22. A solubilização de proteínas de vários compartimentos celulares também pode ser difíceis de obter, especialmente a partir de membranas de plasma, levando a uma amostragem descontrolada de proteome celular. Para proceder com uma análise de nano-LC-MS/MS espectrômetro de massa das amostras, é importante obter uma quantidade suficiente de peptídeos, que pode depender do espectrômetro de massa usado (geralmente, a partir da proteína total deve ser pelo menos 1 µ g para uma condição, e está implícito para aumentar esta quantidade de acordo com o número da fração usado com IEF). Essa restrição pode ser uma desvantagem se a população celular sendo estudada é escassa, o que diferencia proteomic técnicas genômicas, em que a amplificação da matéria-prima é possível.
Mesmo após as obras seminais de Richer e colegas23 e Packer e Fuehr24, a importância do oxigênio em culturas de células tem sido insuficientemente reconhecida. Agora sabemos que cultivo de células em concentrações baixas de oxigênio favorece a aderência, longevidade e divisão. É reconhecido que este é de extrema importância na investigação de células estaminais25. O principal problema técnico para culturas de células sob condições controladas de oxigênio está relacionado à manutenção da concentração de oxigênio desejado durante todo o experimento. Isto requer pré-incubação de todos os meios para impedir a liberação de oxigênio dissolvido e uso de hipoxia postos de trabalho para permitir a manipulação de células de oxigênio baixo (câmara com luvas de processamento) e evitar exposição transitória para as condições de oxigênio de alta .
O protocolo descrito foi usado para obter as assinaturas moleculares de várias polarizações de macrófagos derivados de monócitos humanos e estudar os efeitos de modulação de oxigênio sobre essas assinaturas. Este estudo deu uma visão sobre a descrição dessas polarizações e revelou algumas consequências funcionais. Por exemplo, encontramos que muitas proteínas envolvidas na efferocytosis foram moduladas por um ambiente de baixo oxigênio. Esta abordagem proteômica, baseada no protocolo descrito, apresenta a oportunidade de explorar como macrófagos funções de modificação de parâmetros ambientais e como estes sinais podem ser usados para projetar novas abordagens terapêuticas14.
A abordagem de proteomic descrita neste trabalho é complementar abordagens genómicas que foram usadas durante os últimos anos no campo de estudos de polarização do macrófago humano. Proteomics oferecem a vantagem de quantificação de proteína, que pode apresentar uma expressão diferente do que seus mRNAs correspondentes devido a modificações borne-translational e levar à descoberta de novos biomarcadores. Apesar desta vantagem, proteomic dados são geralmente difíceis de interpretar, em parte devido à alta sensibilidade de espectrometria de massa, levando a muito complexos espectros de MS e falsos positivos na detecção de peptídeos. Recentemente, o software de análise ganhou eficiência para evitar isso. Mesmo se for uma situação de mudança, proteomics também enfrenta baixa reprodutibilidade de genómica26 e está associado com as etapas de validação usando outras técnicas (citometria de fluxo, immunoblotting) para confirmar as modificações quantitativas de proteína níveis de expressão.
Divulgações
Os autores declaram não há conflitos de interesse.
Agradecimentos
AM é financiado pelo programa de líder do grupo de jovens (ATIP/Avenir Inserm-CNRS), por la Ligue Nationale contre le Cancer e la ARC da Fondation pour la recherche sur le Cancer. Agradecemos a Mariette Matondo partir a espectrometria de massa para a plataforma de biologia (UTECHS MSBIO, Instituto Pasteur, Paris). Agradecemos a Lauren Anderson para a leitura do manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| Hypoxia Working Station | Oxford Optronix | Hypoxylab | |
| C6 Flow cytometer | BD | Accuri C6 | |
| Urea | Agilent Technologies | 5188-6435 | |
| Formic acid (FA) | ARISTAR | 450122M | |
| R-250 Coomassie blue | Biorad | 1,610,436 | |
| Lipopolysaccharide, E.Coli (LPS) | Calbiochem | 437627 | |
| 2D clean-up kit | GE Healthcare | 80-6484-51 | |
| RPMI 1640 medium, glutamax supplement | Gibco | 61870044 | |
| HEPES 1 M | Gibco | 15630-080 | |
| MEM Non-Essential Amino Acids (NEAA) Solution 100X | Gibco | 11140-035 | |
| Phosphate Buffered Saline (PBS) 1X | Gibco | 14190-094 | |
| Harvard Apparatus column Reverse C18 micro spin column | Harvard Apparatus | 74-4601 | |
| EDTA 0.5 M, pH 8.0 | Invitrogen | AM9260G | |
| NuPAGE Bis-Tris 4-12% | Life Technologies SAS | NP0321 BOX | |
| CD14 Microbeads human | Miltenyi Biotec | 130-050-201 | |
| MACS separation column LS | Miltenyi Biotec | 130-042-401 | |
| Macrophage colony-stimulating factor (M-CSF) | Miltenyi Biotec | 130-096-485 | |
| Interleukin 4 (IL4) | Miltenyi Biotec | 130-093-917 | |
| Interleukin 13 (IL13) | Miltenyi Biotec | 130-112-410 | |
| Interferon gamma (INFγ) | Miltenyi Biotec | 130-096-482 | |
| CD14-FITC (clone TÜK4) | Miltenyi Biotec | 130-080-701 | |
| MACSmix Tube Rotator | Miltenyi Biotec | 130-090-753 | |
| Trifluoroacetic Acid (TFA) | Pierce | 28904 | |
| Trypsin/Lys-C Mix | PROMEGA | V5073 | |
| Complete Mini, EDTA-free Protease Inhibitor cocktail | Roche | 11836170001 | |
| Density Gradient Solution (Histopaque 1077) | Sigma Aldrich | 10771-100ML | |
| Accumax | Sigma Aldrich | A7089-100ML | |
| Human Serum from human male AB plasma (SAB) | Sigma Aldrich | H4522-100ML | |
| Bovine Serum Albumin (BSA) solution 30% | Sigma Aldrich | A9576-50ML | |
| Trisma-base | Sigma Aldrich | T1503 | |
| Glycerol | Sigma Aldrich | 49767 | |
| β-Mercaptoethanol | Sigma Aldrich | M3148 | |
| Bromophenol blue | Sigma Aldrich | 114405 | |
| Sodium Dodecyl Sulfate (SDS) 20% | Sigma Aldrich | 5030 | |
| Ammonium bicarbonate | Sigma Aldrich | 9830 | |
| Acetonitrile | Sigma Aldrich | 34888 | |
| Dithiothreitol | Sigma Aldrich | 43819 | |
| Iodoacetamide | Sigma Aldrich | 57670 | |
| Thiourea | Sigma Aldrich | T8656 | |
| CHAPS | Sigma Aldrich | C9426 | |
| Micro BCA Assay Kit | ThermoFisher | 23235 | |
| 5 mL sterile plastic pipette | VWR | 612-1685 | |
| Thermomixer C Eppendorf | VWR | 460-0223 | |
| Sep-Pak tC18 reverse phase cartridges, 100 mg | Waters | WAT036820 |
Referências
- Okabe, Y., Medzhitov, R. Tissue biology perspective on macrophages. Nature Immunology. 17 (1), 9-17 (2016).
- Sica, A., Mantovani, A. Macrophage plasticity and polarization: in vivo veritas. The Journal of Clinical Investigation. 122 (3), 787-795 (2012).
- Murray, P. J. Macrophage Polarization. Annual Review of Physiology. 79, 541-566 (2017).
- Chinetti-Gbaguidi, G., Staels, B. Macrophage polarization in metabolic disorders: functions and regulation. Current Opinion in Lipidology. 22 (5), 365-372 (2011).
- Chow, A., Brown, B. D., Merad, M. Studying the mononuclear phagocyte system in the molecular age. Nature Reviews Immunology. 11 (11), 788-798 (2011).
- Mosser, D. M., Edwards, J. P. Exploring the full spectrum of macrophage activation. Nature Reviews Immunology. 8 (12), 958-969 (2008).
- Murray, P. J., Wynn, T. A. Protective and pathogenic functions of macrophage subsets. Nature Reviews Immunology. 11 (11), 723-737 (2011).
- Ginhoux, F., Schultze, J. L., Murray, P. J., Ochando, J., Biswas, S. K. New insights into the multidimensional concept of macrophage ontogeny, activation and function. Nature Immunology. 17 (1), 34-40 (2016).
- Xue, J., et al. Transcriptome-based network analysis reveals a spectrum model of human macrophage activation. Immunity. 40 (2), 274-288 (2014).
- Csete, M. Oxygen in the cultivation of stem cells. Annals of the New York Academy of Sciences. 1049, 1-8 (2005).
- Johansson, A., et al. Functional, morphological, and phenotypical differences between rat alveolar and interstitial macrophages. American Journal of Respiratory Cell and Molecular Biology. 16 (5), 582-588 (1997).
- Pfau, J. C., Schneider, J. C., Archer, A. J., Sentissi, J., Leyva, F. J., Cramton, J. Environmental oxygen tension affects phenotype in cultured bone marrow-derived macrophages. American Journal of Physiology. Lung Cellular and Molecular Physiology. 286 (2), L354-L362 (2004).
- Grodzki, A. C. G., Giulivi, C., Lein, P. J. Oxygen tension modulates differentiation and primary macrophage functions in the human monocytic THP-1 cell line. PLoS One. 8 (1), e54926(2013).
- Court, M., Petre, G., Atifi, M. E., Millet, A. Proteomic Signature Reveals Modulation of Human Macrophage Polarization and Functions Under Differing Environmental Oxygen Conditions. Molecular & Cellular Proteomics. 16 (12), 2153-2168 (2017).
- Cox, J., et al. Accurate proteome-wide label-free quantification by delayed normalization and maximal peptide ratio extraction, termed MaxLFQ. Molecular & Cellular Proteomics. 13 (9), 2513-2526 (2014).
- Cox, J., Neuhauser, N., Michalski, A., Scheltema, R. A., Olsen, J. V., Mann, M. Andromeda: a peptide search engine integrated into the MaxQuant environment. Journal of Proteome Research. 10 (4), 1794-1805 (2011).
- Shevchenko, A., Tomas, H., Havlis, J., Olsen, J. V., Mann, M. In-gel digestion for mass spectrometric characterization of proteins and proteomes. Nature Protocols. 1 (6), 2856-2860 (2006).
- Court, M., et al. Toward a standardized urine proteome analysis methodology. Proteomics. 11 (6), 1160-1171 (2011).
- Wiśniewski, J. R., Zougman, A., Nagaraj, N., Mann, M. Universal sample preparation method for proteome analysis. Nature Methods. 6 (5), 359-362 (2009).
- Liebler, D. C., Ham, A. -J. L. Spin filter-based sample preparation for shotgun proteomics. Nature Methods. 6 (11), 785-786 (2009).
- Hubner, N. C., Ren, S., Mann, M. Peptide separation with immobilized pI strips is an attractive alternative to in-gel protein digestion for proteome analysis. Proteomics. 8 (23-24), 4862-4872 (2008).
- Park, J., et al. Informed-Proteomics: open-source software package for top-down proteomics. Nature Methods. 14 (9), 909-914 (2017).
- Richter, A., Sanford, K. K., Evans, V. J. Influence of oxygen and culture media on plating efficiency of some mammalian tissue cells. Journal of the National Cancer Institute. 49 (6), 1705-1712 (1972).
- Packer, L., Fuehr, K. Low oxygen concentration extends the lifespan of cultured human diploid cells. Nature. 267 (5610), 423-425 (1977).
- Lengner, C. J., et al. Derivation of pre-X inactivation human embryonic stem cells under physiological oxygen concentrations. Cell. 141 (5), 872-883 (2010).
- Sidoli, S., Kulej, K., Garcia, B. A. Why proteomics is not the new genomics and the future of mass spectrometry in cell biology. Journal of Cell Biology. 216 (1), 21-24 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados