Method Article
Полисома профилирование лейшманий, клетки человека и мыши яичка
В этой статье
Резюме
Общая цель Полисома метод профилирования является анализ поступательной деятельности индивидуальных mRNAs или транскриптом mRNAs во время синтеза белка. Этот метод имеет важное значение для исследования регулировка синтеза протеина, перевод активации и репрессий в области здравоохранения и несколько заболеваний человека.
Аннотация
Надлежащего белков в нужное время и в правильном количестве является основой нормальной клеточной функции и выживания в быстро меняющейся среде. Для долгое время исследования выражение гена были преобладаны исследований на уровне транскрипционный анализ. Однако устойчивого состояния уровня мРНК не хорошо коррелируют с производства белка, и переводимости mRNAs варьируется в зависимости от условий. В некоторых организмов, как паразит лейшманийвыражение протеина регулируется главным образом на уровне поступательное. Недавние исследования показали, что белки перевод dysregulation связан с раком, метаболические, нейродегенеративных и других болезней человека. Полисома профилирование является мощный метод для изучения белков перевод правил. Это позволяет измерить поступательного хода индивидуальных mRNAs или проверить перевод в геном масштабе. Основой этой технологии является разделение polysomes, рибосомы, их подразделений и бесплатные mRNAs во время центрифугирования от цитоплазмы lysate через градиент сахарозы. Здесь мы представляем универсальный Полисома профилирования протокол, используемый на трех различных моделей - паразит лейшмании основных, культивируемых клеток человека и животных тканей. Лейшмании клетки свободно растут в суспензии и культивируемых клеток человека растут в адэрентных монослоя, в то время как мыши яичка представляет пример тканей животных. Таким образом метод приспособлен для всех этих источников. Протокол для анализа polysomal фракций включает обнаружение отдельные уровни mRNA по RT-ПЦР, белки западной помарки и анализа рибосомной РНК электрофорезом. Этот метод может быть продлен изучение ассоциации мРНК рибосомы на уровне глубокой РНК seq транскриптом и анализ рибосомы связанных белков, масс-спектроскопии фракций. Метод можно легко регулировать другие биологические модели.
Введение
Регуляцию экспрессии генов в клетках контролируется транскрипционный анализ, посттранскрипционного и Посттрансляционная механизмами. Достижения в глубоких РНК последовательности позволяют исследования уровни mRNA установившегося в геном масштабе на беспрецедентном уровне. Однако последние результаты показали, что уровень мРНК установившегося не всегда коррелируют с белком производства1,2. Судьба отдельных транскрипт является очень сложным и зависит от многих факторов, как внутренних/внешних раздражителей, стресс и т.д. Регуляцию экспрессии генов во время синтеза белка обеспечивает еще один уровень управления выражений, необходимых для быстрого реагирования в изменяющихся условиях. Полисома (или «polyribosome»), профилирование, разделения и визуализация активно перевода рибосомы, является мощный метод для изучения регуляции синтеза белка. Хотя, его первый экспериментальный приложений появилась в 1960-х3, Полисома профилирование является в настоящее время одним из наиболее важных методов в белок перевод исследования4. Один мРНК могут быть переведены на более чем один рибосомы, приводит к образованию Полисома. Стенограммы может быть тупик на рибосомах с циклогексимида5 и мРНК, содержащих различное количество polysomes могут быть разделены в процессе ректификации Полисома сахарозы градиента ultracentrifugation6,7 , 8 , 9. анализ РНК polysomal фракций затем позволяет измерение изменений в трансляционной государствах индивидуальных mRNAs генома масштабе и в ходе различных физиологических условиях4,7, 10. метод также использовался для раскрыть роль 5' УТР и 3' УТР последовательностей в контроле мРНК переводимости11, изучить роль адаптивной трансляционная репрессий12, выявления дефектов в рибосома биогенеза13 и понять роль белков рибосомы связанные с заболеваний человека14,15. В течение последнего десятилетия растущая роль для регуляции экспрессии генов в процессе перевода выяснилось, что свидетельствует о его важности в заболеваниях человека. Свидетельство для трансляционного управления в рак, метаболические и нейродегенеративных заболеваний является подавляющее15,16,,17-18. К примеру, способствует регуляции eIF4E-зависимых трансляционная управления аутизмом связанных с дефицитом15 и FMRP участвует в тупик рибосом на мРНК, связанных с аутизмом14. Таким образом polysomal профилирование является очень важным инструментом для изучения дефекты в трансляционной регулирования в нескольких заболеваний человека.
Анализ протеина polysomal фракций при различных физиологических условиях рассекает функцию факторов, связанных с рибосомами в процессе перевода. Был использован метод профилирования Полисома у многих видов, включая дрожжи, клетки млекопитающих, растения и простейшие10,19,,2021. Протозойные паразитами Trypanosoma и лейшмании выставку ограниченное управление транскрипционный анализ экспрессии генов. Геномы организуются в полицистронная гена кластеры, которые не регулируются промоутер транскрипции22. Вместо этого экспрессии генов развития преимущественно контролируется на уровне перевода протеина и стабильность мРНК в Трипаносоматиды видов23,24. Таким образом понимание трансляционная управления при отсутствии регуляцию особенно важное значение для этих организмов. Polysomal профилирование является мощным инструментом для изучения посттранскрипционного регуляцию экспрессии генов в лейшмании25,26,27,28.
Недавний прогресс в обнаружения индивидуальных mRNAs уровней в режиме реального времени количественного PCR (RT-ПЦР) и полным транскриптом секвенирование нового поколения, а также технологий протеомики, приносит резолюции и преимущества polysomal профилирования на новый уровень. Использование этих методов может быть продлен путем анализа отдельных polysomal фракций, глубокие последовательности РНК, в сочетании с протеомного анализа для мониторинга трансляционная состояния клеток в геном-масштабе. Это позволяет выявлять новых молекулярных игроков, регулирующие перевод различных физиологических и патологических условиях. Здесь мы представляем универсальный Полисома профилирования протокол, используемый на трех различных моделей: паразит лейшмании крупных, культивируемых клеток человека и животных тканей. Мы представляем рекомендации по подготовке lysates клетки из разных организмов, оптимизация условий градиента, выбор РНКазы ингибиторов и применение RT-ПЦР, Западная помарка и электрофорез RNA для анализа Полисома фракции в этом исследовании.
протокол
Всех животных лечения и обработки тканей, полученных в ходе исследования были выполнены согласно протоколов, одобренных институциональный уход животных и использования Комитетом на Texas Tech университете центра науки здоровья в соответствии с национальными институтами Здоровья животных руководящих принципов, номер протокола 96005. Пожалуйста пожертвовать позвоночных животных и подготовить ткани согласно руководящим принципам институциональный уход животных и использование Комитета. Если не хватает такого комитета, обратитесь к руководящим принципам национальных институтов здравоохранения животных. Взрослый (> 60 день старого) использовались мышей C57BL/6. Все животные и тканей были получены согласно протоколов, одобренных институциональный уход животных и использования Комитетом на Texas Tech университета медицинских наук центр в соответствии с руководящими принципами национальных институтов здоровья животных. Для эвтаназии, одной мыши был помещен в небольшой камере, и воздух был постепенно смещен с около 30% двуокиси углерода анестезировать и свести к минимуму страдания животного. После прекращения дыхания мы использовали шейки матки дислокации для подтверждения смерти животного до уборки тканей.
Предупреждение: Вся работа с живой Leishmania и культивируемых клеток человека было сделано в области биобезопасности, кабинет в сертифицированные лаборатории BSL-2.
1. Подготовка цитоплазматических лизатов от лейшмании основных , культивируемых клеток человека и мыши тканей
Примечание: Есть некоторые различия в lysate препаратов из различных исходных материалов. Другие шаги, включая подготовку градиент сахарозы и polysomal фракционирование идентичны и не зависит от источника выборки.
-
Лейшмании основных цитоплазматических lysate подготовка
- Прививать клеток лейшмании основных (штамм FV1) в 30 мл 1 x M199 средние29 содержащие смесь плода Bovine сыворотки (ФБС) и пенициллин/стрептомицина 10% (100 единиц и 100 мкг/мл соответственно)на плотность 1 х 105 клеток/мл .
Примечание: Все шаги с участием клеток лейшмании основных должны проводиться в биобезопасности кабинета. - Место клетки в инкубаторе и расти их при 27 ° C до этапа логарифмической (середине журнала соответствует 5 х 106 клеток/мл). Обычно это занимает около двух дней расти.
- Добавьте циклогексимида лейшмании основные культуры до конечной концентрации 100 мкг/мл арест рибосомы на переведенные мРНК. Нейроны места обратно в инкубаторе для 10 мин при 27 ° C.
- После завершения лечения циклогексимида, клетки перехода к 50 мл Конические трубки и спина их на 1800 x g и 4 ° C на 8 мин удалить супернатант.
- Вымойте клетки с 30 мл Дульбекко фосфатный буфер (DPBS). Центрифуга на 1800 x g и 4 ° C на 8 мин.
- Выбросите супернатант. Ресуспензируйте клеток в 1 мл DPBS.
- Возьмите Алиготе клеток и смешать его с раствором формальдегида 3,5%.
- Подсчет количества ячеек, Горяева и определения их концентрации. Перенесите нужное количество клеток в трубу отцентрифугировать. Lysate готовится из 0.5x108-2 x 108 клеток/мл достаточно для одного сахарозы градиента загрузки.
- Спиновые клетки на 1800 x g и 4 ° C на 8 мин удалить супернатант.
- Ресуспензируйте Пелле клеток на льду в 1 мл буфера lysis, содержащий битор протеазы и иы АБС битор РНКазы (20 мм HEPES-Кох, рН 7,4, 100 мм KCl, 10 мм MgCl2, 2 мм DTT, 1% NP-40, 1 x ингибитор протеазы коктейль (ЭДТА бесплатно), АБС битор РНКазы 200 единиц/мл).
- Пройти lysate 23-иглы в три раза. Lysate должно стать прозрачной после прохода через иглу.
- Центрифуга 11200 x g и 4 ° C на 10 минут, чтобы уточнить lysate. Передавать топленое lysate свежие трубки и держать его на льду до сахарозы градиента ultracentrifugation.
- Собрать 400-500 мкл lysate вход (для последующего анализа), заморозить его сразу в жидком азоте для анализа будущих белка или добавить РНК очистки реагента до замораживания для анализа РНК.
- Прививать клеток лейшмании основных (штамм FV1) в 30 мл 1 x M199 средние29 содержащие смесь плода Bovine сыворотки (ФБС) и пенициллин/стрептомицина 10% (100 единиц и 100 мкг/мл соответственно)на плотность 1 х 105 клеток/мл .
-
Цитоплазматическая lysate подготовка из искусственного человеческих клеток HeLa
- Разделение клетки HeLa и семян их в 20 мл среды DMEM, содержащие 10% FBS и пенициллин/стрептомицина смесь (100 единиц и 100 мкг/мл соответственно) с ячейкой граф 2 x 105 клеток/мл в пластине 15 см.
- Рост клеток HeLa при 37 ° C, 5% CO2 на 20-24 ч. выполнять плазмида ДНК трансфекции согласно производителя протоколы.
- Распространять клетки для 24 ч после трансфекции при 37 ° C, 5% CO2.
- Добавьте циклогексимида выращенные клетки HeLa в конечной концентрации 100 мкг/мл арест рибосомы на переведенные мРНК и инкубации клеток в течение 10 минут при 37 ° C, 5% CO2. Аспирационная среднего. Вымойте клетки дважды с холодной DPBS на льду.
- Добавьте 500 мкл буфера lysis (20 мм HEPES-Кох рН 7,4, 100 мм KCl, 5 мм MgCl2, 1 мм DTT, 0,5% NP-40, 1 x ингибитор протеазы коктейль (ЭДТА бесплатно), 200 единиц/мл РНКазы ингибитор или 1 мг/мл гепарина) к пластине и циклюют клетки на льду.
- Лизированных клетках передать трубку отцентрифугировать. Отрегулируйте концентрацию NP-40 до 0,5% и2 MgCl до 5 мм в соответствии с увеличением объема выборки.
- Пройти lysate 23-иглы 3 - 6 раз.
- Спина на 11200 x g и 4 ° C на 8 минут, чтобы уточнить lysate. После центрифугирования передать новой трубки супернатант. Используйте спектрофотометр для оценки эффективности лизис клетки и определить объем выборки для погрузки на градиенте. Добавить 10 мкл пример 0,5 мл 0,1% додецилового сульфата натрия (SDS). Пустой против 0,1% SDS. Измерение оптической плотности на 260 Нм. Значение ожидаемого поглощения составляет около 15-20 единиц/мл.
- Разбавьте все образцы с буфера lysis то же значение поглощения до сахарозы градиентного центрифугирования. Храните пробы на льду до сахарозы градиентного центрифугирования.
-
Цитоплазматическая lysate подготовка от мыши яичка
- Вскрыть мыши яичка. Сделать небольшой надрез в белочной и собирать семенных канальцев яичек и передавать их в 15 мл конические трубка, содержащая 5 мл DPBS, дополненный 0,1 мм phenylmethylsulfonyl фторид (PMSF).
- Смешайте ткани энергично переворачивать несколько раз. Разрешить ткани, чтобы поселиться в подразделение гравитации на льду на 5 мин.
- Снимите и выбросьте облачно буфер, содержащий соединительной клетки и фрагменты тканей. Повторите процедуру 2-3 раза. Оставшиеся белые гранулы обогащается семенных канальцев и клетки семенозачатка.
- Передать 2-мл пробирку microcentrifuge Пелле семенных канальцах и спина на 500 г x 1 мин отбросить супернатант.
- Добавьте 500 мкл буфера lysis (20 мм трис-HCl, рН 7,4, 100 мм KCl, 5 MgCl2, 1 мм DTT, 0,5% NP-40, 1 x ингибитор протеазы коктейль (ЭДТА бесплатно), 1 мг/мл гепарина или 200 единиц/мл битор РНКазы) трубочки. Использование пипетки для нарезанных ткани.
- Передать небольшой подвески (0,5-1,0 мл) Dounce гомогенизатора. Нарушить ткани с семи до восьми штрихами стекло пестика.
- Трансфер lysate пробки microcentrifuge 1,5 мл.
- Центрифугуйте образцы в 12000 x g и 4 ° C на 8 минут, чтобы очистить lysate. Передать супернатант новой трубки и магазин на льду до погрузки на сахарозу градиента.
- Соберите 50 мкл lysate как входной выборки, заморозить его сразу на-80 ° C для анализа будущих белка; или добавить РНК очистки реагента до замораживания для анализа РНК.
2. сахароза градиента подготовка и Ultracentrifugation
- Подготовьте два сахарозы градиента решения (20 мм HEPES-Кох, рН 7,4, 100 мм KCl, 10 MgCl2, 1 мм DTT, 1 x ингибитор протеазы коктейль), содержащие 10% сахарозы или 50%-ая сахароза. (Tris-HCl, рН 7,4, может использоваться вместо HEPES). Добавьте 200 единиц/мл РНКазы ингибитор или 1 мг/мл гепарина согласно экспериментальный дизайн. Поместите ультрацентрифуга трубка для SW 41 ротора в блоке маркер и нарисуйте линию вдоль верхнего уровня блока. Перенесите трубку в стабильной стойку.
- Возьмите шприц 10 мл с наслаивать устройство и наполнить шприц раствор 10%-ая сахароза (подготовлен как выше). Осторожно выпустить его в нижней части трубки ультрацентрифуга пока достигнет отметки на трубе.
- Заполнить еще один шприц с 50% раствора сахарозы и осторожно вставьте устройство ее слоев через слой 10% сахарозы в нижней части трубки. Осторожно отпустите раствора сахарозы, начиная снизу, пока он не достигнет отметки на трубе. Уплотнение трубку с предоставленного Кап.
- Подготовить градиент сахарозы, включите устройство создатель градиента на. Уровень пластину, используя вверх или вниз кнопки и нажмите кнопку Готово. Выравнивания имеет важное значение для линейность градиента.
- После выравнивания пластины пресс град , чтобы открыть меню «Градиент». Перейти к списку градиента в меню и выберите SW 41 Ti ротора. Затем выберите желаемый сахарозы градиент из списка в меню с помощью кнопок вверх и вниз . Пресс использования.
- Место градиента Трубодержатель на пластину создатель градиента. Перенесите трубку в держатель. В то же время можно приготовить до 6 градиентов. Нажмите кнопку запустить. Создатель градиента поворот трубы на запланированных скорость и углами, образуя линейный градиент. Это займет всего несколько минут, чтобы подготовить градиента.
- Когда процесс завершится, место трубы в стойку. Снимите крышки. Удалите том же томе объема образца из верхней части трубки ультрацентрифугирования.
- Тщательно нагрузка 400-500 мкл lysate содержащих 15-20 A260 единиц polysomes на вершине. Трубы в ротор ведра и сбалансировать их.
- Центрифуга на 260 000 x g и 4 ° C на 2 ч с использованием SW 41 ротора.
3. Полисома фракционирования и сбор проб
Примечание: Хотя lysate препараты имеют некоторые отличия в зависимости от источника, градиента протоколы фракционировки подготовка и Полисома являются одинаковыми для всех типов лизатов.
- После завершения ultracentrifugation место ротора ведра с трубками на льду. Поверните коллектор фракций и градиента фракционатор ON. Нажмите кнопку Сканировать в фракционатор меню. Положите стойку с 24 коллекции трубок в коллектор фракций.
- Заполните вверх промойте резервуар на стороне фракционатор деионизированной водой. Нажмите клавишу ПОЛОСКАНИЯ , для 10 s промывать насос на фракционатор. Прикрепите промыть адаптер с шприц с водой с поршнем для калибровки.
- Откройте фракционатор программного обеспечения на компьютере. Пресс калибровки. Использовать параметры по умолчанию и нажмите кнопку ОК. Будьте готовы придать воды из шприца.
- Нажмите OK , чтобы сделать калибровки. Сразу же начать инъекционных воды для следующих 5 s. В это время вода будет течь через ячейку потока УФ детектор и инструмент будет откалиброван. Знак Завершения калибровки нуля будет отображаться. Документ готов для фракционирования.
- Удалите адаптер полоскания с шприца. Присоедините наконечник для поршневых фракционатор.
- Откройте латунь воздушного клапана и пресс воздуха ключ для 10 s сухой трубы и потока клеток. Закройте клапан воздуха.
- Аккуратно удалите градиента трубки из ведра ротора и поместите его в стойке. Применить Крышка держателя трубки в верхней части трубки и тщательно переместите трубку в держатель шланга для и зафиксируйте ее в положении.
- Установите держатель под поршень фракционатор. Часто можно увидеть polysomal полос на глаз. Ввести нужные параметры для дроби числа и объема (24 фракций на 500 мкл/фракция обычно достаточно). Назовите файл соответствующим образом. Нажмите кнопку ОК, а затем Перейти к ДИАГРАММЕ кнопку. В следующем окне нажмите кнопку Начать сканирование. Параметры будут отображаться, нажмите кнопку ОК. Коллектор будет двигаться от желоба в первой фракцией и поршень будет двигаться в трубу. Когда поршень достигает верхней части градиента он будет медленным для выбранной скорости и фракции будут собраны. После завершения, Поршень движется из градиента трубки.
- Откройте латунь воздушного клапана и пресс воздуха ключ на фракционатор для извлечения последнего фракция.
- Перемещение трубы из стойки на льду.
- Добавьте 2 тома РНК очистки реагента для каждой фракции и flash замораживание в жидком азоте до РНК. В качестве альтернативы если белка необходимо проанализировать, добавьте трихлоруксусной кислоты в конечной концентрации 10% сосредоточить их для западный blotting (см. раздел 8).
4. Подготовка синтезированную РНК In Vitro для нормализации mRNAs уровни во время анализа данных RT-ПЦР
Примечание: E. coli ОмПО мРНК используется в этом протоколе для нормализации. Любые другие РНК, которые не имеют обширные личность с мРНК изучал организма (млекопитающих или лейшмании) могут быть использованы.
- Подготовьте фрагмент ОмПО ДНК, содержащие SP6 промоутер последовательность стандартной реакции PCR от плазмида, содержащие ОмПО гена30.
- Подготовка 100 мкл смеси: 80 мм HEPES-Кох, pH 7.5, 16 мм MgCl2, 2 мм спермидина, 10 мм DTT, 3 мм СПС, 3 мм CTP, 3 мм UTP, 3 мм ГТФ, 0,5 U/мкл РНКазы ингибитор, 1 мкг ОмПО ПЦР ДНК, 3 мкл SP6 РНК-полимеразы , Пирофосфатаза 0,005 U/мкл.
- Инкубируйте на 40 ° C на 2 ч.
- Очищайте РНК, РНК комплект очистки.
- Измерения концентрации в спектрофотометре и изучить электрофорезом геля агарозы.
5. РНК изоляции от градиента дроби и cDNA подготовка
Примечание: Перейти непосредственно с настоящим Протоколом для РНК если битор РНКазы использовался как Ингибитор рибонуклеазы. Однако когда используется как Ингибитор рибонуклеазы, гепарина будет тормозить обратной транскриптазы, используемых в подготовке cDNA. Таким образом будет необходимо дополнительная очистка РНК если гепарин был использован в буфер lysis и градиент. Смотрите раздел 6 подготовить РНК для синтеза cDNA, если был использован гепарина.
- Оттепель образцы, содержащие РНК очистки реагента, добавить 20 нг синтезированную РНК как внутреннего контроля для нормализации RT-ПЦР результаты. Приступайте к подготовке РНК согласно протоколу производителя за исключением одной модификации. 1 мкл РНК класс гликогена (20 мкг) предварительного изопропанол осадков. Растворяют гранулы РНК в 20-25 мкл РНКазы свободной воды.
Примечание: Гликогена служит носителем и помогает избежать потерь и визуализировать РНК Пелле во время очистки. ОмПО мРНК используется для дальнейшей нормализации в RT-ПЦР-реакции. - Измерение концентрации РНК с помощью спектрофотометра для обеспечения адекватного урожайности. Комбинировать равных объемах РНК фракций, содержащих 40, 60 и monosomes как prepolysomes. Фракций, содержащих 2-4 рибосомы комбинировать как свет polysomes и фракций с 5-8 рибосомы комбинировать как тяжелый polysomes.
- Используйте 5-10 мкл РНК из комбинированных фракций для подготовки cDNAs с использованием комплекта и следуя рекомендациям изготовителя.
- Добавьте 80 мкл нуклеиназы свободной воды 20 мкл cDNA. Замораживание образцов cDNA-20 ° C.
6. РНК очистка от загрязнения гепарин
Примечание: Гепарин угнетает нуклеиновых кислот, переработки ферментов, таких как обратной транскриптазы. Таким образом используйте этот протокол дополнительной очистки, когда гепарина используется в литического буфера и/или градиента.
- Добавьте LiCl 1 М конечная концентрация очищенного образцов РНК.
- Смешать образцы и инкубировать на льду за 1 час.
- Спиновые образцы на 16000 x g и 4 ° C на 15 мин.
- Удалите как можно с помощью пипетки полной супернатант.
- Просушите гранулы для около 5 мин.
- Вновь приостановите гранулы в начальный объем РНКазы свободной воды.
- Спектрофотометрические измерения на 260 Нм для определения концентрации РНК. Как правило потеря образца является минимальным.
7. RT-ПЦР и данных анализа распределения мРНК
- Объединить 10.2 мкл воды, 20 мкл SYBR зеленый, 4.8 мкл конкретных праймеров гена (набор 2,5 мкм), 5 мкл cDNA, хорошо перемешать и загрузить 10 мкл на хорошо в triplicates знаке 384-хорошо.
- Крышка с самоклеющаяся пленка плотно и центрифуги пластины на 1800 x g за 5 мин.
- С помощью ПЦР в реальном времени инструмент создан ПЦР-реакции в условиях показано в таблице 1.
- С помощью цикла порога (TC) значения и сравнительный метод CT (ΔΔCТ)31 вычислить процент (%) распределения мРНК в prepolysomes, легких и тяжелых polysomes как описано32 с одним изменением. Использование синтетических РНК (ОмПО здесь) для нормализации данных в RT-ПЦР анализа данных. Синтезированную РНК предоставляет элемент управления нормализации, который позволяет рассчитать уровни относительной мРНК и сравнить их в различных фракций градиента.
8. Анализ белков в Polysomal фракций, западный Blotting
- От 100% (w/v) запас добавить трихлоруксусной кислоты (TCA) в отдельных фракций (500 мкл) до конечной концентрации на 10%, держать на льду, по крайней мере 15 мин, центрифуги в отцентрифугировать за 5 мин, отменить супернатанта, мыть дважды с ледяной ацетона и растворяют в 25 мкл S DS-страница загрузки буфер образца для электрофореза.
- Нагрузка на SDS-PAGE и проводить стандартные электрофорез с следующей передачи PVDF мембрану. Перейти к западной blotting33.
Результаты
В этом исследовании, мы описывают применение polysomal метод профилирования для трех разных источников: паразитарные лейшмании крупных, культивируемых клеток человека и мыши яичка. Клеток лейшмании свободно расти в жидких средах в суспензии, культивируемых клеток человека растут в адэрентных монослоя на тарелки, и яички мыши представляет собой образец ткани. Этот метод можно легко отрегулировать для других типов свободно выросли клеток в суспензии, различные типы тканей, или из другого организма и различные виды культивируемых клеток. Этот подход состоит из четырех основных шагов: lysate подготовки, сахароза градиента подготовка и ultracentrifugation шаг, Полисома фракционирования и образец коллекции следуют анализ фракций. Клетки из разных источников собираются, промывают и анализироваться в буфера lysis проход через иглу или Dounce гомогенизатор. Центрифугирование используется для удаления мусора клеток, уточнения lysate. Схема градиента фракционирование показана на рисунке 1A. Градиент непрерывной Сахароза образуется путем смешивания 10% и 50% сахарозы решений в создатель градиента. Lysate загружается на вершине градиента. Ultracentrifugation отделяет мРНК, связанные с различное количество рибосом, который контролируется УФ детектор во время фракционирования, образуя собственный абсорбция спектра. Собранные фракции используются для анализа РНК и белков (рис. 1B). РНК могут быть проанализированы электрофорезом следуют Северная помарка или используются для производства cDNA, следуют реакции RT-ПЦР для анализа ассоциации индивидуальных mRNAs с polysomes. Секвенирование нового поколения могут использоваться для анализа трансляционная статус mRNAs на геном-масштабе7. Для анализа белка polysomal фракций белки осаждаются трихлоруксусной кислотой сконцентрировать их. Белки затем анализируются западных blotting или масс-спектроскопии на уровне протеома.
Типичный polysomal профиль, образующиеся лейшмании основных активно развивается культура показан на рисунке 2A. Граф поглощения фракционирования имеет собственный форму с типичной пики для рибосома субблоков (40 и 60), единого рибосомы, (80 или monosomes) и polysomes.
Количественного RT-PCR (RT-ПЦР) использовалась для обнаружения ассоциации отдельных лейшмании мРНК рибосомы и polysomes. Сравнительный метод31 CT (ΔΔCТ) является простой и соответствующий подход для изучения уровня относительной mRNAs в клетках. Этот метод требует внутреннего контроля (стабильная мРНК, которая не изменяет выражение во время лечения или условий эксперимента) для расчетов. Однако существует нет внутреннего контроля в polysomal фракций, потому что уровни mRNA или рибосомной РНК будет варьироваться в фракции, в зависимости от их связи с рибосомами, polysomes и др. Для решения проблемы внутреннего контроля, мы использовали синтетический бактериальных ОмПО мРНК для нормализации относительной отдельные уровни mRNA лейшманий в дробей. ОмПО мРНК синтезированные в пробирке и добавляется каждой фракции до экстракции РНК в равных количествах. Добавлением синтетических РНК имеет важное значение, потому что это делает вычисления RT-ПЦР данных более точным, выступающей в качестве внутреннего контроля для вычисления методом сравнительного CT (ΔΔCТ).
Аликвоты градиента фракций были смешаны в три группы: prepolysomes (субъединиц и monosomes), легкие polysomes (состоящий из 2-4 рибосомы) и тяжелых polysomes (состоящий из 5-8 рибосомы). RT-ПЦР была исполнена на РНК из комбинированных фракций для анализа распределения mRNA между этими комбинированных фракций (рис. 2B). 18s рибосомной РНК использовался в качестве элемента управления. Его относительных уровней определяется RT-ПЦР коррелирует с предполагаемое распределение малых субъединиц рибосомальной (свободной субъединицы и как часть monosomes и polysomes) на спектре. RT-ПЦР анализ показал, что индивидуальных mRNAs испытания имеют разную степень участия в перевод этапе логарифмической лейшмании роста. Тубулин мРНК связан преимущественно с тяжелой polysomes, предлагая эффективный перевод. В отличие от Sherp мРНК находится прежде всего с prepolysomes и легких polysomes поддержки менее активным перевода по сравнению с тубулин мРНК.
Выражение рекомбинантных белков в культивируемых клеток — важный экспериментальный подход в различных категорий обучения. Здесь мы представляем пример polysomal профилирования рекомбинантных белков mRNAs в другой образец источника, культивируемых клеток человека. НеЬа клетки были временно transfected с плазмид, выражая рекомбинантных муковисцидоз трансмембранной проводимости регулятор (МВТР)34 или Норри болезней белка (НДП). Спектры поглощения Полисома фракционирования от этих двух независимых культур были очень похожи и содержится собственный пиков соответствующий рибосомальной подразделения (40 и 60), monosomes (80) и polysomes (рис. 3A). Сходство в спектрах от этих экспериментов иллюстрирует воспроизводимость градиента фракционирования. Как в исследованиях, лейшмании , распределение mRNAs определяется RT-ПЦР в долях, представляющих prepolysomes, легкие polysomes и тяжелых polysomes (рис. 3B). Обнаружение РНК малых субъединицы рибосомальной 18S коррелирует с их предполагаемое распределение в спектрах. НДП mRNAs главным образом были связаны с легкой и тяжелой polysomal фракций, в то время как МВТР mRNAs главным образом были найдены в prepolysome фракций, предполагая, что НДП переводится более эффективно. В то время как НПР является относительно небольшой белок, МВТР является очень большой белок (1480 аминокислотных остатков), состоящий из нескольких доменов, которые самостоятельно раз во время перевода35. Нижних захватов МВТР мРНК с polysomes может отражать медленнее перевода, которая необходима для cotranslational складывания ее отдельных доменов.
Фракции Полисома также может использоваться для обнаружения белков. Обнаружение белков в градиента фракций было проведено на примере рибосомных белков в клетках Хела (рис. 4). Белки были сосредоточены высыпанием с 10% ГТС от фракций и Западная помарка была использована для обнаружения небольших субъединицы рибосомальной белка RPS6 и большие субъединицы рибосомальной белок RPL11 (рис. 4, верхней панели). Их распределение коррелирует с собственный пики в спектре поглощения. Эти эксперименты ясно демонстрируют, что фракции Полисома может использоваться для анализа белков в них.
Были использованы многие градиентов концентрации различных сахарозы (к примеру, 7-47%36, 5-50%7, 7-50%6 , 10-50%37, 15-50%8и другие) для polysomes фракционирования. Здесь мы сравнили два градиенты 10-50% и 17-51% (Рисунок 5). Хотя, 17-51% производимого приемлемые результаты, разделение в 10-50% градиент был общий лучше.
Это хорошо документированы, что хелатирующих агентов, таких как ЭДТА, нарушить рибосомы и polysomes8,9. Как показано на рисунке 6, лечение ЭДТА HeLa lysate до погрузки на градиент приводит к исчезновению пики, соответствующие monosomes и polysomes, и значительное увеличение субъединиц рибосом пиков. Этот эксперимент служил как элемент управления и продемонстрировал, что наблюдаемые пиков без лечения ЭДТА являются фактически рибосомных monosomes и polysomes.
Рисунок 7 показывает результаты Полисома фракционирования от мыши яичек. Спектр поглощения имеет сходство с теми, от Leishmania и НеЬа клетки: собственный вершины рибосомальной подразделения, monosomes и polysomes. Их форма и распределение производят внешний вид подписи, что делает его легко идентифицировать их на различных polysomal спектры. Всего РНК были очищены от фракции и РНК из выбранной фракции были проанализированы электрофорезом геля агарозы (рис. 7, верхней панели). Электрофорез показывает типичное распределение 18S и 28S рибосомной РНК. Их острые диапазоны указывают целостности проб. Гель может использоваться для обнаружения индивидуальных mRNAs следующих Северная помарка, или она может использоваться для оценки качества образцов до дальнейших экспериментов на RNA или протеина анализ - рассеянное рибосомной РНК, полосы указывают РНК деградации в образцах.
В ходе нашего исследования мы использовали АБС битор РНКазы и гепарин как иы АБС битор РНКазы в градиентах лизатов и сахароза. Хотя оба из них представили удовлетворительные результаты, использование АБС битор РНКазы предпочтительнее для анализа РНК, потому, что она не помешает cDNA и RT-ПЦР-реакции. Таким образом он не требует дополнительных шагов очистки РНК. Однако если исследователи решили использовать гепарина во время подготовки Полисома, помните, что гепарин угнетает вниз поток приложения, такие как RT-ПЦР и дополнительного шага очистки РНК необходим (см. раздел 6 протокол).
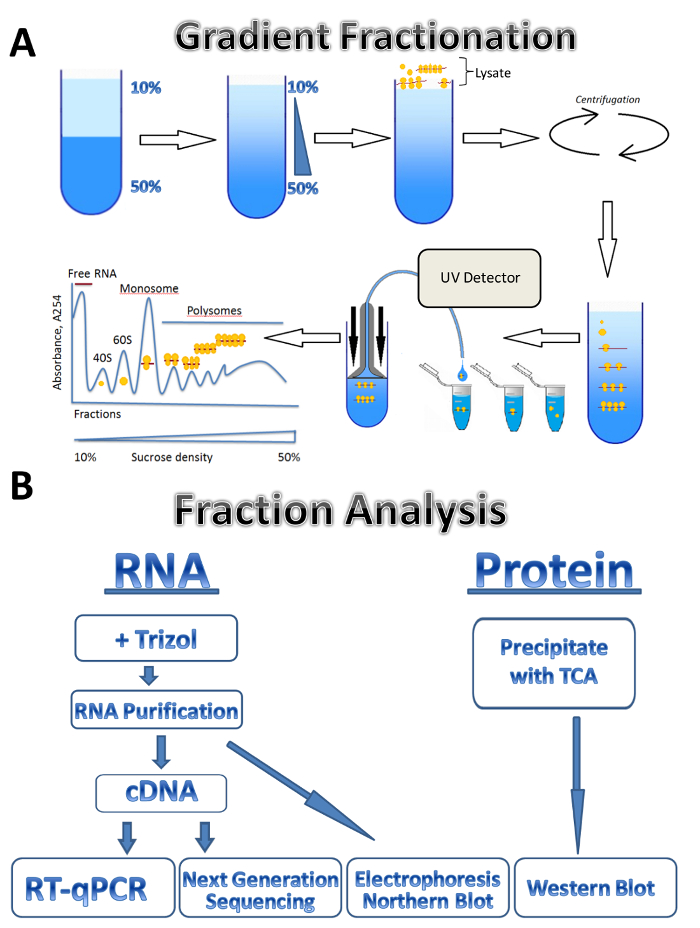
Рисунок 1 . Профилирование Полисома. (A) схема градиента подготовки, фракционирование и поглощения профиль Полисома. (B) схема анализа дроби. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
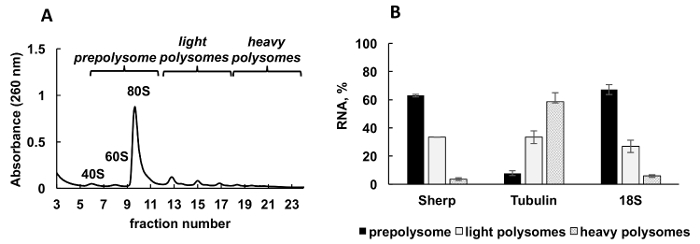
Рисунок 2 . Анализ Полисома профиля лейшмании основных культуры в логарифмической стадии роста. (A) Эндоплазматический lysate был фракционированный в 10-50% сахарозы градиента. (B) относительное распределение 18S RNA, тубулин и мРНК (%) Sherp в prepolysomes, легкие и тяжелые polysomes журнала клеток анализируемой RT-ПЦР. Фракций, содержащих 40, 60 и monosomes были объединены в prepolysomes. Дроби с 2-4 рибосомы были объединены в легких polysomes, в то время как дроби с 5-8 рибосомы сформированные тяжелых polysomes. Синтетические E. coli ОмПО мРНК добавлены фракций до РНК добыча служил нормализации управления в RT-ПЦР. Сравнительный метод31 CT (ΔΔCТ) был использован для расчета уровней мРНК. Планки погрешностей представляют собой стандартные ошибки. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
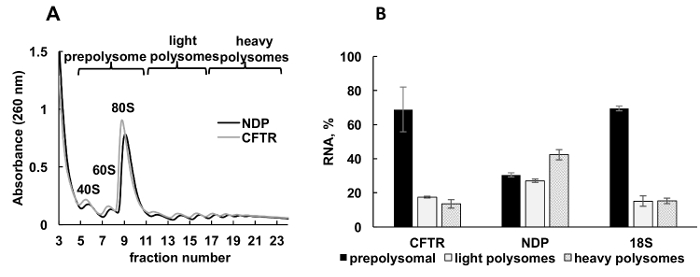
Рисунок 3 . Полисома фракционирования и анализ рекомбинатных МВТР и НДП mRNAs ассоциации с рибосомы клеток HeLa transfected плазмида ДНК с. (A) Polysomal профиль в клетки HeLa transfected с МВТР и НДП плазмид. 10% - 50% сахарозы градиент был применен для достижения разделения polysomes. Пики для малых (40 лет) и большой (60) подразделения, а также monosome (80) указаны. Фракций были объединены как показано на панели A и используется для дальнейшего анализа. (B) распределение mRNAs МВТР и НДП в различных фракций. Обнаружение 18S, RT-ПЦР был использован как элемент управления для Полисома фракционирования. РНК уровни были оценены RT-ПЦР анализа. Данные были нормализованы с использованием синтетических мРНК. Сравнительный метод31 CT (ΔΔCТ) был использован для расчета уровней мРНК. Планки погрешностей представляют собой стандартные ошибки. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
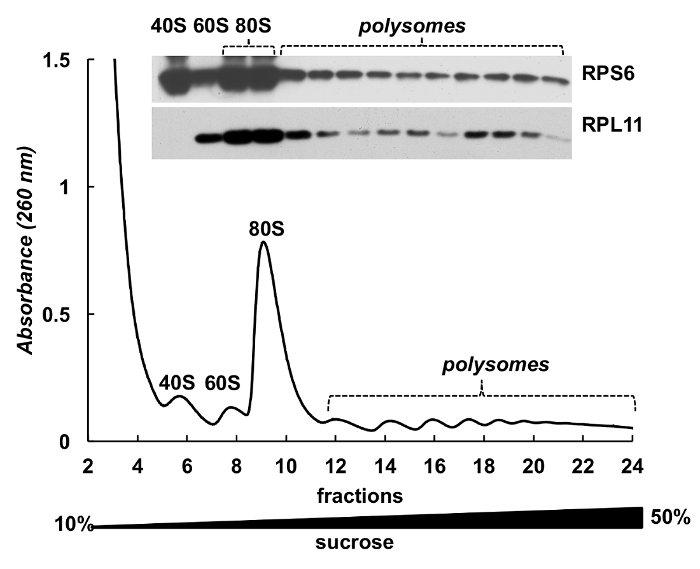
Рисунок 4 . Обнаружение рибосомных белков в polysomal фракций НеЬа. Lysate клетки HELA был подвергнут 10% - 50% сахарозы градиентного центрифугирования. Белки в отдельных фракций были химически осажденный с ГТС и проанализированы электрофорезом в 12% SDS-PAGE с following Западный blotting с помощью мыши RPS6 моноклональных и поликлональных антител RPL11 кролик как первичных антител и Peroxidase-Conjugated коза вторичные антитела анти мыши или анти кролика. Визуализация сигналов было сделано SuperSignal Запад Пико плюс Хемилюминесцентный субстрат. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
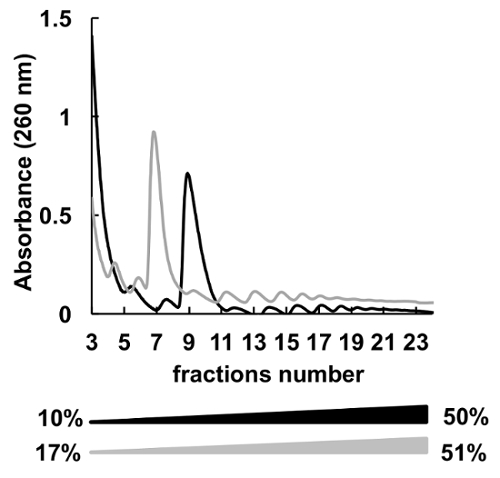
Рисунок 5 . Сравнение HeLa polysomal профилирования в 10% - 50% (черный) или градиенты сахарозы 17-51% (серый). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
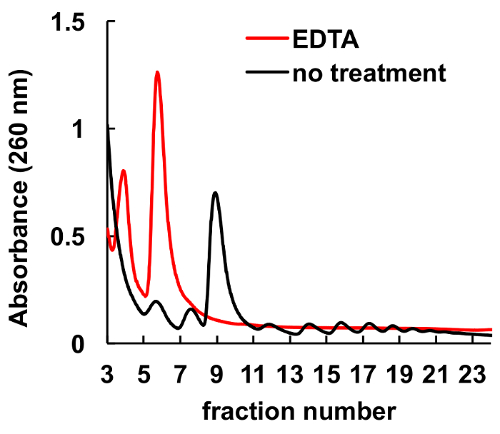
Рисунок 6 . Эффект от лечения ЭДТА на polysomal профиле в клетки HeLa. Lysate клетки HELA лечили 10 мм ЭДТА на льду за 10 мин непосредственно перед сахарозы градиентного центрифугирования. MgCl2 был заменен на 5 мм ЭДТА в сахарозу градиента решений. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
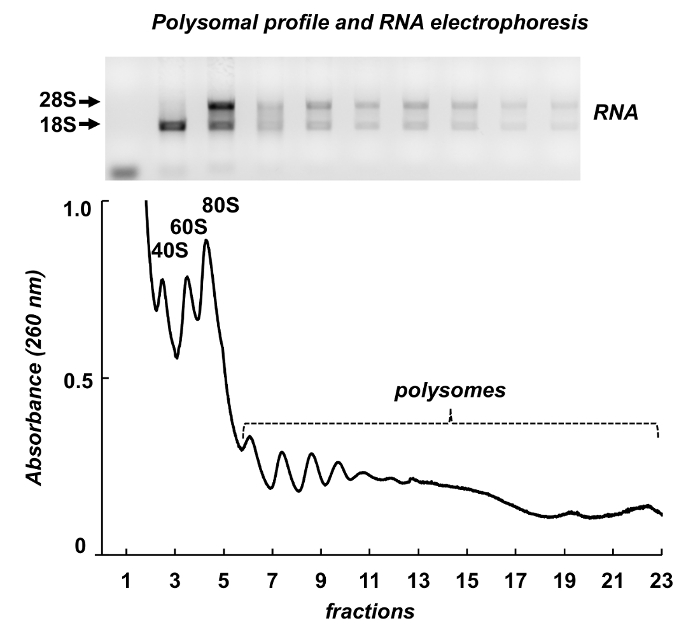
Рисунок 7 . Polysomal профиль из ткани яичка мыши lysate. Фракций были подвергнуты РНК добыча с реактивом Очистка РНК и проанализированы электрофорезом геля агарозы 1%. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Этап | Шаг | Состояние |
| Удерживайте | Шаг 1 | Повышение температуры от 25 до 50° C с 1,6 ° C/s |
| Инкубируйте на 50° C на 2:00 мин | ||
| Шаг 2 | Повышение температуры от 50 до 95° C с 1,6 ° C/s | |
| Инкубируйте на 95° C 10:00 мин | ||
| PCR | Шаг 1 | Инкубируйте на 95° C для 00:15 мин |
| Шаг 2 | Снижение температуры от 95 до 60° C с 1,6 ° C / | |
| Инкубируйте на 60° C для 1:00 мин | ||
| Количество циклов 40 | ||
| Расплава кривой | Шаг 1 | Повышение температуры от 60 до 95° C с 1,6 ° C/s |
| Шаг 2 | Снизьте температуру от 95 до 60° C с 1,6 ° C/s | |
| Инкубируйте на 60° C для 1:00 мин | ||
| Шаг 3 (диссоциация) | Повышение температуры от 60 до 95° C с 0,05 ° C/s | |
| Инкубируйте на 95° C для 00:15 мин | ||
Таблица 1. Условия для RT-ПЦР
Обсуждение
Фракционирование Полисома градиент сахарозы в сочетании с РНК и белка анализ фракций является мощный метод для анализа трансляционная статус индивидуальных mRNAs или весь translatome, а также роли факторов белков, регулирующих поступательные машины во время нормальной физиологической или болезни государства. Polysomal профилирование является метод особенно подходит для изучения трансляционная регулирование в организмов, таких как trypanosomatids, включая лейшмании где транскрипционный анализ управления практически отсутствуют и регулирование выражение гена в основном происходит в процессе перевода.
Здесь мы описываем Полисома фракционирование протокол, используемый на три модели: лейшмании паразитов, культивируемых клеток человека и мыши тканей. Полисома фракционирование шагом является по существу то же самое для разных организмов, используемых в этом исследовании; Однако lysate подготовка имеет некоторые отличия. Лейшмании клетки растут в жидком культуре и собирается центрифугированием и учитываются ячейки до лизиса для обеспечения равных загрузки на градиенте. Клетки человека можно мыть и лизированы непосредственно на пластину. Равных погрузка контролируется оптической плотности. Ткани мыши требуют Dounce гомогенизатор для эффективного лизиса в то время как в случае Leishmania и клетки человека, это достаточно пройти 23-иглы.
Все реагенты используемые должно быть РНКазы и протеазы бесплатно. Мы сравнили гепарин и АБС битор РНКазы как иы АБС битор РНКазы активности в цитоплазматических лизатов. Мы обнаружили, что оба реагентов может эффективно блокировать РНКазы. Однако гепарин влияет на нисходящие приложения, например подготовка cDNA и RT-ПЦР. В результате подготовка РНК требует дополнительной очистки шаг, когда используется гепарина. По нашему мнению АБС битор РНКазы является более удобным выбором и может эффективно использоваться в Полисома, профилирование протокол.
Polysomal профилирование является трудоемким, который является одним из основных ограничений метода. В то же время можно приготовить до шести градиентов. Градиент фракционатор генерирует 144 фракций, которые должны быть обработаны в течение короткого времени. Анализ отдельных фракций может быть трудоемким и дорогим тоже. Таким образом объединение отдельных фракций в предварительно polysomes, легкие и тяжелые polysomes обеспечивает быстрый и менее трудоемкий способ оценить переводческая деятельность индивидуальных mRNAs. Наши результаты RT-ПЦР на комбинированных фракций позволило нам выявить различия в переводимости различных мРНК в Leishmania и НеЬа клетки (на рисунках 2, 3). Однако если необходима прекрасные резолюции, то анализ отдельных фракций могут выполняться.
Рибосома профилирование является еще одним способом для изучения поступательного хода мРНК и основан на измерении производства белков через последовательность мРНК фрагментов защищены рибосома38. Эта технология обеспечивает количественную информацию, связывая последовательностями мРНК с конкретными polysomal фракций, переводится в образце и может предоставить точную информацию о ходе трансляционная mRNAs кодон разрешением по сравнению с Полисома, профилирование технологии. Однако Полисома профилирования могут использоваться для анализа РНК и белка, таким образом обеспечивая дополнительную информацию о протеома polysomes и выявить факторы, способствующие регулированию перевода.
Таким образом polysomal профилирование — это универсальный метод, который может использоваться для анализа трансляционного состояние индивидуальных mRNAs, изучить рибосомы связанных белков и трансляционная регулирования в различных модельных организмов под различные экспериментальные исследования условий.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Авторы благодарят Чинг ли за помощь с аудио записи. Исследования было поддержано запуска средства от центра Texas Tech университета медицинских наук и в центр передового опыта для Поступательное неврологии и терапии (CTNT) предоставить PN-CTNT 2017-05 AKHRJDHW A.L.K.; в части гранта NIH R01AI099380 К.Ж Джеймс C. Хаффмана и Кристен р. Baca были CISER (центр по интеграции стволовых образование и исследования) ученых и были поддержаны программой.
Материалы
| Name | Company | Catalog Number | Comments |
| Instruments: | |||
| Gradient master | Biocomp Instruments Inc. | 108 | |
| Piston Gradient Fractionator | Biocomp Instruments Inc. | 152 | |
| Fraction collector | Gilson, Inc. | FC203B | |
| NanoDrop One | Thermo Scientific | NanoDrop One | |
| Nikon inverted microscope | Nikon | ECLIPSE Ts2-FL/Ts2 | |
| 2720 Thermal Cycler | Applied Biosystems by Life Technologies | 4359659 | |
| CO2 incubator | Panasonic Healthcare Co. | MCO-170A1CUV | |
| HERATHERM incubator | Thermo Scientific | 51028063 | |
| Biological Safety Cabinet, class II, type A2 | NuAire Inc. | NU-543-400 | |
| Revco freezer | Revco Technologies | ULT1386-5-D35 | |
| Beckman L8-M Ultracentifuge | Beckman Coulter | L8M-70 | |
| Centrifuge | Eppendorf | 5810R | |
| Centrifuge | Eppendorf | 5424 | |
| Ultracentrifuge Rotor SW41 | Beckman Coulter | 331362 | |
| Swing-bucket rotor | Eppendorf | A-4-62 | |
| Fixed angle rotor | Eppendorf | F-45-30-11 | |
| Quant Studio 12K Flex Real-Time PCR machine 285880228 | Applied Biosystems by life technologies | 4470661 | |
| TC20 Automated cell counter | Bio-Rad | 145-0102 | |
| Hemacytometer | Hausser Scientific | 02-671-51B | |
| Software | |||
| Triax software | Biocomp Instruments Inc. | ||
| Materials: | |||
| Counting slides, dual chamber for cell counter | Bio-Rad | 145-0011 | |
| 1.5 mL microcentrifuge tube | USA Scientific | 1615-5500 | |
| Open-top polyclear centrifuge tubes, (14 mm x 89 mm) | Seton Scientific | 7030 | |
| Syringe, 5 mL | BD | 309646 | |
| BD Syringe 3 mL23 Gauge 1 Inch Needle | BD | 10020439 | |
| Nunclon Delta Surface plate, 14 cm | Thermo Scientific | 168381 | |
| Nunclon Delta Surface plate, 9 cm | Thermo Scientific | 172931 | |
| Nalgene rapid-flow 90mm filter unit, 500 mL, 0.2 aPES | Thermo Scientific | 569-0020 | |
| BioLite 75 cm3 flasks | Thermo Scientific | 130193 | |
| Nunc 50 mL conical centrifuge tubes | Thermo Scientific | 339653 | |
| Chemicals: | |||
| Trizol LS | Ambion by Life Technologies | 10296028 | |
| HEPES | Fisher Scientific | BP310-500 | |
| Trizma base | Sigma | T1378-5KG | |
| Dulbecco's Modified Eagle's Medium-high glucose (DMEM) | Sigma | D6429-500ML | |
| Fetal Bovine Serum (FBS) | Sigma | F0926-50ML | |
| Penicillin-Streptomycin (P/S) | Sigma | P0781-100ML | |
| Lipofectamine 2000 | Invitrogen | 11668-019 | |
| Dulbecco's phosphate buffered saline (DPBS) | Sigma | D8537-500ML | |
| Magnesium chloride hexahydrate (MgCl2x6H2O) | Acros Organics | AC413415000 | |
| Potassium Chloride (KCl) | Sigma | P9541-500G | |
| Nonidet P 40 (NP-40) | Fluka (Sigma-Aldrich) | 74385 | |
| Recombinant Rnasin Ribonuclease Inhibitor | Promega | N2511 | |
| Heparin sodium salt | Sigma | H3993-1MU | |
| cOmplete Mini EDTA-free protease inhibitors | Roche Diagnostics | 11836170001 | |
| Glycogen | Thermo Scientific | R0551 | |
| Water | Sigma | W4502-1L | |
| Cycloheximide | Sigma | C7698-1G | |
| Chloroform | Fisher Scientific | 194002 | |
| Dithiotreitol (DTT) | Fisher Scientific | BP172-5 | |
| Ethidium Bromide | Fisher Scientific | BP-1302-10 | |
| Ethylenediaminetetraacetic acid disodium dehydrate (EDTA) | Fisher Scientific | S316-212 | |
| Optimem | Life Technologies | 22600050 | |
| Puromycin dihydrochloride | Sigma | P8833-100MG | |
| Sucrose | Fisher Scientific | S5-3KG | |
| Trypsin-EDTA solution | Sigma | T4049-100ML | |
| Hgh Capacity cDNA Reverse Transcriptase Kit | Applied Biosystems by life technologies | 4368814 | |
| Power SYBR Green PCR Master Mix | Applied Biosystems by life technologies | 4367659 | |
| HCl | Fisher Scientific | A144SI-212 | |
| Isopropanol | Fisher Scientific | BP26324 | |
| Potassium Hydroxide (KOH) | Sigma | 221473-500G | |
| Anti-RPL11 antibody | Abcam | ab79352 | |
| Ribosomal protein S6 (C-8) antibody | Santa Cruz Biotechnology Inc. | sc-74459 | |
| 1xM199 | Sigma | M0393-10X1L | |
| Lithium cloride | Sigma | L-9650 | |
| Dimethyl sulfoxide (DMSO) | Fisher Scientific | D128-500 | |
| Gel Loading Buffer II | Thermo Scientific | AM8546G | |
| UltraPure Agarose | Thermo Scientific | 16500-100 | |
| Trichloracetic acid (TCA) | Fisher Scientific | A322-100 | |
| SuperSignal West Pico PLUS chemiluminescent substrate | Thermo Scientific | 34580 | |
| Formaldehyde | Fisher Scientific | BP531-500 | |
| Sodium Dodecyl Sulfate (SDS) | Sigma | L5750-1KG | |
| Phenylmethylsulfonyl fluoride (PMSF) | Sigma | P7626-5G | |
| RNeasy Mini kit | Qiagen | 74104 | |
| Adenosine 5′-triphosphate disodium salt hydrate (ATP) | Sigma | A1852-1VL | |
| Cytosine 5'-triphosphate disodium salt hydrate (CTP) | Sigma | C1506-250MG | |
| Uridine 5'-triphosphate trisodium salt hydrate (UTP) | Sigma | U6625-100MG | |
| Guanosine 5'-triphosphate sodium salt hydrate (GTP) | Sigma | G8877-250MG | |
| SP6 RNA Polymerase | NEB | M0207S | |
| Pyrophoshatase | Sigma | I1643-500UN | |
| Spermidine | Sigma | S0266-1G |
Ссылки
- Schwanhausser, B., et al. Global quantification of mammalian gene expression control. Nature. 473 (7347), 337-342 (2011).
- Capewell, P., et al. Regulation of Trypanosoma brucei Total and Polysomal mRNA during Development within Its Mammalian Host. PLoS One. 8 (6), e67069 (2013).
- Warner, J. R., Knopf, P. M., Rich, A. A multiple ribosomal structure in protein synthesis. Proceedings of the National Academy of Science, USA. 49, 122-129 (1963).
- Piccirillo, C. A., Bjur, E., Topisirovic, I., Sonenberg, N., Larsson, O. Translational control of immune responses: from transcripts to translatomes. Nature Immunology. 15 (6), 503-511 (2014).
- Ennis, H. L., Lubin, M. Cycloheximide: Aspects of Inhibition of Protein Synthesis in Mammalian Cells. Science. 146 (3650), 1474-1476 (1964).
- Masek, T., Valasek, L., Pospisek, M. Polysome analysis and RNA purification from sucrose gradients. Methods in Molecular Biology. 703, 293-309 (2011).
- Gandin, V., et al. Polysome fractionation and analysis of mammalian translatomes on a genome-wide scale. Journal of Visualized Experiments. (87), (2014).
- Zuccotti, P., Modelska, A. Studying the Translatome with Polysome Profiling. Methods in Molecular Biology. 1358, 59-69 (2016).
- Chasse, H., Boulben, S., Costache, V., Cormier, P., Morales, J. Analysis of translation using polysome profiling. Nucleic Acids Research. 45 (3), e15 (2017).
- Arava, Y., et al. Genome-wide analysis of mRNA translation profiles in Saccharomyces cerevisiae. Proceedings of the National Academy of Science, USA. 100 (7), 3889-3894 (2003).
- Gandin, V., et al. nanoCAGE reveals 5' UTR features that define specific modes of translation of functionally related MTOR-sensitive mRNAs. Genome Research. 26 (5), 636-648 (2016).
- Bazzini, A. A., Lee, M. T., Giraldez, A. J. Ribosome profiling shows that miR-430 reduces translation before causing mRNA decay in zebrafish. Science. 336 (6078), 233-237 (2012).
- Zanchin, N. I., Goldfarb, D. S. Nip7p interacts with Nop8p, an essential nucleolar protein required for 60S ribosome biogenesis, and the exosome subunit Rrp43p. Molecular Cell Biology. 19 (2), 1518-1525 (1999).
- Darnell, J. C., et al. FMRP stalls ribosomal translocation on mRNAs linked to synaptic function and autism. Cell. 146 (2), 247-261 (2011).
- Gkogkas, C. G., et al. Autism-related deficits via dysregulated eIF4E-dependent translational control. Nature. 493 (7432), 371-377 (2013).
- Robichaud, N., Sonenberg, N. Translational control and the cancer cell response to stress. Curr Opin Cell Biol. 45, 102-109 (2017).
- Gordon, B. S., Kelleher, A. R., Kimball, S. R. Regulation of muscle protein synthesis and the effects of catabolic states. International Journal of Biochemistry and Cell Biology. 45 (10), 2147-2157 (2013).
- Ishimura, R., et al. RNA function. Ribosome stalling induced by mutation of a CNS-specific tRNA causes neurodegeneration. Science. 345 (6195), 455-459 (2014).
- Petersen, C. P., Bordeleau, M. E., Pelletier, J., Sharp, P. A. Short RNAs repress translation after initiation in mammalian cells. Molecular Cell. 21 (4), 533-542 (2006).
- Juntawong, P., Girke, T., Bazin, J., Bailey-Serres, J. Translational dynamics revealed by genome-wide profiling of ribosome footprints in Arabidopsis. Proceedings of the National Academy of Science, USA. 111 (1), E203-E212 (2014).
- Bunnik, E. M., et al. Polysome profiling reveals translational control of gene expression in the human malaria parasite Plasmodium falciparum. Genome Biology. 14 (11), R128 (2013).
- De Gaudenzi, J. G., Noe, G., Campo, V. A., Frasch, A. C., Cassola, A. Gene expression regulation in trypanosomatids. Essays in Biochemistry. 51, 31-46 (2011).
- Alves, L. R., Goldenberg, S. RNA-binding proteins related to stress response and differentiation in protozoa. World Journal of Biological Chemistry. 7 (1), 78-87 (2016).
- De Pablos, L. M., Ferreira, T. R., Walrad, P. B. Developmental differentiation in Leishmania lifecycle progression: post-transcriptional control conducts the orchestra. Current Opinions in Microbiology. 34, 82-89 (2016).
- Soto, M., et al. Cell-cycle-dependent translation of histone mRNAs is the key control point for regulation of histone biosynthesis in Leishmania infantum. Biochemical Journal. 379, 617-625 (2004).
- McNicoll, F., et al. Distinct 3 '-untranslated region elements regulate stage-specific mRNA accumulation and translation in Leishmania. Journal of Biological Chemistry. 280 (42), 35238-35246 (2005).
- Folgueira, C., et al. The translational efficiencies of the two Leishmania infantum HSP70 mRNAs, differing in their 3 '-untranslated regions, are affected by shifts in the temperature of growth through different mechanisms. Journal of Biological Chemistry. 280 (42), 35172-35183 (2005).
- Dumas, C., Chow, C., Muller, M., Papadopoulou, B. A novel class of developmentally regulated noncoding RNAs in Leishmania. Eukaryotic Cell. 5 (12), 2033-2046 (2006).
- Kapler, G. M., Coburn, C. M., Beverley, S. M. Stable transfection of the human parasite Leishmania major delineates a 30-kilobase region sufficient for extrachromosomal replication and expression. Molecular Cell Biology. 10 (3), 1084-1094 (1990).
- Karamyshev, A. L., Johnson, A. E. Selective SecA association with signal sequences in ribosome-bound nascent chains: a potential role for SecA in ribosome targeting to the bacterial membrane. Journal of Biological Chemistry. 280 (45), 37930-37940 (2005).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative C(T) method. Nature Protocols. 3 (6), 1101-1108 (2008).
- Panda, A. C., Martindale, J. L., Gorospe, M. Polysome Fractionation to Analyze mRNA Distribution Profiles. Bio Protocols. 7 (3), (2017).
- Sambrook, J., Fritsch, E. F., Maniatis, T. . Molecular Cloning. A Laboratory Manual. , (1989).
- Patrick, A. E., Karamyshev, A. L., Millen, L., Thomas, P. J. Alteration of CFTR transmembrane span integration by disease-causing mutations. Molecular Biology of the Cell. 22 (23), 4461-4471 (2011).
- Kleizen, B., van Vlijmen, T., de Jonge, H. R., Braakman, I. Folding of CFTR is predominantly cotranslational. Molecular Cell. 20 (2), 277-287 (2005).
- van den Elzen, A. M., Schuller, A., Green, R., Seraphin, B. Dom34-Hbs1 mediated dissociation of inactive 80S ribosomes promotes restart of translation after stress. EMBO Journal. 33 (3), 265-276 (2014).
- Morita, M., et al. mTOR Controls Mitochondrial Dynamics and Cell Survival via MTFP1. Molecular Cell. 67 (6), 922-935 (2017).
- Ingolia, N. T., Ghaemmaghami, S., Newman, J. R., Weissman, J. S. Genome-wide analysis in vivo of translation with nucleotide resolution using ribosome profiling. Science. 324 (5924), 218-223 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены