Method Article
Polysome Leishmania, 인간 세포 및 마우스 고환에서 프로 파일링
요약
Polysome 프로 파일링 기술의 전반적인 목표 단백질 합성 하는 동안 개별 mRNAs 또는 transcriptome mRNAs의 변환 활동의 분석입니다. 방법은 단백질 합성 규제, 번역 활성화 및 건강과 여러 인간의 질병에 억압의 연구에 대 한 중요 합니다.
초록
적절 한 단백질 식 및 오른쪽 금액에 적절 한 시기에 정상적인 세포 기능 및 빠르게 변화 하는 환경에서 생존의 기초 이다. 오랜 동안에, 유전자 표현 연구 transcriptional 수준에 대 한 연구에 의해 지배 되었다. 그러나, mRNAs의 정상 수준을 잘 단백질 생산, 연관 되지 않습니다 그리고 translatability mRNAs의 조건에 따라 크게 다릅니다. Leishmania, 기생충 같은 몇몇 유기 체에서 단백질 식이 주로 변환 수준에서 통제 된다. 최근 연구는 단백질 번역 dysregulation는 암, 대사, 신경 및 기타 인간의 질병 관련 된 시연 했다. Polysome 프로 파일링 단백질 번역 규칙을 공부 하는 강력한 방법입니다. 그것은 개별 mRNAs의 변환 상태를 측정 하거나 게놈 넓은 규모에 번역을 검토 수 있습니다. 이 기법의 기초 polysomes, 리보솜, 그들의 소 단위 및 자당 그라디언트를 통해 lysate는 세포질의 원심 분리 동안 무료 mRNAs의 분리 이다. 여기, 우리가 현재 보편적인 polysome 프로 파일링 사용 되는 프로토콜에 세 가지 모델-기생충 주요 Leishmania, 경작된 한 인간 세포 및 동물의 조직. Leishmania 셀 서 스 펜 션에서 자유롭게 성장 하 고 마우스 고환 동물 조직 샘플을 나타내는 부착 단층에서 경작된 한 인간 세포 성장. 따라서, 기술은 이러한 소스의 모든 적응 이다. Polysomal 분수의 분석을 위한 프로토콜 개별 mRNA 수준의 실시간 정량 Pcr에 의해 서쪽 오 점 및 전기 이동 법에 의해 리보솜 RNAs의 분석에 의해 단백질의 탐지를 포함 한다. 메서드는 분수의 질량 분광학에 의해 mRNAs 연관 깊은 RNA-seq에 의해 transcriptome 수준에 리보솜의 검사 및 리보솜 관련 단백질의 분석에 의해 더 확장할 수 있다. 메서드는 다른 생물 학적 모델을 쉽게 조정할 수 있습니다.
서문
세포에 있는 유전자 발현의 규칙 transcriptional, posttranscriptional 및 posttranslational 메커니즘에 의해 제어 됩니다. 깊은 RNA 시퀀싱에서 전례 없는 수준에 게놈 넓은 규모에 정상 mRNA 수준의 연구를 수 있습니다. 그러나, 최근 연구 결과 밝혀 정상 mRNA 수준은 단백질 생산1,2와 항상 연결 되지 않습니다. 개별 성적표의 운명 매우 복잡 하 고 내부/외부 자극, 스트레스 등과같은 많은 요인에 따라 달라 집니다. 단백질 종합 동안에 유전자 발현의 규칙 변화에 신속한 대응에 필요한 식 컨트롤의 또 다른 레이어를 제공 합니다. 프로 파일링, 분리 및 리보솜, 적극적으로 번역의 시각화 polysome (또는 "polyribosome") 단백질 종합의 규칙을 공부 하는 강력한 방법입니다. 비록, 그것의 첫번째 실험적인 응용 프로그램 1960 년대3에 등장, polysome 프로 파일링은 현재 단백질 번역 연구4에서 가장 중요 한 기술 중 하나. 단일 mRNAs는 polysome의 형성을 선도 하는 하나 이상의 리보솜에 의해 번역 될 수 있다. 성적 증명서 cycloheximide5 리보솜에 지연 수 있습니다 및 mRNAs polysomes의 다른 숫자를 포함 하 여 자당 그라데이션 ultracentrifugation6,7 polysome 분류 과정에서 분리 될 수 있다 , 8 , 9. polysomal 분수의 RNA 분석 수 있습니다 개별 mRNAs의 변환 상태에 변화의 측정 및 다른 생리 적인 조건4,7, 중 게놈 넓은 규모에 10. 5' UTR 및 3' UTR 시퀀스 mRNA translatability11의 제어의 역할을 공개, 번역 상 진압12miRNAs의 역할을 검토, 리보솜 속13에에서 결함을 밝히기 메서드를 또한 사용 , 인간의 질병14,15리보솜 관련 단백질의 역할을 이해 하 고. 지난 10 년 동안 번역 중 유전자 발현의 규칙을 위한 성장 역할 인간의 질병에 그것의 중요성을 나타내는 등장 했습니다. 암, 대사에 변환 제어 및 신경 퇴행 성 질환에 대 한 증거는 압도적인15,,1617,18. EIF4E-종속 변환 제어의 dysregulation에 기여 하는 예를 들어 자폐증 관련 적자15 와 FMRP은 자폐증14에 연결 된 mRNAs에 리보솜의 연기에 참여 하 고. 따라서, polysomal 프로 파일링 변환 여러 인간 질병에 있는 결함을 공부 하는 매우 중요 한 도구입니다.
다른 생리 적인 조건 하에서 polysomal 분수의 단백질 분석 번역 중 리보솜과 관련 된 요인의 기능 dissects. Polysome 프로 파일링 기법 등 효 모, 포유류 세포, 식물, 원생 동물10,19,,2021많은 종에서 사용 되었습니다. Trypanosoma 등 Leishmania protozoan 기생충 유전자 발현의 제한 된 transcriptional 제어를 전시 한다. 그들의 유전자는 polycistronic 유전자 클러스터 발기인 통제 전사22부족으로 구성 됩니다. 대신, 발달 유전자 발현은 주로 단백질 번역 및 trypanosomatid 종23,24에 mRNA 안정성의 수준에서 제어 됩니다. 따라서, 이해 transcriptional 규칙의 부재에서 변환 제어의이 유기 체에 대 한 특히 중요 하다. Polysomal 프로 파일링 Leishmania25,26,,2728에 유전자 발현의 posttranscriptional 레 귤 레이 션을 공부 하는 강력한 도구입니다.
진짜 개인적인 mRNAs 레벨의 검출에 최근 진행 시간 정량 PCR (RT-정량) 및 차세대 시퀀싱, 프로 테오 믹스 기술에 의해 전체 transcriptome, 해상도 새로운 수준 polysomal 프로 파일링의 장점을 제공 합니다. 이러한 메서드를 사용 하 여 깊은 RNA 시퀀싱 proteomic 분석 게놈 넓은 규모에 셀의 변환 상태를 모니터링을 결합 하 여 개별 polysomal 분수의 분석에 의해 더 확장 수 있습니다. 다른 생리 적 및 병 적인 조건 하에서 번역을 규제 하는 새로운 분자 선수의 식별 수 있습니다. 여기, 우리는 세 가지 모델에 사용 되는 프로토콜을 프로 파일링 범용 polysome 제시: 기생충 주요 Leishmania, 경작된 한 인간 세포 및 동물의 조직. 우리는 다른 유기 체, 그라데이션 조건의 최적화, RNase 억제제의 선택과 polysome 분수가이 연구에서 분석 하는 실시간 정량, 서쪽 오 점 및 RNA 전기 이동 법의 응용 프로그램에서 세포 lysates의 준비에 조언을 제시.
프로토콜
모든 동물 치료 및 연구에서 얻은 조직의 취급 기관 동물 관리 및 사용 위원회의 국가 학회에 택 사스 기술 대학 건강 과학 센터에 의해 승인 하는 프로토콜에 따라 수행 했다 건강 동물 복지 지침, 프로토콜 번호 96005입니다. 척 추가 있는 동물을 희생 하 고 지침에 따라 조직 기관 동물 관리 및 사용 위원회에서 준비 하십시오. 이러한 위원회 부족, 건강의 국가 학회 동물 복지 가이드라인을 참조 하십시오. 성인 (> 60 일 이전) C57BL/6 마우스 사용 되었다. 모든 동물 및 조직 기관 동물 관리 및 사용 위원회 건강의 국가 학회 동물 복지 지침에 따라 택 사스 기술 대학 건강 과학 센터에 의해 승인 하는 프로토콜에 따라 얻은 했다. 안락사, 단일 마우스 작은 챔버에 배치 했다 그리고 공중 약 30%로 점차적으로 전치 되었다 이산화탄소는 동물의 고통을 최소화 하 고 anesthetize. 호흡의 정지, 다음 우리는 조직 수확 전에 동물의 죽음을 확인 하 경부 전위를 사용.
주의: 라이브 Leishmania 경작된 한 인간 세포와 모든 작업 biosafety BSL-2 실험실 인증 캐비닛에서 이루어졌다.
1. 준비에서 세포질 Lysates의 Leishmania 주요 , 경작된 한 인간 세포 및 마우스 조직
참고: 다른 원본 자료에서 lysate 준비에 몇 가지 차이점이 있습니다. 자당 그라데이션 준비와 polysomal 분류를 포함 하 여 다른 단계는 동일 하 고 샘플 소스에 종속 되지 않습니다.
-
Leishmania 주요 세포질 lysate 준비
- 주요 Leishmania (FV1 스트레인) 셀 1 x M199 중간29 10% 태아 둔감 한 혈 청 (FBS)과 페니실린/스 혼합물 포함 30 mL에 접종 (100 단위 및 100 μ g/mL correspondingly)1 x 105 셀/mL의 농도에서 .
참고: 캐비닛 biosafety Leishmania 주요 셀을 포함 하는 모든 단계를 실시 해야 합니다. - 인큐베이터에 셀을 배치 하 고 로그 단계까지 27 ° C에서 그들을 성장 (로그 중반에 해당 5 x 106 셀/mL). 그것은 일반적으로 성장을 약 2 일 걸립니다.
- Leishmania 주요 문화 번역 된 mRNAs에 리보솜 체포를 100 μ g/mL의 최종 농도에 cycloheximide를 추가 합니다. 27 ° c.에서 10 분 동안 인큐베이터에 다시 장소 세포
- Cycloheximide 치료 완료 후 50 mL 원뿔 튜브에 세포를 전송 하 고 1800 x g와 8 분 삭제 상쾌한에 4 ° C에서 그들을 회전.
- Dulbecco의 버퍼 인산 염 (DPBS) 30 mL로 세포 세척. 원심 분리기에서 1800 x g와 4 ° C 8 분.
- 폐기는 상쾌한. 셀 DPBS의 1 mL에 resuspend
- 셀의 약 수 고 3.5% 포름알데히드 솔루션을 함께 섞는다.
- Hemocytometer 여 셀 개수 하 고 그들의 농도 결정 합니다. Microfuge 관으로 원하는 셀 수를 전송 합니다. 0.5x108-2 x 108 셀/mL에서 준비 Lysate 한 자당 그라데이션 선적을 위해 충분 하다.
- 1800 x g에서 셀 회전와 4 ° C 8 분에 대 한 삭제는 상쾌한.
- Protease 억제제와 RNase 억제제 (20 mM HEPES-코, pH 7.4, 100 m m KCl, 10mm MgCl2, 2mm DTT, 1 %NP-40, 1 x 프로 테아 제 억제 물 칵테일 (EDTA 무료), 200 단위/mL RNase 억제제)를 포함 하는 세포의 용 해 버퍼의 1 mL에 얼음에 셀 펠 릿 resuspend
- 통과 lysate 23 게이지 바늘을 통해 세 번. lysate 해야 될 투명 바늘 통과 후.
- 원심 분리기 11,200 x g와 lysate 명확 하 게 10 분 동안 4 ° C 명확히 전송 lysate 신선한 튜브와 자당 그라데이션 ultracentrifugation까지 얼음에 그것을 유지.
- 수집 입력으로 (나중에 분석), lysate의 400-500 μ 바로 미래의 단백질 분석을 위한 액체 질소 동결 또는 RNA 분석에 대 한 동결 전에 RNA 정화 시 약을 추가.
- 주요 Leishmania (FV1 스트레인) 셀 1 x M199 중간29 10% 태아 둔감 한 혈 청 (FBS)과 페니실린/스 혼합물 포함 30 mL에 접종 (100 단위 및 100 μ g/mL correspondingly)1 x 105 셀/mL의 농도에서 .
-
배양된 인간 헬러 세포에서 세포질 lysate 준비
- 헬러 세포를 분할 하 고 20 mL의 10 %FBS 페니실린/스 혼합물 포함 된 DMEM 매체에 씨앗 (100 단위 및 100 μ g/mL correspondingly) 셀 계산 2 x 105 셀/mL 15 cm 접시에.
- 37 ° C, 5% CO2 제조 업체의 프로토콜에 따라 20-24 h. 수행 플라스 미드 DNA transfection에 HeLa 세포 성장.
- 37 ° c, 5% CO2transfection 후 24 h에 대 한 셀을 전파 합니다.
- 번역 된 mRNAs에 리보솜을 체포 하 고 37 ° C, 5% CO2에서 10 분에 대 한 셀을 품 어를 100 μ g/mL의 최종 농도에 성장된 HeLa 세포에 cycloheximide를 추가 합니다. 중간 발음 얼음에 차가운 DPBS 셀 두 번 씻는 다.
- 접시에 500 μ의 세포의 용 해 버퍼 (20 mM HEPES 코 pH 7.4, 100 m m KCl, 5 mM MgCl2, DTT, 0.5 %NP-40, 1 x 프로 테아 제 억제 물 칵테일 1 mM (EDTA-무료), 단위/200ml의 RNase 억제제 또는 1 mg/mL 헤 파 린)를 추가 하 고 얼음에 셀을 다쳤어요.
- Microfuge 관 lysed 세포를 전송 합니다. 0.5% 및 MgCl2 는 샘플의 양이 증가 따라 5mm NP-40의 농도 조정 합니다.
- 통과 lysate 23 게이지 바늘 3-6 시간.
- 스핀 11,200 x g와 lysate 명확 하 게 8 분 4 ° C. 원심, 후 상쾌한 새로운 튜브를 전송 합니다. 세포 세포의 용 해 효율을 평가 하 고 그라데이션에 로드에 대 한 샘플 크기를 결정 하는 분 광 광도 계를 사용 합니다. 0.1%의 0.5 mL를 추가 하는 샘플의 10 μ 나트륨 라우릴 황산 염 (SDS). 0.1 %SDS 대 한 빈. 260에서 흡 광도 측정 nm. 예상된 흡 광도 값은 주위 15-20 단위/mL.
- 자당 기온 변화도 원심 분리 하기 전에 같은 흡 광도 값을 세포의 용 해 버퍼 모든 샘플을 희석. 자당 기온 변화도 원심 분리까지 얼음에 샘플을 계속.
-
마우스 고환에서 세포질 lysate 준비
- 마우스 고환 해 부. Tunica albuginea에 작은 절 개를 하 게 하 고 testes의 seminiferous tubules를 수집 하 고 0.1 m m phenylmethylsulfonyl 불 (PMSF) 보충 하는 DPBS의 5 mL를 포함 하는 15 mL 원뿔 튜브에 그들을 전송.
- 여러 번을 반전 하 여 적극적으로 조직을 믹스. 5 분 동안 얼음에 단위 중력에 정착을 조직을 수 있습니다.
- 제거 하 고 연결 세포와 조직 파편을 포함 하는 흐린 버퍼를 삭제 합니다. 절차 2-3 번 더 반복 합니다. 나머지 흰색 펠 릿 seminiferous tubules 및 생식 세포 농축입니다.
- 2 mL microcentrifuge 튜브를 seminiferous 관 펠 릿을 전송 및 스핀 1 분에 500 x g에서 삭제는 상쾌한.
- tubules에 세포의 용 해 버퍼 (20 mM Tris HCl, pH 7.4, 100 m m KCl, 5 mM MgCl2, DTT, 0.5 %NP-40, 1 x 프로 테아 제 억제 물 칵테일 1 mM (EDTA-무료), 1 mg/mL 헤 파 린 또는 RNase 억제제의 200 단위/mL)의 500 µ L를 추가 합니다. 한 피 펫을 사용 하 여 조직 triturate.
- 작은 정지 전송 (0.5-1.0 mL) Dounce 균질 화기. 유리 유 봉의 7 ~ 8 스트로크 조직 방해.
- 1.5 mL microcentrifuge 튜브 lysate를 전송할.
- 12000 x g와는 lysate를 8 분 동안 4 ° C에서 샘플 원심 자당 기온 변화도에 로드 될 때까지 얼음에 새로운 튜브와 저장소에는 상쾌한 전송.
- 수집 하는 입력된 샘플으로 lysate의 50 μ, 향후 단백질 분석;-80 ° C에서 그것을 지금 당장 동결 또는 RNA 분석에 대 한 동결 전에 RNA 정화 시 약을 추가.
2. 자당 그라데이션 준비 및 Ultracentrifugation
- 두 자당 그라데이션 (20 mM HEPES-코, pH 7.4, 100 m m KCl, 10mm MgCl2, 1mm DTT, 1 x 프로 테아 제 억제 물 칵테일), 포함 하는 솔루션 10% 자당 또는 50% 자당을 준비 합니다. (PH 7.4, Tris HCl HEPES 대신 사용할 수 있습니다). 200 단위/mL RNase 억제제 또는 1 mg/mL 헤 파 린 실험 디자인에 따라 추가 합니다. 마커 블록으로 남서 41로 터에 대 한 ultracentrifuge 튜브를 놓고 블록의 상위 레벨에 따라 라인을 그립니다. 안정적인 랙 튜브를 전송 합니다.
- 연결 된 레이어 링 장치 10 mL 주사기를가지고 하 고 10% 자당 해결책 (위와 같이 준비)와 주사기를 입력. 마크 튜브에 도달할 때까지 부드럽게 ultracentrifuge 튜브의 하단에 그것을 해제.
- 50% 자당 해결책으로 다른 주사기를 조심 스럽게 삽입 튜브의 아래쪽 10% 자당 레이어를 통해 그것의 레이어 링 장치. 부드럽게 튜브에 마크에 도달할 때까지 아래에서 시작 하는 자당 솔루션 출시. 제공 된 모자와 튜브 인감.
- 자당 기온 변화도 준비 하려면 그라데이션 메이커 장치에 설정 합니다. 위로 또는 아래로 단추를 사용 하 여 접시를 레벨 하 고 DONE을 누릅니다. 수평 선형 그라데이션에 대 한 중요 하다입니다.
- 접시를 평준화 후 대학원 그라데이션 메뉴를 열려면 누릅니다. 목록 에 그라데이션 메뉴에가 고 남서 41 Ti로 터를 선택. 다음 위로 및 아래로 단추를 사용 하 여 메뉴의 목록에서 원하는 자당 그라디언트를 선택 합니다. 사용키를 누릅니다.
- 그라데이션 튜브 홀더를 그라데이션 메이커 접시에 놓습니다. 소유자에 튜브를 전송 합니다. 6 그라데이션까지 동시에 준비 될 수 있다. 눌러서 실행합니다. 그라데이션 메이커 프로그램된 속도 선형 그라데이션을 형성 하는 각도에서 튜브를 회전 합니다. 그라디언트를 준비 하는 몇 분 밖에 소요 됩니다.
- 프로세스가 완료 되는 때, 튜브 랙에 배치. 모자를 벗어. Ultracentrifuge 튜브의 상단에서 샘플 볼륨으로 동일한 볼륨을 제거 합니다.
- 조심 스럽게 lysate의 상단에 polysomes 15 20 A260 단위를 포함 하는 400-500 μ 로드. 로 터 양동이에 튜브를 놓고 균형을 합니다.
- 원심 분리기 260000 x g와 4 ° C 2 h SW 41로 터를 사용 하 여.
3. polysome 분류 및 샘플 컬렉션
참고: lysate 준비 소스에 따라 약간의 차이가 있지만, 그라데이션 준비 및 polysome 분별 프로토콜은 lysates의 모든 종류에 대해 동일 합니다.
- 완료 후에 ultracentrifugation의, 얼음에 튜브와로 터 양동이 놓습니다. 일부 수집기 및 그라데이션 fractionator ON을 설정 합니다. Fractionator 메뉴에서 검색 을 클릭 합니다. 분수 수집기에 24 컬렉션 튜브와 선반을 넣어.
- 이온을 제거 된 물으로 fractionator 측면 린스 저수지를 작성. 린스 키 10 s fractionator에 펌프를 씻어. 보정에 대 한 피스톤에 물으로 채워진 주사기 린스 어댑터를 연결 합니다.
- 컴퓨터에 fractionator 소프트웨어를 엽니다. 보정을 누릅니다. 기본 설정을 사용 하 고 확인을 누릅니다. 주사기에서 물을 주사를 준비가 되어있습니다.
- 보정 확인 을 누릅니다. 즉시 다음 5에 대 한 물 주입 시작 s. 이 시간 동안 UV 검출기 흐름 셀 통해 물 흐름 것 이다 하 고 악기를 측정 될 것 이다. 부호 0 교정 완료 나타납니다. 악기 분류에 대 한 준비가 되어있습니다.
- 주사기와 린스 어댑터를 제거 합니다. 팁은 fractionator의 피스톤에 연결 합니다.
- 황동 공기 밸브와 언론에 어 키 10 건조 관과 흐름 셀을 s. 공기 밸브를 닫습니다.
- 부드럽게 회전자 통에서 그라데이션 튜브를 제거 하 고 선반에 그것을 배치. 튜브의 상단에 튜브 홀더 캡 적용 신중 하 게 튜브 튜브 홀더 이동 하 고 위치에 그것을 잠금.
- 아래는 fractionator 피스톤 홀더를 배치 합니다. 종종, polysomal 악대는 눈으로 볼 수 있습니다. 분수 숫자와 볼륨에 대 한 원하는 설정을 소개 (500 μ/분수 24 분수는 일반적으로 충분 한). 파일을 적절 하 게 이름을 지정 합니다. 확인, 그리고 그래프를 이동 버튼을 누릅니다. 다음 창에서 검색 시작을 누릅니다. 확인을 눌러 설정 표시 됩니다. 수집기는 첫 번째 분수 시 궁 창에서 이동할 것 이다 고 피스톤 튜브로 이동 합니다. 피스톤 그라데이션의 상단에 도달 하면 선택한 속도에 느린 것입니다 하 고 분수를 수집 합니다. 완료 되 면, 피스톤 그라데이션 튜브 이동 합니다.
- 황동 공기 밸브와 언론 어 키를 마지막 분수 검색 fractionator에서 엽니다.
- 얼음에는 선반에서 튜브를 이동 합니다.
- 2 양의 RNA 정화 시 약 각 분수를 플래시 RNA 정화까지 액체 질소에서 고정을 추가 합니다. 또는, 단백질 분석 하는 경우, 서쪽 더 럽 히 (섹션 8 참조)에 대 한 집중에 10%의 최종 농도에 trichloroacetic 산을 추가 합니다.
4. 실시간 정량 데이터 분석 수준 동안 mRNAs의 정규화에 대 한 합성 RNA 생체 외에서 준비
참고: 대장균 OmpA mRNA 정규화에 대 한이 프로토콜에 사용 됩니다. 광범위 한 정체성 공부 유 기체의 mRNAs가 없는 다른 RNA (포유류 또는 Leishmania) 사용할 수 있습니다.
- OmpA 유전자30를 포함 하는 플라스 미드에서 표준 PCR 반응에 의해 SP6 발기인 시퀀스가 포함 된 OmpA DNA 파편을 준비 합니다.
- 혼합물의 100 µ L를 준비: 80 mM HEPES-코, pH 7.5, 16 m m MgCl2, 2 mM Spermidine, 10mm DTT, ATP, CTP, 3mm 3mm 3mm UTP, 3mm GTP, 0.5 U/μ RNase 억제제, OmpA PCR DNA, 3 μ s p 6 RNA 중 합 효소의 1 μ g 0.005 U/μ pyrophosphatase.
- 2 시간 동안 40 ° C에서 품 어.
- RNA 정화 키트에 의해 RNA를 정화.
- 분 광 광도 계에 의해 농도 측정 하 고 agarose 젤 전기 이동 법으로 검사.
5. RNA 격리 그라데이션 분수를 cDNA 준비
참고: RNase 억제제 ribonuclease 억제제로 사용 하는 경우이 프로토콜 RNA 정화와 직접 진행 합니다. 그러나, ribonuclease 억제제로 사용 하는 경우 헤 파 린 역전사 cDNA 준비에 사용 된 억제 됩니다. 따라서, 추가 정화 RNA의 헤 파 린 세포의 용 해 버퍼 및 그라데이션에 사용 된 경우에 필요 합니다. 헤 파 린 사용 cDNA 합성에 RNA를 준비 섹션 6을 참조 하십시오.
- RNA 정화 시 약을 포함 하는 샘플을 녹여, 20를 추가 실시간 정량 Pcr 결과의 정규화에 대 한 내부 통제로 합성 RNA의 ng. 한 수정 제외 하 고 제조 업체의 프로토콜에 따라 RNA 준비 진행. RNA 학년 glycogen (20 µ g) 이전 소 프로 파 놀 강수량의 1 µ L를 추가 합니다. 20-25 µ L RNase 무료 물 펠 릿 RNA를 분해.
참고: Glycogen 캐리어 역할 하 고 손실을 방지 하 고 정화 동안 RNA 펠 릿을 시각화 하는 데 도움이. OmpA mRNA는 실시간 정량 Pcr 반응에 더 정규화에 사용 됩니다. - 분 광 광도 계를 사용 하 여 적절 한 수익률을 보장 하는 RNA 농도 측정 합니다. 40, 60 및 prepolysomes로 monosomes를 포함 하는 RNA 분수의 동일한 볼륨을 결합 한다. 2-4 리보솜을 포함 하는 분수 빛 polysomes로 결합 하 고 5-8 리보솜과 분수 무거운 polysomes로 결합.
- 결합 된 분수에서 RNA의 5-10 µ L를 사용 하 여 cDNAs 키트를 사용 하 고 제조 업체의 권장 사항에 따라 준비.
- CDNA의 20 µ L를 nuclease 무료 물 80 µ L를 추가 합니다. -20 ° c.에 cDNA 샘플을 동결
6. RNA 정화 덤플링 오염에서
참고: 헤 파 린 같은 역전사 효소를 처리 하는 핵 산을 억제. 따라서, 세포의 용 해 버퍼 또는 그라데이션에서 헤 파 린 사용이 추가 정화 프로토콜을 사용 합니다.
- 순화 된 RNA 샘플을 1 M 최종 농도에 LiCl을 추가 합니다.
- 샘플을 혼합 하 고 1 시간에 대 한 얼음에 품 어.
- 샘플에서 16000 x g와 15 분 동안 4 ° C 회전.
- 가능한 한 피 펫을 사용 하 여 완전 한 상쾌한을 제거 합니다.
- 약 5 분 동안 펠 릿 건조
- 다시 물 RNase 무료 초기 볼륨에 펠 릿을 일시 중단 합니다.
- 260에 spectrophotometric 측정을 수행 RNA의 농도 결정 하기 위해 nm. 일반적으로, 샘플의 손실 최소화 됩니다.
7. 실시간 정량 Pcr 및 mRNA 분포의 데이터 분석
- 물, SYBR 녹색의 20 μ, 유전자 특정 뇌관 (2.5 μ M 세트)의 4.8 μ의 10.2 μ, cDNA의 5 μ를 결합 하 고 잘 섞어 384-잘 접시에 잘 triplicates에 당 10 μ를 로드.
- 접착 필름으로 접시를 단단히 커버 하 고 접시 5 분 1800 x g에서 원심.
- 실시간 PCR 악기를 사용 하 여 표 1에 표시 된 조건에서 정량 반응을 설정 합니다.
- 사이클 임계값 (CT)를 사용 하 여 값과 비교 CT (ΔΔCT) 방법31 계산 백분율 (%) prepolysomes, 빛, 그리고 무거운 polysomes 한 수정 설명된32 로 mRNA 분포의. 합성 RNA (OmpA 여기)를 사용 하 여 실시간 정량 데이터 분석에서 데이터 정규화에 대 한. 합성 RNA 상대 mRNAs 레벨을 계산 하 여 그라디언트의 다른 분수에 그들을 비교할 수 있는 정규화 제어를 제공 합니다.
8. 서 부 Blotting에 의해 Polysomal 분수에 단백질의 분석
- 100% (w/v) 주식에서 추가 trichloroacetic 산 (TCA) 10%의 최종 농도에 선택한 분수 (500 μ) 적어도 15 분, 5 분 대에 microfuge 분리기 얼음 계속, 상쾌한 삭제, 차가운 아세톤과 두 번 세척 및 25 μ S의 분해 전기 이동 법에 대 한 DS-페이지 샘플 로딩 버퍼입니다.
- SDS 페이지에 로드 하 고 다음 전송 전송 PVDF 막에 표준 전기 이동 법을 실시. 33를 더럽혀 서 진행 합니다.
결과
이 연구에서는 3 개의 서로 다른 소스에 polysomal 프로 파일링 기술의 응용 프로그램 설명: 기생 주요 Leishmania, 경작된 한 인간 세포 및 마우스 고환. Leishmania 세포 현 탁 액에 있는 액체 매체에서 자유롭게 성장, 경작된 한 인간 세포 플레이트에 부착 단층에서 성장 하 고 마우스 고환 조직 샘플을 나타냅니다. 메서드를 사용 하면 다른 종류의 서 스 펜 션, 다양 한 종류의 조직, 또는 다른 유기 체에서 및 배양된 세포의 종류에 자유롭게 성장된 세포를 쉽게 조정할 수 있습니다. 접근 방식 4 개의 주요 단계로 구성 됩니다: lysate 준비, 자당 그라데이션 준비 및 ultracentrifugation 단계, polysome 분류와 샘플 컬렉션 뒤에 분수의 분석. 서로 다른 소스에서 세포는 수집, 세차 고 바늘 또는 Dounce 균질 화기를 통해 통행에 의해 세포의 용 해 버퍼에서 lysed. 원심 분리는 lysate 명확히 세포 파편을 제거 하는 데 사용 됩니다. 그라데이션 분류의 체계는 그림 1A에 표시 됩니다. 연속 자당 그라데이션 그라데이션 메이커에서 10%와 50% 자당 해결책의 혼합 하 여 형성 된다. lysate 그라디언트 상단 로드 됩니다. Ultracentrifugation 분리 분류, 동안 UV 감지기에 의해 모니터링 되는 리보솜의 다른 번호와 연결 된 mRNAs 뚜렷한 흡 광도 스펙트럼을 형성. 수집 된 분수는 RNA 및 단백질 분석 (그림 1B)에 사용 됩니다. RNA 전기 이동 법 뒤 북부 오 점 또는 실시간 정량 Pcr 반응 cDNA 생산 polysomes 개별 mRNAs의 연관 분석을 사용 하 여 분석할 수 있습니다. 차세대 시퀀싱 분석 하는 게놈 넓은 규모7에 mRNAs의 변환 상태를 사용할 수 있습니다. Polysomal 분수의 단백질 분석, 단백질 trichloroacetic 산 그들을 집중 시 켰 던. 단백질은 다음 서쪽 더 럽 히 또는 질량 분광학 프로테옴 수준에서 분석 됩니다.
Polysomal 전형적인 Leishmania 주요 적극적으로 성장 하는 문화에서에서 생성 된 프로 파일은 그림 2A에 표시 됩니다. 흡 광도 그래프는 분별의 리보솜 소 단위 (40와 60), 단일 리보솜 (80 또는 monosomes) 및 polysomes에 대 한 전형적인 봉우리와 독특한 모양이 있다.
양적 RT-PCR (RT-정량) 리보솜 및 polysomes 개별 Leishmania mRNAs의 협회를 감지 하 고용 되었다. 비교 CT (ΔΔCT)31 방법 셀에서 상대 mRNAs 레벨을 공부 하는 간단 하 고 적절 한 접근 이다. 이 메서드는 계산에 대 한 내부 통제 (는 안정적인 mRNA, 치료 또는 실험의 조건 중 식 변경 되지 않는)을 해야 합니다. 그러나, 내부 통제에에서 있다 polysomal 분수 ribosomal RNA 또는 mRNA의 레벨 분수로, 리보솜, polysomes, 등그들의 연관에 따라 달라 집니다 있기 때문에. 내부 제어의 문제를 해결 하려면 우리는 분수에 상대 개별 Leishmania mRNA 수준의 정규화에 대 한 합성 세균 OmpA mRNA를 이용 했다. OmpA mRNA 합성 생체 외에서 그리고 RNA 추출 하기 전에 각 분수에 동일 금액의 추가. 합성 RNA의 추가 실시간 정량 데이터의 계산을 더 정확한 비교 CT (ΔΔCT) 방법으로 계산을 위한 내부 통제로 봉사 하 게 하기 때문에 중요 하다.
Aliquots 그라데이션 분수의 세 그룹으로 혼합 했다: prepolysomes (소 단위 및 monosomes), 라이트 polysomes (2-4 리보솜 구성), 및 무거운 polysomes (5-8 리보솜 구성). 실시간 정량 Pcr이 결합 된 분수 (그림 2B) 사이의 mRNA 분포 분석을 결합 하 여 분수에서 RNA에서 수행 되었다. 18S ribosomal RNA 컨트롤으로 사용 되었다. 실시간 정량 Pcr에 의해 결정의 상대 레벨 작은 ribosomal 소 단위의 예상된 분포와 잘 상관 (무료 소 단위, monosomes 및 polysomes의 일환으로) 스펙트럼에. 실시간 정량 Pcr 분석 공개 테스트 개별 mRNAs Leishmania 성장의 로그 단계 번역에서 포용의 다른 학위를가지고. 효율적인 번역 제안 tubulin mRNA는 무거운 polysomes, 우선적으로 연결 됩니다. Sherp mRNA prepolysomes와 가벼운 polysomes tubulin에 비해 덜 활성화 번역 지원에 주로 발견 되는 반면, mRNA.
배양된 세포에서 재조합 단백질의 표정은 연구의 다양 한 부문에서 중요 한 실험적인 접근 이다. 여기, 우리는 또 다른 샘플 소스, 경작된 한 인간 세포에서에서 재조합 단백질 mRNAs의 polysomal 프로 파일링의 예 제시. 헬러 세포 재조합 낭 성 섬유 증 막 횡단 전도성 레 귤 레이 터 (CFTR)34 Norrie 질병 단백질 (NDP)를 표현 하는 플라스 미드와 페 뚜렷이 했다. 이 두 개의 독립적인 문화에서 polysome 분별의 흡 광도 스펙트럼 매우 유사 하 고 포함 된 개별 봉우리 ribosomal 소 단위 (40와 60), monosomes (80), 및 polysomes (그림 3A)에 해당 했다. 이 실험에서 스펙트럼에 유사성 그라데이션 분별의 재현성을 보여 줍니다. 처럼 Leishmania 연구에서 mRNAs의 분포에서에서 결정 되었다 실시간 정량 Pcr에 의해 prepolysomes, 가벼운 polysomes, 및 무거운 polysomes (그림 3B)를 대표 하는 분수. 작은 ribosomal 소 단위 18S RNA의 검출 스펙트럼에서 추정된 분포와 상관 된다. CFTR mRNAs prepolysome 분수, 신 민 당 보다 효율적으로 번역 제안에 주로 발견 하는 동안 신 민 당 mRNAs 빛과 무거운 polysomal 분수와 관련 된 주로 했다. NDP는 상대적으로 작은 단백질, CFTR은 번역35동안 독립적으로 이동 하는 여러 가지 도메인에서 구성 된 매우 큰 단백질 (1480 아미노산 잔류물). Polysomes와 CFTR mRNA의 낮은 계약의 고유 도메인의 cotranslational 폴딩에 필요한 느린 번역을 반영 수 있습니다.
Polysome 분수는 단백질의 검출에 대 한 또한 사용할 수 있습니다. 그라데이션 분수에 단백질의 탐지는 HeLa 세포 (그림 4)에서 ribosomal 단백질의 예에 실시 됐다. 단백질 강 수 10 %TCA 분수와 서쪽 오 점에서 작은 소 단위 ribosomal 단백질 RPS6 및 큰 소 단위 ribosomal 단백질 RPL11 검출 하기 위하여 사용 되었다에 의해 집중 했다 (그림 4, 맨 위 패널). 그들의 유통 흡 광도 스펙트럼에 독특한 봉우리와 잘 상관 된다. 이 실험은 명확 하 게 polysome 분수 그들의 단백질 분석을 사용할 수 있습니다 보여줍니다.
많은 다른 자당 농도 기온 변화도 (예를 들어, 7-4736, 5-507, 7-506 , 10-5037,8, 15-50 등) polysomes 분류에 대 한 사용 되었다. 여기, 우리는 두 개의 그라디언트 10-50%와 17-51% (그림 5) 비교. 17-51% 수락 가능한 결과 생산, 10-50%에서 분리가 했다 전반적인 더 나은.
그것은 잘 chelating 에이전트, EDTA, 같은 리보솜 및 polysomes8,9방해 문서화 되어있다. 마찬가지로 그것은 그림 6, 그라데이션에 로드 봉우리, 해당 monosomes 및 polysomes, 하의 실종 하 고 리보솜 소 단위에 상당한 증가 봉우리 전에 lysate 헬러의 EDTA 치료에에서 표시 됩니다. 이 실험 제어로 역임 하 고 EDTA 치료 없이 관찰된 봉우리 실제로 ribosomal monosomes와 polysomes는 설명 했다.
그림 7 마우스 testes에서 polysome 분류의 결과 보여 줍니다. 흡 광도 스펙트럼 Leishmania HeLa 세포에서 유사점이 있다: ribosomal 소 단위, monosomes 및 polysomes의 뚜렷한 봉우리. 그들의 모양 및 분포 생성 쉽게 다른 polysomal 스펙트럼에 그들을 식별 하는 서명 모양. 총 RNAs는 분수에서 순화 했다 그리고 선택한 분수에서 RNAs agarose 젤 (그림 7, 맨 위 패널)에 전기 이동 법에 의해 분석 되었다. 전기 이동 법 28S와 18S 리보솜 RNAs의 일반적인 분포를 보여 줍니다. 그들의 날카로운 밴드 intactness의 샘플을 나타냅니다. 젤 때 사용할 수 있는 개별 mRNAs 검색 다음 북부 오 점 또는 RNA 또는 단백질 분석-확산된 리보솜 RNAs 밴드 표시 샘플에서 RNA 저하에 더 실험 하기 전에 샘플의 품질을 평가 하는 데 사용 될 수 있습니다.
우리의 연구 기간 동안 RNase 억제제 및 헤 파 린 lysates 및 자당 기온 변화도에 RNase 억제제로 사용 우리. 둘 다 만족 스러운 결과 제공, RNase 억제제를 사용 하 여 cDNA 및 실시간 정량 Pcr 반응 억제 하지 않습니다 때문에 RNA 분석에 대 한 바람직 했다. 따라서, 그것은 추가적인 RNA 정화 단계를 요구 하지 않았다. 그러나, 연구원 polysome 준비 중 헤 파 린을 사용 하려는 경우 유의 덤플링을 억제 실시간 정량 같은 다운스트림 응용 프로그램 및 추가 RNA 정화 단계 (프로토콜 섹션 6 참조) 필요 하다.
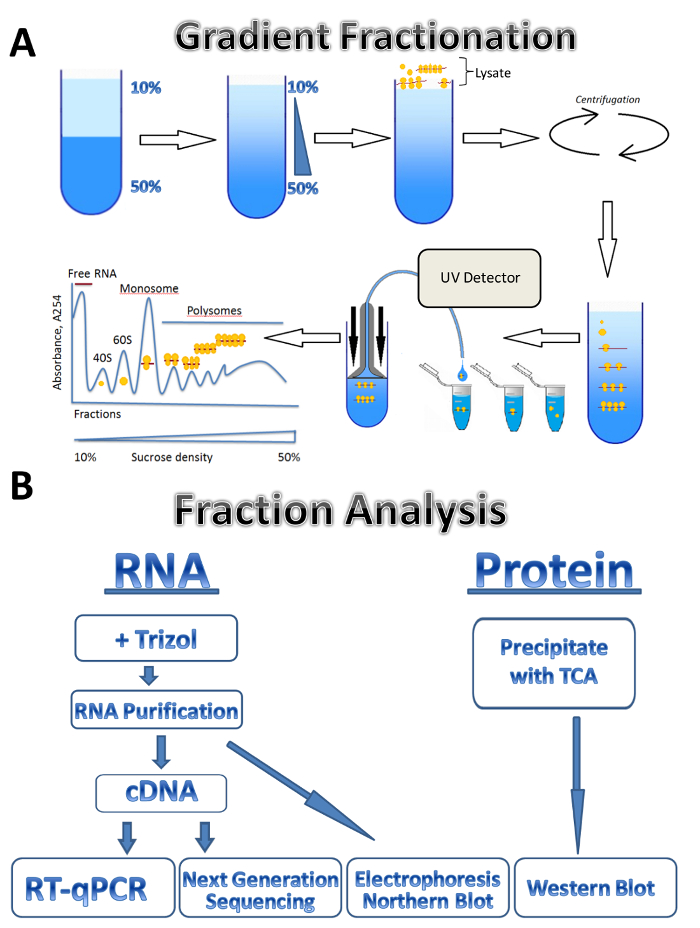
그림 1 . Polysome 프로 파일링. 그라데이션 준비의 (A) 계획 polysome 분류 및 흡 광도 프로필. 일부 분석의 (B) 체계. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
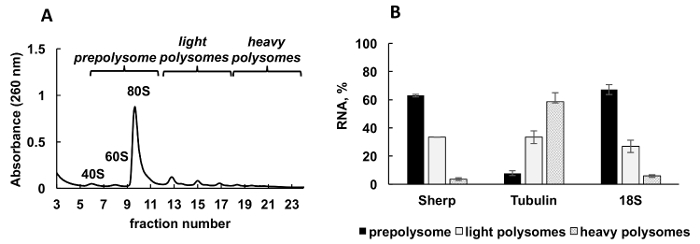
그림 2 . Polysome 프로필 분석 Leishmania 주요 문화 성장 로그 단계에서. (A) Cytoplasmic lysate 했다 분류 한 10-50% 자당 기온 변화도에. (B) 18S RNA, tubulin 및 prepolysomes에서 Sherp mRNAs (%)의 상대 분포, 실시간 정량 분석 로그 셀의 가볍고 무거운 polysomes. 분수를 포함 하는 40, 60 및 monosomes prepolysomes로 결합 했다. 2-4 리보솜과 분수 분수 5-8 리보솜과 무거운 polysomes를 형성 하는 동안 빛 polysomes로 결합 했다. 합성 대장균 OmpA mRNA 분수 이전 RNA 추출 실시간 정량 Pcr에서 정규화 컨트롤로 제공에 추가. 비교 CT (ΔΔCT)31 방법은 mRNA 레벨의 계산을 위해 사용 되었다. 오차 막대는 표준 오류를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
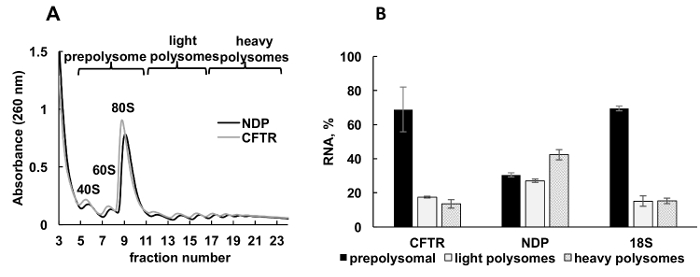
그림 3 . Polysome 분류 및 분석 재조합 CFTR 및 NDP mRNAs 협회의 리보솜 HeLa 세포에서 플라스 미드 DNAs와 페. (A) HeLa 세포에서 Polysomal 프로필 CFTR 및 NDP 플라스 미드와 페. 10%-50% 자당 기온 변화도 polysomes의 분리를 달성에 적용 되었습니다. 소형 (40)와 큰 (60) 소 단위, 뿐만 아니라 monosome (80) 봉우리 표시 됩니다. 분수 패널 A 에 같이 결합 하 고 추가 분석을 위해 사용 했다. (B) 다른 분수에 CFTR 그리고 NDP의 mRNAs의 분포. 실시간 정량 Pcr에 의해 18S의 탐지 polysome 분별에 대 한 제어로 사용 되었다. RNA 수준 실시간 정량 분석에 의해 평가 되었다. 데이터 합성 mRNA를 사용 하 여 정규화 되었다. 비교 CT (ΔΔCT)31 방법은 mRNA 레벨의 계산을 위해 사용 되었다. 오차 막대는 표준 오류를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
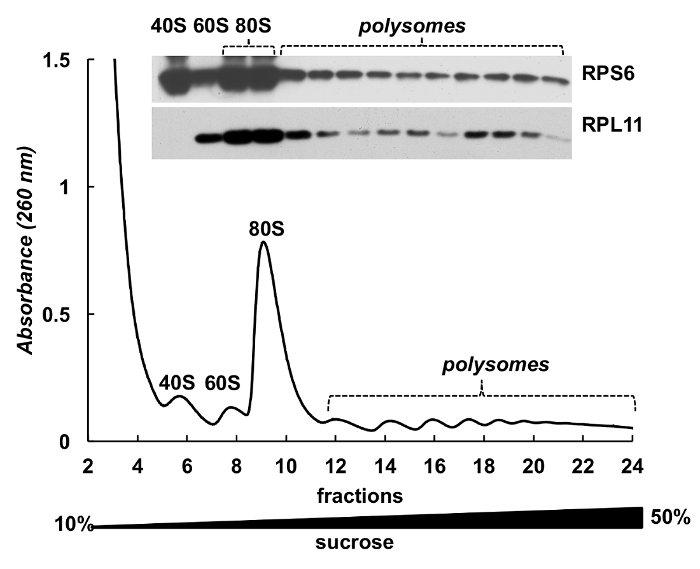
그림 4 . 헬러 polysomal 분수에 ribosomal 단백질의 검출. 헬러 세포 lysate 10%-50% 자당 기온 변화도 원심 분리에 의해 복종 되었다. 선택한 분수에 단백질 TCA와 침전 되었고 12%에서 전기 이동 법에 의해 분석 부 럽을 사용 하 여 다음 SDS 페이지 마우스 단일 클로 널 RPS6와 토끼 polyclonal RPL11 항 체 주 항 체 및 Peroxidase-Conjugated 염소 반대로 마우스 또는 반대로 토끼 보조 항 한 신호 SuperSignal 웨스트 피코 플러스 chemiluminescent 기판에 의해 이루어졌다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
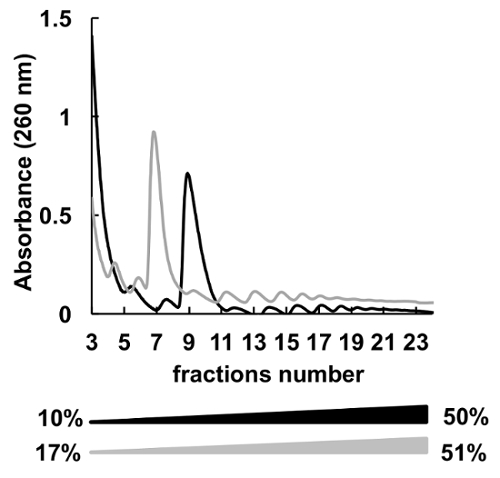
그림 5 . 10%-50% (블랙) 또는 17%-51% (회색) 자당 기온 변화도에 프로 파일링 polysomal 헬러의 비교. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
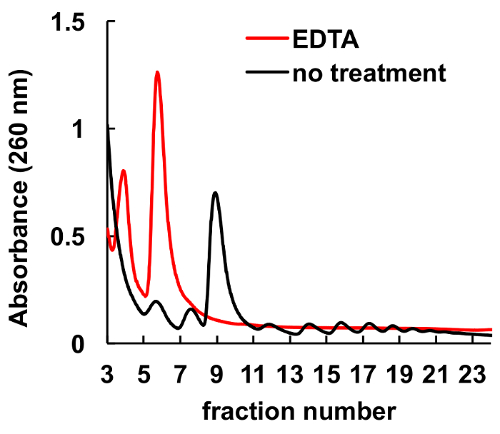
그림 6 . HeLa 세포에서 polysomal 프로필에 EDTA 치료의 효과. 헬러 세포 lysate 10 mm EDTA 자당 기온 변화도 원심 분리 직전 10 분 동안 얼음에 대우 되었다. MgCl2 5 mM EDTA 자당 그라데이션 솔루션에 의해 대체 되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
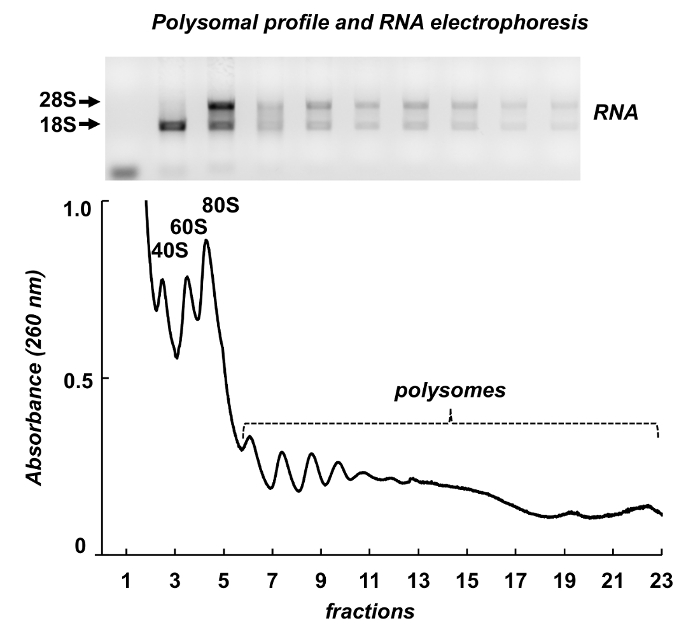
그림 7 . 마우스 고환 조직 lysate에서 polysomal 프로필. 분수는 RNA 정화 시 약으로 RNA 추출 대상이 되었고에 1 %agarose 젤 전기 이동 법에 의해 분석. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| 단계 | 단계 | 조건 |
| 보류 | 1 단계 | 25에서 1.6 ° C/s 50 ° C의 온도 증가 |
| 2시 분 50 ° C에서 품 어 | ||
| 2 단계 | 1.6 ° C/s로 95 ° C에 50에서 온도 증가 | |
| 10시 분 동안 95 ° C에 품 어 | ||
| PCR | 1 단계 | 00시 15분에 대 한 95 ° C에서 품 어 분 |
| 2 단계 | 95에서 1.6 ° C와 60 ° C의 온도 감소 / | |
| 1시 분 동안 60 ° C에서 품 어 | ||
| 사이클 40 수 | ||
| 곡선을 녹여 | 1 단계 | 1.6 ° C/s로 95 ° c에서 60 온도 증가 |
| 2 단계 | 95에서 1.6 ° C/s 60 ° C의 온도 감소 | |
| 1시 분 동안 60 ° C에서 품 어 | ||
| 단계 3 (분리) | 60에서 0.05 ° C/s 95 ° C의 온도 증가 | |
| 00시 15분에 대 한 95 ° C에서 품 어 분 | ||
표 1입니다. 실시간 정량 pcr 조건
토론
자당 기온 변화도 의해 polysome 분별 RNA와 결합 및 분수의 단백질 분석은 개별 mRNAs 또는 전체 translatome의 변환 상태 뿐만 아니라 변환 조절 단백질 요인의 역할을 분석 하는 강력한 방법을 정상적인 생리 적 또는 질병 상태 기계입니다. Polysomal 프로 파일링은 Leishmania transcriptional 제어 크게 결 석 하 고 유전자 표현 규제는 주로 발생을 포함 하는 trypanosomatids와 같은 유기 체에 있는 변환 규칙을 공부 하는 특히 적합 한 기법 동안에 번역.
여기, 우리 3 모델에 사용 되는 polysome 분별 프로토콜 설명: Leishmania 기생충, 경작된 한 인간 세포 및 마우스 조직. Polysome 분류 단계는 본질적으로;이 연구에 사용 된 다른 유기 체를 위해 동일 이다 그러나, lysate 준비 몇 가지 차이점이 있다. Leishmania 셀 액체 문화에서 성장 하 고 원심 분리에 의해 수집 되 고 셀 동일한 그라데이션에 로드 되도록 세포 전에 계산 됩니다. 인간의 세포 세척 하 고 접시에 직접 lysed 수 있습니다. 동일 로드는 광학 밀도 의해 제어 됩니다. 마우스 조직 필요 Dounce 균질 화기 효율적인 세포 Leishmania와 인간 세포, 동안에 경우 그것은 23 게이지 바늘을 통해 그들을 통과 하기에 충분.
모든 시 약 사용 무료 protease RNase 이어야 한다. 우리는 헤 파 린과 RNase 억제제 세포질 lysates의 RNase 활동의 억제제로 비교. 우리는 두 시 약 RNase 효과적으로 막을 수 있다는 것을 발견. 그러나, 헤 파 린 cDNA 준비 및 실시간 정량 같은 다운스트림 응용 프로그램을 영향을 줍니다. 그 결과, RNA의 준비는 헤 파 린 사용 하는 경우 추가 정화 단계를 필요 합니다. 우리의 의견에서 RNase 억제제 보다 편리 하 게 선택 이며 polysome 프로 파일링 프로토콜에서에서 효과적으로 사용할 수 있습니다.
Polysomal 프로 파일링 방법의 주요 한계는 집중, 노동 이다. 6 그라데이션까지 동시에 준비 될 수 있다. 그라데이션 fractionator 144 분수 시간의 짧은 기간에 처리 하는 생성 합니다. 너무 개별 분수의 분석은 시간 소모 하 고 비싼 수 있습니다. 따라서, 개별 분수를 결합 하 여 사전 polysomes로, 가볍고 무거운 polysomes는 신속 하 고 덜 힘 드는 방법은 개별 mRNAs의 변환 활동을 제공 합니다. 결합된 조각에 우리의 실시간 정량 결과 사용 하 여 다른 mRNAs Leishmania HeLa 세포 (그림 2, 3)에서의 translatability에 차이 식별 수 있었습니다. 그러나, 세밀 하 게 확인이 필요한 경우 다음 개별 분수의 분석 수행할 수 있습니다.
리보솜 프로 파일링 mRNA의 변환 상태를 공부 하는 또 다른 방법 이며, 리보솜38에 의해 보호 하는 mRNA 파편의 시퀀싱을 통해 단백질 생산의 측정에 기반. 이 기술 샘플, 번역 되 고 특정 polysomal 분수와 mRNA 시퀀스를 연결 하는 정량적 인 정보를 제공 하 고 mRNAs와 비교 codon 해상도 변환 상태에 정확한 정보를 제공할 수 있습니다. polysome 프로 파일링 기술입니다. 그러나, polysome 프로 파일링 따라서 polysomes의 프로테옴에 추가 정보를 제공 하는 RNA와 단백질 분석용 사용할 수 있습니다 하 고 번역의 규칙에 기여 하는 요소를 식별 합니다.
따라서, polysomal 프로 파일링 이며 개별 mRNAs의 변환 상태를 분석 하는 데 사용할 수 있는 다양 한 기술을 리보솜 관련 단백질 검사 실험에서 다른 다른 모형 유기 체에 있는 변환 규칙을 연구 조건입니다.
공개
저자는 공개 없다.
감사의 말
저자는 오디오 녹음에 대 한 칭이 감사합니다. 연구 택 사스 기술 대학 건강 과학 센터에서 창업 자금에 의해 지원 되었다 및 변환 신경 과학 및 치료제 (CTNT) 우수의 센터에 의해 부여 PN CTNT 2017-05 AKHRJDHW A.L.K.; NIH 교부 금에 의해 부분에서 R01AI099380 K.Z. 제임스 C. 퍼레이드와 순 영 R. Baca CISER (줄기의 통합 교육 및 연구를 위한 센터) 학자 고 프로그램에 의해 지원 되었다.
자료
| Name | Company | Catalog Number | Comments |
| Instruments: | |||
| Gradient master | Biocomp Instruments Inc. | 108 | |
| Piston Gradient Fractionator | Biocomp Instruments Inc. | 152 | |
| Fraction collector | Gilson, Inc. | FC203B | |
| NanoDrop One | Thermo Scientific | NanoDrop One | |
| Nikon inverted microscope | Nikon | ECLIPSE Ts2-FL/Ts2 | |
| 2720 Thermal Cycler | Applied Biosystems by Life Technologies | 4359659 | |
| CO2 incubator | Panasonic Healthcare Co. | MCO-170A1CUV | |
| HERATHERM incubator | Thermo Scientific | 51028063 | |
| Biological Safety Cabinet, class II, type A2 | NuAire Inc. | NU-543-400 | |
| Revco freezer | Revco Technologies | ULT1386-5-D35 | |
| Beckman L8-M Ultracentifuge | Beckman Coulter | L8M-70 | |
| Centrifuge | Eppendorf | 5810R | |
| Centrifuge | Eppendorf | 5424 | |
| Ultracentrifuge Rotor SW41 | Beckman Coulter | 331362 | |
| Swing-bucket rotor | Eppendorf | A-4-62 | |
| Fixed angle rotor | Eppendorf | F-45-30-11 | |
| Quant Studio 12K Flex Real-Time PCR machine 285880228 | Applied Biosystems by life technologies | 4470661 | |
| TC20 Automated cell counter | Bio-Rad | 145-0102 | |
| Hemacytometer | Hausser Scientific | 02-671-51B | |
| Software | |||
| Triax software | Biocomp Instruments Inc. | ||
| Materials: | |||
| Counting slides, dual chamber for cell counter | Bio-Rad | 145-0011 | |
| 1.5 mL microcentrifuge tube | USA Scientific | 1615-5500 | |
| Open-top polyclear centrifuge tubes, (14 mm x 89 mm) | Seton Scientific | 7030 | |
| Syringe, 5 mL | BD | 309646 | |
| BD Syringe 3 mL23 Gauge 1 Inch Needle | BD | 10020439 | |
| Nunclon Delta Surface plate, 14 cm | Thermo Scientific | 168381 | |
| Nunclon Delta Surface plate, 9 cm | Thermo Scientific | 172931 | |
| Nalgene rapid-flow 90mm filter unit, 500 mL, 0.2 aPES | Thermo Scientific | 569-0020 | |
| BioLite 75 cm3 flasks | Thermo Scientific | 130193 | |
| Nunc 50 mL conical centrifuge tubes | Thermo Scientific | 339653 | |
| Chemicals: | |||
| Trizol LS | Ambion by Life Technologies | 10296028 | |
| HEPES | Fisher Scientific | BP310-500 | |
| Trizma base | Sigma | T1378-5KG | |
| Dulbecco's Modified Eagle's Medium-high glucose (DMEM) | Sigma | D6429-500ML | |
| Fetal Bovine Serum (FBS) | Sigma | F0926-50ML | |
| Penicillin-Streptomycin (P/S) | Sigma | P0781-100ML | |
| Lipofectamine 2000 | Invitrogen | 11668-019 | |
| Dulbecco's phosphate buffered saline (DPBS) | Sigma | D8537-500ML | |
| Magnesium chloride hexahydrate (MgCl2x6H2O) | Acros Organics | AC413415000 | |
| Potassium Chloride (KCl) | Sigma | P9541-500G | |
| Nonidet P 40 (NP-40) | Fluka (Sigma-Aldrich) | 74385 | |
| Recombinant Rnasin Ribonuclease Inhibitor | Promega | N2511 | |
| Heparin sodium salt | Sigma | H3993-1MU | |
| cOmplete Mini EDTA-free protease inhibitors | Roche Diagnostics | 11836170001 | |
| Glycogen | Thermo Scientific | R0551 | |
| Water | Sigma | W4502-1L | |
| Cycloheximide | Sigma | C7698-1G | |
| Chloroform | Fisher Scientific | 194002 | |
| Dithiotreitol (DTT) | Fisher Scientific | BP172-5 | |
| Ethidium Bromide | Fisher Scientific | BP-1302-10 | |
| Ethylenediaminetetraacetic acid disodium dehydrate (EDTA) | Fisher Scientific | S316-212 | |
| Optimem | Life Technologies | 22600050 | |
| Puromycin dihydrochloride | Sigma | P8833-100MG | |
| Sucrose | Fisher Scientific | S5-3KG | |
| Trypsin-EDTA solution | Sigma | T4049-100ML | |
| Hgh Capacity cDNA Reverse Transcriptase Kit | Applied Biosystems by life technologies | 4368814 | |
| Power SYBR Green PCR Master Mix | Applied Biosystems by life technologies | 4367659 | |
| HCl | Fisher Scientific | A144SI-212 | |
| Isopropanol | Fisher Scientific | BP26324 | |
| Potassium Hydroxide (KOH) | Sigma | 221473-500G | |
| Anti-RPL11 antibody | Abcam | ab79352 | |
| Ribosomal protein S6 (C-8) antibody | Santa Cruz Biotechnology Inc. | sc-74459 | |
| 1xM199 | Sigma | M0393-10X1L | |
| Lithium cloride | Sigma | L-9650 | |
| Dimethyl sulfoxide (DMSO) | Fisher Scientific | D128-500 | |
| Gel Loading Buffer II | Thermo Scientific | AM8546G | |
| UltraPure Agarose | Thermo Scientific | 16500-100 | |
| Trichloracetic acid (TCA) | Fisher Scientific | A322-100 | |
| SuperSignal West Pico PLUS chemiluminescent substrate | Thermo Scientific | 34580 | |
| Formaldehyde | Fisher Scientific | BP531-500 | |
| Sodium Dodecyl Sulfate (SDS) | Sigma | L5750-1KG | |
| Phenylmethylsulfonyl fluoride (PMSF) | Sigma | P7626-5G | |
| RNeasy Mini kit | Qiagen | 74104 | |
| Adenosine 5′-triphosphate disodium salt hydrate (ATP) | Sigma | A1852-1VL | |
| Cytosine 5'-triphosphate disodium salt hydrate (CTP) | Sigma | C1506-250MG | |
| Uridine 5'-triphosphate trisodium salt hydrate (UTP) | Sigma | U6625-100MG | |
| Guanosine 5'-triphosphate sodium salt hydrate (GTP) | Sigma | G8877-250MG | |
| SP6 RNA Polymerase | NEB | M0207S | |
| Pyrophoshatase | Sigma | I1643-500UN | |
| Spermidine | Sigma | S0266-1G |
참고문헌
- Schwanhausser, B., et al. Global quantification of mammalian gene expression control. Nature. 473 (7347), 337-342 (2011).
- Capewell, P., et al. Regulation of Trypanosoma brucei Total and Polysomal mRNA during Development within Its Mammalian Host. PLoS One. 8 (6), e67069(2013).
- Warner, J. R., Knopf, P. M., Rich, A. A multiple ribosomal structure in protein synthesis. Proceedings of the National Academy of Science, USA. 49, 122-129 (1963).
- Piccirillo, C. A., Bjur, E., Topisirovic, I., Sonenberg, N., Larsson, O. Translational control of immune responses: from transcripts to translatomes. Nature Immunology. 15 (6), 503-511 (2014).
- Ennis, H. L., Lubin, M. Cycloheximide: Aspects of Inhibition of Protein Synthesis in Mammalian Cells. Science. 146 (3650), 1474-1476 (1964).
- Masek, T., Valasek, L., Pospisek, M. Polysome analysis and RNA purification from sucrose gradients. Methods in Molecular Biology. 703, 293-309 (2011).
- Gandin, V., et al. Polysome fractionation and analysis of mammalian translatomes on a genome-wide scale. Journal of Visualized Experiments. (87), (2014).
- Zuccotti, P., Modelska, A. Studying the Translatome with Polysome Profiling. Methods in Molecular Biology. 1358, 59-69 (2016).
- Chasse, H., Boulben, S., Costache, V., Cormier, P., Morales, J. Analysis of translation using polysome profiling. Nucleic Acids Research. 45 (3), e15(2017).
- Arava, Y., et al. Genome-wide analysis of mRNA translation profiles in Saccharomyces cerevisiae. Proceedings of the National Academy of Science, USA. 100 (7), 3889-3894 (2003).
- Gandin, V., et al. nanoCAGE reveals 5' UTR features that define specific modes of translation of functionally related MTOR-sensitive mRNAs. Genome Research. 26 (5), 636-648 (2016).
- Bazzini, A. A., Lee, M. T., Giraldez, A. J. Ribosome profiling shows that miR-430 reduces translation before causing mRNA decay in zebrafish. Science. 336 (6078), 233-237 (2012).
- Zanchin, N. I., Goldfarb, D. S. Nip7p interacts with Nop8p, an essential nucleolar protein required for 60S ribosome biogenesis, and the exosome subunit Rrp43p. Molecular Cell Biology. 19 (2), 1518-1525 (1999).
- Darnell, J. C., et al. FMRP stalls ribosomal translocation on mRNAs linked to synaptic function and autism. Cell. 146 (2), 247-261 (2011).
- Gkogkas, C. G., et al. Autism-related deficits via dysregulated eIF4E-dependent translational control. Nature. 493 (7432), 371-377 (2013).
- Robichaud, N., Sonenberg, N. Translational control and the cancer cell response to stress. Curr Opin Cell Biol. 45, 102-109 (2017).
- Gordon, B. S., Kelleher, A. R., Kimball, S. R. Regulation of muscle protein synthesis and the effects of catabolic states. International Journal of Biochemistry and Cell Biology. 45 (10), 2147-2157 (2013).
- Ishimura, R., et al. RNA function. Ribosome stalling induced by mutation of a CNS-specific tRNA causes neurodegeneration. Science. 345 (6195), 455-459 (2014).
- Petersen, C. P., Bordeleau, M. E., Pelletier, J., Sharp, P. A. Short RNAs repress translation after initiation in mammalian cells. Molecular Cell. 21 (4), 533-542 (2006).
- Juntawong, P., Girke, T., Bazin, J., Bailey-Serres, J. Translational dynamics revealed by genome-wide profiling of ribosome footprints in Arabidopsis. Proceedings of the National Academy of Science, USA. 111 (1), E203-E212 (2014).
- Bunnik, E. M., et al. Polysome profiling reveals translational control of gene expression in the human malaria parasite Plasmodium falciparum. Genome Biology. 14 (11), R128(2013).
- De Gaudenzi, J. G., Noe, G., Campo, V. A., Frasch, A. C., Cassola, A. Gene expression regulation in trypanosomatids. Essays in Biochemistry. 51, 31-46 (2011).
- Alves, L. R., Goldenberg, S. RNA-binding proteins related to stress response and differentiation in protozoa. World Journal of Biological Chemistry. 7 (1), 78-87 (2016).
- De Pablos, L. M., Ferreira, T. R., Walrad, P. B. Developmental differentiation in Leishmania lifecycle progression: post-transcriptional control conducts the orchestra. Current Opinions in Microbiology. 34, 82-89 (2016).
- Soto, M., et al. Cell-cycle-dependent translation of histone mRNAs is the key control point for regulation of histone biosynthesis in Leishmania infantum. Biochemical Journal. 379, 617-625 (2004).
- McNicoll, F., et al. Distinct 3 '-untranslated region elements regulate stage-specific mRNA accumulation and translation in Leishmania. Journal of Biological Chemistry. 280 (42), 35238-35246 (2005).
- Folgueira, C., et al. The translational efficiencies of the two Leishmania infantum HSP70 mRNAs, differing in their 3 '-untranslated regions, are affected by shifts in the temperature of growth through different mechanisms. Journal of Biological Chemistry. 280 (42), 35172-35183 (2005).
- Dumas, C., Chow, C., Muller, M., Papadopoulou, B. A novel class of developmentally regulated noncoding RNAs in Leishmania. Eukaryotic Cell. 5 (12), 2033-2046 (2006).
- Kapler, G. M., Coburn, C. M., Beverley, S. M. Stable transfection of the human parasite Leishmania major delineates a 30-kilobase region sufficient for extrachromosomal replication and expression. Molecular Cell Biology. 10 (3), 1084-1094 (1990).
- Karamyshev, A. L., Johnson, A. E. Selective SecA association with signal sequences in ribosome-bound nascent chains: a potential role for SecA in ribosome targeting to the bacterial membrane. Journal of Biological Chemistry. 280 (45), 37930-37940 (2005).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative C(T) method. Nature Protocols. 3 (6), 1101-1108 (2008).
- Panda, A. C., Martindale, J. L., Gorospe, M. Polysome Fractionation to Analyze mRNA Distribution Profiles. Bio Protocols. 7 (3), (2017).
- Sambrook, J., Fritsch, E. F., Maniatis, T. Molecular Cloning. A Laboratory Manual. , Cold Spring Harbor Laboratory Press. (1989).
- Patrick, A. E., Karamyshev, A. L., Millen, L., Thomas, P. J. Alteration of CFTR transmembrane span integration by disease-causing mutations. Molecular Biology of the Cell. 22 (23), 4461-4471 (2011).
- Kleizen, B., van Vlijmen, T., de Jonge, H. R., Braakman, I. Folding of CFTR is predominantly cotranslational. Molecular Cell. 20 (2), 277-287 (2005).
- van den Elzen, A. M., Schuller, A., Green, R., Seraphin, B. Dom34-Hbs1 mediated dissociation of inactive 80S ribosomes promotes restart of translation after stress. EMBO Journal. 33 (3), 265-276 (2014).
- Morita, M., et al. mTOR Controls Mitochondrial Dynamics and Cell Survival via MTFP1. Molecular Cell. 67 (6), 922-935 (2017).
- Ingolia, N. T., Ghaemmaghami, S., Newman, J. R., Weissman, J. S. Genome-wide analysis in vivo of translation with nucleotide resolution using ribosome profiling. Science. 324 (5924), 218-223 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유