Method Article
在利什曼原虫、人体细胞和小鼠睾丸中的 Polysome 分析
摘要
polysome 分析技术的总体目标是分析个体基因或转录基因在蛋白质合成过程中的平移活动。该方法对健康和多人疾病的蛋白质合成调控、翻译活化和抑制的研究具有重要意义。
摘要
正确的蛋白质表达在适当的时间和正确的数量是正常细胞功能和生存在一个快速变化的环境的基础。长期以来, 基因表达研究以转录水平的研究为主。然而, 基因的稳态水平与蛋白质的生产没有很好的关联, 基因的可译性因条件而变化很大。在某些有机体, 象寄生虫利什曼原虫, 蛋白质表达在翻译水平上主要被调控。最近的研究表明, 蛋白质翻译失调与癌症、新陈代谢、神经变性和其他人类疾病有关。Polysome 分析是研究蛋白质翻译规律的有力方法。它允许测量个体基因的平移状态或在全基因组范围内检查翻译。这种技术的基础是分离 polysomes, 核糖体, 他们的亚基和自由基因在离心的细胞质裂解过程中通过蔗糖梯度。在这里, 我们提出了一个通用的 polysome 分析协议, 用于三种不同的模型-寄生虫利什曼原虫少校, 培养的人类细胞和动物组织。利什曼原虫细胞在悬浮体中自由生长, 培养的人细胞生长在粘附单层, 而小鼠睾丸代表动物组织样本。因此, 该技术适用于所有这些来源。polysomal 分数分析的协议包括通过 rt-pcr 检测个体 mRNA 水平、qPCR 蛋白和用电泳分析核糖体 rna。通过对基因与核糖体在转录水平上的研究, 通过对核糖体相关蛋白的分型质谱分析, 可以进一步扩展该方法。该方法可以很容易地调整到其他生物模型。
引言
细胞基因表达调控由转录、转录后水平和翻译后机制控制。在深 RNA 测序方面的进展允许在一个空前的水平上研究基因组范围内的稳态 mRNA 水平。然而, 最近的研究发现, 稳态 mRNA 水平并不总是与蛋白质生产相关1,2。一个单独的成绩单的命运是非常复杂的, 取决于许多因素, 如内部/外部刺激, 压力,等。在蛋白质合成过程中, 基因表达调控为在变化条件下快速反应提供了另一层表达控制。Polysome (或 "polyribosome") 剖面分析, 积极翻译核糖体的分离和可视化, 是研究蛋白质合成调控的有力方法。虽然, 它的第一个实验应用出现在二十世纪六十年代3中, polysome 分析目前是蛋白质翻译研究4中最重要的技术之一。单基因可由多个核糖体转化导致形成 polysome。转录可以停滞在核糖体与放线菌酮5和基因包含不同数量的 polysomes 可以在 polysome 分馏过程中分离的蔗糖梯度离心 6, 7 ,8,9. polysomal 分数的 RNA 分析然后允许测量基因组范围内单个基因的平移状态的变化, 在不同的生理条件下4,7,10. 该方法还用于揭示 5 ' UTR 和 3 ' UTR 序列在 mRNA 可译性的控制中的作用11, 检查 miRNAs 在平移抑制中的角色12, 揭开核糖体合成13 的缺陷, 并了解核糖体相关蛋白与人类疾病的作用14,15。在过去的十年中, 在翻译过程中对基因表达调控的作用越来越大, 这说明了它在人类疾病中的重要性。在癌症、代谢和神经退行性疾病中进行平移控制的证据非常惊人15,16,17,18。例如, eIF4E-dependent 平移控制的失调有助于自闭症相关的赤字15和 FMRP 参与停滞的核糖体基因链接到自闭症14。因此, polysomal 分析是研究多种人类疾病的翻译调节缺陷的重要工具。
不同生理条件下 polysomal 分数的蛋白质分析, 对翻译过程中核糖体相关因素的作用进行了剖析。polysome 分析技术已用于许多物种, 包括酵母, 哺乳动物细胞, 植物和原生动物10,19,20,21。像锥和利什曼原虫这样的原生动物寄生虫表现出有限的基因表达转录控制。他们的基因组被组织成 polycistronic 基因簇, 缺乏启动子调控的转录22。相反, 发展基因表达主要控制在蛋白质的翻译水平和 mRNA 稳定性的 trypanosomatid 物种23,24。因此, 在缺乏转录调控的情况下理解平移控制对这些生物体尤为重要。Polysomal 分析是研究利什曼原虫25、26、27、28中基因表达转录后水平调控的有力工具。
通过实时定量 PCR (RT-qPCR) 和转录的下一代测序以及蛋白质组学技术检测个体基因水平的最新进展, 将 polysomal 分析的解决方案和优势带到了一个新的层次。通过对单个 polysomal 分数的分析, 结合蛋白质组学分析的方法, 可以进一步扩大对各细胞的使用, 以监测整个基因型范围内体细胞的平移状态。这使得在不同的生理和病理条件下, 识别新的分子玩家调节翻译。在这里, 我们提出了一个通用的 polysome 分析协议, 用于三种不同的模型: 寄生虫利什曼原虫少校, 培养的人类细胞和动物组织。本文就不同生物体的细胞裂解物的制备、梯度条件的优化、RNase 抑制剂的选择、qPCR、印迹和 RNA 电泳等方面的应用提出建议, 以分析 polysome 分数。
研究方案
所有动物的治疗和组织的处理获得的研究是根据协议的机构动物护理和使用委员会在德州理工大学健康科学中心按照国家研究所健康动物福利准则, 96005 号议定书。请牺牲脊椎动物, 根据动物保育和使用委员会的指导方针准备组织。如果缺乏这样一个委员会, 请参考国家卫生研究院动物福利指南。成人 (> 60 天) C57BL/6 小鼠使用。所有动物和组织都是根据美国德州理工大学卫生科学中心的机构动物护理和使用委员会批准的协议获得的, 根据国家卫生动物福利研究所的准则。对于安乐死, 一只老鼠被放在一个小房间里, 空气逐渐偏移, 大约有30% 二氧化碳麻醉, 并将动物的痛苦降到最低。在呼吸停止后, 我们用颈椎脱位来确认动物在收割组织前的死亡。
注意: 所有与活的利什曼原虫和培养的人类细胞的工作都是在 BSL-2 认证实验室的生物安全柜中完成的。
1. 从利什曼原虫少校、培养的人体细胞和小鼠组织中制备细胞质裂解物
注: 不同来源材料的裂解制剂有几个不同之处。其他步骤, 包括蔗糖梯度准备和 polysomal 分馏是相同的, 不依赖于样品来源。
-
利什曼原虫主要细胞质裂解制剂
- 接种利什曼原虫少校(FV1 应变) 细胞在30毫升 1x M199 中29含有10% 胎牛血清 (血清) 和青霉素/链霉素混合物 (100 单位和100微克/毫升相应) 在密度 1x105细胞/毫升.
注意: 涉及利什曼原虫主要单元格的所有步骤都必须在生物安全柜中进行。 - 将细胞放置在孵化器中, 并将其生长在27摄氏度, 直到对数相 (中间的日志对应于 5x106细胞/mL)。它通常需要两天的时间来成长。
- 将放线菌酮添加到利什曼原虫主要区域性, 最终集中100微克/毫升以在翻译的基因上逮捕核糖体。将细胞放回孵化器中10分钟, 在27摄氏度。
- 放线菌酮治疗完成后, 将细胞转移到50毫升圆锥管, 并将其旋转 1800 x g 和4°c, 以8分钟为单位丢弃上清。
- 用30毫升 Dulbecco 磷酸盐缓冲盐水 (DPBS) 冲洗细胞。离心机在 1800 x g 和4°c 为8分钟。
- 放弃上清。并用重悬细胞在1毫升的 DPBS。
- 整除细胞, 并将其与3.5% 甲醛溶液混合。
- 通过 hemocytometer 计数细胞并确定它们的浓度。将所需的细胞数转移到离心管中。从 0.5x108-2x108细胞/mL 中制备的裂解液足够用于一个蔗糖梯度加载。
- 旋转细胞在 1800 x g 和4°c 为8分钟. 丢弃上清。
- 并用重悬在1毫升含有蛋白酶抑制剂和 RNase 抑制剂 (20 毫米 HEPES) 的裂解缓冲液中, 将细胞颗粒放在冰上, pH 值 7.4, 100 毫米氯化钾, 10 毫米氯化镁2, 2 毫米, 1% NP-40, 1x 蛋白酶抑制剂鸡尾酒 (无 EDTA), 200 单位/毫升 RNase 抑制剂)。
- 通过23口径针三倍的裂解液。在通过针后, 裂解液应变得透明。
- 离心机在 11200 x g 和4°c 为10分钟澄清裂解。将澄清的裂解液转移到新鲜的管子上, 并将其保存在冰上直到蔗糖梯度离心。
- 收集 400-500 ul 的裂解剂作为输入 (稍后分析), 冻结它在液氮中的未来蛋白质分析或添加 rna 纯化试剂冷冻前的 rna 分析。
- 接种利什曼原虫少校(FV1 应变) 细胞在30毫升 1x M199 中29含有10% 胎牛血清 (血清) 和青霉素/链霉素混合物 (100 单位和100微克/毫升相应) 在密度 1x105细胞/毫升.
-
人 HeLa 细胞培养的细胞质裂解制剂
- 将 HeLa 细胞分裂成20毫升的 DMEM 培养基, 其中含有10% 的血清和青霉素/链霉素混合物 (100 个单位和100微克/毫升相应), 细胞计数 2x105细胞/毫升在15厘米板中。
- 生长 HeLa 细胞在37°c, 5% CO2为 20-24 h. 根据制造商的协议进行质粒 DNA 转染。
- 在37°c、5% CO2转染后, 将细胞传播24小时。
- 添加放线菌酮到生长的 HeLa 细胞到最后浓度的100微克/毫升, 以逮捕核糖体在翻译基因和孵化细胞为10分钟37摄氏度, 5% CO 2.吸入培养基。用冷 DPBS 在冰上洗两次细胞。
- 添加 500 ul 的裂解缓冲 (20 毫米 HEPES-KOH pH 7.4, 100 毫米氯化钾, 5 毫米氯化镁2, 1 毫米, 0.5% NP-40, 1x 蛋白酶抑制剂鸡尾酒 (无 EDTA), 200 单位/毫升 RNase 抑制剂或1毫克/毫升肝素) 到板上, 并刮在冰上的细胞。
- 将裂解细胞转移到离心管。根据样品体积的增加, 将 NP-40 的浓度调整为0.5% 和氯化镁2到5毫米。
- 通过23口径针3-6 倍的裂解液。
- 旋转 11200 x g 和4°c 8 分钟, 以澄清裂解。离心后, 将上清液转移到新管上。使用分光光度计评估细胞裂解效率, 并确定在梯度上加载的样本量。添加 10 ul 样品到0.5 毫升的0.1% 月桂酸钠 (SDS)。空白对 0.1% SDS。测量吸光度在 260 nm。预期吸光度值约为15-20 单位/毫升。
- 在蔗糖梯度离心前稀释所有与裂解缓冲剂相同的吸光度值。将样品保存在冰上直到蔗糖梯度离心。
-
小鼠睾丸胞浆裂解制剂的制备
- 解剖小鼠睾丸。在膜中做一个小切口, 收集睾丸的精管, 并将其转移到含有5毫升 DPBS 的15毫升圆锥管内, 辅以0.1 毫米 phenylmethylsulfonyl 氟化物 (PMSF)。
- 多次反转, 使组织剧烈混合。允许组织在冰上以单位重力沉降5分钟。
- 除去和丢弃含有结缔组织和组织片段的多云缓冲区。重复这个过程2-3 次。其余的白色颗粒被丰富的精矿小管和生殖细胞。
- 将精管小球转移到2毫升离心管内, 在 500 x g 处旋转1分钟。
- 添加500µL 裂解缓冲液 (20 毫米三盐酸, pH 值 7.4, 100 毫米氯化钾, 5 毫米氯化镁2, 1 毫米, 0.5% NP-40, 1x 蛋白酶抑制剂鸡尾酒 (无 EDTA), 1 毫克/毫升肝素或200单位/毫升 RNase 抑制剂) 到小管。用吸管 triturate 组织。
- 将悬浮液转移至小 (0.5-1.0 毫升) Dounce 均质机。用玻璃杵的七到八冲程扰乱组织。
- 将裂解液转移到1.5 毫升离心管。
- 离心样品在 1.2万 x g 和4°c 8 分钟, 以清除裂解。将上清液转移到新管上, 储存在冰上, 直到在蔗糖梯度上加载。
- 收集 50 ul 的裂解液作为输入样本, 冻结它马上在-80 °c 为未来的蛋白质分析;或者在冷冻前加入 rna 纯化试剂进行 rna 分析。
2. 蔗糖梯度的制备和离心
- 准备两个蔗糖梯度溶液 (20 毫米 HEPES, pH 值 7.4, 100 毫米氯化钾, 10 毫米氯化镁2, 1 毫米, 1x 蛋白酶抑制剂鸡尾酒), 含有10% 蔗糖或50% 蔗糖。(三盐酸, pH 值 7.4, 可以使用而不是 HEPES)。根据实验设计, 添加200个单位/毫升 RNase 抑制剂或1毫克/毫升肝素。将 ultracentrifuge 管用于 SW 41 转子进入标记块并沿该块的上层绘制线。把管子转到一个稳定的架子上。
- 采取10毫升注射器与分层设备连接, 并填补注射器与10% 蔗糖溶液 (准备如上)。轻轻松开它在 ultracentrifuge 管的底部, 直到它到达管上的标记。
- 用50% 蔗糖溶液填充另一注射器, 并小心地将其分层装置通过10% 蔗糖层插入管底部。从底部开始轻轻地释放蔗糖溶液, 直到它到达管子上的标记。用所提供的瓶盖封住管子。
- 要准备蔗糖渐变, 请打开 "渐变制造器" 设备ON。使用向上或下拉按钮对板进行水平设置, 然后按完成。调平对渐变的线性度很重要。
- 在对板进行平整后, 按研究生打开渐变菜单。转到 "渐变" 菜单上的列表, 然后选择 SW 41 Ti 转子。然后使用向上和下拉按钮从菜单列表中选择所需的蔗糖渐变。按使用。
- 将渐变管架放在渐变制造板上。把管子转到支架上。可同时准备多达6个渐变。按运行。梯度发生器按编程速度和角度旋转管子, 形成线性梯度。准备渐变要花几分钟时间。
- 完成过程后, 将管子放在机架中。把帽子摘下来。从 ultracentrifuge 管顶部取出与试样体积相同的体积。
- 仔细加载 400-500 ul 的裂解液, 其中包含15-20 个在顶部的 polysomes 的260单位。把管子放在转子桶里, 平衡它们。
- 离心机在 26万 x g 和4°c 2 小时使用 SW 41 转子。
3. Polysome 分馏和样品收集
注: 虽然裂解制剂有一定的差异, 根据来源, 梯度准备和 polysome 分馏协议是相同的所有类型的裂解物。
- 离心完成后, 将转子桶与管子放在冰上。打开分数收集器和渐变分馏塔ON。单击 "分馏塔" 菜单上的扫描。把24收集管的架子放进分数收集器。
- 用去离子水填满分馏塔一侧的冲洗池。按下十年代的冲洗键以在分馏塔上冲洗泵。将冲洗适配器与装满水的注射器连接在活塞上进行校准。
- 打开计算机上的分馏塔软件。按校准。使用默认设置并按确定。准备从注射器中注入水。
- 按确定进行校准。立即开始为下5秒注入水。在这段时间内, 水会流经紫外线探测器的流动细胞, 仪器将被校准。将出现符号零校准完成。该仪器已准备好进行分馏。
- 用注射器取出冲洗适配器。将尖端连接到分馏塔的活塞上。
- 打开黄铜空气阀, 并按空气键十年代, 以干油管和流动电池。关闭气阀。
- 轻轻地从转子桶中取出渐变管并将其放在机架中。将管座帽涂在管子的顶部, 并小心地将管子移入管架内, 并将其锁定到位。
- 将持有人置于分馏塔的活塞下。通常, polysomal 带可以通过眼睛看到。介绍所需的分数和体积的设置 (24 分数在 500 ul/分数通常是足够的)。适当地命名该文件。按确定, 然后转到图形按钮。在下一个窗口中, 按开始扫描。设置将显示, 请按确定。收集器将从排水沟移动到第一个分数, 活塞将进入管。当活塞到达梯度的顶端, 它会减慢到选定的速度和分数将收集。完成后, 活塞从渐变管中移出。
- 打开黄铜气阀并按下分馏塔上的air键以检索最后一小部分。
- 把管子从架子上移到冰上。
- 将2卷 rna 纯化试剂添加到每一个分数, 并在液氮中快速冷冻直至 RNA 纯化。或者, 如果需要分析蛋白质, 添加乙酸酸到最终浓度为 10%, 将其浓缩为西方印迹 (见8节)。
4. qPCR 数据分析中基因水平规范化的合成 RNA体外制备
注意: 本协议中使用了大肠杆菌欧帕 mRNA 进行规范化。任何其他 RNA 没有广泛的身份与研究的有机体的基因 (哺乳动物或利什曼原虫) 可以使用。
- 用含有欧帕基因30的质粒的标准 PCR 反应制备含有 SP6 启动子序列的欧帕 DNA 片段。
- 准备100µL 的混合物:80 毫米 HEPES, pH 值 7.5, 16 毫米氯化镁2, 2 毫米胺, 10 毫米多线, 3 毫米 ATP, 3 毫米 CTP, 3 毫米 UTP, 3 毫米 GTP, 0.5 U/ul RNase 抑制剂, 1 微克欧帕 PCR DNA, 3 ul SP6 RNA 聚合酶, 0.005 U/ul 焦磷酸酶。
- 孵育40°c 为2小时。
- rna 纯化试剂盒纯化 rna。
- 用分光光度法测定浓度, 用琼脂糖凝胶电泳检查。
5. RNA 分离从梯度组分和 cDNA 准备
注: 如果使用 RNase 抑制剂作为核糖核酸抑制剂, 则直接使用此协议进行 RNA 纯化。然而, 当用作核糖核酸抑制剂时, 肝素会抑制逆转录酶在 cDNA 制备中的应用。因此, 如果用肝素在溶解缓冲和梯度中使用, 则需要额外的 RNA 纯化。请参阅6节, 以制备 RNA 为 cDNA 合成如果使用肝素。
- 将含有 rna 纯化试剂的样品解冻, 加入20的合成 RNA 作为 qPCR 结果规范化的内部控制。根据制造商的协议进行 RNA 的准备, 除了一个修改。添加1µL 的 RNA 级糖原 (20 µg) 前异丙醇沉淀。将 RNA 颗粒溶于20-25 µL 的 RNase 水中。
注意: 糖原作为载体, 有助于避免损失和可视化 RNA 颗粒在纯化过程中。欧帕 mRNA 用于 qPCR 反应的进一步规范化。 - 用分光光度法测定 RNA 浓度, 确保产量充足。将含有40S、60S 和 monosomes 的 RNA 分数的相等体积组合为 prepolysomes。含有2-4 核糖体的分数作为轻 polysomes 和5-8 核糖体的分数组合为重 polysomes。
- 使用5-10 µL 的 RNA 从组合的分数, 以准备基因使用套件和以下制造商的建议。
- 添加80µL 核酸酶游离水到20µL 的 cDNA。将 cDNA 样本冷冻-20 摄氏度。
6. 从肝素污染中提取 RNA
注: 肝素抑制核酸处理酶 (如逆转录)。因此, 当肝素用于溶解缓冲和/或梯度时, 使用这个附加的纯化协议。
- 添加 LiCl 到1米最终浓度的纯化 RNA 样品。
- 将样品混合在冰上孵育1小时。
- 旋转样品在 1.6万 x g 和4°c 为15分钟。
- 用吸管将上清液取出即可完成。
- 空气干燥的颗粒约5分钟。
- 在 RNase 水的初始体积内重新悬浮颗粒。
- 执行分光光度法测量 260 nm, 以确定 RNA 的浓度。通常, 样品的损失是极小的。
7. qPCR 和基因分布的数据分析
- 结合 10.2 ul 的水, 20 ul 的 SYBR 绿色, 4.8 ul 的基因特异性引物 (2.5 微米每套), 5 ul 的 cDNA, 混合良好和负载 10 ul 每井在 triplicates 成384井板块。
- 盖板与胶膜紧密和离心板在 1800 x g 5 分钟。
- 使用实时 PCR 仪在表 1中显示的条件下设置 qPCR 反应。
- 使用循环阈值 (CT) 和比较 Ct (ΔΔCT) 方法31计算 prepolysomes、轻型和重 polysomes 中 mRNA 分布的百分比 (%), 如所述32与一个修改。在 qPCR 数据分析中使用合成 RNA (欧帕) 进行数据规范化。合成 RNA 提供了一个规范化的控制, 允许计算相对基因水平, 并比较在不同的梯度分数。
8. 西方印迹法分析 Polysomal 馏分中的蛋白质
- 从 100% (瓦特/v) 股票, 添加乙酸酸 (TCA) 到选定的分数 (500 ul) 到最后浓度为 10%, 保持在冰上至少15分钟, 离心机在一个离心为5分钟, 放弃上清, 洗两次与冰冷的丙酮和溶解在 25 ul S用于电泳的 DS 页样本加载缓冲区。
- 负载在 SDS 页和进行标准电泳与以下转移到 PVDF 膜。继续进行西方印迹33。
结果
在本研究中, 我们描述了 polysomal 分析技术在三种不同来源的应用: 寄生性的利什曼原虫少校、培养的人体细胞和小鼠睾丸。利什曼原虫细胞在悬浮液培养基中自由生长, 培养的人细胞生长在板上的贴膜上, 小鼠睾丸代表组织样本。该方法可以很容易地调整到其他类型的自由生长细胞在悬浮, 不同类型的组织, 或从另一个有机体, 和不同类型的培养细胞。该方法由四个主要步骤组成: 裂解制剂、蔗糖梯度制备和离心步骤、polysome 分馏和样品采集, 然后对馏分进行分析。从不同来源的细胞收集, 洗涤和裂解溶解缓冲通过通过针或 Dounce 均质。离心是用来去除细胞碎片, 澄清裂解物。渐变分馏的方案显示在图 1A中。一个连续的蔗糖梯度是由混合10% 和50% 蔗糖溶液在梯度制造商。裂解液加载到渐变的顶部。离心分离基因与不同数量的核糖体, 这是监测的紫外检测器在分馏过程中, 形成一个独特的吸光度谱。收集的分数用于 RNA 和蛋白质分析 (图 1B)。RNA 可以通过电泳和北方印迹进行分析, 或者用于 cDNA 生产, 然后进行 qPCR 反应, 分析个体基因与 polysomes 的关系。下一代测序可用于分析基因在全基因组范围7上的平移状态。对于 polysomal 分数的蛋白质分析, 蛋白质是用乙酸酸沉淀来浓缩的。蛋白质然后由西方印迹或在蛋白质组水平的质谱分析。
图 2A中显示了从利什曼原虫主要中生成的典型 polysomal 配置文件。分馏的吸光度图有一个明显的形状与典型的峰值的核糖体亚基 (40S 和 60S), 单核糖体 (80S 或 monosomes) 和 polysomes。
采用定量 rt-pcr (rt qPCR) 检测单个利什曼原虫基因与核糖体和 polysomes 的关联。比较 Ct (ΔΔCt)31方法是研究单元格中相对基因水平的一种简单而恰当的方法。这种方法需要内部控制 (一种稳定的 mRNA, 在处理或实验条件下不改变表达式) 进行计算。然而, 在 polysomal 分数中没有内部控制, 因为任何 mRNA 或核糖体 RNA 的水平在分数上会有所不同, 这取决于它们与核糖体、polysomes、等的关联。为了解决内部控制问题, 我们用合成细菌欧帕 mrna 对分数中相对个体的利什曼原虫mrna 水平进行规范化。欧帕 mRNA 被合成为体外, 并在 RNA 提取前增加到每一个分数的相等量。合成 RNA 的添加非常重要, 因为它使 qPCR 数据的计算更加精确, 可以通过比较 Ct (ΔΔCt) 方法来作为计算的内部控制。
整除数的梯度分数被混合成三组: prepolysomes (亚基和 monosomes), 光 polysomes (包括2-4 核糖体) 和重 polysomes (包括5-8 核糖体)。对组合分数的 RNA 进行 RT qPCR, 分析这些组合分数之间的 mRNA 分布 (图 2B)。以18S 核糖体 RNA 为对照。qPCR 的相对水平与小核糖体亚基 (游离亚基、monosomes 和 polysomes 的一部分) 的估计分布密切相关。qPCR 分析显示, 在利什曼原虫增长的对数阶段, 单独的基因测试有不同程度的翻译参与。蛋白 mRNA 优先与重 polysomes, 建议有效的翻译。相比之下, Sherp mrna 主要与 prepolysomes 和光 polysomes 支持较少活跃的翻译相比蛋白 mrna。
重组蛋白在培养细胞中的表达是不同类型研究的重要实验方法。在这里, 我们提出一个例子, polysomal 分析重组蛋白基因在另一个样本源, 培养的人类细胞。HeLa 细胞瞬时转染的质粒表达重组囊性纤维化跨膜电导调节剂 (CFTR)34或 Norrie 疾病蛋白 (民族民主党)。polysome 分馏的吸光度谱从这两种独立的文化是非常相似的, 并包含明显的峰值相应的核糖体亚基 (40S 和 60S), monosomes (80S) 和 polysomes (图 3A)。这些实验的光谱相似性说明了梯度分馏的重现性。与利什曼原虫研究一样, 基因的分布由表示 prepolysomes、轻 polysomes 和重 polysomes (图 3B) 的分数中的 RT qPCR 决定。检测小核糖体亚基 18S RNA 与它们在光谱中的估计分布相关。民族民主党基因主要与轻和重的 polysomal 分数有关, 而 CFTR 基因主要见于 prepolysome 分数, 这表明国民民主党的翻译效率更高。虽然民族民主党是一个相对较小的蛋白质, CFTR 是一个非常大的蛋白质 (1480 氨基酸残留) 组成的几个领域, 在翻译35中独立折叠。CFTR mRNA 与 polysomes 的降低可能反映了 cotranslational 折叠其不同域所需的较慢的翻译。
Polysome 分数也可用于检测蛋白质。以 HeLa 细胞核糖体蛋白 (图 4) 为例, 对梯度分数中的蛋白质进行检测。蛋白质被集中由降雨雪与 10% TCA 从组分和西部污点被用来检测小亚基核糖体蛋白 RPS6 和大亚基核糖体蛋白 RPL11 (图 4, 顶部面板)。它们的分布与吸光度谱上的明显峰值有很好的相关性。这些实验清楚地证明, polysome 分数可以用来分析蛋白质。
使用了 polysomes 分馏的许多不同的蔗糖浓度梯度 (例如, 7-47%36、5-50%7、7-50%6 、10-50%37、15-50%8和其他)。在这里, 我们比较了两个渐变10-50% 和 17-51% (图 5)。虽然, 17-51% 产生了可接受的结果, 在10-50% 梯度的分离是整体更好。
有充分的证明, 螯合剂, 如 EDTA, 扰乱核糖体和 polysomes8,9。如图 6所示, EDTA 在梯度加载前对 HeLa 裂解液进行处理会导致峰值的消失, 相应于 monosomes 和 polysomes, 核糖体亚基峰的显著增加。该实验作为一种控制, 证明了观察到的峰值没有 EDTA 治疗实际上是核糖体 monosomes 和 polysomes。
图 7显示了从鼠标睾丸 polysome 分馏的结果。吸光度谱与利什曼原虫和 HeLa 细胞有相似之处: 核糖体亚基、monosomes 和 polysomes 的显著峰。它们的形状和分布产生一个签名外观, 使它们在不同的 polysomal 谱上容易识别。用琼脂糖凝胶 (图 7、顶板) 电泳分析了从所选馏分中提取的分数和 rna 的总 rna。电泳显示18S 和28S 核糖体 rna 的典型分布。他们锋利的带子表明了样品的完整性。该凝胶可用于单独的基因检测由以下北印迹或它可以用来评估样品的质量之前, 进一步实验的 rna 或蛋白质分析-扩散核糖体 rna 带表明 RNA 降解的样品。
在我们的研究中, 我们用 RNase 抑制剂和肝素作为 RNase 抑制剂的裂解物和蔗糖梯度。虽然两者都提供了令人满意的结果, 使用 RNase 抑制剂是最好的 RNA 分析, 因为它不抑制 cDNA 和 qPCR 反应。因此, 它不需要额外的 RNA 纯化步骤。然而 , 如果研究人员决定在 polysome 准备过程中使用肝素 , 请注意肝素抑制应用 , 如 RT qPCR 和其他 RNA 纯化步骤是必要的 ( 见协议 6 节 ) 。
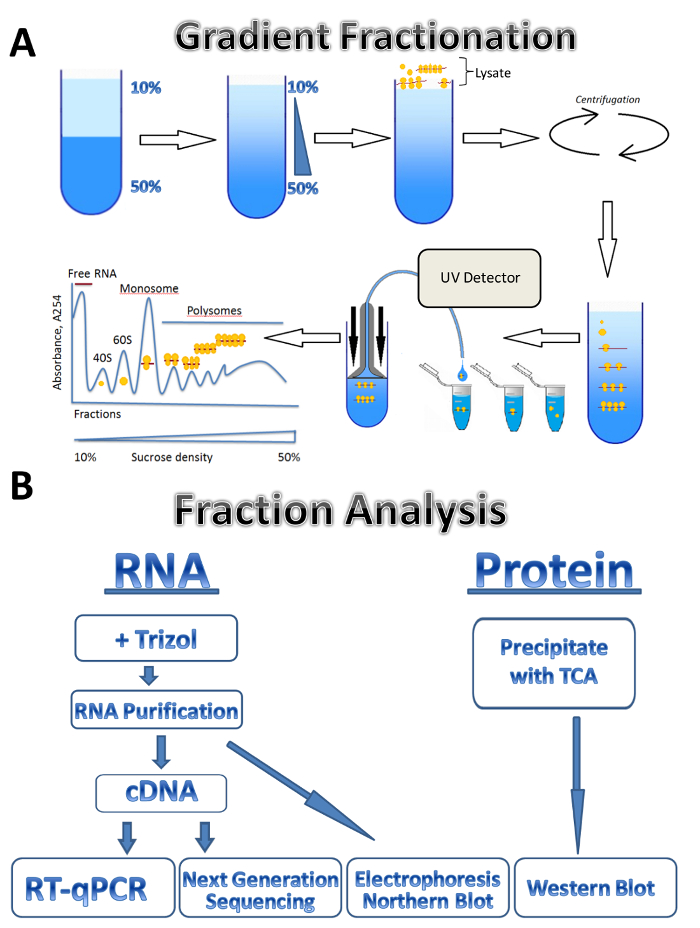
图 1.Polysome 分析.(A)渐变准备、polysome 分馏和吸光度剖面的方案。(B)分数分析方案。请单击此处查看此图的较大版本.
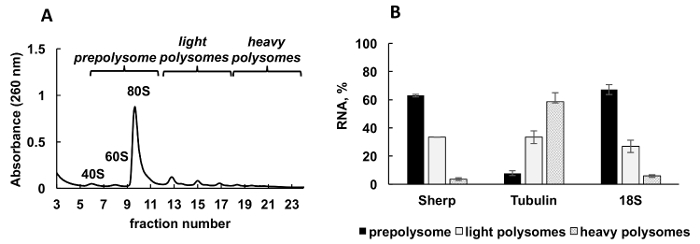
图 2.Polysome 概要分析利什曼原虫主要区域性在对数阶段的增长。(A)细胞质裂解液分10-50% 蔗糖梯度。(B)在 prepolysomes 中的 18S RNA、蛋白和 Sherp 基因 (%) 的相对分布, 由 RT polysomes 分析的对数细胞的光和重 qPCR。将含有40S、60S 和 monosomes 的分数组合为 prepolysomes。2-4 核糖体的分数被组合为光 polysomes, 而5-8 核糖体的分数则形成重 polysomes。合成的大肠杆菌欧帕 mRNA 添加到分数前 RNA 提取作为规范化控制的 RT-qPCR。比较 Ct (ΔΔCt)31方法用于计算 mRNA 水平。错误条表示标准错误。请单击此处查看此图的较大版本.
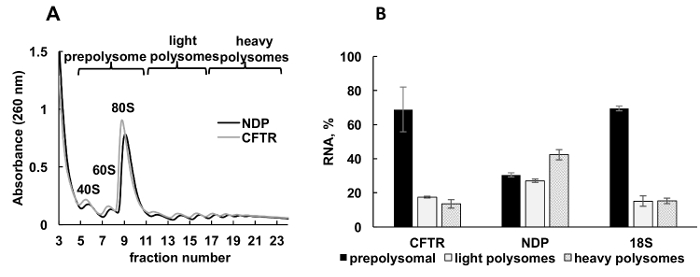
图 3.Polysome 重组 CFTR 和民族民主党基因与核糖体基因转染质粒 dna 的分离和分析.(A) Polysomal 在 CFTR 和民族民主党转基因质粒上转染的 HeLa 细胞中的分布。采用 10%-50% 蔗糖梯度实现 polysomes 分离。指出了小 (40S) 和大 (60S) 亚基的峰值以及 monosome (80S)。分数组合在面板A上显示, 用于进一步分析。(B)基因 CFTR 和国民民主党在不同分数中的分布情况。采用 RT qPCR 检测 18S, 作为 polysome 分馏的控制。用 RT-qPCR 分析法对 RNA 水平进行评价。用合成 mRNA 对数据进行规范化。比较 Ct (ΔΔCt)31方法用于计算 mRNA 水平。错误条表示标准错误。请单击此处查看此图的较大版本.
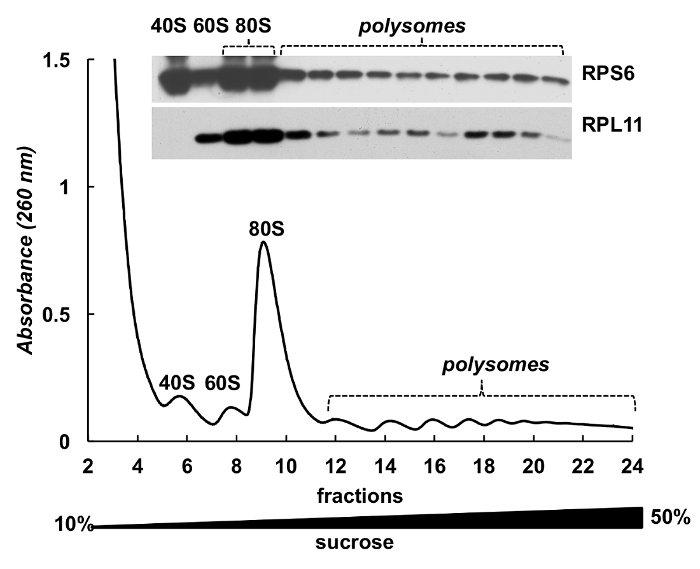
图 4.polysomal 中核糖体蛋白的检测.采用 10%-50% 蔗糖梯度离心法进行 HeLa 细胞裂解。用小鼠单克隆 RPS6 和兔多克隆 RPL11 抗体作为原发抗体和过氧化物酶-共轭山羊, 用 TCA 对12% 页蛋白进行了分离, 并通过电泳分析了所选馏分中的蛋白质。抗鼠或抗兔二级抗体。信号的可视化是通过 SuperSignal 西皮加化学发光基底进行的。请单击此处查看此图的较大版本.
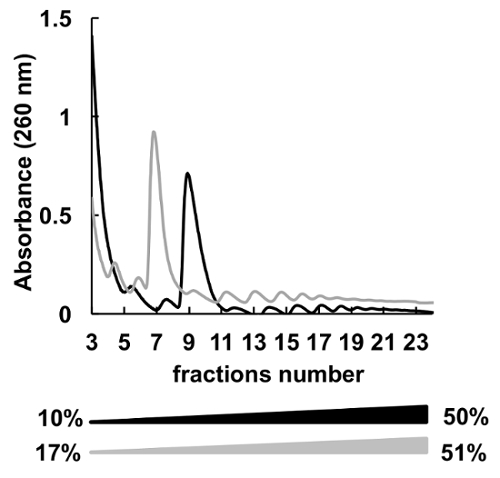
图 5.10%-50% (黑色) 或 17%-51% (灰色) 蔗糖梯度中 HeLa polysomal 分析的比较.请单击此处查看此图的较大版本.
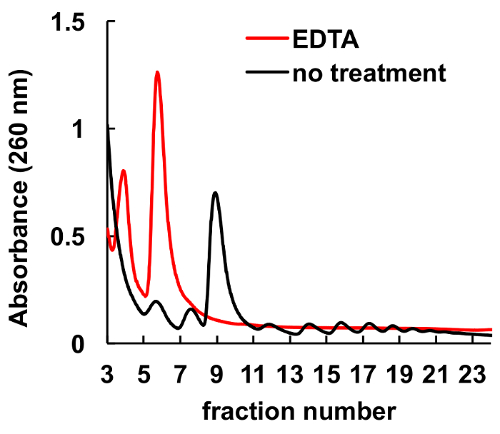
图 6.EDTA 处理对 HeLa 细胞 polysomal 剖面的影响.在蔗糖梯度离心前, 用10毫米 EDTA 在冰上治疗 HeLa 细胞裂解液10分钟。氯化镁2在蔗糖梯度溶液中被5毫米 EDTA 取代。请单击此处查看此图的较大版本.
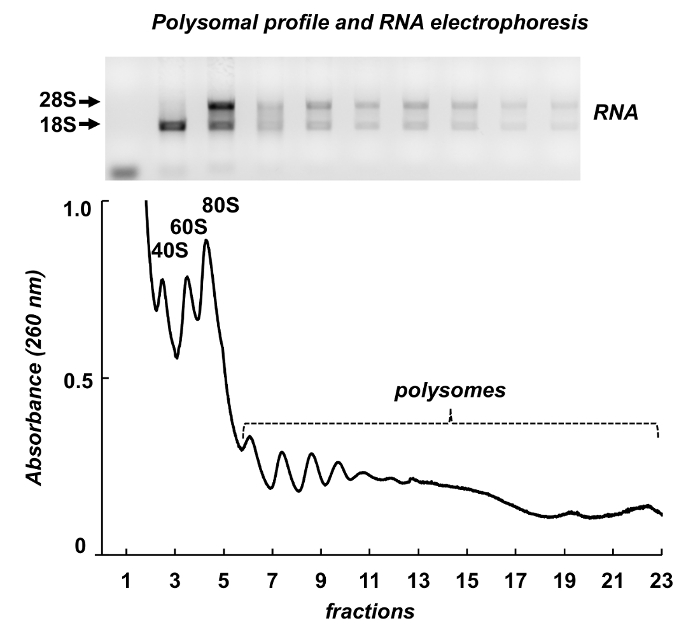
图 7.Polysomal 小鼠睾丸组织裂解液的外形.在1% 琼脂糖凝胶中, 用 rna 纯化试剂进行 rna 提取, 并进行电泳分析。请单击此处查看此图的较大版本.
| 阶段 | 步 | 条件 |
| 举行 | 步骤1 | 将温度从25增加到 50°c, 1.6°C/秒 |
| 在50°c 孵育2:00 分钟 | ||
| 步骤2 | 将温度从50增加到95°C 与 1.6°C/秒 | |
| 在95°C 孵化10:00 分钟 | ||
| Pcr | 步骤1 | 在95°C 孵化00:15 分钟 |
| 步骤2 | 用1.6°C 将温度从95降到60°c | |
| 在60°c 孵化1:00 分钟 | ||
| 周期数40 | ||
| 熔体曲线 | Step1 | 将温度从60增加到95°C 与 1.6°C/秒 |
| 步骤2 | 将温度从95降低到 60°c 1.6°C/秒 | |
| 在60°c 孵化1:00 分钟 | ||
| 步骤 3 (离解) | 将温度从60增加到95°C 与 0.05°C/秒 | |
| 在95°C 孵化00:15 分钟 | ||
表1。qPCR 条件
讨论
蔗糖梯度结合 RNA 和蛋白质分析 Polysome 分馏是分析个体基因或整个 translatome 的平移状态以及调节平移的蛋白质因子作用的有力方法。机械在正常的生理或疾病状态。Polysomal 分析是一种特别适合于研究生物体中的平移调节的技术, 如 trypanosomatids 包括利什曼原虫, 其中转录控制很大程度上缺乏, 基因表达调控主要发生在翻译过程中。
在这里, 我们描述了一个 polysome 分馏协议用于三模型:利什曼原虫寄生虫, 培养的人类细胞和小鼠组织。polysome 分馏步骤基本上是相同的, 在本研究中使用的不同有机体;然而, 裂解制剂有一定的差异。利什曼原虫细胞生长在液态培养中, 通过离心收集, 细胞在裂解前计数, 以确保梯度上的载荷相等。人体细胞可以直接在盘子上冲洗和裂解。等荷载受光密度控制。小鼠组织需要 Dounce 均质机进行有效的裂解, 而在利什曼原虫和人类细胞的情况下, 它足以通过23口径针。
所有使用的试剂应 RNase 和蛋白酶免费。我们比较了肝素和 RNase 抑制剂作为 RNase 活性抑制剂的细胞质裂解物。我们发现两种试剂都能有效地阻断 RNase。然而, 肝素影响下游应用, 如 cDNA 制备和 qPCR。因此, 在使用肝素时, RNA 的制备需要额外的纯化步骤。我们认为, RNase 抑制剂是更方便的选择, 可以有效地用于 polysome 性能分析协议。
Polysomal 分析是劳动密集型, 是该方法的主要局限性。可同时准备多达六个渐变。梯度分馏塔生成144个分数, 需要在短时间内处理。对单个分数的分析可以耗费时间和成本。因此, 将单个分数组合为预 polysomes, 轻、重 polysomes 为估计个体基因的平移活动提供了一种快速而又不费力的方法。我们对组合分数的 qPCR 结果使我们能够识别在利什曼原虫和 HeLa 细胞中不同基因的可译性的差异 (图 2, 3)。但是, 如果需要更精细的分辨率, 则可以对单个分数进行分析。
核糖体分析是研究 mrna 的平移状态的另一种方法, 它是根据核糖体38保护的 mRNA 片段的测序来测量蛋白质的生产。该技术提供的定量信息关联的 mRNA 序列与特定的 polysomal 分数被翻译成一个样本, 并可以提供准确的信息, 基因在密码子解析的平移状态, 比较polysome 分析技术。然而, polysome 分析可以用于 RNA 和蛋白质分析, 从而提供了关于 polysomes 蛋白质组的补充信息, 并找出有助于调节翻译的因素。
因此, polysomal 分析是一种通用的技术, 可用于分析个体基因的平移状态, 检测核糖体相关蛋白, 研究不同模型生物体在不同实验条件下的平移规律。条件。
披露声明
作者没有什么可透露的。
致谢
作者感谢清李的录音帮助。这项研究得到了来自德州理工大学健康科学中心的启动基金的支持, 以及由翻译神经科学和治疗中心 (CTNT) 授予 PN-CTNT 2017-05 AKHRJDHW A.L.K.;部分由 NIH 授予 R01AI099380 对 K.Z. 詹姆斯 c. 霍夫曼和克里斯汀 r 巴卡是喜赛 (干细胞教育 & 研究的整合中心) 学者并且由节目支持。
材料
| Name | Company | Catalog Number | Comments |
| Instruments: | |||
| Gradient master | Biocomp Instruments Inc. | 108 | |
| Piston Gradient Fractionator | Biocomp Instruments Inc. | 152 | |
| Fraction collector | Gilson, Inc. | FC203B | |
| NanoDrop One | Thermo Scientific | NanoDrop One | |
| Nikon inverted microscope | Nikon | ECLIPSE Ts2-FL/Ts2 | |
| 2720 Thermal Cycler | Applied Biosystems by Life Technologies | 4359659 | |
| CO2 incubator | Panasonic Healthcare Co. | MCO-170A1CUV | |
| HERATHERM incubator | Thermo Scientific | 51028063 | |
| Biological Safety Cabinet, class II, type A2 | NuAire Inc. | NU-543-400 | |
| Revco freezer | Revco Technologies | ULT1386-5-D35 | |
| Beckman L8-M Ultracentifuge | Beckman Coulter | L8M-70 | |
| Centrifuge | Eppendorf | 5810R | |
| Centrifuge | Eppendorf | 5424 | |
| Ultracentrifuge Rotor SW41 | Beckman Coulter | 331362 | |
| Swing-bucket rotor | Eppendorf | A-4-62 | |
| Fixed angle rotor | Eppendorf | F-45-30-11 | |
| Quant Studio 12K Flex Real-Time PCR machine 285880228 | Applied Biosystems by life technologies | 4470661 | |
| TC20 Automated cell counter | Bio-Rad | 145-0102 | |
| Hemacytometer | Hausser Scientific | 02-671-51B | |
| Software | |||
| Triax software | Biocomp Instruments Inc. | ||
| Materials: | |||
| Counting slides, dual chamber for cell counter | Bio-Rad | 145-0011 | |
| 1.5 mL microcentrifuge tube | USA Scientific | 1615-5500 | |
| Open-top polyclear centrifuge tubes, (14 mm x 89 mm) | Seton Scientific | 7030 | |
| Syringe, 5 mL | BD | 309646 | |
| BD Syringe 3 mL23 Gauge 1 Inch Needle | BD | 10020439 | |
| Nunclon Delta Surface plate, 14 cm | Thermo Scientific | 168381 | |
| Nunclon Delta Surface plate, 9 cm | Thermo Scientific | 172931 | |
| Nalgene rapid-flow 90mm filter unit, 500 mL, 0.2 aPES | Thermo Scientific | 569-0020 | |
| BioLite 75 cm3 flasks | Thermo Scientific | 130193 | |
| Nunc 50 mL conical centrifuge tubes | Thermo Scientific | 339653 | |
| Chemicals: | |||
| Trizol LS | Ambion by Life Technologies | 10296028 | |
| HEPES | Fisher Scientific | BP310-500 | |
| Trizma base | Sigma | T1378-5KG | |
| Dulbecco's Modified Eagle's Medium-high glucose (DMEM) | Sigma | D6429-500ML | |
| Fetal Bovine Serum (FBS) | Sigma | F0926-50ML | |
| Penicillin-Streptomycin (P/S) | Sigma | P0781-100ML | |
| Lipofectamine 2000 | Invitrogen | 11668-019 | |
| Dulbecco's phosphate buffered saline (DPBS) | Sigma | D8537-500ML | |
| Magnesium chloride hexahydrate (MgCl2x6H2O) | Acros Organics | AC413415000 | |
| Potassium Chloride (KCl) | Sigma | P9541-500G | |
| Nonidet P 40 (NP-40) | Fluka (Sigma-Aldrich) | 74385 | |
| Recombinant Rnasin Ribonuclease Inhibitor | Promega | N2511 | |
| Heparin sodium salt | Sigma | H3993-1MU | |
| cOmplete Mini EDTA-free protease inhibitors | Roche Diagnostics | 11836170001 | |
| Glycogen | Thermo Scientific | R0551 | |
| Water | Sigma | W4502-1L | |
| Cycloheximide | Sigma | C7698-1G | |
| Chloroform | Fisher Scientific | 194002 | |
| Dithiotreitol (DTT) | Fisher Scientific | BP172-5 | |
| Ethidium Bromide | Fisher Scientific | BP-1302-10 | |
| Ethylenediaminetetraacetic acid disodium dehydrate (EDTA) | Fisher Scientific | S316-212 | |
| Optimem | Life Technologies | 22600050 | |
| Puromycin dihydrochloride | Sigma | P8833-100MG | |
| Sucrose | Fisher Scientific | S5-3KG | |
| Trypsin-EDTA solution | Sigma | T4049-100ML | |
| Hgh Capacity cDNA Reverse Transcriptase Kit | Applied Biosystems by life technologies | 4368814 | |
| Power SYBR Green PCR Master Mix | Applied Biosystems by life technologies | 4367659 | |
| HCl | Fisher Scientific | A144SI-212 | |
| Isopropanol | Fisher Scientific | BP26324 | |
| Potassium Hydroxide (KOH) | Sigma | 221473-500G | |
| Anti-RPL11 antibody | Abcam | ab79352 | |
| Ribosomal protein S6 (C-8) antibody | Santa Cruz Biotechnology Inc. | sc-74459 | |
| 1xM199 | Sigma | M0393-10X1L | |
| Lithium cloride | Sigma | L-9650 | |
| Dimethyl sulfoxide (DMSO) | Fisher Scientific | D128-500 | |
| Gel Loading Buffer II | Thermo Scientific | AM8546G | |
| UltraPure Agarose | Thermo Scientific | 16500-100 | |
| Trichloracetic acid (TCA) | Fisher Scientific | A322-100 | |
| SuperSignal West Pico PLUS chemiluminescent substrate | Thermo Scientific | 34580 | |
| Formaldehyde | Fisher Scientific | BP531-500 | |
| Sodium Dodecyl Sulfate (SDS) | Sigma | L5750-1KG | |
| Phenylmethylsulfonyl fluoride (PMSF) | Sigma | P7626-5G | |
| RNeasy Mini kit | Qiagen | 74104 | |
| Adenosine 5′-triphosphate disodium salt hydrate (ATP) | Sigma | A1852-1VL | |
| Cytosine 5'-triphosphate disodium salt hydrate (CTP) | Sigma | C1506-250MG | |
| Uridine 5'-triphosphate trisodium salt hydrate (UTP) | Sigma | U6625-100MG | |
| Guanosine 5'-triphosphate sodium salt hydrate (GTP) | Sigma | G8877-250MG | |
| SP6 RNA Polymerase | NEB | M0207S | |
| Pyrophoshatase | Sigma | I1643-500UN | |
| Spermidine | Sigma | S0266-1G |
参考文献
- Schwanhausser, B., et al. Global quantification of mammalian gene expression control. Nature. 473 (7347), 337-342 (2011).
- Capewell, P., et al. Regulation of Trypanosoma brucei Total and Polysomal mRNA during Development within Its Mammalian Host. PLoS One. 8 (6), e67069(2013).
- Warner, J. R., Knopf, P. M., Rich, A. A multiple ribosomal structure in protein synthesis. Proceedings of the National Academy of Science, USA. 49, 122-129 (1963).
- Piccirillo, C. A., Bjur, E., Topisirovic, I., Sonenberg, N., Larsson, O. Translational control of immune responses: from transcripts to translatomes. Nature Immunology. 15 (6), 503-511 (2014).
- Ennis, H. L., Lubin, M. Cycloheximide: Aspects of Inhibition of Protein Synthesis in Mammalian Cells. Science. 146 (3650), 1474-1476 (1964).
- Masek, T., Valasek, L., Pospisek, M. Polysome analysis and RNA purification from sucrose gradients. Methods in Molecular Biology. 703, 293-309 (2011).
- Gandin, V., et al. Polysome fractionation and analysis of mammalian translatomes on a genome-wide scale. Journal of Visualized Experiments. (87), (2014).
- Zuccotti, P., Modelska, A. Studying the Translatome with Polysome Profiling. Methods in Molecular Biology. 1358, 59-69 (2016).
- Chasse, H., Boulben, S., Costache, V., Cormier, P., Morales, J. Analysis of translation using polysome profiling. Nucleic Acids Research. 45 (3), e15(2017).
- Arava, Y., et al. Genome-wide analysis of mRNA translation profiles in Saccharomyces cerevisiae. Proceedings of the National Academy of Science, USA. 100 (7), 3889-3894 (2003).
- Gandin, V., et al. nanoCAGE reveals 5' UTR features that define specific modes of translation of functionally related MTOR-sensitive mRNAs. Genome Research. 26 (5), 636-648 (2016).
- Bazzini, A. A., Lee, M. T., Giraldez, A. J. Ribosome profiling shows that miR-430 reduces translation before causing mRNA decay in zebrafish. Science. 336 (6078), 233-237 (2012).
- Zanchin, N. I., Goldfarb, D. S. Nip7p interacts with Nop8p, an essential nucleolar protein required for 60S ribosome biogenesis, and the exosome subunit Rrp43p. Molecular Cell Biology. 19 (2), 1518-1525 (1999).
- Darnell, J. C., et al. FMRP stalls ribosomal translocation on mRNAs linked to synaptic function and autism. Cell. 146 (2), 247-261 (2011).
- Gkogkas, C. G., et al. Autism-related deficits via dysregulated eIF4E-dependent translational control. Nature. 493 (7432), 371-377 (2013).
- Robichaud, N., Sonenberg, N. Translational control and the cancer cell response to stress. Curr Opin Cell Biol. 45, 102-109 (2017).
- Gordon, B. S., Kelleher, A. R., Kimball, S. R. Regulation of muscle protein synthesis and the effects of catabolic states. International Journal of Biochemistry and Cell Biology. 45 (10), 2147-2157 (2013).
- Ishimura, R., et al. RNA function. Ribosome stalling induced by mutation of a CNS-specific tRNA causes neurodegeneration. Science. 345 (6195), 455-459 (2014).
- Petersen, C. P., Bordeleau, M. E., Pelletier, J., Sharp, P. A. Short RNAs repress translation after initiation in mammalian cells. Molecular Cell. 21 (4), 533-542 (2006).
- Juntawong, P., Girke, T., Bazin, J., Bailey-Serres, J. Translational dynamics revealed by genome-wide profiling of ribosome footprints in Arabidopsis. Proceedings of the National Academy of Science, USA. 111 (1), E203-E212 (2014).
- Bunnik, E. M., et al. Polysome profiling reveals translational control of gene expression in the human malaria parasite Plasmodium falciparum. Genome Biology. 14 (11), R128(2013).
- De Gaudenzi, J. G., Noe, G., Campo, V. A., Frasch, A. C., Cassola, A. Gene expression regulation in trypanosomatids. Essays in Biochemistry. 51, 31-46 (2011).
- Alves, L. R., Goldenberg, S. RNA-binding proteins related to stress response and differentiation in protozoa. World Journal of Biological Chemistry. 7 (1), 78-87 (2016).
- De Pablos, L. M., Ferreira, T. R., Walrad, P. B. Developmental differentiation in Leishmania lifecycle progression: post-transcriptional control conducts the orchestra. Current Opinions in Microbiology. 34, 82-89 (2016).
- Soto, M., et al. Cell-cycle-dependent translation of histone mRNAs is the key control point for regulation of histone biosynthesis in Leishmania infantum. Biochemical Journal. 379, 617-625 (2004).
- McNicoll, F., et al. Distinct 3 '-untranslated region elements regulate stage-specific mRNA accumulation and translation in Leishmania. Journal of Biological Chemistry. 280 (42), 35238-35246 (2005).
- Folgueira, C., et al. The translational efficiencies of the two Leishmania infantum HSP70 mRNAs, differing in their 3 '-untranslated regions, are affected by shifts in the temperature of growth through different mechanisms. Journal of Biological Chemistry. 280 (42), 35172-35183 (2005).
- Dumas, C., Chow, C., Muller, M., Papadopoulou, B. A novel class of developmentally regulated noncoding RNAs in Leishmania. Eukaryotic Cell. 5 (12), 2033-2046 (2006).
- Kapler, G. M., Coburn, C. M., Beverley, S. M. Stable transfection of the human parasite Leishmania major delineates a 30-kilobase region sufficient for extrachromosomal replication and expression. Molecular Cell Biology. 10 (3), 1084-1094 (1990).
- Karamyshev, A. L., Johnson, A. E. Selective SecA association with signal sequences in ribosome-bound nascent chains: a potential role for SecA in ribosome targeting to the bacterial membrane. Journal of Biological Chemistry. 280 (45), 37930-37940 (2005).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative C(T) method. Nature Protocols. 3 (6), 1101-1108 (2008).
- Panda, A. C., Martindale, J. L., Gorospe, M. Polysome Fractionation to Analyze mRNA Distribution Profiles. Bio Protocols. 7 (3), (2017).
- Sambrook, J., Fritsch, E. F., Maniatis, T. Molecular Cloning. A Laboratory Manual. , Cold Spring Harbor Laboratory Press. (1989).
- Patrick, A. E., Karamyshev, A. L., Millen, L., Thomas, P. J. Alteration of CFTR transmembrane span integration by disease-causing mutations. Molecular Biology of the Cell. 22 (23), 4461-4471 (2011).
- Kleizen, B., van Vlijmen, T., de Jonge, H. R., Braakman, I. Folding of CFTR is predominantly cotranslational. Molecular Cell. 20 (2), 277-287 (2005).
- van den Elzen, A. M., Schuller, A., Green, R., Seraphin, B. Dom34-Hbs1 mediated dissociation of inactive 80S ribosomes promotes restart of translation after stress. EMBO Journal. 33 (3), 265-276 (2014).
- Morita, M., et al. mTOR Controls Mitochondrial Dynamics and Cell Survival via MTFP1. Molecular Cell. 67 (6), 922-935 (2017).
- Ingolia, N. T., Ghaemmaghami, S., Newman, J. R., Weissman, J. S. Genome-wide analysis in vivo of translation with nucleotide resolution using ribosome profiling. Science. 324 (5924), 218-223 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。