Method Article
Индуцируемая T7-РНК-полимераза-опосредованная мультигенная экспрессия, pMGX
В этой статье
Резюме
В этом исследовании описаны способы опосредованной T7 совместной экспрессии нескольких генов из одной плазмиды в Escherichia coli с использованием плазмидной системы pMGX.
Аннотация
Совместная экспрессия нескольких белков приобретает все большее значение для синтетической биологии, изучает белково-белковые комплексы и характеризует и использует пути биосинтеза. В этой рукописи описывается использование высокоэффективной системы для построения мультигенных синтетических оперонов под контролем индуцируемой РНК-полимеразы Т7. Эта система позволяет одновременно размножать гены из одной плазмиды. Здесь набор из четырех связанных векторов, pMGX-A, pMGX-hisA, pMGX-K и pMGX-hisK, с маркером (A и K), устойчивым к ампициллину или канамицину, и либо обладающим, либо отсутствующим N-концевым гексагистидином Тег (его). Подробные протоколы для построения синтетических оперонов с использованием этой векторной системы предоставляются вместе с соответствующими данными, показывая, что система на основе pMGX, содержащая пять генов, может быть легко сконструирована и использована для получения всех пяти кодированных белков в Escherichia coli . Эта системаEm и протокол позволяют исследователям регулярно выражать сложные многокомпонентные модули и пути в E. coli .
Введение
Совместная экспрессия нескольких белков становится все более существенной, особенно в приложениях для синтетической биологии, где должны быть выражены несколько функциональных модулей 1 ; При изучении белково-белковых комплексов, где экспрессия и функция часто требуют совместного экспрессии 2 , 3 ; И в характеристике и использовании путей биосинтеза, где каждый ген в пути должен быть выражен 4 , 5 , 6 , 7 , 8 . Был разработан ряд систем для совместной экспрессии, особенно в организме хозяина Escherichia coli , рабочей лошади для экспрессии лабораторного рекомбинантного белка 9 . Например, несколько плазмид с различными выбираемыми маркерами могут быть использованы для экспрессии отдельных белков с использованием богатства различных экс Векторы растяжения 10 , 11 . Одиночные плазмидные системы для множественной экспрессии белка использовали либо множественные промоторы для контроля экспрессии каждого гена 10 , 12 ; Синтетические опероны, где множественные гены кодируются на одном транскрипте 2 , 13 ; Или, в некоторых случаях, один ген, кодирующий полипептид, который в конечном счете протеолитически обработан, давая желаемые представляющие интерес белки 14 .

Рисунок 1: рабочий процесс pMGX, показывающий построение полицистронного вектора. Система pMGX обеспечивает гибкую и легкую в использовании стратегию для создания синтетических оперонов под контролем индуцибельного промотора T7.E.com/files/ftp_upload/55187/55187fig1large.jpg "target =" _ blank "> Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
В этой рукописи описывается использование высокоэффективной системы для построения мультигенных синтетических оперонов под контролем индуцируемой РНК-полимеразы Т7 ( фиг. 1 ). Эта система позволяет одновременно размножать гены из одной плазмиды. Он основан на плазмидной системе, первоначально называемой pKH22, которая была успешно использована для ряда различных приложений 6 , 7 , 8 . Здесь этот набор плазмид расширяется до четырех связанных векторов: pMGX-A, экспрессирующего вектора, лишенного любых C- или N-концевых тегов, и маркера устойчивости к ампициллину; PMGX-hisA, вектор экспрессии, кодирующий N-концевую гексагистидиновую метку и маркер устойчивости к ампициллину; PMGX-K, вектор экспрессии lПодбирая любые C- или N-концевые метки и маркер устойчивости к канамицину; И pMGX-hisK, вектор экспрессии, кодирующий N-концевую гексагистидиновую метку и маркер устойчивости к канамицину. В этом исследовании продемонстрирован способ генерации полицистронного вектора, содержащего пять генов с использованием системы pMGX, в частности pMGX-A, наряду с успешным продуцированием каждого отдельного белка в Escherichia coli .
протокол
1. Получение генов интереса
- Дизайн синтетических генов.
- Оптимизируйте последовательность генов для экспрессии E. coli .
- Удалите любые проблемные сайты рестрикции из последовательности (AvrII, NdeI, EcoRI и XbaI).
- Включить сайты рестрикции для клонирования; Рекомендуется сайт 5'-NdeI и сайт 3'-EcoRI. При необходимости можно использовать другие сайты; Относятся к области многоклонирования выбранной плазмиды ( фиг. S1- S4 ). Если необходимо, включите 5 'или 3' кодирующий тег для обнаружения вестерн-блоттинга.
- Коммерчески заказывайте сконструированный ген.
- Либо тупое клонирование гена в тупой вектор, используя тупой набор клонирования, в соответствии с инструкциями производителя; Проекционные праймеры для амплификации гена (затем перейдите к этапу 1.2.2); Или добавить дополнительные 5 'и 3' концы для прямого клонирования в плазмиду pMGX и перейти к этапу 2. ЗдесьE репрезентативные результаты - от тупого клонирования генов, представляющих интерес.
- Амплифицировать желаемый ген (из сконструированного и оптимизированного синтетического гена или из ДНК-матрицы, содержащей нужный ген). 15 .
- Дизайн праймеров с сайтами рестрикции для клонирования; Рекомендуется сайт 5'-NdeI и сайт 3'-EcoRI. При необходимости можно использовать другие сайты; Относятся к области многоклонирования выбранной плазмиды ( фиг. S1- S4 ). Если необходимо, укажите либо 5 ', либо 3' кодирующий тег для обнаружения вестерн-блоттинга.
- ПЦР амплифицируют нужный ген 15 .
- Проанализируйте ПЦР с помощью электрофореза в агарозном геле 16 .
- Если существует неспецифическая амплификация, очистите амплифицированный ген путем экстракции гелем. Если нет, используйте набор для очистки фермента.
- Количественную оценку ДНК с помощью спектрофотометра путем проверки поглощенияE при 260 нм; Заготовку с буфером для элюирования 17 .
2. Клонирование генов, представляющих интерес, в вектор мультигенной экспрессии, pMGX 18
- Ограничение переваривает полученный ген, представляющий интерес, и желаемый вектор, pMGX, с NdeI и EcoRI.
ПРИМЕЧАНИЕ. Если получено большое количество рециркулированных плазмид, позвольте реакции NdeI протекать в течение 1 часа перед добавлением EcoRI.- Используйте 40 мкл переварительной реакции, содержащей 0,5-1,5 мкг ДНК и 1 мкл каждого фермента с 4 мкл соответствующего 10-кратного буфера.
- Для дайджеста NdeI и EcoRI используйте буфер EcoRI и сначала добавьте эндонуклеазу NdeI. Дайджест в течение 1 ч при 37 ° С. Затем добавьте эндонуклеазу EcoRI и дайте дайджесту продолжить в течение дополнительного часа. NdeI чувствителен к расщеплениям, близким к концу ДНК, поэтому первоначальное переваривание EcoRI может предотвратить эффективное расщепление NdeI.
- ЭлектрOphorese рестрикционный дайджест на агарозном геле (для гена 1 kb используют 0,7% агарозный гель при 110 В в течение 55 мин, для выбора процента агарозного геля для разных размеров генов см. Ссылку 16 .
- Акцизную вставку и полоски с использованием чистого скальпеля или лезвия бритвы и поместите вырезанный сегмент геля в пробирку объемом 1,5 мл.
- Извлеките ДНК из агарозного геля с использованием набора для экстракции геля в соответствии с протоколом производителя.
- Лигируйте интересующий ген в вектор pMGX, используя соотношение 3: 1 вставки в вектор; Установить отрицательную перевязку переваренного pMGX без вставки.
- Настроить реакцию лигирования 20 мкл, содержащую 1 мкл ДНК-лигазы Т4, 0,15-0,5 мкг векторной ДНК (~ 5 мкл) и соответствующее количество вставки на основе соотношения вставки к вектору 3: 1 и размера Вставляемый ген; PMGX-магистрали составляют от 5,312 до 5,504 б.п. Включите отрицательную реакцию управления, которая содержит все значения buТ вставляемый ген. Убедитесь, что количество векторной ДНК эквивалентно в отрицательном контрольном лигировании и реакции лигирования вектора плюс вставки.
- Трансформировать реакции лигирования в химически компетентные клетки E.coli XL1-Blue и лигированные плазмиды pMGX- yfg1 (содержащий ген, представляющий интерес 1), pMGX- yfg2 (содержащий ген, представляющий интерес 2) ... pMGX- yfgn (содержащий ген, представляющий интерес n). Используйте асептическую технику (внутри шкафа биобезопасности или под пламенем).
- Оттереть 100 мкл аликвоты химически компетентной XL1-Blue E. coli на льду в течение 5 мин, а затем добавить 5 мкл реакций лигирования. Инкубируйте 30 минут на льду.
- Разогреть клетки в течение 45 с на водяной бане при температуре 42 ° С, а затем добавить 200 мкл холодного LB. Инкубируйте их на льду в течение 2 мин.
- Встряхните клетки при 37 ° С, 220 об / мин в течение 1 ч, а затем распределите планшет на 100 мкл на пластине LB-агар, содержащей соответствующий(Ампициллин или канамицин).
- Экран клонов для положительных трансформантов.
- Сравните количество колоний на отрицательных контрольных и лигирующих пластинах. Требуется коэффициент подсчета колоний более 1: 2. Если на отрицательной контрольной панели имеется большое количество колоний, вернитесь к шагу 2.1 и просмотрите примечание.
- Выберите 4-8 отдельных колоний (в зависимости от отрицательного контроля: соотношение лигирования) от каждой реакции лигирования различных генов, вставленных для скрининга (1 n), и заселите 4 мл LB и соответствующую культуру / индивидуальную колонию с антибиотиками в течение ночи. Выращивайте культуры в течение ночи при встряхивании при 37 ° C и 220 об / мин.
- Изолируют плазмидную ДНК с использованием набора для выделения плазмидной ДНК в соответствии с протоколом производителя.
- Настроить 20 мкл NdeI + EcoRI digest-реакции, содержащей 150-500 нг ДНК и 1 мкл каждого фермента с 2 мкл соответствующего 10-бутового буфера. ВЭто случай, добавить NdeI и EcoRI в то же самое время, что интересующий ген будет находиться между сайтами рестрикции. Рекомендуется отрицательный контроль с пустым вектором pMGX. Дайджест в течение 2 ч при 37 ° С на водяной бане.
3. Вставка гена 2 в вектор pMGX, содержащий ген 1, pMGX- yfg1
- Редкий дайджест pMGX- yfg1 с AvrII и лечить кишечной фосфатазой теленка (CIP).
- Используйте 40 мкл реакционной смеси, содержащей 0,5-1,5 мкг векторной ДНК (~ 5-10 мкл выделенной ДНК) и 1 мкл AvrII с 4 мкл соответствующего 10-кратного буфера. Дайджест в течение 1,5 ч при 37 ° С, а затем добавляют 1,5 мкл CIP. Оставьте его при 37 ° C еще 30 минут.
- Редкий дайджест pMGX- yfg2 с AvrII и XbaI для освобождения интересующего гена.
- Использовать 40 мкл переварительной реакции, содержащей 0,5-1,5 мкг ДНК и 1 мк; L каждого фермента с 4 мкл соответствующего 10-буфера. Дайджест в течение 2 ч при 37 ° С.
- Электрофоретические рестрикционные переваривания на соответствующем проценте (0,7%) агарозного геля и акциз полостей вставки и вектора с использованием чистого лезвия скальпеля / бритвы (см. Шаги 2.2-2.3).
- Извлеките ДНК с использованием набора для экстракции геля в соответствии с протоколом производителя и определите количественно ДНК 17 .
- Ligate ген 2 в pMGX- yfg1 с использованием соотношения 3: 1 вставки в вектор. Настройте отрицательное лигирование переваренного pMGX- yfg1 без дополнительной вставки. Настройте, как описано выше на шаге 2.5.
- Трансформируйте 5 мкл реакций лигирования в химически компетентные клетки E. coli XL1-Blue, лигированные плазмиды pMGX- yfg1,2 (содержащие ген 1 и 2) и отрицательный контроль pMGX- yfg1 , как показано на этапе 2.6.
- Сравните количество колоний на отрицательном контроле и лигирующих пластинах. Коэффициент подсчета колоний gТребуется повторный набор, чем 1: 2. Если на отрицательной контрольной панели имеется большое количество колоний, вернитесь к шагу 3.1 и просмотрите обработку CIP.
- Выберите 4-8 отдельных колоний (в зависимости от отрицательного контроля: коэффициент лигирования) от реакции лигирования и инокулируйте 4 мл LB плюс соответствующий антибиотик на каждую колонию и растите в течение ночи при 37 ° C и 220 об / мин.
- Изолируют плазмидную ДНК с использованием набора для выделения плазмидной ДНК в соответствии с протоколом производителя и количественно определяют ДНК 17 .
- Экран эффективного введения второго гена путем выполнения рестрикционного переваривания pMGX- yfg1,2 с помощью EcoRI.
- Используйте 20 мкл переварительной реакции, содержащей 150-500 нг ДНК и 1 мкл фермента EcoRI с 2 мкл буфера EcoRI 10x. Дайджест в течение 2 ч при 37 ° С.
- Электрофорез - рестрикционный переваривание на соответствующем процентном агарозном геле; Найдите группу, которая соответствуетС размером гена 2 (см. Шаг 2.2). Ген может вставлять в вектор в нежелательной, обращенной ориентации.
4. Добавление третьего гена в вектор pMGX, содержащий гены 1 и 2, pMGX- yfg1,2
- Редкий дайджест pMGX- yfg1,2 с AvrII и обработать CIP, как показано на шаге 3.1.
- Регрессионный дайджест pMGX- yfg3 с AvrII и XbaI, как показано на шаге 3.2.
- Электрофорез - рестрикционные переваривания на соответствующем проценте агарозного геля и акцизной вставки и векторных полос с использованием чистого лезвия скальпеля / бритвы; См. Шаги 2.2-2.3.
- Экстрагируют ДНК из агарозного геля с использованием набора для экстракции гелем и количественно определяют ДНК 17 .
- Ligate ген 3 в pMGX- yfg1,2 с использованием соотношения вставки-в-вектор 3: 1 и установить отрицательное лигирование переваренного pMGX- yfg1,2 без дополнительной вставки, как показано на этапе 3.5.
- Трансформировать 5 мкл реакций лигирования в XL1-Blue химически компетентные клетки E. coli , лигированная плазмида pMGX- yfg1,2,3 (содержащие гены, представляющие интерес 1, 2 и 3), и отрицательный контроль pMGX- yfg1,2 , как видно на этапе 2.6.
- Сравните количество колоний на отрицательном контроле и лигирующих пластинах. Если на отрицательной контрольной панели имеется большое количество колоний, вернитесь к шагу 4.1 и просмотрите обработку CIP.
- Выберите 4-8 отдельных колоний (в зависимости от отрицательного контроля: коэффициент лигирования) от реакции лигирования и инокулируйте 4 мл LB плюс соответствующий антибиотик на отдельную колонию; Растут в течение ночи при 37 ° С и 220 об / мин.
- Изолируйте плазмидную ДНК с использованием набора для выделения плазмидной ДНК в соответствии с протоколом производителя.
- Экран эффективного введения третьего гена путем выполнения рестрикционного переваривания pMGX- yfg1,2,3 с EcoRI, как видно на этапе 3.10.
- Электрофорез - рестрикционный переваривание на соответствующем процентном агарозном геле; смотретьДля полос, которые соответствуют размерам гена 2 и гена 3 (см. Шаг 2.2). Примечание: ген 3 может вставлять в вектор в нежелательной, обращенной ориентации. Если гены 2 и 3 имеют одинаковый размер, для скрининга должен быть выбран другой подходящий сайт дайджеста.
ПРИМЕЧАНИЕ. Повторите по мере необходимости для каждого нового гена.
5. Получение протеинов, представляющих интерес, с использованием мультигенной системы экспрессии и оценки продукции путем Вестерн-блоттинга
- Трансформируйте положительный клон, содержащий все интересующие гены, в химически компетентную продуцирующую белок E. coli , такую как BL21- (λDE3).
- Оттереть 100 мкл аликвоты химически компетентного BL21- (λDE3) E. coli на льду в течение 5 мин и затем добавить 1 мкл положительной клонированной плазмидной ДНК; Инкубировать в течение 30 мин на льду.
- Нагрейте клетки в течение 45 с на водяной бане при температуре 42 ° C, а затем добавьте 200 мкл холодного LB. Инкубируйте на льду в течение 2 мин.
- Встряхните клетки при 37 ° С и 220 об / мин в течение 1 ч, а затем распределите планшет на 100 мкл на пластину с LB-агаром, содержащую подходящий селектируемый маркер (либо ампициллин, либо канамицин).
- Выразите белок индукцией изопропил-β-D-1-тиогалактопиранозидом (IPTG).
- Выделите изолированную колонию с пластины преобразования B21- (λDE3) и заселите 4 мл LB плюс соответствующий антибиотик; Растирать в течение ночи, встряхивая при 37 ° С и 220 об / мин.
- Инокулируйте 100 мл LB плюс соответствующую культуру антибиотика, используя 1 мл ночной культуры.
- Растите при 37 ° C со встряхиванием со скоростью 220 об / мин до OD 600 0,6.
- Индуцировать культуру с помощью 100 мкМ IPTG и расти в течение 15 ч при 25 ° С и 220 об / мин.
- Удаляют 1 мл культуры и центрифугируют ее при 13000 мкг в течение 1 мин; Отбросьте супернатант.
- Лизы клеток с использованием раствора лизиса в соответствии с инструкциями производителяИ заготовку вестерн-блотта растворимого клеточного лизата, чтобы определить, были ли успешно созданы все белки 19 .
Результаты
В этом исследовании целью было совместное экспрессирование пяти белков из одной плазмиды. Исправленные пять кодонов синтетические фрагменты гена, кодирующие либо N-, либо C-концевые гексагистидиновые метки, были куплены коммерчески. Синтетические гены амплифицировали с помощью ПЦР и индивидуально клонировали в ПЦР-тупой вектор и секвенировали. Для получения полицистронной плазмиды пять генов, представляющих интерес, сначала клонировали в подходящую плазмиду pMGX, pMGX-A. На рисунке 2 показаны PCRBlunt- yfg1 и PCRBlunt- yfg2 в дополнение к pMGX-A, расщепленным NdeI + EcoRI (см. Шаг 2). Чтобы клонировать первые два гена в pMGX-A, плазмиду расщепляли NdeI + EcoRI ( фиг. 2 ). После клонирования генов, представляющих интерес, в pMGX-A, вновь сконструированные плазмиды, обозначенные как pMGX- yfg1 и pMGX- yfg2 , были расщеплены AvrII + XbaI, чтобы подтвердить, что были получены успешные клоны, так какПоказанных в полосах 1,1-kb и 1,3 кбит, полученных на фиг. 3 .
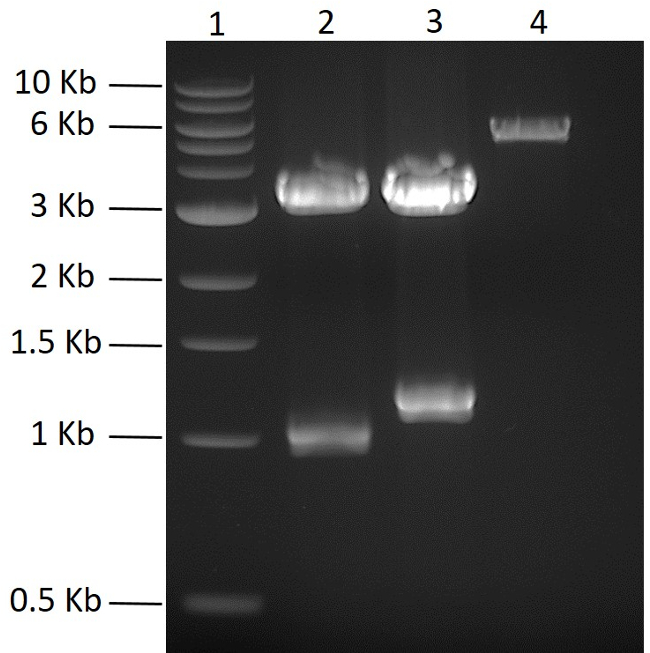
Рисунок 2: Клонирование плазмид pMGX. Ожидаемые результаты ПЦР-тупых плазмид, содержащих yfg1 и yfg2 после расщепления NdeI + EcoRI, показаны на 0,7% агарозном геле (110 В, 55 мин). Лейн 1, 1 kb ДНК-лестница; Полоса 2, PCRBlunt- yfg1 ; Полоса 3, PCRBlunt- yfg2 ; Дорожка 4, pMGX-A. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
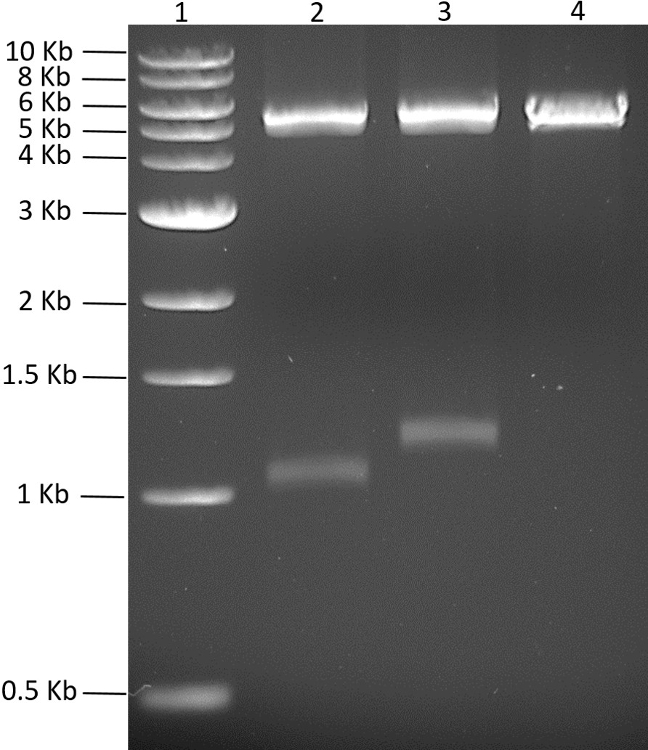
Рисунок 3: Скрининг pMGX- yfg1 и pMGX- yfg2. Агарозный гель 0,7% (110 В, 55 мин) показывает Две полосы, которые генерируются как pMGX- yfg1, так и pMGX- yfg2 после переваривания с AvrII + XbaI. Лейн 1, 1-kb ДНК-лестница; Полоса 2, pMGX- yfg1 ; Полоса 3, pMGX- yfg2 ; Дорожка 4, pMGX-A. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
С обоими генами в соответствующем векторе pMGX была построена полицистронная плазмида. Для получения плазмиды pMGX- yfg1,2 pMGX- yfg1 расщепляли с помощью AvrII, как показано на рисунке 4 . PMGX- yfg2 расщепляли AvrII + XbaI, а ген 1,3-kb, содержащий этот фрагмент, лигировали в сайт AvrII линеаризованного pMGX- yfg1 , генерируя pMGX- yfg1,2 . Переваривание pMGX- yfg1,2 с EcoRI подтвердило успешное клонирование желаемой плазмиды и показано в> Рисунок 5.

Рисунок 4: Генерация бицистронной плазмиды pMGX- yfg1,2. Электрофорез в 0,7% агарозном геле приводит (110 В, 55 мин) pMGX- yfg1, расщепляемого AvrII и pMGX- yfg2, расщепляемого AvrII + XbaI. Лейн 1, 1-kb ДНК-лестница; Полоса 2, pMGX- yfg1, переваренная AvrII; Дорожка 3, pMGX- yfg2, переваренная AvrII + XbaI; Дорожка 4, pMGX-A. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
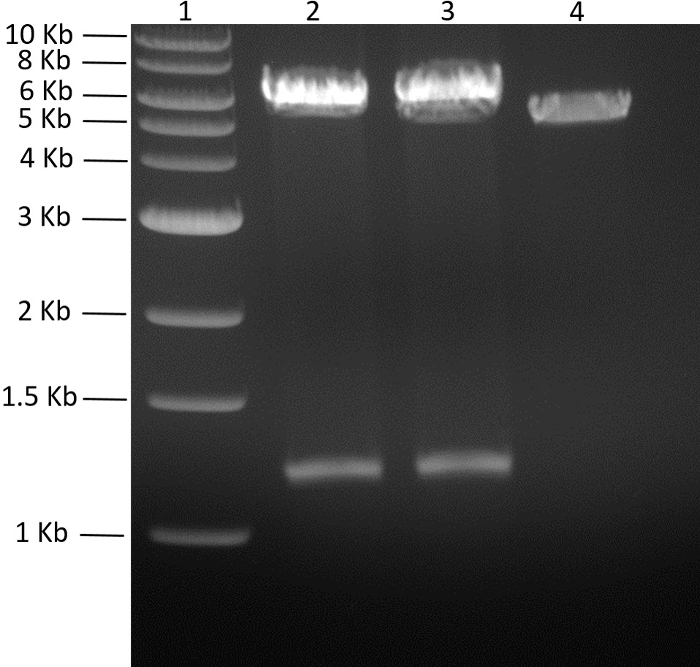
Рисунок 5: Скрининг клонов pMGX- yfg1,2 . Полученный 0,7% агарозный гель (110 В, 55 мин) pMGX- yfПоказаны g1,2 клоны, расщепленные EcoRI. Успешные клоны будут генерировать две полосы, одну для вставленного гена yfg2, а другую, соответствующую основной цепи + yfg1 ( pMGX-yfg1 ). Лейн 1, 1 kb ДНК-лестница; Полоса 2, pMGX- yfg1,2, расщепляемая EcoRI, клон 1; Полоса 3, pMGX- yfg1,2, расщепляемая EcoRI, клон 2; Дорожка 4, pMGX-A. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
При создании полицистронной плазмиды, содержащей два или более гена, можно встретить нежелательную обратную вставку гена, клонированного в сайт AvrII. Фигура 6 представляет собой гель, подчеркивающий различие между результатами расщепленной плазмиды с геном, вставленным в правильную ориентацию, в отличие от гена, который вставлен в обратную ориентацию. Если генЛигируют и клонируют в нежелательной ориентации, сайт EcoRI в конце гена будет вставлен рядом с сайтом EcoRI предыдущего гена. Это позволило бы получить размер фрагмента, который практически не обнаруживается электрофорезом ДНК-гена (менее 50 б.п.). Кроме того, последний вставленный ген появится в позвоночнике, который легко идентифицируется из-за того, что размер основной цепи больше, чем ожидалось. Разница в размере основы от ожидаемого размера будет указывать размер последнего вставленного гена.

Рисунок 6: Скрининг клонов pMGX- yfg1-5 . Показано 1,3% агарозного геля (110 В, 65 мин), изображающего результаты pMGX- yfg1-5, расщепленных EcoRI. Успешные клоны (дорожка 2) будут генерировать полосу, соответствующую последнему вставленному генам ( yfg5 в этом случае 1,1 kb). ЛВСE 1, 1-kb ДНК-лестница; Полоса 2, положительный клон pMGX- yfg1-5, расщепляемый EcoRI; Полоса 3, отрицательный клон pMGX- yfg1-5, расщепляемый EcoRI; 4, pMGX- yfg1-4 . Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Чтобы закончить вектор экспрессии полицистрона с пятью генами, оставшиеся три гена были клонированы один за другим в pMGX- yfg1,2 для получения pMGX- yfg1-5 (см. Этап 5). Затем эту плазмиду трансформировали в BL21- (λDE3), и экспрессию белков индуцировали в культуре с серединой логарифма путем добавления IPTG. Фиг. 7 представляет собой вестерн-блот клеточных лизатов, подтверждающий, что все пять белков из одной плазмиды, содержащей несколько генов в одном опероне, могут быть выражены. Экспрессия pMGX- yfg1 (содержащая 1 ген),PMGX- yfg1,2 (содержащий 2 гена) и pMGX- yfg1-5 (содержащий 5 генов).
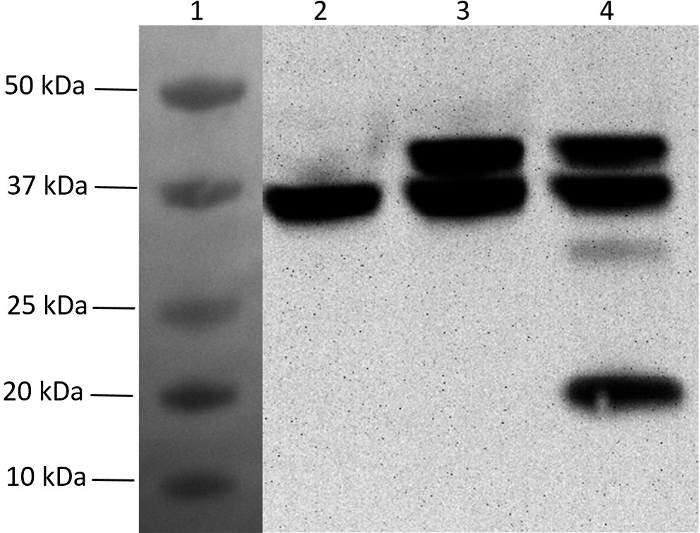
Рисунок 7: Вестерн-блот-анализ экспрессии мультигена с использованием системы pMGX. Включение либо N- или С-концевых гексагистидиновых меток позволило вестерн-блот-детектировать экспрессию белка. Образцы отделяли на предварительно литых 4-20% градиентных безрисковых акриламидных гелях (200 В, 35 мин, 10 см х 8,5 см), а затем переносили (40 В, 90 мин) на нитроцеллюлозную мембрану (0,45 мкм, 10 см х 7 см). Использовали HRP-конъюгированное анти-His моноклональное антитело, которое не требует вторичного антитела. Буферы для блокировки, переноса и антитела были приготовлены в соответствии с рекомендациями производителя антител. Обнаружение проводили с помощью субстрата Хемилюминесцентного HRP с последующим заводом производителяtructions. Полученную мембрану визуализировали с помощью тепловизора без фильтра. Дорожка 1, двухцветный стандарт, переносимый на мембрану (не хемилюминесцентный); Полоса 2, His6pMGX- yfg1 ; Полоса 3, His6pMGX- yfg1,2 ; Дорожка 4, His6pMGX- yfg1-5. Примечание. Протеин, продуцируемый yfg5, имеет тот же размер, что и белок, вырабатываемый yfg1 (оба составляют 36 кДа) и не может быть отделен от геля. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительные данные: нажмите здесь, чтобы скачать этот файл.
Обсуждение
Совместная экспрессия множественных генов приобретает все большее значение, особенно при характеристике и восстановлении сложных многогенных метаболических путей 3 , 4 , 5 . Система pMGX делает мультигенную совместную экспрессию в рутине 6 , 7 , 8 E. coli и доступна для различных исследователей. В этом исследовании было показано, что пять белков, представляющих интерес, одновременно получают из одной плазмидной системы с использованием pMGX-A. Многие доступные в настоящее время системы ко-экспрессии допускают только введение двух генов, генерирующих бицистронные плазмиды, такие как векторы 12 ПЭТ-дуэт. Если требуется добавить больше генов, требуются несколько бицистронных векторов с различными выбираемыми маркерами. В отличие от других многогеневых экспрессионных систем, система pMGX позволяет упростить клонированиеИз нескольких генов в одну плазмиду, с возможностью повторного использования сайтов рестрикции без необходимости в разных донорных плазмидах или для удаления множества сайтов рестрикционных ферментов из генов 13 , 14 . Критические этапы в этом протоколе включают в себя разработку генов, предотвращение вторичной рециркуляции однократно переваренных векторов pMGX и экранов полицистронных векторов для правильной ориентации вставленного гена.
При планировании стратегии клонирования для построения полицистронной системы важно обеспечить, чтобы гены, представляющие интерес, не содержали сайты рестрикции, необходимые для последующего клонирования. В частности, они включают XbaI и AvrII, которые необходимы для вставки второго и последующих генов в вектор pMGX, содержащий первый интересующий ген (этапы 3 и 4). Кроме того, необходимо исключить сайты рестрикции, которые будут использоваться для первоначального клонирования gПредставляющих интерес для pMGX (шаг 2). Как правило, они включают NdeI или NheI на 5'-конце гена и BamHI или EcoRI на 3'-конце гена, хотя, если необходимо, могут быть использованы и другие сайты рестрикции. Устранение лишних нежелательных сайтов рестрикции может быть легко осуществлено на стадии синтеза генов или, в случае генов, клонированных из других источников, путем синонимичных нуклеотидных замещений через сайт-направленный мутагенез 20 .
Добавление последующих генов, представляющих интерес для pMGX, содержащих первый интересующий ген, требует линеаризации pMGX- yfg1 с AvrII (шаг 3.1, отметим, что он также может быть линеаризован с XbaI). Этот линеаризованный вектор будет быстро распознаваться во время введения второго интересующего гена (шаг 3.5), что приводит к чрезвычайно большому числу фоновых клонов. Чтобы этого избежать, необходимо обработать линеаризованный вектор фосфатазой для дефосфорилирования 5̸2; Концы линеаризованного вектора. Как правило, используется CIP, хотя другие доступны. Оптимизация как единиц фосфатазы, так и времени инкубации может потребоваться для оптимизации лигаций последующих генов, представляющих интерес, в линеаризованный вектор.
Наконец, при создании полицистронной системы интересующий ген изначально вырезается путем переваривания с помощью XbaI и AvrII, генерируя комплементарные когезионные концы на 5'- и 3'-концах гена (этапы 3.2 и 4.2). Эта вставка может быть лигирована в линеаризованный вектор в прямом или обратном направлении. Поскольку все когезионные концы идентичны, никакой направленности не обеспечивается посредством дополнительного отжига когезионных концов. Таким образом, необходимо скринировать результирующие клоны для правильного направления вставки представляющего интерес гена. Это легко сделать путем скрининга клонов с одним из сайтов рестрикции, используемым для клонирования исходного гена, представляющего интерес, в pMGX (этап 2). Как правило,EcoRI используется, так как сайт рестрикции находится на 3'-конце гена, и поэтому целесообразно отображать направленность, как показано на рисунке 6 . В большинстве случаев 50% клонов, содержащих интересующий ген, имеют ген в правильной ориентации, а 50% имеют ген в противоположной ориентации.
Редко (~ 10% лигаций) все клоны от конкретного лигирования могут иметь интересующий ген, вставленный только в одном направлении. Этот результат, по-видимому, зависит от последовательности, поскольку он очень воспроизводим в этих конкретных случаях. Если это происходит, и представляющий интерес ген непрерывно вставляется в обратную ориентацию, к обычному желаемому вектору можно получить доступ путем переключения направления клонирования. Например, вместо клонирования yfg2 в AvrII-сайт pMGX- yfg1 , yfg1 можно клонировать в сайт XbaI pMGX- yfg2 . Заметим, что это дает идентичный конечный векторсистема. Эта дополнительная гибкость, обеспечивающая доступ к одной и той же системе из разных стратегий клонирования, является очень выгодной.
Важным ограничением этой методологии является то, что белки, кодируемые на 3'-конце полицистронного транскрипта, обычно экспрессируются на более низких уровнях, чем белки, кодируемые на 5'-конце транскрипта, и этот эффект более выражен, чем длиннее транскрипт , Это означает, что изменение порядка генов, представляющих интерес в синтетическом опероне, может влиять на относительные уровни экспрессии белков, которые они кодируют, обеспечивая механизм для тонкой настройки относительных уровней экспрессии.
Таким образом, система pMGX обеспечивает надежный метод совместной экспрессии нескольких белков из одной плазмиды в E. coli , которая может использоваться для различных применений в синтетической биологии и для характеристики биохимического пути.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана Советом по естественным наукам и инженерным исследованиям Канады.
Материалы
| Name | Company | Catalog Number | Comments |
| Enzymes | |||
| Alkaline Phosphatase, Calf Intestinal (CIP) | New England Biolabs | M0290S | |
| AvrII | New England Biolabs | R0174S | |
| EcoRI | New England Biolabs | R0101S | |
| NdeI | New England Biolabs | R0111S | |
| XbaI | New England Biolabs | R0145S | |
| Herculase II Fusion DNA Polymerase | Agilent Technologies | 600677 | |
| T4 DNA Ligase | New England Biolabs | M0202S | |
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| 1 kb DNA ladder | New England Biolabs | N3232L | |
| 4-20% Mini-PROTEAN TGX Stain-Free Protein Gels | Bio-Rad | 456-8095 | |
| 50x TAE | Fisher Thermo Scientific | BP1332-4 | |
| Agar | Fisher Thermo Scientific | BP1423-500 | |
| Agarose | Fisher Thermo Scientific | BP160-500 | |
| Ampicilin | Sigma-Alrich | A9518-5G | |
| BL21 (DE3) chemically comeptent cells | Comeptent cell prepared in house | ||
| B-PER Bacterial Protein Extraction Reagent | Fisher Thermo Scientific | PI78243 | |
| dNTP mix | Agilent Technologies | Supplied with polymerase | |
| Gel Extraction Kit | Omega | D2500-02 | E.Z.N.A Gel Extraction, supplied by VWR Cat 3: CA101318-972 |
| Glycine | Fisher Thermo Scientific | BP381-1 | |
| His Tag Antibody [HRP], mAb, Mouse | GenScript | A00612 | |
| Immobilon Western Chemiluminescent HRP Substrate | EMD Millipore | WBKLS0100 | |
| IPTG | Sigma-Alrich | 15502-10G | |
| LB | Fisher Thermo Scientific | BP1426-500 | |
| Methanol | Fisher Thermo Scientific | A411-20 | |
| Pasteurized instant skim milk powder | Local grocery store | No-name grocery store milk is adequate | |
| Nitrocellulose membrane | Amersham Protran (GE Healthcare Life Sciences) | 10600007 | Membrane PT 0.45 µm 200 mm x 4 m, supplied by VWR Cat #: CA10061-086 |
| Plasmid DNA Isolation Kit | Omega | D6943-02 | E.Z.N.A Plasmid DNA MiniKit I, supplied by VWR Cat #: CA101318-898 |
| pMGX | Boddy Lab | Request from the Boddy Lab Contact cboddy@uottawa.ca | |
| Primers | Intergrated DNA Technologies | Design primers as needed for desired gene | |
| Synthetic Gene | Life Technologies | Design and optimize as needed | |
| Thick Blot Filter Paper | Bio-Rad | 1703932 | |
| Tris base | BioShop | TRS001.1 | |
| Tween-20 | Sigma-Alrich | P9416-50ML | |
| XL1-Blue chemically competent cells | Comeptent cell prepared in house | ||
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| BioSpectrometer | Eppendorf | RK-83600-07 | |
| Gel box - PAGE | Bio-Rad | 1658005 | Mini-PROTEIN Tetra Vertical Electrophoresis Cell |
| Gel Imager | Alpha Innotech | AlphaImager EC | |
| Incubator-oven | Fisher Thermo Scientific | 11-690-650D | Isotemp |
| Incubator-shaker | Fisher Thermo Scientific | SHKE6000-7 | MaxQ 6000 |
| Personna Razors | Fisher Thermo Scientific | S04615 | |
| Power Pack | Bio-Rad | S65533Q | FB300 |
| Transilluminator | VWR International | M-10E,6W | |
| Thermocylcer | Eppendorf | Z316091 | Mastercycler Personal, supplied by Sigma |
| UV Face-Shield | 18-999-4542 | ||
| Waterbath | Fisher Thermo Scientific | 15-460-2SQ | |
| Western Transfer Apparatus | Bio-Rad | 1703935 | Mini-Trans Blot Cell |
Ссылки
- Purnick, P. E. M., Weiss, R. The second wave of synthetic biology: from modules to systems. Nat. Rev. Mol. Cell Biol. 10 (6), 410-422 (2009).
- Bieniossek, C., et al. Automated unrestricted multigene recombineering for multiprotein complex production. Nat. Methods. 6 (6), 447-450 (2009).
- Jochimsen, B., et al. Five phosphonate operon gene products as components of a multi-subunit complex of the carbon-phosphorus lyase pathway. Proc. Natl. Acad. Sci. USA. 108 (28), 11393-11398 (2011).
- Martin, V. J. J., Pitera, D. J., Withers, S. T., Newman, J. D., Keasling, J. D. Engineering a mevalonate pathway in Escherichia coli for production of terpenoids. Nat. Biotechnol. 21 (7), 796-802 (2003).
- Ajikumar, P. K., et al. Isoprenoid pathway optimization for Taxol precursor overproduction in Escherichia coli. Science. 330 (6000), 70-74 (2010).
- Boddy, C. N., Hotta, K., Tse, M. L., Watts, R. E., Khosla, C. Precursor-directed biosynthesis of epothilone in Escherichia coli. J. Am. Chem. Soc. 126 (24), 7436-7437 (2004).
- Lundgren, B. R., Boddy, C. N. Sialic acid and N-acyl sialic acid analog production by fermentation of metabolically and genetically engineered Escherichia coli. Org. Biomol. Chem. 5 (12), 1903-1909 (2007).
- Horsman, M. E., Lundgren, B. R., Boddy, C. N. N-Acetylneuraminic Acid Production in Escherichia coli Lacking N-Acetylglucosamine Catabolic Machinery. Chem. Eng. Commun. 203 (10), 1326-1335 (2016).
- Romier, C., et al. Co-expression of protein complexes in prokaryotic and eukaryotic hosts: experimental procedures, database tracking and case studies. Acta Crystallogr. D, Biol. Crystallogr. 62 (Pt 10), 1232-1242 (2006).
- Tolia, N. H., Joshua-Tor, L. Strategies for protein coexpression in Escherichia coli. Nat. Methods. 3 (1), 55-64 (2006).
- Chanda, P. K., Edris, W. A., Kennedy, J. D. A set of ligation-independent expression vectors for co-expression of proteins in Escherichia coli. Protein Expr. Purif. 47 (1), 217-224 (2006).
- Kim, K. -J., et al. Two-promoter vector is highly efficient for overproduction of protein complexes. Protein Sci. 13 (6), 1698-1703 (2004).
- Tan, S., Kern, R. C., Selleck, W. The pST44 polycistronic expression system for producing protein complexes in Escherichia coli. Protein Expr. Purif. 40 (2), 385-395 (2005).
- Chen, X., Pham, E., Truong, K. TEV protease-facilitated stoichiometric delivery of multiple genes using a single expression vector. Protein Sci. 19 (12), 2379-2388 (2010).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. J. Vis. Exp. (63), e3998(2012).
- Lee, P. Y., Costumbrado, J., Hsu, C. -Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J. Vis. Exp. (62), (2012).
- Sukumaran, S. Concentration determination of nucleic acids and proteins using the micro-volume BioSpec-nano-spectrophotometer. J. Vis. Exp. (48), (2011).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Molecular Cloning. J. Vis. Exp. , Available from: https://www-jove-com.remotexs.ntu.edu.sg/science-education/5074/molecular-cloning (2016).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. The Western Blot. J. Vis. Exp. , Available from: https://www-jove-com.remotexs.ntu.edu.sg/science-education/5065/the-western-blot (2016).
- Laible, M., Boonrod, K. Homemade site directed mutagenesis of whole plasmids. J. Vis. Exp. (27), (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены