Method Article
Простой Одношаговый Вскрытие Протокол целом монтажа подготовки взрослых
В этой статье
Резюме
Взрослых Drosophila мозг является ценным система для изучения нейронной цепи, высшие функции мозга, и сложные расстройства. Эффективный метод рассекать всю мозговую ткань от маленькой головы летучей будет способствовать мозга на основе исследования. Здесь мы опишем простой, один шаг рассечение протокол мозга взрослого человека с хорошо сохранившейся морфологии.
Аннотация
Существует растущий интерес к использованию дрозофилы для моделирования мозга дегенеративных заболеваний человека, карта нейронные схемотехника в взрослом мозге, и изучение молекулярной и клеточной основы высших функций мозга. Препарат целого монтирование мозга взрослого человека с хорошо сохранившейся морфологии имеет решающее значение для таких всего головного мозга на основе исследований, но может быть технически сложным и занимает много времени. Этот протокол описывает простой в освоении, один шаг рассечение подход головки взрослых мух менее чем за 10 секунд, сохраняя при этом неповрежденный мозг, прикрепленный к остальной части тела, чтобы облегчить последующие этапы обработки. Процедура помогает удалить большую часть глаза и трахеи тканей, обычно связанные с мозгом, который может повлиять на более позднем этапе формирования изображения, а также места, меньший спрос на качество рассекает щипцов. Кроме того, мы опишем простой метод, который позволяет удобно листать смонтированных образцов мозга на покровное, что очень важно для работы с изображениями с обеих сторон бдожди с аналогичной интенсивности и качества сигнала. В качестве примера протокола, мы представим анализ дофаминергических (DA) нейронов в головном мозге взрослых WT (вес 1118) мух. Высокая эффективность метода рассечение делает его особенно полезным для крупномасштабных исследований мозга взрослых на основе у дрозофилы.
Введение
Модель организма дрозофилы, широко известный как дрозофилы, уже давно ценится за его изящными генетических инструментов, короткие репродуктивные времена, и высоко консервативны молекулярных и клеточных путей. Плодовая муха была успешно использована для рассекают основных сигнальных путей, структурирование механизмы многоклеточных организмов, а также механизмы , лежащие в основе развития нейронов, функции и заболевания 1,2. С учетом последних достижений в области маркировки клеток и визуализации технологий, плодовая мушка мозг стал особенно мощным в тонкой отображения нейронной цепи и в рассекает молекулярной и клеточной основы высших мозговых функций, таких как обучение и память, и циркадный ритм 1,3, 4,5,6,7,8.
Одним особым преимуществом системы Drosophila является его относительно небольшой размер, что позволяет целом монтажа подготовку и обследование головного мозга с помощью обычного соединения или конфокальной микроскопии. Тхиs функция позволяет подробные анатомические и функциональный анализ нейронной цепи, или даже один нейрон, на клеточном и субклеточном уровнях, в контексте всей ткани мозга, таким образом, обеспечивая как целостный взгляд на исследуемый объект и его точную геометрию в целом головной мозг. Однако, учитывая довольно миниатюрные размеры мозга, он также представляет собой сложную техническую задачу в эффективно рассекает неповрежденный ткани мозга из защитного экзоскелет головки случае во взрослой мухи. Различные эффективные и относительно простые методы рассечение были описаны подробно, которые обычно включают тщательное и ступенчатые удаление корпуса головки и связанные с ним ткани и глаза, трахеи, и жир из мозга надлежащего 9, 10. Эти микрохирургические методы рассечение часто устанавливают достаточно жесткие требования к качеству диссекции пинцетом, опираясь на щипцов с прекрасными хорошо выровненных советов, которые могут быть легко повреждены. Более того, как рассеченные мозг часто separatред от остальной части тела, мозг может быть легко потеряны во время последующих окрашивания и моечных процессов из-за их малых размеров и их прозрачности в буфере обработки. Здесь мы описываем относительно простой и легкий в освоении, один шаг протокол рассечение для мозга взрослого человека, который держит расчлененный мозги, прикрепленные к туловищу. Процесс рассечение часто легко убирает большую часть мозга ассоциированных тканей, таких как глаз и трахеи и снижает спрос на хорошее качество рассечение щипцов.
Кроме того, при визуализации мозга под флуоресцентным микроскопом или составного конфокальный микроскоп, сторона мозга, который находится вдали от флуоресцентного источника света часто дает более слабый сигнал и менее четкие изображения из-за толщины мозга целом монтажа. Здесь мы также опишем простой способ установки, позволяющий легко листать образцов мозга, что позволяет удобно визуализации обеих сторон мозга с аналогичным сигналом Intensiти и качества.
В качестве доказательства правильности концепции для применения этого метода для изучения мозга взрослого человека, мы исследовали далее присутствие DA нейронов в мозге W 1118 мух; генотип , который часто используется в качестве родительской линии для получения трансгенных мух и контроль дикого типа во многих исследованиях Drosophila.
протокол
1. Решения, используемые для мозга Вскрытие и иммунофлуоресцентного окрашивания
- Рассеките взрослого летать мозги в искусственной спинномозговой жидкости (ACSF): 119 мМ NaCl, 26,2 мМ NaHCO 3, 2,5 мМ KCl, 1 мМ NaH 2 PO 4, 1,3 мМ MgCl 2 и 10 мМ глюкозы. Перед использованием Газ ACSF с 5% CO 2/95% O 2 в течение 10 - 15 мин и шип с 2,5 мМ CaCl 2. Стерилизацию раствора ACSF путем фильтрации через мембрану 0,22 мкм фильтр.
Примечание: Храните ACSF при температуре 4 ° С , чтобы предотвратить бактериальное заражение. Муха мозг также может быть расчленена в растворе фосфатно-солевом буфере (PBS), хотя детальное сравнение эффектов двух рассечение решений на конечное качество формирования изображения рассеченных мозга не была выполнена. - С помощью 4% параформальдегида (PFA), полученного в 1х PBS в качестве закрепляющего раствора, который, как правило, на аликвоты и хранили при -20 ° С.
обеспечения уплатып: PFA является токсичным и коррозионными и должны быть обработаны с осторожностью. - Используйте 1X PBS, чтобы промыть PFA из головного мозга и после последней стадии промывки, во время иммунофлуоресцентного окрашивания рассеченных мозга. Подготовьте 1x PBS с 10 - кратным PBS раствора (1,37 М NaCl, 27 мМ KCl, 100 мМ Na 2 HPO 4 и 18 мМ KH 2 PO 4).
- С помощью 0,3% Tween-20 в PBS (1x 1x PBT) для всех последующих стадий промывки во время иммунофлуоресцентного окрашивания рассеченных мозга.
2. микрохирургические Препарирование взрослых Fly Heads
Примечание: Процедура рассечение показана на рисунке 1.
- Обезболить взрослых мух CO 2. Использование щипцов, поднимите муху и кратко депарафинизации его кутикулу путем погружения его в 70% этаноле в течение 3 - 5 с. Это гарантирует, что никакие пузырьки не прилипают к лету кутикулы при погружении в ACSF или раствор рассечение 1X PBS.
- Подрассекает микроскоп с источником света под углом, который не будет заблокирован вручную, установите объектив для достижения четкое представление о лету (1.2x увеличением). Используйте пинцет с недоминирующем рукой , чтобы обездвижить животное и погружать муху в холодный раствор с рассечение брюшко вверх, как показано на рисунке 1А.
- Хранить щипцов при 160 - 170 ° углом по отношению к рассечение пластины, в то время как прилагая небольшое усилие на живот мухи (показано стрелками на рисунке 1a). Этот шаг будет иммобилизации летать и заставить его двигаться головы назад на 15 - 25 ° при расширении хобот вверх. В процессе, мягкой и полупрозрачной область кутикулы, под хоботка, должны стать очевидными. Увеличьте масштаб и отрегулируйте фокальную плоскость на эту область.
Примечание: Не держите пинцет слишком плотно, а просто достаточно прочны , чтобы стабилизироватьмуха. Слишком большое усилие вызывает внутренние органы к разрыву в раствор. - Используйте доминирующую руку, чтобы нажать рассекает пинцетом так, чтобы его советы закрыты, что будет генерировать мягкий силу сопротивления на кончики пинцета, так что пинцет будет весной открытым, когда давление со стороны раздаточной стороны освобождается. Расположите щипцов перпендикулярно к щипцов держащих муха, как показано на рисунке 1В.
- Пирс закрытые концы рассечение щипцов через мягкую и полупрозрачной области кутикулы под хоботка, как показано красной стрелкой на рисунке 1В. Важно, чтобы не проникнуть в щипцов слишком глубоко, что она затрагивает мозг. Мозг собственно должен стать видимым. Поддержание стабильного понимание лету с недоминирующем рукой.
- Быстро, но устойчиво, выпустите кончики рассечение щипцов своей собственной силой и опираться на импульс от этого выпуска, чтобы оторвать тон экзоскелет окружающих голову мухи. Нетронутым мозг собственно должен стать видимым (белая ткань непосредственно над кончик нижнего силы р на фиг.1C) Выполните воображаемую линию , чтобы направлять импульс высвобождаемых Forcep наконечниками (проиллюстрированных как внешнее красных стрелок , показанных на рисунке 1C). Это будет мягко удалить экзоскелет и большая часть мозга ассоциированных с глазом и трахеи из головного мозга. Правильный выбор времени и усилие, прилагаемое для открытия экзоскелет будет зависеть от опыта исследователя.
Примечание: Это самый важный шаг во время вскрытия. Важно, чтобы полагаться на естественной силы, генерируемой импульса открытия щипцов для удаления экзоскелет, оставляя обнаженный мозг остается прикрепленной к остальной части тела. - Используйте пинцет в доминирующую руку, чтобы тщательно удалить остаточные ткани аксессуары, такие как трахеи, которая появляется в виде белых волокнистых структур remainiнг прилагается к мозгу. Будьте осторожны, чтобы не тянуть или повредить мозг правильной.
3. Иммунофлуоресцентного Окрашивание Мозги
- Закрепить расчлененный образцы мозга и связанные с ними торс приблизительно 1 мл 4% PFA в течение 40 - 60 мин.
Примечание: Для этого и последующих шагов, держите пробирки или пластины с образцами на nutator правильно смешивать образцы в растворе. - Промыть 1 мл 1x PBS с помощью пипетки раствор вверх и вниз 3 раза. Будьте осторожны, чтобы не аспирата мозги прочь.
- Промыть 5 раз с помощью 1x PBT в течение 5 мин каждый. Держите образцы на nutator во время инкубации.
- Инкубируйте с первичными антителами, при правильном разбавления O / N при температуре 4 ° С.
- На следующий день, удалить первичные антитела, и мыть образцов 5 раз 1x PBT. Оставьте образцы в течение 5 - 10 мин в растворе 1x PBT между каждым мытьем. Держите образцы на nutator во время инкубации.
- Выдержите промытыйОбразцы в соответствующих вторичных антител с предложенным разбавлении и времени инкубации.
- Вымойте образцов в шесть раз с 1x PBT с 10-минутной инкубации между каждой стирки.
Этот шаг имеет решающее значение для удаления неспецифически связанных вторичных антител из образца. - Выдержите в 1: 10000 разбавлении 1 мг / мл 4 ', 6'-диамидино-2-фенилиндола (DAPI) в растворе 1х PBT в течение 30 мин. DAPI, представляет собой ДНК-краситель, который связывается с регионами АТ ДНК и могут быть использованы для выявления общей морфологии мозга.
- Промыть три раза 1x PBS.
- Образцы Переложить в рассечение блюдо, так и отдельные мозги от тела в рассечение блюдо с помощью щипцов.
- После окрашивания и стадий промывки, смонтировать мозги между двумя покровные и поместить покровные поверх монтажной ползуна. Таким образом, образцы мозга можно легко перевернуть так, чтобы обе стороны мозга могут быть отображены с аналогичной интенсивности сигнала.
Примечание: Установка мозга на покровное вместо непосредственно на монтажной слайде позволяет листать ориентации образца свободно. Процесс монтажа поясняется более подробно ниже.- Поместите 18 х 18 мм покровным поверх монтажной ползуна. Расширьте отверстие наконечника пипетки с лезвием и использовать его для передачи мозги в 1х растворе PBS на 18 х 18 мм покровным.
- Поместите мозги на середину покровного стекла, удалить жидкость вокруг мозга с тонкой наконечником пипетки, а затем добавить еще 20 - 40 мкл анти-выцветанию монтажной среды (0,2% (вес / объем) н-пропилгаллат в 99,5 % ACS класса глицерина) по сравнению с мозгом.
Примечание: Количество гистологическая среда добавлен зависит от количества мозгов обследованных. - Аккуратно распределите мозги при перемещении вязкой монтажной среды наружу. Поместите второй 18 х 18 мм покровным на верхней части мозга, сначала опуская слайд с одной стороны, пока он не войдет в контакт споверхность монтажной скольжением, а затем медленно опуская другую сторону, чтобы свести к минимуму контакт мозга с воздушными пузырьками.
Примечание: Там нет необходимости использовать распорку между двумя покровные, как объем монтажной среды и мозг должен обеспечить достаточное пространство для разделения двух покровные. - Разрешить слайды осесть. Удалить лишнюю жидкость, которые выходят из сторон клиньев с лабораторной ткани.
- Для предотвращения покровные с установленными мозги от падения монтажной слайд во время транспортировки, используйте небольшой кусочек ленты, чтобы прикрепить покровные к монтажному слайде.
Примечание: Мозги монтируется между суппорты могут быть отображены немедленно или хранили при 4 ° С в течение до одной недели без существенной потери флуоресцентного сигнала, без необходимости использования каких - либо герметик для уплотнения слайды. Для длительного сохранения окрашенных мозга, стороны двух промахов могут быть запечатаны шIth лак для ногтей и хранить в -20 ° C морозильнике, хотя запятнанные мозг может потерять свои сигналы в течение долгого времени. Это не рекомендуется.
- Используйте соответствующее соединение флуоресцентного микроскопа или конфокальной микроскопии для изображения мозги.
- Во-первых, в него изображение со стороны головного мозга ближе к цели, а затем осторожно перевернуть покровные, чтобы иметь образцы зажатой в середине. Этот шаг способствует приобретению изображение другой стороны того же мозга.
- Используйте вертикальное соединение флуоресцентного микроскопа и 20X объектив к изображению весь мозг (примеры на рисунке 2) и объектив 40X к изображению меньших областей мозга, таких как DA нейронов в области кластера Парный Передней медиальной (РАМ) (примеры на рисунке 3).
Результаты
На рисунке 1 показаны основные процедуры для взрослых рассечение мозга, как описано выше , 2 и 3 представляют собой репрезентативные образы 3-дневного возраста WT. (Генотип: W 1118) для взрослых летать мозги, которые были costained с антителом против Тирозингидроксилаза (TH , окрашенные в красный цвет на рисунке 2 и белый на рисунке 3), маркер обычно используется для обозначения DA нейронов 11, в дополнение к ДНК красителя DAPI маркировать все клеточные ядра и антитела против белка Elav, маркер для всех дифференцированных нейронов в лету (окрашен в зеленый цвет), которые вместе показали общую структуру мозга.
Для получения первичных антител на рисунках 2 и 3, мы использовали кроличье анти-TH антитела при разведении 1: 200 и крысиного анти-Elav антителом при разведении 1: 100, бееч готовили в 1x PBT с 5% нормальной козьей сыворотки, чтобы блокировать неспецифическое связывание. Для получения вторичных антител, мы использовали Alexa Fluor 488-конъюгированного антитела козы против крысиных и AlexaFluor596-конъюгированный козий анти-кроличий антитела в разведении 1: 500 в 1х PBT.
Чтобы создать образ, мозги, мы использовали вертикальное соединение флуоресцентный микроскоп, снабженный функцией apotome приобрести Z-Stack изображений срезов мозга, которые охватывают всю глубину области интереса в головном мозге. Например, чтобы получить четкую визуализацию общего распределения DA нейронов в целом мозге, мы использовали 20X объектив отдельно изображение передняя и задняя стороны одного и того же мозга (рисунок 2). Глубина каждой стороне мозга, который может изображается охватить все нейроны DA составляет около 20 - 25 мкм в общей сложности. Для того, чтобы надежно визуализировать и количественно DA нейроны в области РАМ кластера, которые имеют меньшие размеры ячеек и слабее TH сиgnals (смотри ниже), мы использовали 40X объектив. Кроме того, в функции сбора Z-серии от коммерческого программного обеспечения, мы выбрали раздел толщиной 0,5 - 1 мкм между каждым изображаемого среза, что обеспечивало оптимальное качество изображения в 3D - реконструкции региона РАМ кластера (рис 3в). Толщина АИМ кластера в мозге, который охватывает все нейроны DA составляет около 8 - 10 мкм в общей сложности. По нашему опыту, функция apotome может значительно снизить шумовой сигнал в визуализации толстых образцов с высоким фоном, таких как весь мозг или региона РАМ кластера.
Фигуры 2А-Е показывают переднюю вид головного мозга, тогда как фигуры 2F-J показывают вид задней одного и того же мозга после того, как листать покровные , которые держат образцы мозга, которые отображают подобный уровень интенсивности сигнала между двумя сторонами мозга для все три изображаемого канала. DA NeurДополнения были сгруппированы в различные кластеры после раннего обозначения 11, хотя здесь мы используем имя Paired Задней медиальной (PPM) , чтобы включить PPM1, PPM2 и PPM3 кластеров на передней стороне мозга, а также имя Paired POSTERIOR боковой (PPL ) , чтобы покрыть кластеры PPL1 и PPL2 от задней части мозга, как показано на рисунках 2Е и 2J. рис 2Е и 2J в белом шоу передней и задней взглядов одного и того же мозга в высоком увеличении, показывая различные кластеры DA нейроны с обеих сторон мозга. Белый пунктирные линии подчеркивают выдающуюся Пэм и спаренная Передней Боковой (PAL) кластеры в передней части мозга (рис 2E), а также Закона о госзакупках и РРМ кластеров в задней части мозга (рис 2J).
Фигуры 3А и 3В повторное резюме результатов количественной оценки для некоторых из кластеров DA в 1118 ш мух. Мы насчитали DA нейроны Кусочек за кусочком, а также от 3D реконструированы изображения, которые должны сводить к минимуму неточное подсчета. По нашим оценкам, 3-дневные ж 1118 мухи имеют в среднем 27 DA нейронов в целом в кластере PPM в мозг, 16 DA нейронов в кластере PPL на полушарии, 5 DA нейронов в PAL кластера на полусфере (рис 3А), и 97 DA нейронов в каждом из РАМ кластеров (рис 3B). Рисунок 3C является представителем 3D реконструкция DA нейронов в PAL и РАМ кластеров, проецируемых из кусочков большого увеличения изображений , охватывающих все нейроны DA в этом регионе. Очевидно, что по сравнению с другими кластерами, такими как PAL, DA нейроны в РАМ кластере имеют относительно меньшие размеры ячеек и более слабые сигналы, TH окрашиванию.
"SRC =" / файлы / ftp_upload / 55128 / 55128fig1.jpg "/>
Рисунок 1:. Графическое изображение рассечения протокола для взрослых дрозофилы мозга (А) Мухи расположены с вентральной стороны вверх, и удерживается в грудной клетке с использованием не доминантной рукой. Силы осторожно наносят (красные стрелки) с щипцами, чтобы вызвать обратную наклон головы летучей и небольшим внешним расширением хоботка, обнажая белую прозрачную область ниже. (B) Щипцы из доминантной руки вставлены в прозрачной области под хоботка, создавая неглубокий надрез (красная стрелка). Обратите внимание, что щипцы, которые мы используем, не имеют очень тонкие концы наконечника. (С) Щипцы могут отделиться через свою собственную силу, как указано красными стрелками. Импульс, открыв щипцов удаляет глаза и экзоскелет, подвергая относительно чистую дрозофилы мозга. Большая часть трахеи удалены в процессе. ( D) Лишние вспомогательные ткани , окружающие мозг тщательно отделан прочь для полного облучения мозга правильной. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
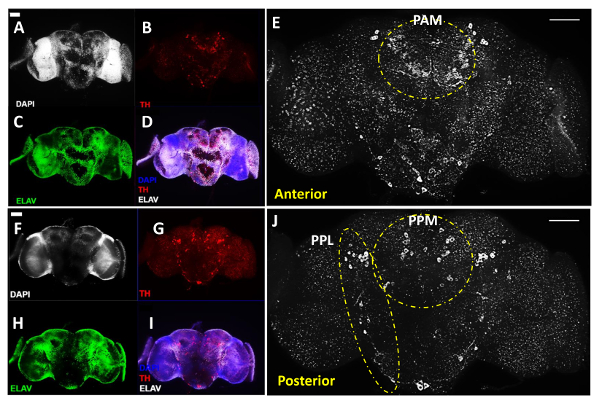
Рис . 2: Д. А. Нейроны раскрыты с анти-Тирозингидроксилаза (TH) антител в взрослых мужчин Drosophila B дождя (приобретенная с Цель 20Х) Эта цифра включает репрезентативные образы расчлененных мозга взрослого человека , реконструируют с использованием Z стеками изображения области мозга проценты, полученные с соединением флуоресцентного микроскопа. (AE) Передней и (FJ) Posterior виды одного и того же мозга взрослого человека; (A & F) клеточных ядер были обследованы с помощью DAPI окрашивания (белый) и нейронов (C & H) WERE метили пан-нейронный маркер анти-Elav антител (зеленый цвет); (B & G) DA нейроны выявлены анти-TH антител (красный). (D & I) Наложение изображений для DAPI, TH и лечения Elav. (Е & J) Увеличенный вид областей головного мозга с DA нейронами показаны белым. Пунктирные линии подчеркивают PAL и Пэм кластеров в передней части мозга и PPL и ПМП кластеров в задней части мозга. Шкалы составляет 50 мкм во всех панелях. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 3. Количественная DA нейронами в головном мозге взрослого мужчины ш 1118 мух (Приобретенные с 40X Цель). (A & B) Количественная DA пeurons дня 3 самца W 1118 мух, выявленные анти-TH окрашивания. Данные представлены усов коробчатых участков с указанием минимальных и максимальных значений, что и выбросов; а также первый (Q1), второй (Q2) и третьего (Q3) квартили. Второй квартиль представлена как среднее значение. (A) PPM {(п = 28) Минимум: 21, 1: 24, Средний балл: 27, 2: 30, Макс: 32}, PPL {(п = 26) Минимум: 10, 1: 12, Средний балл: 16, Q2: 18, Макс: 25} и {PAL (п = 24), Min: 2, 1: 4, Средний балл: 5, 2: 5, Макс: 10} кластеры; (B) РАМ кластер {(п = 20) Минимум: 86, 1: 94, Средний балл: 97, 2: 97, Макс: 99}. (C) представитель проекции изображение , показывающее DA нейроны в РАМ и PAL кластеров самца ш 1118 мух на 3 суток. Шкала бар составляет 20 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
С ростом интереса с помощью взрослых дрозофилы мозга для изучения заболеваний головного мозга человека, нейронной цепи, и высшие функции мозга, необходимо разработать простые и быстрые методы , чтобы получить неповрежденные летать мозги для всего-монтировки анализы, что особенно важно для крупно- масштабирование мозга на основе экранов. Наш метод обеспечивает простой и легкий в освоении подход рассекать из муху головой (часто менее чем за 10 секунд с опытом работы) с хорошо сохранившейся морфологии, которые в значительной степени очищен от сопутствующих тканей. Поскольку рассеченные мозги все еще прикреплены к остальной части летучей тел, они, как правило, опускаются на дно пробирки быстро и легко распознавать и собирать во время стирки и окрашивания шагов. Это существенно минимизирует потери образца, который может быть важным вопросом при обработке образцов мозга крошечных физических размеров. Эта проблема может быть особенно важно для крупномасштабных исследований. Мозг может быть легко отсоединен от корпусапосле завершения процесса окрашивания перед монтажом.
Во время диссекции, важно расположить муху правильно, поддерживать надлежащие углы при удалении экзоскелет из головы мухи, и мягко оказывают надлежащую силу при выполнении каждого шага. Рекомендуется , чтобы пинцет расположены перпендикулярно друг к другу , с тем чтобы предотвратить обезглавливание лету (Фиг.1В). Как показано в представительных изображений на рисунке 2, мозги , полученные с использованием этого протокола удовлетворительные результаты. В этом примере, мы сосредоточились на нейронах DA в РАМ кластера мозга взрослого человека. Дрозофилы мозга в среднем имеет в общей сложности около 280 DA нейронов в protocerebrum, которые распределены в различных кластеров в различных областях мозга с характерными узорами проекционных и функциональным выходом 11, 12. Ранее характеристику DA нейронов у взрослых дрозофилы мозга, вкнг летать модели генов болезней человека , таких , как в Паркин мутантов, в основном сосредоточены на PAL, PPL и PPM кластеры , которые имеют относительно большие размеры клеток и заметное выражение TH, стандартный производитель , используемый для маркировки DA нейронов 13-18.
Тем не менее, большинство нейронов да в летучей мозге обнаруживаются в кластерах РАМ, около 100 DA нейронов в кластере. По сравнению с клетками в других кластерах DA, DA нейроны в РАМ кластера обычно показывают меньший уровень экспрессии тирозин гидроксилазы и небольших размеров клеток. В образцах, приготовленных из нашего рассечение и окрашивания протокола, нейроны DA в РАМ кластера могут быть четко визуализировать и отображены в высоком качестве с использованием соединения флуоресцентного микроскопа, без конфокальной микроскопии. Учитывая большое количество, количественное определение DA нейронов в РАМ кластера различных генетических фонов может производить более надежные и воспроизводимые результаты. Мы полагаем, что DA нейроны в РАМ CLUSтер представляют другую полезную систему для изучения биологии DA и моделирования DA-связанных расстройств, таких как болезнь Паркинсона.
По нашему опыту, функция apotome от микроскопа мы использовали может значительно уменьшить фоновый сигнал, особенно при изучении образцов со значительной толщины, например, всей взрослой мухи мозга. Хотя конфокальный микроскоп может создавать изображения с большим количеством деталей, большим увеличением и лучшего качества, часто отнимает много времени и дорого. Это особенно верно для визуализации большого количества толстых образцов, таких как мозга взрослого человека, которые требуют серии секции Z-стек для четкого 3D-реконструкции и анализа деконволюции. С этой точки зрения, функция apotome представляет собой быструю и экономичную альтернативу для получения изображений достаточного качества (например, изображения на рисунках 2 и 3).
В исследованиях головного мозга, часто бывает необходимо клеткам изображения на обеих сидез того же мозга. Например, DA нейроны присутствуют в кластерах с обеих передней и задней стороны мозга. Тем не менее, из - за его толщины, после того, как мозг монтируется на предметное стекло, сторона от источника света (то есть сторона , обращенная к предметное стекло) , как правило , приводит к более слабым сигналам и менее четкое изображение при визуализируют с помощью регулярного соединения и конфокальной микроскопов. Путем установки образцов между двумя покровных щечек, он позволяет удобно листать образцов на смонтированной горкой и последующей визуализации обеих сторон одного и того же мозга с аналогичными интенсивности сигналов. На рисунке 2 приведен пример визуализации нейронов да с обеих сторон летать мозги, используя этот метод, который показал относительно сравнимую интенсивность сигнализации и качество изображения.
Несколько простых в последующих подходов для рассечения взрослых летать мозги были хорошо описаны 9, 10. Наш подход обеспечивает альтернативный метод , который может мехTher упростить процессы рассечение и окрашивание взрослой мухи мозги. С большим количеством крупномасштабных исследований, проводимых с целью наметить весь мозг нейронной цепи, а также его молекулярные и клеточные компоненты, можно предвидеть , что автоматизированные рассечение и визуализации подходы могут быть разработаны для взрослых Drosophila мозги для реализации высокой пропускной способности генетических и наркотиков экранов в естественных условиях в этой классической генетической модели.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Мы признаем, г-н EnEs Mehmet, г-жа Kiara Андраде, г-жа Пилар Родригес, Крис Квок, и г-жу Danna сура гафир за их огромную поддержку проекта.
Материалы
| Name | Company | Catalog Number | Comments |
| w*; parkΔ21/TM3, P{GAL4-Kr.C}DC2, P{UAS-GFP.S65T}DC10, Sb1 | Bloomington Drosophila Stock Center | 51652 | Balancer was switched to TM6B |
| PBac{WH}parkf01950 | Exelixis at Harvard Medical School | f01950 | Balancer was switched to TM6C |
| NaCl | Fisher Scientific | S640-500 | |
| Sodium Bicarbonate (NaHCO3) | Fisher Scientific | 02-003-990 | |
| Potassium Chloride (KCl) | Fisher Scientific | BP366-500 | |
| Sodium phosphate, monobasic monohydrate (NaHCO3) | Fisher Scientific | 02-004-198 | |
| Magnesium Chloride (MgCl2) | Fisher Scientific | 02-003-265 | |
| D-Sorbitol | Sigma-Aldrich | S1876-500G | Replaces glucose |
| Calcium chloride dihydrate (CaCl2) | Sigma-Aldrich | C5670-500G | |
| EMD Millipore Durapore PVDF Membrane Filters: Hydrophilic: 0.22 µm Pore Size | Fisher Scientific | GVWP14250 | |
| Formalin Solution, 10% (Histological) | Fisher Scientific | SF98-20 | |
| Potassium Phosphate, Dibasic, Powder, Ultrapure Bioreagent | Fisher Scientific | 02-003-823 | |
| Tween-20 | Fisher Scientific | BP337-500 | |
| Excelta Precision Tweezers with Very Fine Points | Fisher Scientific | 17-456-055 | Protocol does not require very fine points. |
| Anti-Tyrosine Hydroxylase Antibody | Pel-Freez Biologicals | P40101 | |
| Rat-Elav-7E8A10 anti-elav | The Developmental Studies Hybridoma Bank | Clone 7E8A10 | |
| Goat anti-Rat IgG (H+L) Secondary Antibody, Alexa Fluor 647 conjugate | ThermoFisher Scientific | A-21247 | |
| Goat anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 594 conjugate | ThermoFisher Scientific | A-11037 | |
| DAPI Solution (1 mg/mL) | ThermoFisher Scientific | 62248 | |
| Propyl gallate powder | Sigma-Aldrich | P3130-100G | |
| Glycerol ACS reagent, ≥99.5% | Sigma-Aldrich | G7893-500ML | |
| Zeiss Axioimager Z1 | Zeiss | Quote | |
| Zeiss Apotome.2 | Zeiss | Quote | |
| Zen lite software | Quote |
Ссылки
- Wangler, M. F., Yamamoto, S., Bellen, H. J. Fruit flies in biomedical research. Genetics. 199, 639-653 (2015).
- Bellen, H. J., Yamamoto, S. Morgan's legacy: fruit flies and the functional annotation of conserved genes. Cell. 163, 12-14 (2015).
- Aso, Y., et al. The neuronal architecture of the mushroom body provides a logic for associative learning. Elife. 3, 04577(2014).
- Reiter, L. T., Potocki, L., Chien, S., Gribskov, M., Bier, E. A systematic analysis of human disease-associated gene sequences in Drosophila melanogaster. Genome Res. 11, 1114-1125 (2001).
- Yamagata, N., et al. Distinct dopamine neurons mediate reward signals for short- and long-term memories. Proc Natl Acad Sci U S A. 112, 578-583 (2015).
- Nern, A., Pfeiffer, B. D., Rubin, G. M. Optimized tools for multicolor stochastic labeling reveal diverse stereotyped cell arrangements in the fly visual system. Proc Natl Acad Sci U S A. 112, 2967-2976 (2015).
- Waddell, S. Neural Plasticity: Dopamine Tunes the Mushroom Body Output Network. Curr Biol. 26, 109-112 (2016).
- Wolff, T., Iyer, N. A., Rubin, G. M. Neuroarchitecture and neuroanatomy of the Drosophila central complex: A GAL4-based dissection of protocerebral bridge neurons and circuits. J Comp Neurol. 523, 997-1037 (2015).
- Sweeney, S. T., Hidalgo, A., de Belle, J. S., Keshishian, H. Dissection of adult Drosophila brains. Cold Spring Harb Protoc. 2011, 1472-1474 (2011).
- Wu, J. S., Luo, L. A protocol for dissecting Drosophila melanogaster brains for live imaging or immunostaining. Nat Protoc. 1, 2110-2115 (2006).
- Mao, Z., Davis, R. L. Eight different types of dopaminergic neurons innervate the Drosophila mushroom body neuropil: anatomical and physiological heterogeneity. Front Neural Circuits. 3, 5(2009).
- White, K. E., Humphrey, D. M., Hirth, F. The dopaminergic system in the aging brain of Drosophila. Front Neurosci. 4, 205(2010).
- Yang, Y., et al. Mitochondrial pathology and muscle and dopaminergic neuron degeneration caused by inactivation of Drosophila Pink1 is rescued by Parkin. Proc Natl Acad Sci U S A. 103, 10793-10798 (2006).
- Greene, J. C., et al. Mitochondrial pathology and apoptotic muscle degeneration in Drosophila parkin mutants. Proc Natl Acad Sci U S A. 100, 4078-4083 (2003).
- Whitworth, A. J., et al. Increased glutathione S-transferase activity rescues dopaminergic neuron loss in a Drosophila model of Parkinson's disease. Proc Natl Acad Sci U S A. 102, 8024-8029 (2005).
- Pesah, Y., et al. Drosophila parkin mutants have decreased mass and cell size and increased sensitivity to oxygen radical stress. Development. 131, 2183-2194 (2004).
- Trinh, K., et al. Decaffeinated coffee and nicotine-free tobacco provide neuroprotection in Drosophila models of Parkinson's disease through an NRF2-dependent mechanism. J Neurosci. 30, 5525-5532 (2010).
- Kim, K., Kim, S. H., Kim, J., Kim, H., Yim, J. Glutathione s-transferase omega 1 activity is sufficient to suppress neurodegeneration in a Drosophila model of Parkinson disease. J Biol Chem. 287, 6628-6641 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены