Method Article
Um de uma etapa simples protocolo de dissecação para Whole mount-Preparação do Adulto
Neste Artigo
Resumo
O adulto de Drosophila cérebro é um sistema valioso para estudar circuitos neuronais, funções cerebrais superiores, e doenças complexas. Um método eficiente para dissecar tecido do cérebro inteiro do cabeça pequena mosca facilitará estudos baseados em cerebrais. Aqui nós descrevemos um de uma etapa simples protocolo, dissecação de cérebros adultos com morfologia bem preservada.
Resumo
Há um interesse crescente na utilização de Drosophila para modelar doenças degenerativas do cérebro humano, mapa circuitos neuronais em cérebros adultos, e estudar a base molecular e celular de funções cerebrais superiores. A preparação de toda a montagem dos cérebros adultos com morfologia bem preservado é fundamental para tais estudos baseadas no cérebro inteiro, mas pode ser tecnicamente desafiadora e demorada. Este protocolo descreve uma abordagem dissecção um passo fácil de aprender, de uma cabeça de mosca adulta em menos de 10 s, ao mesmo tempo manter o cérebro intacto ligado ao resto do corpo para facilitar os passos de processamento subsequentes. O procedimento ajuda a remover a maior parte dos tecidos do olho e da traqueia, normalmente associadas com o cérebro que pode interferir com a imagiologia passo posterior, e também reduz a procura da qualidade do fórceps de dissecação. Além disso, descreve-se um método simples que permite a inversão conveniente das amostras de cérebro montados sobre uma lamela, o que é importante para imagiologia de ambos os lados da bchuvas com intensidade de sinal semelhante e qualidade. Como um exemplo do protocolo, apresentamos uma análise de neurônios dopaminérgicos (DA) em cérebros adultos de WT (w 1118) voa. A elevada eficácia do método de dissecação torna-o particularmente útil para estudos baseados no cérebro adulto em larga escala em Drosophila.
Introdução
O organismo modelo Drosophila, vulgarmente conhecida como a mosca da fruta, tem sido valorizado por suas ferramentas genéticas elegantes, tempos reprodutivos curtos e altamente conservadas vias moleculares e celulares. A mosca da fruta tem sido empregue com sucesso para dissecar as vias de sinalização de base, os mecanismos de padronização de organismos multicelulares, bem como os mecanismos subjacentes ao desenvolvimento neuronal, funções e doenças 1,2. Com os recentes avanços em tecnologias de rotulagem de células e de imagem, o cérebro da mosca de fruta tornou-se especialmente poderosa in fine mapeamento dos circuitos neuronais e em dissecar a base molecular e celular das funções superiores do cérebro, tais como a aprendizagem ea memória, e ritmo circadiano 1,3, 4,5,6,7,8.
Uma vantagem particular do sistema de Drosophila é o seu tamanho relativamente pequeno, permitindo que toda a montagem de preparação e análise do cérebro utilizando um composto regular ou microscópio confocal. This recurso permite análises detalhadas anatômicas e funcionais de circuitos neuronais, ou mesmo um único neurônio, em níveis celulares e subcelulares, no contexto de um tecido do cérebro inteiro, proporcionando assim uma visão holística do assunto estudado e sua geometria exata dentro do todo cérebro. No entanto, dado o tamanho diminuto em vez do cérebro, ela também apresenta um desafio técnico em dissecar de forma eficiente um tecido cerebral intacta fora do caso cabeça exoesqueleto de proteção em uma mosca adulta. Vários métodos de dissecação eficaz e relativamente simples têm sido descritos em pormenor, que geralmente envolvem cuidadosa e passo a passo de remoção do processo cabeça e os tecidos associados, incluindo os olhos, a traqueia, e gordura do cérebro correcta 9, 10. Estes métodos de dissecação microcirúrgicos muitas vezes colocam exigências bastante rigorosas sobre a qualidade do fórceps de dissecação, contando com uma pinça com pontas bem alinhadas finos que podem ser facilmente danificados. Além disso, como os cérebros dissecados são muitas vezes separated do resto do corpo, o cérebro pode ser facilmente perdido durante os processos de coloração e lavagem subsequente, devido às suas pequenas dimensões e a sua transparência no tampão de processamento. Aqui, descrevemos um protocolo de dissecção de uma etapa relativamente simples e fácil de aprender, por cérebros adultos que mantém os cérebros dissecados anexados ao tronco. O processo de dissecção muitas vezes facilmente afasta a maioria dos tecidos associada ao cérebro, tais como o olho e traquéia e reduz a demanda por uma pinça de dissecação de boa qualidade.
Além disso, quando imagiologia do cérebro, ao microscópio composto fluorescente ou microscópio confocal, o lado do cérebro que está distante da fonte de luz fluorescente, muitas vezes produz um sinal mais fraco e menos imagens claras devido à espessura do cérebro inteiro de montagem. Aqui, nós também descrevem um método de montagem simples que permite um fácil inversão das amostras de cérebro, permitindo imagiologia conveniente de ambos os lados do cérebro com intensificação de sinal semelhantety e qualidade.
Como uma prova de conceito para a aplicação do presente método para estudar o cérebro adulto, examinámos ainda mais a presença de neurónios DA no cérebro de moscas W 1118; um genótipo que é frequentemente utilizado como a linha parental para a geração de moscas transgénicas e o controlo de tipo selvagem, em muitos estudos de Drosophila.
Protocolo
1. soluções utilizadas para Brain Dissecção e imunofluorescência Coloração
- Dissecar a mosca adulta cérebros em fluido cerebrospinal artificial (aCSF): NaCl 119 mM, 26,2 mM de NaHCO3, 2,5 mM de KCl, 1 mM de NaH 2 PO 4, 1,3 mM de MgCl 2, e 10 mM de glucose. Antes da utilização, o gás aCSF com 5% de CO 2/95% de O 2 por 10 - 15 min e pico com 2,5 mM de CaCl2. Esterilizar a solução por filtração através de aCSF de um filtro de membrana de 0,22 um.
Nota: loja aCSF a 4 ° C para evitar a contaminação bacteriana. cérebros voo também pode ser dissecado em uma solução de fosfato tamponado salino (PBS), embora as comparações detalhadas dos efeitos das duas soluções de dissecação sobre a qualidade da imagem final dos cérebros dissecados não ter sido realizada. - Use paraformaldeído a 4% (PFA) em PBS 1x preparada como a solução fixadora, que é normalmente dividido em alíquotas e armazenado a -20 ° C.
caution: PFA é tóxico e corrosivo e deve ser manuseado com cuidado. - Use 1x PBS para lavar o PFA a partir de cérebros e depois da última etapa de lavagem, durante a coloração de imunofluorescência dos cérebros dissecados. Prepara-se o PBS 1x de PBS 10x solução de estoque (1,37 M de NaCl, KCl 27 mM, 100 mM de Na 2 HPO 4, e 18 mM de KH 2 PO 4).
- Use Tween-20 a 0,3% em 1x PBS (1x PBT) para todos os passos de lavagem subsequentes durante a coloração de imunofluorescência dos cérebros dissecados.
2. microcirúrgica Dissection de Chefes mosca adulta
Nota: O procedimento de dissecção é ilustrado na Figura 1.
- Anestesiar as moscas adultas com CO 2. Utilizando uma pinça, pegar uma mosca e brevemente dewax sua cutícula por imersão em etanol 70% para 3 - 5 s. Isso garante que não há bolhas aderem à cutícula mosca quando imerso na aCSF ou solução de dissecção 1X PBS.
- Debaixo demicroscópio de dissecação com uma fonte de luz com um ângulo que não será bloqueado pelas mãos, definir a lente objectiva para obter uma vista clara da mosca (1,2X de ampliação). Use uma pinça com a mão não dominante para imobilizar o animal e mergulhe a mosca na solução de dissecção fria com seu abdômen virado para cima, como mostrado na Figura 1A.
- Manter a pinça de cada 160 - 170 ° ângulo com respeito à placa de dissecação, enquanto exerce uma pequena força para o abdómen da mosca (ilustrados como setas na Figura 1A). Esta etapa irá imobilizar a mosca e forçá-lo a mover a cabeça para trás, até 15 de - 25 ° ao estender a tromba para cima. No processo, uma região macio e translúcido da cutícula, por baixo da tromba, deve tornar-se aparente. Aumentar a ampliação e ajustar o plano focal para esta região.
Nota: Não segure a pinça com muita força, mas sim apenas o suficiente firme para estabilizaro voo. Demasiada força fará com que os órgãos dentro de ruptura para a solução. - Use a mão dominante para pressionar as pinças de dissecação de modo que suas pontas são fechadas, o que gerará uma força resistente leve nas pontas da pinça, de modo que a pinça vai saltar quando a pressão da mão de retenção é liberado. Posicionar a pinça perpendicularmente para a pinça que prende a mosca, como mostrado na Figura 1B.
- Pierce as pontas fechadas dos fórceps de dissecção através da região macio e translúcido da cutícula por baixo da tromba, como ilustrado pela seta vermelha na Figura 1B. É importante para não penetrar a pinça muito profundamente que ele toca o cérebro. O cérebro adequada deve tornar-se visível. Manter um aperto estável da mosca com a mão não-dominante.
- Rapidamente, mas de forma constante, solte as pontas das pinças de dissecação por sua própria força e contar com o impulso a partir desta liberação para arrancar tele exoesqueleto em torno da cabeça da mosca. Um cérebro intacto adequado deve tornar-se visível (o tecido branco imediatamente acima da ponta da pinça inferior na Figura 1C) Siga uma linha imaginária para orientar a dinâmica das dicas fórceps liberados (ilustrado como as setas vermelhas para fora mostrado na Figura 1C). Isto irá remover suavemente o exoesqueleto e na maioria das ocular associada ao cérebro e traqueia do cérebro. A temporização adequada e força aplicada para abrir o exoesqueleto será dependente da experiência do investigador.
Nota: Este é o passo mais crítico durante a dissecção. É importante contar com a força natural gerada a partir do movimento das pinças de abertura para remover o exosqueleto, deixando o cérebro exposta permanece ligado ao resto do corpo. - Use a pinça na mão dominante para remover cuidadosamente os tecidos acessórios remanescentes, como o traqueal que aparece como estruturas de fibras brancas remaining ligado ao cérebro. Tenha cuidado para não puxar ou danificar o cérebro adequada.
3. imunofluorescência coloração dos Brains
- Fixar as amostras de cérebro dissecado com seus torsos associados em aproximadamente 1 mL de PFA 4% para 40 - 60 min.
Nota: Para esta e as subsequentes etapas, manter os tubos ou placas com amostras em um nutator para misturar adequadamente as amostras na solução. - Enxágüe com 1 mL de 1x PBS pipetando a solução cima e para baixo 3 vezes. Tenha cuidado para não aspirar o cérebro de distância.
- Lavar 5 vezes com 1x PBT durante 5 min cada. Manter as amostras no nutator durante a incubação.
- Incubar com anticorpos primários na diluição adequada O / N a 4 ° C.
- No dia seguinte, remove os anticorpos primários, e lava-se as amostras 5 vezes com 1x PBT. Deixar as amostras durante 5 - 10 min na solução 1x PBT entre cada lavagem. Manter as amostras no nutator durante a incubação.
- Incubar a lavadaamostras em anticorpos secundários apropriados com a diluição e tempo de incubação sugeridas.
- Lavam-se as amostras de seis vezes com 1x de PBT com uma incubação de 10 min entre cada lavagem.
Este passo é crítico para a remoção de anticorpos secundários ligados de forma não específica a partir da amostra. - Incubar numa diluição de 1: 10000 de 1 mg / ml de 4 ', 6'-diamidino-2-fenilindol (DAPI) em solução PBT 1x durante 30 min. DAPI é um corante de ADN que se liga às regiões AT de DNA e pode ser usado para revelar a morfologia global do cérebro.
- Lavar três vezes com PBS 1x.
- amostras de transferência para um prato de dissecação, e separar os cérebros dos corpos em um prato dissecção usando uma pinça.
- Após os passos de lavagem e de coloração, montar os cérebros em entre duas lamelas e colocar as lamelas sobre uma corrediça de montagem. Deste modo, as amostras de tecido cerebral pode ser facilmente invertida de modo que ambos os lados do cérebro pode ser trabalhada com um sinal de intensidade semelhante.
Nota: Montagem do cérebro sobre a lamela em vez de directamente sobre a lâmina de montagem permite a inversão da orientação do exemplo livremente. O processo de montagem é explicado em mais detalhe abaixo.- Coloque uma lamela de 18 x 18 mm na parte superior de uma corrediça de montagem. Alargar a abertura de uma ponta de pipeta com uma lâmina e usá-lo para transferir o cérebro em solução de PBS 1x para a lamela de 18 x 18 mm.
- Colocar os cérebros no meio da lamela, remover o líquido em torno dos cérebros com uma ponta de pipeta fina, e em seguida, adicionar outro 20 - 40? L de meio de montagem anti-desvanecimento (0,2% (w v) de n-propil galato / em 99,5 % de glicerol, grau ACS) ao longo dos cérebros.
Nota: A quantidade de meio de montagem adicionada depende do número de cérebros examinados. - Delicadamente espalhar os miolos, enquanto deslocando o meio de montagem viscosa para fora. Colocar uma segunda lamela de 18 x 18 mm em cima dos cérebros baixando a corrediça a partir de um lado até que fique em contacto coma superfície de deslizamento de montagem, e em seguida, baixando lentamente o outro lado para minimizar o contacto do cérebro com bolhas de ar.
Nota: Não há nenhuma necessidade de usar um espaçador entre as duas lamelas de cobertura, como o volume do meio de montagem e os cérebros deve proporcionar um espaço suficiente para separar as duas lamelas. - Permitir que os slides para se estabelecer. Remover o líquido excessivo que saem dos lados dos talões com um tecido de laboratório.
- Para evitar que as lamelas com os cérebros montados de cair fora do slide de montagem durante o transporte, use um pequeno pedaço de fita para prender as lamelas para o slide de montagem.
Nota: Os cérebros montado entre as lâminas podem ser visualizados de imediato ou conservadas a 4 ° C durante até uma semana sem perda significativa de sinal de fluorescência, sem a necessidade de utilizar qualquer selante para selar as lâminas. Para a conservação a longo prazo dos cérebros manchado, do lado das duas folhas pode ser selado Wom unha polonês e armazenados em um freezer -20 ° C, embora cérebros manchadas pode perder os seus sinais ao longo do tempo. Isto não é recomendado.
- Use um microscópio composto fluorescente apropriado ou microscópio confocal para a imagem do cérebro.
- Em primeiro lugar, obter a imagem a partir do lado do cérebro mais próximo do objectivo, e em seguida virar cuidadosamente as lamelas de ter as amostras ensanduichada no meio. Este passo facilita a aquisição da imagem do outro lado do mesmo cérebro.
- Use um microscópio vertical composto fluorescente e uma lente objetiva de 20X para a imagem da totalidade do cérebro (exemplos na Figura 2) e uma objetiva de 40X a imagem menores regiões do cérebro, tais como neurónios DA na região do cluster do Emparelhados Anterior Medial (PAM) (exemplos na Figura 3).
Resultados
A Figura 1 ilustra os principais procedimentos de dissecação cérebro adulto, como descrito acima As Figuras 2 e 3 são imagens representativas de três dias de idade WT. (Genotipo: W 1118) mosca adulta cérebros que foram costained com um anticorpo contra a tirosina hidroxilase (TH , colorido a vermelho na Figura 2 e branco na Figura 3), um marcador comumente usado para rotular neurónios dA 11, em adição ao corante de ADN DAPI para marcar todos os núcleos celulares e um anticorpo contra a proteína elav, um marcador para todos os neurónios diferenciados em tempo real (de cor verde), que em conjunto revelaram a estrutura global do cérebro.
Para os anticorpos primários nas Figuras 2 e 3, utilizou-se anticorpo de coelho anti-TH na proporção de 1: anticorpo anti-elav 200 de diluição e de rato a uma diluição de 1: 100, WHICH foram preparados em 1x PBT com soro de cabra normal a 5% para bloquear a ligação não específica. Para os anticorpos secundários, utilizou-se anticorpo de cabra anti-rato conjugado 488-Alexa Fluor e o anticorpo anti-coelho de cabra conjugado com AlexaFluor596 a uma diluição de 1: 500 em 1x PBT.
Para imagem do cérebro, foi utilizado um microscópio composto fluorescente vertical equipado com uma função ApoTome para adquirir imagens Z-pilha de fatias de cérebro que cobrem toda a profundidade da região de interesse no cérebro. Por exemplo, para obter uma clara visualização da distribuição geral de neurónios DA em todo o cérebro, utilizou-se uma lente objectiva de 20x a imagem separadamente os lados anterior e posterior do mesmo cérebro (Figura 2). A profundidade de cada lado do cérebro fotografadas que podem cobrir todos os neurónios DA é de cerca de 20 - 25 | iM no total. Para visualizar de forma confiável e quantificar neurónios DA na região do cluster PAM, que têm tamanhos de células menores e mais fracos si THgnals (ver abaixo), utilizou-se uma lente objectiva de 40x. Além disso, em função de aquisição Z-série do software comercial, foi selecionada uma espessura de corte de 0,5-1 mm entre cada fatia trabalhada, o que garantiu melhor qualidade de imagem em uma reconstrução 3D da região do cluster PAM (Figura 3c). A espessura do aglomerado PAM no cérebro que abrange todos os neurónios DA é de cerca de 8-10? M no total. Na nossa experiência, a função ApoTome pode reduzir significativamente o sinal de ruído em imagiologia de amostras grossas com fundo elevado, tal como uma região do cérebro inteiro ou cluster PAM.
As Figuras 2A-E mostram a vista anterior de um cérebro, enquanto que as Figuras 2F-J mostram a vista posterior do mesmo cérebro depois de virar as lamelas que seguram as amostras de cérebro, que exibem um nível semelhante de intensidade de sinal entre os dois lados do cérebro para todos os três canais com imagens. O neur DAons foram agrupados em diferentes grupos seguintes a designação início 11, embora aqui usamos o nome Emparelhado Posterior Medial (PPM) para incluir o ppm1, PPM2 e aglomerados ppm3 no lado anterior do cérebro, eo nome Emparelhado lateral posterior (PPL ) para cobrir os aglomerados PPL1 e PPL2 a partir do lado posterior do cérebro, como representado nas Figuras 2E e 2J. as Figuras 2E e 2J na mostra anterior branco e uma vista posterior do mesmo cérebro em grande ampliação, revelando os diferentes aglomerados de dA neurónios em ambos os lados do cérebro. O branco linhas tracejadas destacar a grupos emparelhados Anterior Lateral (PAL) PAM proeminente e no lado anterior do cérebro (Figura 2E), bem como o PPL e os clusters ppm em face posterior do cérebro (Figura 2J).
As Figuras 3A e 3B uma re resumos dos resultados de quantificação para alguns dos grupos de DA em W 1118 moscas. Contamos neurônios DA fatia por fatia e também de imagens 3D reconstruídas, o que deve minimizar a contagem imprecisa. Nós estimamos que os 3 dias de idade w 1118 moscas têm uma média de 27 neurônios DA geral no cluster PPM per cérebro, 16 neurônios DA no cluster PPL por hemisfério, 5 neurônios DA em conjunto PAL por hemisfério (Figura 3A), e 97 neurônios dA em cada um dos agrupamentos PAM (Figura 3B). Figura 3C é uma reconstrução 3D representativa de neurônios dA nos clusters PAL e PAM, projectadas a partir de fatias de imagens de alta ampliação, abrangendo todos os neurônios dA nesta região. É evidente que em comparação com outros grupos, tais como a PAL, neurónios DA na agrupar PAM têm tamanhos de células relativamente pequenas e sinais mais fracos de coloração TH.
"Src =" / files / ftp_upload / 55128 / 55128fig1.jpg "/>
Figura 1:. Graphical Ilustração do Protocolo de dissecação para adultos Drosophila Cérebro Flies (A) estão posicionadas com o lado ventral para cima, e na posse do tórax usando a mão não-dominante. Força foi gentilmente aplicada (setas vermelhas) para a pinça para induzir a inclinação da cabeça para trás mosca e ligeira extensão para fora dos probóscide, expondo a região transparente branco abaixo. (B) Fórceps da mão dominante são inseridos na região transparente sob a tromba, criando uma incisão pouco profunda (seta vermelha). Note-se que a pinça que usamos não tem extremidades das pontas muito finas. (C) pinças são permitidos ser separadas através da sua própria força, tal como indicado pelas setas vermelhas. O impulso gerado pela abertura das pinças remove os olhos e exoesqueleto, expondo um cérebro Drosophila relativamente limpa. A maior parte da traqueia são removidos no processo. ( D) tecidos acessórios em excesso ao redor do cérebro são cuidadosamente aparado para a exposição completa do cérebro adequada. Por favor clique aqui para ver uma versão maior desta figura.
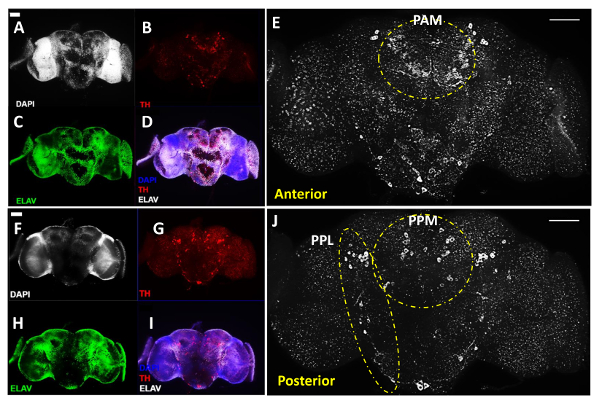
Figura 2:. DA Neurônios revelada com anti-tirosina hidroxilase (TH) de anticorpos em macho adulto Drosophila B chuva (adquirida com um 20X Objective) Este valor inclui imagens representativas de cérebros adultos dissecados, reconstruída usando imagens empilhadas-Z da região do cérebro juros obtida com o microscópio fluorescente composto. (AE) anterior e (FJ) vista posterior do mesmo cérebro adulto; (A & F) núcleos celulares foram fotografadas pela coloração DAPI (branco) e neurônios (C & H) were marcada por anticorpos marcadores pan-neuronal anti-elav (verde); Neurônios (B & G) DA são reveladas por anticorpos anti-TH (vermelho). (D & I) Sobreposição de imagens para DAPI, TH e tratamento elav. (E & J) Visão ampliada das regiões do cérebro com neurônios DA mostrados em branco. As linhas tracejadas destacar os aglomerados PAL e PAM no anterior do cérebro e aglomerados e PPL ppm no posterior do cérebro. A barra de escala representa 50 mm em todos os painéis. Por favor clique aqui para ver uma versão maior desta figura.

Figura 3. Quantificação da DA Neurônios no cérebro de adulto masculino w 1118 moscas (adquirida com um 40X Objective). (A & B) Quantificação de DA neurons do dia 3 do sexo masculino w 1118 moscas, revelados por coloração anti-TH. Os dados são representados por gráficos de caixas suiça mostrando valores mínimos e máximos que os valores extremos; assim como a primeira (Q1), segundo (Q2) e terceira (P3) quartis. O segundo quartil é representado como o valor médio. (A) PPM {(n = 28) Min: 21, Q1: 24, Média: 27, Q2: 30, Max: 32}, PPL {(n = 26) Min: 10, Q1: 12, Média: 16, Q2: 18, Max: 25}, e PAL {(n = 24), min: 2, Q1: 4, média: 5, Q2: 5, Max: 10} aglomerados; Cluster (B) PAM {(n = 20) Min: 86, Q1: 94, Média: 97, Q2: 97, Max: 99}. (C) A imagem de projeção representante mostrando neurônios DA nos PAM e PAL aglomerados de macho w 1118 moscas em 3 d. Barra de escala representa 20 um. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Com um interesse crescente no uso adulto Drosophila cerebral para estudar doenças humanas cérebro, circuitos neuronais e as funções cerebrais superiores, é necessário o desenvolvimento de métodos simples e rápidos para obter cérebros da mosca intactas para as análises todo-mount, que é especialmente importante para grande- dimensionar telas baseadas no cérebro. Nosso método fornece uma maneira simples e fácil de aprender abordagem para dissecar uma cabeça mosca (muitas vezes em menos de 10 s com experiência) com morfologia bem preservado que é em grande parte livre de tecidos associados. Como os cérebros dissecados ainda estão ligados ao resto dos corpos mosca, eles geralmente afundar para o fundo do tubo da amostra rapidamente e são fáceis de reconhecer e recolher durante os passos de lavagem e de coloração. Isso minimiza significativamente a perda de amostra que pode ser uma questão importante no processamento das amostras de cérebro de pequenas dimensões físicas. Este problema pode ser especialmente importante para estudos de larga escala. O cérebro pode ser facilmente retirado do corpoapós a conclusão do processo de coloração, antes da montagem.
Durante a dissecção, é importante posicionar correctamente a mosca, manter os ângulos adequados ao remover o exoesqueleto a partir da cabeça da mosca, e suavemente exercer a força adequada na realização de cada etapa. Recomenda-se que os fórceps são colocados perpendicularmente um ao outro, a fim de evitar a decapitação de mosca (Figura 1B). Como se mostra nas imagens representativas na Figura 2, os cérebros preparados utilizando este protocolo de produzir resultados satisfatórios. Neste exemplo, nós nos concentramos sobre os neurônios DA no cluster PAM de cérebros adultos. Um cérebro Drosophila, em média, tem um total de cerca de 280 neurônios DA por protocérebro, que são distribuídos em grupos distintos em diferentes regiões do cérebro com padrões de projeção distintos e saída funcional 11, 12. Caracterização anterior de neurônios DA em adultos cérebros de Drosophila, including voar modelos de genes de doenças humanas, tais como em mutantes Parkin, em grande parte focado no PAL, os clusters PPL e PPM que têm relativamente grandes tamanhos de células e expressão proeminente do TH, o fabricante padrão utilizado para a rotulagem da neurônios 13-18.
No entanto, a maioria dos neurónios da DA no cérebro mosca são encontrados nos grupos de PAM, com cerca de 100 neurónios DA por cacho. Em comparação com células em outros clusters DA, neurônios DA no cluster PAM mostram normalmente um menor nível de expressão de tirosina hidroxilase e tamanhos de células menores. Em amostras preparadas a partir de nosso protocolo de dissecção e coloração, os neurônios DA no cluster PAM pode ser claramente visualizado e fotografada em alta qualidade utilizando um microscópio de fluorescência composto, sem imagem confocal. Dado o seu grande número, quantificação de neurônios DA no cluster PAM de diferentes origens genéticas podem produzir resultados mais confiáveis e reprodutíveis. Sugerimos que os neurônios Da no clus PAMTer representam um outro sistema útil para estudar a biologia DA e modelagem de desordens relacionadas com a DA, tais como a doença de Parkinson.
Na nossa experiência, a função ApoTome do microscópio foi utilizado pode reduzir significativamente o sinal de fundo, especialmente na análise de amostras com a espessura significativa, tais como o cérebro inteiro mosca adulta. Embora microscópio confocal pode produzir imagens com mais detalhes, uma ampliação maior e melhor qualidade, isto é muitas vezes demorado e dispendioso. Isto é especialmente verdadeiro para a imagem de um grande número de amostras grossas tais como cérebros adultos que requerem série de seção Z-stack para a reconstrução 3D clara e análise deconvolução. Nesta perspectiva, a função ApoTome representa uma alternativa rápida e de baixo custo para produzir imagens de qualidade suficiente (por exemplo, imagens das Figuras 2 e 3).
Em estudos do cérebro, é frequentemente necessário para as células imagem em ambos Sides do mesmo cérebro. Por exemplo, neurónios DA estão presentes em aglomerados de ambos os lados anterior e posterior do cérebro. No entanto, devido à sua espessura, depois de um cérebro está montado sobre a lâmina, no lado distante da fonte de luz (isto é, o lado voltado para a corrediça de montagem) geralmente dá origem a sinais mais fracos e as imagens menos claras quando fotografada usando composto regular e confocal microscópios. Ao montar as amostras, entre as duas lâminas de cobertura, que permite inversão conveniente das amostras sobre a corrediça montada e subsequente imagiologia de ambos os lados do mesmo cérebro com intensidades de sinal similares. A Figura 2 é um exemplo de imagem neurónios DA a partir de ambos os lados voar cérebros usando este método, que mostrou a intensidade de sinalização relativamente comparáveis e qualidade de imagem.
Várias abordagens fáceis de seguir para dissecar adultos voar cérebros têm sido bem descrito 9, 10. Nossa abordagem fornece um método alternativo que pode pelether simplificar a dissecção e coloração processos de mosca adulta cérebros. Com mais estudos em grande escala sendo conduzidos para mapear todo o circuito neuronal do cérebro, bem como seus componentes moleculares e celulares, é previsível que Dissecção e imagem abordagens automatizadas podem ser desenvolvidos para adultos cérebros de Drosophila para realizar telas genéticos e medicamentos de alto rendimento in vivo, neste modelo de genética clássica.
Divulgações
The authors have nothing to disclose.
Agradecimentos
Nós reconhecemos o Sr. Enes Mehmet, Ms. Kiara Andrade, Ms. Pilar Rodriguez, Chris Kwok, e Ms. Danna Ghafir por seu imenso apoio ao projeto.
Materiais
| Name | Company | Catalog Number | Comments |
| w*; parkΔ21/TM3, P{GAL4-Kr.C}DC2, P{UAS-GFP.S65T}DC10, Sb1 | Bloomington Drosophila Stock Center | 51652 | Balancer was switched to TM6B |
| PBac{WH}parkf01950 | Exelixis at Harvard Medical School | f01950 | Balancer was switched to TM6C |
| NaCl | Fisher Scientific | S640-500 | |
| Sodium Bicarbonate (NaHCO3) | Fisher Scientific | 02-003-990 | |
| Potassium Chloride (KCl) | Fisher Scientific | BP366-500 | |
| Sodium phosphate, monobasic monohydrate (NaHCO3) | Fisher Scientific | 02-004-198 | |
| Magnesium Chloride (MgCl2) | Fisher Scientific | 02-003-265 | |
| D-Sorbitol | Sigma-Aldrich | S1876-500G | Replaces glucose |
| Calcium chloride dihydrate (CaCl2) | Sigma-Aldrich | C5670-500G | |
| EMD Millipore Durapore PVDF Membrane Filters: Hydrophilic: 0.22 µm Pore Size | Fisher Scientific | GVWP14250 | |
| Formalin Solution, 10% (Histological) | Fisher Scientific | SF98-20 | |
| Potassium Phosphate, Dibasic, Powder, Ultrapure Bioreagent | Fisher Scientific | 02-003-823 | |
| Tween-20 | Fisher Scientific | BP337-500 | |
| Excelta Precision Tweezers with Very Fine Points | Fisher Scientific | 17-456-055 | Protocol does not require very fine points. |
| Anti-Tyrosine Hydroxylase Antibody | Pel-Freez Biologicals | P40101 | |
| Rat-Elav-7E8A10 anti-elav | The Developmental Studies Hybridoma Bank | Clone 7E8A10 | |
| Goat anti-Rat IgG (H+L) Secondary Antibody, Alexa Fluor 647 conjugate | ThermoFisher Scientific | A-21247 | |
| Goat anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 594 conjugate | ThermoFisher Scientific | A-11037 | |
| DAPI Solution (1 mg/mL) | ThermoFisher Scientific | 62248 | |
| Propyl gallate powder | Sigma-Aldrich | P3130-100G | |
| Glycerol ACS reagent, ≥99.5% | Sigma-Aldrich | G7893-500ML | |
| Zeiss Axioimager Z1 | Zeiss | Quote | |
| Zeiss Apotome.2 | Zeiss | Quote | |
| Zen lite software | Quote |
Referências
- Wangler, M. F., Yamamoto, S., Bellen, H. J. Fruit flies in biomedical research. Genetics. 199, 639-653 (2015).
- Bellen, H. J., Yamamoto, S. Morgan's legacy: fruit flies and the functional annotation of conserved genes. Cell. 163, 12-14 (2015).
- Aso, Y., et al. The neuronal architecture of the mushroom body provides a logic for associative learning. Elife. 3, 04577(2014).
- Reiter, L. T., Potocki, L., Chien, S., Gribskov, M., Bier, E. A systematic analysis of human disease-associated gene sequences in Drosophila melanogaster. Genome Res. 11, 1114-1125 (2001).
- Yamagata, N., et al. Distinct dopamine neurons mediate reward signals for short- and long-term memories. Proc Natl Acad Sci U S A. 112, 578-583 (2015).
- Nern, A., Pfeiffer, B. D., Rubin, G. M. Optimized tools for multicolor stochastic labeling reveal diverse stereotyped cell arrangements in the fly visual system. Proc Natl Acad Sci U S A. 112, 2967-2976 (2015).
- Waddell, S. Neural Plasticity: Dopamine Tunes the Mushroom Body Output Network. Curr Biol. 26, 109-112 (2016).
- Wolff, T., Iyer, N. A., Rubin, G. M. Neuroarchitecture and neuroanatomy of the Drosophila central complex: A GAL4-based dissection of protocerebral bridge neurons and circuits. J Comp Neurol. 523, 997-1037 (2015).
- Sweeney, S. T., Hidalgo, A., de Belle, J. S., Keshishian, H. Dissection of adult Drosophila brains. Cold Spring Harb Protoc. 2011, 1472-1474 (2011).
- Wu, J. S., Luo, L. A protocol for dissecting Drosophila melanogaster brains for live imaging or immunostaining. Nat Protoc. 1, 2110-2115 (2006).
- Mao, Z., Davis, R. L. Eight different types of dopaminergic neurons innervate the Drosophila mushroom body neuropil: anatomical and physiological heterogeneity. Front Neural Circuits. 3, 5(2009).
- White, K. E., Humphrey, D. M., Hirth, F. The dopaminergic system in the aging brain of Drosophila. Front Neurosci. 4, 205(2010).
- Yang, Y., et al. Mitochondrial pathology and muscle and dopaminergic neuron degeneration caused by inactivation of Drosophila Pink1 is rescued by Parkin. Proc Natl Acad Sci U S A. 103, 10793-10798 (2006).
- Greene, J. C., et al. Mitochondrial pathology and apoptotic muscle degeneration in Drosophila parkin mutants. Proc Natl Acad Sci U S A. 100, 4078-4083 (2003).
- Whitworth, A. J., et al. Increased glutathione S-transferase activity rescues dopaminergic neuron loss in a Drosophila model of Parkinson's disease. Proc Natl Acad Sci U S A. 102, 8024-8029 (2005).
- Pesah, Y., et al. Drosophila parkin mutants have decreased mass and cell size and increased sensitivity to oxygen radical stress. Development. 131, 2183-2194 (2004).
- Trinh, K., et al. Decaffeinated coffee and nicotine-free tobacco provide neuroprotection in Drosophila models of Parkinson's disease through an NRF2-dependent mechanism. J Neurosci. 30, 5525-5532 (2010).
- Kim, K., Kim, S. H., Kim, J., Kim, H., Yim, J. Glutathione s-transferase omega 1 activity is sufficient to suppress neurodegeneration in a Drosophila model of Parkinson disease. J Biol Chem. 287, 6628-6641 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados