Method Article
一个简单的一步解剖协议成人全安装准备
摘要
成年果蝇大脑是研究神经回路,大脑高级功能和复杂性疾病的宝贵制度。一种有效的方法来剖析来自小苍蝇头全脑组织将促进脑为基础的研究。在这里,我们描述了一个简单的一步解剖成人的大脑保存完好的形态协议。
摘要
有在使用果蝇到人脑退行性疾病的模型,在成人大脑映射神经设计电路,和研究的高级脑功能的分子和细胞基础的兴趣日益增加。成人大脑的整体卡口制剂保存完好的形态是这样的全脑为基础的研究关键的,但也可以是技术挑战性和耗时。这个协议描述了成年果蝇头部在不到10秒的一个易于了解,一步法解剖的方法,同时保持附连到身体的其他部分的完整的脑,以方便后续处理步骤。该过程有助于消除最通常与可以与稍后成像步骤干涉大脑相关的眼睛和气管组织的,并且也对所述解剖钳的质量需求较少。此外,我们描述一个简单的方法,可用于在盖玻片安装的脑样品的方便翻转,这是用于成像的B的两侧重要降雨具有类似信号强度和质量。作为协议的一个例子,我们在野生成年大脑多巴胺能呈现(DA)神经元的分析( 附1118)苍蝇。解剖方法的疗效高,使其成为在果蝇中大型为主脑的成人研究特别有用。
引言
模式生物果蝇 ,俗称实蝇,长期以来一直重视其优雅的基因工具,短生育时间和高度保守的分子和细胞通路。果蝇已成功地用于解剖基本信号通路,多细胞生物体的图案化的机制,以及神经元发育,功能的基本机制,和疾病1,2-。在细胞标记和成像技术的最新进展,果蝇大脑已经成为神经回路的精细定位,并在解剖的高级脑功能,例如学习,记忆,和昼夜节律1,3的分子和细胞基础特别强大, 4,5,6,7,8。
果蝇系统的一个特别的优点是它的相对小的尺寸,允许使用常规化合物或共焦显微镜的大脑整个安装制备和检查。氏取值特征使神经元电路的详细解剖和功能分析,或甚至一个单一的神经元,在细胞和亚细胞水平,在全脑组织的范围内,从而在整个内提供所研究的受试者的两个整体视图及其精确几何脑。然而,考虑到大脑的相当小尺寸,它也呈现在一个成年果蝇有效解剖一个完整的脑组织从保护外骨骼头壳体的技术挑战。各种有效和相对简单的解剖的方法已详细描述,其通常涉及仔细和分步除去头部壳体的和相关的组织,包括眼睛,气管,和脂肪从大脑适当9,10,这些显微解剖的方法经常放置在解剖钳的质量相当严格的要求,依托细以及对齐提示,可以很容易损坏钳。此外,作为解剖大脑往往分隔符从身体的其余编,大脑可以容易地期间,因为它们的小尺寸和它们在处理缓冲器透明度的后续染色和洗涤过程丢失。在这里,我们描述了,保持连接到躯干的解剖大脑成人大脑相对简单和容易学习,一步夹层协议。解剖过程中往往容易清除了大部分脑相关组织如眼睛和气管,并减少了质量好的解剖钳的需求。
此外,荧光化合物显微镜或共焦显微镜下成像大脑时,大脑的一侧即来自荧光光源远经常产生一个较弱的信号和较少的清晰图像,由于整个贴装脑的厚度。在这里,我们还描述了一个简单的安装方法,其允许大脑样品容易翻转,使大脑两侧方便成像相似的信号的IntensiTY和质量。
作为证明的概念对于本方法的应用,研究成人脑,我们进一步研究多巴胺神经元的用w 1118蝇脑中的存在;被经常用作用于产生转基因苍蝇,在许多果蝇研究野生型对照的亲本系基因型。
研究方案
1.解决方案用于脑解剖和免疫荧光染色
- 解剖成人飞脑在人造脑脊髓液(ACSF):119 mM氯化钠,26.2毫碳酸氢钠 ,2.5mM的氯化钾,1mM的的NaH 2 PO 4,1.3毫氯化镁 ,和10mM葡萄糖。在使用前,气体用5% 的 CO 2/95%O 2,10的脑脊液- 15分钟,穗带的2.5mM的CaCl 2。通过一个0.22微米的膜过滤器灭菌脑脊液溶液。
注:储存脑脊液在4℃,以防止细菌污染。飞大脑也可以在磷酸盐缓冲盐水(PBS)溶液解剖,虽然对解剖大脑的最终成像质量两个夹层溶液的作用详细的比较没有被执行。 - 使用在1×PBS中制备的固定剂溶液,其通常等分并储存在-20℃的4%多聚甲醛(PFA)。
CautioN:PFA是有毒和腐蚀性,应小心处理。 - 使用1X PBS从大脑和最后的清洗步骤后冲洗PFA,解剖大脑的免疫荧光染色过程中。从10倍的PBS原液制备1×PBS中(1.37 M氯化钠,27毫米氯化钾,100mM的磷酸氢二钠,和18毫KH 2 PO 4)。
- 解剖脑的免疫荧光染色期间在1×PBS中(1×PBT)的所有随后的洗涤步骤使用0.3%吐温-20。
2.成年果蝇首脑显微解剖
注意:解剖过程在图1中示出。
- 用CO 2麻醉成年果蝇。 5秒 - 使用镊子,拿起一只苍蝇,并简要由70%乙醇浸泡3就其脱蜡角质层。这确保了沉浸在脑脊液或1X PBS夹层溶液时没有气泡附着于飞角质层。
- 下在那个不会被手被阻塞的角度解剖与光源的显微镜,设置物镜达到飞(1.2X倍率)一个明确的说法。使用镊子用非优势手来固定动物和浸入飞入其腹部朝上, 如图1A中的冷夹层溶液。
- 保持镊子在160 - 170°角相对于夹层板,同时施加一个小的力到飞行的腹部(示出为图1A中的箭头)。这一步将固定飞行,并迫使它由15向后移动头部 - 向上延伸长鼻25°一会儿。在此过程中,表皮的柔软和半透明区域,长鼻下方,应当是显而易见的。增加放大倍率和调整焦平面到这一地区。
注意:不要拿着镊子得太紧,而只是足够牢固,能够稳定飞。用力过猛将导致内部器官破裂到溶液中。 - 使用优势手按解剖镊,以便其尖端封闭的,这将产生对钳子的前端温和耐力,以便从保持手压被释放时的镊子将弹开。钳子垂直定位到保持飞镊子, 如图1B所示 。
- 皮尔斯解剖钳通过长鼻下方的角质层柔软和半透明区域闭合的提示,由图1B中的红色箭头所示。不穿透钳子太深它接触大脑是重要的。大脑正确的应该变得可见。保持飞与非优势手稳定的把握。
- 很快但稳定,靠自身的力量释放解剖钳提示,并依靠势头从这个版本到撕去Ť他的外骨骼周围的苍蝇头。一个完整的脑正确应该成为可见(白色组织立即在图1C的底部钳子的前端以上)跟随的假想线引导释放钳子提示(如在图1C中所示的向外红色箭头示出)的动能。这将温和地去除骨骼,大部分来自大脑的脑相关的眼睛和气管。适当的时机和力施加到打开外骨骼将取决于研究者的经验。
注:这是在解剖最关键的一步。它依赖于从开口钳的动量产生的自然力量,同时留下露出的脑仍附着在身体的其他部分以除去外骨骼是重要的。 - 使用优势手的镊子小心地将残余附件组织,如出现白色纤维结构的气管remaini纳克附着到大脑。要小心,不要拉扯或损伤大脑正确的。
3.大脑的免疫荧光染色
- 固定在约1毫升4%PFA进行40与它们相关的躯干的解剖脑样品 - 60分钟。
注意:对于这个和随后的步骤,保持上一章动器的管或板的样品在溶液中适当地混合的样品。 - 吹打解决方案上下3次用1毫升1X PBS的冲洗。小心不要吸出的大脑了。
- 用1×PBT洗5次,每次5分钟。保持对章动器样品孵化过程中。
- 一抗孵育适当的稀释O / N在4℃。
- 第二天,除去第一抗体,并用1×PBT洗样品5次。离开样品5 - 在1倍的PBT溶液10分钟,每次洗涤之间。保持对章动器样品孵化过程中。
- 孵育洗样中所建议的稀释和培养时间适当的二级抗体。
- 用1X PBT洗样品六次每次冲洗之间的温育10分钟。
本步骤是从样品中除去非特异性结合的第二抗体是至关重要的。 - 孵育以1:在1×PBT溶液的1毫克/毫升4',6'-二脒基-2-苯基吲哚(DAPI)1:10,000稀释30分钟。 DAPI是结合DNA的AT区,可用于揭示脑的整体形态的DNA染料。
- 用1X PBS冲洗三次。
- 转移样品解剖菜,然后使用镊子解剖盘分开尸体的大脑。
- 后染色和洗涤步骤,装入在盖玻片两者之间的大脑,并放置在盖玻片上的安装滑道的顶部。以这种方式,所述脑样品可以容易地翻转使大脑的两侧可具有类似的信号强度进行成像。
注意:安装脑盖玻片上,而不是直接在安装滑道使得样品的方向翻转自如。安装工序是在下面更详细说明。- 放置在安装滑道的顶部的18×18mm的盖玻片。加宽枪头用刀片的开口,并用它来在1×PBS溶液转移大脑到18×18mm的盖玻片。
- 放置的大脑上盖玻片的中间,除去用细枪头大脑周围液体,然后添加另外20 - 抗褪色封固剂的40微升(0.2%(重量/体积)正丙基99.5没食子酸%ACS级甘油)在大脑。
注:固定介质中加入的量取决于研究大脑的数量。 - 轻轻散开的大脑,而向外移位粘性安装介质。放置在脑的顶部的第二18×18mm的盖玻片通过首先从一侧降低滑动直到其与接触安装滑的表面上,然后慢慢降低的另一侧,以尽量减少气泡脑接触。
注意:没有必要使用垫片在两个盖玻片之间,作为安装培养基的体积和大脑应提供足够的两个盖玻片分开的空间。 - 允许的幻灯片落户。除去过量的液体,从用实验室组织卡瓦两侧出来。
- 为了防止安装的大脑盖玻片在运输过程中脱落的安装滑轨,用一小块胶带将盖玻片安装到固定的幻灯片。
注意:脑安装在之间的幻灯片可以立即被成像或在没有荧光信号的显著损失4℃长达一个星期保存下来,而不需要使用任何密封剂密封的幻灯片。对于染色的大脑长期保存,这两个滑动的侧可被密封瓦特第i指甲油,并存储在-20℃冰箱,虽然染色的大脑可能会失去它们的信号在一段时间。这是不推荐的。
- 使用适当的复合荧光显微镜或共聚焦显微镜图像的大脑。
- 首先,从大脑更靠近物镜的一侧获取图像,然后小心地翻转的盖玻片有夹在中间的试样。这个步骤有利于获得相同的大脑的另一侧的图像。
- 使用一个直立化合物荧光显微镜和20X物镜到图像全脑( 图2中的例子)和40X物镜到大脑的图像较小的区域,如在配对前内侧(PAM)簇区多巴胺神经元(示例在图3中)。
结果
图1示出了用于成人脑解剖主程序中,如上所述图2和3是3日龄WT代表性图像(基因型:W 1118)成人飞大脑,其被costained用抗酪氨酸羟化酶的抗体(TH ,用红色的图2和白色图3),一个标记通常用于标记多巴胺神经元11中,除了将DNA染料DAPI标记所有所有分化的神经元细胞的细胞核和针对ELAV蛋白的抗体,标记物在飞(着色为绿色),它们一起显示了大脑的整体结构。
对于在图2和3中的第一抗体,我们使用兔抗TH抗体以1:200的稀释和大鼠抗ELAV抗体以1:100稀释,WHI通道分别在1×PBT制备含5%正常山羊血清阻断非特异性结合。对于二级抗体,我们使用的Alexa Fluor 488缀合的山羊抗大鼠抗体和AlexaFluor596缀合的山羊抗兔抗体以1:500稀释在1×PBT。
到图像的大脑中,我们使用配备有apotome函数来获取脑切片覆盖在大脑中的感兴趣的区域的整个深度的Z堆叠图像的直立化合物荧光显微镜。例如,为了获得多巴胺神经元在整个大脑的一般分布的清晰的可视化,我们使用20X物镜分开图像中相同的大脑的前部和后部侧面( 图2)。大脑的每一侧的深度成像,可以覆盖所有的多巴胺神经元为约20 - 总共25微米。为了可靠地可视化和量化的PAM簇区DA能神经元,它们具有更小的单元尺寸和较弱TH SIgnals(见下文),我们使用40X物镜。此外,在从商用软件的Z系列获取功能,我们选择了0.5的部分厚度- 1微米每个成象片之间,这确保最佳图像质量的3D重建的PAM簇区( 图3c)的。 PAM群集在覆盖所有的多巴胺神经元的大脑的厚度为约10 - 总共10微米。在我们的经验,apotome函数可以显著减少在成像厚的样品具有高的背景下,噪声信号,如一个全脑或在PAM簇区域。
图2A-E示出了大脑的前视图,而图2F-J显示相同的脑的后部视图翻转持有的脑样品,这对于大脑的两侧之间显示信号强度的类似水平的盖玻片后所有三个成像通道。该DA neur组件被分为以下早期指定11个不同的群集,尽管这里我们使用配对后内侧(PPM)的名称,以包括PPM1,PPM2,并且在大脑的前侧PPM3群集和配对后外侧的名称(PPL )以覆盖从大脑的后侧的PPL1和PPL2簇,如在白色显示前和在高倍率同一脑的后部观点图2E和2J。 图2E和2J中所示,揭示DA的不同群集对大脑的两侧的神经元。白色虚线突出显示在脑中( 图2E)以及PPL和大脑( 图2J)的后侧的PPM簇的前侧的突出PAM和配对前外侧(PAL)的簇。
图3A和3B一个重新量化结果对一些单位为W 1118苍蝇DA集群的摘要。我们数DA神经元薄片切片,也从三维重建图像,应尽量减少不准确计数。我们估计,3日龄W¯¯1118苍蝇有27 DA能神经元的整体平均每大脑中的PPM集群,16 DA能神经元每半球PPL集群中,5 DA神经元每半球PAL集群( 图3A),并在每个PAM集群( 图3B)97 DA能神经元。 图3C是在PAL和PAM集群DA能神经元,从高放大倍率的图像覆盖所有的DA能神经元在这一地区的片投射的代表三维重建。显而易见的是相对于其它簇如PAL制式,在PAM集群中的多巴胺神经元具有相对较小的细胞尺寸和较弱TH染色信号。
"SRC ="/文件/ ftp_upload / 55128 / 55128fig1.jpg"/>
图1:在解剖议定书成人果蝇脑的图形示意图 (A)的蝇被定位与腹侧向上,并且通过使用非优势手胸廓保持。力轻轻地施加(红色箭头)的钳子以诱导飞头和吸管的轻微向外延伸的向后倾斜,露出下面的白色透明区。 (B)中从优势手钳插在长鼻下方的透明区域,形成一个浅切口(红色箭头)。注意,我们使用镊子没有很细的尖端。 (C)的钳被允许通过其自身的力来分开,由红色箭头所示。通过打开钳产生的势头消除眼睛和骨骼,露出一个相对干净的果蝇大脑。大多数气管是在过程中除去。 ( D)大脑周围多余的附件组织被精心修剪掉大脑适当的全面曝光。 请点击此处查看该图的放大版本。
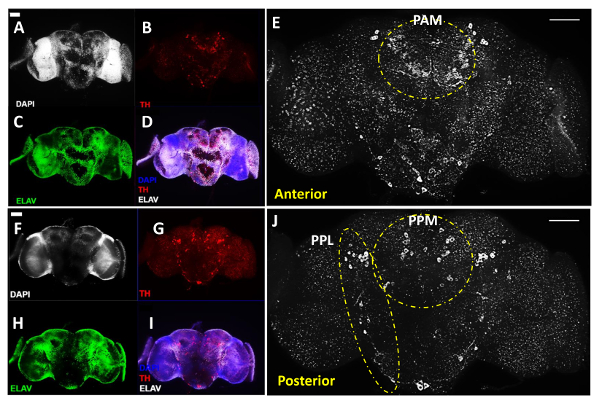
图2:DA神经元揭示用抗酪氨酸羟化酶(TH)抗体在成年男性果蝇乙雨(具有20X目的收购)该图包括解剖成人大脑的代表性图像,使用的大脑区域中的Z堆叠图像重建与化合物荧光显微镜获得利益。 (AE)和前(FJ)同成人大脑的后部意见; (A&F)细胞核被DAPI染色(白色)和(C&H)神经元W¯¯成像ERE由泛神经元标记的抗抗体ELAV(绿色)标记的; (B&G)多巴胺神经元被抗TH抗体(红色)显示。 (D&I)为DAPI,TH和治疗ELAV图像的叠加。 (E&J),以白色示出与多巴胺神经元的大脑区域的放大图。虚线突出显示在脑和PPL和PPM簇在脑的后部的前部的PAL制式和PAM簇。比例尺代表所有的面板为50微米。 请点击此处查看该图的放大版本。

图3. DA能神经元的定量在成年男性的大脑W¯¯1118苍蝇(有40X目的收购)。(A&B)DA为n的量化每日3男euronsW¯¯1118苍蝇,抗TH染色显示。数据由晶须箱形图表示的最大值和最小值作为异常值表示;以及第一(Q1),第二(Q 2)和第三(Q3)四分位。第二四分位被表示为平均值。 (A)PPM {(N = 28)最小:21,1:24,平均:27,Q2:30,最大:32},PPL {(N = 26)最小:10,1:12,平均:16, Q2:18,最大:25}和{PAL(N = 24),最小:2,1:4,平均:5,Q2:5,最大:10}集群; (B)PAM集群{(N = 20)最小:86,1:94,平均:97,Q2:97,最大:99}。显示了在3天的雄性W¯¯1118苍蝇的PAM和PAL集群DA能神经元(C)代表的投影图像。比例尺代表20微米。 请点击此处查看该图的放大版本。
讨论
在使用成年果蝇脑研究人类脑疾病,神经元的电路,和更高的脑功能的兴趣日益增加,需要开发简单和快速的方法,以获得完整的飞大脑对于整个贴装分析,这是适用于大尤其重要比例基于大脑的屏幕。我们的方法提供了一个简单,易于学习的方法来剖析出一只苍蝇头(通常在不到10秒的经验)有保存完好的形态被清除大部分相关的组织。作为解剖大脑仍附着到飞体的其余部分,它们通常下沉快速样品管的底部,很容易在洗涤和染色步骤,以识别和收集。这显著减少样品损失,可以是一个突出的问题在加工微小的物理尺寸的脑样品。这个问题可以是大规模的研究尤其重要。大脑可以从主体容易脱落在完成染色过程中,安装前后。
在夹层中,以正确地定位飞,从蝇头拆除外骨骼时保持适当的角度,并轻轻在执行每个步骤施加适当的力是非常重要的。建议在钳子被垂直地放置于彼此,以便防止所述飞( 图1B)的断头。如图中的代表图像在图2中,使用该方案制备的脑中产生令人满意的结果。在这个例子中,我们集中在成人脑的PAM集群中的多巴胺神经元。 果蝇的大脑中有平均每总额约protocerebrum 280 DA能神经元,它们分布在不同的集群中具有鲜明的投影模式和功能输出11,12大脑的不同区域。在成年果蝇的大脑,includi DA能神经元上的表征吴飞人类疾病基因的车型,如帕金突变体,大都集中在PAL,具有相对较大的单元尺寸和TH,用于标记DA能神经元13-18的标准制造者突出表现PPL和PPM集群。
然而,大多数在飞脑多巴胺神经元中的PAM簇中发现,每簇约100多巴胺神经元。相比于其它的DA簇的细胞,在PAM集群中多巴胺神经元正常显示酪氨酸羟化酶的表达和更小单元尺寸的一个更小的水平。从我们的解剖和染色方案制备的样品,在PAM集群中的多巴胺神经元可以清楚地显现,并使用化合物荧光显微镜在高质量成像,而不共焦成像。鉴于其大一些,不同遗传背景的PAM集群中的多巴胺神经元的量化可能会产生更可靠的和可重复的结果。我们建议多巴胺神经元的PAM的CLU之三表示用于研究的DA生物学和建模的DA相关的障碍,如帕金森氏病的另一个有用的系统。
在我们的经验,从我们使用可显著降低背景信号,特别是在检查与显著厚度的样品,如全成年果蝇脑的显微镜apotome功能。虽然共焦显微镜可以产生更多的细节,更高的放大倍率和更好质量的图像,它通常是费时和昂贵的。这是用于成像大量厚的样品,尤其如此,例如要求系列明确的3D重建和去卷积分析Z堆叠部的成人大脑。在这个角度来看,apotome函数表示一种快速和成本有效的替代方案,以产生足够的质量的图像( 例如 ,在图2和3的图像)。
在脑研究,这是通常需要图像的细胞在两个SI相同的大脑的DES。例如,多巴胺神经元存在于从两个大脑的前部和后部双方簇。然而,由于它的厚度,脑被安装到滑动后,从光源远的一侧( 即,面对该安装滑动的一侧)通常成像时使用常规的化合物和共焦引起较弱信号和较少的清晰图像显微镜。通过在两个盖玻片之间安装的样品中,它允许在安装的滑动,并且在同一脑具有类似信号强度的两侧的后续成像样品的方便翻转; 图2是从两侧的成像多巴胺神经元的一个例子飞使用该方法,其显示相对可比信令强度和成像质量的大脑。
一些易于后续方案的解剖成人飞的大脑已经很好地描述了9,10。我们的方法提供了一种替代方法,可以皮毛疗法简化成人的解剖和染色工艺飞大脑。与正在开展更大规模的研究,绘制出全脑的神经元电路,以及它的分子和细胞成分,可以预见的是自动化的解剖和成像方法可为成年果蝇的大脑,实现高通量的基因和药物屏幕开发在这个经典的遗传模型体内 。
披露声明
The authors have nothing to disclose.
致谢
我们承认埃内斯穆罕默德先生,伽罗安德拉德女士,Pilar Rodriguez女士,克里斯国和丹娜Ghafir女士对项目的巨大支持。
材料
| Name | Company | Catalog Number | Comments |
| w*; parkΔ21/TM3, P{GAL4-Kr.C}DC2, P{UAS-GFP.S65T}DC10, Sb1 | Bloomington Drosophila Stock Center | 51652 | Balancer was switched to TM6B |
| PBac{WH}parkf01950 | Exelixis at Harvard Medical School | f01950 | Balancer was switched to TM6C |
| NaCl | Fisher Scientific | S640-500 | |
| Sodium Bicarbonate (NaHCO3) | Fisher Scientific | 02-003-990 | |
| Potassium Chloride (KCl) | Fisher Scientific | BP366-500 | |
| Sodium phosphate, monobasic monohydrate (NaHCO3) | Fisher Scientific | 02-004-198 | |
| Magnesium Chloride (MgCl2) | Fisher Scientific | 02-003-265 | |
| D-Sorbitol | Sigma-Aldrich | S1876-500G | Replaces glucose |
| Calcium chloride dihydrate (CaCl2) | Sigma-Aldrich | C5670-500G | |
| EMD Millipore Durapore PVDF Membrane Filters: Hydrophilic: 0.22 µm Pore Size | Fisher Scientific | GVWP14250 | |
| Formalin Solution, 10% (Histological) | Fisher Scientific | SF98-20 | |
| Potassium Phosphate, Dibasic, Powder, Ultrapure Bioreagent | Fisher Scientific | 02-003-823 | |
| Tween-20 | Fisher Scientific | BP337-500 | |
| Excelta Precision Tweezers with Very Fine Points | Fisher Scientific | 17-456-055 | Protocol does not require very fine points. |
| Anti-Tyrosine Hydroxylase Antibody | Pel-Freez Biologicals | P40101 | |
| Rat-Elav-7E8A10 anti-elav | The Developmental Studies Hybridoma Bank | Clone 7E8A10 | |
| Goat anti-Rat IgG (H+L) Secondary Antibody, Alexa Fluor 647 conjugate | ThermoFisher Scientific | A-21247 | |
| Goat anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 594 conjugate | ThermoFisher Scientific | A-11037 | |
| DAPI Solution (1 mg/mL) | ThermoFisher Scientific | 62248 | |
| Propyl gallate powder | Sigma-Aldrich | P3130-100G | |
| Glycerol ACS reagent, ≥99.5% | Sigma-Aldrich | G7893-500ML | |
| Zeiss Axioimager Z1 | Zeiss | Quote | |
| Zeiss Apotome.2 | Zeiss | Quote | |
| Zen lite software | Quote |
参考文献
- Wangler, M. F., Yamamoto, S., Bellen, H. J. Fruit flies in biomedical research. Genetics. 199, 639-653 (2015).
- Bellen, H. J., Yamamoto, S. Morgan's legacy: fruit flies and the functional annotation of conserved genes. Cell. 163, 12-14 (2015).
- Aso, Y., et al. The neuronal architecture of the mushroom body provides a logic for associative learning. Elife. 3, 04577(2014).
- Reiter, L. T., Potocki, L., Chien, S., Gribskov, M., Bier, E. A systematic analysis of human disease-associated gene sequences in Drosophila melanogaster. Genome Res. 11, 1114-1125 (2001).
- Yamagata, N., et al. Distinct dopamine neurons mediate reward signals for short- and long-term memories. Proc Natl Acad Sci U S A. 112, 578-583 (2015).
- Nern, A., Pfeiffer, B. D., Rubin, G. M. Optimized tools for multicolor stochastic labeling reveal diverse stereotyped cell arrangements in the fly visual system. Proc Natl Acad Sci U S A. 112, 2967-2976 (2015).
- Waddell, S. Neural Plasticity: Dopamine Tunes the Mushroom Body Output Network. Curr Biol. 26, 109-112 (2016).
- Wolff, T., Iyer, N. A., Rubin, G. M. Neuroarchitecture and neuroanatomy of the Drosophila central complex: A GAL4-based dissection of protocerebral bridge neurons and circuits. J Comp Neurol. 523, 997-1037 (2015).
- Sweeney, S. T., Hidalgo, A., de Belle, J. S., Keshishian, H. Dissection of adult Drosophila brains. Cold Spring Harb Protoc. 2011, 1472-1474 (2011).
- Wu, J. S., Luo, L. A protocol for dissecting Drosophila melanogaster brains for live imaging or immunostaining. Nat Protoc. 1, 2110-2115 (2006).
- Mao, Z., Davis, R. L. Eight different types of dopaminergic neurons innervate the Drosophila mushroom body neuropil: anatomical and physiological heterogeneity. Front Neural Circuits. 3, 5(2009).
- White, K. E., Humphrey, D. M., Hirth, F. The dopaminergic system in the aging brain of Drosophila. Front Neurosci. 4, 205(2010).
- Yang, Y., et al. Mitochondrial pathology and muscle and dopaminergic neuron degeneration caused by inactivation of Drosophila Pink1 is rescued by Parkin. Proc Natl Acad Sci U S A. 103, 10793-10798 (2006).
- Greene, J. C., et al. Mitochondrial pathology and apoptotic muscle degeneration in Drosophila parkin mutants. Proc Natl Acad Sci U S A. 100, 4078-4083 (2003).
- Whitworth, A. J., et al. Increased glutathione S-transferase activity rescues dopaminergic neuron loss in a Drosophila model of Parkinson's disease. Proc Natl Acad Sci U S A. 102, 8024-8029 (2005).
- Pesah, Y., et al. Drosophila parkin mutants have decreased mass and cell size and increased sensitivity to oxygen radical stress. Development. 131, 2183-2194 (2004).
- Trinh, K., et al. Decaffeinated coffee and nicotine-free tobacco provide neuroprotection in Drosophila models of Parkinson's disease through an NRF2-dependent mechanism. J Neurosci. 30, 5525-5532 (2010).
- Kim, K., Kim, S. H., Kim, J., Kim, H., Yim, J. Glutathione s-transferase omega 1 activity is sufficient to suppress neurodegeneration in a Drosophila model of Parkinson disease. J Biol Chem. 287, 6628-6641 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。