Method Article
大人のホールマウントの準備のためのシンプルなワンステップ解剖プロトコル
要約
大人ショウジョウバエの脳は神経回路、高次脳機能、および複雑な疾患を研究するための貴重なシステムです。小さなハエの頭から全脳組織を分析するための効率的な方法は、脳ベースの研究を促進します。ここでは、よく保存された形態を有する成人の脳の簡単な、ワンステップ解剖プロトコルを記述します。
要約
、人間の脳変性疾患をモデル化し、成人の脳における神経回路網をマップし、高次脳機能の分子・細胞基盤を研究するためにショウジョウバエを使用することに関心が高まっています。よく保存された形態を有する成人の脳の全体のマウントの準備は、全脳ベースの研究のために重要であるが、技術的に困難と時間がかかることがあります。その後の処理工程を容易にするために、身体の残りの部分に結合して、無傷の脳を維持しながら、このプロトコルは、10秒未満で大人のフライヘッドの簡単に学ぶ、ワンステップ解剖のアプローチを説明します。手順は、通常、後撮像工程を妨害する可能性が脳に関連した目や気管組織の大部分を除去するのに役立ちますし、また解剖鉗子の品質にあまり需要を配置します。さらに、我々は、Bの両面を撮像するために重要であるカバーガラス上に取り付けられた脳試料の便利な反転を可能にする簡単な方法を説明します同様の信号強度と品質の雨。プロトコルの例として、我々はWTの大人の脳でドーパミン作動性(DA)ニューロンの分析を提示(1118ワット )飛びます。解剖法の高い有効性は、 ショウジョウバエの大規模な成人の脳ベースの研究のために特に有用です。
概要
一般的にミバエとして知られているモデル生物ショウジョウバエは 、長い間そのエレガントな遺伝子ツール、短い生殖回、および高度に保存された分子および細胞経路のために評価されています。ミバエが正常に基本的なシグナル伝達経路、多細胞生物のパターン形成メカニズムだけでなく、神経発達のメカニズム、機能、および疾患1,2を分析するために採用されています。細胞標識およびイメージング技術の最近の進歩により、ショウジョウバエの脳は、神経回路の微細なマッピングで、そのような学習と記憶、および概日リズム1,3などの高次脳機能の分子および細胞基盤を解剖に特に強力になっています4,5,6,7,8。
ショウジョウバエシステムの1つの特定の利点は、通常の化合物または共焦点顕微鏡を使用して脳の全マウント調製および検査を可能にする、その比較的小さいサイズです。ティsの機能は、このように研究対象の全体像と全体内でのその正確なジオメトリの両方を提供し、全脳組織との関連で、細胞および細胞下レベルで、神経回路、または単一ニューロンの詳細な解剖学的および機能解析を可能にします脳。しかし、脳のかなり小型のサイズを考えると、それはまた、効率的な大人のハエで保護外骨格ヘッドケースのうち、無傷の脳組織を解剖における技術的な課題を提示しています。種々の効果的で比較的単純な切開方法は、通常、適切な脳9のヘッドケースの除去および目を含む関連した組織、気管、及び脂肪、10慎重伴い、段階的れ、詳細に記載されている。これらの顕微解剖法多くの場合、簡単に破損することができ、微細よく整列ヒントを鉗子に頼って、切開鉗子の品質にかなり厳しい要求を配置します。また、解剖脳は、多くの場合、separatあるとして体の他の部分から編、脳は簡単に、それらの小さなサイズと処理バッファでの透明性のその後の染色および洗浄プロセスの間に失われることがあります。ここでは、胴体に取り付けられた解剖頭脳を保ち、成人の脳のために、比較的単純かつ容易に習得できるワンステップ解剖プロトコルを記述します。解剖のプロセスは、多くの場合、簡単にそのような目や気管などの脳関連組織のほとんどを離れてクリアし、良質の解剖鉗子の需要が減少します。
蛍光化合物の顕微鏡や共焦点顕微鏡下で脳を撮像する場合に加え、離れ蛍光光源からである脳の側は、しばしば、ホールマウント脳の厚さに弱い信号の少ない鮮明な画像を生成します。ここで、我々はまた、同様の信号intensiと脳の両側の好都合なイメージングを可能にする、脳試料を容易に反転することができ、簡単な取付方法を説明しますTYと品質。
概念実証の成人の脳を研究するために、この方法の適用については、我々はさらに1118ハエワットの脳におけるDAニューロンの存在を調べました。多くの場合、多くのショウジョウバエの研究で、トランスジェニックハエおよび野生型コントロールを生成するための親株として使用されている遺伝子型。
プロトコル
脳解剖と免疫染色に使用1.ソリューション
- 119のNaCl、26.2ミリモルのNaHCO 3、2.5のKCl、1 mMののNaH 2 PO 4、1.3のMgCl 2、および10 mMグルコース:大人は、人工脳脊髄液(aCSFの)で脳を飛ぶ解剖。使用前に、10、5%CO 2/95%O 2とのガスaCSFの- 2.5 mMのCaCl 2を15分とスパイク。 0.22μmのメンブレンフィルターを通して濾過することによりaCSFの溶液を滅菌します。
注:ストアaCSFの4℃での細菌汚染を防止します。解剖した脳の最終的な結像品質上の2つの解剖ソリューションの影響の詳細な比較が行われていないが、フライ脳はまた、リン酸緩衝生理食塩水(PBS)溶液中で切開することができます。 - 通常、等分し、-20℃で保存されている固定液として1×PBSで調製した4%パラホルムアルデヒド(PFA)を使用します。
CautioN:PFAは、有毒で腐食性であり、取り扱いに注意を要します。 - 解剖脳の免疫蛍光染色の際に、脳から、最後の洗浄工程の後にPFAをすすぐために1×PBSを使用してください。 10×PBS原液(1.37 MのNaCl、27mMのKClを、100 mMののNa 2 HPO 4、及び18mMのKH 2 PO 4)から1×PBSを準備します。
- 解剖脳の免疫蛍光染色の際に後続のすべての洗浄工程のための1×PBS(1×PBT)で0.3%のTween-20を使用してください。
大人のフライヘッズの2顕微解剖
注:解剖手順は図1に示されています。
- CO 2と大人のハエを麻酔。 5秒 - 鉗子を使用して、フライと簡単にピックアップ3を70%エタノールに浸漬することによって、そのキューティクルを脱蝋。これはaCSFのか、1X PBS郭清溶液に浸漬したときに気泡がフライキューティクルに付着しないことが保証されます。
- 下手でブロックされることはありません角度で光源と顕微鏡を解剖、フライ(1.2X倍率)のクリアな視界を達成するために、対物レンズを設定します。動物を固定し、 図1(a)に示すように 、その腹部は、上向きと冷たい解剖溶液にフライを浸漬する非優位の手で鉗子を使用してください。
- ( 図1Aの矢印で示される)フライの腹部に小さな力を発揮しながら、解剖板に対する170°の角度- 160で鉗子を保管してください。このステップは、ハエを固定化し、15によって後方にヘッドを移動するためにそれを強制します - 25°上向きに口吻を拡張しながら。プロセスでは、キューティクルの柔らかく、半透明の領域は、口吻の下に、明らかになるはずです。倍率を増やして、この領域に焦点面を調整します。
注:あまりにもしっかりと鉗子を保持するが、安定化させるのに十分ではなく、単にしっかりしないでくださいフライ。あまりにも多くの力は内部の臓器が溶液中に破裂する原因となります。 - 持ち手からの圧力が解放されたとき、鉗子が開いて春になりますように、鉗子の先端に軽度の抵抗力が生成されます、その先端が閉じているように、解剖鉗子を押すように利き手を使用してください。 図1(b)に示すように 、フライを保持鉗子に対して垂直に鉗子を配置します。
- ピアース図1Bの赤い矢印で示すように口吻の下キューティクルの柔らかく、半透明領域を介して切開鉗子の閉じた先端、。あまりにも深く、それが脳に触れることを鉗子に浸透しないことが重要です。適切な脳が見えるようになるはずです。非支配手でハエの安定的な把握を維持します。
- 迅速にしかし着実、トンを離れて引き裂くために、独自の力で解剖鉗子の先端を解放し、このリリースの勢いに依存しています彼は外骨格フライヘッドを囲みます。適切な無傷の脳は解放鉗子先端( 図1Cに示す外側に赤い矢印として示す)の勢いを導くために仮想線に従ってください(すぐに図1Cの一番下の鉗子の先端上記白組織)見えるようになるはずです。これは、静かに外骨格を削除し、脳から脳が関係している眼と気管のほとんどになります。適切なタイミングと力が外骨格は、研究者の経験に依存することになる開くために適用されます。
注:これは、解剖時に最も重要なステップです。露出した脳を残すことは体の他の部分に付着したままながら、外骨格を削除するには、鉗子口の勢いから生成された天然の力に頼ることが重要です。 - 慎重にそのような白い繊維構造として表示され、気管などの残骸付属組織を除去するために、利き手でピンセットを使用しremainingが脳に取り付けられています。適切な脳を引っ張ったり、傷つけないように注意してください。
脳の3免疫蛍光染色
- 60分 - 40のための4%PFAの約1 mL中にそれらの関連torsosと解剖脳サンプルを修正しました。
注:この、その後の手順については、適切に溶液中の試料を混合するニューテーター上のサンプルを用いて、チューブまたはプレートを保ちます。 - ソリューションをピペットで3回上下1×PBS 1mLですすいでください。離れて脳を吸引しないように注意してください。
- 5分ごとに1×PBTで5回洗浄します。インキュベーションの間にニューテーター上のサンプルを保管してください。
- 適切な希釈Oで/ N 4℃で一次抗体とインキュベートします。
- 翌日、一次抗体を除去し、1×PBTでサンプルを5回洗浄します。各洗浄の間に1×PBT溶液に10分 - 5のためのサンプルを残します。インキュベーションの間にニューテーター上のサンプルを保管してください。
- 洗浄をインキュベート提案した希釈およびインキュベーション時間と適切な二次抗体中のサンプル。
- 各洗浄の間に10分間のインキュベーションで1×PBTでサンプルを6回洗浄します。
このステップでは、試料から非特異的に結合した二次抗体を除去するために重要です。 - 30分間、1×PBT溶液中の1mg / mlの4 '、6'-ジアミジノ-2-フェニルインドール(DAPI)の10,000希釈:1でインキュベートします。 DAPIがDNAのAT領域に結合し、脳の全体的な形態を明らかにするために使用することができるDNA色素です。
- 1×PBSで3回洗浄します。
- 転送解剖皿にサンプル、および鉗子を使用して解剖皿の中の体から脳を分離します。
- 染色および洗浄工程の後、両者の間にカバースリップで脳をマウントし、マウントスライドの上にカバースリップを配置。脳の両側が同様の信号強度を用いて画像化することができるように、このように、脳試料を容易に反転することができます。
注:代わりに直接取り付けスライド上のカバースリップ上で脳をマウントすると、自由に、サンプルの向きの反転を可能にします。実装プロセスは、以下でより詳細に説明します。- マウントスライドの上に18×18ミリメートルカバースリップを置きます。ブレード付きピペットチップの開口部を広げ、18×18ミリメートルのカバーガラス上に1×PBS溶液中で脳を転送するためにそれを使用。
- 抗フェードマウンティング培地の40μL(0.2%(99.5中w / v)のn-プロピル没食子酸 - 別の20を、カバースリップの中央に脳を置き、微細ピペットチップで脳の周りの液体を除去し、その後追加脳%以上のACSグレードのグリセロール)。
注:追加された封入剤の量を調べた脳の数によって異なります。 - 外側に粘性マウンティング培地をずらしながら優しく頭を広げ。それはと接触するまで、第1片側からスライドを下げることによって、脳の上に第18のx 18ミリメートルのカバーガラスを配置取付スリップの表面は、その後ゆっくりと気泡と脳との接触を最小限にするために反対側を下げます。
注意:マウンティング培地と脳の体積が2カバースリップを分離するのに十分なスペースを提供しなければならないように、2つのカバースリップの間にスペーサーを使用する必要はありません。 - スライドが落ち着くことを可能にします。実験室の組織とスリップの側面から出てくる過剰な液体を除去します。
- 輸送中に取り付けスライドから脱落取り付けられた頭脳を持つカバースリップを防止するために、取り付けスライドにカバースリップを添付し、テープの小片を使用します。
注:脳をスライドの間に取り付けられたスライドを密閉するために、任意のシーラントを使用することなく、蛍光シグナルの有意な損失なしにすぐに画像形成された、または最大1週間4℃で保存することができます。染色された脳の長期保存のために、2スリップの側はwを封止することができますi番目のマニキュアとステンド脳は時間をかけてそれらの信号を失うかもしれませんが、-20℃の冷凍庫に保存されています。これは推奨されません。
- 画像に脳を適切な化合物の蛍光顕微鏡や共焦点顕微鏡を使用してください。
- まず、客観的に近い脳の側から画像を取得してから、慎重に真ん中に挟まれたサンプルを持ってカバースリップを反転。このステップは、同じ脳の反対側の画像を取得促進します。
- ペア前方内側側(PAM)クラスター領域におけるこのようなDAニューロンなどの脳の画像より小さな領域、(例に脳全体( 図2の例)と対物レンズ40倍の画像に直立化合物の蛍光顕微鏡および20X対物レンズを使用してください図3で)。
結果
上記のように図1は 、成人の脳の解剖のための主な手順を示している2、3 3日齢のWTの代表画像です(遺伝子型:1118ワット ) の数値 。大人は、チロシンヒドロキシラーゼ(THに対する抗体で共染色した脳を、飛びます、 図2の赤で着色し、 図3)の白、マーカーは、一般的に、すべての分化したニューロンのためのすべての細胞核とELAVタンパク質に対する抗体、マーカーを標識するためにDNA色素DAPIに加えて、DAニューロン11を標識するために使用します一緒に脳の全体的な構造を明らかにした(緑色に着色)フライ、インチ
1で200希釈およびラット抗ELAV抗体: 図2と図 3の一次抗体のために、私たちは1でウサギ抗TH抗体を使用する100希釈、WHICHは、非特異的結合をブロックするために、5%正常ヤギ血清で1×PBT中で調製しました。 1X PBTで500倍に希釈した二次抗体のために、我々は1でアレクサフルオロ488ヤギ抗ラット抗体およびAlexaFluor596コンジュゲートヤギ抗ウサギ抗体を使用しました。
脳画像に、我々は、脳内の関心領域の全深さをカバーする脳切片のZスタック画像を取得するapotome機能を備えた直立化合物、蛍光顕微鏡を使用しました。例えば、脳全体におけるDAニューロンの一般的な分布の明確な可視化を得るために、私たちは別々の画像と同じ脳の前部と後部の側面( 図2)に20X対物レンズを使用していました。脳の各側の深さは、すべてのDAニューロンをカバーすることができる画像形成された約20 - 合計で25ミクロン。確実に小さいセルサイズと弱いTH SIを持つPAMクラスター領域内のDAニューロンを、可視化および定量化するために、gnals(下記参照)、我々は、40X対物レンズを使用していました。 PAMクラスター領域( 図3c)の3D再構成に最適な画像品質を確保し、各画像形成されたスライスの間に1ミクロン、 -また、商用ソフトウェアからZシリーズの取得機能では、我々は0.5の切片厚を選択しました。全部で10ミクロン - すべてのDAニューロンを覆う脳におけるPAMのクラスタの厚さは約8です。我々の経験では、apotome機能が大幅にこのような全脳やPAMクラスター領域として高いバックグラウンドを持つ厚い試料をイメージングにおけるノイズ信号を減らすことができます。
図2F-Jのための脳の両側の間の信号強度の同様のレベルを表示する脳試料を保持するカバースリップを反転した後、同じ脳の後面図を示し、一方、 図2A-Eは 、脳の前面図を示しますすべての3つの画像形成されたチャネル。 DA neurここで我々は脳の前方側にはPPM1、PPM2、およびPPM3クラスタを含むように後方内側側(PPM)ペア名を使用して、後側方(PPLペアになる名前が、アドオンは、早期の指定11以下の異なるクラスターに分類しました図2E及び2Jに示されるように)、脳の後部側からPPL1とたpPL2クラスタをカバーする。白いショーの前方および高倍率で同じ脳の後部ビューで、図2Eと2Jを 、DAの異なるクラスタを明らかに脳の両側のニューロン。白のラインが脳( 図2E)の前方側で顕著PAMと対になった前外側(PAL)クラスタだけでなく、脳の後部側のPPLとPPMのクラスター( 図2J)をハイライト表示し、破線。
図3Aおよび図3Bの A ワット1118ハエにおけるDAクラスタの一部のための定量結果の要約再。私たちは、DAニューロンは、スライスによって、また、不正確なカウントを最小限に抑える必要があります3D再構成画像からスライスカウント。私たちは、3日齢ワット1118ハエは、全体的な脳あたりPPMクラスタで27 DAニューロンの平均を持っていることを推定し、半球ごとにPPLクラスタ内の16 DAニューロン、半球あたりPALクラスター( 図3A)で5 DAニューロン、そして、PAMクラスター( 図3B)の各97 DAニューロン。 図3Cは、この地域のすべてのDAニューロンをカバーする高倍率の画像のスライスから投影PALおよびPAMクラスタ内のDAニューロンの代表的な3D再構成、です。このようなPALのような他のクラスターと比較して、PAMのクラスタ内のDAニューロンは、比較的小さなセルサイズおよび弱いTH染色シグナルを持っていることは明らかです。
"SRC =" /ファイル/ ftp_upload / 55128 / 55128fig1.jpg "/>
図1:大人ショウジョウバエの脳のための解剖プロトコルのグラフィカルなイラスト (A)ハエが上向きに腹側に位置し、非利き手を用いて胸部に保持されています。力を穏やかに下の白い透明な領域を露出、フライヘッドの後傾と口吻のわずかな外向きの拡張を誘導するために鉗子(赤矢印)を適用しました。利き手から(B)鉗子は浅い切開(赤い矢印)を作成、吻の下の透明領域に挿入されています。我々が使用する鉗子は、非常に微細な先端を持っていないことに注意してください。赤い矢印で示されているように(C)鉗子は、それ自身の力を介して離れて来ることを許可されています。鉗子を開くことによって生成された運動量が比較的きれいなショウジョウバエの脳を露出させ、目と外骨格を削除します。気管のほとんどは、プロセス中に除去されます。 ( 脳を取り巻くD)過剰アクセサリ組織は慎重に適切な脳の完全な露光のためにトリミングされている。 この図の拡大版をご覧になるにはこちらをクリックしてください。
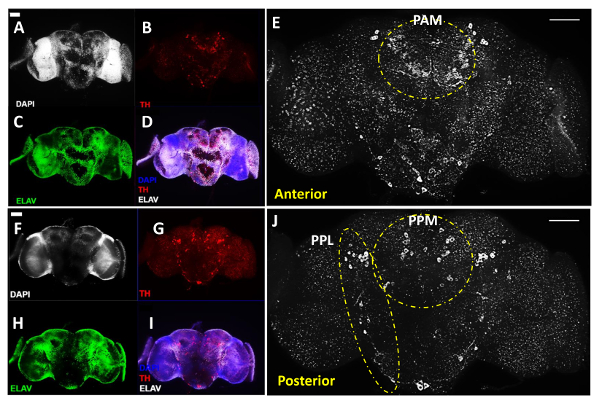
図2:DAニューロンが(20X目的で取得)成人男性ショウジョウバエBの雨の中で抗チロシンヒドロキシラーゼ(TH)抗体で明らかにしたが、この図は、解剖大人の脳の代表画像を含む、の脳領域のZ-積み重ねられた画像を用いて再構成化合物蛍光顕微鏡を用いて得られた関心。 (AE)前方及び(FJ)同じ成人の脳の後部眺め。 (A&F)細胞核はDAPI染色(白)とワット(C&H)ニューロンによって画像化しました汎神経マーカー抗ELAV抗体(緑色)によって標識ERE。 (B&G)DAニューロンを、抗TH抗体(赤)によって明らかにされています。 (D&I)DAPI、TH及びELAVの治療のための画像のオーバーレイ。 (E&J)白で示したDAニューロンと脳領域の拡大図。破線は、脳の前部におけるPALおよびPAMクラスタおよび脳の後部でPPLとPPMのクラスタを強調表示します。スケールバーはパネルの全てでは50μmを表す。 この図の拡大版をご覧になるにはこちらをクリックしてください。

(40X目的で取得)1118ハエワット男性成人の脳における図3.定量DAニューロンの。(A&B)DA n個の定量抗TH染色によって明らかにされた1118ハエワット 3日目のオスのeurons。データは、外れ値として最小値と最大値を示すウィスカーボックスプロットで表されます。同様に第二(Q2)と第3(Q3)四分位数、(Q1)最初。第二の四分位数は、平均値として表されます。 (A)PPM {(N = 28)分:21、Q1:24、平均:27、第2四半期:30、最大:32}、PPL {(N = 26)分:10、Q1:12、平均:16、 Q2:18、最大:25}、およびPAL {(N = 24)、分:2、Q1:4、平均:5、Q2:5、最大:10}クラスター。 (B)PAMクラスタ{(N = 20)分:86、Q1:94、平均:97、第2四半期:97、最大:99}。 (C)3 dの1118ハエワット男性のPAMとPALのクラスタにDAニューロンを示す代表的な投影画像。スケールバーは20μmで表す。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
人間の脳疾患、神経回路、および高次脳機能を研究するために大人ショウジョウバエの脳を使用して、関心の高まりと、大のために特に重要であるホールマウント分析し、無傷ハエの脳を得るために、簡単かつ迅速な方法を開発する必要があります脳ベースの画面を拡大縮小。我々の方法は、主に、関連組織からクリアされるよく保存形態で(多くの場合、経験を持つ10秒未満で)フライ頭を解剖するためのシンプルで簡単に学ぶアプローチを提供します。解剖脳がまだフライ体の残りの部分に結合されているように、彼らは通常、すぐに試料管の底に沈むと洗浄および染色工程の間に認識し、収集するのは簡単です。これは、大幅に小さな物理的な大きさの脳サンプルを処理する際に顕著な問題になる可能性があり、サンプルの損失を最小限に抑えることができます。この問題は、大規模な研究のために特に重要であることができます。脳は簡単に本体から取り外すことができます染色工程が終了した後、取り付け前。
解剖時には、正確にフライを配置フライヘッドから外骨格を削除するときに、適切な角度を維持し、穏やかに各ステップを実行する際に適切な力を発揮することが重要です。鉗子がフライ( 図1B)の断頭を防止するために、互いに直交配置されることをお勧めします。 図2の代表的な画像に示されるように、このプロトコルを使用して調製し、脳は満足な結果を生みます。この例では、成人の脳のPAMクラスタ内のDAニューロンに焦点を当てました。平均でショウジョウバエの脳は、独特の突起パターンと機能出力11、12と脳の異なる領域での異なるクラスタに分散されている前大脳あたり約280 DAニューロン、の合計を持っています。大人ショウジョウバエの脳、includiにおけるDAニューロンの前の特性評価をngのは、 パーキン変異体のようなヒト疾患遺伝子のモデルを飛ぶ、大部分がPALに焦点を当てている、比較的大きなセルサイズとTH、ラベリングDAニューロン13-18のために使用される標準的なメーカーの顕著な発現を有するPPL、およびPPMクラスター。
しかし、ハエの脳内のDAニューロンの大部分は、クラスタあたり約100 DAニューロンで、PAMのクラスタで発見されています。他のDAクラスター内の細胞と比較して、PAMクラスタ内のDAニューロンは、通常、チロシンヒドロキシラーゼの発現と小さいセルサイズの小さいレベルを示しています。我々の解剖染色プロトコルから調製した試料では、PAMのクラスタ内のDAニューロンが明確に可視化することができ、共焦点画像化することなく、化合物の蛍光顕微鏡を用いて、高品質で画像化。その多数を考えると、異なる遺伝的背景のPAMクラスタ内のDAニューロンの定量化は、より信頼性と再現性のある結果が生じる可能性があります。私たちは、PAM CLUSにそのDAニューロンを提案しますターは、DA生物学を研究し、パーキンソン病などのDA関連障害をモデル化するための別の有用なシステムを表しています。
我々の経験では、我々が使用し、顕微鏡からapotome機能が大幅に、全成人のハエの脳のように、特に重要な厚さのサンプルを検査するには、バックグラウンド信号を減らすことができます。共焦点顕微鏡は、より詳細に、より高い倍率とより良い品質の画像を生成することができるが、それはしばしば時間がかかり、高価です。これは、このような明確な3D再構築やデコンボリューション解析のためのZ-stackセクションのシリーズを必要とする成人の脳のような厚手の多数のサンプルを画像化するために特にそうです。この観点では、apotome機能は十分な品質の画像を生成するための迅速かつ費用効果的な代替手段を表す( 例えば 、 図2および図 3の画像)。
脳の研究では、両方のSi上の画像セルにしばしば必要です同じ脳のデス。例えば、DAニューロンは、脳の前部と後部の両側からのクラスタに存在しています。脳がスライド上にマウントされた後画像化されたときしかし、その厚さに、離れた光源からの側(すなわち、取り付けスライドに面する側)は、通常、定期的な化合物と共焦点を使用して、弱い信号の少ない鮮明な画像を生じさせます顕微鏡。 2つのカバースライド間に試料を装着することにより、それが取り付けられたスライドと同様の信号強度と同じ脳の両側の後続のイメージングのサンプルの便利な反転を可能にする。 図2の両側から撮像DAニューロンの一例です比較的匹敵するシグナル強度と結像品質を示し、この方法を使用して、脳を飛びます。
大人が脳を飛ぶ解剖するためのいくつかのわかりやすいアプローチはうまく9、10に記載されている。我々のアプローチは、毛皮できる代替方法を提供し、THERは大人飛ぶ脳の解剖と染色工程を簡略化。より大規模な研究は、脳全体の神経回路だけでなく、その分子と細胞成分をマップするために実施されていると、ハイスループット遺伝的および薬画面を実現するために自動化された解剖とイメージングのアプローチは大人ショウジョウバエの脳のために開発することができること予想されますこの古典的な遺伝モデルのin vivoインチ
開示事項
The authors have nothing to disclose.
謝辞
私たちは、プロジェクトへの巨大なサポートのために氏のENEメフメットさん、キアラ・アンドラーデ、さんピラール・ロドリゲス、クリス・クォック、およびさんダンナガーフィルを認めます。
資料
| Name | Company | Catalog Number | Comments |
| w*; parkΔ21/TM3, P{GAL4-Kr.C}DC2, P{UAS-GFP.S65T}DC10, Sb1 | Bloomington Drosophila Stock Center | 51652 | Balancer was switched to TM6B |
| PBac{WH}parkf01950 | Exelixis at Harvard Medical School | f01950 | Balancer was switched to TM6C |
| NaCl | Fisher Scientific | S640-500 | |
| Sodium Bicarbonate (NaHCO3) | Fisher Scientific | 02-003-990 | |
| Potassium Chloride (KCl) | Fisher Scientific | BP366-500 | |
| Sodium phosphate, monobasic monohydrate (NaHCO3) | Fisher Scientific | 02-004-198 | |
| Magnesium Chloride (MgCl2) | Fisher Scientific | 02-003-265 | |
| D-Sorbitol | Sigma-Aldrich | S1876-500G | Replaces glucose |
| Calcium chloride dihydrate (CaCl2) | Sigma-Aldrich | C5670-500G | |
| EMD Millipore Durapore PVDF Membrane Filters: Hydrophilic: 0.22 µm Pore Size | Fisher Scientific | GVWP14250 | |
| Formalin Solution, 10% (Histological) | Fisher Scientific | SF98-20 | |
| Potassium Phosphate, Dibasic, Powder, Ultrapure Bioreagent | Fisher Scientific | 02-003-823 | |
| Tween-20 | Fisher Scientific | BP337-500 | |
| Excelta Precision Tweezers with Very Fine Points | Fisher Scientific | 17-456-055 | Protocol does not require very fine points. |
| Anti-Tyrosine Hydroxylase Antibody | Pel-Freez Biologicals | P40101 | |
| Rat-Elav-7E8A10 anti-elav | The Developmental Studies Hybridoma Bank | Clone 7E8A10 | |
| Goat anti-Rat IgG (H+L) Secondary Antibody, Alexa Fluor 647 conjugate | ThermoFisher Scientific | A-21247 | |
| Goat anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 594 conjugate | ThermoFisher Scientific | A-11037 | |
| DAPI Solution (1 mg/mL) | ThermoFisher Scientific | 62248 | |
| Propyl gallate powder | Sigma-Aldrich | P3130-100G | |
| Glycerol ACS reagent, ≥99.5% | Sigma-Aldrich | G7893-500ML | |
| Zeiss Axioimager Z1 | Zeiss | Quote | |
| Zeiss Apotome.2 | Zeiss | Quote | |
| Zen lite software | Quote |
参考文献
- Wangler, M. F., Yamamoto, S., Bellen, H. J. Fruit flies in biomedical research. Genetics. 199, 639-653 (2015).
- Bellen, H. J., Yamamoto, S. Morgan's legacy: fruit flies and the functional annotation of conserved genes. Cell. 163, 12-14 (2015).
- Aso, Y., et al. The neuronal architecture of the mushroom body provides a logic for associative learning. Elife. 3, 04577(2014).
- Reiter, L. T., Potocki, L., Chien, S., Gribskov, M., Bier, E. A systematic analysis of human disease-associated gene sequences in Drosophila melanogaster. Genome Res. 11, 1114-1125 (2001).
- Yamagata, N., et al. Distinct dopamine neurons mediate reward signals for short- and long-term memories. Proc Natl Acad Sci U S A. 112, 578-583 (2015).
- Nern, A., Pfeiffer, B. D., Rubin, G. M. Optimized tools for multicolor stochastic labeling reveal diverse stereotyped cell arrangements in the fly visual system. Proc Natl Acad Sci U S A. 112, 2967-2976 (2015).
- Waddell, S. Neural Plasticity: Dopamine Tunes the Mushroom Body Output Network. Curr Biol. 26, 109-112 (2016).
- Wolff, T., Iyer, N. A., Rubin, G. M. Neuroarchitecture and neuroanatomy of the Drosophila central complex: A GAL4-based dissection of protocerebral bridge neurons and circuits. J Comp Neurol. 523, 997-1037 (2015).
- Sweeney, S. T., Hidalgo, A., de Belle, J. S., Keshishian, H. Dissection of adult Drosophila brains. Cold Spring Harb Protoc. 2011, 1472-1474 (2011).
- Wu, J. S., Luo, L. A protocol for dissecting Drosophila melanogaster brains for live imaging or immunostaining. Nat Protoc. 1, 2110-2115 (2006).
- Mao, Z., Davis, R. L. Eight different types of dopaminergic neurons innervate the Drosophila mushroom body neuropil: anatomical and physiological heterogeneity. Front Neural Circuits. 3, 5(2009).
- White, K. E., Humphrey, D. M., Hirth, F. The dopaminergic system in the aging brain of Drosophila. Front Neurosci. 4, 205(2010).
- Yang, Y., et al. Mitochondrial pathology and muscle and dopaminergic neuron degeneration caused by inactivation of Drosophila Pink1 is rescued by Parkin. Proc Natl Acad Sci U S A. 103, 10793-10798 (2006).
- Greene, J. C., et al. Mitochondrial pathology and apoptotic muscle degeneration in Drosophila parkin mutants. Proc Natl Acad Sci U S A. 100, 4078-4083 (2003).
- Whitworth, A. J., et al. Increased glutathione S-transferase activity rescues dopaminergic neuron loss in a Drosophila model of Parkinson's disease. Proc Natl Acad Sci U S A. 102, 8024-8029 (2005).
- Pesah, Y., et al. Drosophila parkin mutants have decreased mass and cell size and increased sensitivity to oxygen radical stress. Development. 131, 2183-2194 (2004).
- Trinh, K., et al. Decaffeinated coffee and nicotine-free tobacco provide neuroprotection in Drosophila models of Parkinson's disease through an NRF2-dependent mechanism. J Neurosci. 30, 5525-5532 (2010).
- Kim, K., Kim, S. H., Kim, J., Kim, H., Yim, J. Glutathione s-transferase omega 1 activity is sufficient to suppress neurodegeneration in a Drosophila model of Parkinson disease. J Biol Chem. 287, 6628-6641 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved